Diabetes, Estrés Oxidativo y Ejercicio Físico
Mustafa Atalay1 y David E Laaksonen1
Department of Physiology, University of Kuopio, Kuopio, 70211 Kuopio, Finlandia.
Artículo publicado en el journal PubliCE del año 2002.
Publicado 2 de diciembre de 2005
Resumen
Palabras clave: actividad física, antioxidantes, especies reactivas de oxígeno
INTRODUCCION
Durante el ejercicio moderado el consumo de oxígeno se incrementa unas 8-10 veces, y el flujo de oxígeno a través de los músculos se puede incrementar unas 90-100 veces. Incluso el ejercicio moderado puede incrementar la producción de radicales libres y abrumar las defensas antioxidantes, resultando en un estrés oxidativa (Sen y Packer, 2000).
Se demostró primero en 1978, por Dillard et al (Dillard et al, 1978) que en humanos, incluso el ejercicio de moderada intensidad incrementaba el contenido de pentano, un subproducto de la peroxidación de los lípidos, en el aire espirado. En 1982, Davies et al, por primera vez proporcionaron evidencia directa utilizando el método de espectroscopia de resonancia paramagnética de electrones. En ratas el ejercicio exhaustivo en cinta ergométrica incrementaba de 2 a 3 veces la concentración de radicales libres en el músculo y en el hígado (Davies et al, 1982).
Estudios posteriores llevados a cabo por nuestro grupo y por varios otros grupos demostraron que el ejercicio vigoroso induce el estrés oxidativo medido a través del daño oxidativo de lípidos, proteínas e incluso material genético (Sen et al., 1994a; Goldfarb et al., 1996; Tiidus et al., 1996; Khanna et al., 1999; Ji, 1999; Atalay y Sen, 1999; Sen, 1999; Sen et al., 2000; Atalay et al., 2000; Selamoglu et al., 2000). Por otro lado, el entrenamiento de la resistencia, tanto continuo como fraccionado, parece inducir una protección antioxidante y reducir la estrés oxidativa. Por lo tanto, el ejercicio regular resulta en una protección contra el estrés oxidativo provocado por el ejercicio agudo (Atalay et al., 1996a; 1996b; Powers et al., 1997; 1999; Khanna et al., 1999; Sen, 1999).
La diabetes mellitus (DM) es un síndrome caracterizado por una secreción
anormal de insulina, que provoca un trastorno en el metabolismo de carbohidratos
y lípidos, y se diagnostica debido a la detección de hiperglucemia. La diabetes
es un problema de salud a nivel mundial que predispone a un marcado incremento
en la mortalidad por causas cardiovasculares y a serios problemas de morbidez y
mortalidad relacionados con el desarrollo de nefropatías, neuropatías y
retinopatías (Zimmet et al, 1997). La prevalencia de la DM tipo 2 entre los
adultos varía desde menos del 5% a más del 40% dependiendo de la población en
cuestión (Zimmet et al, 1997). Debido al incremento de la obesidad, el
sedentarismo y los malos hábitos alimenticios tanto en occidente como en los
países en vías de desarrollo, la prevalencia de la DM tipo 2 está creciendo a
una tasa exponencial (Zimmet and Lefebvre, 1996).
El aumento en el estrés oxidativo medido a través de índices de peroxidación de
lípidos y oxidación de proteínas ha mostrado incrementarse tanto en la diabetes
insulino dependiente (IDDM) como en la diabetes no insulino dependiente (NIDDM)
(Sato et al., 1979; Velazquez et al., 1991; Collier et al., 1992; MacRury et
al., 1993; Neri et al., 1994; Yaqoob et al., 1994; Griesmacher et al., 1995;
Niskanen et al., 1995; Laaksonen et al., 1996; Santini et al., 1997; Laaksonen y
Sen,2000; Cederberg et al., 2001) e incluso en pacientes sin complicaciones.
También se ha mostrado que en la diabetes hay un incremento en la oxidación de
lipoproteínas de baja densidad (LDL) o en la susceptibilidad a la oxidación (Collier
et al., 1992; Neri et al., 1994; Yaqoob et al., 1994; Griesmacher et al., 1995;
Laaksonen et al., 1996; Santini et al., 1997).
A pesar de la fuerte evidencia experimental que indica que el estrés oxidativo puede determinar el comienzo y la progresión de complicaciones tardías en la diabetes (Baynes, 1991; Van Dam et al., 1995; Giugliano et al., 1996), aun hay controversia acerca de si el incremento en el estrés oxidativo es meramente asociativo más que causal en la DM. Esto se debe parcialmente a que la medición del estrés oxidativo se basa comúnmente en mediciones indirectas y no específicas de productos de especies reactivas de oxígeno, y parcialmente se debe a que la mayoría de los estudios clínicos con pacientes de DM han sido de diseño transversal (Laaksonen y Sen, 2000).
Los mecanismos detrás del aparente incremento en el estrés oxidativo en la diabetes no están completamente esclarecidos. La evidencia acumulada apuna a varios mecanismos interrelacionados (Lyons, 1993; Cameron y Cotter, 1993; Tesfamariam, 1994; Cameron et al., 1996), incremento en la producción de radicales libres tales como el ion superóxido (Nath et al., 1984; Ceriello et al., 1991; Wolff et al.,1991; Dandona et al.,1996), o reducción del estátus antioxidante (Asayama et al., 1993; Tsai et al., 1994; Ceriello et al., 1997; Santini et al.,1997). Estos mecanismos incluyen la glucoxidación (Hunt et al.,1990; Wolff et al., 1991) y la formación de productos avanzados de glicosilación (AGE) (Lyons,1993; Schleicher et al., 1997) activación de la vía de los polioles (Cameron et al., 1996; Cameron y Cotter,1993; Grunewald et al., 1993; Kashiwagi et al., 1994; De Mattia et al.,1994; Kashiwagi et al., 1996) alteración del estátus redox del glutatión de la cell26 (Grunewald et al., 1993; Kashiwagi et al.,1994; De Mattia et al.,1994; Kashiwagi et al., 1996) inactivación de las enzimas antioxidantes (Arai et al.,1987; Blakytny and Harding, 1992; Kawamura et al., 1992) del metabolismo del ascorbato (Sinclair et al., 1991) y perturbaciones en el metabolismo del oxido nítrico y de las prostaglandinas (Tesfamariam, 1994; Maejima et al., 2001).
Estudios prospectivos (Lakka et al., 1994; Paffenbarger et al., 1994) sugieren que el ejercicio regular y la aptitud física medida a través del consumo máximo de oxigeno tienen un efecto protector contra las enfermedades cardiovasculares y la mortalidad. Sin embargo no se han estudiado a pacientes con diabetes, y los mecanismos por los cuales el ejercicio reduce la mortalidad por enfermedades cardiovasculares todavía son poco claros. El ejercicio como una herramienta de la medicina preventiva ha sido ampliamente recomendado, también para pacientes diabéticos (American Diabetes Association, 1998). El ejercicio regular puede fortalecer las defensas antioxidantes y puede reducir el estrés oxidativo en reposo y luego del ejercicio agudo (Sen et al, 1994b, Sen, 1995; Kim et al, 1996). Sin embargo, los beneficios o riesgos relativos del ejercicio agudo y crónico en relación con el estrés oxidativo en grupos con una incrementada susceptibilidad de estrés oxidativo, tal como los pacientes diabéticos, no son conocidos. Laaksonen et al (1996) recientemente hallaron un incrementado estrés oxidativo, medido a través de sustancias reactivas al ácido tiobarbitúrico en plasma (TBARS) en reposo y luego del ejercicio en hombres jóvenes con diabetes melliltus tipo 1. Sin embargo, la aptitud física medida por medio del consumo máximo de oxígeno (VO2máx) estuvo inversa y fuertemente correlacionada con las TBARS en plasma solo en los hombres con diabetes, sugiriendo un efecto protector de la aptitud física contra el estrés oxidativo.
MECANISMOS DEL INCREMENTO EN EL ESTRÉS OXIDATIVO EN LA DIABETES
Productos Finales de la Glicosilación
Los productos avanzados de la glicosilación (AGEs) son los productos de la glicosilación y oxidación (glucoxidación), los cuales se incrementan con la edad, y a una tasa acelerada en la diabetes mellitus (Sell et al., 1992; Dyer et al., 1993).
Estudios in vitro han sugerido que la glicosilación en si misma puede resultar en la producción de superóxidos (Jones et al., 1987; Sakurai y Tsuchiya, 1988). Se ha hipotetizado que la oxidación resulta en la producción de iones superóxido, H2O2 y a través de la transición de catálisis metálica, en radicales hidróxidos (Wolff et al, 1991). La catalasa y otros antixidantes reducen la formación de uniones cruzadas y de AGE (Elgawish et al.,1996; Schleicher et al.,1997)
Alteraciones en el Metabolismo del Glutatión
El glutatión tisular desempeña un rol central en la defensa antioxidante (Sen and Hanninen, 1994; Meister, 1995). El glutatión reducido elimina las especies reactivas del oxígeno tales como el peróxido de hidrógeno y los lípidos peroxidados, tanto directamente como por medio del mecanismo de la glutatión peroxidaza (GPX) catalizada. La glutation reductasa (GRD), dependiente del NADPH, cataliza la reducción del glutatión oxidado, lo cual sirve para mantener las reservas intracelulares de glutatión y para mantener un estado redox favorable. La Glutation – S – transferasa (GTS) cataliza la reacción entre el grupo SH y los potenciales agentes alquilantes, haciéndola mas soluble en agua y más adecuada para su transporte fuera de la célula. La GST también puede utilizar peróxidos como sustratos (Mannervik y Danielson, 1998).
Homeostasis del Glutatión
Los pacientes con diabetes tipo 2 sufren de una reducción en la GSG de los eritrocitos y de un incremento en los niveles de GSSG (De Mattia et al., 1994; Jain and McVie, 1994). La GSH sanguínea se reduce significativamente en las diferentes fases de la diabetes tipo 2, tales como: la intolerancia a la glucosa o hiperglucemia temprana (Vijayalingam et al, 1996), dentro de los dos años del diagnóstico o antes de desarrollar complicaciones (Sundaram et al, 1996) y en un pobre control de la glucemia (Peuchant et al, 1997). Los glóbulos rojo de pacientes con diabetes tipo 2 tienen niveles reducidos de GSH, una actividad desmejorada de la gama glutamil transferasa y una actividad desmejorada de tioles (Yoshida et al., 1995). El tratamiento con agentes anti diabéticos durante 6 meses corrigió estos cambios.
Thornalley et al (1996) halló una correlación inversa entre los niveles de GSH en los eritrocitos y la presencia de complicaciones diabéticas en pacientes con diabetes tipo 1 y tipo 2. Sin embargo, la mayoría de los estudios también han observado una reducción de los niveles de glutatión tanto en sangre como en los glóbulos rojos en pacientes con diabetes tipo 2. En pacientes con diabetes tipo 1 se pueden extraer conclusiones menos firmes. Debería clarificarse si los niveles se reducen en pacientes sin complicaciones y si los pacientes con complicaciones tienen niveles aun menores. La significancia patofisiológica de la reducción en los niveles de glutatión en la diabetes mellitus queda aun por ser demostrada.
Enzimas Dependientes del Glutatión
Walter et al (1991) no hallaron diferencias en la actividad sanguínea total de la GRD en pacientes con diabetes tipo 1 y tipo 2 en comparación con pacientes de control que no tenían diabetes. Muruganandam et al (1992) también halló observó que en pacientes con diabetes tipo 1 la cinética enzimática de la GRD en los glóbulos rojos era normal. Por otro lado, la actividad de la GRD sanguínea era menor en niños con diabetes tipo 1 en comparación con niños saludables (Stahlberg and Hietanen, 1991).
Una gran cantidad de estudios ha mostrado que la actividad de la glutatión peroxidasa (GPX) en glóbulos rojos, en la sangre total y en los leucocitos era similar en pacientes con DM tipo 1 y tipo 2 en comparación con grupos de sujetos control (Walter et al., 1991; Leonard et al., 1995; Akkus et al., 1996). Por otra parte, se ha mostrado una desmejora en la actividad de la GPX en pacientes asiáticos con diabetes (Tho and Candlish, 1987). En pacientes con DM tipo 1 los niveles plasmáticos de selenio eran normales, pero el contenido de selenio y la actividad de la GPX en los glóbulos rojos estaba reducida (Osterode et al, 1996).
En pacientes con DM tipo 1 se ha observado una cinética normal de la GPX dentro de los glóbulos rojos (Muruganandam et al 1992). Se ha reportado que la actividad de la GST está reducida en el corazón y en el hígado (McDermott et al 1994). Los cambios observados en las enzimas dependientes de glutatión en modelos experimentales de diabetes han sido contradictorios. La mayoría de los estudios muestran cambios en la actividad enzimática dependientes del tejido y del tiempo. Incluso tomando en cuenta estos factores, no puede hallarse consenso entre los estudios acerca del impacto de la DM sobre la actividad de las enzimas dependientes del glutatión. Los cambios observados en las enzimas dependientes de glutatión en pacientes con diabetes también han son inconsistentes. Las diferencias en los resultados no pueden ser completamente explicadas por la metodología de los estudios.
Desmejora de la Actividad de la Superóxido Dismutasa y de la Catalasa
La superóxido dismutasa (SOD) y la catalasa son las principales enzimas antioxidantes. La SOD existe en tres diferentes isoformas. Cu,Zn-SOD se encuentra mayormente en el citosol y produce la dismutación del superóxido en peróxido de hidrógeno. La SOD extracelular (EC) se halla principalmente en el plasma y en el espacio intracelular. La Mn-SOD se encuentra en la mitocondria. La catalasa es una enzima que descompone el peróxido de hidrógeno y de encuentra principalmente en los peroxisomas o en los microperoxisomas. El superóxido puede reaccionar con otras especies reactivas de oxígeno tales como el óxido nítrico para forma especies altamente tóxicas tal como el peroxinitrito, además se sus efectos tóxicos directos (Tesfamariam, 1994). El peroxinitrito reacciona con los residuos de tirosina de las proteínas resultando en la producción de nitrotirosina en las proteínas plasmáticas, lo cual es considerado como evidencia indirecta del incremento en la producción de peroxinitrito y en el estrés oxidativo. Aunque la nitrotirosina no pudo detectarse en el plasma de controles saludables, se halló nitrotirosina en el plasma de todos los pacientes con diabetes tipo 2 examinados. Consistentemente con estos resultados, los valores de nitrotirosina plasmática se correlacionaron con las concentraciones plasmáticas de glucosa (Ceriello et al, 2001). Además, la exposición de células endoteliales a altas concentraciones de glucosa derivó en el aumento de la producción del anión superóxido, lo cual puede eliminar el oxido nítrico. La reducción de los niveles de oxido nítrico resulta en una desmejora de las funciones endoteliales, vasodilatación y retardo de la replicación celular (Giugliano et al, 1996). Alternativamente, el superóxido puede ser dismutado a peróxido de hidrógeno mucho más reactivo, lo cual a través de la reacción de Fenton puede derivar en la formación de radicales hidroxilos altamente tóxicos (Wolff et al, 1991). En los neutrófilos de diabéticos se observó una reducción de la actividad citoplasmática de la Cu,Zn-SOD y especialmente de la (Mn-)SOD mitocondrial. Consecuentemente los niveles de superóxido estimados indirectamente a través de la reducción en el citocromo c, estaban elevados en los neutrófilos de pacientes diabéticos como resultado de la reducción en la actividad de la SOD (Nath et al, 1984). La principal razón para la reducción de la actividad de la SOD es la glucosilación de la Cu,Zn-SOD, lo cual se ha demostrado que deriva en la inactivación de la enzima tanto in vivo como in vitro (Arai et al, 1987). Asimismo, la división de la Cu,Zn-SOD y la liberación de Cu2+ in vitro resultó en la formación de ROS catalizada metales de transición (Kaneto et al., 1996).
Sin embargo, la actividad de la Cu,Zn-SOD en los eritrocitos está inversamente correlacionada con los índices de control glucémico en pacientes con DM (Tho et al.,1988). Se ha hallado que la actividad de la Cu,Zn-SOD en los glóbulos rojos está reducida en pacientes con DM (Arai et al, 1987), (Kawamura et al, 1992). La glicosilación puede reducir la EC-SOD asociada a las células, lo cual puede predisponer al daño oxidativo. Jennings et al (Jennings et al, 1991) hallaron una reducción en la actividad de la Cu,Zn-SOD de los glóbulos rojos en pacientes con DM tipo 1 con retinopatía en comparación con pacientes con DM tipo1 sin complicaciones microvasculares y en comparación con sujetos control no diabéticos. Sin embargo, hay reportes que desacuerdan con estos hallazgos. La actividad de la Cu,Zn-SOD en glóbulos rojos fue similar en pacientes con DM tipo 1 y tipo 2 en comparación con sujetos normales (Tho y Candlish,1987), (Walter et al.,1991), (Leonard et al., 1995; Faure et al., 1995) independientemente de las complicaciones microvasculares (Walter et al, 1991). La actividad de la SOD en los leucocitos fue similar entre pacientes con DM tipo 2 y sujetos sanos de control, a pesar de la incrementada peroxidación de los lípidos y de los reducidos niveles de ascorbato (Akkus et al., 1996). Además, se ha reportado un incremento de la actividad de la SOD en glóbulos rojos y un incremento en los niveles séricos de MDA en pacientes con DM tipo 1 con normo – microalbuminuria y retinopatía en comparación con sujetos sanos (Yaqoob et al., 1994; Skrha et al., 1994).
Se observó una reducción en las actividades de la superóxido y de la catalasa en los glóbulos rojos, en 105 sujetos con una desmejorada tolerancia a la glucosa (IGT) y en la hiperglucemia temprana así como también en pacientes con DM tipo 2 (Vijayalingam et al., 1996). Sin embargo, en otro estudio llevado a cabo con 26 pacientes con DM tipo 2 con pobre control glucémico, se observó una actividad de la catalasa y de la SOD en los glóbulos rojos (Peuchant et al., 1997). Se ha hallado que la actividad de la EC-SOD era normal en pacientes con DM tipo 1 (Adachi et al., 1996) a pesar de niveles plasmáticos de EC-SOD ligeramente elevados (MacRury et al., 1993; Adachi et al., 1996).
La amplia variabilidad entre los estudios no permite extraer conclusiones acerca de si la actividad de las distintas isoformas de SOD o de la catalasa son anormales en pacientes diabéticos. Nuevamente, las diferencias en las metodologías utilizadas en los estudios o el diseño de los estudios no explican por completo los hallazgos conflictivos entre los estudios.
La Vía de los Polioles
La hiperglucemia activa la vía de los polioles, resultando en la activación de la aldosa reductasa y en la producción de sorbitol (Figura 1). La importancia de la vía de los polioles puede variar entre los distintos tejidos. La inducción del estrés oxidativo puede ocurrir a través de diferentes mecanismos, incluyendo la depleción de las reservas de NADPH y la consecuente alteración del metabolismo del glutatión y del óxido nítrico.
En distintos estudios se observó una reducción de los niveles de GSH y de NADPH y de los cocientes entre NADPH/NADP+ y GSH/GSSG en 18 pacientes con diabetes tipo 2 en comparación con 16 sujetos control no diabéticos (De Mattia et al., 1994; Bravi et al., 1997). Una semana de tratamiento con Tolrestat, un inhibidor de la aldosa reductasa, incrementó los niveles de NADPH y de GSH en aquellos pacientes cuyos niveles de NADPH estaban reprimidos (n = 8). Por lo tanto, al menos en un subconjunto de pacientes con DM tipo 2 la activación de la vía de los polioles parece depletar el NADPH y la GSH en los eritrocitos. Similarmente, en un reciente estudio, la utilización de sorbinil inhibidor de la aldosa reductasa restauró las concentraciones de antioxidantes reducidos glutatión (GSH) y ascorbato, y normalizó la peroxidación de los lípidos inducida por la diabetes en ratas streptozotocin-diabéticas (Obrosova et al, 2002).
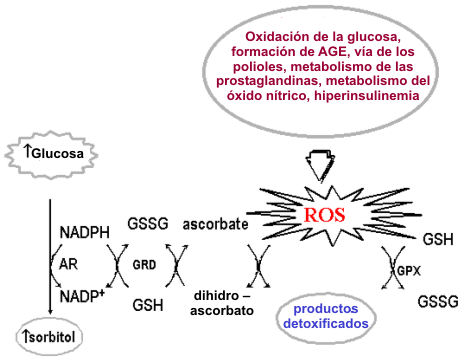
Figura 1. Mecanismos del incremento en el estrés oxidativo en la diabetes
mellitus. ROS; especies reactivas de oxígeno; GSH; glutatión reducido, GSSG,
glutatión oxidado; GRD, glutatión reductasa; GPX, glutatión peroxidasa; AR,
aldosa reductasa. (Modificado de Laaksonen and Sen, 2000).
PEROXIDACION DE LOS LÍPIDOS Y OXIDACION DE LAS PROTEINAS EN LA DIABETES MELLITUS
Peroxidación de los Lípidos en Pacientes Diabéticos
Los productos finales de la peroxidación de los lípidos son muy comúnmente detectados mediante la medición de sustancias reactivas al ácido tiobarbitúrico (TBARS). Sin embargo, este análisis ha sido criticado por la falta de especificidad. La peroxidación de los lípidos medida a través de hidroperóxidos lipídicos (Hermes-Lima et al., 1995) ha mostrado correlacionar estrechamente con TBARS en muestras de tejidos. Con la apropiada precaución, la medición de TBARS puede proveer de información significativa (Draper et al., 1993).
La utilización de TBARS como un índice de la peroxidación de los lípidos fue iniciada por Yagi et al (1976), cuyo grupo también ha mostrado incrementados niveles plasmáticos de TBARS en la diabetes mellitus (Sato et al, 1979) consistentemente con los resultados de otros investigadores (Noberasco et al., 1991; Altomare et al., 1992; Gallou et al., 1993; Jain and McVie, 1994; Gugliucci et al., 1994; Nourooz-Zadeh et al., 1995; Ozben et al., 1995; Nacitarhan et al., 1995; Freitas et al., 1997). De manera similar, se ha reportado un incremento en las concentraciones plasmáticas de peróxido en pacientes con DM tipo 1 y tipo 2 (Walter et al., 1991; Faure et al., 1993). Se ha mostrado, en ratas y en humanos, que los glóbulos rojos (RBC) de los diabéticos son más susceptibles a la peroxidación de los lípidos medida mediante TBARS (Godin et al., 1988; Fujiwara et al., 1989). La capacidad de oxidación del plasma medido a través de hidroperóxidos lipídicos fue mayor en un grupo de pacientes con DM, aunque los niveles basales fueron similares en sujetos con tolerancia normal a la glucosa, con tolerancia desmejorada a la glucosa y con DM tipo 2 (Haffner et al, 1995). Asimismo, se ha observado que los niveles plasmáticos de TBARS estaban significativamente incrementados en pacientes con DM tipo 2 a medida que se incrementaba la duración de la enfermedad y el desarrollo de las complicaciones (Sundaram et al., 1996).
Los liposomas formados a partir de membranas celulares de glóbulos rojos de pacientes con DM son altamente sensibles a la peroxidación de los lípidos inducida por superóxidos (Urano et al, 1991). La SOD y la vitamina E inhiben la peroxidación de los lípidos. Los niveles de MDA mostraron una correlación significativa con la Hb glucosilada. La peroxidación de lípidos LDL se incrementó en 19 pacientes diabéticos pobremente controlados en comparación con sujetos de control de la misma edad y sexo (Watala and Winocour, 1992)
La formación de dienos conjugados refleja eventos tempranos en la peroxidación de los lípidos (Ahotupa et al, 1998). El análisis espectrofotométrico de dienos conjugados, sin embargo, no provee información acerca de los hidroperóxidos. Los niveles séricos de un dieno conjugado isómero del ácido linoleico fue mayor en pacientes con DM y microalbuminuria que en sujetos de control (Collier et al, 1992).
En un estudio en donde se investigó la peroxidación de los lípidos en 56 adultos jóvenes con DM tipo 1 y 56 sujetos control no diabéticos se observó que la concentración plasmática de TBARS estaba elevada en las mujeres pero no en los hombres (Evans and Orchard, 1994). Similarmente en un reciente estudio llevado a cabo por Marra et al (2002) se mostró que la mayor peroxidación de lípidos, medida como hidroxiperóxidos de lípidos, los dienos conjugados totales conjuntamente con una menor capacidad antioxidante del plasma total en las etapas tempranas de la diabetes tipo 1, especialmente en mujeres, puede sugerir la mayor susceptibilidad de las mujeres diabéticas a complicaciones cardiovasculares. Además, se observó una mayor peroxidación de lípidos y una reducción de los niveles de ascorbato en los leucocitos de 53 pacientes con DM tipo 2 en comparación con 34 sujetos de control (Akkus et al, 1996). Los niveles de MDA fueron mayores en 20 pacientes a quienes se les había diagnosticado recientemente DM tipo 2 en comparación con sujetos de control (Armstrong et al, 1996). Los niveles de RBC libres y de MDA estaban elevados en 26 pacientes con DM tipo 2 pobremente controlados (Peuchant et al, 1997). Luego de tres días de euglucemia mantenida por la infusión constante de insulina y glucosa, la concentración de MDA libres se vio significativamente reducida.
El cociente entre la vitamina E/peróxidos lipídicos es el principal determinante de la susceptibilidad de la LDL para oxidarse. Los niveles de MDA fueron mayores en pacientes con DM en comparación con sujetos de control. Además, la peroxidación de la LDL estuvo estrechamente correlacionada con la magnitud de la glucación de la LDL. En hombres, la TBARS estuvo correlacionada con los niveles de triglicéridos y de HbA1, pero esto no ocurrió en mujeres. El tratamiento con dietas provocó una reducción significativa de los niveles de HbA1c y de MDA. Los hidroperóxidos lipídicos y los dienos conjugados estuvieron elevados en 72 pacientes con DM tipo 1 bien controlados y sin complicaciones, independientemente del control metabólico y de la duración de la diabetes (Santini et al, 1997). En 14 pacientes normolipidémicos con DM se observó una mayor concentración de TBARS pero no de los oxiesteroles en comparación con sujetos de control (Mol et al, 1997). Los niveles plasmáticos de hidroperóxidos lipídicos fueron substancialmente mayores en 41 pacientes con DM tipo 2 en comparación con 87 sujetos de control (Nourooz Zadeh et al., 1997). Los niveles plasmáticos de hidroperóxidos lipídicos fueron similares entre pacientes con o sin complicaciones así como también entre fumadores y no fumadores. Los niveles plasmáticos de peróxidos lipídicos, la producción de monocitos TNF-alfa estimulada por LPS y la adhesión de monocitos a las células endoteliales estuvo incrementada en 8 pacientes con DM tipo 2 pobremente controlados y bajo tratamiento con glyburide en comparación con 8 sujetos sanos (Dasfaits et al, 1998). La administración de Gliclazide revirtió estas anormalidades.
Por otra parte, no se observaron diferencias en los niveles séricos de dienos conjugados entre pacientes diabéticos saludables y sujetos saludables de control (MacRury et al., 1993; Sinclair et al., 1992; Jennings et al., 1991), aunque los niveles de dienos conjugados estuvieron incrementados en 26 pacientes diabéticos con micro-angiopatía (Jennings et al, 1991). Los nivles de TBARS en pacientes con DM tipo 2 pobremente controlados y en pacientes con DM tipo 2 bien controlados no fueron diferentes de los niveles hallados en sujetos de control, mientras que la formación de radicales hidroxilos estuvo elevada en pacientes con DM (Ghiselli et al, 1992).
Los niveles plasmáticos de TBARS fueron similares entre pacientes con DM tipo 1, pacientes con DM tipo 2 y sujetos de control (Neri et al., 1994; Leonard et al., 1995; Zoppini et al., 1996). Sin embargo, la MDA estuvo elevada en pacientes con DM con complicaciones microvasculares en comparación con pacientes con DM sin complicaciones y con sujetos saludables (Neri et al, 1994).
La mayoría de los estudios publicados ha hallado una incrementada peroxidación de lípidos tanto en pacientes con DM tipo 1 como en pacientes con DM tipo 2. Sin embargo, también se han hallado resultados contradictorios y estos no pueden ser explicados simplemente en base al diseño o metodología utilizada en los estudios. Es menos claro si la peroxidación de lípidos está incrementada en pacientes con DM incluso antes del desarrollo de enfermedades micro y macro vasculares. Todavía estamos lejos de establecer una posible causa de la peroxidación de lípidos en el desarrollo de complicaciones micro y macro vasculares en la diabetes.
Niskanen et al (1995) demostró por primera vez que los TBARS plasmáticos estaban elevados en 22 pacientes con una desmejorada tolerancia a la glucosa. Luego de 10 años de seguimiento los niveles de insulina y de glucosa en ayuno pudieron utilizarse para estimar los niveles de TBARS a través de análisis de regresión múltiple, sugiriendo que la resistencia a la insulina desempeña algún papel en la inducción del estrés oxidativo. En respaldo a estos hallazgos, se ha observado que la peroxidación de lípidos estuvo elevada en 105 sujetos IGT e hiperglucemia temprana así como también en pacientes con DM tipo 2 (Haffner et al., 1995). Por otra parte, los niveles basales de hidroperóxidos de lípidos fueron similares en 75 sujetos con tolerancia normal a la glucosa, con tolerancia desmejorada a la glucosa y con DM tipo 2 (Haffner et al, 1995).
Aunque los resultados hasta la fecha acerca de la resistencia a la insulina como mecanismo inductor del incremento en el estrés oxidativo son intrigantes, los estudios son sorprendentemente pocos. Dada la atención puesta sobre la resistencia a la insulina en la patogénesis de la DM y de las enfermedades cardiovasculares en general, los estudios futuros deberían investigar el rol de la resistencia a la insulina como inductora del estrés oxidativo.
Susceptibilidad de la LDL a la Oxidación
La incubación de LDL con las mismas concentraciones de glucosa observadas en el estado diabético, produjo un incremento en la susceptibilidad de la LDL a la oxidación, medida por medio de la formación, movilidad electroforética y degradación por macrófagos de TBARS y dienos conujuados (Kawamura et al., 1994; Bowie et al., 1993). Además, la susceptibilidad de la LDL a la oxidación correlacionó fuertemente con el grado de glicosilación de la LDL (Bowie et al., 1993). En sujetos con diabetes tipo I pobremente controlados y en comparación con sujetos normales de control se observó que la concentración plasmática de TRAP (potencial total de atropamiento de radicales peróxido) era menor mientras que la susceptibilidad de la LDL a la oxidación, medida por medio de la fase de retraso para la formación de dienos conjugados luego del inicio de la oxidación de la LDL por adición de cobre, fue mayor (Tsai et al., 1994).
En contraste, en numerosos estudios, no se observaron diferencias entre pacientes con diabetes tipo I y sujetos no diabéticos en la susceptibilidad de la LDL y la VLDL a la oxidación (Gugliucci et al., 1994; O-Brien et al., 1995; Jenkins et al., 1996; Mol et al., 1997). Aunque no hubo diferencias entre los grupos en el contenido de vitamina E LDL, la composición de ácidos grasos LDL en ésteres de colesterol o en los trigliceridos, la glucación de la LDL estuvo elevada en pacientes con DM tipo I (O-Brien et al., 1995).
La mayoría de los estudios han hallado una incrementada susceptibilidad de la LDL a la oxidación en pacientes con DM, aunque algunos estudios bien diseñados han reportado estudios conflictivos. Los estudios llevados a cabo hasta la fecha no permiten extraer conclusiones firmes acerca de si la LDL es más susceptible a la oxidación en pacientes con DM sin complicaciones en comparación con sujetos sanos, o acerca del efecto que las complicaciones o el control glucémico tienen sobre la susceptibilidad de la LDL a la oxidación.
Anticuerpos para el Colesterol Oxidado
Los pacientes con DM tipo 1 y tipo 2 tuvieron un mayor índice de anticuerpos (calculados como el cociente entre los anticuerpos y la LDL modificada y nativa) en comparación con sujetos de control para la LDL oxidada por Cu2+ y la LDL malondialdehido modificada (Bellomo et al., 1995; Festa et al. 1998; Griffin et al., 1997).
En contraste, en pacientes a los cuales se les diagnostico tempranamente DM tipo 1 o en aquellos a los cuales se les realizó un seguimiento de 10 años, los niveles séricos de anticuerpos para el colesterol LDL oxidado o para la LDL malondialdehido modificada, fueron similares a los observados en sujetos sanos de control (Uusitupa et al., 1996; Mironova et al., 1997; Korpinen et al., 1997). Asimismo, en un estudio llevado a cabo en pacientes diabéticos con normo y macro albuminuria, y que llevaban bastante tiempo de enfermedad, y con sujetos sanos, no se observaron diferencias en los niveles de LDL malondialdehido modificada entre los sujetos diabéticos con normoalbuminuria, con albuminuria y los sujetos de control (Korpinen et al, 1997). En un estudio muy reciente, se detectaron índices incrementados de anticuerpos para la LDL oxidada en sujetos con diabetes tipo 2, pero solo en aquellos con enfermedad macrovascular (Hsu et al, 2002).
No se ha hallado un consenso claro acerca de la presencia incrementada de anticuerpos LDL oxidados para la oxidación de colesterol LDL o especialmente para índices de peroxidación de lípidos en plasma o en suero, en pacientes con DM. Aunque se han publicado resultados interesantes que vinculan los anticuerpos LDL oxidados a la arteriosclerosis carotidea en la población general (Salonen et al, 1992), no pueden extraerse conclusiones similares a partir de los estudios llevados a cabo con sujetos diabéticos. Si esto es un argumento en contra del incremento en el estrés oxidativo o su rol en la patogénesis de la arteriosclerosis en pacientes con DM o contra la utilización de anticuerpos LDL oxidados como marcador de la peroxidación de los lípidos en pacientes con DM, continúa siendo algo poco claro.
Oxidación de Proteínas en Pacientes diabéticos
Las proteínas son un blanco importante para los agentes oxidativos. Las especies reactivas del oxígeno modifican las cadenas laterales de aminoácidos, tales como los residuos de arginina, lisina, treonina y prolina, para formar carbonilos proteicos. Estos pueden ser fácilmente medidos por medio de la reacción con 2,4-dinitrofenil hidrazina utilizando métodos espectrofotométricos, inmunohistoquímicos o radioactivos. El contenido de corbonilos proteicos es el marcados más ampliamente utilizado para medir la modificación oxidativa de las proteínas y se ha sugerido que es un marcador confiable del estrés oxidativo (Chevion et al., 2000). Se han detectado niveles elevados de carbonilos proteicos tanto en pacientes con DM tipo 1 y tipo 2 como en la diabetes experimental (Dominguez et al., 1998; Cakatay et al., 2000; Telci et al., 2000; Jang et al., 2000; Cederberg et al., 2001). Asimismo, el contenido de carbonilos proteicos se correlaciona bien con las complicaciones de la diabetes (Altomare et al, 1997).
Además de la oxidación de lípidos y proteínas, se ha reportado daño oxidativo del ADN en pacientes diabéticos. Los pacientes con DM tipo 1 y tipo 2 tienen niveles significativamente mayores de 8-hidroxideoxiguanosina, un indicador del daño oxidativo del ADN en células mononucleares (Dandona et al, 1996). Estos cambios pueden contribuir a la aterogénesis en la DM y a las complicaciones microangiopáticas de la enfermedad.
EJERCICIO, APTITUD FISICA Y ESTRES OXIDATIVO EN LA DIABETES MELLITUS
El estrés oxidativo está implicado en la aceleración de la aterosclerosis y en el desarrollo de complicaciones microvasculares en la diabetes mellitus. Asimismo, el ejercicio físico puede inducir agudamente el daño oxidativo, aunque el entrenamiento regular parece incrementar las defensas antioxidantes, y en algunos estudios con animales se ha observado que produce una reducción de la peroxidación de los lípidos.
El ejercicio es la mayor modalidad de tratamiento terapéutico para la DM (American Diabetes Association, 1998; Laaksonen et al., 2000). Para maximizar los beneficios del ejercicio, es importante entender el efecto del ejercicio agudo y a largo plazo sobre el estrés oxidativo y sobre las defensas antioxidantes en la diabetes. Con estas metas en mente, hemos reclutado a 9 sujetos con DM saludables y a 13 hombres de control de entre 20 y 30 años (Laaksonen et al., 1996; Atalay et al., 1997). Los sujetos pedalearon durante 40 minutos en un cicloergómetro al 60% del VO2máx luego de cinco minutos de entrada en calor. Se recolectaron muestras de sangre tanto en reposo como inmediatamente después del ejercicio. Como medida del estrés oxidativo se utilizaron mediciones de la concentración plasmática de TBARS, y los cambios en los niveles de GSSG y en el cociente GSSG/TSGH (glutatión total) en respuesta al ejercicio. Como índices de las defensas antioxidantes se utilizaron los niveles sanguíneos de TGSH y GSSG y los niveles de GPX, GRD, GST, y de actividad de superóxidos y de la catalasa en los glóbulos rojos.
La actividad de la GRD en los glóbulos rojos en reposo fue 15% mayor en el grupo de sujetos diabéticos (p<0.05). Sin embargo, la actividad de la Cu,ZN-SOD y de la catalasa en reposo fueron significativamente menores en el grupo de sujetos diabéticos. El ejercicio agudo provocó un modesto incremento en la actividad de la Se-GPX en los eritrocitos en el grupo de control, pero no en el grupo IDDM. La actividad de la Se-GPX post ejercicio fue significativamente mayor en el grupo control en comparación con el grupo IDDM. Aunque el ejercicio no afectó significativamente la actividad de la GRD, debido a los grandes valores de reposo, la actividad de la GRD post ejercicio fue también mayor en el grupo IDDM que en el grupo control. Las actividades post ejercicio de la GST, Cu,Zn-SOD y de la catalasa en los eritrocitos fueron similares en los dos grupos (Atalay et al, 1997).
Hemos hallado un incremento en la concentración plasmática de TBARS en los hombres diabéticos tanto en reposo como luego del ejercicio, mostrando por primera vez el incremento del estrés oxidativo inducido por el ejercicio en sujetos con DM (Laaksonen and Sen, 2000). Estos resultados también respaldan a estudios previos que sugerían que los pacientes con DM tipo 1 tienen una incrementada peroxidación de lípidos incluso en ausencia de complicaciones. La reducción de la actividad de la Cu,Zn-SOD en conjunto con un incremento en la producción de peróxidos (Nath et al., 1984; Ceriello et al., 1991; Wolff et al., 1991; Dandona et al., 1996) podría exacerbar el estrés oxidativo, especialmente si no se compensa con un incremento en la actividad de la catalasa o de la Se-GPX. Los iones superóxido pueden reaccionar con otras especies reactivas de oxígeno tal como el óxido nítrico para formar especies altamente tóxicas tal como peroxinitrito, además de los efectos tóxicos directos (Tesfamariam, 1994). Alternativamente, el superóxido puede ser dismutado a un peróxido de hidrógeno mucho más reactivo, lo cual a través de la reacción de Fenton puede derivar en la formación de radicales hidroxilos altamente tóxicos (Wolf et al, 1991). De esta manera la reducción en la actividad de la catalasa también puede contribuir al incremento del estrés oxidativo hallado en sujetos con DM tipo 1. También se ha mostrado que el incremento en los niveles de glucosa y de peróxido de hidrógeno inactivan a la catalasa (Ou and Wolff 1994). Como se mencionó anteriormente, en pacientes con DM con frecuencia, pero no siempre, se observa una reducción en la actividad de la SOD y de la catalasa en los glóbulos rojos.
El incremento en los niveles sanguíneos de TGSH en hombres con DM puede representar una respuesta adaptativa al incremento en el estrés oxidativo, mediada posiblemente en parte a través del incremetno en la actividad de la GRD en los glóbulos rojos. La mayoría de los estudios no han hallado cambios o han hallado una reducción en los niveles de glutatión en pacientes con DM. Relativamente pocos estudios han examinado los niveles de glutatión en pacientes con DM tipo 1. Frecuentemente, los pacientes ancianos tienen complicaciones, o han sido pobremente descriptos con respecto a la presencia de complicaciones diabéticas o de control glucémico. En el estudio de Di Simplicio et al (1995), sin embargo, los pacientes con DM tipo 1 y sin complicaciones parecen tener un nivel incrementado de plaquetas GSH.
La fuerte correlación negativa entre la concentración plasmática de TBARS y el VO2máx sugiere que una buena aptitud física puede tener un papel protector contra el estrés oxidativo. Por lo tanto surge la siguiente pregunta: ¿puede reducirse la peroxidación de los lípidos a través del entrenamiento regular en pacientes diabéticos? Si es así, esto tendría implicaciones clínicas de largo alcance, y por lo tanto es necesario establecer firmemente el rol del estrés oxidativo en el desarrollo de complicaciones micro y macro vasculares en la diabetes.
En un estudio reciente llevado a cabo en ratas con diabetes inducida por la administración de streptozotosina, nuestro grupo mostró que el entrenamiento de la resistencia redujo la peroxidación de los lípidos medida por el nivel de TBARS en el músculo vasto lateral, y además incrementó el nivel de glutatión peroxidasa en el músculo gastronecmio rojo (Gul et al, 2002). Sin embargo, el entrenamiento de la resistencia incrementó la formación de dienos conjugados y redujo la actividad de glutatión peroxidasa en el corazón. Consistentemente con estos resultados, previamente se ha observado en ratas saludables entrenadas en resistencia la reducción de los niveles cardíacos de antioxidantes (Kihlstrom et al., 1989). El ejercicio exhaustivo agudo indujo estrés oxidativo, medido por el incremento en la concentración de TBARS, en el hígado e incrementó la formación de dienos en el corazón. El incremento en los niveles de TBARS en el hígado de ratas diabéticas desentrenadas luego de la realización de ejercicio agudo exhaustivo esta de acuerdo con nuestras observaciones previas en un estudio llevado a cabo con ratas normales (Khanna et al., 1999). Estos resultados sugieren que a pesar de los efectos adversos en el corazón, el entrenamiento de la resistencia parece regular las defensas antioxidantes dependientes de glutatión en el músculo esquelético.
CONCLUSION
La diabetes mellitus está asociada con un incremento marcado de la mortalidad por causas de enfermedad coronaria, no explicables por los factores de riesgo tradicionales. Aunque los datos no son todavía concluyentes, con mayor frecuencia se ha implicado al estrés oxidativo en la patogénesis de las enfermedades micro y macro vasculares observadas en pacientes diabéticos. Cierta evidencia también respalda el papel de la actividad física en la reducción de la peroxidación de los lípidos. Si el ejercicio físico regular puede mostrar un efecto protector contra el estrés oxidativo en pacientes con DM, entonces esto podría tener un impacto directo en la utilización del ejercicio físico como una modalidad terapéutica en la diabetes.
Agradecimientos
Este trabajo fue parcialmente respaldado por subsidios de investigación otorgados por el Ministerio de Educación de Finlandia y por la Fundación Juho Vainio. David E Laaksonen fue apoyado por la Escuela de Graduados TULES, Academia de Finlandia. Los autores agradecen a la Sra. Merja Saastamoinen por su asistencia en la edición.
Referencias
1. American Diabetes Association (1998). clinical practice recommendations. Diabetes Care 21, S1-95
2. Adachi, T., Yamada, H., Yamada, Y., Morihara, N., Yamazaki, N., Murakami, T., Futenma, A., Kato, K., and Hirano, K (1996). Substitution of glycine for arginino-213 in extracellular-superoxide dismutase impairs affinity for heparin and endothelial cell surface. Biochemical Journal 313:Part 1, 235-239
3. Ahotupa, M., Marniemi, J., Lehtimaki, T., Talvinen, K., Raitakari, O.T., Vasankari, T., Viikari, J., Luoma, J., and Yla-Herttuala, S (1998). Baseline diene conjugation in LDL lipids as a direct measure of in vivo LDL oxidation. Clinical Biochemistry 31, 257-261
4. Akkus, I., Kalak, S., Vural, H., Caglayan, O., Menekse, E., Can, G., and Durmus, B (1996). Leukocyte lipid peroxidation, superoxide dismutase, glutathione peroxidase and serum and leukocyte vitamin C levels of patients with type II diabetes mellitus. Clinica Chimica Acta 244, 221-227
5. Altomare, E., Grattagliano, I., Vendemaile, G., Micelli-Ferrari, T., Signorile, A., and Cardia, L (1997). Oxidative protein damage in human diabetic eye: evidence of a retinal participation. European Journal of Clinical Investigation 27, 141-147
6. Altomare, E., Vendemiale, G., Chicco, D., Procacci, V., and Cirelli, F (1992). Increased lipid peroxidation in type 2 poorly controlled diabetic patients. Diabetes & Metabolism 18, 264-271
7. Arai, K., Iizuka, S., Tada, Y., Oikawa, K., and Taniguchi, N (1987). Increase in the glucosylated form of erythrocyte Cu-Zn-superoxide dismutase in diabetes and close association of the nonenzymatic glucosylation with the enzyme activity. Biochimica et Biophysica Acta 924, 292-296
8. Armstrong, A.M., Chestnutt, J.E., Gormley, M.J., and Young, I.S (1996). The effect of dietary treatment on lipid peroxidation and antioxidant status in newly diagnosed noninsulin dependent diabetes. Free Radical Biology and Medicine 21, 719-726
9. Asayama, K., Uchida, N., Nakane, T., Hayashibe, H., Dobashi, K., Amemiya, S., Kato, K., and Nakazawa, S (1993). Antioxidants in the serum of children with insulin-dependent diabetes mellitus. Free Radical Biology and Medicine15, 597-602
10. Atalay, M., Laaksonen, D.E., Khanna, S., Kaliste-Korhonen, E., Hanninen, O., and Sen, C.K (2000). Vitamin E regulates changes in tissue antioxidants induced by fish oil and acute exercise. Medicine and Science in Sports and Exercise 32, 601-607
11. Atalay, M., Laaksonen, D.E., Niskanen, L., Uusitupa, M., and Hanninen, O., Sen, C.K (1997). Altered antioxidant enzyme defences in insulin-dependent diabetic men with increased resting and exercise-induced oxidative stress. Acta Physiologica Scandinavica 161, 195-201
12. Atalay, M., Marnila, P., Lilius, E.M., Hanninen, O., and Sen, C.K (1996). Glutathione-dependent modulation of exhausting exercise-induced changes in neutrophil function of rats. European Journal of Applied Physiology and Occupational Physiology 74, 342-347
13. Atalay, M., Seene, T., Hanninen, O., and Sen, C.K (1996). Skeletal muscle and heart antioxidant defences in response to sprint training. Acta Physiologica Scandinavica 158, 129-134
14. Atalay, M., and Sen, C.K (1999). Physical exercise and antioxidant defenses in the heart. Annals New York Academy of Sciences 874, 169-177
15. Baynes, J.W (1991). Role of oxidative stress in development of complications in diabetes. Diabetes 40, 405-412
16. Bellomo, G., Maggi, E., Poli, M., Agosta, F.G., Bollati, P., and Finardi, G (1995). Autoantibodies against oxidatively modified low-density lipoproteins in NIDDM. Diabetes 44, 60-66
17. Blakytny, R., and Harding, J.J (1992). Glycation (non-enzymic glycosylation) inactivates glutathione reductase. Biochemical Journal 288, 303-307
18. Bowie, A., Owens, D., Collins, P., Johnson, A., and Tomkin, G.H (1993). Glycosylated low density lipoprotein is more sensitive to oxidation: implications for the diabetic patient? Atherosclerosis 102, 63-67.
19. Bravi, M.C., Pietrangeli, P., Laurenti, O., Basili, S., Cassone Faldetta, M., Ferri, C., and De Mattia, G (1997). Polyol pathway activation and glutathione redox status in non-insulin-dependent diabetic patients. Metabolism 46, 1194-1198
20. Cakatay, U., Telci, A., Salman, S., Satman, L., and Sivas, A (2000). Oxidative protein damage in type I diabetic patients with and without complications. Endocrine Research 26, 365-379
21. Cameron, N.E., and Cotter, M.A (1993). Potential therapeutic approaches to the treatment or prevention of diabetic neuropathy: evidence from experimental studies. Diabetic Medicine 10, 593-605
22. Cameron, N.E., Cotter, M.A., and Hohman, T.C (1996). Interactions between essential fatty acid, prostanoid, polyol pathway and nitric oxide mechanisms in the neurovascular deficit of diabetic rats. Diabetologia 39, 172-182
23. Cederberg, J., Basu, S., and Eriksson, U.J (2001). Increased rate of lipid peroxidation and protein carbonylation in experimental diabetic pregnancy. Diabetologia 44, 766-774
24. Ceriello, A., Bortolotti, N., Falleti, E., Taboga, C., Tonutti, L., Crescentini, A., Motz, E., Lizzio, S., Russo, A., and Bartoli, E (1997). Total radical-trapping antioxidant parameter in NIDDM patients. Diabetes Care 20, 194-197
25. Ceriello, A., Giugliano, D., Quatraro, A., Dello-Russo, P., and Lefebvre, P.J (1991). Metabolic control may influence the increased superoxide generation in diabetic serum. Diabetic Medicine 8, 540-542
26. Ceriello, A., Mercuri, F., Quagliaro, L., Assaloni, R., Motz, E., Tonutti, L., and Taboga, C (2001). Detection of nitrotyrosine in the diabetic plasma: evidence of oxidative stress. Diabetologia 44, 834-838
27. Chevion, M., Berenshtein, E., and Stadtman, E.R (2000). Human studies related to protein oxidation: protein carbonyl content as a marker of damage. Free Radical Research 33 Suppl, S99-108
28. Collier, A., Rumley, A., Rumley, A.G., Paterson, J.R., Leach, J.P., Lowe, G.D., and Small, M (1992). Free radical activity and hemostatic factors in NIDDM patients with and without microalbuminuria. Diabetes 41, 909-913
29. Dandona, P., Thusu, K., Cook, S., Snyder, B., Makowski, J., Armstrong, D., and Nicotera, T (1996). Oxidative damage to DNA in diabetes mellitus. Lancet 347, 444-445
30. Davies, K.J., Quintanilha, A.T., Brooks, G.A., and Packer, L (1982). Free radicals and tissue damage produced by exercise. Biochemical and Biophysical Research Communications107, 1198-1205
31. De Mattia, G., Laurenti, O., Bravi, C., Ghiselli, A., Iuliano, L., and Balsano, F (1994). Effect of aldose reductase inhibition on glutathione redox status in erythrocytes of diabetic patients. Metabolism 43, 965-968
32. Desfaits, A.C., Serri, O., and Renier, G (1998). Normalization of plasma lipid peroxides, monocyte adhesion, and tumor necrosis factor-alpha production in NIDDM patients after gliclazide treatment. Diabetes Care 21, 487-493
33. Di Simplicio, P., de Giorgio, L.A., Cardaioli, E., Lecis, R., Miceli, M., Rossi, R., Anichini, R., Mian, M., Seghieri, G., and Franconi, F (1995). Glutathione, glutathione utilizing enzymes and thioltransferase in platelets of insulin-dependent diabetic patients: relation with platelet aggregation and with microangiopatic complications. European Journal of Clinical Investigation 25, 665-669
34. Dillard, C.J., Litov, R.E., Savin, W.M., Dumelin, E.E., and Tappel, A.L (1978). Effects of exercise, vitamin E, and ozone on pulmonary function and lipid peroxidation. Journal of Applied Physiology 45, 927-932
35. Dominguez, C., Ruiz, E., Gussinye, M., and Carrascosa, A (1998). Oxidative stress at onset and in early stages of type 1 diabetes in children and adolescents. Diabetes Care 21, 1736-1742
36. Draper, H.H., Squires, E.J., Mahmoodi, H., Wu, J., Agarwal, S., and Hadley, M (1993). A comparative evaluation of thiobarbituric acid methods for the determination of malondialdehyde in biological materials. Free Radical Biology and Medicine 15, 353-363
37. Dyer, D.G., Dunn, J.A., Thorpe, S.R., Bailie, K.E., Lyons, T.J., McCance, D.R., and Baynes, J.W (1993). Accumulation of Maillard reaction products in skin collagen in diabetes and aging. The Journal of Clinical Investigation 91, 2463-2469
38. Elgawish, A., Glomb, M., Friedlander, M., and Monnier, V.M (1996). Involvement of hydrogen peroxide in collagen cross-linking by high glucose in vitro and in vivo. J. Biol. Chem 271, 12964-12971
39. Evans, R.W., and Orchard, T.J (1994). Oxidized lipids in insulin-dependent diabetes mellitus: a sex-diabetes interaction? Metabolism 43, 1196-1200.
40. Faure, P., Benhamou, P.Y., Perard, A., Halimi, S., and Roussel, A.M (1995). Lipid peroxidation in insulin-dependent diabetic patients with early retina degenerative lesions: effects of an oral zinc supplementation. Eur. J. Clin. Nutr. 49, 282-288
41. Faure, P., Corticelli, P., Richard, M.J., Arnaud, J., Coudray, C., Halimi, S., Favier, A., and Roussel, A.M (1993). Lipid peroxidation and trace element status in diabetic ketotic patients: influence of insulin therapy. Clinical Chemistry 39, 789-793
42. Festa, A., Kopp, H.P., Schernthaner, G., and Menzel, E.J (1998). Autoantibodies to oxidised low density lipoproteins in IDDM are inversely related to metabolic control and microvascular complications. Diabetologia. 41, 350-356
43. Freitas, J.P., Filipe, P.M., and Rodrigo, F.G (1997). Lipid peroxidation in type 2 normolipidemic diabetic patients. Diabetes Research and Clinical Practice 36, 71-75
44. Fujiwara, Y., Kondo, T., Murakami, K., and Kawakami, Y (1989). Decrease of the inhibition of lipid peroxidation by glutathione-dependent system in erythrocytes of non-insulin dependent diabetics. Klin. Wochenschr. 67, 336-341
45. Gallou, G., Ruelland, A., Legras, B., Maugendre, D., Allannic, H., and Cloarec, L (1993). Plasma malondialdehyde in type 1 and type 2 diabetic patients. Clinica Chimica Acta 214, 227-234
46. Ghiselli, A., Laurenti, O., De Mattia, G., Maiani, G., and Ferro Luzzi, A (1992). Salicylate hydroxylation as an early marker of in vivo oxidative stress in diabetic patients. Free Radical Biology and Medicine 13, 621-626
47. Giugliano, D., Ceriello, A., and Paolisso, G (1996). Oxidative stress and diabetic vascular complications. Diabetes Care 19, 257-267
48. Godin, D.V., Wohaieb, S.A., Garnett, M.E., and Goumeniouk, A.D (1988). Antioxidant enzyme alterations in experimental and clinical diabetes. Mol. Cell. Biochem. 84, 223-231
49. Goldfarb, A.H., McIntosh, M.K., and Boyer, B.T (1996). Vitamin E attenuates myocardial oxidative stress induced by DHEA in rested and exercised rats. Journal of Applied Physiology 80, 486-490
50. Griesmacher, A., Kindhauser, M., Andert, S.E., Schreiner, W., Toma, C., Knoebl, P., Pietschmann, P., Prager, R., Schnack, C., and Schernthaner, G (1995). Enhanced serum levels of thiobarbituric-acid-reactive substances in diabetes mellitus. Am. J. Med. 98, 469-475
51. Griffin, M.E., McInerney, D., Fraser, A., Johnson, A.H., Collins, P.B., Owens, D., and Tomkin, G.H (1997). Autoantibodies to oxidized low density lipoprotein: the relationship to low density lipoprotein fatty acid composition in diabetes. Diabetic Medicine 14, 741-747
52. Grunewald, R.W., Weber, II, Kinne Saffran, E., and Kinne, R.K (1993). Control of sorbitol metabolism in renal inner medulla of diabetic rats: regulation by substrate, cosubstrate and products of the aldose reductase reaction. Biochimica et Biophysica Acta 1225, 39-47
53. Gugliucci, A., Menini, T., and Stahl, A.J (1994). Susceptibility to copper-enhanced autoxidation of VLDL+LDL fractions from diabetic patients. Biochem. Mol. Biol. Int. 32, 139-147
54. Gul, M., Laaksonen, D.E., Atalay, M., Vider, L., and Hanninen, O (2002). Endurance training decreases oxidative stress in streptozotocin induced diabetic rat. Scandinavian Journal of Sports Medicine and Sports, in press
55. Haffner, S.M., Agil, A., Mykkanen, L., Stern, M.P., and Jialal, I (1995). Plasma oxidizability in subjects with normal glucose tolerance, impaired glucose tolerance, and NIDDM. Diabetes Care 18, 646-653
56. Hermes-Lima, M., Willmore, W.G., and Storey, K.B (1995). Quantification of lipid peroxidation in tissue extracts based on Fe(III)xylenol orange complex formation. Free Radical Biology and Medicine 19, 271-280
57. Hsu, R.M., Devaraj, S., and Jialal, I (2002). Autoantibodies to oxidized low-density lipoprotein in patients with Type 2 diabetes mellitus. Clinica Chimica Acta 317, 145-150
58. Hunt, J.V., Smith, C.C., and Wolff, S.P (1990). Autoxidative glycosylation and possible involvement of peroxides and free radicals in LDL modification by glucose. Diabetes 39, 1420-1424
59. Jain, S.K., and McVie, R (1994). Effect of glycemic control, race (white versus black), and duration of diabetes on reduced glutathione content in erythrocytes of diabetic patients. Metabolism 43, 306-309
60. Jang, Y.Y., Song, J.H., Shin, Y.K., Han, E.S., and Lee, C.S (2000). Protective effect of boldine on oxidative mitochondrial damage in streptozotocin-induced diabetic rats. Pharmacological Research 42, 361-371
61. Jenkins, A.J., Klein, R.L., Chassereau, C.N., Hermayer, K.L., and Lopes Virella, M.F (1996). LDL from patients with well-controlled IDDM is not more susceptible to in vitro oxidation. Diabetes 45, 762-767
62. Jennings, P.E., McLaren, M., Scott, N.A., Saniabadi, A.R., and Belch, J.J (1991). The relationship of oxidative stress to thrombotic tendency in type 1 diabetic patients with retinopathy. Diabetic Medicine 8, 860-865
63. Ji, L.L (1999). Antioxidants and oxidative stress in exercise. Proceedings of the Society for Experimental Biology and Medicine 222, 283-292
64. Jones, A.F., Winkles, J.W., Thornalley, P.J., Lunec, J., Jennings, P.E., and Barnett, A.H (1987). Inhibitory effect of superoxide dismutase on fructosamine assay. Clinical Chemistry 33, 147-149
65. Kaneto, H., Fujii, J., Myint, T., Miyazawa, N., Islam, K.N., Kawasaki, Y., Suzuki, K., Nakamura, M., Tatsumi, H., Yamasaki, Y., and Taniguchi, N (1996). Reducing sugars trigger oxidative modification and apoptosis in pancreatic beta-cells by provoking oxidative stress through the glycation reaction. Biochemical Journal 320, 855-863
66. Kashiwagi, A., Asahina, T., Ikebuchi, M., Tanaka, Y., Takagi, Y., Nishio, Y., Kikkawa, R., and Shigeta, Y (1994). Abnormal glutathione metabolism and increased cytotoxicity caused by H2O2 in human umbilical vein endothelial cells cultured in high glucose medium. Diabetologia 37, 264-269
67. Kashiwagi, A., Asahina, T., Nishio, Y., Ikebuchi, M., Tanaka, Y., Kikkawa, R., and Shigeta, Y (1996). Glycation, oxidative stress, and scavenger activity: glucose metabolism and radical scavenger dysfunction in endothelial cells. Diabetes 45, S84-S86
68. Kawamura, M., Heinecke, J.W., and Chait, A (1994). Pathophysiological concentrations of glucose promote oxidative modification of low density lipoprotein by a superoxide-dependent pathway. The Journal of Clinical Investigation 94, 771-778
69. Kawamura, N., Ookawara, T., Suzuki, K., Konishi, K., Mino, M., and Taniguchi, N (1992). Increased glycated Cu,Zn-superoxide dismutase levels in erythrocytes of patients with insulin-dependent diabetis mellitus. The Journal of Clinical Endocrinology and Metabolism 74, 1352-1354
70. Khanna, S., Atalay, M., Laaksonen, D.E., Gul, M., Roy, S., and Sen, C.K (1999). Alpha-lipoic acid supplementation: tissue glutathione homeostasis at rest and after exercise. Journal of Applied Physiology 86, 1191-1196
71. Kihlstrom, M., Ojala, J., and Salminen, A (1989). Decreased level of cardiac antioxidants in endurance-trained rats. Acta Physiologica Scandinavica 135, 549-554
72. Kim, J.D., Yu, B.P., McCarter, R.J.M., Lee, S.Y., and Herlihy, J.T (1996). Exercise and diet modulate cardiac lipid peroxidation and antioxidant defenses. Free Radical Biology and Medicine 20, 83-88
73. Korpinen, E., Groop, P.H., Akerblom, H.K., and Vaarala, O (1997). Immune response to glycated and oxidized LDL in IDDM patients with and without renal disease. Diabetes Care 20, 1168-1171
74. Laaksonen, D.E., Atalay, M., Niskanen, L., Uusitupa, M., and Hanninen, O., Sen, C.K (1996). Increased resting and exercise-induced oxidative stress in young IDDM men. Diabetes Care 19, 569-574
75. Laaksonen, D.E., Atalay, M., Niskanen, L.K., Mustonen, J., Sen, C.K., Lakka, T.A., and Uusitupa, M.I (2000). Aerobic exercise and the lipid profile in type 1 diabetic men: a randomized controlled trial. Medicine and Science in Sports and Exercise 32, 1541-1548
76. Laaksonen, D.E., and Sen, C.K.(2000) Exercise and Oxidative Stress in Diabetes Mellitus In: Handbook of Oxidants and Antioxidants in Exercise. Ed: Sen CK, Packer L and Hanninen O. Amsterdam: Elsevier, 1105-1136
77. Lakka, T.A., Venalainen, J.M., Rauramaa, R., Salonen, R., Tuomilehto, J., and Salonen, J.T (1994). Relation of leisure-time physical activity and cardiorespiratory fitness to the risk of acute myocardial infarction. The New England Journal of Medicine 330, 1549-1554
78. Leonard, M.B., Lawton, K., Watson, I.D., Patrick, A., Walker, A., and MacFarlane, I (1995). Cigarette smoking and free radical activity in young adults with insulin-dependent diabetes. Diabetic Medicine 12, 46-50
79. Lyons, T.J (1993). Glycation and oxidation: a role in the pathogenesis of atherosclerosis. The American Journal of Cardiology 71, 26B-31B
80. MacRury, S.M., Gordon, D., Wilson, R., Bradley, H., Gemmell, C.G., Paterson, J.R., Rumley, A.G., and MacCuish, A.C (1993). A comparison of different methods of assessing free radical activity in type 2 diabetes and peripheral vascular disease. Diabetic Medicine 10, 331-335
81. Maejima, K., Nakano, S., Himeno, M., Tsuda, S., Makiishi, H., Ito, T., Nakagawa, A., Kigoshi, T., Ishibashi, T., Nishio, M., and Uchida, K (2001). Increased basal levels of plasma nitric oxide in Type 2 diabetic subjects. Relationship to microvascular complications. Journal of Diabetes and its Complications 15, 135-143
82. Mannervik, B., and Danielson, U.H (1988). Glutathione transferases--structure and catalytic activity. CRC. Critical Reviews in Biochemistry 23, 283-337
83. Marra, G., Cotroneo, P., Pitocco, D., Manto, A., Di Leo, M.A., Ruotolo, V., Caputo, S., Giardina, B., Ghirlanda, G., and Santini, S.A (2002). Early Increase of Oxidative Stress and Reduced Antioxidant Defenses in Patients With Uncomplicated Type 1 Diabetes: A case for gender difference. Diabetes Care 25, 370-375
84. McDermott, B.M., Flatt, P.R., and Strain, J.J (1994). Effects of copper deficiency and experimental diabetes on tissue antioxidant enzyme levels in rats. Annals of Nutrition & Metabolism 38, 263-269
85. Meister, A (1995). Glutathione metabolism. Methods in Enzymology 251, 3-7
86. Mironova, M., Virella, G., Virella Lowell, I., and Lopes Virella, M.F (1997). Anti-modified LDL antibodies and LDL-containing immune complexes in IDDM patients and healthy controls. Clinical Immunology and Immunopathology 85, 73-82
87. Mol, M.J., de Rijke, Y.B., Demacker, P.N., and Stalenhoef, A.F (1997). Plasma levels of lipid and cholesterol oxidation products and cytokines in diabetes mellitus and cigarette smoking: effects of vitamin E treatment. Atherosclerosis 129, 169-176
88. Muruganandam, A., Drouillard, C., Thibert, R.J., Cheung, R.M., Draisey, T.F., and Mutus, B (1992). Glutathione metabolic enzyme activities in diabetic platelets as a function of glycemic control. Thrombosis Research 67, 385-397
89. Nacitarhan, S., Ozben, T., and Tuncer, N (1995). Serum and urine malondialdehyde levels in NIDDM patients with and without hyperlipidemia. Free Radical Biology and Medicine 19, 893-896
90. Nath, N., Chari, S.N., and Rathi, A.B (1984). Superoxide dismutase in diabetic polymorphonuclear leukocytes. Diabetes 33, 586-589
91. Neri, S., Bruno, C.M., Raciti, C., Dangelo, G., Damico, R., and Cristaldi, R (1994). Alteration of oxide reductive and haemostatic factors in type 2 diabetics. Journal of Internal Medicine 236, 495-500
92. Niskanen, L.K., Salonen, J.T., Nyyssonen, K., and Uusitupa, M.I (1995). Plasma lipid peroxidation and hyperglycaemia: a connection through hyperinsulinaemia? Diabetic Medicine 12, 802-808.
93. Noberasco, G., Odetti, P., Boeri, D., Maiello, M., and Adezati, L (1991). Malondialdehyde (MDA) level in diabetic subjects. Relationship with blood glucose and glycosylated hemoglobin. Biomedecine & Pharmacotherapy 45, 193-196
94. Nourooz Zadeh, J., Rahimi, A., Tajaddini Sarmadi, J., Tritschler, H., Rosen, P., Halliwell, B., and Betteridge, D.J (1997). Relationships between plasma measures of oxidative stress and metabolic control in NIDDM. Diabetologia 40, 647-653
95. Nourooz-Zadeh, J., Tajaddini-Sarmadi, J., McCarthy, S., Betteridge, D.J., and Wolff, S.P (1995). Elevated levels of authentic plasma hydroperoxides in NIDDM. Diabetes 44, 1054-1058
96. O-Brien, S., Mori, T.A., Puddey, I.B., and Stanton, K.G (1995). Absence of increased susceptibility of LDL to oxidation in type 1 diabetics. Diabetes Research and Clinical Practice 30, 195-203
97. Obrosova, I.G., Van Huysen, C., Fathallah, L., Cao, X.C., Greene, D.A., and Stevens, M.J (2002). An aldose reductase inhibitor reverses early diabetes-induced changes in peripheral nerve function, metabolism, and antioxidative defense. The FASEB Journal 16, 123-125
98. Osterode, W., Holler, C., and Ulberth, F (1996). Nutritional antioxidants, red cell membrane fluidity and blood viscosity in type 1 (insulin dependent) diabetes mellitus. Diabetic Medicine 13, 1044-1050
99. Ou, P., and Wolff, S.P (1994). Erythrocyte catalase inactivation (H2O2 production) by ascorbic acid and glucose in the presence of aminotriazole: role of transition metals and relevance to diabetes. Biochemical Journal 303, 935-939
100. Ozben, T., Nacitarhan, S., and Tuncer, N (1995). Plasma and urine malondialdehyde levels in non-insulin-dependent diabetic patients with and without microalbuminuria. Int J Clin Lab Res 25, 162-164
101. Paffenbarger, R.S., Jr., Kampert, J.B., Lee, I.M., Hyde, R.T., Leung, R.W., and Wing, A.L (1994). Changes in physical activity and other lifeway patterns influencing longevity. Medicine and Science in Sports and Exercise 26, 857-865
102. Peuchant, E., Delmas Beauvieux, M.C., Couchouron, A., Dubourg, L., Thomas, M.J., Perromat, A., Clerc, M., and Gin, H (1997). Short-term insulin therapy and normoglycemia. Effects on erythrocyte lipid peroxidation in NIDDM patients. Diabetes Care 20, 202-207
103. Powers, S.K., Coombes, J., and Demirel, H (1997). Exercise training-induced changes in respiratory muscles. Sports Medicine 24, 120-131
104. Powers, S.K., Ji, L.L., and Leeuwenburgh, C (1999). Exercise training-induced alterations in skeletal muscle antioxidant capacity: a brief review. Medicine and Science in Sports and Exercise 31, 987-997
105. Rabini, R.A., Fumelli, P., Galassi, R., Dousset, N., Taus, M., Ferretti, G., Mazzanti, L., Curatola, G., Solera, M.L., and Valdiguie, P (1994). Increased susceptibility to lipid oxidation of low-density lipoproteins and erythrocyte membranes from diabetic patients. Metabolism 43, 1470-1474
106. Sakurai, T., and Tsuchiya, S (1988). Superoxide production from nonenzymatically glycated protein. FEBS Letters 236, 406-410
107. Salonen, J.T., Yla Herttuala, S., Yamamoto, R., Butler, S., Korpela, H., Salonen, R., Nyyssonen, K., Palinski, W., and Witztum, J.L (1992). Autoantibody against oxidised LDL and progression of carotid atherosclerosis [see comments]. Lancet 339, 883-887
108. Santini, S.A., Marra, G., Giardina, B., Cotroneo, P., Mordente, A., Martorana, G.E., Manto, A., and Ghirlanda, G (1997). Defective plasma antioxidant defenses and enhanced susceptibility to lipid peroxidation in uncomplicated IDDM. Diabetes 46, 1853-1858
109. Sato, Y., Hotta, N., Sakamoto, N., Matsuoka, S., Ohishi, N., and Yagi, K (1979). Lipid peroxide level in the plasma of diabetic patients. Biochemical Medicine and Metabolic Biology 21(1),104-107
110. Schleicher, E.D., Wagner, E., and Nerlich, A.G (1997). Increased accumulation of the glycoxidation product N(epsilon)-(carboxymethyl)lysine in human tissues in diabetes and aging. The Journal of Clinical Investigation 99, 457-468
111. Selamoglu, S., Turgay, F., Kayatekin, B.M., Gonenc, S., and Islegen, C (2000). Aerobic and anaerobic training effects on the antioxidant enzymes of the blood. Acta Physiologica Hungarica 87, 267-273
112. Sell, D.R., Lapolla, A., Odetti, P., Fogarty, J., and Monnier, V.M (1992). Pentosidine formation in skin correlates with severity of complications in individuals with long-standing IDDM. Diabetes 41, 1286-1292
113. Sen, C.K (1995). Oxidants and antioxidants in exercise. Journal of Applied Physiology 79, 675-686
114. Sen, C.K (1999). Glutathione homeostasis in response to exercise training and nutritional supplements. Mol Cell Biochem 196, 31-42
115. Sen, C.K., Atalay, M., and Hanninen, O (1994). Exercise-induced oxidative stress: glutathione supplementation and deficiency. Journal of Applied Physiology 77, 2177-2187
116. Sen, C.K., and Hanninen, O (1994). Physiological antioxidants. In: Exercise and oxygen toxicity. Ed: Sen CK, Packer L and Hanninen O. Amsterdam: Elsevier, 89-126
117. Sen, C.K., and Packer, L (2000). Thiol homeostasis and supplements in physical exercise. Am J Clin Nutr 72, 653S-669S
118. Sen, C.K., Packer, L., and Hanninen, O (1994). Exercise and Oxygen Toxicity. Amsterdam: Elsevier
119. Sen, C.K., Packer, L., and Hanninen, O (2000). Handbook of Oxidants and Antioxidants in Exercise. Amsterdam: Elsevier
120. Sinclair, A.J., Girling, A.J., Gray, L., Le-Guen, C., Lunec, J., and Barnett, A.H (1991). Disturbed handling of ascorbic acid in diabetic patients with and without microangiopathy during high dose ascorbate supplementation. Diabetologia 34, 171-175
121. Sinclair, A.J., Girling, A.J., Gray, L., Lunec, J., and Barnett, A.H (1992). An investigation of the relationship between free radical activity and vitamin C metabolism in elderly diabetic subjects with retinopathy. Gerontology 38, 268-274
122. Skrha, J., Hodinar, A., Kvasnicka, J., Stibor, V., Sperl, M., Stolba, P., and Hilgertova, J (1994). Early changes of serum N-acetyl-beta-glucosaminidase, tissue plasminogen activator and erythrocyte superoxide dismutase in relation to retinopathy in type 1 diabetes mellitus. Clinica Chimica Acta 229, 5-14
123. Stahlberg, M.R., and Hietanen, E (1991). Glutathione and glutathione-metabolizing enzymes in the erythrocytes of healthy children and in children with insulin-dependent diabetes mellitus, juvenile rheumatoid arthritis, coeliac disease and acute lymphoblastic leukaemia. Scandinavian Journal of Clinical and Laboratory Investigation 51, 125-130
124. Sundaram, R.K., Bhaskar, A., Vijayalingam, S., Viswanathan, M., Mohan, R., and Shanmugasundaram, K.R (1996). Antioxidant status and lipid peroxidation in type II diabetes mellitus with and without complications. Clinical Science 90, 255-260
125. Telci, A., Cakatay, U., Salman, S., Satman, I., and Sivas, A (2000). Oxidative protein damage in early stage Type 1 diabetic patients. Diabetes Res Clin Pract 50, 213-223
126. Tesfamariam, B (1994). Free Radicals in Diabetic Endothelial Cell Dysfunction. Free Radical Biology and Medicine 16, 383-391
127. Tho, L.L., and Candlish, J.K (1987). Superoxide dismutase and glutathione peroxidase activities in erythrocytes as indices of oxygen loading in disease: a survey of one hundred cases. Biochemical Medicine and Metabolic Biology 38, 74-80
128. Tho, L.L., Candlish, J.K., and Thai, A.C (1988). Correlates of diabetes markers with erythrocytic enzymes decomposing reactive oxygen species. Annals of Clinical Biochemistry 25, 426-431
129. Thornalley, P.J., McLellan, A.C., Lo, T.W., Benn, J., and Sonksen, P.H (1996). Negative association between erythrocyte reduced glutathione concentration and diabetic complications. Clinical Science 91, 575-582
130. Tiidus, P.M., Pushkarenko, J., and Houston, M.E (1996). Lack of antioxidant adaptation to short-term aerobic training in human muscle. The American Journal of Physiology 271, R832-836
131. Tsai, E.C., Hirsch, I.B., Brunzell, J.D., and Chait, A (1994). Reduced plasma peroxyl radical trapping capacity and increased susceptibility of LDL to oxidation in poorly controlled IDDM. Diabetes 43, 1010-1014
132. Urano, S., Hoshi Hashizume, M., Tochigi, N., Matsuo, M., Shiraki, M., and Ito, H (1991). Vitamin E and the susceptibility of erythrocytes and reconstituted liposomes to oxidative stress in aged diabetics. Lipids 26, 58-61
133. Uusitupa, M.I., Niskanen, L., Luoma, J., Vilja, P., Mercuri, M., Rauramaa, R., and Yla Herttuala, S (1996). Autoantibodies against oxidized LDL do not predict atherosclerotic vascular disease in non-insulin-dependent diabetes mellitus. Arteriosclerosis, Thrombosis, and Vascular Biology 16, 1236-1242
134. Walter, R.M., Jr., Uriu Hare, J.Y., Olin, K.L., Oster, M.H., Anawalt, B.D., Critchfield, J.W., and Keen, C.L (1991). Copper, zinc, manganese, and magnesium status and complications of diabetes mellitus. Diabetes Care 14, 1050-1056
135. Van Dam, P.S., Van Asbeck, B.S., Erkelens, D.W., Marx, J.J.M., Gispen, W.-H., and Bravenboer, B (1995). The role of oxidative stress in neuropathy and other diabetic complications. Diabetes/Metabolism Reviews 11, 181-192
136. Watala, C., and Winocour, P.D (1992). The relationship of chemical modification of membrane proteins and plasma lipoproteins to reduced membrane fluidity of erythrocytes from diabetic subjects. European Journal of Clinical Chemistry and Clinical Biochemistry 30, 513-519
137. Velazquez, E., Winocour, P.H., Kesteven, P., Alberti, K.G., and Laker, M.F (1991). Relation of lipid peroxides to macrovascular disease in type 2 diabetes. Diabetic Medicine 8, 752-758
138. Vijayalingam, S., Parthiban, A., and Shanmugasundaram, K.R., Mohan, V (1996). Abnormal antioxidant status in impaired glucose tolerance and non-insulin-dependent diabetes mellitus. Diabetic Medicine 13, 715-719
139. Wolff, S.P., Jiang, Z.Y., and Hunt, J.V (1991). Protein glycation and oxidative stress in diabetes mellitus and ageing. Free Radical Biology and Medicine 10, 339-352
140. Yagi, K (1976). A simple fluorometric assay for lipoperoxide in blood plasma. Biochemical Medicine 15, 212-216
141. Yaqoob, M., McClelland, P., Patrick, A.W., Stevenson, A., Mason, H., White, M.C., and Bell, G.M (1994). Evidence of oxidant injury and tubular damage in early diabetic nephropathy. Q. J. Med. 87, 601-607
142. Yoshida, K., Hirokawa, J., Tagami, S., Kawakami, Y., Urata, Y., and Kondo, T (1995). Weakened cellular scavenging activity against oxidative stress in diabetes mellitus: regulation of glutathione synthesis and efflux. Diabetologia 38, 201-210
143. Zimmet, P., and Lefebvre, P (1996). The global NIDDM epidemic. Treating the disease and ignoring the symptom [editorial]. Diabetologia. 39, 1247-1248
144. Zimmet, P.Z., McCarty, D.J., and de Courten, M.P (1997). The global epidemiology of non-insulin-dependent diabetes mellitus and the metabolic syndrome. Journal of Diabetes and its Complications 11, 60-68
145. Zoppini, G., Targher, G., Monauni, T., Faccini, G., Pasqualini, E., Martinelli, C., Zenari, M.L., and Muggeo, M (1996). Increase in circulating products of lipid peroxidation in smokers with IDDM. Diabetes Care 19, 1233-1236