Efectos de la Actividad Física a Largo Plazo sobre la Estructura y la Función Cardíaca: Un Estudio en Gemelos
Markku Alen1,3,4, Sara Mutikainen1, Merja Perhonen2, Tuija Leskinen1, Jouko Karjalainen5, Taina Rantanen1,6, Jaakko Kaprio7,8,9 y Urho M Kujala1
1Department of Health Sciences, University of Jyväskylä, Jyväskylä, Finland.
2CorusFit Oy, Jyväskylä, Finland.
3Department of Medical Rehabilitation, Oulu University Hospital, Oulu, Finland.
4Institute of Health Sciences, University of Oulu, Oulu, Finland.
5Unit for Sports and Exercise Medicine, University of Helsinki, Helsinki, Finland.
6Finnish Centre for Interdisciplinary Gerontology, University of Jyväskylä, Jyväskylä, Finland.
7Department of Public Health, University of Helsinki, Helsinki, Finland.
8National Institute for Health and Welfare, Helsinki, Finland.
9Institute for Molecular Medicine Finland FIMM, Helsinki, Finland.
Artículo publicado en el journal PubliCE del año 2012.
Publicado 15 de marzo de 2010
Resumen
Palabras clave: ejercicio, ecocardiografía, electrocardiografía, frecuencia cardíaca, control de la predisposición genética, estudio longitudinal
INTRODUCCION
Las enfermedades cardiovasculares son todavía una de las principales causas de muerte a nivel mundial, lo cual presenta un desafío para los sistemas de cuidados de la salud y resalta la importancia de los procedimientos preventivos. Está bien documentado que la actividad física reduce el riesgo de hipertensión (Whelton et al., 2002) y la ocurrencia de enfermedades cardíacas coronarias (Batty, 2002). Parte de los beneficios de la actividad física en la reducción del riesgo de sufrir enfermedades cardiovasculares puede estar mediado a través de sus efectos positivos sobre la estructura y función cardíaca. Ciertos cambios en la estructura y la función cardíaca, tales como la cardiopatía hipertrófica del ventrículo hizquierdo (LVH) (Vakili et al., 2001), el incremento de la frecuencia cardíaca de reposo (Dyer et al., 1980) y las anormalidades en la repolarización (inversión de la onda T) (Ristola, 1983; Rose et al., 1978) están asociadas con el incremento del riesgo de morbidez y mortalidad por causas cardiovasculares. Numerosos estudios de control de casos localizados llevados a cabo con atletas, han reportado que el entrenamiento deportivo provoca cambios opuestos en la función cardíaca, tales como la reducción de la frecuencia cardíaca de reposo (Bjørnstad et al., 1991; Parker et al., 1978; Sharma et al., 1999; Stolt et al., 1997). El entrenamiento físico también puede inducir cambios en la repolarización (Bjørnstad et al., 1991; Sharma et al., 1999) lo cual se manifiesta a través de la disminución o el sostenimiento de la amplitud de las ondas T. Una inversión de la ondas T ≥ 2 mm puede estar asociada con un incrementado riesgo de desarrollar enfermedades cardíacas estructurales, tal como la cardiomiopatía hipertrófica (Pelliccia et al., 2008), pero cambios menos pronunciados no tienen ninguna significancia prognóstica (Pelliccia et al., 2008; Serra-Grima et al., 2000). Se ha sugerido que los cambios estructurales, por ejemplo, el incremento de la masa del ventrículo izquierdo (LVM) y el incremento de las dimensiones de las cavidades cardíacas (Pluim et al., 2000) tienen un origen fisiológico más que patológico, ya que estos cambios no están asociados con la disfunción diastólica (Plium et al., 2002) y son generalmente reversibles luego de un período de desentrenamiento (Ehsani et al., 1978; Pelliccia et al., 2002). La LHV fisiológica mejora la función cardíaca, incrementando el volumen latido y el gasto cardíaca, permitiendo una mayor capacidad aeróbica. El incremento de la capacidad aeróbica es importante no solo para el que los atletas de alto nivel alcancen su pico de rendimiento, sino también para que los individuos de la población general puedan llevar a cabo actividades de la vida diaria, en particular aquellos individuos con enfermedades y/o los individuos ancianos.
Las pruebas aleatorias controladas u otros estudios longitudinales en está área son menos numerosos, pero se han llevado a cabo algunos estudios que utilizaron intervenciones de ejercicio a corto plazo en sujetos sedentarios u otras poblaciones no atléticas (Adams et al., 1981; Morrison et al., 1986; Schuit et al., 1998). Los hallazgos reportados luego del entrenamiento en estos estudios han sido similares a los reportados en los estudios de control de casos localizados llevados a cabo con atletas. Sin embargo, se sabe menos acerca de los efectos de la actividad física recreacional a largo plazo sobre la estructura y la función cardíaca, especialmente en poblaciones no atléticas. La investigación en esta área es desafiante, pero es difícil llevar a cabo estudios aleatorios controlados de ejercicio a largo plazo, y por otra parte, los estudios observacionales de seguimiento pueden incluir sesgos genéticos en la selección de los sujetos. Esto último puede haber también causado problemas en la interpretación de los resultados de los estudios de control de casos localizados llevados a cabo con atletas y sujetos sedentarios, ya que la estructura (Sharma et al., 2006) y la función cardíaca (Mutikainen et al., 2009), así como también la participación en la actividad física (Stubbe et al., 2006), se ven afectadas en un grado moderado a alto por factores genéticos. Esto puede hacer que existan personas que les resulte más fácil participar de programas de entrenamiento deportivo u otras actividades físicas vigorosas, lo cual resultará en una asociación aparente, pero no causal, entre la actividad física y la estructura y función cardíaca.
Para minimizar dichos problemas en el presente estudio, llevamos a cabo análisis apareados de la estructura y la función cardíaca en pares de gemelos identificados en base a la discordancia a largo plazo en sus niveles de actividad física. Al estudiar tanto gemelos monocigóticos (MZ) como dicigóticos (DZ), fuimos capaces de controlar las condiciones ambientales de la niñez y, en forma parcial, la predisposición genética, ya que los gemelos MZ comparten todos sus genes y los gemelos DZ comparten, en promedio, la mitad de sus genes. El propósito del presente estudio fue investigar los efectos de la actividad física recreacional a largo plazo vs la inactividad física sobre la estructura y función cardíaca (de reposo) en pares de gemelos que presentan diferencias en sus hábitos de actividad física a lo largo de un período de 32 años. También se tuvo como objetivo investigar los efectos de la actividad/inactividad física a largo plazo sobre la frecuencia cardíaca submáxima y pico en un test clínico de ejercicio. Nuestra hipótesis fue que un estilo de vida físicamente activo provocará adaptaciones cardíacas, las cuales estarán en la misma dirección que aquellas causadas por el entrenamiento deportivo, aun luego de controlar la predisposición genética y las condiciones ambientales de la infancia.
METODOS
Participantes
El presente estudio es parte del estudio TWINACTIVE, el cual tiene como propósito investigar las consecuencias metabólicas y cardiovasculares de la actividad/inactividad física, utilizando como muestra pares de gemelos con discordancia en sus niveles de actividad física. Los detalles acerca del reclutamiento y la valoración de la actividad física han sido descritos previamente (Leskinen et al., 2009) por lo que aquí solo se presenta un resumen. Dieciséis pares de gemelos (7 MZ y 9 DZ, edad media 60 años) fueron identificados en el Cohorte Nacional de Gemelos de Finlandia (n = 5663 pares) (Kaprio and Koskenvuo, 2002). Los datos se recolectaron en base al tiempo de actividad física recreacional y de traslado diario, en diferentes puntos del período de seguimiento. La cantidad de actividad física recreativa fue documentada utilizando métodos validados (Leskinen et al., 2009; Waller et al., 2008). Con los datos recolectados, se calcularon los índices MET (para el tiempo de actividad física recreativa y el tiempo de actividad física de traslado en forma separada) asignando un múltiplo de la tasa metabólica de reposo (intensidad de la actividad × duración de una sesión × frecuencia mensual). Esto fue expresado como un valor de MET en horas/día (Kujala et al., 1998; Waller et al., 2008).
Para la identificación de los pares de gemelos discordantes en cuanto al tiempo de actividad física recreacional y de traslado al trabajo (i.e., el mismo gemelo de cada par era más activo que su otro/a gemelo/a) se procedió de la siguiente manera. Primero, el par de gemelos seleccionados era presentaba discordancias respecto del nivel de actividad física en los cuestionarios de valoración inicial en 1975 y 1981 (165 pares de 5663). Segundo, la discordancia entre los gemelos fue observada nuevamente en al menos cuatro de los seis puntos de evaluación en la entrevista de seguimiento retrospectiva a partir de 1980 y hasta el 2005 (54 pares de 165). Tercero, antes de invitar al par de gemelos a participar de las evaluaciones de laboratorio, se procedió a excluir a aquellos pares cuyo estatus de salud/medicación (cáncer maligno, artritis reumatoide, enfermedad de Alzheimer, discapacidad/edad, colaboración insuficiente) violara severamente los objetivos del estudio (7 pares) así como también aquellos pares cuya discordancia en los niveles de actividad física fuera mínima (21 pares). De los restantes 26 pares, 9 pares declinaron la invitación y un par ya no presentaba discordancias en los niveles de actividad física. Por lo tanto, en la valoración de seguimiento realizada en 2007 se halló que 16 pares de gemelos presentaban discordancia respecto de sus niveles de actividad física recreacional y de traslado al trabajo, y estos pares fueron los que realizaron las evaluaciones. La cigocidad de los pares participantes fue determinada mediante el genotipo de diez marcadores genéticos altamente polimórficos.
En el presente sub estudio, la inclusión de pares de gemelos se llevó a cabo solamente en base a la discordancia en el tiempo de actividad física recreativa, ya que los estudios publicados hasta la fecha han mostrado que se requiere de actividad física vigorosa para inducir cambios en la función eléctrica del corazón. Por lo tanto, se excluyeron tres pares, que mostraron muy pequeña discordancia en el tiempo de actividad física recreativa (0.6-3.0 MET h·día-1) durante el período de seguimiento de 32 años. Además, debido a que las anormalidades específicas de conducción hacen imposible interpretar las características del ECG de reposo en forma significativa, se excluyó a un par de gemelos que presentaba bloqueo de la rama derecha. Luego de estos procedimientos de selección, el número final de pares incluidos en los análisis estadísticos fue 5 pares MZ y 7 pares DZ (50-67 años, tres pares de mujeres y nueve pares de hombres).
Durante el período de seguimiento, la diferencia promedio en el tiempo de actividad física recreacional entre los gemelos activos e inactivos fue de 8.2 (4.0, DE) MET h·día-1 [1.2 (1.1, DE) vs 9.4 (3.8, DE) MET h·día-1, p < 0.001] lo cual es equivalente, por ejemplo, a caminar 2 horas diariamente. La diferencia fue similar entre los pares MZ y DZ. El valor MET para los gemelos inactivos es equivalente, por ejemplo, a 45 min de caminata suave dos veces por semana y el valor MET para los gemelos activos equivale a correr 90 min cuatro veces por semana.
El estudio fue llevado a cabo de acuerdo a las normas de práctica clínica y científica establecidas por la Declaración de Helsinki. Todos los participantes fueron informados acerca del estudio y firmaron un documento de consentimiento informado antes de participar en cualquier evaluación. El plan del estudio fue aprobado por el Comité de Ética del Distrito Central de Salud Pública de Finlandia.
Mediciones Ecocardiográficas
Los estudios ecocardiográficos fueron llevados a cabo utilizando un dispositivo Siemens Acuson CV70, con un transductor P4-2 de 3.6 MHz. Todas las mediciones fueron llevadas a cabo por el mismo examinador (MP). Los participantes fueron posicionados a 45º, en posición de decúbito lateral izquierdo, realizándose un análisis integrado en modo M y un análisis bidimensional para determinar el grosor del septum interventricular (IVST), el grosor de la pared posterior (PWT) del ventrículo izquierdo (LV) en el momento de la diástole y los diámetros del LV al final de la diástole (LVEDD) y al final de la sístole (LVESD). Los registros bidimensionales en modo M fueron obtenidos a lo largo del eje largo paraesternal. El IVST, el PWT y el LVEDD fueron medidos durante el pico de la onda R del electrocardiograma (ECG). El LVESD fue medido en el punto más angosto entre el septum y la pared posterior. La LVM fue calculada utilizando la ecuación de Deverux: masa (g) = 0.8 × {1.04 × [(IVST + LVEDD + PWT)3 - (LVEDD)3]} + 0.6 (Devereux et al., 1986), donde las variables necesarias se miden en la diástole y se expresan en centímetros. Para tener en cuenta la influencia del tamaño corporal sobre las dimensiones cardíacas, el LVEDD y la LVM fueron ajustados por el área de superficie corporal (BSA), calculada mediante la ecuación de Mosteller (Mosteller, 1987): [(talla en cm × peso en kilogramos) / 3600]1/2. La LVM también fue ajustada por la talla y el peso corporal. La fracción de eyección (EF, %) fue calculada como: EF = 100 × [(EDV – ESV)/EDV]. EDV representa el volumen diastólico final del LV y ESV el volumen sistólico final del LV. En los análisis estadísticos, se excluyeron los datos de un participante porque fue imposible medir las variables necesarias para el cálculo de la LVM, y por lo tanto los datos de este participante fueron también excluidos de los análisis relacionados con la LVM.
Mediciones Electrocardiográficas
Se utilizó un ECG de reposo estándar de 12 derivaciones (incluyendo la frecuencia cardíca) con el participante en posición supina a 50 mm/s y 10 mm/mV utilizando un dispositivo GE Medical System IT CardioSoft V5.02. Las variables medidas se detallan en la sección Resultados y en la Tabla 2. La frecuencia cardíaca corregida por el intervalo QT fue calculada utilizando la ecuación de Bazett (QT/RR1/2) (Bazett, 1920). Los índices LVH fueron calculados como sigue: Voltaje Sokolow Lyon (SV1 RV5) (Sokolow and Lyon, 1949), Voltaje Cronell (RaVL + SV3) (Casale et al., 1985) y producto Cornell (voltaje Cornell × duración del complejo QRS) (Molloy et al., 1992). Lso componentes del voltaje Sokolow Lyon y del voltaje Cornell, así como también las amplitudes de las ondas T en las derivaciones V1, V5 y II fueron medidas manualmente, mientras que las otras variables fueron recolectadas a través de los registros automáticos del ECG. Tanto las medidas ecocardiográficas como las medidas electrocardiográficas fueron llevadas a cabo desconociendo los datos del estatus de actividad física, cigocidad y de que gemelo se trataba.
Test Clínico de Ejercicio
Para la valoración de la aptitud cardiorrespiratoria, luego de la medición del ECG de reposo, se llevó a cabo un test clínico de ejercicio máximo limitado por síntomas, utilizando un cicloergómetro (Leskinen et al., 2009). El protocolo del test consiste de etapas de 2 min, comenzando con una etapa de aprendizaje a 20 W y una etapa de entrada en calor de 25 W. Posteriormente, la carga se incrementa en 25 W por etapa. La frecuencia cardíaca se registró a partir del ECG tanto antes del test (con los sujetos sentados en el cicloergómetro) como durante y al final de cada etapa. La frecuencia cardíaca pico fue definida como la mayor frecuencia cardíaca alcanzada en cualquier etapa. El VO2pico fue estimado a partir de la mayor carga alcanzada durante el test.
Otras Mediciones
Los datos iniciales y de seguimiento referentes a los hábitos de tabaquismo y los relacionados con la actividad física laboral fueron recolectados utilizando diarios, cuestionarios y entrevistas, tal como se describiera previamente (Kaprio and Koskenvuo, 2002; Kujala et al., 1998; Waller et al., 2008). La valoración de la presencia de enfermedades crónicas y del uso de medicamentos, así como las mediciones antropométricas y de la presión sanguínea de rutina, se llevaron a cabo en la examinación clínica.
Análisis Estadísticos
Se utilizaron análisis apareados para estudiar las diferencias entre los gemelos. En primer lugar, se llevaron a cabo análisis para todos los pares de gemelos y posteriormente se llevaron a cabo análisis para los gemelos MZ y DZ separadamente, para evaluar si las tendencias eran similares por cigocidad. La normalidad de los datos fue analizada mediante el test de Shapiro-Wilk, y los análisis apareados se llevaron a cabo de la siguiente manera: se utilizó el test t de Student para muestras apareadas en variables continuas con distribución normal; en variables continuas con distribución no normal se utilizó el test de Ranking con Signo de Wilcoxon y para las variables categóricas se utilizó el test de Simetría. El nivel de significancia fue establecido a p<0.05 (a dos colas). Los datos fueron analizados utilizando el programa SPSS 14.0 (SPSS Inc., Chicago, IL, USA) y el programa Stata Version 8 (Stata Corp., College Station, TX, USA).
RESULTADOS
Las características iniciales en 1975 y las características al final del período de seguimiento en 2007 de los 12 pares de gemelos se muestran en la Tabla 1. Además del índice de actividad física recreativa en MET, la única variable estadísticamente significativa entre los gemelos activos e inactivos fue el consumo de oxígeno pico, lo que indicó que la discordancia de actividad física también se reflejó en los niveles de aptitud cardiorrespiratoria entre los gemelos [28.1 (3.7, DE) vs 34.4 (4.9, DE) ml·kg-1·min-1, p = 0.003].
Al final del período de seguimiento, se observaron diferencias significativas entre los gemelos activos y los inactivos respecto de algunas variables ecocardiográficas y electrocardiográficas (Tabla 2). La frecuencia cardíaca de reposo fue, en promedio, 8.8 latidos/min (95% CI 1.3 a 16.4) meno en los gemelos activos que en los gemelos inactivos (p = 0.03). La frecuencia cardíaca corregida por el intervalo QT fue similar entre los gemelos. Además, se observó una tendencia hacia una mayor LVM por unidad de peso corporal y a una mayor amplitud de la onda T en la derivación II en los gemelos activos (18% y 15%, respectivamente, p = 0.08 para ambas variables). Las variables LVEDD, LVEDD/BSA, EF, intervalo PR, duración del intervalo QRS, P, QRS y eje T, duración de P y amplitud de la onda T en las derivaciones V1 y V5, y los índices de la LVH no fueron estadísticamente significativos entre los gemelos activos y los gemelos inactivos.
Similares tendencias en las diferencias intra-par, fueron observadas tanto para los pares de gemelos MZ y DZ, excepto para la duración del QRS, el eje P y el eje T (Tabla 2). Entre los pares de gemelos MZ, las diferencias intra-par en parte de las variables estudiadas fueron mayores que las observadas para el grupo total de estudio. De estas variables, la LVM por unidad de peso corporal alcanzó significancia estadística. La LVM absoluta y la LVM corregida por la BSA, la talla o el peso corporal fueron 21-22% mayores, el eje P 20% menos y la amplitud de la onda T en la derivación II fue un 17% mayor en los gemelos activos que en los gemelos inactivos. La frecuencia cardíaca de reposo fue 9.6 latidos por minuto (95% CI – 4.2 a 23.4) menor en los gemelos activos. Los resultados de la frecuencia cardíaca de reposo y de la LVM por unidad de peso corporal para cada par de gemelos MZ se presentan en las Figuras 1 y 2.
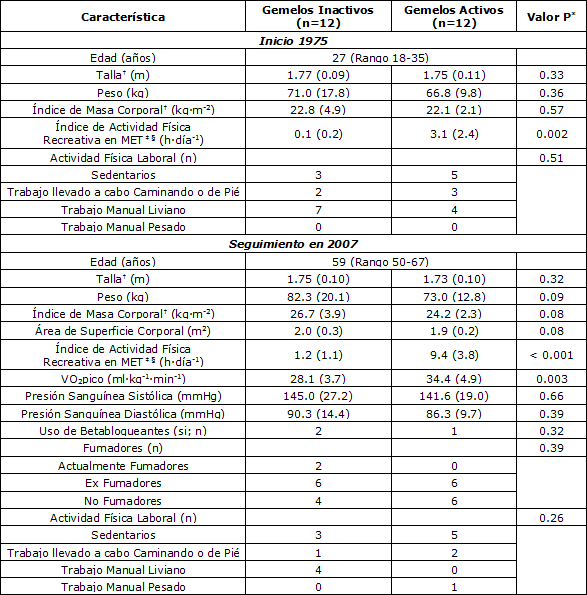
Tabla 1. Características iniciales y al final del período de seguimiento de los 12 pares de gemelos (9 hombres y 3 mujeres). Los datos de las variables continuas son medias (DE). *La diferencia entre los gemelos activos e inactivos se determinó en base al Test t de Student para muestras apareadas en aquellas variables continuas con distribución normal, en base al Test de Ranking con Signo de Wilcoxon para aquellas variables continuas sin distribución normal y en base al Test de Simetría para las variables categóricas. † n = 11. ‡Ver detalles de la definición y cálculos en la sección Métodos. §Incluye el tiempo de actividad física recreativa y de actividad física hacia y desde el trabajo.
La frecuencia cardíaca para los gemelos activos e inactivos durante el test clínico de ejercicio se muestra en la Figura 3. La frecuencia cardíaca en posición de sentado antes del test fue significativamente menor en los gemelos activos que en los gemelos inactivos [61.8 (3.8, DE) vs 74.0 (10.3, DE) latidos/minuto, respectivamente] y se mantuvo significativamente más baja en los gemelos activos en cada etapa submáxima del test. Sin embargo, la frecuencia cardíaca pico alcanzada durante el test (que no se muestra en la figura) fue similar entre los pares de gemelos [161 (12.0, DE) latidos/min en los gemelos activos vs 161.8 (16.4, DE) latidos/min en los gemelos inactivos, p = 0.99]. Similares tendencias fueron observadas cuando se analizaron separadamente los datos de los gemelos MZ y DZ.
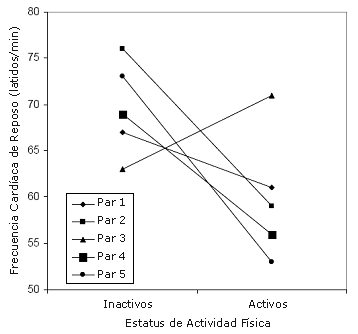
Figura 1. Frecuencia cardíaca de reposo en los pares de gemelos monocigóticos.
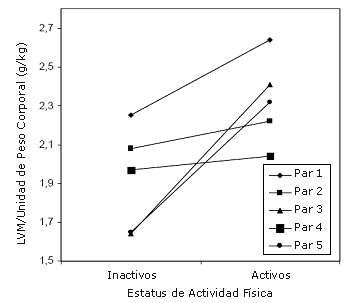
Figura 2. Masa del ventrículo izquierdo (LVM) por unidad de peso corporal en los pares de gemelos monocigóticos.
DISCUSION
Nuestro estudio con gemelos mostró que un estilo de vida físicamente activo durante un período de más de 30 años provoca una reducción de la frecuencia cardíaca de reposo y de la frecuencia cardíaca durante ejercicio submáximo, y hasta cierto punto, también un incremento de la LVM relativa al peso corporal.
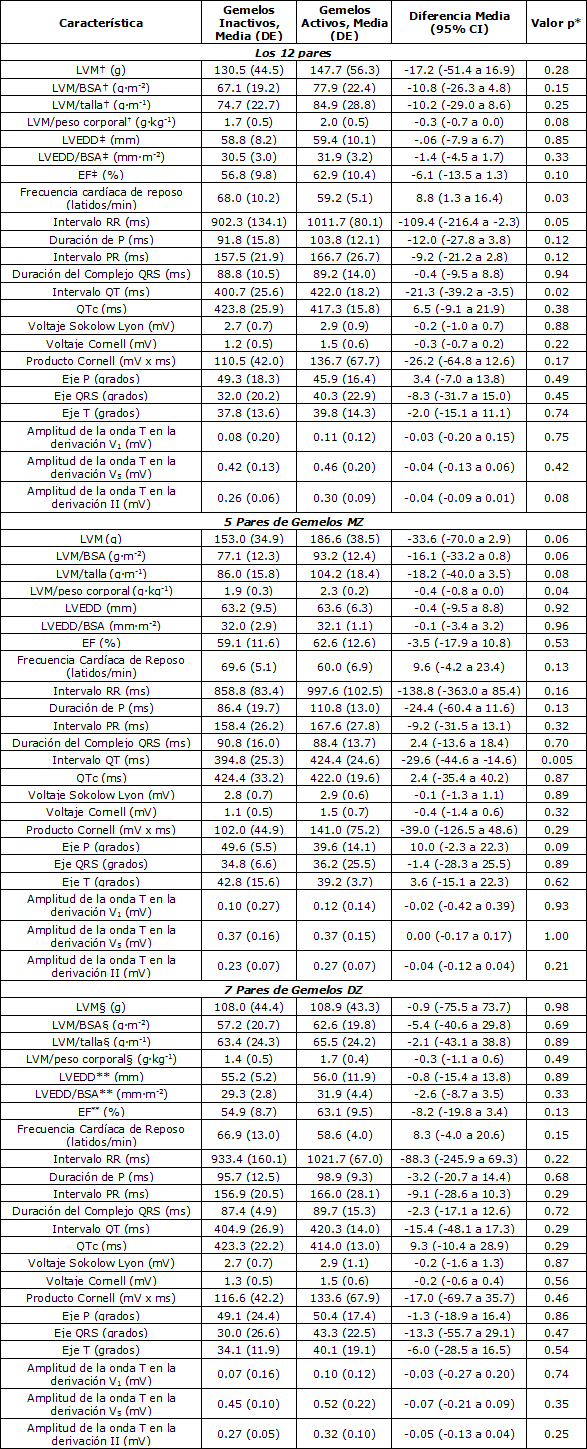
Tabla 2. Resultados de la evaluación de seguimiento para las variables ecocardiográficas y electrocardiográficas en los 12 pares de gemelos, cuyas diferencias intra-par en el tiempo de actividad física recreativa fue de 8.2 (4.0, DE) MET h·día-1. La diferencia entre los gemelos activos e inactivos se determinó en base al Test t de Student para muestras apareadas en aquellas variables continuas con distribución normal y en base al Test de Ranking con Signo de Wilcoxon para aquellas variables continuas sin distribución normal. † n = 10. ‡ n = 11. § n = 5. ** n = 6. LVM = masa del ventrículo izquierdo (ver los cálculos en la sección Métodos); BSA = área de superficie corporal (ver los cálculos en la sección Métodos); LVEDD = diámetro del ventrículo izquierdo al final de la diástole; EF = fracción de eyección.
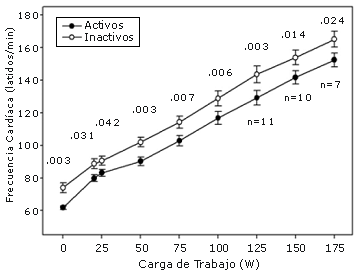
Figura 3. Frecuencia cardíaca (media ± EEM) antes y durante el test clínico de ejercicio limitado por síntomas en los gemelos activos e inactivos (n = 12).
Estas adaptaciones tienen la misma dirección que las reportadas en atletas altamente entrenados. La utilización de gemelos permitió el ajuste total (pares MZ) o parcial (pares DZ) de los factores genéticos. El ambiente durante la infancia en tanto en los gemelos MZ como en los gemelos DZ comúnmente es similar. Por lo tanto, los resultados de nuestro estudio sugieren que la actividad física tiene efectos beneficiosos sobre la estructura y la función cardíaca, aun cuando se controla parcial o totalmente la predisposición genéticas y el ambiente durante la infancia. Esto es para destacar debido a que la participación en un programa de ejercicio (Stubbe et al., 2006) así como también la estructura (Sharma et al., 2006) y la función cardíaca (Mtikainen et al., 2009) están genéticamente influenciadas.
Tanto los estudios longitudinales como los estudios de casos han reportado, casi sin excepción, una reducción de la frecuencia cardíaca como consecuencia del entrenamiento físico (Bjørnstad et al., 1991; Parker et al., 1978; Sharma et al., 1999; Stolt et al., 1997). Los factores que pueden contribuir a esta adaptación incluyen la reducción intrínseca de la frecuencia cardíaca, al incremento del tono parasimpático y a la reducción del tono simpático (Fagard, 2003). La reducción de la frecuencia cardíaca es un predictor independiente de la reducción de la mortalidad por causas cardiovasculares (Kannel et al., 1987; Shaper et al., 1993). En nuestro estudio, la frecuencia cardíaca de reposo (medida en posición supina) de los gemelos activos fue aproximadamente 10 latidos por minuto menor que la de los gemelos inactivos [59 (5, DE) vs 68 (10, DE) latidos/min, respectivamente]. Una diferencia similar e incluso mayor fue observada cuando la frecuencia cardíaca fue medida con los sujetos en posición de sentados antes del comienzo del test clínico de ejercicio. De acuerdo con un estudio previo (Sharper et al., 1993) la diferencia en la frecuencia cardíaca de reposo observada en nuestro estudio es clínicamente significativa. Sharper et al. (1993) reportaron que aquellos individuos con mayores frecuencias cardíacas de reposo (valores similares a los registrados en nuestro grupo de gemelos inactivos, i.e., 60-69 latidos/min) tienen un riesgo 40% mayor de mortalidad por enfermedad coronaria y un riesgo 60% mayor de muerte súbita por un evento cardíaco, que aquellos cuya frecuencia cardíaca de reposo es menor a 60 latidos/min (como en nuestro grupo de gemelos activos), incluso luego de controlar los factores de riego clásicos de enfermedad coronaria.
Una diferencia similar en la frecuencia cardíaca, entre los gemelos activos e inactivos, fue observada durante las etapas submáximas del test clínico de ejercicio. En cada etapa, comenzando con la etapa de aprendizaje, los valores de la frecuencia cardíaca fueron significativamente menores en los gemelos activos. Sin embargo, los valores de la frecuencia cardíaca pico fueron los mismos entre los pares de gemelos. Estas son adaptaciones al entrenamiento bien conocidas (Charlton and Crawford, 1997) pero nuestro estudio mostró que estas adaptaciones son parcialmente independientes de la predisposición genética. Al igual que la reducción en la frecuencia cardíaca de reposo la reducción de la frecuencia cardíaca submáxima es una adaptación beneficiosa debido a que, por ejemplo, reduce el estrés sobre el miocardio y por lo tanto el oxígeno necesario durante el ejercicio.
En el presente estudio se estimó el VO2pico a partir de la mayor carga alcanzada durante el test clínico de ejercicio y este fue mayor en los gemelos activos, mostrando que la discordancia en la actividad física también se vio reflejada en los niveles de aptitud cardiorrespiratoria de los gemelos. Muchos estudios han reportado que el consumo de oxígeno máximo o pico es un rasgo heredable (Bielen et al., 1990; Bouchard et al., 1998; Bouchard et al., 1986; Fagard et al., 1991; Fagard et al., 1987). Las estimaciones de la heredabilidad varían sobre un amplio rango; en los estudios de Bouchard et al., (1986), Bouchard et al., (1998) y Fagard et al., (1991) las estimaciones de la heredabilidad están en un rango aproximado del 10 al 80% dependiendo de los ajustes. Además, la respuesta del VO2máx al entrenamiento físico muestra una fuerte heredabilidad. Por ejemplo, en sujetos adultos sedentarios se observó un incremento del 50% en respuesta a un programa de entrenamiento de 20 semanas (Bouchard et al., 1999). A su vez, la aptitud cardiorrespiratoria puede influenciar las variables del ECG de reposo. Estas influencias han sido similares a las causadas por la actividad física o el entrenamiento deportivo. Por ejemplo, la frecuencia cardíaca de reposo es más baja y la amplitud de la onda T es mayor en los atletas con el mejor nivel de aptitud física que aquellos cuyo nivel de aptitud física es claramente bajo (Bjørnstad et al., 1993).
Como se esperaba, en base a la significativamente menor frecuencia cardíaca de reposo, las variables del ECG dependientes de la frecuencia cardíaca (intervalo QT) se vieron significativamente prolongadas en los gemelos activos. Cuando el intervalo QT fue corregido por la frecuencia cardíaca, fue más corto en los gemelos activos, pero la diferencia no fue ni estadística ni clínicamente significativa. En cambio, estudios previos de control de casos han reportado intervalos QT significativamente más prolongados en atletas que en controles sedentarios (Bjørnstad et al., 1991; Sharma et al., 1999; Stolt et al., 1997). Esto ha derivado en que exista cierta preocupación acerca de la significancia de la prolongación del intervalo QT inducida por el entrenamiento debido a que, al menos entre pacientes con enfermedades cardíacas, la prolongación del intervalo QT está asociada con muerte súbita y otros eventos adversos (Schwartz and Wolf, 1978). Sin embargo, son raras las prolongaciones extremas en el intervalo QT entre atletas u otras personas físicamente activas (Basavarajaiah et al., 2007) y estas pueden estar asociadas con síndromes congénitos o heredados de intervalos QT largos. En contraste a los estudios llevados a cabo con atletas altamente entrenados, los resultados del presente estudio sugieren que, si bien el intervalo QT no corregido fue significativamente más prolongado, el intervalo QT permanece inalterado como consecuencia de la actividad física recreacional de intensidad moderada.
En el presente estudio se realizó la corrección del intervalo QT por la frecuencia cardíaca utilizando la ecuación de Bazett, la cual puede no ser óptima para la corrección ya que estudios previos (Karjalainen et al., 1994) han reportado que la ecuación de Bezett sobre-ajusta el intervalo QT a altas frecuencias cardíacas y sub-ajusta el intervalo QT a bajas frecuencias cardíacas. Sin embargo, cuando realizamos la corrección del intervalo QT por la frecuencia cardíaca utilizando la ecuación QTc = intervalo QT + [(1000 – intervalo RR) / 7], en la cual los cambios en el intervalo RR no influencian el intervalo QT (Katsuoka et al., 1998), los resultados permanecieron similares; i.e., no se hallaron diferencias estadísticamente significativas entre los gemelos.
Algunos de los medicamentos utilizados en el tratamiento de enfermedades cardiovasculares pueden haber influenciado la frecuencia cardíaca. En nuestro estudio, entre los pares de gemelos MZ, un par fue discordante respecto del uso de betabloqueantes (el gemelo inactivo utilizaba un bloqueante selectivo beta1). Cuando se analizaron todas las variables de la frecuencia cardíaca y las variables del ECG dependientes de la frecuencia cardíaca sin este par de gemelos, los resultados (diferencias medias) permanecieron similares.
Se observó una tendencia hacia una incrementada LVM por unidad de peso corporal en los gemelos activos. Cuando los pares de gemelos MZ fueron estudiados separadamente, la diferencia entre los gemelos activos e inactivos fue estadísticamente significativa. El incremento de la LVM es una de las adaptaciones más frecuentemente documentadas en atletas, lo cual resulta en una mayor cavidad del LV y/o en un engrosamiento de la pared del LV (Plium et al., 2000). Sin embargo, la LVM es un rasgo altamente heredable; en una gran cohorte de gemelos, cerca del 60% de las diferencias individuales en la LVM fueron explicadas por factores genéticos (Sharma et al., 2006). Esto puede, al menos en cierta medida, ser una casusa de sesgo en los estudios de control de casos, i.e., las personas con un corazón congénitamente grande pueden tener una mayor propensión a participar en actividades vigorosas debido a que para ellos el ejercicio les resulta más fácil que para las personas con un corazón más pequeño. Similares problemas pueden surgir en otros tipos de estudios poblacionales (tales como los estudios de intervención) ya que los factores genéticos pueden también modificar la respuesta del miocardio al entrenamiento físico. Por ejemplo, se ha reportado que tanto el gen del angiotensinógeno M235T (Karjalainen et al., 1999) y los polimorfismos I/D del gen de la enzima convertidora de angiostesina (Kasikcioglu et al., 2004; Montgomery et al., 1997; Tanriverdi et al., 2005) están asociados con la variabilidad de la LVM inducida por el entrenamiento físico. Los mayores valores de LVM fueron hallados en aquellos pares homocigóticos ya sea para el alelo T o el alelo D, respectivamente. En nuestro estudio, los problemas previamente mencionados fueron superados comparando pares de gemelos MZ, quienes son idénticos a nivel de la secuencia de cromosomas (con la rara excepción de mutaciones somáticas); aunque pueden existir diferencias epigenéticas entre gemelos MZ (Fraga et al., 2005). Pero a pesar de esto, la LVM por unidad de peso corporal fue mayor en los gemelos MZ activos, sugiriendo que la actividad física puede tener efectos independientes sobre la LVM. Si bien nosotros no medimos la función diastólica para determinar la presencia de anormalidades diastólicas, es probable que el incremento de la LVM fuera fisiológico, ya que ninguno de los gemelos MZ activos presentó una hipertensión significativa, desórdenes valvulares u otras condiciones que derivaran en un incremento patológico en la LVM.
Estudios previos también han reportado otras adaptaciones a la actividad física, tal como el incremento del LVEDD (Pluim et al., 2000), la prolongación del intervalo R (Sharma et al., 1999) y un eje QRS más vertical (Bjørnstad et al., 1991; Parker et al., 1978), pero estos resultados no fueron observados en el presente estudio. Existen numerosas razones para esta discrepancia. Primero, la actividad física de intensidad moderada puede no ser suficiente para inducir adaptaciones de este tipo en el corazón. Segundo, estas “adaptaciones” pueden no revelarse cuando se tienen en cuenta los factores genéticos y los factores ambientales durante la infancia. Sin embargo, esto no significa que el entrenamiento físico no contribuya a las diferencias observadas en estudios previos llevados a cabo con atletas, ya que la intensidad del entrenamiento de los atletas es significativamente mayor que la utilizada frecuentemente por nuestros gemelos y además probablemente existan diferencias en los niveles de entrenamiento que los atletas realizaron durante la niñez y la adolescencia. Tercero, la pequeña muestra del presente estudio pudo haber derivado en una falta de potencia estadística para detectar diferencias entre los gemelos activos y los gemelos inactivos. El pequeño tamaño de la muestra se debió al estricto criterio utilizado para determinar la discordancia de actividad física y las subsiguientes dificultades para hallar pares de gemelos que cumplieran con este criterio. El número de pares también fue muy pequeño para separar los análisis entre hombres y mujeres, aunque se sabe que la adaptación del corazón al entrenamiento físico es específica del sexo (Spirito et al., 1994). Además, no se efectuaron mediciones iniciales de la estructura y la función cardíaca; sin embargo, los sujetos con enfermedades cardíacas o pulmonares declaradas, o con síntomas relacionados, fueron excluidos.
El estudio de control con gemelos probablemente representa el mejor diseño de estudio controlado a largo plazo en humanos ya que permite el ajuste de los factores genéticos y familiares debido a total o casi total igualdad en los genes, edad, sexo y ambiente intrauterino e infantil. El período de seguimiento fue lo suficientemente largo (32 años), cubriendo la mayor parte de la vida adulta de los participantes y excediendo la longitud de la historia de entrenamiento de muchos estudios llevados a cabo con atletas. Además, la cantidad y/o intensidad de la actividad física a la cual se observan adaptaciones positivas es totalmente alcanzable por individuos normales y saludables en comparación con los niveles de entrenamiento reportados en los estudios llevados a cabo con atletas.
CONCLUSIONES
Las principales adaptaciones a la actividad física recreativa a largo plazo son la reducción de la frecuencia cardíaca de reposo y de la frecuencia cardíaca submáxima, incluso luego de controlar total o parcialmente la predisposición genética y el ambiente infantil. También se observó una tendencia hacia una incrementada LVM por unidad de peso corporal y hacia una sostenida amplitud de la onda T. Estas adaptaciones están en la misma dirección que las reportadas previamente en atletas, sugiriendo que la actividad física, aun de menor intensidad, tiene efectos beneficiosos sobre la estructura y la función cardíaca. La disminución de la frecuencia cardíaca de reposo es una adaptación clínicamente significativa ya que está asociada con la reducción de la mortalidad por causas cardiovasculares, y por lo tanto la prevención de desórdenes cardiovasculares debería incluir la participación en programas de actividad física.
Puntos Clave
- La principal adaptación a la actividad física a largo plazo es la reducción de la frecuencia cardíaca de reposo, incluso luego de controlar la predisposición genética.
- El VO2pico fue mayor en los gemelos activos que en los gemelos inactivos y concordantemente, la frecuencia cardíaca submáxima durante el test clínico de ejercicio fue menor en los gemelos físicamente activos.
- Se observó una tendencia hacia una incrementada LVM por unidad de peso corporal y hacia una sostenida amplitud de la onda T en los gemelos activos.
Agradecimientos
Este estudio fue respaldado por la Academia de Finlandia, el Ministerio de Educación de Finlandia y la Fundación Juho Vainio (TWINACTIVE Study); por el Centro de Excelencia en Enfermedades Genéticas Complejas de la Academia de Finlandia (Finnish Twin Cohort Study); por la Universidad de Jyväskylä, la Fundación Juho Vainio y la Fundación Cultural Finlandesa (Sara Mutikainen).
Dirección para el envío de correspondencia
Sara Mutikainen. Department of Health Sciences, PO Box 35 (Viveca), FIN-40014 University of Jyväskylä, Finland (sara.mutikainen@gmail.com).
Referencias
1. Adams, T.D., Yanowitz, F.G., Fisher, A.G., Ridges, J.D., Lovell, K. and Pryor, T.A (1981). Noninvasive evaluation of exercise training in college-age men. Circulation 64, 958-965
2. Basavarajaiah, S., Wilson, M., Whyte, G., Shah, A., Behr, E. and Sharma, S (2007). Prevalence and significance of an isolated long QT interval in elite athletes. European Heart Journal 28, 2944-2949
3. Batty, G.D (2002). Physical activity and coronary heart disease in older adults. A systematic review of epidemiological studies. European Journal of Public Health 12, 171-176
4. Bazett, H.C (1920). An analysis of time relations of electrocardiogram. Heart 7, 353-370
5. Bielen, E., Fagard, R. and Amery, A (1990). Inheritance of heart structure and physical exercise capacity: A study of left ventricular structure and exercise capacity in 7-year-old twins. European Heart Journal 11, 7-16
6. Casale, P.N., Devereux, R.B., Kligfield, P., Eisenberg, R.R., Miller, D.H., Chaudhary, B.S. and Phillips, M.C (1985). Electrocardiographic detection of left ventricular hypertrophy: Development and prospective validation of improved criteria. Journal of the American College of Cardiology 6, 572-580
7. Charlton, G.A. and Crawford, M.H (1997). Physiologic consequences of training. Cardiology Clinics 115, 345-354
8. Devereux, R.B., Alonso, D.R., Lutas, E.M., Gottlieb, G.J., Campo, E., Sachs, I. and Reichek, N (1986). Echocardiographic assessment of left ventricular hypertrophy: Comparison to necropsy findings. American Journal of Cardiology 57, 450-458
9. Dyer, A.R., Persky, V., Stamler, J., Paul, O., Shekelle, R.B., Berkson, D.M., Lepper, M., Schoenberger, J.A. and Lindberg, H.A (1980). Heart rate as a prognostic factor for coronary heart disease and mortality: Findings in three Chicago epidemiologic studies. American Journal of Epidemiology 112, 736-749
10. Ehsani, A.A., Hagberg, J.M. and Hickson, R.C (1978). Rapid changes in left ventricular dimensions and mass in response to physical conditioning and deconditioning. American Journal of Cardiology 42, 52-56
11. Fagard, R (2003). Athletes heart. Heart 89, 1455-1461
12. Fagard, R., Bielen, E. and Amery A (1991). Heritability of aerobic power and anaerobic energy generation during exercise. Journal of Applied Physiology 70, 357-362
13. Fagard, R., van den Broeke, C., Bielen, E. and Amery, A (1987). Maximum oxygen uptake and cardiac size and function in twins. American Journal of Cardiology 60, 1362-1367
14. Fraga, M.F., Ballestar, E., Paz, M.F., Ropero, S., Setien, F., Ballestar, M.L., Heine-Suner, D., Cigudosa, J.C., Urioste, M., Benitez, J., Boix-Chornet, M., Sanchez-Aguilera, A., Ling, C., Carlsson, E (2005). Poulsen, P., Vaag, A., Stephan, Z., Spector, T.D., Wu, Y.Z., Plass, C. and Esteller, M. Epigenetic differences arise during the lifetime of monozygotic twins. PNAS 102, 10604-10609
15. Kannel, W.B., Kannel, C., Paffenbarger, R.S. Jr. and Cupples, L.A (1987). Heart rate and cardiovascular mortality: The Framingham study. American Heart Journal 113, 1489-1494
16. Kaprio, J. and Koskenvuo, M (2002). Genetic and environmental factors in complex diseases: The older Finnish twin cohort. Twin Research 5, 358-365
17. Kasikcioglu, E., Kayserilioglu, A., Ciloglu, F., Akhan, H., Oflaz, H., Yildiz, S. and Peker, I (2004). Angiotensin-converting enzyme gene polymorphism, left ventricular remodeling, and exercise capacity in strength-trained athletes. Heart Vessels 19, 287-293
18. Katsuoka, H., Mimori, Y., Kurokawa, K., Harada, T., Kohriyama, T., Ishizaki, F., Harada, A. and Nakamura, S (1998). QTc interval, and autonomic and somatic nerve function in diabetic neuropathy. Clinical Autonomic Research 8, 139-143
19. Kujala, U.M., Kaprio, J., Sarna, S. and Koskenvuo, M (1998). Relationship of leisure-time physical activity and mortality: The Finnish twin cohort. Journal of the American Medical Association 279, 440-444
20. Molloy, T.J., Okin, P.M., Devereux, R.B. and Kligfield, P (1992). Electrocardiographic detection of left ventricular hypertrophy by the simple QRS voltage-duration product.. Journal of the American College of Cardiology 20, 1180-1186
21. Montgomery, H.E., Clarkson, P., Dollery, C.M., Prasad, K., Losi, M.A., Hemingway, H., Statters, D., Jubb, M., Girvain, M., Varnava, A., World, M., Deanfield, J., Talmud, P (1997). McEwan, J.R., McKenna, W.J. and Humphries, S. Association of angiotensin-converting enzyme gene I/D polymorphism with change in left ventricular mass in response to physical training. Circulation 96, 741-747
22. Morrison, D.A., Boyden, T.W., Pamenter, R.W., Freund, B.J., Stini, W.A., Harrington, R. and Wilmore, J.H (1986). Effects of aerobic training on exercise tolerance and echocardiographic dimensions in untrained postmenopausal women. American Heart Journal 112, 561-567
23. Mosteller, R.D (1987). Simplified calculation of body surface area. New England Journal of Medicine 317, 1098
24. Parker, B.M., Londeree, B.R., Cupp, G.V. and Dubiel, J.P (1978). The noninvasive cardiac evaluation of long-distance runners. Chest 73, 376-381
25. Pelliccia, A., Di Paolo, F.M., Quattrini, F.M., Basso, C., Culasso, F., Popoli, G., De Luca, R., Spataro, A., Biffi, A., Thiene, G. and Maron, B.J (2008). Outcomes in athletes with marked ECG repolarization abnormalities. New England Journal of Medicine 358, 152-161
26. Pelliccia, A., Maron, B.J., De Luca, R., Di Paolo, F.M., Spataro, A. and Culasso, F (2002). Remodeling of left ventricular hypertrophy in elite athletes after long-term deconditioning. Circulation 105, 944-949
27. Pluim, B.M., Zwinderman, A.H., van der Laarse, A. and van der Wall, E.E (2000). The athletes heart: A meta-analysis of cardiac structure and function. Circulation 101, 336-344
28. Ristola, P (1983). Resting ECG measurements and risk of cardiovascular death in Finland. Publications of the Social Insurance Institution, Finland, AL:22. Helsinki. In Finnish (English summary)
29. Rose, G., Baxter, P.J., Reid, D.D. and McCartney, P (1978). Prevalence and prognosis of electrocardiographic findings in middle-aged men. British Heart Journal 40, 636-643
30. Schuit, A.J., Dekker, J.M., de Vegt, F., Verheij, T.C., Rijneke, R.D. and Schouten, E.G (1998). Effect of physical training on QTc interval in elderly people. Journal of Electrocardiology 31, 111-116
31. Schwartz, P.J. and Wolf, S (1978). QT interval prolongation as predictor of sudden death in patients with myocardial infarction. Circulation 57, 1074-1077
32. Shaper, A.G., Wannamethee, G., Macfarlane, P.W. and Walker, M (1993). Heart rate, ischaemic heart disease, and sudden cardiac death in middle-aged British men. British Heart Journal 70, 49-55
33. Sharma, P., Middelberg, R.P.S., Andrew, T., Johnson, M.R., Christley, H. and Brown, M.J (2006). Heritability of left ventricular mass in a large cohort of twins. Journal of Hypertension 24, 321-324
34. Sharma, S., Whyte, G., Elliott, P., Padula, M., Kaushal, R., Mahon, N. and McKenna, W.J (1999). Electrocardiographic changes in 1000 highly trained junior elite athletes. British Journal of Sports Medicine 33, 319-324
35. Sokolow, M. and Lyon, T.P (1949). The ventricular complex in left ventricular hypertrophy as obtained by unipolar precordial and limb leads. American Heart Journal 37, 161-186
36. Spirito, P., Pelliccia, A., Proschan, M.A., Granata, M., Spataro, A., Bellone, P., Caselli, G., Biffi, A., Vecchio, C. and Maron, B.J (1994). Morphology of the athletes heart assessed by echocardiography in 947 elite athletes representing 27 sports. American Journal of Cardiology 74, 802-806
37. Stolt, A., Kujala, U.M., Karjalainen, J. and Viitasalo, M (1997). Electrocardiographic findings in female endurance athletes. Clinical Journal of Sport Medicine 7, 85-89
38. Stubbe, J.H., Boomsma, D.I., Vink, J.M., Cornes, B.K., Martin, N.G., Skytthe, A., Kyvik, K.O., Rose, R.J., Kujala, U.M., Kaprio, J., Harris, J.R (2006). Pedersen, N.L., Hunkin, J., Spector, T.D. and de Geus, E.J.C. Genetic influences on exercise participation in 37.051 twin pairs from seven countries. PLoS ONE 1, e22
39. Tanriverdi, H., Kaftan, H.A., Evrengul, H., Dursunoglu, D., Turgut, G. and Kilic, M (2005). QT dispersion and left ventricular hypertrophy in athletes: Relationship with angiotensin-converting enzyme I/D polymorphism. Acta Cardiologica 60, 387-393
40. Vakili, B.A., Okin, P.M. and Devereux, R.B (2001). Prognostic implications of left ventricular hypertrophy. American Heart Journal 141, 334-341
41. Waller, K., Kaprio, J. and Kujala, U.M (2008). Associations between long-term physical activity, waist circumference and weight gain: A 30-year longitudinal twin study. International Journal of Obesity 32, 353-361
42. Whelton, S.P., Chin, A., Xin, X. and He, J (2002). Effect of aerobic exercise on blood pressure: A meta-analysis of randomized, controlled trials. Annals of Internal Medicine 136, 493-503