Efectos Independientes y Combinados de los Aminoácidos y la Glucosa después de los Ejercicios de Fuerza
Kevin Tipton2, R. R Wolfe2, Sharon L Miller1, David L Chinkes2 y Steven E Wolf2
Artículo publicado en el journal PubliCE del año 2003.
Publicado 18 de agosto de 2011
INTRODUCCION
El ejercicio de fuerza estimula la síntesis de proteínas musculares, tanto en sentido absoluto como en relación a la tasa de degradación de proteínas musculares (3,11). Sin embargo, en ausencia de ingesta nutricional, el equilibrio entre la síntesis y la degradación (es decir, la síntesis neta de proteínas musculares) permanece negativo después del ejercicio de fuerza (3, 4). Por consiguiente, el aumento en el tamaño muscular (anabolismo) que se produce por el entrenamiento de la fuerza debe reflejar una interacción entre el ejercicio y la ingesta nutricional. Aunque se sabe que la administración de aminoácidos exógenos solos (4, 16) o de aminoácidos más glucosa (12) puede estimular la síntesis de proteínas musculares después del ejercicio, no se conoce todavía cual es la composición óptima que debe tener un suplemento nutricional para promover esta respuesta.
Dado que se sabe que los aminoácidos estimulan la síntesis de proteínas musculares (13), es posible predecir que el consumo de aminoácidos o proteínas puede ser un componente esencial de un suplemento diseñado para promover el anabolismo. Sin embargo, la importancia de la ingesta de energía junto con aminoácidos / proteínas está menos clara. Por otra parte, hay poca evidencia que apoye la importancia de la grasa como fuente de energía para promover la utilización eficaz de los aminoácidos ingeridos. Además hay razones para esperar un efecto de interacción entre la ingesta de los aminoácidos y de carbohidratos que se produce por la respuesta insulínica provocada por los carbohidratos (20).
La insulina es una hormona anabólica importante, pero su mecanismo de acción en el músculo es discutido (5, 7). La evaluación del efecto de la insulina en el músculo es difícil por el hecho que la infusión sistémica de insulina provoca una pronunciada hipoaminoacidemia. Esta disminución en los niveles de aminoácidos tiende a neutralizar cualquier acción directa de la insulina para estimular la síntesis de proteínas musculares in vivo (20). La infusión de insulina directamente en la arteria femoral para provocar hiperinsulinemia local en ausencia de cualquier cambio en las concentraciones de aminoácidos estimuló la síntesis de proteínas musculares en reposo (2). Sin embargo, luego de los ejercicios de fuerza la hiperinsulinemia local no produjo ningún aumento adicional en la síntesis de proteínas musculares, aunque se observo una atenuación en el aumento post-ejercicio de la tasa de degradación de proteínas (5). Es posible que la imposibilidad de la insulina sola para estimular adicionalmente la síntesis después del ejercicio, se deba a un suministro relativamente insuficiente de aminoácidos. Si esto es verdad, entonces el aporte de aminoácidos exógenos después del ejercicio debe permitir la expresión del efecto estimulante de la insulina. Esta respuesta sería manifestada como un efecto de interacción entre la insulina y los aminoácidos, de modo que los efectos combinados de la hiperinsulinemia y de los aminoácidos ingeridos serían mayores que la suma de sus efectos independientes. Por lo tanto, una de las metas principales de este proyecto fue evaluar los efectos individuales y de interacción de la ingesta de aminoácidos y/o carbohidratos (para estimular la liberación de insulina) sobre la síntesis de proteínas musculares después del ejercicio.
Un segundo aspecto de este estudio fue diseñado para evaluar la evolución en el tiempo de la respuesta de producción de proteínas musculares frente a un suplemento oral después del ejercicio. Nosotros hemos demostrado previamente que la ingesa de aminoácidos esenciales (EAA) más carbohidratos luego del ejercicio, aumenta significativamente el anabolismo de las proteínas musculares a través del aumento en la síntesis de proteínas musculares sin alterar la degradación de las mismas (12).
Aunque el aumento en la síntesis neta de proteínas musculares fue estadísticamente significativo, este aumento fue relativamente efímero y persistió sólo durante 1 h luego del consumo de la bebida. Una segunda bebida podría ampliar potencialmente tanto la duración como la magnitud de la respuesta dada la respuesta relativamente efímera a una sola bebida. Alternativamente, es posible que un segundo bolus pueda provocar una respuesta menor. Consideramos este resultado porque recientemente observamos durante una infusión intravenosa de aminoácidos de 6 h, que la síntesis de proteínas sólo fue estimulada durante las primeras 2 h y a las 6 h, la tasa de síntesis había regresado al nivel basal a pesar de los aumentos persistentes en las concentraciones de aminoácidos (6). Además, en nuestro estudio previo en el cual se administró un bolus de aminoácidos y glucosa (12) la concentración arterial de aminoácidos y de insulina seguían siendo significativamente mayores en el momento donde la tasa neta de síntesis de proteínas musculares había regresado a su valor basal. Por consiguiente, un segundo objetivo de este estudio fue determinar si la respuesta a un segundo bolus de aminoácidos y/o carbohidratos era afectada por la ingesta previa de la misma dosis 1 hora antes.
MÉTODOS
Diez voluntarios (seis varones y cuatro mujeres) participaron en el estudio que fue aceptado por el Comité de Revisión Institucional de la Repartición Médica de la Universidad de Texas (UTMB). Todos los sujetos proporcionaron su consentimiento informado por escrito y fueron sometidos a un análisis de salud previo, para asegurar que estaban sanos y no padecían enfermedades metabólicas. En ese momento, los sujetos también realizaron una prueba de evaluación de fuerza para determinar su repetición máxima (1 RM) de ejercicios en press de piernas y de extensión de rodilla. El volumen de las piernas fue estimado a partir de de las mediciones antropométricas del perímetro y talla de las piernas en varios puntos situados hacia abajo a lo largo de las piernas (10).
Se solicitó a los participantes que no realizaran ejercicio, que evitaran el alcohol y que mantuvieran su dieta normal en el día previo al estudio. Los voluntarios arribaron al Centro de Investigación Clínica General (GCRC) en UTMB en condiciones de ayuno de toda la noche. La mañana siguiente, se colocaron los catéteres en venas periféricas para la infusión continua con cebamiento de un isótopo estable como marcador. Los catéteres fueron colocados en arteria y vena femoral para extraer muestras de sangre arterial y venosa y para la infusión del colorante verde indocianina (ICG) en las arterias con el fin de evaluar el flujo sanguíneo de la pierna (9). Los catéteres femorales fueron insertados usando lidocaina y la apertura de los catéteres fue mantenida mediante la infusión de solución fisiológica.
El protocolo de infusión general se muestra esquemáticamente en la Figura 1. Después de obtener la muestra de sangre para la medición del enriquecimiento de aminoácidos y de la concentración de ICG, de fondo se comenzó con la infusión continua con cebamiento de fenilalanina L-[2H5] [velocidad de infusión = 0,10 µmol·kg-1min-1, dosis de carga (dosis de cebamiento) = 2 µmol·kg-1min-1) y 15N-urea (velocidad de infusión = 0,227 µmol·kg-1min-1, dosis de carga (dosis de cebamiento) =113 µmol·kg-1min-1]. Luego los participantes descansaron cómodamente en una cama durante aproximadamente 1 h, y a continuación se prepararon para realizar la rutina de ejercicios de fuerza. El ejercicio fue realizado en aproximadamente 40 min y consistió en ejercicios en press de pierna (10 series de 10 repeticiones) y extensiones de rodilla (8 series de 8 repeticiones), ambos a 75% de 1 RM del sujeto. Cada serie se completó en aproximadamente 30 s con un descanso de 2 min entre las series. Luego de realizar los ejercicios, los sujetos regresaron a la cama y se obtuvieron las primeras muestras 30 min luego de la finalización de la última serie de ejercicios. Una hora después del ejercicio, los sujetos ingirieron una bebida que contenía solo carbohidratos (CHO), solo aminoácidos (AA) o carbohidratos y aminoácidos juntos (MIX). La cantidad de carbohidratos (glucosa) y de aminoácidos que fueron ingeridos fue ajustada según el peso corporal, en una relación de 35 g de carbohidratos y 6 g de aminoácidos en un sujeto de 70 kg. Los detalles de las bebidas, entre las que se incluía la mezcla de aminoácidos se observan en la Tabla 1. La mezcla de aminoácidos tenía aproximadamente 50% de aminoácidos esenciales (EAA) (2,8 g en un total de 6 g). Cinco sujetos del estudio (tres varones y dos mujeres) completaron las tres pruebas, un sujeto finalizo dos pruebas y cuatro sujetos participaron en una prueba cada uno. Se realizo un número equivalente de pruebas, para cada tratamiento; n=7.
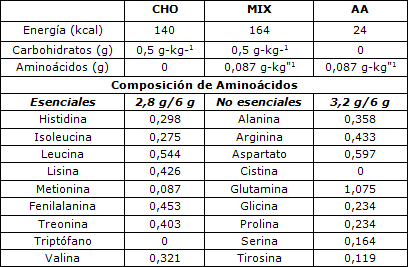
Tabla 1. Composición de los suplementos.
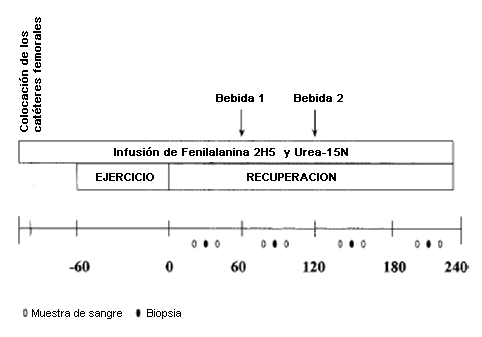
Figura 1. Esquema del protocolo del estudio.
Aproximadamente 10 min antes de cada período de muestreo, comenzó la infusión continua con cebamiento de ICG en la arteria femoral y se mantuvo a lo largo del período de prueba. Se tomaron muestras de sangre venosa femoral y periférica para la medición del flujo sanguíneo y luego se efectuó el muestreo de sangre arterial y venosa femoral. La infusión del colorante fue interrumpida brevemente para permitir la obtención de la muestra de la arteria femoral y luego fue reiniciada rápidamente. Las muestras de sangre fueron tomadas 30-min post-ejercicio, en intervalos de 10 min luego del consumo de cada bebida 1h y 2h post-ejercicio y en cuatro puntos de tiempo durante la tercer y última hora del período de recuperación. Las muestras de sangre se utilizaron para la determinación de las diferencias de sustratos entre arteria y vena en el músculo de las piernas y para la medición del enriquecimiento de urea y fenilalanina (Phe). Los enriquecimientos y la concentración de Phe fueron determinados mediante cromatografía de gases-espectrometría de masa, tal como se describió previamente (19). Las concentraciones de glucosa fueron determinados enzimáticamente utilizando un auto analizador (YSI 2300 STAT, Yellow Springs, OH).
Se extrajeron biopsias musculares para cuantificar la concentración intracelular de Phe. La primera biopsia muscular se tomó 30-min después del ejercicio, a partir de la porción lateral del músculo vastus lateralis derecho, aproximadamente 20 centímetros por encima de la rodilla, usando una aguja de biopsia de 5-mm (Stille, Estocolmo, Suecia) (1). En cada biopsia se extrajeron aproximadamente 30-50 mg de tejido muscular. Este procedimiento provee una muestra de músculo esquelético mixto (1). La sangre, la grasa y el tejido conjuntivo visible fueron removidos de la muestra y el tejido restante fue inmediatamente congelado en el nitrógeno líquido y conservado a -80°C para ser analizados posteriormente. Las biopsias fueron realizadas 30 min después del ejercicio, ~30 min después del consumo de la primera y de la segunda bebida y cerca del fin de la tercer hora de recuperación.
La captación neta de Phe en el músculo fue calculada por el producto entre del flujo sanguíneo (mililitros por minuto por 100 mL de volumen de pierna) y la diferencia en las concentraciones arteriales y venosas. Las tasas de aparición y desaparición de Phe en sangre, fueron calculadas utilizando un modelo basado solamente en las mediciones sanguíneas. La tasa de desaparición (Rd) de Phe en el músculo fue calculada mediante la siguiente fórmula:
Rd = [EA o CA - EV o CV] o BF/EA
Donde EA y EV son los enriquecimientos de Phe en arteria y vena, respectivamente, CA y CV son las concentraciones de Phe arteriales y venosas, respectivamente, y BF es la velocidad del flujo sanguíneo a lo largo de la pierna. La tasa de aparición (Ra) de Phe en el músculo fue calculada posteriormente mediante la siguiente fórmula:
Ra = Rd - (CA - CV).BF
Donde Ra representa los aminoácidos liberados a partir de la degradación de proteínas musculares que aparecen en el plasma, y Rd representa la pérdida irreversible de aminoácidos en el plasma. Dado que la Phe no puede ser metabolizada dentro del músculo, Rd representa la síntesis de proteína muscular a partir de Phe unida al plasma.
El área debajo de la curva (AUC) de captación de Phe durante el período de recuperación de 3 horas se determinó utilizando el método del trapecio.
La producción de urea fue calculada por las tasas de enriquecimiento e infusión del marcador tal como se describió en (21).
Análisis Estadísticos
Para todos los resultados obtenidos se calcularon los valores promedio y los resultados fueron expresados en forma de Media ± EEM (error estándar de la media). Las diferencias entre los grupos de tratamientos fueron determinadas mediante un ANOVA de dos vías donde un factor era el sujeto y el otro factor era el grupo. Si se observaban diferencias significativas (p<0,05), se realizaba el test post hoc de Tukey para determinar cuales tratamientos presentaban las diferencias significativas.
RESULTADOS
Glucosa
La concentración de glucosa en el plasma se incrementó significativamente en respuesta al consumo de las bebidas que contenían carbohidratos, CHO y MIX (P <0,05) (Figura 2). La captación de glucosa también fue significativamente más alta en estos tratamientos que durante la recuperación suplementada con aminoácidos (P <0,01)
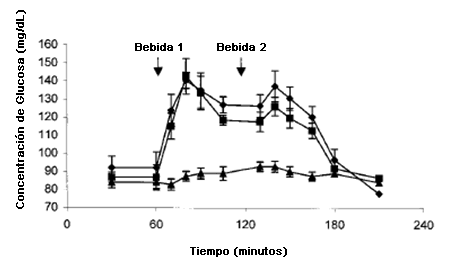
Figura 2. Concentración arterial de glucosa. 0 representa el final del ejercicio. La bebida 1 se administró 60 min post ejercicio. La bebida 2 se administró 120 min después del ejercicio. ◊ = Solo carbohidratos (CHO); ▲= Solo aminoácidos (AA); ■ = Carbohidratos más aminoácidos (MIX).
Insulina
Los niveles plasmáticos de insulina siguieron el aumento de glucosa y presentaron un máximo ~20 min luego del consumo de CHO o MIX (Figura 3).El área debajo de la curva (AUC) de la insulina AUC fue significativamente mayor en respuesta al consumo de MIX (P <0,001), y además el consumo de la bebida con CHO aumentó el AUC de la insulina más de lo que lo hizo la bebida que contenía solo AA (P <0,001). Sin embargo, AA mostró una tendencia a aumentar las concentraciones de insulina por encima de la línea de base y de las concentraciones post-ejercicio (P = 0,08). Al final de la tercer hora de recuperación, las concentraciones de insulina regresaron a los niveles post-ejercicio en los tres tratamientos.
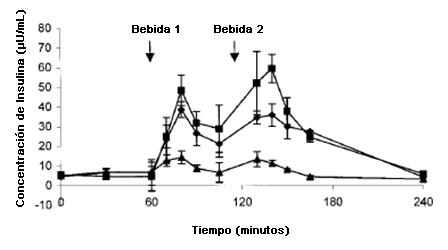
Figura 3. Concentración de insulina en el Plasma. ◊ = Solo carbohidratos (CHO); ▲= Solo aminoácidos (AA); ■ = Carbohidratos mas aminoácidos (MIX)
Concentración y consumo de Phe
Las concentraciones arteriales de Phe aumentaron significativamente en los 10 min posteriores al consumo de AA (P <0,05) o MIX (P <0,05) pero permanecieron relativamente constantes en respuesta al consumo de CHO (Figura 4). Los valores en los tratamientos con las bebidas de aminoácidos comenzaron a disminuir antes del consumo de la segunda bebida, pero todavía se encontraban significativamente por encima de los valores de la línea de base (MIX, P <0,05; AA, P <0,001). La respuesta a la segunda bebida fue comparable con la de la primera bebida que contenía aminoácidos.
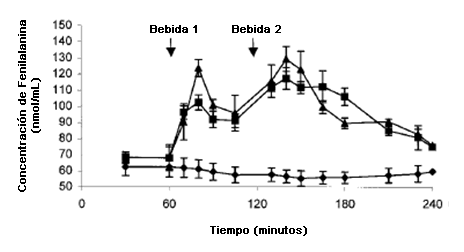
Figura 4. Concentración arterial de fenilalanina. ◊ = Solo carbohidratos (CHO); ▲= Solo aminoácidos (AA); ■ = Carbohidratos mas aminoácidos (MIX).
Flujo de Sangre
El flujo de sangre tomó el valor más alto a los 30 min post-ejercicio en todos los grupos, tomando valores medios de 6,69 ± 0,6; 6,63 ± 1,2 y 5,32 ± 0,5 mL·min-1·100mL-1·pierna-1 en los grupos CHO, AA y MIX, respectivamente. Los valores disminuyeron a 5,13 ± 0,9; 4,70 ± 0,6 y 4,64 ± 0,6 en los mismos grupos 3 horas después del ejercicio. No se observaron diferencias significativas entre los grupos y las disminuciones con el tiempo, si bien fueron consistentes, igualmente no fueron significativamente diferentes.
La captación neta de Phe en el músculo siguió el mismo patrón general temporal a medida que la concentración de sangre variaba en los tres tratamientos. Sin embargo, tanto en el grupo AA como en el grupo MIX, la captación neta de Phe había regresado al valor previo a la bebida en 1 h, a pesar de que la concentración de Phe en sangre todavía era elevada. De manera similar, la captación neta aumentada después de la segunda bebida de AA o MIX regresó al valor de la línea de base 120 min después del ejercicio, a pesar del aumento persistente en las concentraciones del aminoácido. El área debajo de la curva (AUC) durante las 3 horas, fue significativamente mayor para MIX que para CHO (P <0,05) pero no se observaron diferencias significativas entre AA y CHO o entre AA y MIX. Los valores individuales para CHO, MIX y AA fueron 53,0 ± 6,0; 114,4 ± 38,3 y 71,1 ± 13,3 (mg·pierna-1·3h-1) (Figura 5), respectivamente. Los tres grupos presentaron un aumento significativo por encima del valor basal (punto de medición a los 30-min). Reportes previos sobre de cinética de Phe durante recuperación sin suplementación realizados con este protocolo de ejercicio, indicaron que los valores a lo largo de este período de tiempo no cambiaron (12). Las estimaciones del AUC durante cada hora del período de recuperación, indican una respuesta significativamente mayor en la primera y segunda hora para los grupos MIX y AA en comparación con CHO (Figura 6). La respuesta durante la tercer hora no fue significativamente diferente entre los grupos, aunque el valor para el grupo CHO fue el más alto y para el grupo de AA fue el menor.
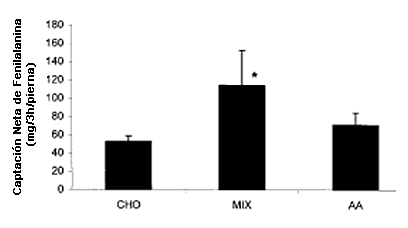
Figura 5. Área debajo de la curva para la captación neta de fenilalanina a lo largo de 3 h después del consumo de la primera bebida. * Significativamente mayor que CHO, P <0,05.
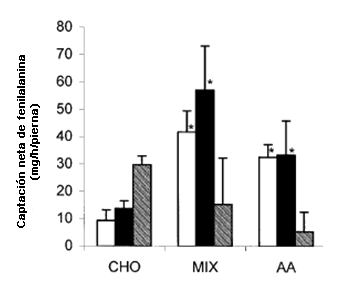
Figura 6. Área debajo de la curva para la captación neta de fenilalanina, expresada en función de las horas después del consumo de la primera bebida. * Presenta diferencias significativas con el grupo CHO, P <0,05. Barra Blanca = 1 h; Barra Negra= 2 h; Barra Gris = 3 h.
Los cambios en la concentración intramuscular de Phe entre los tratamientos no podrían explicar las diferencias en Rd. Aunque la concentración intramuscular de Phe disminuyó en el grupo de CHO, el valor se mantuvo contante durante los últimos 90 min del estudio, por lo que los cambios en el tamaño del reservorio o pool no explicarían la respuesta de Rd durante ese tiempo. No se observaron cambios significativos en las concentraciones intramusculares de Phe en los dos grupos que recibieron los aminoácidos exógenos.
Cuando los valores de Ra de cada una de las 3 primeras horas después del consumo de la primera bebida, se expresaron en forma de media, se observó una caída progresiva en el grupo de CHO, de modo tal, que el valor durante la tercera hora disminuyó significativamente por debajo del valor obtenido durante la primer hora (Figura 7). No se observó ningún otro cambio significativo en Ra. Rd no varió significativamente en el grupo CHO con el tiempo. De manera similar, el aumento en Rd en MIX fue significativamente mayor que los valores correspondientes del grupo CHO a lo largo de cada una de las 3 horas. Rd aumentó durante las primeras 2 horas en el grupo AA, pero en la tercera regresó al nivel basal (Figura 8).

Figura 7. Tasa de aparición de fenilalanina (Ra) muscular en sangre. El valor durante la tercer hora después del consumo de CHO fue significativamente menor que el valor durante la primer hora después de consumir la bebida, P <0,05. No se observó ninguna otra diferencia significativa. Barra Blanca = 1 h; Barra Negra= 2 h; Barra Gris = 3 h.
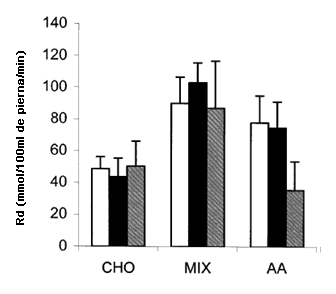
Figura 8. Tasa de desaparición (Rd), o pérdida irreversible, de fenilalanina de la sangre hacia el músculo. Todos los valores de MIX fueron mayores que los valores correspondientes de CHO. Los valores en las dos primeras horas para AA fueron significativamente mayores que los valores correspondientes a CHO (P <0,05). Barra Blanca = 1 h; Barra Negra= 2 h; Barra Gris = 3 h.
Enriquecimiento y Producción de Urea
El enriquecimiento de urea aumentó gradualmente con el tiempo en el grupo CHO pero en los grupos MIX y AA se mantuvo constante. Las tasas de producción de urea calculadas indicaron una caída significativa durante la tercera hora después del consumo de CHO, pero ningún cambio en los otros tratamientos. La producción de urea coincidió con la Ra de Phe, es decir, ambas habían disminuido significativamente durante la tercer hora después del consumo de CHO, pero no cambiaron con el tiempo en los otros tratamientos (Figura 9).
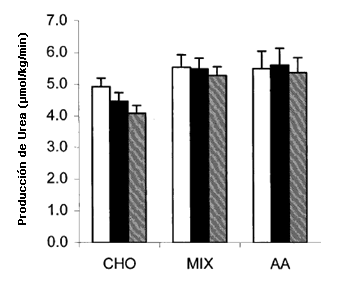
Figura 9. Tasa de producción de urea. El valor obtenido en la tercer hora con CHO fue significativamente (P <0,05) menor que el valor durante la primer hora. Barra Blanca = 1 h; Barra Negra= 2 h; Barra Gris = 3 h.
DISCUSIÓN
Los resultados de este estudio amplían los resultados previos obtenidos por este laboratorio, que demostraron un aumento en la síntesis neta de proteínas musculares cuando una dosis elevada de aminoácidos era infundida (4) o consumida (12,16) después del ejercicio. Una mezcla de 6 g de EAA más 35 g de glucosa también aumentó la síntesis neta de proteínas musculares cuando fue administrada inmediatamente antes, o en uno de tres momentos después del ejercicio, aunque el efecto anabólico fue mayor cuando era administrado antes del ejercicio (17). Estos estudios previos no abordaron la importancia relativa de los componentes de la mezcla de EAA/glucosa. Los resultados del estudio presente demostraron que cuando ~35 g de CHO se combinaron con ~6 g de una mezcla equilibrada de aminoácidos (es decir, aminoácidos esenciales (EAA) y no esenciales (NEAA)) el efecto sobre la síntesis neta de proteína muscular fue aproximadamente equivalente a la suma del efecto independiente de cualquiera de los ingredientes por separado (Figura 5). Durante el período de 2-h posteriores al consumo de CHO más AA (MIX) y de aminoácidos solos (AA), la síntesis neta de proteína muscular fue significativamente mayor que con CHO solo, pero no se observó ninguna diferencia entre MIX y AA (Figura 6).
Estudios previos han aportado cierta evidencia que el consumo de carbohidratos solos mejora el metabolismo de las proteínas. Rennie et al. observaron un mejor balance de leucina durante ejercicios de resistencia en los cuales se consumieron suplementos con carbohidratos (13), mientras que Roy et al. informaron una disminución en la proteolisis de las proteínas miofibrilares cuando los carbohidratos fueron ingeridos después del ejercicio de fuerza (14). Nuestros resultados son consistentes con esta última observación, ya que la producción de urea y la Ra de fenilalanina fueron significativamente menores en el grupo CHO en relación con el valor previo a la bebida a 30 min y el balance neto fue mayor a cero a lo largo de las 3 h después del consumo (Figura 6). Implícita en esta interpretación de nuestros resultados está la suposición, que en la ausencia de cualquier intervención, el balance neto de Phe habría permanecido constante durante el tiempo durante el cual se midió la respuesta a la bebida. La base para esta suposición es el resultado de nuestro estudio previo en que un grupo de sujetos no recibió ninguna intervención hasta 4 h después del ejercicio (12). En ese estudio no se observaron variaciones en el equilibrio en el balance neto a lo largo de las primeras 3 h después del ejercicio (12).
Aunque el efecto neto de los CHO solos, sobre la síntesis neta de proteínas musculares indicó un anabolismo moderado (es decir, la tasa de síntesis excede la tasa de degradación), no se observó ningún efecto de CHO en Rd, lo que indica la ausencia de cambio en la tasa de síntesis de proteínas musculares. Esto coincide con nuestra observación anterior acerca de que la hiperinsulinemia local no logró estimular la síntesis de proteínas musculares después del ejercicio (5). Cuando los estudios de evaluación de la respuesta de síntesis de proteínas musculares a la insulina se comparan, queda claro que la insulina sólo estimula la síntesis de proteínas musculares en un contexto de disponibilidad adecuada de aminoácidos (20). Así, es posible que después del ejercicio, la insulina aumente el potencial para una síntesis de proteínas musculares acelerada, pero esto sólo puede reflejarse en una mayor producción de proteínas, si la disponibilidad de aminoácido aumenta simultáneamente. Así, cuando un aumento en la insulina se acopló con un aumento en la concentración de aminoácidos (MIX), se observó un efecto de interacción, en el cual la respuesta normal de síntesis de proteínas musculares frente a los aminoácidos se amplificó por el aumento de la insulina, a pesar de que un aumento aislado en la insulina era inefectivo.
Nuestro diseño experimental no controló la ingesta calórica. Por lo tanto, el grupo MIX que presentó la respuesta de balance neto más positiva, consumió mayor cantidad de calorías totales (164) que los grupos AA (24) o CHO (140). Sin embargo, es improbable que las respuestas observadas puedan ser explicadas por los desequilibrios calóricos. Así, cuando se agregaron los aminoácidos (24 cal) a los carbohidratos (140 cal), se observó una mejora significativa en el balance neto (MIX contra CHO). En el contraste, cuando los carbohidratos (140 cal) se agregaron a los aminoácidos (24 cal), no se observó ningún aumento significativo en el balance neto resultante por encima de la respuesta a los aminoácidos solos (MIX contra AA).
En contraste con la situación del consumo de CHO, hay ciertas dudas acerca de si los aminoácidos administrados solos pueden estimular la síntesis neta de proteínas musculares. Esta respuesta se produce por la infusión o ingestión de aminoácidos, ya sea en reposo o después del ejercicio (4, 15, 17). En el presente estudio, la acción anabólica de los aminoácidos, tanto en el grupo AA como en el grupo MIX, se debió principalmente a un estímulo de síntesis de proteína muscular, tal como lo refleja el Rd (Figura 8). Nosotros demostramos previamente que 40 g de una mezcla equilibrada de aminoácidos estimuló la síntesis de proteínas musculares después del ejercicio (18), pero en el presente estudio nosotros proporcionamos un total de sólo dos dosis de 6 g cada una (3 g de aminoácidos esenciales (EAAs) y 3 g de aminoácidos no esenciales (NEAAs) por dosis). Cuando se combinó con el consumo de CHO, esto produjo una captación neta total de Phe de 43±8 mg·h-1·pierna-1 durante la primera hora después del consumo de la primera bebida. Esta incorporación es aproximadamente la mitad del valor de respuesta de consumo neto de Phe que nosotros obtuvimos previamente (107 mg·h-1·pierna-1) cuando proporcionamos 6 g de EAAs + 35 g de glucosa en forma de una sola dosis, 1 hora después del ejercicio (12). Estos resultados son consistentes con nuestra noción que sólo los EAAs son efectivos para estimular la síntesis de proteínas musculares (18).
Nosotros podemos estimar que aproximadamente el 50% de la Phe ingerida fue incorporada en los músculos de todo el cuerpo, si nosotros asumimos que la Phe incorporada en una pierna representa 25% del total. Si otro 20% de la Phe ingerida fuera incorporado a las proteínas en otros tejidos, entonces se oxidaría aproximadamente un 30%. Se anticiparían porcentajes comparables para los otros EAA en la mezcla y se esperaría que se oxide un porcentaje mayor de los NEAA ingeridos. El nitrógeno de los aminoácidos oxidados contribuiría eventualmente con la producción de urea, pero la producción de urea no aumentó en ninguno de los grupos que recibieron aminoácidos. Sin embargo, la ausencia de cambio en la producción de urea en los grupos que consumieron aminoácidos debe ser interpretada en el contexto de la disminución en la producción de urea, en el grupo que solo consumió glucosa (Figura 9) (8). Además, nuestra capacidad para detectar la magnitud de cambio esperado en la producción de urea sobre la base de los aminoácidos ingeridos era marginal, considerado la eficacia relativamente alta de la incorporación de aminoácidos ingeridos en proteínas.
La respuesta al consumo de la segunda dosis de cada bebida 2 horas después del ejercicio fue esencialmente igual que la respuesta a la primera dosis (Figura 6). Mientras que la segunda bebida mantuvo las mayores concentraciones de glucosa, Phe, o insulina (dependiendo de la bebida) a lo largo de las 3 h posteriores al ejercicio, esencialmente todas las variables medidas, relacionadas al metabolismo de las proteínas musculares regresaron a los valores de la línea de base, al final de la segunda hora. La respuesta rápida, pasajera de las concentraciones de aminoácidos frente al consumo de un bolo bebible de aminoácidos libres, observada en este estudio no coincide con lo observado en un estudio previo donde evaluamos la respuesta a una infusión continua con cebamiento de aminoácidos, que provocó un aumento de 1,7 veces en la concentración de aminoácidos que fue esencialmente constante durante la experiencia de 6 horas (6). Sin embargo la síntesis de proteínas musculares, sólo aumentó durante las primeras 2 horas del aumento en la concentración de aminoácidos (6). Esta menor respuesta a lo largo del tiempo implica que durante un aumento en estado estable de la concentración de aminoácidos, la síntesis de proteínas musculares se vuelve reflejo del efecto estimulante de los aminoácidos. Por consiguiente podríamos haber anticipado que se produciría una menor respuesta a la segunda bebida luego de 1 hora, porque la concentración de Phe todavía duplicaba al valor basal, sin embargo, en ese momento, la síntesis neta de proteínas musculares disminuyó al valor basal. No obstante, el consumo de la segunda bebida 1 hora después del consumo de la primera bebida estimuló una captación neta de aminoácidos similar a la observada en respuesta a la primera bebida (Figura 6). La implicación práctica de este hallazgo es que un suplemento o bebida con aminoácidos que se consume después del ejercicio no disminuiría el estímulo de síntesis de proteínas musculares que se produciría, por ejemplo, a partir de una comida consumida en algún momento después del ejercicio. Desde una perspectiva mecánica, podría ser que la síntesis de proteínas musculares responda a un cambio en la concentración sanguínea o intracelular, en lugar de un cambio en sus valores absolutos.
Otro aspecto del timing de la respuesta sugerido por nuestros datos, es que el efecto máximo de la insulina puede no coincidir con su concentración máxima. Tanto la Ra (que refleja la degradación de proteínas musculares) como la producción de urea sólo disminuyeron significativamente en la tercer hora después de la dosis inicial de CHO (Figuras 7 y 9). Esta reducción explica el balance neto positivo en este grupo durante la tercera hora (Figura 6). Además, el grupo de MIX presentó una respuesta casi idéntica a la del grupo de AA de captación neta de Phe, durante la primera hora y fue sólo en la segunda y particularmente en la tercera hora que la respuesta fue exclusivamente más positiva que la del grupo AA (Figura 6). Si, de hecho hay un retraso, en la acción de la insulina, entonces el efecto máximo de los aminoácidos puede no haber coincidido en el tiempo con el efecto máximo de la insulina. Si éste es el caso, los aminoácidos ingeridos en alguna forma de absorción más lenta (es decir, proteína intacta) pueden provocar un efecto de interacción mayor entre los aminoácidos y los carbohidratos, de modo que la concentración máxima de aminoácidos coincida con la acción máxima de insulina.
En conclusión, nuestros resultados confirman los efectos anabólicos previamente descriptos sobre las proteínas musculares del consumo de aminoácidos y glucosa después del ejercicio de fuerza. Además, los resultados indican que los efectos combinados del consumo de carbohidratos y aminoácido reflejan aproximadamente la suma de sus efectos individuales. Cuando se combinan los resultados del estudio actual con nuestros resultados previos (12), parecería que se necesita solo la ingesta de aminoácidos esenciales (EAA) para estimular la síntesis de proteínas musculares después del ejercicio. Finalmente, la respuesta a la segunda bebida demuestra que la ingesta previa de una cantidad modesta de aminoácidos o carbohidratos no disminuye la respuesta metabólica a una segunda dosis comparable consumida 1 hora después.
Dirección para Envío de Correspondencia
Robert R. Wolfe, Ph.D., 815 Market Street, Galveston, TX 77550; correo electrónico: rwolfe@utmb.edu.
Agradecimientos
Los estudios fueron apoyados por el Centro de Investigación Clínica General de la Rama Médica de la Universidad de Texas en Galveston, subsidio M01 RR 00073 de National Center for Research Resources, National Institutes of Health, United States Public Health Service; subsidio DK 38010 de National Institutes of Health y subsidio 8490 de Shriners Hospital for Children.
Los estudios fueron apoyados por el Centro de Investigación Clínica General de la Rama Médica de la Universidad de Texas en Galveston, subsidio M01 RR 00073 de National Center for Research Resources, National Institutes of Health, United States Public Health Service; subsidio DK 38010 de National Institutes of Health y subsidio 8490 de Shriners Hospital for Children.
Referencias
1. BERGSTROM, J., F. FURST, O. NOREE, and E. VINNARS (1974). Intracellular free amino acid concentration in human muscle tissue. J. Appl. Physiol. 36:693697
2. BIOLO, G., R. Y. D. FLEMING, and R. R. WOLFE (1995). Physiologic hyperinsulinemia stimulates protein synthesis and enhances transport of selected amino acids in human skeletal muscle. J. Clin. Invest. 95:811819
3. BIOLO, G., S. P. MAGGI, B. D. WILLIAMS, K. D. TIPTON, and R. R. WOLFE (1995). Increased rates of muscle protein turnover and amino acid transport after resistance exercise in humans. Am. J. Physiol. 268:E514E520
4. BIOLO, G., K. D. TIPTON, S. KLEIN, and R. R. WOLFE (1997). An abundant supply of amino acids enhances the metabolic effect of exercise on muscle protein. Am. J. Physiol. 273:E122E129,
5. BIOLO, G., B. D. WILLIAMS, R. Y. D. FLEMING, and R. R. WOLFE (1999). Insulin action on muscle protein kinetics and amino acid transport during recovery after resistance exercise. Diabetes 48:949957
6. BOHE, J., F. AILI LOW, R. R. WOLFE, and M. J. RENNIE (2001). Latency and duration of stimulation of human muscle protein synthesis during continuous infusion of amino acids. J. Physiol. 532:2:575579
7. FARRELL, P. A., N. J. FEDELE, T. C. VARY, S. R. BIMBALL, C. H. LANG, and L. S. JEFFERSON (1999). Regulation of protein synthesis after acute exercise in diabetic rats. Am. J. Physiol. 276:E721E727
8. JAHOOR, F., and R. R. WOLFE (1987). Regulation of urea production by glucose infusion in vivo. Am. J. Physiol. 253:E543E550
9. JORFELDT, L., and J. WAHREN (1971). Leg blood flow during exercise in man. Clin. Sci. Lond. 41:459473
10. KATCH, V., and A. WELTMAN (1975). Predictability of body segment volumes in living subjects. Hum. Biol. 47:203218
11. PHILIPS, S. M., K. D. TIPTON, A. AARSLAND, S. E. WOLF, and R. R. WOLFE (1997). Mixed muscle protein synthesis and breakdown after resistance exercise in humans. Am. J. Physiol. 273:E99E107
12. RASMUSSEN, B. B., K. D. TIPTON, S. L. MILLER, S. E. WOLF, and R. R. WOLFE (2000). An oral amino acid-carbohydrate supplement enhances muscle protein anabolism after resistance exercise. J. Appl. Physiol. 88:386392
13. RENNIE, M. J., R. H. T. EDWARDS, D. HALLIDAY, D. E. MATTHEWS, S. L. WOLMAN, and D. J. MILLWARD (1982). Muscle protein synthesis measured by stable isotope techniques in man: the effects of feeding and fasting. Clin. Sci. Lond. 63:519523
14. ROY, B. D., M. A. TARNOPOLSKY, J. D. MACDOUGALL, J. FOWLES, and K. E. YARASHESKI (1997). Effect of glucose supplement timing on protein metabolism after resistance training. J. Appl. Physiol. 82:18821888
15. SVANBERG, E., A. C. MOLLER-LOSWICK, D. E. MATTHEWS, U. KORNER, M. ANDERSSON, and K. LUNDHOLM (1996). Effects of amino acids on synthesis and degradation of skeletal muscle protein in humans. Am. J. Physiol. 271:E718E724
16. TIPTON, K. D., A. A. FERRANDO, S. M. PHILIPS, D. DOYLE, and R. R. WOLFE (1999). Postexercise net protein synthesis in human muscle from orally administered amino acids. Am. J. Physiol. 276:E628634
17. TIPTON, K. D., B. B. RASMUSSEN, S. L. MILLER, et al (2001). Timing of amino acid-carbohydrate ingestion alters anabolic response of muscle to resistance exercise. Am. J. Physiol. 281:E197E206
18. TIPTON, K. D., B. E. GURKIN, S. MATIN, and R. R. WOLFE (2000). Nonessential amino acids are not necessary to stimulate net muscle protein synthesis in healthy volunteers. J. Nutr. Biochem. 10:89 95
19. WOLFE, R. R (1992). Radioactive and Stable Isotope Tracers in Biomedicine: Principle and Practice of Kinetic Analysis . New York: Wiley Liss Inc
20. WOLFE, R. R., and E. VOLPI (2001). Insulin and protein metabolism. In: Handbook of Physiology, Section 7 Volume II, L. S. Jefferson and A. D. Cherrington (Eds.). New York: Oxford, 2001, pp. 735757
21. WOLFE, R. R (1981). Measurement of urea kinetics in vivo by means of a constant tracer infusion of di-15N-urea. Am. J. Physiol. 240: E428E434