Los Elementos Contráctiles como Factores Restrictivos de la Flexibilidad
Instituto del Profesorado en Educación Física. Córdoba, Argentina.
Artículo publicado en el journal PubliCE del año 1998.
Publicado 8 de abril de 2000
De todos los elementos que componen el músculo estriado voluntario, las proteínas contráctiles constituyen un factor de resistencia que condiciona la magnitud y el alcance de la deformación longitudinal que las acciones de extensión ejercen sobre el mismo. Las adaptaciones a largo plazo al entrenamiento de la flexibilidad se materializan, concretamente, a nivel de la ultraestructura el tejido conectivo. Sin embargo, para que los estiramientos puedan ejercer un efecto específico sobre este tejido, resulta crucial la minimización de la tensión restrictiva y limitante que las estructuras contráctiles del músculo tienden, tanto refleja como voluntariamente, a ofrecer. Así, en el caso de una completa relajación neuromuscular, una fuerza externa puede llegar hasta duplicar la longitud normal de reposo del sarcómero conservándose la distancia mínima entre los filamentos delgados y gruesos a los efectos de que se pueda establecer, ante el cambio de las condiciones excitatorias, por lo menos un puente cruzado.
De hecho, el grado de actividad contráctil de las proteínas sarcoméricas depende, en gran parte, de los mecanismos fisiológicos particulares del sistema nervioso. Es por ello que la creación de condiciones de máxima inhibición constituye el objetivo principal de las más avanzadas y efectivas técnicas para el desarrollo de la flexibilidad. A mayor relajación muscular, mayor efecto tendrán los estiramientos sobre el tejido conectivo que es el que, en definitiva, sufre las adaptaciones más o menos duraderas al entrenamiento de la flexibilidad.
Desde esta perspectiva, todo parece indicar que, en cuanto a la flexibilidad se refiere, los tejidos que mayor estudio requieren son el nervioso y el conectivo. No obstante, el tejido muscular contráctil, que si bien no verifica cambios estables producto del entrenamiento de la flexibilidad, es el que concretiza obedientemente la actividad funcional del sistema nervioso potenciando o restringiendo los efectos de los estiramientos sobre el tejido conectivo. Así, como mecanismo intermedio, los elementos contráctiles son efecto del estado fisiológico del sistema nervioso y causa, simultáneamente, de las mayores o menores adaptaciones del tejido conectivo.
Ahora bien, si el grado de resistencia de las proteínas contráctiles obedeciera únicamente a las órdenes impuestas por el sistema nervioso, nada justificaría el análisis estructural y funcional del sarcómero y otros orgánulos sarcoplasmáticos. Precisamente porque la relajación muscular no es un proceso de carácter exclusivamente nervioso, sino que depende también, y en gran parte, de factores funcionales y energéticos intrafibrilares, es que el análisis de tales aspectos no puede ser pasado por alto en el contexto de esta obra.
El músculo estriado esquelético
Estructuralmente, el músculo estriado está compuesto por fascículos los que, a su vez, constan de un número variable (de 100 a 500 aproximadamente) de fibras polinucleadas que se disponen formando largas cintas que, en el hombre, pueden alcanzar los 10 cm. de longitud y las 400 micras de diámetro. Las fibras musculares poseen varios núcleos localizados muy cerca de la membrana celular. Las fibras, a su vez, se encuentran compuestas por numerosas unidades de menor tamaño denominadas miofibrillas, formadas esencialmente por las proteínas actina y miosina, cuya disposición periódica permite apreciar la característica imagen de estriaciones transversales. Básicamente, existen dos clases distintas de músculo estriado: el cardíaco y el esquelético. Dentro del contexto de esta obra se considerarán específicamente los aspectos referidos al músculo estriado esquelético que es el que, en definitiva, ofrece hasta el 41% (Johns y Wright, 1962) de la resistencia total al incremento de amplitud angular de recorrido articular.
La musculatura esquelética posibilita el
movimiento y los desplazamientos recíprocos de las distintas piezas óseas
que constituyen el esqueleto funcional. El número de músculos esqueléticos
en el hombre es muy elevado: 434.
La forma de los distintos músculos del cuerpo humano es variable. Entre los
que más interesan desde el punto de vista de la flexibilidad como capacidad
motora son los fusiformes, los penniformes, los bipenniformes, los
multimembranosos, y los multitendinosos. Al respecto, según Platonov (1994,
Pág. 150):
"Las particularidades de la situación de las aponeurosis de los tendones en los músculos alados implican su menor capacidad de estiramiento respecto a los fusiformes que, por regla general, tienen menor superficie de interacción de la masa del músculo con la del tendón".
De la misma manera, un músculo multimembranoso o multitendinoso, tiene una menor capacidad de estiramiento que un fusiforme normal, debido al gran porcentaje de tejido conectivo en relación a los componentes musculares contráctiles.
El músculo estriado completo, cubierto por su epimisio, resulta de la reunión de un conjunto de fascículos musculares dispuestos, por lo general, paralelamente al eje longitudinal. Rodeado por su perimisio, cada fascículo está compuesto por fibras musculares convenientemente protegidas por su capa de endomisio. Este último debe distinguirse anatómicamente de la auténtica membrana plasmática de la fibra muscular, denominada como sarcolema. A su vez, las miofibrillas se pueden encontrar los denominados sarcómeros o unidades estructurales fisiológicas del círculo a nivel molecular. Cada sarcómero está compuesto por una serie de bandas claras y oscuras. Las zonas claras son denominadas como bandas I (por ser isotrópicas) y las zonas oscuras como bandas A (por ser anisotrópicas). En el centro de la zona oscura se encuentra una banda clara más pequeña, denominada H cruzada longitudinalmente por una línea oscura o línea N. A su vez, en las bandas claras puede observarse otra línea oscura denominada Z.
Convencionalmente, se conoce como sarcómero al conjunto de estructuras comprendidas entre los líneas Z.
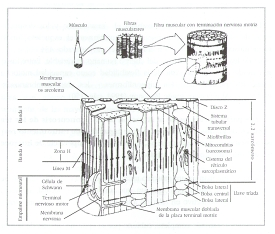
Figura 1. Corte ampliado de una sola fibra
de músculo estriado que muestra el sistema miofibrilar, el sistema tubular
transverso, el retículo sarcoplasmático y la unión mioneural. (De CARLSON y
WILKIE. 1974. Tomado de Astrand y Rodahl. 1992, p. 28)
Estructura del sarcómero
La alternancia de bandas claras y oscuras en el sarcómero deriva de la disposición relativa de sus dos filamentos contráctiles más abundantes, a saber, la miosina o filamento grueso y la actina o filamento delgado. Así, en el sarcómero relajado, las bandas claras están compuestas exclusivamente por filamentos de actina que se extienden desde las líneas Z hacia la zona central del sarcómero. La zona H, por el contrario, consta solamente de filamentos gruesos que desde la línea central o M se dirigen hacia fuera. Finalmente, las bandas oscuras A están constituidas tanto por filamentos de miosina como de actina convenientemente superpuestas inclusive en estado de reposo. En estas condiciones, así como los filamentos de actina no llegan a establecer contacto con la línea M, tampoco los de miosina logran alcanzar la línea Z.
El sarcómero presenta también, transversalmente, una clara ordenación. Así, si el corte es realizado a nivel de la zona H, se observan solo filamentos gruesos y si el corte transversal es a nivel de la banda I se aprecian solamente filamentos finos. Pero si dicho corte es realizado a nivel de la banda oscura A, cada filamento grueso se encuentra rodeado por seis finos y cada filamento fino, por otros seis, tres de los cuales son gruesos y los otros tres finos, dispuestos alternada y geométricamente.
Aparte de la miosina y de la actina dentro del sarcómero se deben, al menos, otras dos proteínas de gran significación funcional en cuanto a los procesos de contracción relajación se refiere: la troponina y la tropomiosina.
Miosina
Compone los filamentos gruesos y es un polímero resultante de la agregación de 360 moléculas ordenadamente empaquetadas. Cada molécula unitaria de miosina está formada por dos cadenas polipeptídicas helicoidales, enrolladas entre sí. A su vez, cada cadena está compuesta por dos porciones claramente distinguibles: una cabeza o porción inicial globular y una larga cola. Las dos colas se yuxtaponen formando una única larga cola mientras que las dos cabezas sobresalen nítidamente del empaquetamiento del polímero. La zona central del filamento grueso está desprovista de cabezas.
Considerando la molécula individual de miosina, su análisis permite distinguir dos fracciones denominadas como meromiosina pesada (MMP) y meromiosina ligera (MML). La MML o meromiosina ligera compone los gruesos paquetes de miosina y no interactúa con la actina. Por el contrario, la MMP o meromiosina pesada sí es capaz de relacionarse con los filamentos finos y está compuesta, a su vez, por dos fracciones: la S1o cabeza y la S2 o cuello. Le primer fragmento o S1 denota una fuerte actividad degradativa de ATP.
Las proyecciones de la MMP parecen palos de golf y están rotadas aproximadamente 120° en relación a la proyección anterior. Dos bisagras flexibles permiten la actividad muscular contráctil. Una está ubicada entre el cuello de la MMP o S2 y la MML; y la otra entre el S1 y el S2 de la misma MMP. La primera bisagra acerca a la molécula de miosina a la de actina y posibilita la unión. La segunda bisagra es la que en definitiva, permite generar la fuerza "moviendo" al filamento de actina (Astrand - Rodahl, 1992).
Actina
Esta proteína, en su forma monomérica, recibe la denominación de actina G, mientras que polimerizada (cada polímero está constituido por unas 400 moléculas de actina G) es conocida como actina F. Para formar el filamento fino, dos cadenas de actina F se enrollan entre sí, en forma de doble hélice, quedando un hueco o ranura entre ambas. En este hueco o rama se localizan otras dos proteínas de función esencialmente reguladora conocidas como troponina, y tropomiosina.
Tropomiosina
Estructuralmente es muy parecida a la miosina monomérica y lo único que la distingue es la carencia de porciones S1 o globulares. Está compuesta por dos cadenas enrolladas helicoidalmente y se dispone ocupando la mayor parte del surco o ranura que queda entre las dos cadenas de actina. Por sus extremos se une a la troponina y se extiende a lo largo de la longitud de 7 actinas G.
Troponina
Es una proteína globular compuesta por tres subunidades. Se encuentra ligada a la tropomiosina y se sitúa también en los surcos o ranuras cada 7 monómeros de actina G o cada media vuelta de hélice de actina F. Según Astrand y Rodahl (1992) la molécula de troponina tiene tres subunidades: la TN-C o proteína que liga el calcio; la TN-1 o proteína que es capaz de inhibir la interacción de la actina con los puentes de miosina; y la TN-T que es una proteína fuertemente unida a la tropomiosina.
Otras proteínas
Además de las cuatro proteínas ya indicadas, en el sarcómero se pueden aislar otras de alta significación estructural, reguladora y enzimática. Entre ellas se encuentran la proteína M (presente en la línea M) la alfa-actinina (uno de cuyos componentes podría ser el soporte estructural de la línea Z), y la beta actinina (función probablemente estabilizadora de los empaquetamientos de actina).
El sistema sarcotubular
Dentro de las fibras musculares, la reticulación tiene una significación funcional muy importante. En la misma, por su alto desarrollo y crucial participación en el proceso contráctil se deben considerar los túbulos transversales (o túbulos T), los túbulos longitudinales (o túbulos L) y las cisternas terminales.
Los túbulos T están situados a lo largo de la línea Z y son, en realidad, invaginaciones de la cadena en dirección al interior de la fibra. Los túbulos L corren perpendiculares a los T, es decir, paralelos a los miofilamentos. Si bien contactan con los túbulos T, los túbulos L no están abiertos a ellos, por lo que su contenido líquido interior (CA++ en proporción muy abundante) difiere notablemente del de los túbulos T. Las cisternas terminales se encuentran situadas en el fondo del sarcómero y en lo único que se diferencian de los túbulos L es en su mayor tamaño y capacidad de alojamiento de calcio (CA++). Fisiológicamente, se le suele denominar como "tríada" al conjunto formado por estas tres estructuras.
Antes de echarle un vistazo al mecanismo de la contracción y la relajación muscular, cabe hacer referencia a dos estructuras de importante función elástica que, hasta el momento, poco han sido estudiadas con especto a la misma. Ellos son el sarcolema y el sarcoplasma. Según Huxley (1974, citado por Astrand, 1992) dentro de cada puente de miosina- actina hay un elemento elástico en serie con un elemento no lineal. Concretamente, parece que vínculos elásticos conectan el cuello de la MMP con el resto del ramillete de la MML. Sin embargo, no se sabe cuál es la estructura de este componente elástico como tampoco la clase de cambios que sufre durante el proceso de contracción o relajación o al producirse el "salto" de puentes cruzados.
El proceso de la contracción muscular
Al contraerse, el músculo disminuye su longitud acortando los sarcómeros. Una serie de modificaciones a nivel de las bandas claras y oscuras pueden verificarse durante dicho proceso, a saber:
Disminución de la amplitud de la banda I y la
zona H.
Mantenimiento de la banda A y de las líneas Z y M.
El grado de contracción determina la magnitud de la disminución de la banda I y de la zona H siendo que, incluso, pueden llegar a desaparecer adquiriendo el sarcómero la totalidad de la estiración característica de las bandas A. Durante la contracción se verifica el deslizamiento recíproco de los filamentos de actina y miosina; los primeros en dirección a la línea M y los segundos a la línea Z.
Según la teoría del "Filamento deslizante" se establecen durante la contracción muscular entre los filamentos de actina y de miosina, "puentes cruzados" que conforman un sistema de interacción entre los segmentos S1 o cabezas de miosina y las moléculas de actina. El fragmento S2 o cuello de la miosina es susceptible de doblarse a la manera de bisagra para permitir el deslizamiento de la actina hacia un acortamiento de aproximadamente 2 x 10 nm (namómetros), es decir, el 1% de la longitud total de sarcómero. Sin embargo, puesto que en condiciones normales el sarcómero puede acortarse hasta el 50% de su longitud, el mecanismo de bisagra es complementado por el "salto" de los puentes cruzados en dirección a la línea Z.
Al llegar el potencial de acción al sarcolema, la corriente despolarizante ingresa al interior de la fibra muscular a través de los túbulos T. Ello provoca el éxodo masivo del calcio de las cisternas terminales y, en menor medida, de los túbulos L.
Según Astrand (1992) todavía se desconoce como la despolarización del túbulo T provoca la liberación de Ca++ del retículo sarcoplasmático hacia el espacio miofibrilar. Los aspectos anátomo-fisiológicos de la relación túbulo T - Cisterna terminal constituyen, por el momento, un interrogante (Tada, y Col, 1978; Frinnell y Brazier,1981 y Endo, 1977; citados por Astrand, 1992)
El calcio libre en el sarcoplasma es el factor responsable del fenómeno de contracción de la fibra muscular. El calcio liberado de las cisternas se acopla a la troponina. El complejo troponina - calcio determina cambios en la disposición espacial de la tropomiosina, la cual desde su posición de bloqueo emigra hacia otras zonas centrales del surco dejando en libertad de interacción a la miosina con la actina. Eliminada la acción bloqueante de la tropomiosina, para el establecimiento de puentes cruzados se supone la hidrólisis del ATP unido, hasta el momento, a la cabeza de miosina o porción S1. Al mismo tiempo, para permitir el deslizamiento paralelo de los miofilamentos, las porciones S2 de la meromiosina pesada deben plegarse a la manera de bisagras.
Según Astrand (1992) la cabeza del puente puede unirse a la actina con un ángulo de 90° y luego cambiar su ángulo de unión a 45° pero, en realidad, todavía no se sabe con certeza el grado exacto de movimiento y rotación de los subporciones S1 y S2 de miosina durante la contracción.
El mecanismo de la relajación muscular
Para que tropomiosina abandone la porción central del surco de actina y se ubique en condiciones de inhibir la interacción con la miosina es necesario que se disuelva la unión de la troponina con el calcio y que éste regrese a las cisternas terminales. Este transporte de calcio consume energía, requiriendo la hidrólisis de un ATP por cada dos moléculas de calcio. De hecho, si tal energía es escasa, la posibilidad de relajación queda reducida y por mayor que sea la inhibición del SN, la resistencia del músculo al estiramiento habrá de ser grande.
Alargamiento del sarcómero
Minuciosas mediciones microscópicas de la longitud del sarcómero en su totalidad como así también de sus filamentos de actina, miosina y zona H han permitido establecer sus limitaciones estructurales entre el alargamiento inducido por una fuerza externa. Según Alter (1991, pág. 27):
"Cuando un sarcómero es estirado hasta el punto de ruptura, puede alcanzar una longitud aproximada de 3,60 micras. Sin embargo, una ruptura del sarcómero no es deseable. Nuestro interés principal es estirar el sarcómero hasta una longitud donde, al menos, pueda mantenerse un puente cruzado entre la actina y la miosina. Se ha llegado a saber que esa longitud es de aproximadamente 3,50 micras".
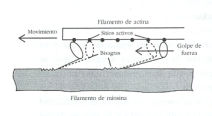
Figura 2. Mecanismo del
"deslizamiento" para la contracción del músculo. (Tomado de
Guyton, 1989. p. 115)
Si se considera que la longitud normal de reposo del sarcómero es de 2,30 micras, el componente contráctil es capaz de ceder hasta 1,20. Esto representa un aumento de más del 50% respecto de la longitud de reposo pudiendo llegar, inclusive, al 67% (Alter, 1991). Ahora bien, sin que se conserve la posibilidad de establecer puentes cruzados (por lo menos uno) el sarcómero puede ser estirado hasta un 120% de su longitud normal. Ello no se debe al alargamiento de los filamentos de miosina o actina "en si" puesto que ellos no modifican, en absoluto, individualmente su longitud. El alargamiento del sarcómero es causado por el deslizamiento de filamentos gruesos y delgados en forma paralela. En estas condiciones, tanto las bandas I como la zona H presentan un incremento notable de su longitud; mientras que la zona A puede incluso llegar a desaparecer si, debido a la separación entre las línea Z, ya no se verifica superposición entre filamentos finos y gruesos.