Absorción Intestinal de Agua de una Selección de Soluciones de Carbohidratos en Humanos
Carl V Gisolfi1, R. W Summers1, H. P Schedl1 y T. L Bleiler1
Departments of Exercise Science, Physiology and Biophysics, and Internal Medicine, University of Iowa Colleges of Liberal Arts, Medicine and the Medical Service, Department of Veterans Affairs Medical Center, Iowa City, Iowa 52242.
Artículo publicado en el journal PubliCE, Volumen 0 del año 1992.
Publicado 3 de julio de 2006
Resumen
Palabras clave: Absorción del ión de sodio, perfusión segmentaria, terapia de rehidratación oral
INTRODUCCION
Durante el ejercicio prolongado, la fatiga esta asociada con la deshidratación, hipertermia, hipoglicemia, y depleción del glucógeno muscular (2, 7,36). Además, durante eventos de ultraendurance, algunos atletas sufren hiponatremia (14, 32). Para promover una función circulatoria normal, para evitar lesiones térmicas, y para mejorar la performance, los fluidos deben ser ingeridos durante el ejercicio para reemplazar el agua y las sales perdidas en el sudor y para promover una fuente exógena de energía (22, 28, 30). Estos fluidos deben ser rápidamente evacuados desde el estómago y absorbidos en el intestino para mantener una hidratación adecuada.
Si virtualmente no ocurre absorción en el estómago (44), el suministro de hidratación y energía exógena es dependiente de la absorción de carbohidratos (CHO), agua, y sal en el intestino. La absorción es marcadamente variable entre los sujetos, y la composición y concentración de CHO necesarias para maximizar la absorción de agua, sal, y hexosa es desconocida. La fructosa estimula el 66-100%, tanto de la absorción de Na+ y agua neta, como de glucosa [la absorción de agua es expresada en ml/mmol del CHO absorbido (11)], pero la absorción de fructosa es limitada en humano (38), y la ingestión de soluciones de fructosa puede resultar en un trastorno gastrointestinal (15). La glucosa estimula la absorción activa y pasiva de Na y secreción de K+ (11): la fructosa estimula la absorción de K+ (11). La sucrosa inhibe la absorción de agua (31, 35, 49), mientras que las maltodextrinas han sido reportadas por maximizar la absorción de agua (20, 21, 42). Con respecto al flujo de glucosa neta, 1) la sucrosa ha sido reportada por fortalecer (46) o retardar (21) la absorción de glucosa, 2) la maltosa confiere una ventaja kinética sobre la glucosa (5, 41), y 3) la glucosa derivada de maltotriosa o una mezcla de oligómero de la glucosa es absorbida, significativamente más rápido, que de la glucosa libre (8, 21).
El propósito de este estudio fue comparar la absorción de agua de soluciones de glucosa, sucrosa, una maltodextrina, y un jarabe de maíz sólido prefusionado a través del duodeno-yeyuno en sujetos humanos. Las preguntas específicas que se han hecho fueron 1) Influencia la forma de CHO, usado para formular una bebida de reemplazo de fluidos, la absorción de agua?; y 2) A qué concentración de CHO declina la absorción de agua?.
METODOS
Sujetos
Ocho voluntarios masculinos de 25.3±1.4 (SE) años de edad, con un peso de 75.2±2.4 kg, y 179.5±2.2 cm de altura sirvieron como sujetos en este estudio. El protocolo fue aprobado por nuestro comité institucional en el uso de sujetos humanos en la investigación y cada sujeto proveyó su informe de consentimiento firmado. Los sujetos desayunaron 12 horas antes de colocárseles un tubo multilumen y, dependiendo de la duración del experimento, fueron prefusionados un máximo de cinco y un mínimo de dos soluciones, en un día dado.
Soluciones
Diecisiete soluciones se probaron en un orden al azar. Estas incluyeron soluciones al 2, 4, 6, y 8% de glucosa (111-444 mM), e iguales concentraciones de sucrosa (55-233 mM), de una maltodextrina (17-67 mM), y de un jarabe de maíz sólido (40-160 mM), usando como solución control NaCl isotónica. Todas las soluciones se hicieron isotónicas por la adición de NaCl, excepto las soluciones de glucosa al 6 y 8%, que fueron hipertónicas. Todas las soluciones contuvieron 1 mg/ml de polietilenglicol, como un marcador no absorbible para la determinación del flujo de agua. Las maltodextrinas tuvieron un equivalente de dextrosa (DE) de 15, mientras que el jarabe de maíz sólido tuvo un DE de 36. El valor de DE provee un índice del grado de hidrólisis del polímero de almidón; 100/DE da un promedio de la longitud de la cadena del polímero. Así, las maltodextrinas tuvieron un promedio de longitud de la cadena de siete unidades de glucosa, mientras que el jarabe sólido de maíz tuvo un promedio de longitud de cadena de tres unidades de glucosa. Por ello, las maltodextrinas son designadas G 7 y los jarabes sólidos de maíz son designados G 3, como indicadores de sus promedios de longitud de cadena. Con respecto a las distribuciones de frecuencia de las diferentes longitudes de cadenas, G 3 contuvo 6% de glucosa: 53.3% de 2, 3, y 4 unidades de glucosa y 22% de >10 unidades de glucosa. El porcentaje remanente contuvo 5-10 unidades de glucosa. G 7 contuvo 1.3% de glucosa: 5% cada 2, 3, 4, 5, y 8 unidades de glucosa, 18% de 6 y 7 unidades de glucosa y 50% de >10 unidades de glucosa, y un remanente de 5% contuvo 9 y 10 unidades de glucosa. A concentraciones molares iguales, las soluciones de G 7 y G 3 proveen más mitades de glucosa para la absorción y el metabolismo que lo que da la solución de glucosa libre. En contraste, la sucrosa tiene menos mitades de glucosa por gramo.
Técnica
La construcción del catéter multilumen y la técnica de perfusión segmentaria han sido explicadas en detalle previamente (16). Brevemente, el catéter multilumen fue de 150 cm de largo y consistió en cuatro lúmenes, cada uno con un diámetro de 2 mm (Arndorfer Medical Specialities, Greendale, WI). Una bolsa de plástico conteniendo 1.5 ml de mercurio fue suturada en su final más distante y encerrada en un balón. El primer lumen del catéter se introdujo en el balón. El segundo lumen sirvió como el tubo de infusión y tenía una única abertura de 100 cm desde su final más próximo. El tercer y el cuarto lumen proveyeron lugares de muestreo, cada uno con tres aberturas espaciadas a 1 cm. Las aberturas intermedias de los lugares de muestreo más próximos y más distantes estuvieron a 10 y 50 cm del punto de infusión más distante, respectivamente.
Protocolo
Las intubaciones fueron hechas bajo guía fluoroscópica en el Centro de Enfermedades Digestivas del Hospital de Clínicas de la Universidad de Iowa. Las soluciones fueron infundidas a un % de 15 ml/min usando una bomba Masterflex (Cole Parmer Instrument), calibrada inmediatamente antes de cada experimento, mientras el sujeto permanecía sentado en una silla con su espalda y brazos en descanso. El protocolo de perfusión consistió de un período de equilibrio de 20 min, sin perfusión, para estabilizar el volumen de plasma. Al final de este período comenzó la perfusión. Los primeros 30 min sirvieron como un período de equilibrio, seguidos de un período de test de 70 min. Durante el período de test, las muestras del fluido fueron sacadas del lumen más próximo a 1 ml/min y del más distante por el método de sifón con 10 min de intervalos. Las muestras de sangre fueron sacadas por un catéter endovenoso (aguja intracat. calibre 18 y con llave de heparina), antes del período de equilibrio y a intervalos de 15 min durante el período de test de 70 min. Entre los experimentos del mismo día, se les dio a los sujetos entre 10 a 20 min entre soluciones, para caminar y elongarse. Este período fue seguido por el mismo protocolo descripto anteriormente; por ej.: un descanso de 20 min sentado, para el equilibrio del volumen de plasma seguido por 100 min de la perfusión (30 min de equilibrio, 70 min del período de test).
Análisis Químicos
El polietilenglicol fue medido por el análisis turbidométrico, modificado por Malawer (27). El Na+ y el K+ fueron medidos por fotometría de llama (Modelo 943, Instrumentation Laboratories); la osmolalidad fue medida por una osmómetro de presión de vapor (Modelo 5500, Wescor), y la glucosa fue medida usando un reactivo Trinder a 505 nm (Sigma Nº 315). La hemoglobina fue medida por el método de cianmethemoglobina (Sigma Nº 525) y el cambio de porcentaje en el volumen de plasma fue calculado de acuerdo al método de Dill y Costill (9).
Análisis Estadístico
El flujo de agua neta y el movimiento del soluto soluble fueron calculados de acuerdo a Cooper et al. (6). Un análisis de variancia a dos vías (two-way anova), fue usado para evaluar el efecto del tiempo, el tipo de CHO y la concentración CHO de la solución, sobre el agua y sobre el flujo de soluto, durante el período de test. Un test F para el análisis de los efectos simples, fue usado para aislar las diferencias específicas. Un análisis de regresión simple de la media de flujo de Na+ sobre la media de flujo de agua y K+, y sobre la concentración de Na+ ([Na]), fue realizado durante el test segmentario, incluyendo todas las soluciones. Ocasionalmente, no se podían obtener muestras suficientes para completar todos los análisis. Cuando esto ocurría, sino había más de 2 valores faltantes en un experimento, estos eran reemplazados por un promedio de los valores disponibles para ese experimento. La significancia estadística fue establecida en P<0.05. Todos los valores son reportados como valores medios±SE.
RESULTADOS
Flujos de Agua y CHO
El orden en el cual las soluciones fueron prefusionadas no tuvo efecto sistemático sobre ninguna variable (ANOVA a una vía, p>0.05). También, los análisis repetidos ANOVA no mostraron diferencias en los tiempos del flujo de agua neta, Na+ o K+, de cada experimento. De esta manera la información fue excluida y sólo se reportaron los valores medios.
La Figura 1 muestra la información del flujo de agua neta, agrupada para comparar cada CHO, considerando las cuatro concentraciones. La absorción de agua neta con las perfusiones de todas las soluciones al 2.4, y 6% de CHO, fue mayor (p<0.05) que con la perfusión de la solución salino-isotónica de control. El flujo de agua neta para las soluciones de CHO al 2.4, y 6% pasaron de -11.6 a -13.7; de -10.6 a -15.0; y de -8.7 a -13.6 ml/h/cm, respectivamente. La perfusión de la sucrosa al 8% y las soluciones de G 7 al 8% causaron una mayor absorción (p<0.05) de agua, comparadas con las soluciones de control, las de G 3 al 8% y la de glucosa al 8%. El movimiento de agua neta durante la perfusión de glucosa hipertónica al 8% no se diferenció de cero. Esto es atribuible a la secreción neta de agua en el segmento de mezcla. La secreción neta ocurrió en el segmento de mezcla, tanto para las soluciones de glucosa al 6 y al 8% (50.9±13.5 y 58.7±11.5 ml/h/cm, respectivamente).
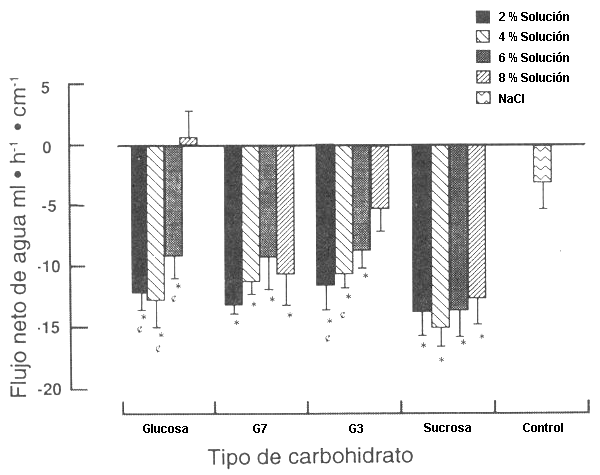
Figura 1. Flujo del agua en relación a la concentración de carbohidratos
(CHO) agrupados por el tipo de CHO (los valores negativos indican la absorción
neta, los valores positivos indican la secreción neta en todas las figuras). Con
glucosa, el flujo de agua neta disminuyó con una concentración de glucosa
incrementada sobre un 4%; y con un 8%, el flujo de agua no se diferenció de
cero. La absorción de agua fue independiente de la concentración de sucrosa.
Para los jarabes sólidos de maíz con un promedio de longitud de cadena de 3
unidades de glucosa (G 3), la absorción de agua disminuyó progresivamente con el
incremento de la concentración, pero esta tendencia fue menos pronunciada para
las maltodextrinas con un promedio de longitud de cadena de 7 unidades de
glucosa (G 7). (*) Difiere de la solución de control NaCl (p<0.05); (¢) difiere
de la solución al 8% del mismo tipo de CHO (p<0.05).
El promedio del flujo de agua neta no se diferenció para las soluciones de sucrosa (-13.7 ml/h/cm) y G 7 (-11.0 ml/h/cm) (Fig. 1). Todas las soluciones con sucrosa y las G 7 produjeron una significativamente mayor absorción de agua que la solución de control. Para las soluciones G 3, el flujo de agua neta fue mayor (p<0.05) que para el control, durante la perfusión de las soluciones al 2, 4, y 6%, y las soluciones al 2 y 4% produjeron una mayor absorción de agua que la solución al 8%. Para la glucosa, las soluciones al 2, 4, y 6% produjeron una mayor (p<0.05) absorción de agua que la solución control y que la solución de glucosa al 8% el flujo neto de glucosa, medido de las soluciones de glucosa al 2, 4, 6, y 8% fue -1.5±0.5, -2.4±0.4, -4.0±0.3 y -3.2±0.6 mmol/h/cm, respectivamente; ej., se incrementa la linearidad de las soluciones del 2 al 6%, luego se nivela (plateau) cuando la concentración fue incrementada al 8% (Fig. 2). El % de glucosa absorbido de las soluciones al 2, 4, 6, y 8% fue 75.5±6.2, 72.0±13.2, 83.1±9.2 y 61.2±7.7%, respectivamente.
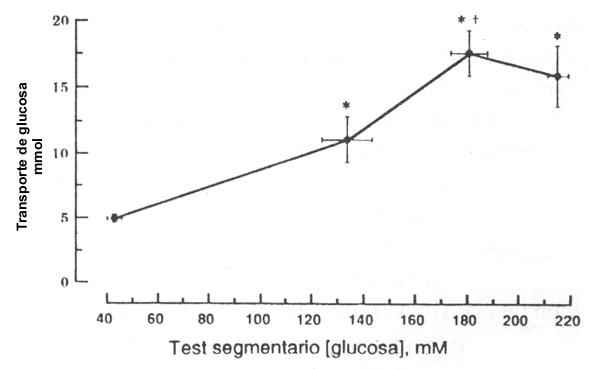
Figura 2. Relación entre el transporte de glucosa y la concentración
promedio de glucosa en el test de perfusión segmentada, durante la perfusión de
las soluciones de glucosa al 2, 4, 6, y 8%. El transporte de glucosa establece
un “plateau” o meseta con las soluciones hipertónicas al 6 y 8%. (*) Difiere de
la solución al 2%. (+) Difiere de la solución al 4%.
Flujo de Na+
Los valores de [Na+] en la solución original y en los lugares de muestreo más próximos y más distantes son presentados en la Tabla 1. El [Na+] en la solución original pasó de 0 a 155 mM y no influenció los porcentajes de absorción de agua. El [Na+] en el lugar de muestreo más próximo, pasó de 32 a 147 mM, y en el lugar más distante pasó de 59 a 148 mM. El flujo de agua neta correlacionó con el flujo de Na+ (Fig. 3, r=0.72, p<0.01), pero tuvo menor “r” con la [Na+] en el test segmentado (r=0.23, p=0.02, información no mostrada). De todos modos, el flujo de Na+ neto correlacionó significativamente con la [Na+], en el test segmentado, y la absorción neta ocurrió a un [Na+] tan baja como 50 mM (Fig. 4). La absorción de Na+ fue mayor con todas las soluciones al 2% que con la solución control salina isotónica, pero no hubo diferencias en el flujo de Na+ entre cualquiera de las soluciones al 2% (Fig. 5). El flujo de Na+ fue mayor con la solución de G7 al 4% que con la de glucosa al 4%. Dentro de las soluciones al 4%, sólo la solución de G7 se diferenció de la de control. Durante la perfusión de glucosa al 6%, el movimiento del Na+ no se diferenció de cero, pero la perfusión al 8% de la solución de glucosa resultó en una secreción de Na+ neto, la cual fue significativamente diferente de la solución de control. Todas las otras soluciones al 6% estuvieron asociadas con la absorción neta de Na+. La solución de G7 al 8% resultó en una mayor absorción de Na+ (p<0.05), comparada con los otros tipos de CHO al 8%. El flujo de Na+ producido por las soluciones al 2 y al 8% de glucosa fue diferente (p<0.05) de aquellos obtenidos durante la perfusión de la solución de control (Fig. 5). Los flujos de Na+ para las soluciones de glucosa al 2, 4 y 6% fueron, todos, significativamente diferentes de la solución al 8%. El flujo neto de Na+ fue el mismo para las soluciones de glucosa al 4 y 6%. No hubo diferencia en el flujo neto de Na+ asociado con el porcentaje de CHO en la solución, durante la perfusión de CHO del tipo G7, pero las soluciones al 2 y 4% produjeron una absorción significativamente mayor de Na+ que la de control. El flujo neto de Na+ durante la perfusión de las soluciones de G 3, fue mayor (p<0.05) que la de control sólo para la concentración al 2%. La absorción de Na+ fue más alta (p<0.05) durante la perfusión de las soluciones de G3 al 2 y al 4%, comparadas con la solución al 8%. La absorción de Na+ durante la perfusión de las soluciones de sucrosa fue mayor (p<0.05) que la de control, sólo para concentración al 2%. La absorción de Na+ fue más alta (p<0.05) durante la perfusión al 2 y al 4% de sucrosa, comparadas con la del 8% de sucrosa. La absorción de Na+ también fue más alta para la solución de sucrosa al 2%, comparada con la solución de sucrosa al 6%.
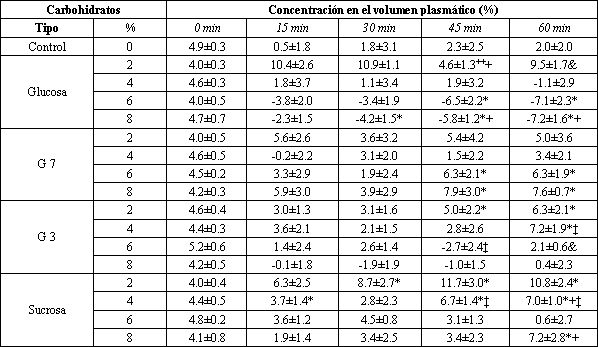
Tabla 1. Concentración de carbohidratos y Na+, y la
osmolaridad de las diferentes soluciones de carbohidratos. Los datos son
presentados como valores medios±SE de los valores extraídos durante el período
de testeo. G7 es maltodextrinas con longitud de cadena promedio de 7 unidades de
glucosa; G3 es jarabe sólido de maíz con longitud de cadena promedio de 3
unidades de glucosa. (*) Diferencia significativa con la solución original
(p<0.05). (+) Diferencia significativa con medición proximal (p<0.05).
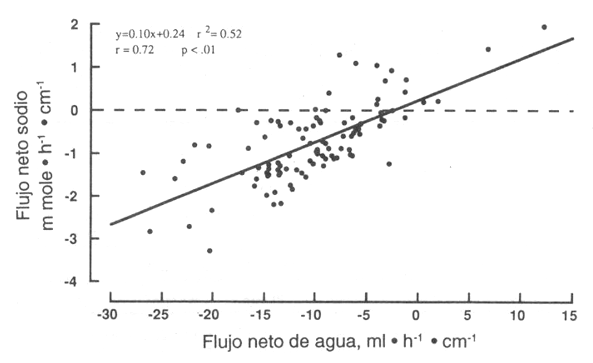
Figura 3. Regresión lineal del flujo de Na+ neto en relación
al flujo de agua neta. Cada valor representa medias del flujo de agua neta
diagramado en función de las medias del flujo de Na+, para las
soluciones dadas, durante los últimos 60 min de la perfusión. Los flujos de Na+
y agua están directamente correlacionados.
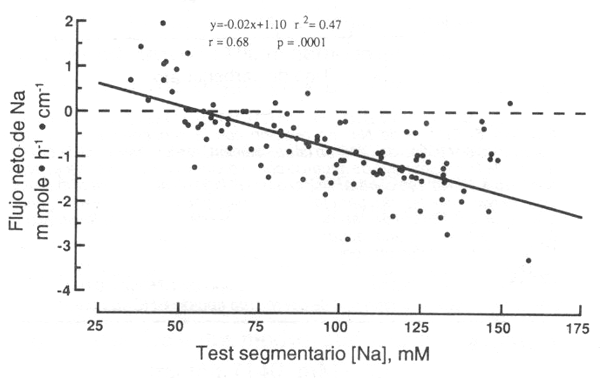
Figura 4. Regresión lineal del flujo de Na+ sobre [(Na+)]
en el test segmentario. Cada valor representa medias del flujo de Na+
neto para las soluciones dadas, durante los últimos 60 min de la perfusión,
diagramados en oposición a medias de [Na+] en el test segmentario,
sobre el mismo período de tiempo. La absorción de Na+ (valores
negativos) se incrementa con el aumento de la [Na+]. Nótese que la
absorción ocurre a una [Na+], tan baja, como 50 mM.
Flujo de K+
La perfusión de la solución control causó una secreción de K+ neto (Fig. 6). El flujo de K+ fue independiente de los tipos de CHO para las soluciones al 2 o al 4%. La absorción de K+ durante la perfusión al 2% de G 3 y de sucrosa al 2% fue mayor (p<0.05), que durante la perfusión de la solución control. La perfusión de todas las soluciones al 4%, excepto la de G 3 al 4%, resultaron de una absorción significativamente mayor (p<0.05) de K+, que durante la perfusión de la solución de control. La perfusión de todas las soluciones al 6% produjeron un flujo de K+, que no fue significativamente diferente de la solución control, pero las soluciones de G 7 y de sucrosa, resultaron significativamente diferente (p<0.05) de la de glucosa.
De las soluciones al 8%, sólo la de glucosa produjo un flujo de K+ diferente (p<0.05) de la solución control. Todas las otras soluciones al 8% de CHO, resultaron en valores del flujo de K+ diferentes (p<0.05), de la solución de glucosa al 8%. No hubo diferencias en el flujo de K+ asociado con los porcentajes diferentes de las soluciones de G 7 o de sucrosa. El flujo de K+ no se diferenció de cero con la perfusión de las soluciones de glucosa al 2 y al 4%, y de G 3, mientras que las soluciones de glucosa al 6 y al 8%, y la del 8% de G 3 causaron una secreción de K+ neto, durante el test segmentario. El flujo de K+ neto correlacionó significativamente con el flujo de Na+ neto, al margen de la concentración de CHO (y= 0.04. x + 0.29; r= 0.78, p<0.01).
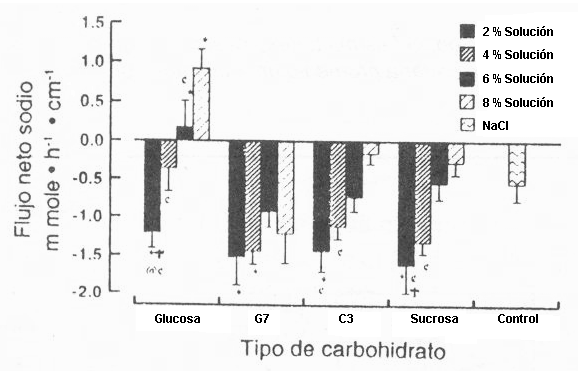
Figura 5. El flujo de Na+ en relación con la concentración de
CHO agrupados por el tipo de CHO en cada solución. Al incrementarse la [CHO], el
flujo de Na+ disminuyó de acuerdo con la disminución progresiva en [Na+]
(ver Tabla 1). Nótese el paralelismo entre el flujo de agua neta (Fig. 1) y el
flujo de Na+ (esta Figura), para todas las soluciones de CHO,
exceptuando la de sucrosa. El flujo de Na+ no se diferenció de cero
con el de la glucosa al 6%, y la secreción neta ocurrió con el de glucosa al 8%.
(*) Difiere de la solución control (p<0.05). (c) Difiere de la solución al 8%
del mismo tipo de CHO (p<0.05). (+) Difiere de la solución al 6% del mismo tipo
de CHO (p<0.05). (@) Difiere de la solución al 4% del mismo tipo de CHO
(p<0.05).
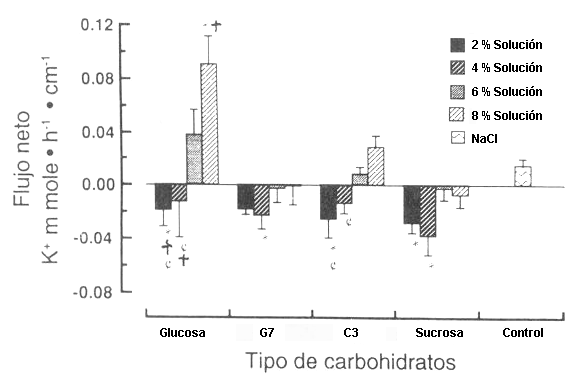
Figura 6. El flujo de K+ en relación a la concentración de CHO,
agrupados por el tipo de CHO. El flujo de K+ neto es absorbido a
bajas [CHO] y tiende hacia una secreción, o ha un flujo cerca de cero, a altas [CHO].
(*) Difiere de la solución control (p<0.05). (†) Difiere de la solución al 6%
del mismo tiempo de CHO (p<0.05). (¢) Difiere de la solución al 8% del mismo
tipo de CHO (p<0.05).
Datos sobre el Plasma
Los valores de Na+, K+, y de osmolaridad del plasma no se modificaron en relación al tiempo (p>0.05), y por eso fueron excluidos, para generar un solo valor medio para la comparación estadística entre grupos. Cuando estas medias fueron comparadas, no hubo diferencias entre las diferentes formas de CHO o entre las diferentes concentraciones estudiadas. La Tabla 2 muestra los datos sobre la glucosa del plasma, recolectados en relación al tiempo. Para todas las soluciones de CHO, excepto la solución de glucosa al 8%, hubo un incremento (p<0.05) en la glucosa del plasma, cerca de 15 min después del comienzo de la perfusión. Esta elevación permaneció a través de los 60 min, para todas las soluciones, excepto para las siguientes: G 3 después de 15 min G 7 al 4% después de 30 min, y sucrosa al 8% después de 45 min. No hubo cambio en la concentración de glucosa en el plasma (p>0.05), durante la perfusión de la solución isotónica de control de ClNa.
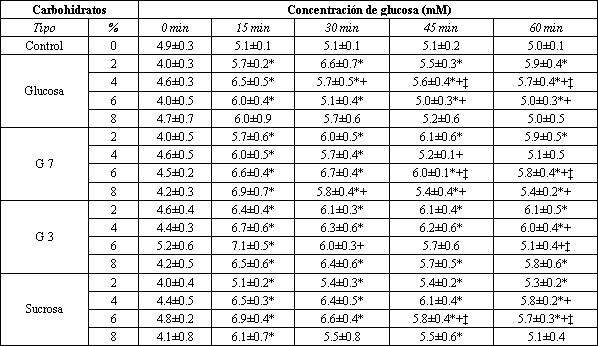
Tabla 2. Concentraciones de glucosa plasmática durante la perfusión. Los
valores son medias +/- SE. (*) Difiere significativamente del minuto cero
(p<0.05). (+) Difiere significativamente del minuto 15 (p<0.05). (‡) Difiere
significativamente del minuto 30 (p<0.05).

Tabla 3. Cambios porcentuales en el volumen plasmático, durante la
perfusión. Los datos son presentados como valores medios±SE. (*) Diferencias
significativas comparadas con la pre-perfusión (0min) (p<0.05). (+) Diferencias
significativas con medición de 45 min (p<0.05). (‡) Diferencias significativas
con medición de 30 min (p<0.05). (&) Diferencias significativas con medición de
15 min (p<0.05).
Porcentaje de Cambios en el Volumen del Plasma
Los valores discutidos más abajo, son porcentajes promedio de los cambios en el volumen del plasma (Tabla 3). La perfusión de la solución de control no cambió significativamente el volumen de plasma. La glucosa al 2% y la sucrosa al 2% incrementaron (p<0.05) el volumen de plasma 9.3 y 9.4%, respectivamente. El incremento promedio en el volumen de plasma para las soluciones al 2 y al 4% fue 7.0 y 3.2%, respectivamente. La perfusión de glucosa al 6 y 8% resultó en una significativa disminución (p<0.05) en el volumen de plasma (5.2 y 4.9%, respectivamente), comparada con la línea de base, con la solución control, y todas las otras soluciones al 6 y al 8%, respectivamente. No hubo otras diferencias entre las soluciones al 6 y al 8% y la solución control.
Prefusionar las soluciones de G7 y G3 de CHO causaron un incremento promedio en el volumen de plasma de 5.5 y 4.1%, respectivamente, pero no hubo diferencias entre las soluciones con diferentes porcentajes de CHO; estas soluciones no fueron diferentes de la solución de control. La sucrosa al 2% incrementó (p<0.05) el volumen de plasma en 9.4%, el cual fue 7.8% por sobre el valor de control, 6.4% sobre el valor de la sucrosa al 6%, y 5.4% más que la sucrosa al 8%. La sucrosa al 2% no elevó significativamente el volumen de plasma más que la sucrosa al 4%.
DISCUSION
Absorción de Agua
La primera pregunta formulada para este estudio fue: ¿”La concentración y forma de CHO usados para formular una bebida de reemplazo de fluidos, influencia la absorción de agua?” La respuesta es no, por encima de concentraciones del 6% (Figura 1). Estas soluciones producen una absorción de agua significativamente mayor que la solución salina isotónica de control, apoyando el concepto de que la adición de CHO a una solución con electrolitos mejora el transporte de agua (11, 43). La segunda pregunta que se formuló fue: “¿A qué concentración de CHO declina la absorción de agua significativamente?”. La respuesta a esta pregunta depende de la forma del CHO usada para formular la solución. La absorción de agua no se redujo significativamente incrementando la concentración de CHO más arriba del 8%, para las soluciones que contenían G 7 o sucrosa, pero una solución al 8% redujo la absorción de agua (menor secreción neta); y la absorción de agua ante la solución de G3 al 8% fue significativamente menor que la absorción de agua ante soluciones al 8% de sucrosa y de G7.
Este último punto es de considerable importancia, porque otros (21) han demostrado una absorción de glucosa (de oligómeros de glucosa de cadena corta) significativamente mayor que de los monómeros de glucosa y de sucrosa, sugiriendo que la absorción de agua (no reportada) podría también ser mayor. Esta discrepancia podría estar relacionada a la concentración de CHO de las soluciones estudiadas. Jones et al. (21) compararon soluciones isotónico-isocalóricas azúcar-salinas con 140 mM de glucosa. De todos modos, aún si se prefusionara a esta concentración (140 mM), maltotriosa o una mezcla de oligómeros-glucosa, se produciría una mayor absorción de glucosa que un monómero de glucosa o sucrosa, también podría esperarse que estas soluciones produjeran una mayor absorción de agua. De todos modos, no encontramos diferencias en la absorción de agua de las soluciones al 2% de sucrosa y de G3; la última podría ser considerada comparable a la mezcla de oligómeros de Jones et al.
Además de la concentración y forma del CHO, las características importantes de las bebidas de reemplazo de fluidos, influyen [Na+] y osmolaridad. Excepto por las soluciones de glucosa al 6 y al 8%, la osmolaridad fue controlada en los presentes estudios prefusionando soluciones isotónicas (Tabla 1).
Agregar diferentes cantidades de ClNa a las soluciones originales, para hacerlas isotónicas, no influenció la absorción de agua neta. Por otro lado, el flujo de agua neta correlacionó significativamente con el flujo de Na+ neto (Fig. 3), indicando que el movimiento de Na+ es un determinante importante en el movimiento del agua. La absorción de Na+ también fue significativamente correlacionada con la absorción de K+ (n=0.78, p<0.01), y fundamentalmente, el flujo de agua neta sigue el flujo de soluto neto. De todos modos, la observación de que la absorción de agua correlacionó pobremente con el [Na+] en el test segmentario (r=0.23), sugiere que la absorción de CHO jugó el rol dominante en la determinación del movimiento del agua en este estudio. Fortdran et al. (13) encontraron que, en el yeyuno, la absorción de Na+ fue estimulada por la presencia de glucosa y es marcadamente influenciada por el movimiento de agua. La vía primaria del transporte de Na+ fue la resistencia de la solución. Consideradas en conjunto, estas observaciones apoyan el concepto de Pappenheimer (34), de que la presencia de glucosa en el lúmen intestinal abre las uniones estrechas de la pared celular y promueve un movimiento de agua y solutos a través de un camino metabólico paracelular.
En el presente estudio, la solución al 4% (220 mM) de glucosa (concentración de glucosa de 132 mM en el test segmentario) produjo la mayor absorción de agua entre las soluciones de glucosa. Estas informaciones son comparables con otros valores en la literatura, usando la técnica de perfusión segmentada en humanos (27, 29, 45). No medimos la concentración de CHO en el test segmentario para las otras soluciones de CHO.
Usando un sistema de profusión intestinal in vivo en ratas para determinar la óptima absorción de agua neta bajo condiciones isotónicas, Lifshitz y Wapnir (25) encontraron que la relación molar entre la glucosa y el Na+ fue el factor crítico. La solución óptima contuvo 111 mM de glucosa y 60 mM de Na+ y tuvo un cociente proporcional de glucosa/concentración de Na+, ligeramente menor que 2:1. La absorción de Na+ fue directamente relacionada a su concentración en la solución del test, y el Na+ fue segregado a concentraciones luminales por debajo de 60 mM. En un estudio subsecuente con soluciones hipotónicas (155-220 mosmol/kg H2O), estos autores encontraron que las proporciones de glucosa/Na+ de 1:1 o 1:2, fueron aún más efectivas en promover la absorción de agua neta (48). Ellos concluyeron que una solución de rehidratación oral con una osmolaridad d +/- 200 mosmol/kg H2O, una proporción de glucosa/Na+ de 1:2, y una concentración de glucosa no excedente de 60 mM, evocó la mayor absorción de agua del yeyuno. Otros investigadores concuerdan con que las soluciones hipotónicas promueven la absorción de agua (12, 19, 23, 24), pero el agua corriente, que es marcadamente hipotónica, es absorbida más lentamente (p<0.05) que el agua de soluciones de CHO + electrolitos, isotónica (16). En el presente estudio con soluciones de glucosa isotónica, encontramos que la absorción de agua neta fue independiente de las proporciones de glucosa/Na+ en las soluciones de testeo, pasando de 1.2:1 a más de 8.5:1 (Tabla 1, datos de la glucosa).
La razón de ello, está probablemente relacionada a la velocidad con la cual el intestino puede intercambiar el [Na+] luminar (Tabla 1, solución de testeo, datos “proximal” y “distal”), y en cierto grado, también se debe a los cambios que ocurren en la concentración de glucosa luminar. La proporción glucosa/Na+ en el test segmentario para las soluciones de glucosa al 2, 4, 6% (que no produjo diferencias significativas en el flujo de agua neta), fue 0.4:1, 2:1, y 3.5:1, respectivamente.
A raíz de que G3 y G7 fueron isotónicas en nuestros experimentos, no examinamos el potencial de hipotonicidad para el mejoramiento de la absorción de agua. De hecho, durante la perfusión, la hidrólisis incrementó la osmolaridad de G3 y G 7 (Tabla 1: solución al 8%, media del muestreo de los sitios proximales y distales; 309 y 332 mosmol/kg H2O, respectivamente). A pesar del hecho de que el G 3 fue menos hipertónico que el G 7, La absorción de agua decreció progresivamente con el incremento de concentración de CHO con G 3, pero no con G 7 (Fig. 1).
La presente información no explica completamente las razones para esta diferencia en el comportamiento. El incremento en la osmolaridad durante la perfusión de los oligosacáridos, es consecuente con el bien sabido exceso de la capacidad digestiva por sobre la capacidad de absorción de CHO del tracto alimenticio. El gran incremento en la osmolaridad del G 7, comparado con G 3, sugiere una mayor hidrólisis de este sustrato, y por ello una mayor carga de monosacáridos ofertados a la mucosa, con un mayor potencial para la absorción de CHO totales, y por ende de absorción de agua. Realmente, nuestra información demuestra que la absorción de glucosa se incrementa progresivamente, al tiempo que la concentración luminar sube a 132 mM, en tests segmentarios (solución de glucosa al 4%, Fig. 2); y la absorción de agua también incrementa del 2 al 4% de glucosa (Fig. 1). Por eso las diferencias en la digestibilidad podrían contribuir a una mayor absorción de agua en G 7 que en G 3. [Na+] positiva podría contribuir a una mayor absorción de agua porque [Na+] fue más alto para G 7 que para G 3 (98 vs. 78 mM para la solución al 8%, Tabla 1). De todos modos, [Na+] no puede ser crítica, porque [Na+] fue más alta para G 3 que para las soluciones de sucrosa, produciendo, sin embargo, la sucrosa una mayor absorción de agua neta.
Si una solución es isotónica, la forma del CHO usado para formular la solución no parece afectar la absorción de agua; de todos modos, esto podría no ser verdad para la absorción de los propios CHO. Otros autores han demostrado diferencias significativas en la absorción de glucosa, a partir de soluciones isotónicas-isocalóricas de glucosa (azúcar + electrolitos), maltotriosa, y una mezcla de oligosacáridos (20, 21). Además, el transporte de glucosa a partir de sucrosa es, al menos en parte, independiente del Na+ (37), y la absorción de fructosa a partir de la sucrosa, es significativamente mayor que la absorción de la fructosa, a partir de la fructosa libre (40). Las proporciones relativamente altas del flujo de agua neta a partir de soluciones de sucrosa en el presente estudio están probablemente relacionadas a la absorción de CHO, y no al flujo de Na+, porque el flujo de Na+ declinó al haberse incrementado la [sucrosa] del 2 a 8% (Fig. 5), mientras el flujo de agua neta fue menos afectado por el incremento de la concentración de sucrosa (Fig. 1). La disminución en el flujo de Na+ es atribuida a la disminución en [Na+], al haberse incrementado la concentración de sucrosa de 2 a 8% (Tabla 1).
La leve ventaja de la sucrosa sobre las otras formas de CHO pueden ser atribuidas, en parte, a más de un mecanismo de transporte de CHO. La glucosa puede ser transportada con y sin Na+, y la fructosa puede ser transportada por una difusión facilitada y por un mecanismo de cotransporte (37, 40) de la glucosa, dependiente de fructosa.
Nuestros resultados en humanos contrastan con las observaciones en animales. Patra et al. (35) encontraron que la perfusión de una solución isosmótica de sucrosa-electrolitos (en mM: 90 Na+, 15 K+, 105 Cl-, y 90 de sucrosa), a través del yeyuno y el ilion de ratas anestesiadas, causó una absorción significativamente mayor de Na+, Cl-, y K+, pero con una absorción significativamente menor de agua, comparada con una solución isotónica glucosa-electrolitos. En un experimento en una rata no anestesiada, Saunders y Sillery (42) encontraron que la perfusión de 60 mM de sucrosa con 120 mM NaCl y 20 mM KCl, a través del duodeno yeyuno, fracasó en la promoción de la absorción de agua o Na+, comparadas con 10 mM de polímero de glucosa (equivalente a 56 mM de glucosa como oligosacáridos de glucosa) o 60 mM de soluciones de glucosa conteniendo electrolitos similares. La diferencia entre estas observaciones en animales experimentales y nuestras observaciones en humanos, podría ser atribuída a mecanismos diferentes de transporte o a diferencias en la composición de la solución. Las soluciones usadas en estos animales estudiados son más comparables con nuestras soluciones al 2 y al 4% (concentraciones del test segmentario), las cuales contenían levemente más CHO, levemente menos Na+ y no contenían K+. Las ratas absorben la fructosa por un mecanismo activo carrier mediante (17, 26), mientras que la fructosa es absorbida pasivamente en humanos. De todos modos, la diferencia podría favorecer la absorción de agua y ClNa por parte de las ratas. Probablemente, la baja [CHO] y la alta [Na+] en los estudios de animales, deberían favorecer la absorción de ClNa por las ratas. Por eso, tal vez haya diferencias en cuanto a especies, referente a la absorción de sucrosa.
Absorción de Glucosa
El flujo de glucosa neto incrementado con la concentración de glucosa del 2 al 6%, luego se niveló, probablemente porque la solución al 8% no causó un flujo de agua neto (Fig. 2). Este incremento en la absorción con incrementos en la concentración, concuerdan con los resultados de Abbott et al. (1) y Groen (18), aunque el porcentaje máximo de absorción ocurrió a una más baja concentración en nuestro estudio. La concentración de glucosa luminal, tan alta como la observada en este estudio, ha sido reportada en el intestino luego de una comida rica en CHO (34). Pappenheimer (34) sugiere que la presencia de glucosa en el lumen estimula la absorción de glucosa, la cual a su turno activa los elementos contráctiles dentro del citoplasma del enterocito, para abrir las estrechas uniones entre las células epiteliales. Una vez que esta senda paracelular está abierta, ella facilita el movimiento para el agua y el soluto (incluyendo glucosa), a través del enterocito, dentro del torrente sanguíneo. De todos modos, Ferraris et al. (10) encontraron que en ratas, conejos y perros alimentados con dietas normales, la concentración de glucosa en el intestino delgado pasó de sólo 0.2 a 48 mM; éstas desafían el concepto que dice que el arrastre solvente puede convertirse en la senda primaria de transporte para la absorción de glucosa, bajo condiciones fisiológicas normales. En el presente estudio, la concentración promedio de glucosa en el test, pasó de 43 a 215 mM (Fig. 2), y la concentración luminal de glucosa para una solución dada, se mantuvo en un estado uniforme (datos no presentados). Si el Na+ relacionado con el mecanismo de transporte de la membrana se satura a una concentración de glucosa luminal de 20-30 mM (34), el incremento lineal en el transporte de glucosa de las soluciones, pasando de 40 a 180 mM de glucosa, indica que hay otros mecanismos de transporte de glucosa que deben considerarse para el transporte adicional. El “plateau” en la absorción de glucosa con concentraciones al 8% de glucosa, es consecuente con un efecto de disminución de la absorción de agua (Fig. 1) sobre la absorción de glucosa, en lugar de una saturación del transporte de glucosa.
Absorción de Electrolitos
A raíz de que el ClNa fue usado para hacer las soluciones isotónicas, cuando la concentración CHO fue incrementada, la [Na+] disminuyó (Tabla 1). Aún para una forma dada de CHO, la [Na+] no fue constante. En general, a la más baja [Na+] en una solución, dará el más bajo flujo de Na+ (Fig. 4). En la ausencia del Na+ en las soluciones de glucosa al 6 y 8%, la absorción de Na+ no ocurrió. Aunque la secreción de Na+ neta ha sido reportada a una [Na+] intraluminal <80-90 mM (47), en el presente estudio, nosotros encontramos una absorción de Na+ neta a una [Na+] luminal tan baja, como 50 mM durante el test segmentario (Fig. 4).
El K+ estuvo ausente en estas soluciones del test; en consecuencia, la absorción neta de K+ que ocurrió durante el test es secundaria a la secreción de K+ neto que ocurrió en el segmento de mezcla (Fig. 6). Algunas soluciones continuaron promoviendo la secreción de K+ neto en el test segmentario. Todas las soluciones al 2 y al 4% de CHO resultaron en una absorción de K+ neto comparado con la solución de control salino isotónica, indicando que la presencia de CHO fue influenciada por el movimiento de K+. En duodeno-yeyuno, el movimiento de K+ es considerado generalmente pasivo y de seguir los movimientos de los fluidos (3). La observación de que las altas concentraciones de glucosa (al 6 y 8%) promovieron la secreción de K+, mientras que todas las concentraciones de sucrosa promovieron la absorción de K+ neto, es atribuida a la secreción de K+ estimulada por la glucosa, y a la absorción de K+ estimulada por la fructosa (11). Los hallazgos de que todas las soluciones G 7 causaron una pequeña absorción de K+ neto, mientras que las más altas concentraciones (al 6 y 8%) de las soluciones del G 3 causaron una pequeña secreción de K+ neto, puede ser relacionada a la concentración de glucosa luminal resultante de la hidrólisis de estas soluciones. Nosotros especulamos que la hidrólisis de las soluciones G 7 resultan en una más baja concentración de glucosa luminal que la hidrólisis de las soluciones del G 3. La observación de que los flujos de Na+ y K+ están significativamente correlacionados (r= 0.78, p<0.05, datos no mostrados), concuerda con las evidencias de otros autores (48) y sugieren que el transporte de estos iones puede estar correlacionado (39).
Información sobre el Plasma
La observación de que la [Na+] del plasma y la osmolaridad no cambiaron durante el tiempo, es consecuente con los hallazgos de que la absorción de agua neta se correlacionó significativamente con la absorción de Na+ neto. El transporte de K+ es considerado generalmente pasivo, y en el duodeno-yeyuno, éste sigue los cambios en el movimiento del agua (4); por eso no se esperaba un cambio en la [K+] del plasma, bajo las condiciones de este estudio. La concentración de glucosa en el plasma se incrementó dentro de los 15 min de la perfusión de todas las soluciones de CHO, excepto la solución al 8% de glucosa (Tabla 2). Esto se esperaba porque la absorción de glucosa, sin dudas, siguió a la perfusión de las diferentes soluciones de CHO.
La solución de glucosa al 8% no elevó la concentración de glucosa en el plasma por sobre el valor inicial, tal vez porque el valor del minuto cero fue elevado debido a la secreción de agua neta, causada por la hipertonicidad de esta solución.
Los valores de la glucosa en el plasma llegaron a un pico en los 15 y 30 min, y con algunas excepciones, permanecieron significativamente elevados sobre la concentración inicial de glucosa a través del protocolo. Como nosotros no medimos la absorción de glucosa a partir de la sucrosa, o de las soluciones G7 y G3, no tenemos información sobre porqué la perfusión de las soluciones al 6% de G3, 4% de G7, y 8% de sucrosa no sostuvieron una concentración de glucosa en el plasma significativamente elevada.
En resumen, la absorción de agua neta por efectos de soluciones isotónicas-isocalóricas es: 1) independiente del tipo de CHO usado para formular la bebida, con concentraciones mayores al 6%; y 2) es significativamente reducida al incrementar las concentraciones de CHO, por arriba del 8%, para las soluciones conteniendo glucosa y G 3, pero no G 7 o sucrosa. Por eso, a altas concentraciones, la forma del CHO usado para formular una solución de rehidratación oral puede jugar un importante rol en la absorción de agua intestinal. Puede ser posible proveer energía adicional sin sacrificar la rehidratación, seleccionando una forma apropiada de CHO. La proporción de glucosa para la [Na+] no influenció el flujo de agua neta, y el transporte de glucosa se incrementó linealmente con la concentración de glucosa luminal de 40 a 180 mM. La última observación sugiere que hay otros mecanismos de transporte de glucosa, a parte del mecanismo dependiente del transportador de Na+ mediado por el transporte activo de glucosa, que participa en la absorción CHO, a altas concentraciones de glucosa luminal.
Finalmente, es importante señalar que estas informaciones no son aplicables directamente a la rehidratación oral. En un estudio previo (33), nosotros demostramos que la rehidratación no fue diferente luego de la ingestión de una solución de glucosa al 10% o una solución de polímero de glucosa al 10%. Cuando estas informaciones son consideradas a la luz del presente estudio, se hace claro que debe ocurrir una considerable dilución cuando una solución al 10% es consumida oralmente. Otros autores han demostrado que altas concentraciones de CHO pueden incrementar la secreción gástrica y reducir el vaciamiento gástrico, modulando así, el porcentaje de absorción, independientemente de la capacidad potencial de transporte del intestino.
Esta investigación fue subsidiada por el Instituto de Ciencias del Deporte Gatorade y el Servicio de Investigación de la Administración Nacional de Veteranos.
Referencias
1. Annott, W.O., W.G. Karr, and T.G. Miller (1936). Absorption of glucose from the human small intestine (abstract). Am. J. Med. Sci. 191: 871
2. Bergstrom, J. and F. Hultman (1966). The effect of exercise on muscle glycogen and electrolytes in normals. Scand. J. Clin. Invest. 18: 16-20
3. Binder, H.J (1988). absorption and secretion of water and electrolytes by small and large intestine. Philadelphia, p.a.: saunders, p. 1022-1045
4. Binder, H.J. and Gisandle (1987). Electrolyte absorption and secretion in the mammalian colon. New york: raven, p. 1389-1418
5. Cook, G.C (1973). comparison of absorption rates of glucose and maltose in man in vivo. Clin. Sci. Lond. 41: 425-428
6. Cooper, H., R. Levitan, J.S. Fordtran, and R.J. Ingelfinger (1966). A method for studying absorption of water and solute from the human small intestine. Gastroenterology 50: 1-7
7. Coyle, E.F., A.R. Coggan, M.K. Hemmert, and J.L. Ivy (1986). Muscle glycogen utilization during prolonged strenuous exercise when fed carbohydrate. J. Appl. Physiol. 61: 165-172
8. Daun, F., M.I. Cohen, H.Mcnamara, and L. Finberg (1978). Intestinal osmolality and carbohydrate absorption in rats treated with polymerized glucose. Pediatr. Res. 12: 24-26
9. Dill, D.B., and D.L. Costill (1974). Calculation of percentage changes in volumes of blood, plasma, and red cells in dehydration. J. Appl. Physiol. 37: 247-248
10. Ferraris, R.P., S.Yasharpour, K.C.K. Lloyd, R. Mirzayan, and J.M. Diamond (1990). Luminal glucose concentrations in the gut under normal conditions. Am. J. Physiol. 259 (gastrointest. Liver physiol. 22): g 822-g 837
11. Fordtran, J.S (1975). Stimulation of active and passive sodium absorption by sugars in the human jejunum. J. Clin. Invest. 55: 728-737
12. Fordtran, J.S., R. Levitan, V. Bikerman, and B.A. Burrows (1961). The kinetics of water absorption in the human intestine. Trans. Assoc. Am. Physicians 74: 195-206
13. Fordtran, J.S., F.C. Rector, and N.W. Carter (1968). The mechanisms of sodium absorption in the human small intestine. J. Clin. Invest. 17: 881-900
14. Frizzell, R.T., G.H. Lang, D.C. Lowerence, and S.R. Lathan (1986). Hyponatremia and ultramarathon running. J. Am. Med. Assoc. 255: 772-774
15. Fruth, J.M., and C.V. Gisolfi (1983). Effects of carbohydrate consumption on endurance performance: fructose vs. Glucose. In: nutrient utilization during exercise, edited by e.l. fox. Columbus, oh: ross laboratories, p. 68-75
16. Gisolfi, C.V., R.W. Summers, H.P. Schedl, T.L., Bleiler, and R.A. Orrlinger (1990). Human intestinal water absorption: direct vs. Indirect measurements. Am. J. Physiol. 258 (gastrointest. Liver physiol. 21): g 216-g 222
17. Gracey, M.V., Burke, and A (1972). Oshin. Active intestinal transport of d fructose. Biochim. Biophys. Acta 226: 397-406
18. Broen, J (1937). The absorption of hexoses from the upper part of the small intestine in man. J. Clin. Invest. 16: 245-255
19. Hunt, J.B., E.J. Elliott, P.D. Faircnough, and M.J.G. Farthing (1988). Effects of [na] on water and na absorption from hypotonic oral rehydration solutions (ors) (abstract). Clin. Sci. Lond. 74, suppl. 18: 2
20. Jones, B.J.M., B.E. Brown, J.S. Loran, D. Edgerton, J.F. Kennedy, J.A. Stead, and D.B.A. Silk (1983). Glucose absorption from starch hydrolysates in the human jejunum. Gut. 24: 1152-1160
21. Jones, D.J.M., B.E. Higgins, and D.B.A. Silk (1987). Glucose absorption from maltotriose and glucose oligomers in the human jejunum. Clin. Sci. Lond. 72: 409-414
22. Lanmb, D.R., and G.R. Brodowicz (1986). Optimal use of fluids of varying formulations to minimize exercise induced disturbances in homeostasis. Sports med. 3: 247-274
23. Leiper, J.B. and R.J. Maughan (1986). The effect of luminal tonicity on water absorption from a segment of the intact human jejunum. (abstract). j. Physiol. Lond. 378: 95 p
24. Leiper, J.B. and R.J. Maughan (1988). Comparison of absorption rates from two hypotonic and the isotonic rehydration solutions in the intact human jejunum (abstract). Clin. Sci. Lond. 75, suppl. 19: 22 p
25. Lieshitz, F., and R.A. Wapnir (1985). Oral hydration solutions: experimental optimization of water and sodium absorption. J. Pediatr. 106: 383-389
26. Macrae, A.R., and T.S. Neudoerffer (1972). Support for the existence of an active transport mechanism of fructose in the rat. Biochim. Biophys. Acta 288: 137-144
27. Malawer, S.J (1965). Interrelationship between jejunal absorption of sodium, glucose and water in man. Am. J. Clin. Invest. 44: 1072-1073
28. Maughan, R (1991). Carbohydrate electrolyte solutions during prolonged exercise. In: ergogenics: enhancement of performance in exercise and sport, edited by D.R. Lamb and M.H. Williams. Indianapolis
29. Modigliani, R., and J.J. Bernier (1971). Absorption of glucose, sodium, and water by the human jejunum studied by intestinal perfusion with a proximal occluding balloon and at variable flow rates. Gut 12: 184-193
30. Murray, R (1987). The effects of consuming carbohydrate electrolyte beverages on gastric emptying and fluid absorption during and following exercise. Sports med. 4: 322-351
31. Newton, C.R., P.B. Mcintyre, J.E. Lennard, Jones, J.J., Gonvers, and D.M. Preston (1985). Effect of different drinks on fluid and electrolyte losses from a jejunostomy. J. R. Soc. Med. 78: 27-34
32. Noakes, T.D., N. Goodwin, B.L. Rayner, T. Branken, and R.K.N. Taylor (1985). Water intoxication: a possible complication during endurance exercise. Med. Sci. Sports exercise 17: 370-375
33. Owen, M.D., K.C. Kregel, P.T. Wall, and C.V. Gisolfi (1986). Effects of ingesting carbohydrate beverages during exercise in the heat. Med. Sci. Sports exercise 18: 568-575
34. Paffenheimer, J.R (1990). Paracellular intestinal absorption of glucose, creatinine, and mannitol in normal animals: relation to body size. Am. J. Physiol. 259 (gastrointest. Liver physiol. 22): g 290-g 299
35. Patra, F.C., D. Mahalanabis, and R.N. Jalan (1982). Stimulation of sodium and water absorption by sucrose in the rat small intestine. Acta pediatr. Scand. 71: 103-107
36. Pugh, L.G.C.E., J.L. Corbett, and R.H. Johnson (1967). Rectal temperatures, weight losses, and sweat rates in marathon running. J. Appl. Physiol. 23: 347-352
37. Ramasawamy, K., P. Malathi, W.F. Caspary, and R.K. Cranf (1974). Studies of the transport of glucose from disaccharides by hamster small intestine in vitro. II. Characteristics of the disaccharidase related transport system. Biochim. Biophys. Acta 345: 39-48
38. Ravich, W.J., T.N. Bayless, and M. Thomas (1983). Fructose: incomplete intestinal absorption in humans. Gastroenterology 84: 26-29
39. Rose, R.C (1976). Transport of sodium and potassium in intestinal epithelial cells. Life sci. 18: 1229-1236
40. Rumessen, J.J., and E. Gudmand Hoyer (1986). Absorption capacity of fructose in healthy adults. Comparison with sucrose and its constituent monosaccharides. Gut 27: 1161-1168
41. Sandle, G.I., R.W. Lobley, and R. Holmes (1977). Effect of maltose on the absorption of glucose in the jejunum in man (abstract). Gut 18: a 944
42. Saunders, D.R. , and J.K. Sillery (1985). Absorption of carbohydrate electrolyte solutions in rat duodenojejunum. Implications for the composition of oral electrolyte solutions in man. Dig. Dis. Sci. 30: 154-160
43. Schedl, H.P., and J.A. Clifton (1963). Solute and water absorption by the human small intestine. Nature lond. 199: 1261-1267
44. Scholer, J.F., and C.F. Code (1954). Rate of absorption of water from stomach and small bowel of human beings. Gastroenterology 27: 565-577
45. Sladen, G.E., and A.M. Dawson (1969). Interrelationships between the absorptions of glucose, sodium and water by the normal human jejunum. J. Clin. Sci. 36: 119-132
46. Spiller, R.C., B.J.M. Jones, B.E. Brown, and D.B.A. Silk (1982). Enhancement of carbohydrate absorption by the addition of sucrose to enteric diets (abstract). J. Parenter. Enteral nutr. 6: 321
47. Spiller, R.C., B.J.M. Jones, and D.B.A. Silk (1987). Jejunal water and electrolyte absorption from two proprietary enteral feeds in man: importance of sodium content. Gut 28: 681-687
48. Wapnir, R.A., and F. Lifshitz (1985). Osmolality and solute concentration-their relationship with an oral hydration solution effectiveness: an experimental assessment. Pediatr. Res. 19: 894-898
49. Wheeler, K.B. and J.G. Banwell (1986). Intestinal water and electrolyte flux of glucose polymer electrolyte solutions. Med. Sci. Sports exercise 18: 436-439