Efectos de la Ingesta de Carbohidratos Líquidos sobre el Ejercicio Repetido con Esfuerzo Máximo en Ciclistas de Competición
Mark D Haub1, Jeffrey A Potteiger3 y Gregory G Haff2
1Department of Human Nutrition, Kansas State University, Manhattan, Kansas 66506.
2Department of Health, Leisure, and Exercise Science, Appalachian State University, Boone, North Carolina 28608.
3Department of Health, Physical Education, and Recreation, Virginia Commonwealth University, Richmond, Virginia 23284.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2003.
Publicado 20 de octubre de 2004
Resumen
Palabras clave: recuperación, alta intensidad, ciclismo, glucosa, lactato, ácidos grasos
INTRODUCCIÓN
El ejercicio de corta duración y alta intensidad, realizado con un consumo de oxígeno (VO2 máx.) igual o mayor al 100 %, depende fuertemente de la glucólisis para la producción de energía (22). Consecuentemente, la alta demanda de resíntesis de trifosfato de adenosina (ATP) durante este tipo de ejercicio requiere que el combustible provenga predominantemente de las fuentes de carbohidratos, principalmente glucógeno (9, 20). Se ha sugerido que en ejercicios agotadores que duran ~3 minutos, la glucólisis provee aproximadamente el 80 % del ATP (20). Muchas competiciones atléticas requieren que los atletas se desempeñen a estas intensidades; sin embargo, existe una limitada literatura científica acerca de cómo los atletas pueden mejorar su rendimiento en eventos en los cuales se requiere que estos califiquen para posteriores rondas de competencia (i.e., eliminatorias, semifinales o finales). Esos escenarios competitivos pueden permitir que el atleta disponga solamente de una hora para repletar sus reservas de combustibles antes de su siguiente competencia. Varios estudios han examinado los efectos de la ingesta de carbohidratos sobre el rendimiento en resistencia (12, 14, 17, 19), pero hay una escasez de literatura que examine los efectos de la misma sobre los rendimientos en ejercicios que duran menos de 5 minutos, la cual es la duración en la que muchos atletas compiten repetidamente (e.g., ciclismo de pista, natación, y carreras de velocidad y de media distancia). Además, no está claro si la intervención nutricional durante el breve período de recuperación mejoraría el rendimiento máximo luego de las eliminatorias.
Bangsbo y Saltin (3) examinaron los efectos del ejercicio de extensión de rodilla a una pierna hasta el agotamiento sobre el subsiguiente tiempo hasta el agotamiento luego de 60 minutos de recuperación. Ellos observaron que el rendimiento en el ejercicio agotador de corta duración se redujo aproximadamente un 10 % durante el segundo período de ejercicio hasta el agotamiento. Utilizando un diseño de ejercicio similar al utilizado por Bangsbo y Saltin (3), Haub y cols. (15) investigaron si la ingesta de carbohidratos líquidos durante un período de recuperación de 60 minutos entre dos períodos de ejercicios máximos afectaba el rendimiento. Se observó que la ingesta de carbohidratos minimizó la reducción en el rendimiento en el ejercicio en relación a la administración de placebo (PLC) (15). Los sujetos estudiados por Haub y cols. (15) realizaron una prueba por tiempo (tiempo para completar un determinado trabajo) similares a las realizadas por los ciclistas de pista. Una reducción en el rendimiento de la magnitud de la observada previamente (3, 15) podría dificultar la posibilidad de que el atleta alcance el rendimiento óptimo y que continúe hacia las rondas de calificación de la competición.
Sin embargo, en los estudios de Bangsbo y Saltin (3) y Haub y cols. (15), los sujetos no eran atletas, y uno de los protocolos implicó ejercicios hasta el agotamiento utilizando extensiones unilaterales de rodilla (2, 3). Debido a que los sujetos no eran atletas de competición y debido a que las competiciones atléticas no son disputadas hasta el punto del agotamiento (2, 3), los resultados de estos estudios no son completamente aplicables a los atletas (6).
Por ello, el propósito de la presente investigación fue (a) determinar el efecto de la ingesta de carbohidratos líquidos durante el período de recuperación de 60 minutos entre pruebas por tiempo de corta duración sobre el rendimiento subsiguiente en una prueba por tiempo en ciclistas de competición (b) verificar el efecto de la ingesta de carbohidratos sobre las concentraciones plasmáticas de glucosa ([glucosa]), ácidos grasos no eterificados ([NEFA]), y lactato ([La-]) antes y después de cada período de ciclismo de alta intensidad y corta duración a través del monitoreo de la disponibilidad de combustibles antes y después de cada prueba.
MÉTODOS
Enfoque Experimental del Problema
El diseño experimental fue desarrollado para imitar los escenarios competitivos donde los atletas realizan rondas de clasificación o eliminatorias para avanzar al evento final, tal como en el ciclismo de pista, eventos del atletismo de pista y campo y en la natación. La duración de la prueba se seleccionó en base a los tiempos de rendimiento en 3000 m persecución en ciclismo de pista y a los de carrera de 1500 m en pista y campo, los cuales son generalmente completados dentro de los 210-280 segundos, dependiendo del nivel de aptitud física. Estos eventos a veces necesitan que los atletas califiquen para la prueba final con una recuperación limitada entre los esfuerzos. Este estudio fue diseñado para examinar si la ingesta de carbohidratos afecta el rendimiento en la prueba por tiempo subsiguiente. Además, se valoraron variables sanguíneas para monitorear los cambios en la disponibilidad de sustratos, antes y después de cada prueba y para determinar el efecto de la ingesta de carbohidratos durante la recuperación sobre la disponibilidad de sustratos durante la segunda prueba.
Sujetos
Siete ciclistas varones de competición (media±DE; edad = 23±3 años; peso = 73.3±4.3 kg; talla = 1.81±0.02 mts; consumo de oxígeno pico (VO2 pico) = 4.58±0.5 l/min) participaron en este experimento. Todos los sujetos leyeron y voluntariamente dieron su consentimiento por escrito y completaron un cuestionario acerca de su historial de salud de acuerdo con las directivas establecidas por el Comité Consultivo para la Experimentación con Humanos de la Universidad de Kansas. Se requirió que los sujetos hubieran estado entrenando al menos 5 días por semana en los últimos 6 meses antes de la evaluación, o hubieran alcanzado un VO2 pico > 4.0 l/min (rango =4.10–5.67 l/min), y fueran ciclistas certificados por la Federación de Ciclismo de los Estados Unidos (categoría 4 hasta profesional). Los sujetos se abstuvieron de realizar ejercicios intensos y de consumir cafeína durante las 24 horas previas a la evaluación.
Diseño de la Investigación
Los sujetos fueron evaluados en 3 ocasiones. La evaluación inicial fue para determinar el VO2 pico de los sujetos y para que los sujetos se familiarizaran con el protocolo del test 100-kJ (100KJ-TEST). En las sesiones de evaluación 2 y 3 se realizaron los tratamientos en los cuales los sujetos realizaron un 100KJ-TEST, ingirieron 1 de las 2 bebidas de tratamiento, descansaron por 60 minutos y entonces realizaron un segundo 100KJ-TEST (SERIE-2). Las condiciones experimentales se administraron en la forma de doble ciego y fueron asignadas a cada sujeto aleatoriamente de forma equilibrada. Cada sesión de evaluación fue llevada a cabo a la misma hora del día, con un intervalo entre las sesiones de al menos 3 días y no más de 7 días. El coeficiente de variación de los 100KJ-TETS para estos ciclistas fue de 2.24 %.
Evaluación del Ejercicio
Durante la primera visita al laboratorio, se determino el VO2 pico mediante un test progresivo de ejercicio (GXT) utilizando un cicloergómetro con carga (Monark modificado 868) con interfase a una computadora. El GXT consistió de 5 min de entrada en calor a 90 rev/min y una potencia de 80 W. La entrada en calor fue seguida por etapas de 2 minutos en las cuales se incremento la carga en 40 W hasta que los sujetos llegaran al agotamiento. El cicloergómetro fue equipado con una varilla magnética para medir la velocidad de la rueda. La computadora calculó la potencia utilizando la velocidad de la rueda y el peso aplicado al freno de la misma. Los gases espirado fueron directamente a un sistema metabólico SensorMedics 2900 (Sensor Medics, Yorba Linda, CA) a través de una boquilla Hans-Rudolph que impedía la reinspiración (Hans-Rudolph, Kansas City, MO). El flujómetro y los analizadores de gases fueron calibrados antes de cada evaluación.
Treinta minutos después del GXT, cada sujeto realizó el 100KJ-TEST para familiarizarse con las condiciones de tratamiento. Para el 100KJ-TEST, cada sujeto realizó una entrada en calor de 7 minutos con el 50 % de la resistencia pico alcanzada durante el GXT pedaleando a 90 revoluciones/min. Durante la entrada en calor los sujetos realizaban un sprint de 5 segundos cada 60 segundos a partir del minuto 3 y hasta el minuto 6 para prepararse para las altas revoluciones que se realizarían durante el 100KJ-TEST. Los sujetos descansaron 3 minutos luego de la entrada en calor. Para el 100KJ-TEST, la resistencia fue incrementada hasta el 90 % de la resistencia pico alcanzada durante el GXT. La producción de potencia varío de acuerdo con la tasa de pedaleo (revoluciones/min) que cada sujeto sintiera que le permitiría completar la prueba en el menor tiempo posible. La única instrucción dada a los sujetos fue que completaran la prueba tan rápido como fuera posible. Cuando comenzaba el 100KJ-TEST, los sujetos generaraban 100 kJ tan rápido como fuera posible. Los sujetos eran informados verbalmente cuando se completaba el 25, 50, 75, 80, 85, 90 y 95 % del trabajo.
Para las dos condiciones de tratamiento, los sujetos se reportaron al laboratorio con 3 a 6 horas de estado post-absortivo. El estado post-absortivo fue elegido para simular las prácticas dietarias antes de las competiciones reales. Cada sujeto descanso en posición supina durante 15 minutos antes de la recolección inicial de las muestras sanguíneas. Luego de esto los sujetos se sentaban en el cicloergómetro y eran conectados al sistema metabólico. Los sujetos realizaron el primer 100KJ-TEST (SERIE-1) siguiendo los mismos procedimientos utilizados en la prueba de familiarización. Durante la SERIE-1, se midió el tiempo para completar el 100KJ-TEST (TIEMPO) y la potencia aeróbica (VO2 [l/min]) los cuales fueron utilizados como variables de rendimiento. Una vez finalizada la SERIE-1, se recolectaron muestras de sangre. Luego de esto los sujetos se sentaron e ingirieron la solución de tratamiento asignada para ese día. La intervención de tratamiento consistió en ingerir una solución al 20 % de 0.7 g/(kg de masa corporal) (5) de maltodextrina (Gatorlode CHO) o un volumen igual de PLC (aspartamo) igualado en sabor (Gatorade). Los sujetos ingirieron la bebida asignada dentro de los 2 minutos. Luego de la ingesta, los sujetos permanecían sentados en una silla, con las piernas elevadas, y se movían lo mínimo posible. Luego de 60 minutos de recuperación, se recolectaron nuevas muestras de sangre. Los sujetos completaron la SERIE-2 utilizando procedimientos de evaluación idénticos a los descritos previamente para la SERIE-1.
Dieta
Para monitorear la ingesta dietaria, cada sujeto registró los alimentos que consumió el día anterior y el día de cada sesión de tratamiento. Este registro de alimentos fue utilizado para valorar la ingesta calórica total y la ingesta de carbohidratos antes de cada tratamiento. Para alcanzar patrones nutricionales similares, el registro inicial de alimentos fue utilizado como menú para el día anterior y para el día de la última sesión. La ingesta calórica total y el contenido de carbohidratos fue analizado a por medio del registro dietario utilizando el programa Food Processor software (v 7.01; ESHA Research, Salem, OR)
Recolección y Análisis de la Sangre
La sangre venosa (~4 ml) se recolectó de la vena del antebrazo entes de la SERIE-1 (PRE-1), 2 minutos después de la SERIE-1 (POST-1), después de los 60 minutos de recuperación (PRE-2) y 2 minutos después de la SERIE-2 (POST-2). Cada muestra, ~3.5 ml fue colocada en un tubo vacutainer que contenía ácido etilenediaminetetraacetico y fue inmediatamente centrifugado durante 10 minutos a 10 ºC. El plasma fue extraído y congelado a –70 ºC para los posteriores análisis de la [glucosa] plasmática (Sigma kit #315-100; Sigma Chemical Co., St. Louis, MO) y [NEFA] (ACS-ACOD method; Wako Chemicals, Richmond, VA) utilizando espectrofotometría (Beckman, Fullerton, CA). Los restantes 0.5 ml de sangre fueron inmediatamente analizados para determinar la [La-] (YSI 1500 L-Sport Lactate Analyzer; Yellow Springs Instruments, Yellow Springs, OH), concentración de hemoglobina (Sigma kit #525-A; Sigma) utilizando espectrofotometría y para la determinación del hematócrito utilizando el método de microcapilaridad. Los valores de la hemoglobina y del hematócrito fueron utilizados para calcular los cambios en el volumen plasmático (11) y subsiguientemente para corregir las concentraciones de todas las variables sanguíneas. Todos los análisis fueron realizados en duplicado.
Análisis estadísticos
Para determinar la interacción y los efectos principales entre los tratamientos se utilizo el análisis de varianza de 2 vías para mediciones repetidas (tratamiento por tiempo) (Statistica software, StatSoft, Tulsa, OK). Para valorar las diferencias intra grupo y para analizar las diferencias en la ingesta dietaria de 48 hs para cada sujeto se utilizó la prueba t. La significancia fue establecida a p ≤0.05. Todos los valores se presentan como medias±DE.
RESULTADOS
El promedio de ingesta energética durante los 2 días anteriores al ejercicio fue 21.0±3.3 MJ y 20.6±3.5 MJ para los grupos CHO y PLC, respectivamente. La media de ingesta de carbohidratos fue de 639.2±180.8 g y 631.8±194.2 g para los grupos CHO y PLC respectivamente. No hubo diferencias significativas entre o dentro de los tratamientos para el total de energía consumida o para la ingesta de carbohidratos en los días anteriores a la evaluación.
La tabla 1 ilustra el tiempo y el VO2 para cada 100KJ-TEST. No hubo diferencias significativas entre los grupos CHO y PLC en el TIEMPO o en el VO2 en la SERIE-1. La ingesta de carbohidratos líquidos no tuvo un efecto significativo entre o dentro de los tratamientos para el TIEMPO o el VO2 en la SERIE-2.

Tabla 1. Resumen de las variables de rendimiento para cada condición de
tratamiento (n=7). Los valores son presentados como medias±DE. SERIE-1 =primer
protocolo del test 100kJ, SERIE-2 = segundo protocolo del test 100kJ; CHO =Gatorlode;
PLC =Placebo; TIEMPO =Tiempo para completar el 100KJ-TEST; VO2
=potencia aeróbica. * No hubo diferencias significativas (p>0.05) entre o dentro
de los grupos.
Hubo un efecto de interacción significativo para la [glucosa] plasmática luego de la ingesta de las bebidas de tratamiento (Figura 1). No se observaron diferencias significativas entre o dentro de los tratamientos en PRE-1 o POST-1. Durante el período de 60 minutos de recuperación, el tratamiento con CHO resulto en un incremento en la [glucosa] plasmática (p=0.044). A la inversa, la [glucosa] plasmática en el grupo PLC disminuyó durante el período de recuperación de 60 minutos. En el POST-2, ocurrió un efecto de interacción significativo, con una reducción en la [glucosa] plasmática en el grupo CHO y un incremento en el grupo PLC.
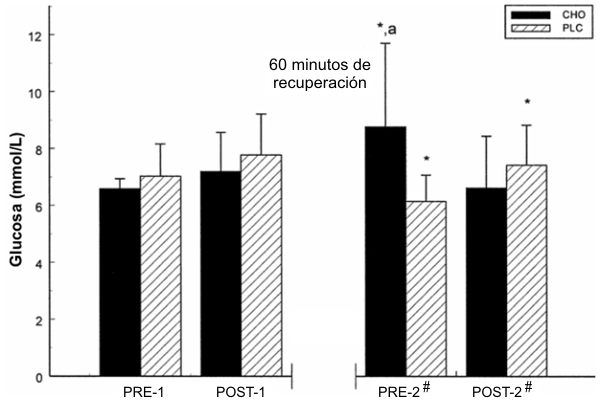
Figura 1. Concentración media de glucosa para el grupo CHO (barras sólidas) y
para el grupo PLC (barras a rayas) antes y después de cada 100KJ-TEST; n=7; *
significativamente diferente con respecto al punto del tiempo anterior; # efecto
de interacción relativo al punto del tiempo anterior (e.g., el valor se
incremento para un tratamiento y descendió para otro); a, diferencia
significativa entre los grupos en cualquier punto del tiempo. Los valores son
presentados como medias±DE. CHO =Gatorlode; PLC =placebo; 100KJ-TEST =protocolo
del test 100-kJ
Para la [NEFA], hubo un efecto de interacción (p=0.04) entre los tratamientos durante los 60 minutos de recuperación (Figura 2). Con el tratamiento con PLC, la [NEFA] se incrementó (p=0.030) en POST-2 en relación al tratamiento con CHO. El valor obtenido en POST-2 para el tratamiento con PLC también se incremento (p=0.016) en relación al valor obtenido en POST-1.
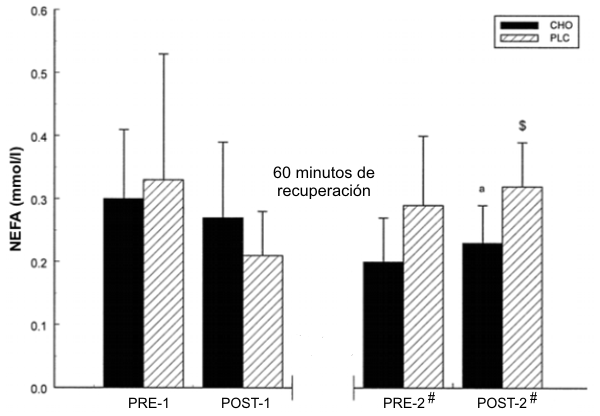
Figura 2. Concentración media de NEFA para el grupo CHO (barras sólidas) y para
el grupo PLC (barras a rayas), antes y después de cada 100KJ-TEST; n=7; $,
significativamente diferente con respecto a POST-1 para ese tratamiento; #
efecto de interacción relativo al punto del tiempo anterior (e.g., el valor se
incremento para uno de los tratamientos y disminuyó para el otro); a, diferencia
significativa entre los grupos en cualquier punto del tiempo. Los valores
representan la media±DE. CHO =Gatorlode; PLC =placebo; 100KJ-TEST =protocolo del
test 100-kJ; NEFA =ácidos grasos no esterificados; POST-1 = muestras de sangre
tomadas luego del 100KJ-TEST.
No se observaron diferencias significativas en la [La-] entre los tratamientos en cualquier momento de las mediciones (Figura 3). Desde PRE-1 hasta POST-2, la [La-] se incrementó significativamente tanto en el grupo CHO como en el grupo PLC. En PRE-2, ambos tratamientos experimentaron una reducción significativa en la [La-] en relación al valor en POST-1, pero la misma se mantuvo significativamente elevada para los dos grupos en relación al valor de PRE-1 (CHO, p=0.007; PLC, p=0.011). En POST-2, la [La-] fue significativamente mayor que en PRE-1 y PRE-2 para ambos tratamientos.
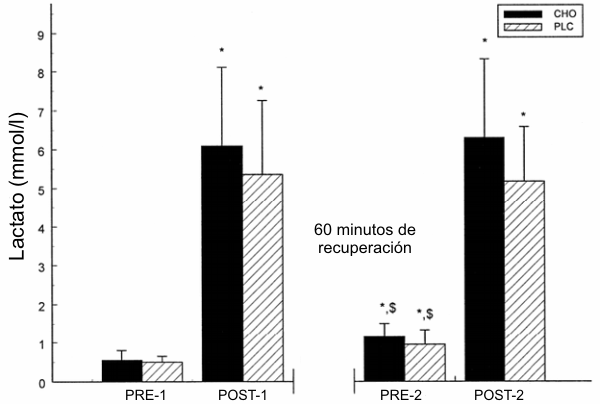
Figura 3. Concentración media de lactato para el grupo CHO (barras sólidas) y
para el grupo PLC (barras a rayas) antes y después de cada 100KJ-TEST; n=7; *
significativamente diferente con respecto al punto en el tiempo anterior; $,
significativamente diferente con respecto a PRE-1. Los valores representan la
media±DE. CHO =Gatorlode; PLC =placebo; [La-] = concentración de lactato; PRE-1
=muestras de sangre tomadas antes del 100KJ-TEST.
DISCUSIÓN
Los principales y más novedosos hallazgos de esta investigación fueron que la ingesta de carbohidratos luego de una prueba inicial de alta intensidad en ciclistas varones resulto en que (a) no hubo cambios en el tiempo de la prueba subsiguiente realizada 1 hora después y (b) hubo cambios significativos entre los tratamientos para la [glucosa] y [NEFA] plasmática, pero no para la [La-]. Esta falta de diferencia en el rendimiento respalda el concepto de que los resultados obtenidos en otras investigaciones en donde se utilizaron sujetos moderadamente entrenados (15) y protocolos no específicos del deporte (2, 3) no pueden ser generalizados a los atletas de competición. Además, los rendimientos en las subsiguientes pruebas de tiempo parecen depender de otros factores más que de la abundancia de substratos circulantes.
En comparación con los presentes resultados, otros autores han observado (2, 3, 5) que, el rendimiento en ejercicios de corta duración y máximo esfuerzo disminuye luego recuperarse durante 60 minutos de un período previo de ejercicios de alta intensidad en sujetos saludables o moderadamente entrenados, cuando no se ingieren componentes nutricionales durante la recuperación. Aunque, cuando las reservas de glucógeno son elevadas, el rendimiento durante la segunda serie se mantuvo (2). Haub y cols. (15) observaron una disminución en el rendimiento en la segunda prueba de tiempo con la condición PLC, mientras que el rendimiento en la segunda prueba de tiempo se mantuvo cuando se ingirieron CHO durante el período de recuperación de 60 minutos. Los resultados de la presente investigación no coinciden con estas observaciones previas (15), debido a que los sujetos pudieron mantener el rendimiento en la prueba de tiempo durante la SERIE-2 sin tener en cuenta el tratamiento. Además, el mínimo cambio en el rendimiento de ~2 % en el grupo PLC del presente estudio es de la misma magnitud que el grado de cambio observado para los sujetos que ingirieron CHO (15) y para aquellos con elevados niveles de glucógeno antes de la evaluación (2). Debido a que no se realizaron muestras de tejido muscular en el presente estudio, fue imposible saber el contenido inicial de glucógeno muscular antes de las pruebas de tiempo. Algunos pueden considerar que la mínima diferencia en el rendimiento entre los grupos CHO y PLC en la SERIE-2 es significativa, pero que dado el desvío estándar de los valores del TIEMPO, la diferencia observada no puede considerarse significativa.
De acuerdo con Butterfield (6), para determinar los efectos ergogénicos de los suplementos nutricionales, el diseño de investigación debe ser específico del deporte, utilizando situaciones de competición y sujetos que participen en dicho deporte. El protocolo de ejercicio de extensiones de rodilla a una pierna utilizado previamente (2, 3), no es representativo de lo que un atleta encontraría durante una competencia. Además, los atletas muy raramente compiten con el campeón, el cual es capaz de desempeñarse por el mayor período de tiempo a una determinada intensidad. Por el contrario, en la mayoría de los casos, el evento competitivo implica que el atleta trate de cubrir una distancia dada tan rápido como sea posible. Asimismo, los sujetos en las investigaciones de Bangsbo y Saltin (3) y de Haub y cols. (15) no estaban entrenados para competir utilizando los protocolos asignados. Por lo tanto, puede ser difícil que sus resultados se generalicen al escenario deportivo (6). Los sujetos en el presente estudio eran ciclistas entrenados. Asimismo, cada sujeto completo la misma cantidad de trabajo con un esfuerzo “máximo”, de la misma manera que en la competencia. La diferencia en el rendimiento se basó en cuan rápido los sujetos fueron capaces de pedalear hasta completar el trabajo.
La disminución en la [glucosa] plasmática durante el período de recuperación de 60 minutos en el grupo PLC fue probablemente resultado de la remoción de glucosa desde la circulación debido al incremento en las proteínas transportadoras de glucosa (GLUT-4) inducido por el ejercicio en la superficie de la membrana del sarcolema (10). El incremento en la [glucosa] plasmática durante la recuperación debido a la ingesta de carbohidratos era de esperarse y fue similar a lo observado previamente utilizando este protocolo (15). Para nuestro conocimiento, no existen investigaciones que hallan examinado el efecto de la ingesta de glucosa luego de la realización de ejercicios de corta duración y alta intensidad sobre la captación de glucosa en atletas entrenados. El incremento significativo en la [glucosa] plasmática desde PRE-2 hasta POST-2 para el grupo PLC fue probablemente el resultado del incremento en la producción de glucosa hepática en respuesta al incremento en los niveles de glucagón y catecolaminas. Se ha mostrado que estas hormonas se incrementan luego del ejercicio de corta duración y de alta intensidad (21). El efecto significativo entre los tratamientos observado desde PRE-2 hasta POST-2 fue probablemente resultado de los efectos supresores de la insulina sobre la secreción de glucagón desde el páncreas y de la inhibición de la producción de glucosa hepática (16). Además, la captación de glucosa puedo haberse incrementado durante la SERIE-2 en el grupo CHO debido a los efectos aditivos de la insulina y las contracciones musculares sobre el aumento del transporte de glucosa (10). Esto probablemente ocurrió debido a que la captación de glucosa durante el ejercicio está regulada por el flujo sanguíneo a través del tejido activo, el cual se incrementa luego del entrenamiento (1), y debido a que la insulina disminuye los efectos inhibitorios de la glucosa-6-fosfato sobre la glucógeno fosforilasa (4).
Los cambios en la [NEFA] que ocurrieron fueron los esperados. Luego de la ingesta de una bebida a base de carbohidratos, la [NEFA] disminuyó, mientras que durante el tratamiento con PLC la [NEFA] se incrementó, resultando en un efecto de interacción entre los tratamientos. La secreción asociada de insulina, luego de la ingesta de la bebida a base de carbohidratos, reduce los niveles circulantes de NEFA por medio de la supresión de la lipasa sensible a las hormonas, la cual es la encima clave de la lipólisis (7). La insulina fosforila a la fosfodiesterasa y lleva a una reducción en la adenosina monofosfato cíclica y de la actividad de la lipasa sensible a las hormonas (13). Mientras que durante el tratamiento con PLC, los mismos sujetos estuvieron probablemente sin la influencia reguladora de un elevado nivel de insulina y por lo tanto la actividad de la HSL estuvo elevada para movilizar ácidos grasos no esterificados en respuesta a los niveles incrementados de catecolaminas que tienden a ocurrir en respuesta al ejercicio realizado con el máximo esfuerzo (8). La diferencia significativa entre los tratamientos en POST-2 pudo haber resultado de la supresión continua de la insulina sobre la liberación de NEFA (7).
Los cambios significativos en la [La-] fueron esperados, con un incremento significativo luego de la SERIE-1 y de la SERIE-2 tanto en el grupo CHO como en el grupo PLC. Además, debido a que el trabajo realizado durante cada serie fue idéntico y el TIEMPO y el VO2 fueron similares para los grupos CHO y PLC, la falta de diferencia entre los tratamientos no es sorprendente, ya que la [La-] en sangre parece estar inherentemente ligada a la tasa de glucogenólisis y a la cantidad de trabajo realizado (8). Asimismo, la recuperación de 60 minutos no fue los suficientemente larga como para que los niveles de lactato retornaran a los niveles previos al ejercicio.
Para resumir, la ingesta de carbohidratos luego de una prueba de tiempo de corta duración no mejora el rendimiento en la subsiguiente prueba de tiempo de corta duración en ciclistas de competición, pero altera significativamente la [glucosa] plasmática y la [NEFA] en relación con la condición PLC. Es probable que en los ciclistas entrenados halla otros factores, más que de la biodisponibilidad de los combustibles circulantes, que influencien el rendimiento en el ejercicio subsiguiente de corta duración y alta intensidad, tal como los cambios en el sistema nervioso central (19). Los presentes resultados contrastan con los observados con individuos menos entrenados (15) y con protocolos no específicos del deporte (2).
Aplicaciones Prácticas
Los ciclistas y otros atletas competitivos continuamente buscan medios nutricionales para mejorar el rendimiento. Durante los eventos competitivos, a veces se requiere que los atletas compitan en múltiples eventos con poco tiempo entre cada uno para recuperarse adecuadamente. En un esfuerzo para mejorar el rendimiento durante las rondas de competencia subsiguientes, los atletas pueden ingerir compuestos o alimentos durante el período recuperación. En la presente investigación no se observaron diferencias en la segunda prueba de tiempo cuando los sujetos ingirieron tanto carbohidratos como placebo luego de la primera prueba de tiempo. Los ciclistas no experimentaron un cambio en el rendimiento; esto puedo haber resultado de la utilización de estrategias de ritmo de carrera o de adecuados niveles disponibles de sustratos (o ambos) durante el segundo esfuerzo. Como no disponíamos del control nutricional de los 3-5 días anteriores a la evaluación, es difícil obtener resultados concluyentes. Sin embargo, los atletas no tienen idénticos comportamientos de alimentación por lo que el control dietario pudo no haber tenido utilidad cuando se aplican estos resultados a la competición atlética. Dados los resultados y el escenario implicados con esta investigación, los ciclistas pueden elegir si ingieren carbohidratos líquidos durante la recuperación sin influenciar significativamente el rendimiento posterior.
Agradecimientos
Los autores agradecen a los Doctores Neil Salkind y Karen White por su ayuda con los análisis estadísticos y al Dr. Alex Koch, a la Dra. Karen Kuphal, a Eric Burgett y a Travis Perret por la asistencia técnica. Esta investigación estuvo respaldada por el Student Research Award del Gatorade Sports Science Institute, Barrington, IL.
Dirección para el envío de correspondencia
Dr. Mark D. Haub; correo electrónico: haub@humec.ksu.edu
Referencias
1. Armstrong, R.B., and M.H. Laughlin (1984). Exercise blood flow patterns within and among rat muscles after training. Am. J. Physiol. 246: H. 59H68
2. Bangsbo, J., T.E. Graham, B. Kiens, and B. Saltin (1992). Elevated muscle glycogen and anaerobic energy production during exhaustive exercise in man. J. Physiol. (Lond.). 451:205227
3. Bangsbo, J., and B. Saltin (1993). Recovery of muscle from exerciseIts importance for subsequent performance. Intermittent High Intensity Exercise: Preparation, Stress, and Damage Limitation
4. Bessman, S., and P. Geiger (1980). Compartmentation of hexokinase and creatine phosphokinase, cellular regulation, and insulin action. Curr. Top. Cell Regul. 16:5586
5. Blom, P.C., A.T. Hostmark, O. Vaage, K.R. Kardel, and S. Maehlum (1987). Effect of different post-exercise sugar diets on the rate of muscle glycogen synthesis. Med. Sci. Sports Exerc. 19:491496
6. Butterfield, G (1996). Ergogenic aids: Evaluating sport nutrition products. Int. J. Sport Nutr. 6:191197
7. Campbell, P.J., M.G. Carlson, J.O. Hill, and N. Nurjhan (1992). Regulation of free fatty acid metabolism by insulin in humans: Role of lipolysis and reesterification. J. Physiol. 263: E. 1063E1069
8. Carey, G.B (1998). Mechanisms regulating adipocyte lipolysis. Adv. Exp. Med. Biol. 441:157170
9. Cheetham, M.E., L.H. Boobis, S. Brooks, and C. Williams (1986). Human muscle metabolism during sprint running. J. Appl. Physiol. 61:5460
10. Cortright, R.N., and G.L (1997). Dohm. Mechanisms by which insulin and muscle contraction stimulate glucose transport. Can. J. Appl. Physiol. 22:519530
11. Dill, D.B., and D.L. Costill (1974). Calculation of percentage changes in volumes of blood, plasma, and red cells in dehydration. J. Appl. Physiol. 37:247248
12. El-Sayed, M.S., J. Balmer, and A.J. Rattu (1997). Carbohydrate ingestion improves endurance performance during a 1 h simulated cycling time trial. J. Sports Sci. 15:223230
13. Eriksson, H., M. Ridderstrale, E. Degerman, D. Ekholm, C.J. Smith, V.C. Manganiello, P. Belfrage, and H. Tornqvist (1995). Evidence for the key role of the adipocyte cGMP-inhibited cAMP phosphodiesterase in the antilipolytic action of insulin. Biochim. Biophys. Acta. 1266:101107
14. Febbraio, M.A., A. Chiu, D.J. Angus, M.J. Arkinstall, and J.A. Hawley (2000). Effects of carbohydrate ingestion before and during exercise on glucose kinetics and performance. J. Appl. Physiol. 89:22202226
15. Haub, M.D., J.A. Potteiger, D.J. Jacobsen, K.L. Nau, L.A. Magee, and M.J. Comeau (1999). Glycogen replenishment and repeated maximal effort exercise: Effect of liquid carbohydrate. Int. J. Sport Nutr. 9:406415
16. Howlett, K., D. Angus, J. Proietto, and M. Hargreaves (1998). Effect of increased blood glucose availability on glucose kinetics during exercise. J. Appl. Physiol. 84:14131417
17. Jeukendrup, A., F. Brouns, A.J. Wagenmakers, and W.H. Saris (1997). Carbohydrate-electrolyte feedings improve 1 h time trial cycling performance. Int. J. Sports Med. 18:125129
18. Klausen, K., and G. Sjogaard (1980). Glycogen stores and lactate accumulation in skeletal muscle of man during intense bicycle exercise. Scand. J. Sports Sci. 2:712
19. McConell, G., K. Kloot, and M. Hargreaves (1996). Effect of timing of carbohydrate ingestion on endurance exercise performance. Med. Sci. Sports Exerc. 28:13001304
20. Medbo, J.I (1993). Glycogen breakdown and lactate accumulation during high-intensity cycling. Acta Physiol. Scand. 149:8589
21. Naveri, H., K. Kuoppasalmi, and M. Harkonen (1985). Plasma glucagon and catecholamines during exhaustive short-term exercise. Eur. J. Appl. Physiol. 53:308311
22. Spriet, L.L., M.I. Lindinger, R.S. McKelvie, G.J.F. Heigenhauser, and N.L. Jones (1989). Muscle glycogenolysis and H+ concentration during maximal intermittent cycling. J. Appl. Physiol. 66:813