Envejecimiento y Actividad Física
Publicado 14 de enero de 2015, 16:17
Este es un fragmento de uno de los apuntes de cátedra de la asignatura "Fisiología del Envejecimiento" del módulo 1 del Posgrado de Actividad Física en Adultos Mayores.
Autor: Lic. Sebastián Del Rosso.
2.1 INTRODUCCIÓN AL IMPACTO DE ENEVEJECIMIENTO Y LA ACTIVIDAD FÍSICA
La mayoría de los individuos, incluso sin los efectos de enfermedades o de un estilo de vida sedentario, vivirán lo suficiente paracruzar un importante umbral funcional que hará que sus tareas cotidianas resulten cada vez más difíciles (Young, 1986). Los efectos de un estilo de vida sedentario y las enfermedades aceleran estos procesos de pérdida funcional. Los sistemas cardiorrespiratorio, músculo-esquelético, endócrino y nervioso desempeñan un papel importante en el mantenimiento de la capacidad funcional. Además el peso corporal también tiene su impacto en relación con este umbral funcional que al que hicimos mención previamente. El envejecimiento está asociado con un incremento en el porcentaje de grasa corporal (Jackson et al., 1995). En ausencia de otros cambios, la acumulación de 15 kg de grasa corporal en un hombre conuna masa corporal inicial de 70 kg reduce el transporte de oxígeno en un 18%, casi la mitad de la pérdida observada por el envejecimiento (Shephard, 1994). En la mayoría de los sistemas, el impacto del envejecimiento sobre las actividades funcionales cotidianas se vuelve notorio a partir de los 30-40 años de edad (Spirduso et al., 2005). Por lo tanto en las siguientes secciones estudiaremos como repercute el proceso de envejecimiento sobre los sistemas cardiorrespiratorio, músculo-esquelético, hormonal, neuro-muscular e inmunológico y cuál es el papel de la actividad física para reducir la disminución funcional asociada con el envejecimiento.
|
Punto Clave
Los sistemas cardiorrespiratorio, músculo-esquelético, endócrino y nervioso desempeñan un papel importante en el mantenimiento de la capacidad funcional. En la mayoría de los sistemas, el impacto del envejecimiento sobre las actividades funcionales cotidianas se vuelve notorio a partir de los 30-40 años de edad |
2.2 SISTEMA CARDIOVASCULAR Y RESPIRATORIO
Las consecuencias prácticas del envejecimiento sobre
el sistema cardiovascular son un cambio progresivo en la morfología y la
función del sistema cardiovascular y un incremento en el número de desórdenes
cardiovasculares asociados con el envejecimiento (ACSM, 1998, Shephard,
1994). Los principales cambios morfológicos del sistema cardiovascular con
el envejecimiento se producen en la estructura y en las cámaras cardíacas, en
el sistema de conducción (venas, arterias, etc.) y en las coronarias y otras
arterias elásticas. También se produce una reducción en el volumen mitocondrial
y en la actividad oxidativa de las enzimas de las células cardíacas (Lakatta, 1993). La reducida capacidad del corazón para suministrar
oxígeno a los músculos activos (debido a la reducción del gasto cardíaco
máximo, del volumen latido máximo y la reducción de la sensibilidad simpática y
la pérdida de contractilidad intrínseca) es una característica normal del
envejecimiento (ACSM, 1998, Lakatta,
1993). El corazón se vuelve ligeramente hipertrófico con una reducida
sensibilidad a la estimulación simpática (pero no parasimpática), por lo que el
incremento en la frecuencia cardíaca inducido por el ejercicio y la
contractilidad del miocardio son menores en los individuos ancianos (ACSM, 2000, Hollenberg et al., 2006). La presión sanguínea es generalmente mayor en los individuos
ancianos, especialmente durante el ejercicio (Stratton et al., 1994). De todas maneras la función cardíaca de adultos
mayores saludables generalmente es adecuada para cubrir las necesidades
corporales, al menos para actividades submáximas (Shephard, 1994). El gasto cardíaco es el producto de la frecuencia
cardíaca y del volumen latido y estos tres parámetros están reducidos en los
individuos ancianos, aunque es difícil aislar si esto se debe a un proceso
inherente de envejecimiento o a la reducción de la actividad física o a cambios
patológicos acumulativos (Brach et al., 2004,
Jackson et al., 1995, Sesso et al., 2000). Para investigar esto McGuire et al (2001) realizaron un seguimiento
de 5 sujetos durante 30 años, evaluándolos inicialmente en 1966. En este
estudio se evaluó la capacidad de ejercicio de los sujetos (consumo de oxígeno),
el volumen cardíaco (mediante análisis radiográfico), la frecuencia cardíaca de
reposo y ejercicio, la presión sanguínea de reposo y ejercicio, el volumen
ventilatorio y el gasto cardíaco. Los resultados generes de este estudio
mostraron que: Comparado con los datos iniciales de 1966, se hallaron ciertas
tendencias interesantes a pesar de la falta de significancia estadística. El VO2máx
absoluto disminuyó en un 11% (3.3 versus 2.9 L·min-1). De la misma
manera, se observaron disminuciones en el consumo máximo de oxigeno relativo al
peso corporal total (43 versus 31 mL·kg-1·min-1), y
relativo a la masa libre de grasa (49.7 versus 42.9 ml·kg de masa libre de
grasa-1·min-1). El 6% de disminución en la frecuencia
cardiaca máxima (FCmáx.; 193 versus 181 latidos·min-1) fue
equilibrado por un incremento del 16% en el volumen sistólico máximo (VSmax;
104 verus 121 mL). Notablemente, no hubo una disminución en al gasto cardiaco
máximo a lo largo del intervalo de 30 años (20.0 vs 21.4 L·min-1).
La diferencia a-v de O2 máxima disminuyo en un 17% (16.2 versus 13.8
vol%). Al analizar estos datos vemos que el envejecimiento parece afectar el
consumo de oxígeno (tanto absoluto como relativo) y la frecuencia cardíaca
máxima, no obstante hay que tener en cuenta que dentro de la muestra hubo
sujetos sedentarios, activos y deportistas por ello es importante analizar (en
este caso) los datos en forma individual.
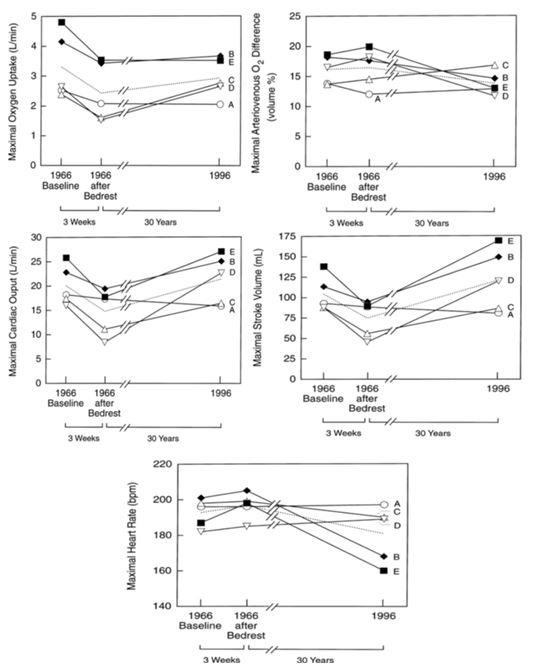
Figura 1. Datos del consumo máximo de oxígeno (panel superior izquierdo), diferencia arterio-venosa de O2 (panel superior derecho), gasto cardíaco máximo (panel medio izquierdo), volumen latido máximo (panel medio derecho) y de la frecuencia cardíaca máxima (panel inferior) al comienzo del estudio (1966) yluego de 30 años de seguimiento. Las letras A a la E hacen referencia a los datos de cada sujeto (McGuire et al., 2001).
En la Figura 1 se encuentran las curvas individuales para el consumo de oxígeno, la diferencia arterio-venosa de O2, el gasto cardíaco máximo, el volumen latido máximo y la frecuencia cardíaca máxima. En la mayoría de los casos, el consumo máximo de oxígeno, la diferencia arterio-venosa de O2 y la frecuencia cardíaca máxima disminuyeron con la edad. En contraposición se observa un incremento del volumen latido máximo y del gasto cardíaco máximo lo que muestra una mayor dependencia del mecanismo de Frank-Starling para compensar la reducción en la frecuencia cardíaca máxima, cuya reducción parece estar asociada a la menor sensibilidad cardíaca a la estimulación simpática. Al parecer, incluso los adultos mayores saludables, tienen un mecanismo de reserva para mantener el gasto cardíaco y por lo tanto pueden ser más vulnerables a la descompensación cuando se superpone una enfermedad (Abrass, 1990). En relación con la función pulmonar, la capacidad pulmonar total no parece cambiar con la edad, pero la capacidad funcional y el volumen residual declinan con el incremento de la edad (Pride, 2005). También hay una pérdida de elasticidad de los tejidos debido a la mayor cantidad de puentes cruzados entre las moléculas de colágeno, incrementando la rigidez y la elasticidad de los alveolos (e.g., reducción de la capacidad vital).La declinación con la edad en el volumen espiratorio forzado en un segundo (FEV1), la FEV1/Capacidad vital (CV) y en el flujo máximo con diferentes volúmenes pulmonares de gran importancia práctica. Estos cambios se deben, en parte, a la menor capacidad vital, pero también la FEV1/CVtambién declina con la edad. Recientemente se ha hallado que la limitación en el flujo espiratorio durante la respiración corriente en reposo es común entre los adultos mayores y esto puede reducir adicionalmente la reserva ventilatoria durante el ejercicio (Pride, 2005).
En resumen, el proceso de envejecimiento parece afectar tanto el sistema cardiocirculatorio como el sistema respiratorio y esto deriva en la reducción del consumo máximo de oxígeno y por lo tanto del esfuerzo necesario para realizar una tarea dada.
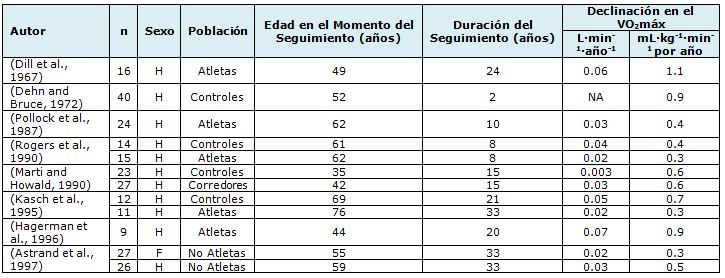
Tabla 1. Resumen de estudios longitudinales que evaluaron la declinación de VO2máx asociada con el envejecimiento. (McGuire et al., 2001)
Se ha indicado que los valores del VO2máx declinan desde 42-50 mL·kg-1·min-1
en hombres y de 35-40 mL·kg-1·min-1 en mujeres a valores
de 25-30 mL·kg-1·min-1 en ambos sexos a la edad de 65
años (Shephard, 1994). Las pérdidas adicionales que se produzcan durante los 65 años de vida
resultarán en que una tarea que antes era relativamente sencilla y requería
poco esfuerzo, durante la vejez requiera un mayor porcentaje del máximo de
reserva (Figura 1superior). Por ejemplo, un hombre anciano requerirá un esfuerzo
físico mayor que el de una mujer joven para llevar a cabo un mismo ejercicio.
Esta reducción de los márgenes de seguridad entre la función normal y el valor
funcional umbral para actividades cotidianas importantes, significa que incluso
una enfermedad menor puede hacer que un individuo anciano sea incapaz de
realizar dichas tareas sin asistencia (Figura 1superior). La ADNFS (Allied
Dunbar National Fitness Survey) sugiere un umbral de capacidad aeróbica para
caminar confortablemente a una velocidad lenta (4.8 km por hora). En este
reporte se sugirió que caminar a un ritmo confortable requiere que el costo de
oxígeno sea menor al 50% del consumo máximo de oxígeno. Sin embargo, se ha
observado que casi la mitad de las mujeres y una significativa proporción de
hombres por encima de los 55 años no tienen la capacidad aeróbica necesaria
para caminar a esta velocidad (Figura 2 inferior)
2.3 SISTEMA MÚSCULO-ESQUELÉTICO Y ARTICULAR
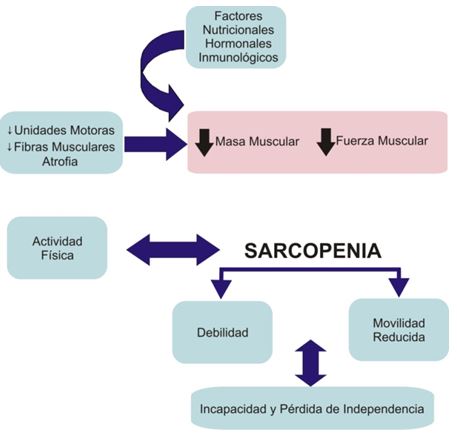
La sarcopenia, la pérdida de masa muscular asociada con el envejecimiento, es una de las principales causas de debilidad muscular y reducción de la capacidad motora en los adultos mayores (Bosco and Komi, 1980, Young, 1997). Si bien la sarcopenia está relacionada principalmente con un proceso neural, entre los factores que pueden contribuir a este proceso se encuentran los factores nutricionales, hormonales e inmunológicos así como también la reducción de la actividad física. Sin embargo, la sarcopenia por sí sola no da cuenta completamente de la debilidad muscular observada en los adultos mayores, ya que la pérdida de fuerza es mayor que la que puede explicarse por la reducción en el tamaño muscular. En esta sección examinaremos algunos de los factores que afectan el sistema músculo-esquelético y articular con el envejecimiento.
Envejecimiento y metabolismo de las proteínas musculares
La estructura y composición de los músculos esqueléticos cambia con el avance de la edad; se produce una infiltración de grasas y tejido conectivo, una pérdida de proteínas musculares y una reducción del área de sección cruzada (Parise and Yarasheski, 2000). La pérdida de proteínas musculares con la edad está relacionada a la pérdida de función y a la incapacidad para realizar actividades de la vida diaria. Además, las proteínas musculares proveen aminoácidos para otros procesos metabólicos. Por lo tanto, es importante mantener adecuadas reservas de aminoácidos musculares a medida que envejecemos (Yarasheski, 2003). El propósito de esta sección es describir como el envejecimiento afecta la tasa de síntesis de proteínas musculares. Diversos estudios han mostrado que los aminoácidos puros pueden estimular la síntesis de proteínas musculares y mejorar el balance neto de proteínas en individuos jóvenes y ancianos (Paddon-Jones et al., 2004, Rasmussen et al., 2002, Volpi et al., 1998, Volpi et al., 2003, Volpi et al., 1999). Si bien los adultos mayores tienen una incrementada extracción esplénica de los aminoácidos administrados oralmente (i.e., inmediatamente luego de la absorción), esto no parece influenciar la concentración sistémica de aminoácidos, lo cual afectará el efecto anabólico de los aminoácidos (Volpi et al., 1999). Los aminoácidos esenciales, en particular, son capaces de estimular la síntesis de proteínas musculares en los ancianos, mientras que los aminoácidos no esenciales no parecen proveer beneficios adicionales con respecto a la deposición y anabolismo de las proteínas musculares. Debido a que se ha reportado que la degradación de proteínas musculares se mantiene esencialmente sin cambios con el avance de la edad (Hasten et al., 2000, Rasmussen et al., 2002, Volpi et al., 2000, Volpi et al., 2001, Welle et al., 1995), se han llevado a cabo diversos estudios para examinar la influencia del envejecimiento sobre la síntesis de proteínas musculares tanto en estado basal (post-absortivo) y post-prandial. Si bien algunos investigadores han reportado una reducción en la tasa de síntesis de proteínas musculares en estado basal con el envejecimiento (Balagopal et al., 1997, Welle et al., 1993), otros no pudieron confirmar estos hallazgos en individuos ancianos que exhibían una reducción en la masa muscular. Las razones de estas discrepancias aun no son claras, pero es probable que las diferencias en el estatus nutricional y el nivel de actividad física de las diferentes muestras haya desempeñado un rol significativo. Recientes estudios sugieren que la respuesta de la síntesis de proteínas a la ingesta de alimentos está reducida en los ancianos (Koopman and van Loon, 2009) y se cree que esto representa un factor responsable de la declinación asociada al envejecimiento en la masa muscular. La actividad física, por otro lado, estimula la acumulación post-ejercicio de proteínas musculares tanto en jóvenes como en ancianos; sin embargo, esto último depende en gran medida del momento de la administración de aminoácidos y/o proteínas, antes, durante y/o después del ejercicio (Koopman and van Loon, 2009). Al parecer el entrenamiento con sobrecarga representa una estrategia terapéutica efectiva para aumentar la masa muscular y el rendimiento funcional de los ancianos, y esto último muestra que la capacidad de la maquinaria sintética de proteínas musculares para responder a estímulos anabólicos en los ancianos está preservada (Koopman and van Loon, 2009)
Sarcopenia y envejecimiento: influencia del sexo y la actividad física
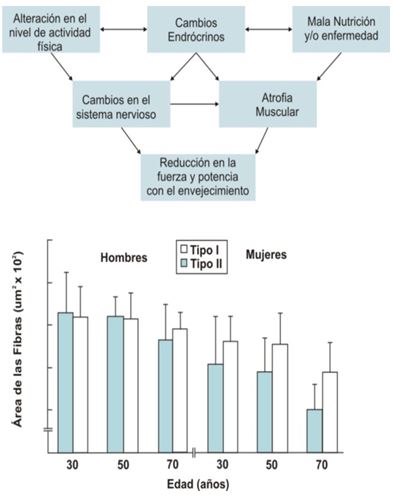
Existen múltiples factores interrelacionados que contribuyen al desarrollo y progresión de la sarcopenia (Figura 4). Estos factores, sin duda, contribuyen en diferentes grados a la pérdidaasociada con la edad de masa muscular, fuerza, y en el grado de desmejora funcional en hombres y mujeres ancianos (Doherty, 2003). La sarcopenia es diferente de otras condiciones que resultan en la pérdida de tejido muscular, tales como la cachexia y la emaciación. Roubenoff (2001) distingue entre la emaciación, la cachexia y la sarcopenia. La emaciación se refiere a la perdida no intencional de peso corporal, que incluye a la masa grasa y la masa libre de grasa, y se produce por una ingesta dietaria inadecuada que resulta en un balance energético negativo. La cachexia se refiere a la pérdida de masa libre de grasa, pero con poca o sin pérdida de peso corporal, y se produce por respuestas hormonales inflamatorias que resultan en un incremento de la tasa metabólica y de la degradación de proteínas. Por último, la sarcopenia se refiere específicamente a la pérdida de masa muscular, y es una parte normal del proceso de envejecimiento (Roubenoff, 2001). En contraste con la sarcopenia, los individuos ancianos pueden sufrir tanto de emaciación como de cachexia como resultado de enfermedades asociadas con el envejecimiento pero no como resultado normal del envejecimiento. La sarcopenia puede compararse con la pérdida de masa ósea que se produce con el envejecimiento. Baumgartner et al (1998) midieron la masa muscular apendicular mediante absorciometría dual de rayos X en 833 ancianos hispanos seleccionados aleatoriamente y en hombres y mujeres caucásicos. La sarcopenia se definió como una masa muscular ≥ 2 desviaciones estándar por debajo de la media para sujetos saludables. La prevalencia de sarcopenia mediante esta definición se incrementó desde el 13% al 24% en individuos de entre 65 y 70 años y hasta más del 50% en aquellos mayores a los 80 años de edad. La prevalencia se incrementó tanto en hombres como en mujeres pero en realidad fue mayor en los hombres (58%) que en las mujeres (45%) mayores de 75 años de edad (Baumgartner et al., 1998). Estos hallazgos sugieren que la sarcopenia es diferente de la osteopenia en que los hombres se ven afectados en mayor medida que las mujeres. Sin embargo, debido a que las mujeres tienen una mayor expectativa de vida, las mujeres pueden sufrir las consecuencias de la sarcopenia en mayor medida que los hombres. La pérdida de masa muscular puede derivar en la pérdida de fuerza y función física, lo cual es una de las principales preocupaciones entre los individuos ancianos. Los sujetos con sarcopenia tenían una probabilidad significativamente mayor de utilizar bastones o caminadores y una mayor historia de caídas. Estas probabilidades fueron independientes de la edad, raza, obesidad, ingresos económicos, ingesta de alcohol, actividad física, tabaquismo y co-morbidez. Roubenoff (2001) propuso que la severidad de la sarcopenia se basa en un bucle de retroalimentación que incluye la actividad física (o inactividad), la masa muscular, la fuerza y la función física. Este bucle de retroalimentación puede tener una dirección positiva (saludable) o negativa (incapacitante).
Desmejora estructural y funcional de los músculos: cambios miofibrilares con la edad asociados a la sarcopenia
Los datos histológicos, obtenidos predominantemente mediante la técnica de biopsia muscular, han permitido comprender de mejor manera la causa de la atrofia asociada con la edad. La mayoría de los estudios han observado que, en promedio, con el incremento de la edad hay una reducción del tamaño de las fibras tipo II sin que se vea afectado el tamaño de las fibras tipo I (Doherty et al., 1993, Grimby and Saltin, 1983, Larsson et al., 1978, Lexell, 1993, Lexell and Downham, 1992, Roos et al., 1997, Vandervoort, 2002) (Figura 2).
Sin embargo, esta reducción en el tamaño de las
fibras es moderada en comparación con la reducción en la masa muscular, por lo
que se ha propuesto que puede producirse la reducción en el número de fibras
musculares (Lexell et al., 1988). Además, existe evidencia histoquímica de agrupamiento de los tipos de
fibras, atrofia de las fibras e incremento de la co-expresión de isoformas de
cadenas pesadas de miosina (MHC) que se cree son consistentes con procesos de
desenervación y reinervación progresiva secundarios a un proceso neuropático
crónico (Andersen et al., 1999, Essen-Gustavsson and Borges, 1986, Oertel, 1986). En base a estos
hallazgosy la pérdida de fibras
musculares señalada previamente, se ha sugerido que la pérdida de
α-motoneuronas puede ser responsable de la pérdida de masa muscular asociada al
envejecimiento (Brown, 1972, Doherty and Brown, 1993, Doherty and Brown, 1997, Roos et
al., 1997). Estudios
electrofisiológicos han demostrado una substancial pérdida de unidades motoras
en los músculos distales de las extremidades inferiores y superiores (de Koning et al., 1988, Stalberg et al., 1989) lo cual respaldaría esta
hipótesis. Estos hallazgos conjuntamente con los cambios morfológicos
consistentes con un proceso neuropático apuntan a que la pérdida de
motoneuronas asociada con el envejecimiento es un factor que contribuye a la
reducción del número de fibras musculares y la masa muscular (Doherty, 2003).
Aspectos hormonales asociados con la sarcopenia
Además de esto, existen factores hormonales, metabólicos, nutricionales, inmunológicos y moleculares que contribuyen a la sarcopenia. Se ha postulado que con el envejecimiento hay una menor producción de, o una mayor resistencia a, factores anabólicos y el potencial desarrollo de influencias catabólicas sobre el músculo esquelético. Diversos estudios han investigado la relación entre los mediadores hormonales y la sarcopenia. Los niveles séricos de testosterona y andrógenos adrenales declinan con el envejecimiento (Tenover et al., 1987, Tenover, 1992, Tenover, 2000) y existe evidencia epidemiológica que respalda la relación entre la reducción en la testosterona y la declinación en la masa muscular (Baumgartner et al., 1999), la fuerza (Baumgartner et al., 1999, Perry et al., 2000) y el estatus funcional (Perry et al., 2000). Se sabe que los estrógenos pueden tener un efecto anabólico sobre los músculos, posiblemente como resultado de su conversión a testosterona (Roubenoff and Hughes, 2000), y está bien reconocido que se produce una declinación en los niveles de estrógenos en las mujeres como resultado del envejecimiento. Los estrógenos y la testosterona pueden inhibir la producción de interleucinas 1 y 6 (IL-1, IL6), sugiriendo que la reducción en los niveles de estas hormonas puede tener un efecto catabólico indirecto sobre el músculo (Roubenoff and Hughes, 2000).
La menopausia está asociada con la reducción de los niveles circulantes de 17-β-estradiol en mujeres de mediana edad y en mujeres ancianas (Dionne et al., 2000). Se ha observado una reducción en el rendimiento muscular durante la menopausia conjuntamente con una rápida reducción de la producción de hormonas ováricas (Sipila et al., 2001). Esta observación sugiere que las hormonas esteroides femeninas pueden desempeñar un importante rol en la regulación del rendimiento muscular en mujeres de mediana edad y ancianas. Se ha demostrado que la terapia de reemplazo hormonal atenúa la pérdida de masa muscular que ocurre en el período pre menopáusico (Dionne et al., 2000, Phillips et al., 1993). Si bien los datos son limitados, se sugiere que la terapia de reemplazo hormonal conjuntamente con el entrenamiento con sobrecarga puede ser muy beneficioso en el período post-menopáusico temprano; sin embargo, se requieren más estudios para dilucidad el rol de la terapia de reemplazo hormonal en relación con la mejora o mantenimiento de la masa, la fuerza y la función muscular.
Los niveles de hormona del crecimiento y de IGF-I (factor de crecimiento tipo insulínico 1) declinan con la edad. En general los estudios han mostrado que la administración de hormona de crecimiento en dosis farmacológicas incrementa la masa muscular pero no la fuerza (Zachwieja and Yarasheski, 1999). Actualmente se comprende aún menos cuál es el papel de la deficiencia de GH en el desarrollo de la sarcopenia (Roubenoff and Hughes, 2000). La secreción de GH desde la pituitaria estimula la secreción periférica de IGF-1 “sistémicos”, lo cual estimula el crecimiento del tejido muscular nuevo (Hameed et al., 2002). Sin embargo, se sabe que la producción de GH es menor en individuos obesos. Por lo tanto, la masa grasa puede ser un factor de confusión respecto de la relación entre la reducción de los niveles de GH y la sarcopenia. Actualmente se considera que dados los efectos secundarios, los costos y los resultados confusos en la literatura, la hormona del crecimiento no puede ser recomendada como una intervención eficaz para el tratamiento de la sarcopenia (Yarasheski et al., 1995, Zachwieja and Yarasheski, 1999).
En la actualidad se reconoce que el envejecimiento está asociado con una declinación en la ingesta de alimentos (lo que se denomina anorexia de la vejez) y se considera que puede ser un factor importante en el desarrollo y progresión de la sarcopenia (Morley, 2001a, Morley, 2001b, Morley et al., 2001).
Otro posible mecanismo detrás de la sarcopenia es la
alteración del turnover proteico. En
general, la atrofia muscular se produce cuando la degradación proteica excede
la síntesis. Existe evidencia de que el envejecimiento está asociado con una
menor tasa fraccional sintética de proteínas musculares (Hasten et al., 2000, Yarasheski et al., 1993), de proteínas miofibrilares
(actina/miosina), y de proteínas mitocondriales (Welle et al., 1993, Yarasheski et al., 1993).
Influencia del ejercicio
Dados estos hallazgos mencionados hasta el momento y
la relación entre la masa y la función muscular, ha habido un gran interés en
examinar la capacidad de incrementar la actividad anabólica en adultos mayores
mediante el entrenamiento con sobrecarga. Por ejemplo, Yarasheski et al (1995)
reportaron un incremento en la síntesis de proteínas musculares (~ 50%)
acompañado por ganancias de fuerza luego de 16 semanas de entrenamiento
progresivo de la fuerza en hombres ancianos (65-75 años). Por último, la
inactividad física es un factor significativo que contribuye a la sarcopenia
asociada con la edad. Está bien establecido que los hombres y mujeres que son
físicamente menos activos tienen menos masa muscular y una incrementada
prevalencia de incapacidad (Evans, 2002, Evans and Cyr-Campbell, 1997, Porter et al., 1995, Roubenoff
and Hughes, 2000, Vandervoort, 2002). Si bien es difícil extraer
conclusiones de estudios transversales los resultados de numerosos estudios que
han documentado que el entrenamiento con sobrecarga puede revertir la sarcopenia,
proveen evidencia de una relación entre la actividad física y la masa y la
fuerza muscular.
Reducción funcional con la edad
Una de las consecuencias más comunes de la sarcopenia es la reducción de la función física. Las caídas son la principal causa de lesión, morbidez y mortalidad en los ancianos, lo cual está comúnmente relacionado con la debilidad de los músculos del tobillo, la rodilla y la cadera (Province et al., 1995). Característicamente se produce una reducción del torque voluntario máximo en los músculos del tren inferior y superior. La potencia muscular también se declina con la edad, incluso en mayor medida que el torque pico, lo que resulta en la desmejora de la función física (Martin et al., 2000). Este cambio puede ser explicado por la pérdida de masa muscular y la alteración en la morfología muscular, predominantemente la reducción en la proporción del área de sección cruzada de las fibras tipo II.
|
Punto Clave
Las caídas son la principal causa de lesión, morbidez y mortalidad en los ancianos, lo cual está comúnmente relacionado con la debilidad de los músculos del tobillo, la rodilla y la cadera |
La debilidad muscular (pérdida de fuerza y potencia) es uno de los mecanismos subyacentes a una pobre función y se correlaciona con diversas medidas del estatus funcional (Skelton, 2001, Skelton et al., 1994, Young, 1997). La pérdida de fuerza en los cuádriceps con el envejecimiento significa que muchos adultos tendrán un nivel de fuerza por debajo del umbral necesario para levantarse de una silla baja o para utilizar sus brazos como ayuda (Skelton et al., 1994) (Tabla 2).
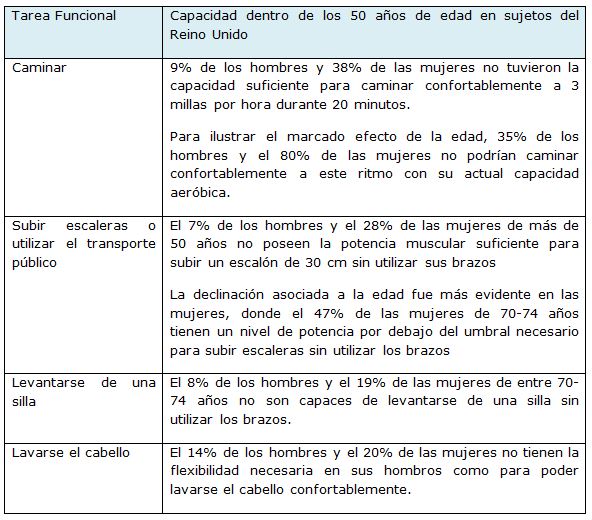
La capacidad para subir o bajar escaleras, levantarse de una silla, utilizar la bañera en lugar de la ducha puede verse significativamente comprometida si los niveles de fuerza no son suficientes (Brill et al., 2000, Hyatt et al., 1990, Skelton et al., 1994). La reducción de la masa muscular también está asociada con la desmejora de la función inmune y del control de la temperatura (ACSM, 1998). Luego de los 30 años se produce una progresiva declinación en la fuerza y potencia muscular, que se acelera luego de la 5ta década de vida y se reduce en un 10-15% desde este punto (Skelton et al., 1994). Häkkinen (2003) establece que la reducción en la fuerza máxima a partir de los 30 años y hasta los 80 puede ser de hasta un 30-40%(Häkkinen, 2003). Además, la reducción en la fuerza máxima asociada con la edad puede variar ligeramente entre los diferentes grupos musculares (Figura 3). La pérdida de fuerza muscular de las extremidades inferiores parece ser mayor que la de las extremidades superiores, presumiblemente debido a la reducción del uso del tren inferior en comparación con el tren superior (Frontera et al., 1988)
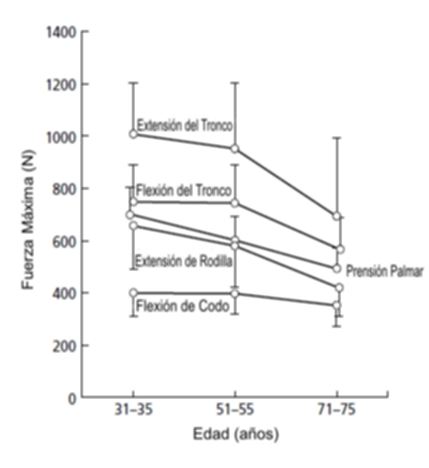
Figura
3. Fuerza isométrica máxima (Medias ± EE) de diferentes grupos
musculares en hombres de tres diferentes grupos de edad (Viitasalo et al., 1985).
La reducción en la fuerza muscular está relacionada con diversos factores resumidos en la Figura 6 superior (Porter et al., 1995). Sin embargo, la reducción en la fuerza máxima está relacionada en mayor medida a la reducción de la masa muscular tanto en hombres como en mujeres, ya que el envejecimiento (como se mencionara previamente) está asociado con alteraciones en el equilibrio hormonal, especialmente con la reducción de los niveles de andrógenos (Chakravarti et al., 1976, Hammond et al., 1978, Vermeulen et al., 1972) y con frecuencia con la declinación en el volumen de actividades físicas normales y/o con la reducción en la carga (intensidad) de estas actividades. Se ha demostrado, y lo hemos mencionado previamente, que la declinación en la masa muscular se debe tanto a la reducción en el tamaño de las fibras musculares individuales (especialmente las fibras tipo II), y en la pérdida de fibras individuales (Essen-Gustavsson and Borges, 1986, Larsson et al., 1978, Lexell et al., 1988). Los datos presentados en la Figura 5 inferior muestran la atrofia muscular asociada con la edad y la atrofia preferencial de las fibras tipo II en el grupo de individuos de 70 años en comparación con el grupo de 50 años (tanto hombres como mujeres).
La reducción en el número de fibras puede ser
causada por un daño irreparable de las fibras o por el permanente contacto
entre los nervios de las fibras musculares. Parte de la población fibrilar
parece sufrir un proceso de desinervación, aunque el proceso de reinervación es
posible con el envejecimiento (Häkkinen, 2003). Tanto el proceso de desenervación como la inactividad parecen
subyacer al cambio en el tamaño de las fibras con el envejecimiento (Lexell et al., 1988). En adición a la reducción de la masa muscular, la reducción en la
fuerza máxima, especialmente a mayores edades, puede deberse en parte a una
reducción en el impulso neural voluntario máximo hacia los músculos y/o a
cambios en las características “cualitativas” del tejido muscular. Actualmente
se ha mostrado que la declinación en la fuerza se debe en parte a la reducción
de la activación voluntaria máxima de los agonistas. La incompleta activación
muscular (Figura 5) puede explicarse en parte por la reducción asociada con la
edad en la tasa de disparo de las unidades motoras (Kamen et al., 1995).
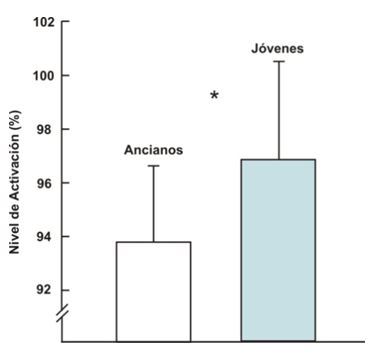
Figura 5. Nivel de activación (%) durante contracciones voluntarias máximas en jóvenes y ancianos. (Yue et al., 1999)
Además de los cambios en el impulso neural máximo hacia los agonistas, aparentemente hay un incremento asociado con la edad en la co-activación de los antagonistas, especialmente durante acciones dinámicas. En el movimiento normal humano el tiempo necesario para producir cierto nivel de fuerza submáximo puede ser, a veces, más importante que el nivel de fuerza absoluta. En este sentido, se ha demostrado que el envejecimiento está asociado con una mayor desmejora de la producción de fuerza explosiva (Bosco and Komi, 1980, Clarkson et al., 1981, Hakkinen and Hakkinen, 1991, Izquierdo et al., 1999a). Los resultados que se muestran en la Figura 6 representan la reducción en la capacidad del salto vertical con el incremento de la edad tanto en hombres como en mujeres.
Por lo tanto, para minimizar los efectos del
envejecimiento sobre el sistema neuromuscular, se debería combinar el
entrenamiento de la fuerza con ejercicios modificados de potencia como parte
del programa de entrenamiento de los adultos mayores. Esto además podría
contribuir positivamente a intentar mantener la capacidad funcional al nivel
más alto posible, y por el mayor tiempo posible, en este grupo poblacional.
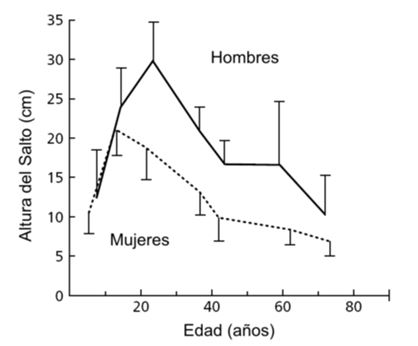
Figura 6. Altura media (± DE) alcanzada en saltos desde media sentadilla por hombres y mujeres de diferentes grupos de edades (Bosco and Komi, 1980)
Aspectos celulares del envejecimiento
Los mecanismos fundamentales detrás de la sarcopenia son complejos, multifactoriales e inseparables (Tarnopolsky and Parise, 2002). El envejecimiento puede observarse a nivel celular o al nivel del organismo en general, pero para hacer esto se deben comprender los mecanismos celulares subyacentes. Se ha observado una reducción en el número de células en cultivos de fibroblastos en pacientes ancianos vs pacientes jóvenes, y esto parece estar relacionado con alteraciones mitocondriales (Harley, 1997, Martens et al., 2000, Tresini et al., 1999). El desarrollo y crecimiento celular normal implica una forma de muerte celular denominada apoptosis (o muerte celular pre-programada); la inhibición de la muerte celular pre-programada puede derivar en la neoplasia.
Estrés oxidativo y cambios mitocondriales
Diversas teorías del envejecimiento celular implican la producción de radicales libres o especies reactivas del oxígeno (ROS). Los radicales libres son compuestos altamente reactivos con una vida corta que tienen un electrón no apareado. Su acumulación resulta en el daño de los lípidos estructurales, proteínas y ADN, y modificaciones en la estructura con el consecuente deterioro en la función celular (Tarnopolsky and Parise, 2002). Ejemplos de las especies reactivas del oxígeno incluyen el peroxinitrito, el radical superóxido, el radical hidroxilo y el peróxido de hidrógeno. Las enzimas específicas encargadas de eliminar los radicales libres incluyen la Cu/Zn dismutasa superóxido (Cu/ZnSOD), la manganeso superóxido dismutasa intramitocondrial (MnSOD, SOD-2 mitocondrial), la glutatión peroxidasa mitocondrial y citosólica y la catalasa. Las potenciales consecuencias del daño inducido por especies reactivas del oxígeno incluyen las alteraciones en procesos fundamentales tal como la fidelidad de la replicación del ADN, la alteración de la estructura secundaria y terciaria de las proteínas y alteraciones en la integridad y permeabilidad de las membranas. La observación de que los roedores viven más con una dieta restringida en calorías ha ganado substancial interés (Holloszy and Schechtman, 1991, Weindruch et al., 1986). La hipótesis desarrollada a partir de esta observación es que, a medida que se reduce la tasa metabólica basal, también se reduce el flujo a través de los complejos I y III de la cadena de electrones que producen radicales libres (Tarnopolsky and Parise, 2002). Recientemente un grupo de investigadores que estudiaban una familia de insectos denominados Drosophilia hallaron un gen denominado INDY (por sus siglas en inglés “I’m not dead yet” o aun no estoy muerto) el cual codifica una proteína homóloga a un transportador de dicarboxilato (Rogina et al., 2000) y que aquellos insectos que poseían una mutación de este gen en uno de sus alelos tenían en promedio un período de vida del doble de su especie. A partir de esto se sugirió que las consecuencias celulares de las mutaciones del gen INDY representaban una forma de inanición celular. Si bien ambas teorías derivan en una reducción del flujo a través de los complejos I y III de la cadena de transporte de electrones (reduciendo la producción de radicales libres), esto aún no ha sido probado concluyentemente.
Uno de los principales objetivos del ataque de los radicales libres es el ADN hallado en la matriz mitocondrial, lo cual representa aproximadamente el 1% del ADN total. El daño oxidativo y las mutaciones resultantes del ADN se producen con mucha mayor frecuencia en el ADN mitocondrial que en el ADN nuclear (Yakes and Van Houten, 1997, Wei et al., 1998, Barja and Herrero, 2000). Se ha observado que la supresión del ADN es más frecuente en los ancianos que en los individuos jóvenes (Lezza et al., 1994, Lezza et al., 1997). La producción de radicales libres en los músculos se acelera con el envejecimiento. Este incremento es atribuido a una declinación asociada a la edad en la función mitocondrial caracterizada por un turnover más lento, una eficiencia reducida y un incremento en el desplazamiento de electrones hacia la cadena de transporte (Navarro et al., 2001, Pesce et al., 2001, Wallace, 2001). De ha hipotetizado que esta declinación en la función es consecuencia de la producción mitocondrial de especies reactivas de oxígeno. Debido a que la mitocondria es la fuente principal de ROS, esta puede ser especialmente susceptible al daño oxidativo y a la subsiguiente disfunción. La “Teoría del Envejecimiento Mitocondrial” describe un fenómeno de un ciclo vicioso en donde la producción mitocondrial de ROS deriva en el daño oxidativo, la disfunción mitocondrial y el incremento de la producción de ROS. Estas acciones, tanto en forma colectiva como individual derivan en la reducción de la función muscular. El exceso de ROS provoca disfunción contráctil, cambios regulatorios y degradación de las proteínas musculares. El daño oxidativo de las proteínas musculares también puede derivar en la disfunción contráctil y en la degradación de proteínas musculares. Por último, la disfunción mitocondrial deriva en la ineficiente producción de energía y en el compromiso de la función muscular (Moylan et al., 2006).
Turnover proteico ¿está vinculado al estrés oxidativo?
Si bien existen algunas relaciones co-temporales sugerentes, no se ha establecido una relación directa entre las especies reactivas del oxígeno y la sarcopenia. En general, los animales de edad avanzada muestran una reducción en la expresión del ARNm músculo-esquelético para la codificación de proteínas involucradas en el turnover proteico y en el metabolismo energético (Lee et al., 1999). A nivel fisiológico, las ROS podrían incrementar la degradación proteica o reducir la síntesis de proteínas, lo cual afectaría la masa muscular (Tarnopolsky and Parise, 2002). Concebiblemente, las ROS podrían afectar el DNA, reduciendo la transcripción del ARNm (ácido ribonucleico mensajero). Las proteínas oxidadas también podrían sufrir alteraciones estructurales o catalíticas, derivando en una reducción de la eficiencia de traducción de las proteínas, una alteración en las modificaciones post-traducción o proteólisis. Desde el punto de vista funcional, la reducción en la tasa sintética fraccional ha sido correlacionada con las medidas funcionales de la fuerza de los músculos de la rodilla (Balagopal et al., 1997). Dado que hay un incremento del estrés oxidativo en los músculos esqueléticos de los ancianos, se podría hipotetizar que el incremento en las proteínas modificadas por la oxidación incrementaría la degradación proteica.
Envejecimiento, sexo y susceptibilidad al daño muscular y al sobreentrenamiento
Las reacciones fisiológicas al, y los mecanismos asociados con el daño muscularinducido por el ejercicio y los subsiguientes procesos de recuperación han sido bien caracterizados en los adultos jóvenes. El daño muscular inducido por el ejercicio es una consecuencia común de la realización de ejercicios poco comunes, el sobreentrenamiento o las contracciones musculares excéntricas. El daño muscular puede ser causado por una excesiva tensión sobre las fibras musculares, las miofibrillas y los sarcómeros, lo cual puede resultar en la disrupción de la línea Z de los sarcómeros y el daño de tejidos conectivos y de proteínas estructurales (Evans and Cannon, 1991, Friden and Lieber, 1992). Las contracciones musculares excéntricas son particularmente dañinas, debido a que se activa una menor sección cruzada del músculo para proveer la misma tensión que la requerida por una contracción concéntrica (Enoka, 1996).
Los cambios relativos en la longitud muscular durante las contracciones también contribuyen al daño muscular y las lesiones asociadas con las contracciones excéntricas (Tiidus, 2002). Además del daño muscular inducido mecánicamente, el ejercicio puede resultar en otras disrupciones estructurales del músculo y las membranas inducidas por radicales libres u otros procesos químicos (Clanton et al., 1999, Ji, 1995). Durante el ejercicio prolongado se generan especies reactivas de oxígeno en la cadena de transporte mitocondrial. Estas ROS pueden ser responsables de la peroxidación inducida por el ejercicio de las membranas lipídicas, de las macromoléculas y del daño muscular estructural asociado a la peroxidación (Clanton et al., 1999, Ji, 1995). La inflamación muscular post-ejercicio también está caracterizada por la formación de ROS a partir de los neutrófilos y macrófagos y por el ácido hipocloroso generado por la actividad de la mieloperoxidasa de los neutrófilos.Estos procesos, aunque necesarios para ayudar a degradar y remover el tejido muscular dañado y otras macromoléculas, también puede contribuir al daño y la disrupción de las células musculares asociado con la respuesta inflamatoria en los días posteriores al ejercicio.
Diferencias asociadas con la edad en el daño muscular post ejercicio yen la recuperación
La evidencia recolectada tanto en modelos de animales como de humanos sugiere que existen diferencias asociadas con la edad en la susceptibilidad de los músculos esqueléticos al daño inducido por el ejercicio y en la capacidad para la reparación post-daño (Tiidus, 2002). Una de estas diferencias está relacionada con el trabajo requerido para inducir daño muscular. Los estudios en humanos han tendido a demostrar un mayor grado de daño muscular en los adultos mayores que en los adultos jóvenes. Por ejemplo, Manfredi et al., reportaron que luego de la realización de ejercicio excéntrico, los hombres mayores (59-63 años) desentrenados exhibieron un daño muscular significativamente mayor que los individuos jóvenes (20-30 años) (Manfredi et al., 1991).
Mediante la examinación de las biopsias musculares, estos investigadores determinaron que los hombres adultos mayores exhibieron un daño extensivo focal y edema en más del 90% de las fibras musculares, inmediatamente post-ejercicio, en comparación con el 5-50% de fibras dañadas exhibidas por los jóvenes. Fielding et al., señalaron mayores tasas de degradación proteica en los músculos de ancianos en comparación con los músculos de jóvenes luego de la realización de ejercicios excéntricos (Fielding et al., 1991). La actividad sérica post ejercicio de la creatina quinasa (CK) ha mostrado ser similar entre individuos jóvenes y ancianos (Manfredi et al., 1991)o ser menor en los adultos mayores (Fielding et al., 1993).
La
mayoría de los estudios con animales y humanos concuerdan en que la
recuperación del daño muscular agudo inducido por el ejercicio está desmejorada
en los adultos mayores. Además de la menor tasa de recuperación en los músculos
de los adultos mayores, se ha reportado una falta de adaptación protectora en
músculos lesionados por contracciones excéntricas (McBride et al., 1995). Se ha observado que los músculos de animales jóvenes
manifiestan adaptaciones a la lesión muscular inicial, de manera que la segunda
tanda de contracciones excéntricas induzca menos daño adicional (evidenciado
por el mantenimiento de la fuerza muscular pre ejercicio). En contraste, los
músculos de los animales ancianos son menos exitosos para inducir dichas adaptaciones,
de manera que la segunda tanda de contracciones excéntricas todavía puede
inducir un daño significativo. Esto sugiere que además de la menor tasa de
reparación del daño muscular, la calidad de la reparación muscular puede verse
comprometida en los adultos mayores.
Mecanismos fisiológicos de las diferencias asociadas con la edad en el daño y la recuperación post ejercicio
Numerosos factores pueden dar cuenta de la desmejoradacapacidad de los músculos para hacer frente a ejercicios que induzcan daño muscular y para recuperarse óptimamente de este daño (Tiidus, 2002). Como se discutiera previamente, la sarcopenia muscular es aparentemente una parte inevitable del envejecimiento. La muerte asociada con la edad de los nervios motores y la subsiguiente pérdida de fibras musculares, particularmente de fibras tipo II, pueden explicar gran parte dela pérdida de fuerza asociada con el envejecimiento. La pérdida de fibras musculares está acompañada por una reducción de la aleatoriedad en la distribución del tipo de fibras dentro de los músculos y con un incrementado agrupamiento de los tipos de fibras, particularmente algunas de las fibras tipo II desinvervadas serán reinervadas por nervios motores tipo I (Frontera et al., 1988, Hughes and Schiaffino, 1999, Lexell and Downham, 1991). Debido a que los músculos con menos masa, más débiles y funcionalmente comprometidos pueden ser más susceptibles al daño muscular, la reducción en la fuerza muscular asociada con la edad puede ser un factor importante que afecte la susceptibilidad de los ancianos al daño muscular inducido por el ejercicio. Dado que el entrenamiento de la fuerza aumenta significativamente la masa muscular en ancianos (Singh et al., 1999), el entrenamiento regular podría ser una importante medida profiláctica contra el daño muscular inducido por el ejercicio en adultos mayores.
|
Punto Clave
Debido a que los músculos con menos masa, más débiles y funcionalmente comprometidos pueden ser más susceptibles al daño muscular, la reducción en la fuerza muscular asociada con la edad puede ser un factor importante que afecte la susceptibilidad de los ancianos al daño muscular inducido por el ejercicio |
También es posible que la reducción en la actividad física asociada al envejecimiento pueda desempeñar un rol en la susceptibilidad al daño muscular inducido por el ejercicio en los adultos mayores, además de cualquier cambio intrínseco en la calidad muscular. En adición a los factores mecánicos, los eventos químicos, particularmente aquellos relacionados con la peroxidación inducida por las ROS, pueden afectar el daño muscular inducido por el ejercicio (Ji, 1995). Si bien los datos son limitados, existe evidencia de que el daño oxidativo inducido por el ejercicio es mayor en los animales y adultos ancianos que en los jóvenes (Polidori et al., 2000). Por lo tanto, las posibles diferencias en la protección contra el daño oxidativo inducido por el ejercicio o la capacidad de una adaptación antioxidante al entrenamiento en ancianos vs jóvenes continúa siendo controversial.
Además,
de la calidad muscular, otro factor potencial en la capacidad para resistir al
daño muscular inducido por el ejercicio y la optimización de la reparación es
la calidad de los factores externos al músculo relacionados con la reparación
del mismo. El envejecimiento está asociado con incrementados niveles
circulantes de marcadores inflamatorios tales como el factor de necrosis
tumoral alfa (TNF-α), las interleuquinas 6 (IL-6) y la proteína C reactiva (Pedersen et al., 2000). Los niveles anormalmente altos de inflamación son
considerados como factores en las respuestas sub-óptimas a la enfermedad o la
infección en sujetos ancianos. Por lo tanto, un estímulo inflamatorio sistémico
supranormal podría ser un factor que retrase la reparación muscular
post-ejercicio en los adultos mayores.
Interacción de la edad y el sexo en el daño muscular inducido por el ejercicio y su reparación
Se sabe relativamente poco acerca de los efectos del envejecimiento sobre las potenciales diferencias sexuales en el daño muscular inducido por el ejercicio. Como se señaló previamente, tanto los hombres como las mujeres ancianos tienen la capacidad de responder al entrenamiento con sobrecarga mediante el incremento del tamaño muscular y de la fuerza. Por lo tanto, cualquier pérdida de protección muscular a partir de la adaptabilidad al daño inducido por el ejercicio no parece lo suficientemente grande como para dificultar la adaptación al entrenamiento de la fuerza en cualquiera de los sexos. Sin embargo, algunos estudios sugieren que los estrógenos pueden influenciar la fuerza muscular en las mujeres y que parte de la pérdida de fuerza muscular en las mujeres ancianas puede deberse a la reducción en los estrógenos que se produce luego de la menopausia (Phillips et al., 1993, Sarwar et al., 1996). Si los estrógenos protegen a los músculos esqueléticos del daño inducido por el ejercicio, la reducción en los niveles de estrógenos en las mujeres post menopáusicas podría hacer que sus músculos sean significativamente más susceptibles al daño muscular que el de los hombres. La evidencia indirecta de esto podría encontrarse en el hecho de que las mujeres pre menopáusicas tienen una menor incidencia de enfermedades cardíacas que los hombres de edades similares.
Roth
et al., hallaron evidencia de mayor daño ultraestructural en los músculos
esqueléticos de mujeres ancianas (65-75 años) en comparación con mujeres más
jóvenes (20-30 años) que seguían un programa de entrenamiento con sobrecarga,
mientras que dichas diferencias no existieron entre hombres de edades
comparables (Roth et al., 2000,
Roth et al., 1999). En estos estudios, luego del entrenamiento se hallaron mayores signos
de daño ultraestructural en las mujeres ancianas que en las mujeres jóvenes y
que en los hombres ancianos y jóvenes. Pero es muy importante señalar que a
pesar del grado de susceptibilidad relativamente mayor al daño muscular en las
mujeres ancianas, estas conservan la capacidad de adaptarse positivamente al
entrenamiento. Por lo tanto, el grado de daño muscular inducido por el
ejercicio en las mujeres ancianas, aunque posiblemente mayor que el observado
en los hombres, no parece desmejorar su respuesta adaptativa al entrenamiento
de la fuerza.
Envejecimiento y sistema osteo-articular
En cualquier momento, aproximadamente un 10% de la superficie ósea del esqueleto adulto se encuentra bajo una remodelación activa, mientras que el restante 90% es quiescente. La densidad mineral ósea tiene su pico alrededor de los 25 años de edad, y a los aproximadamente 30 años, el equilibrio entre la formación y la reabsorción ósea comienza alterarse de manera tal que la reabsorción comienza a exceder a la deposición, y a los aproximadamente 50 años se produce la pérdida progresiva de calcio y el deterioro de la matriz orgánica del hueso (Skelton and Dinan-Young, 2008). La masa ósea tiene su pico entre los 20 y 40 años, y los hombres alcanzan un pico mayor de masa ósea que las mujeres. Luego de los 40 años, la masa ósea declina a una tasa de 0.5-1% por año, con un período de pérdida acelerada en las mujeres en los 5-10 años posteriores a la menopausia. La acelerada pérdida de hueso ocurre debido a la reducción de los niveles de la hormona sexual oestrógeno, que protege al esqueleto femenino de la excesiva reabsoricón ósea (Eastell and Riggs, 1988). En total, las mujeres pierden aproximadamente un 25-30% de hueso cortical y un 35-50% de hueso trabecular a lo largo de la vida, mientras que los hombres pierden aproximadamente dos tercios de esta tasa (Riggs et al., 1981). La densidad ósea sigue a las pérdidas de fuerza muscular, aunque la declinación en la fuerza se produce antes que la pérdida de densidad ósea. Las fuerzas musculares ejercidas sobre el hueso, son probablemente los factores claves para mantener la salud ósea (Rutherford, 1999). Los cambios a nivel óseo son tanto cuantitativos como cualitativos e incluyen:
- Alteraciones en la dinámica de las células óseas, resultando en el cambio de los procesos normales de reabsorción y formación ósea.
- Cambios en la arquitectura ósea
- Acumulación de microfracturas
- Disparidad localizada en la concentración de los minerales depositados, con hipomineralización en alunas áreas e hipermineralización en otras
- Cambios en las propiedades cristalinas de los depósitos minerales
- Cambios en el contenido proteico de la matriz material
Este es un fragmento de uno de los apuntes de cátedra de la asignatura "Fisiología del Envejecimiento" del módulo 1 del Posgrado de Actividad Física en Adultos Mayores.
Autor: Lic. Sebastián Del Rosso.
2.4 SISTEMA NEURO-MUSCULAR
El envejecimiento está asociado con una pérdida de la función neural, con menores tiempos de reacción y con un más lento procesamiento central (Skelton and Dinan-Young, 2008). La capacidad de los individuos para moverse y ser independientes con el incremento de la edad, depende en gran parte de mantener una adecuada capacidad funcional del sistema neuromuscular. Este sistema, que gobierna la generación y el control de la fuerza, característicamente sufre una declinación substancial en la capacidad funcional con el envejecimiento, pero retiene un alto grado de su capacidad adaptativa.
Posibles factores que contribuyen a la sarcopenia
Como
se mencionara en la sección correspondiente, la sarcopenia se define como una
declinación en la masa muscular debido al envejecimiento, con una pérdida
concomitante de fuerza voluntaria. La sarcopenia y los cambios en la función
contráctil pueden ser explicados por alteraciones morfológicas en el tejido
músculo-esquelético. Sin embargo, dependiendo de los músculos estudiados, la
debilidad asociada con la edad no puede ser explicada únicamente por
adaptaciones estructurales (Porter et al., 1995,
Roos et al., 1997). Por ejemplo, existen cambios asociados con la edad en los mecanismos
de excitación-contracción y en las proteínas contráctiles que reducen la
función contráctil y, además, cambios en los factores neurológicos que afectan
la producción y control de la fuerza voluntaria. En esta sección discutiremos
algunos de estos mecanismos.
Impulso central
La
debilidad asociada a la edad puede ser causada, en cierto grado, por la
reducción del impulso central, y por lo tanto por la reducida capacidad para
activar la musculatura en forma voluntaria (ver Figura 7). El umbral de
excitabilidad del tracto cortico-espinal se incrementa progresivamente con la
edad (Rossini et al., 1992). También se produce un incremento en la resistencia
eléctrica de las membranas celulares (Engelhardt et al.,
1989) y una progresiva reducción de la velocidad de conducción de las
motoneuronas (Doherty et al., 1993). Además, parece reducirse el factor de seguridad y la
efectividad de la transmisión sináptica a través de la junta neuromuscular,
aunque es incierto hasta qué punto dichos cambios serán funcionalmente
significativos.
Remodelación de las unidades motoras
Se define a la remodelación de las unidades motoras (UM) como el ciclo natural de renovación de las conexiones neuromusculares entre la motoneurona y las fibras musculares. A través del proceso de desinervación por medio de la muerte de los axones motores, el subsiguiente brote de las UM existentes, y la re-reinervación de las fibras previamente desinervadas, se produce la remodelación de las UM (Brooks and Faulkner, 1994). Inicialmente, la capacidad de re-reinervación es capaz de compensar la desinervación, pero con el avance de los años, la disrupción neurogénica excede la capacidad de restaurar la innervación, dejando un gran número de fibras musculares sin suministro neural. Esto, a su vez, precipita la atrofia y la muerte de las fibras musculares. Se estima que la tasa de pérdida de UM es del 1% anual comenzando en la tercera década de vida e incrementándose exponencialmente con el avance de los años (Tomlinson and Irving, 1977). Entre la segunda y la décima década de vida, los datos reportados muestran una pérdida de UM del 25%,mientras que algunos estudios muestran una pérdida total de UM que alcanza hasta el 50% (Brown, 1972, Tomlinson and Irving, 1977).
La degeneración neural relacionada con el envejecimiento, aunque presente en todos los tipos de UM, parece afectar preferencialmente a las fibras musculares tipo II (rápidas), las cuales se encuentran inervadas por las UM de gran tamaño (Ansved and Larsson, 1990). Esto puede evidenciarse a través del incremento en la proporción de inervación en las UM lentas que es paralelo a la declinación en el número de fibras tipo II (Kugelberg, 1976). Sin embargo, esto ocurre a costa de que las fibras tipo II abandonadas son incorporadas en las UM lentas que inervan fibras musculares tipo I (lentas) por medio del brote colateral (Porter et al., 1995). Consecuentemente, las fibras tipo II incorporadas por reinervación en las UM lentas tipo I se vuelven, con respecto a las propiedades fisiológicas y bioquímicas, fibras tipo I.
Numerosas fuentes dentro de la literatura proveen evidencia de la remodelación de UM con el envejecimiento (Brown et al., 1981, Howard et al., 1988, Kugelberg, 1976, Larsson, 1995, Larsson and Ansved, 1995, Roos et al., 1997). La evidencia bioquímica muestra cambios en las cadenas pesadas de miosina (MHC), la porción de la miosina especializada en proveer el golpe de fuerza y la base molecular para la velocidad de la contracción muscular, en las fibras rápidas-fatigables tipo IIb sugiriendo una transformación hacia las fibras tipo IIa rápidas-resistentes a la fatiga (Roos et al., 1997). La distribución normal aleatoria de las UM pequeñas y grandes observada comúnmente en los músculos, es alterada con la remodelación de las UM lo cual queda evidenciado por los datos histoquímicas que muestran un amontonamiento o agrupamiento de las fibras tipo I con la declinación en los grupos de fibras tipo II. Estos hallazgos son indicativos de las alteraciones estructurales secundarias a la remodelación de las UM y no están libres de consecuencias funcionales.
Reclutamiento de unidades motoras y frecuencia de disparo
La fuerza muscular es graduada por el reclutamiento de un número apropiado de unidades motoras y por la alteración de los patrones y frecuencia de descarga. Al parecer el umbral de reclutamiento de las unidades motoras se reduce con la edad, probablemente en asociación con el cambio hacia un menor número de unidades motoras y hacia la preponderancia de fibras tipo I (Erim et al., 1999). Además, la relación entre el nivel de reclutamiento y la tasa de disparo de las unidades motoras individuales parece ser diferente entre los jóvenes y los adultos mayores. En la mayoría de los estudios llevados a cabo, la tasa de disparo de las unidades motoras es significativamente menor en los adultos mayores que en los jóvenes (Figura 9), aunque existe cierto desacuerdo en si esto solo ocurre a altos niveles de fuerza o en todo el rango normal de fuerza. Estas diferencias parecen ser específicas de los músculos, ya que algunos músculos parecen mostrar una mayor reducción en la frecuencia de disparo que otros (Erim et al., 1999, Roos et al., 1997).
La variabilidad en la frecuencia de disparo de las unidades motoras es otro parámetro que podría afectar la producción óptima de fuerza. Debido a factores axonales intrínsecos, tal como el ruido sináptico a bajas tasas de descarga, parece que las unidades motoras tienen un umbral tónico específico de tensión al cual la frecuencia de disparo se vuelve regular. Se ha propuesto que los adultos mayores tienen una mayor variabilidad en su patrón de descarga de las unidades motoras y es posible que estas unidades no alcancen el umbral necesario para la estabilidad (Nelson et al., 1983, Nelson et al., 1984, Soderberg et al., 1991). Desde el punto de vista funcional, esta incrementada variabilidad podría afectar negativamente la producción y el control de la fuerza en los adultos mayores.
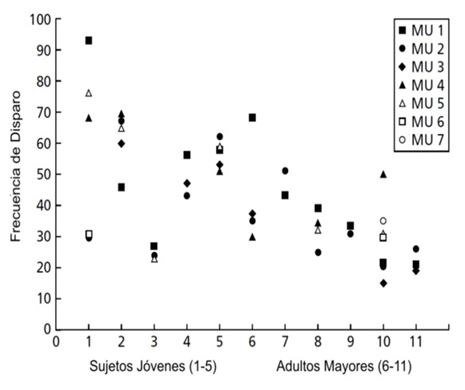
Figura 9. Frecuencia de disparo de las unidades motoras en sujetos jóvenes y ancianos (Kamen et al., 1995)
Propiedades contráctiles
Además de la debilidad muscular registrada a partir de contracciones voluntarias e inducidas eléctricamente, otra característica del sistema neuromuscular con el envejecimiento es el cambio en la calidad contráctil, comúnmente registrado como una respuesta contráctil más lenta. Durante contracciones voluntarias, se produce una reducción asociada con la edad en la tasa de desarrollo de la fuerza (Nelson et al., 1983, Nelson et al., 1984, Soderberg et al., 1991) así como también en la capacidad para acelerar una extremidad (Stanley and Taylor, 1993). Los cambios contráctiles pueden resumirse funcionalmente como una desviación hacia la izquierda de la curva que representa la relación entre la fuerza y la frecuencia. Si bien la magnitud con la cual un músculo más lento y débil refleja directamente cambios en la composición muscular es debatible, se ha sugerido que, en base a los datos morfológicos y las propiedades contráctiles, las fibras tipo I contribuyen proporcionalmente más a la generación de fuerza en los ancianos que en los jóvenes.
Fuerza voluntaria
En secciones previas hemos discutido el tema de la
reducción en la fuerza muscular debido a la sarcopenia, pero es interesante
aportar algunos datos más. Como se indicó previamente, en comparación con los
adultos jóvenes, la fuerza puede estar reducida hasta un 50% en sujetos de 80
años de edad. Diversos estudios han sugerido que la pérdida de fuerza está
estratificada por ubicación anatómica, siendo los músculos distales de las
extremidades inferiores más afectados que los músculos proximales de las extremidades
superiores (Aoyagi and Shephard, 1992, Grabiner and Enoka, 1995, Rogers and Evans,
1993, Vandervoot and Symons, 2001). Algunos estudios han
utilizado contracciones excéntricas en lugar de contracciones isocinéticas, y
se ha observado que en algunos grupos musculares, el torque excéntrico se ve
menos afectado por la edad. En comparación con la pérdida de aproximadamente el
50% de la fuerza isométrica y concéntrica, los sujetos en la octava década de
vida muestran una reducción de la fuerza excéntrica de aproximadamente un 25%
para el mismo grupo muscular (Vandervoot and Symons, 2001).
Potencia
La potencia es función tanto de la fuerza como de la
velocidad de movimiento. Provee una medida de la capacidad funcional de los
músculos estrechamente relacionada con las actividades cotidianas dinámicas.
Debido a que la fuerza y la velocidad de contracción se ven reducidas con la
edad, es de esperar que la potencia sea substancialmente menor en los adultos
mayores que en los jóvenes.Diversos
estudios se han enfocado en los cambios asociados con la edad en la potencia de
los extensores de las extremidades inferiores (Bassey, 1997, Martin et al., 2000), de las extremidades
superiores (Marsh et al., 1999, Metter et al., 1999) o ambos (Izquierdo et al., 1999b). En general se ha observado que la pérdida de potencia es un 25% mayor
que la pérdida de fuerza isométrica o isocinética, y es especialmente
pronunciada a altas velocidades de contracción. Dado que los principales
determinantes de la potencia máxima son el tamaño y el tipo de fibras, la
sarcopenia y, específicamente, la pérdida relativa de fibras tipo II pueden
explicar la mayor pérdida de potencia en los músculos de los adultos mayores (Martin et al., 2000). Otros factores que afectan la potencia y que posiblemente estén
relacionados, directa o indirectamente, con la masa muscular y las
características de los tipos de fibras incluyen: la reducción en la tensión
específica, la capacidad oxidativa, la velocidad óptima de movimiento, la
complianza muscular y el incremento de la grasa corporal (Brown et al., 1999, Conley et al., 2000, Evans, 2000). Los resultados de algunos
estudios sugieren que la pérdida de potencia en ejercicios dinámicos es mayor
para las extremidades inferiores (Marsh et al., 1999) que para las extremidades superiores (Izquierdo et al., 1999b). También se ha sugerido que las mujeres ancianas desarrollan solo
hasta un 50% de la potencia desarrollada por los hombres ancianos (Bassey et al., 1992, Kostka et al., 2000, Metter et al., 1999) a pesar de las diferencias
en la masa muscular, y esto puede reflejar los menores niveles hormonales en
las mujeres. Debido a que la edad afecta más a al a potencia que a la fuerza, y
que la mayoría de las actividades cotidianas requieren de una combinación de
fuerza y velocidad de movimiento – o un mínimo de la capacidad para generar
potencia – la preservación de la potencia muscular con el avance de la edad es
importante para reducir el riesgo de incapacidad y dependencia. En general, la
pérdida de potencia puede desmejorar la eficiencia del movimiento derivando en
una excesiva fatiga muscular, en la dependencia de músculos accesorios y en
lesiones por sobreuso y caídas.
Fatigabilidad
La fatiga se define a nivel neuromuscular como cualquier reducción en la fuerza o potencia durante un esfuerzo voluntario, sin considerar si la tarea puede o no continuar realizándose exitosamente (Bigland-Ritchie et al., 1995). Debido a que el envejecimiento está asociado con substanciales alteraciones en la estructura y función de muchos aspectos del sistema neuromuscular relacionados con la generación de fuerza, es razonable esperar que los mecanismos que determinan la capacidad de resistencia y de fatiga muscular se vean afectados. (Rice and Cunningham, 2002). Si bien los datos cuantitativos son limitados, se ha observado una reducción en la capacidad para mantener el rendimiento y para la recuperación luego del ejercicio en adultos mayores (Rice and Cunningham, 2002). Debido a la sarcopenia y a otros cambios asociados con la edad en el sistema neuromuscular, la capacidad para realizar cualquier tarea que requiera de una carga absoluta puede ser problemática. Además, en los adultos mayores la susceptibilidad a la fatiga está incrementada debido a que cualquier tarea representa una mayor proporción de la fuerza o la potencia máxima.
El impulso central, o activación central, puede influenciar la eficacia y el modo del impulso neural en el sistema nervioso central, y es importante determinar si la fatiga se debe a factores centrales o periféricos. La mejorada resistencia del sistema neuromuscular observada en algunas situaciones, especialmente a bajas intensidades de contracción, puede ser explicada por el remodelamiento del pool de unidades motoras, con una proporción relativamente mayor de fibras tipo I resistentes a la fatiga (Rice and Cunningham, 2002). Sin embargo, el potencial oxidativo de los músculos no necesariamente se incrementa, debido a los cambios significativos en la actividad oxidativa de las enzimas y a la declinación de la función mitocondrial que resulta del envejecimiento. Si se consideran las alteraciones en el sistema neuromuscular, la naturaleza de la tarea puede ser un factor que influencie la fatiga en los adultos mayores. Los estudios que han examinado los efectos del sexo y la edad sobre la fatigabilidad han incluido otra importante variable al concepto de fatiga específica de la tarea: debido a las probables diferencias en la estructura y función de los músculos y posiblemente a los cambios diferenciales asociados con la edad entre los sexos, es razonable esperar que los efectos de la fatiga sean dependientes del sexo (Rice and Cunningham, 2002)
Control de la fuerza
El proceso de envejecimiento está acompañado por un enlentecimiento del control motor, a pesar del mantenimiento de adecuados niveles de fuerza, potencia y resistencia. Esto puede afectar significativamente el éxito de los adultos mayores para realizar actividades cotidianas. La desmejora del control motor puede afectar los músculos de los brazos y manos limitando así la realización de importantes funciones o actividades que requieren de un apropiado control y precisión. Del mismo modo, la reducción del control motor en los músculos de las extremidades inferiores puede afectar el equilibrio y la zancada durante la marcha, predisponiendo así a los adultos mayores a sufrir accidentes por caídas.
También se ha observado que los adultos mayores de
70 años realizan con menor precisión ciertas destrezas manuales y requieren de
mayor tiempopara manipular objetos
pequeños (Patten and Kamen, 2000, Grabiner and Enoka, 1995). Se ha sugerido que la
reducida capacidad para mantener una fuerza submáxima constante se debe, en
parte, a la mayor fuerza ejercida por el mayor número de unidades motoras de
bajo umbral en los adultos mayores. Esto podría reflejar el remodelamiento de
las unidades motoras asociado con la edad que se discutiera en secciones
previas. Además, como ya se mencionó la tasa de descarga de las unidades motoras
se reduce con la edad, por lo que la graduación de la fuerza en los adultos
mayores dependerá más del reclutamiento, desmejorando así el control de la
fuerza. Lo que siempre se debe tener presente es que, cualquiera sean los
mecanismos, la lentitud de movimiento, la reducción de la destreza motora, la
desmejora de la coordinación y la desmejora del equilibrio, combinado con la
pérdida de fuerza resultará en que los individuos ancianos experimenten
dificultades para realizar actividades cotidianas. Las lesiones por caídas son
una de las consecuencias más serias de estas desmejoras (Nardone et al., 1995, Smith et al., 1996, Thelen et al., 2000). La desmejora del
equilibrio y la marcha son dos de los factores de riesgo más significativos de
limitación en la movilidad y de caídas en los ancianos. Pero es claro que el
incremento en la actividad física y la participación en programas de ejercicio
puede mejorar en gran medida la movilidad y reducir la incidencia de caídas.
Este es un fragmento de uno de los apuntes de cátedra de la asignatura "Fisiología del Envejecimiento" del módulo 1 del Posgrado de Actividad Física en Adultos Mayores.
Autor: Lic. Sebastián Del Rosso.
REFERENCIAS
2. ACSM 1998. American College of Sports Medicine Position Stand. Exercise and physical activity for older adults. Med Sci Sports Exerc, 30, 992-1008.
3. ACSM 2000. ACSM's Guidelines for exercise testing and prescription Philadelphia, Lippincott Williams & Wilkins.
4. ANDERSEN, J. L., TERZIS, G. & KRYGER, A. 1999. Increase in the degree of coexpression of myosin heavy chain isoforms in skeletal muscle fibers of the very old. Muscle Nerve, 22, 449-54.
5. ANSVED, T. & LARSSON, L. 1990. Quantitative and qualitative morphological properties of the soleus motor nerve and the L5 ventral root in young and old rats. Relation to the number of soleus muscle fibers. J Neurol Sci, 96, 269-82.
6. AOYAGI, Y. & SHEPHARD, R. J. 1992. Aging and muscle function. Sports Med, 14, 376-96.
7. ASTRAND, P. O., BERGH, U. & KILBOM, A. 1997. A 33-yr follow-up of peak oxygen uptake and related variables of former physical education students. J Appl Physiol, 82, 1844-52.
8. AU, W. W., SIERRA-TORRES, C. H., CAJAS-SALAZAR, N. & SALAMA, S. A. 1999. Inheritance of polymorphic metabolizing genes on environmental disease and quality of life. Mutat Res, 428, 131-40.
9. AUSTIN, M. A., FRIEDLANDER, Y., NEWMAN, B., EDWARDS, K., MAYER-DAVIS, E. J. & KING, M. C. 1997. Genetic influences on changes in body mass index: a longitudinal analysis of women twins. Obes Res, 5, 326-31.
10. BALAGOPAL, P., ROOYACKERS, O. E., ADEY, D. B., ADES, P. A. & NAIR, K. S. 1997. Effects of aging on in vivo synthesis of skeletal muscle myosin heavy-chain and sarcoplasmic protein in humans. Am J Physiol, 273, E790-800.
11. BALTES, M. M. & LANG, F. R. 1997. Everyday functioning and successful aging: the impact of resources. Psychol Aging, 12, 433-43.
12. BARER, B. M. 1994. Men and women aging differently. Int J Aging Hum Dev, 38, 29-40.
13. BARJA, G. & HERRERO, A. 2000. Oxidative damage to mitochondrial DNA is inversely related to maximum life span in the heart and brain of mammals. FASEB J, 14, 312-8.
14. BARNES, R. F., RASKIND, M., GUMBRECHT, G. & HALTER, J. B. 1982. The effects of age on the plasma catecholamine response to mental stress in man. J Clin Endocrinol Metab, 54, 64-9.
15. BASSEY, E. J. 1997. Measurement of muscle strength and power. Muscle Nerve Suppl, 5, S44-6.
16. BASSEY, E. J., FIATARONE, M. A., O'NEILL, E. F., KELLY, M., EVANS, W. J. & LIPSITZ, L. A. 1992. Leg extensor power and functional performance in very old men and women. Clin Sci (Lond), 82, 321-7.
17. BAUMGARTNER, R. N., KOEHLER, K. M., GALLAGHER, D., ROMERO, L., HEYMSFIELD, S. B., ROSS, R. R., GARRY, P. J. & LINDEMAN, R. D. 1998. Epidemiology of sarcopenia among the elderly in New Mexico. Am J Epidemiol, 147, 755-63.
18. BAUMGARTNER, R. N., WATERS, D. L., GALLAGHER, D., MORLEY, J. E. & GARRY, P. J. 1999. Predictors of skeletal muscle mass in elderly men and women. Mech Ageing Dev, 107, 123-36.
19. BEAMER, W. G., DONAHUE, L. R., ROSEN, C. J. & BAYLINK, D. J. 1996. Genetic variability in adult bone density among inbred strains of mice. Bone, 18, 397-403.
20. BEN-YEHUDA, A. & WEKSLER, M. E. 1992a. Host resistance and the immune system. Clin Geriatr Med, 8, 701-11.
21. BEN-YEHUDA, A. & WEKSLER, M. E. 1992b. Immune senescence: mechanisms and clinical implications. Cancer Invest, 10, 525-31.
22. BIGLAND-RITCHIE, B., RICE, C. L. & GARLAND, R. J. 1995. Task-dependent factors in fatigue of human voluntary contractions. In: GANDEVIA, S. C., ENOKA, R. M. & MCCOMAS, A. J. (eds.) Fatigue: Neurological and muscular mechanisms. New York: Plenum Press.
23. BJORNTORP, P. 1997. Body fat distribution, insulin resistance, and metabolic diseases. Nutrition, 13, 795-803.
24. BLOOMFIELD, S. A. 1997. Changes in musculoskeletal structure and function with prolonged bed rest. Med Sci Sports Exerc, 29, 197-206.
25. BOSCO, C. & KOMI, P. V. 1980. Influence of aging on the mechanical behavior of leg extensor muscles. Eur J Appl Physiol Occup Physiol, 45, 209-19.
26. BOUCHARD, C. & DESPRÉS, J. C. 1988. Variation in fat distribution with age and health implications. In: SPIRDUSO, W. W. & ECKERT, H. (eds.) Physical activity and aging. The academy papers 22. Champaign: Human Kinetics
27. BOWLES, J. T. 1998. The evolution of aging: a new approach to an old problem of biology. Med Hypotheses, 51, 179-221.
28. BOYD, W. 1961. Textbook of pathology. Structure and function in disease Philadelphia, Lea & Febiger
29. BRACH, J. S., SIMONSICK, E. M., KRITCHEVSKY, S., YAFFE, K. & NEWMAN, A. B. 2004. The association between physical function and lifestyle activity and exercise in the health, aging and body composition study. J Am Geriatr Soc, 52, 502-9.
30. BRILL, P. A., MACERA, C. A., DAVIS, D. R., BLAIR, S. N. & GORDON, N. 2000. Muscular strength and physical function. Med Sci Sports Exerc, 32, 412-6.
31. BROOKS, S. V. & FAULKNER, J. A. 1994. Skeletal muscle weakness in old age: underlying mechanisms. Med Sci Sports Exerc, 26, 432-9.
32. BROWN, M., FISHER, J. S. & SALSICH, G. 1999. Stiffness and muscle function with age and reduced muscle use. J Orthop Res, 17, 409-14.
33. BROWN, M. C., HOLLAND, R. L. & HOPKINS, W. G. 1981. Motor nerve sprouting. Annu Rev Neurosci, 4, 17-42.
34. BROWN, W. F. 1972. A method for estimating the number of motor units in thenar muscles and the changes in motor unit count with ageing. J Neurol Neurosurg Psychiatry, 35, 845-52.
35. BUTTERWORTH, M., MCCLELLAN, B. & ALLANSMITH, M. 1967. Influence of sex in immunoglobulin levels. Nature, 214, 1224-5.
36. CARMELLI, D. 1982. Intrapair comparisons of total life span in twins and pairs of sibs. Hum Biol, 54, 525-37.
37. CARMICHAEL, C. M. & MCGUE, M. 1995. A cross-sectional examination of height, weight, and body mass index in adult twins. J Gerontol A Biol Sci Med Sci, 50, B237-44.
38. CEFALU, W. T., WANG, Z. Q., WERBEL, S., BELL-FARROW, A., CROUSE, J. R., 3RD, HINSON, W. H., TERRY, J. G. & ANDERSON, R. 1995. Contribution of visceral fat mass to the insulin resistance of aging. Metabolism, 44, 954-9.
39. CLANTON, T. L., ZUO, L. & KLAWITTER, P. 1999. Oxidants and skeletal muscle function: physiologic and pathophysiologic implications. Proc Soc Exp Biol Med, 222, 253-62.
40. CLARKSON, P. M., KROLL, W. & MELCHIONDA, A. M. 1981. Age, isometric strength, rate of tension development and fiber type composition. J Gerontol, 36, 648-53.
41. COLLINS, K. J., EXTON-SMITH, A. N. & DORE, C. 1981. Urban hypothermia: preferred temperature and thermal perception in old age. Br Med J (Clin Res Ed), 282, 175-7.
42. CONLEY, K. E., JUBRIAS, S. A. & ESSELMAN, P. C. 2000. Oxidative capacity and ageing in human muscle. J Physiol, 526 Pt 1, 203-10.
43. CONNIDIS, I. 1989. Family ties and aging, Toronto, Butterworth
44. COPELAND, J. L., CHU, S. Y. & TREMBLAY, M. S. 2004. Aging, physical activity, and hormones in women--a review. J Aging Phys Act, 12, 101-16.
45. CHAKRAVARTI, S., COLLINS, W. P., FORECAST, J. D., NEWTON, J. R., ORAM, D. H. & STUDD, J. W. 1976. Hormonal profiles after the menopause. Br Med J, 2, 784-7.
46. DE KONING, P., WIENEKE, G. H., VAN DER MOST VAN SPIJK, D., VAN HUFFELEN, A. C., GISPEN, W. H. & JENNEKENS, F. G. 1988. Estimation of the number of motor units based on macro-EMG. J Neurol Neurosurg Psychiatry, 51, 403-11.
47. DEFRONZO, R. A., BONADONNA, R. C. & FERRANNINI, E. 1992. Pathogenesis of NIDDM. A balanced overview. Diabetes Care, 15, 318-68.
48. DEHN, M. M. & BRUCE, R. A. 1972. Longitudinal variations in maximal oxygen intake with age and activity. J Appl Physiol, 33, 805-7.
49. DESPRES, J. P. 1998. The insulin resistance-dyslipidemic syndrome of visceral obesity: effect on patients' risk. Obes Res, 6 Suppl 1, 8S-17S.
50. DILL, D. B., ROBINSON, S. & ROSS, J. C. 1967. A longitudinal study of 16 champion runners. J Sports Med Phys Fitness, 7, 4-27.
51. DIONNE, I. J., KINAMAN, K. A. & POEHLMAN, E. T. 2000. Sarcopenia and muscle function during menopause and hormone-replacement therapy. J Nutr Health Aging, 4, 156-61.
52. DOHERTY, T. J. 2003. Invited review: Aging and sarcopenia. J Appl Physiol, 95, 1717-27.
53. DOHERTY, T. J. & BROWN, W. F. 1993. The estimated numbers and relative sizes of thenar motor units as selected by multiple point stimulation in young and older adults. Muscle Nerve, 16, 355-66.
54. DOHERTY, T. J. & BROWN, W. F. 1997. Age-related changes in the twitch contractile properties of human thenar motor units. J Appl Physiol, 82, 93-101.
55. DOHERTY, T. J., VANDERVOORT, A. A. & BROWN, W. F. 1993. Effects of ageing on the motor unit: a brief review. Can J Appl Physiol, 18, 331-58.
56. DRINKWATER, B. L., BEDI, J. F., LOUCKS, A. B., ROCHE, S. & HORVATH, S. M. 1982. Sweating sensitivity and capacity of women in relation to age. J Appl Physiol, 53, 671-6.
57. DUBLIN, L. L., LOTKA, A. J. & SPIEGELMAN, M. 1949. Length of life: A study of the life table, New York, Ronald Press.
58. EASTELL, R. & RIGGS, B. L. 1988. Diagnostic evaluation of osteoporosis. Endocrinol Metab Clin North Am, 17, 547-71.
59. EKONOMOV, A. L., RUDD, C. L. & LOMAKIN, A. J. 1989. Actuarial aging rate is not constant within the human life span. Gerontology, 35, 113-20.
60. EL-ZEIN, R., ZWISCHENBERGER, J. B., WOOD, T. G., ABDEL-RAHMAN, S. Z., BREKELBAUM, C. & AU, W. W. 1997. Combined genetic polymorphism and risk for development of lung cancer. Mutat Res, 381, 189-200.
61. ENGELHARDT, J. K., MORALES, F. R., YAMUY, J. & CHASE, M. H. 1989. Cable properties of spinal cord motoneurons in adult and aged cats. J Neurophysiol, 61, 194-201.
62. ENOKA, R. M. 1996. Eccentric contractions require unique activation strategies by the nervous system. J Appl Physiol, 81, 2339-46.
63. ERIM, Z., BEG, M. F., BURKE, D. T. & DE LUCA, C. J. 1999. Effects of aging on motor-unit control properties. J Neurophysiol, 82, 2081-91.
64. ERSHLER, W. B. 1993. The influence of an aging immune system on cancer incidence and progression. J Gerontol, 48, B3-7.
65. ESPELAND, M. A., STEFANICK, M. L., KRITZ-SILVERSTEIN, D., FINEBERG, S. E., WACLAWIW, M. A., JAMES, M. K. & GREENDALE, G. A. 1997. Effect of postmenopausal hormone therapy on body weight and waist and hip girths. Postmenopausal Estrogen-Progestin Interventions Study Investigators. J Clin Endocrinol Metab, 82, 1549-56.
66.ESSEN-GUSTAVSSON, B. & BORGES, O. 1986. Histochemical and metabolic characteristics of human skeletal muscle in relation to age. Acta Physiol Scand, 126, 107-14.
67. EVANS, W. J. 2000. Exercise strategies should be designed to increase muscle power. J Gerontol A Biol Sci Med Sci, 55, M309-10.
68. EVANS, W. J. 2002. Effects of exercise on senescent muscle. Clin Orthop Relat Res, S211-20.
69. EVANS, W. J. & CANNON, J. G. 1991. The metabolic effects of exercise-induced muscle damage. Exerc Sport Sci Rev, 19, 99-125.
70. EVANS, W. J. & CYR-CAMPBELL, D. 1997. Nutrition, exercise, and healthy aging. J Am Diet Assoc, 97, 632-8.
71. FAHN, H. J., WANG, L. S., HSIEH, R. H., CHANG, S. C., KAO, S. H., HUANG, M. H. & WEI, Y. H. 1996. Age-related 4,977 bp deletion in human lung mitochondrial DNA. Am J Respir Crit Care Med, 154, 1141-5.
72. FAURE-DELANEF, L., BAUDIN, B., BENETEAU-BURNAT, B., BEAUDOIN, J. C., GIBOUDEAU, J. & COHEN, D. 1998. Plasma concentration, kinetic constants, and gene polymorphism of angiotensin I-converting enzyme in centenarians. Clin Chem, 44, 2083-7.
73. FERGUSON, F. G., WIKBY, A., MAXSON, P., OLSSON, J. & JOHANSSON, B. 1995. Immune parameters in a longitudinal study of a very old population of Swedish people: a comparison between survivors and nonsurvivors. J Gerontol A Biol Sci Med Sci, 50, B378-82.
74. FERRANNINI, E., VICHI, S., BECK-NIELSEN, H., LAAKSO, M., PAOLISSO, G. & SMITH, U. 1996. Insulin action and age. European Group for the Study of Insulin Resistance (EGIR). Diabetes, 45, 947-53.
75. FIATARONE, M. A., MARKS, E. C., RYAN, N. D., MEREDITH, C. N., LIPSITZ, L. A. & EVANS, W. J. 1990. High-intensity strength training in nonagenarians. Effects on skeletal muscle. JAMA, 263, 3029-34.
Este es un fragmento de uno de los apuntes de cátedra de la asignatura "Fisiología del Envejecimiento" del módulo 1 del Posgrado de Actividad Física en Adultos Mayores.
Autor: Lic. Sebastián Del Rosso.
