La Historia Menstrual como Factor Determinante de la Densidad Ósea en Jóvenes Atletas
Barbara L Drinkwater, Barbara Bruemmer y Charles H Chesnut
Artículo publicado en el journal PubliCE, Volumen 0 del año 1990.
Publicado 4 de septiembre de 2006
Resumen
Palabras clave: amenorrea, ciclo menstrual, densidad mineral ósea, alto rendimiento
INTRODUCCION
Durante los últimos 4 años, algunos investigadores reportaron una densidad ósea vertebral significativamente menor en jóvenes atletas amenorreicas en comparación con jóvenes eumenorreicas. En dos estudios (1, 2) se observó que esta pérdida ósea era aparentemente revertida cuando mujeres examenorreicas reanudaban los ciclos normales seguidos por una reducción en la actividad y un pequeño aumento de peso. En ambos grupos, el incremento en la densidad ósea fue de aproximadamente 6% en un período de 14 meses. A pesar de que este cambio fue alentador, en nuestro artículo (1) observábamos que era prematuro asumir que la masa ósea de estas jóvenes mujeres pudiera eventualmente retornar a los niveles normales para su edad.
Recientes observaciones en nuestro laboratorio nos han sugerido que en verdad, este aumento puede ser limitado; nos preguntamos, entonces, si largos períodos de irregularidades menstruales pueden ejercer efectos prolongados sobre la densidad mineral ósea. El aumento en la densidad ósea (6,3%) observado durante nuestro estudio anterior, descendió a un 3% al año siguiente y luego cesó durante los dos años posteriores (B.L.D., B.B., y C.H., datos no publicados). La densidad ósea lumbar de estas mujeres permaneció por debajo del promedio para su edad, 4 años después de haber reanudado ciclos menstruales normales.
El presente estudio fue diseñado para examinar, en forma más cercana, la relación entre la densidad mineral ósea actual, la historia menstrual y el estado menstrual presente en mujeres jóvenes.
SUJETOS Y METODOS
Sujetos
Noventa y siete mujeres activas, con edades entre 18 y 38 años, participaron en este estudio, dando su consentimiento por escrito según los procedimientos establecidos por el comité de Revisión de Sujetos Humanos de la Universidad de Washington (Seattle). Todas las mujeres eran no fumadoras, entrenaban en forma regular al menos 4 veces por semana durante 45 minutos o más por sesión, no habían utilizado pastillas anticonceptivas y no tenían ningún problema médico que afectara su metabolismo óseo. Las mujeres fueron convocadas a través de publicidad en los medios noticiosos y en negocios de artículos deportivos, a través de cartas enviadas a clubes y médicos, y con posters pegados en el campo universitario.
La información acerca de la historia menstrual y nivel de actividad física de cada mujer fue obtenida a través de un cuestionario durante la primera visita. Con esta entrevista preliminar se descartaron del estudio a aquellas mujeres con irregularidades menstruales previas a la iniciación del entrenamiento, o que no estaban asociadas con el aumento súbito en la intensidad del entrenamiento. Cuatro mujeres eran amenorreicas primarias que habían comenzado ballet o atletismo en el comienzo en el comienzo de su adolescencia.
Para los propósitos de este estudio, el estado menstrual actual fue definido como regular (10 a 13 ciclos por año), oligomenorreico (3 a 6 ciclos por año con intervalos mayores a 36 días), o amenorreico (no más de 2 ciclos por año, o ningún ciclo durante los últimos 6 meses). Las mujeres que tenían entre 7 y 9 períodos anuales fueron excluidas del estudio para poder demarcar más claramente entre las oligomenorreicas y las amenorreicas. La historia menstrual fue categorizada como: “habiendo tenido siempre ciclos menstruales regulares”®, o “habiendo tenido episodios de oligomenorrea”(O), o “amenorrea”(A). A las mujeres con historia de amenorrea se les preguntó la edad que tenían cuando cesó la menstruación y la duración de cada episodio amenorreico. La combinación de la duración de todos los períodos amenorreicos fue calculada en meses.
Todas las combinaciones de los modelos menstruales presentes y pasados fueron ubicadas en una escala de 1 a 9 por dos endocrinólogos, de acuerdo a sus estimaciones sobre el potencial efecto en la masa ósea. Por ejemplo, el modelo “siempre haber tenido períodos regulares” (R/R) estuvo ranqueado primero en la escala (como 1), teniendo el efecto más positivo sobre el hueso. Aquellas amenorreicas actuales que tuvieron períodos de amenorrea en el pasado (A/A), fueron ubicadas últimas (como 9), teniendo los patrones más negativos.
Protocolo
Se utilizaron técnicas de absorciometría fotónica dual (Series 84, Ohio Nuclear, Cleveland, Ohio) para medir la masa ósea en cinco sitios (1) vértebras lumbares L1 a L4; (2) cuello del fémur; (3) cabeza femoral, extendiendo la zona hasta 3,6 cm por debajo del trocánter menor; (4) tibia, 6,4 cm por debajo del punto medio entre el maléolo lateral y el cóndilo lateral; y (5) porción paralela del peroné. Se usaron técnicas de absorciometría fotónica simple (Analizador Oseo Cameron, Modelo 178, The Norland Co., Fort Atkinson, Wis) para medir la masa ósea en dos puntos radiales: un décimo (S1) y un quinto (S2) de la longitud del antebrazo. Las técnicas específicas para ambas mediciones fueron previamente descriptas (3). La confiabilidad de estas técnicas fue calculada a través de test-retest de 13 mujeres jóvenes normales a lo largo de un período de seis meses. Los coeficientes de correlación fueron: vértebras lumbares, r=0,98; radio distal, r=0,98; cabeza radial, r=0,85; cuello del fémur, r=0,88; fémur, r=0,87; peroné, r=0,96; y tibia, r=0,81. Los errores standard de estimación variaron desde un valor bajo de 0,02 g/cm² para el radio distal y vértebras lumbares, hasta un valor alto de 0,10 g/cm² para el fémur, promediando 0,04 g/cm² para los siete sitios. El estado menstrual actual fue confirmado a través de muestras de sangre (10 mL) con intervalos de 7 días durante 4 semanas. Las muestras de sangre se obtuvieron entre las 8 y las 10 de la mañana luego de un ayuno nocturno. Se dejó coagular la sangre, se la centrifugó y se la guardó a -20ºC hasta que fuera utilizada para evaluar los niveles de estradiol y de progesterona, en la forma descripta previamente (3).
Se midieron los pliegues cutáneos triccipital, subescapular, abdominal, suprailíaco y femoral medial, utilizando calibres Lange (4). La suma de estos cinco pliegues, considerada como una estimación de la masa adiposa, fue comparada con los valores normales para este grupo erario de mujeres.
Los datos fueron procesados utilizando un análisis de variancia de factor simple a través de los grupos menstruales, seguido por el Tests Neuman-Keuls para comparaciones múltiples post hoc. Las relaciones entre las variables fueron obtenidas usando una correlación producto-momento para los datos proporcionales e intervalados, la correlación Orden de Rango de Spearman para los datos ordinales, y técnicas de regresión múltiple. Todas las referencias como diferencias o relaciones significativas implican una probabilidad igual o menor que P<0,05.
RESULTADOS
Hubo una significativa relación lineal entre la densidad vertebral actual de estas mujeres y sus patrones menstruales pasados y presentes (Figura 1). Un análisis de variancia a través de los nueve grupos menstruales mostró diferencias significativas (P<0,01) entre el grupo 1 y los grupos 8 y 9, pero no entre los grupos 2 a 7. Por lo tanto, los nueve grupos fueron divididos en tres: grupo1, aquellas mujeres que siempre habían tenido ciclos regulares (grupo 1 originalmente, R/R); grupo 2, aquellas mujeres que habían tenido períodos de oligomenorrea o amenorrea espaciados con períodos regulares y mujeres que actualmente eran oligomenorreicas (grupos 2 a 7 originalmente, R/O/A); y grupo 3, aquellas mujeres que actualmente eran amenorreicas y que en el pasado también habían sido amenorreicas u oligomenorreicas (grupos 8 y 9 originalmente, A/O).
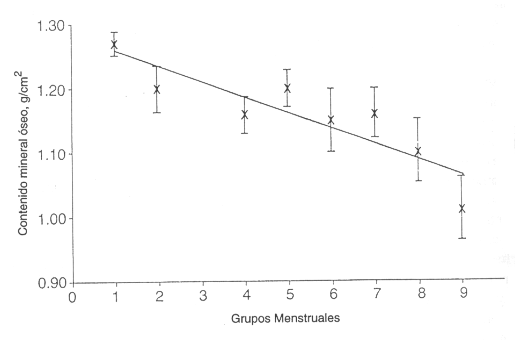
Figura 1. Regresión de la densidad ósea vertebral (L a L4) sobre la
historia menstrual de 97 mujeres. Se muestra la media ±DS para cada uno de los
siguientes grupos: (1) R, n= 21; (2) R/O, n= 7; (3) O/R, n= 2; (4) O/O, n= 5;
(5) R/A, n= 22; (6) A/R, n=9; (7) O/A, n= 10; (8) A/O, n= 10; y (9) A/A, n=11. R
indica regular; O, oligomenorreica; y A, amenorreica.
El patrón es estado actual/historia. Vértebras lumbares g/cm²=1,288-0,025 modelos menstruales; r=-0,43; SE est= 0,14. Los promedios a menos de 5 sujetos no fueron graficado, a pesar de que los puntos de datos individuales fueron incluidos en el análisis.
Se encontró una diferencia significativa en la densidad mineral ósea vertebral entre cada grupo menstrual (Tabla 1). Las mujeres que siempre habían tenido períodos regulares tuvieron los valores más altos, las mujeres con irregularidades ocasionales tuvieron un promedio 6% menor, y aquellas que nunca fueron regulares tuvieron un promedio 17% menor. Los grupos 1 y 2 tuvieron una densidad femoral mayor que el grupo 3. No hubo diferencias en ningún otro sitio.
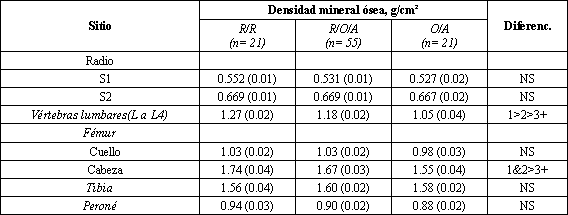
Tabla 1. Densidades minerales óseas en siete sitios, en mujeres agrupadas
en tres grupos menstruales. *R/R indica “siempre regular”; R/O/A es “períodos
regulares con episodios de oligomenorrea y/o amenorrea”; O/A, significa
“oligomenorreica o amenorreica” desde la menarca. NS= diferencias no
significativas. Los valores representan las medias (+/- SE). +P<0,01.
Las características físicas y los regímenes de entrenamiento de estos tres grupos difirieron en varios aspectos (Tabla 2). Las mujeres que nunca habían tenido ciclos regulares eran más jóvenes, pesaban menos y habían tenido la menarca más tarde. Además habían comenzado el entrenamiento intenso siendo más jóvenes, entrenaban con mayor frecuencia y durante más tiempo cada sesión, y corrían más millas que las mujeres en el grupo 1. El grupo 2 fue similar al grupo 3 en cuanto a los entrenamientos y a la edad, pero estas mujeres comenzaron a entrenar siendo de mayor edad y además tenían más peso.
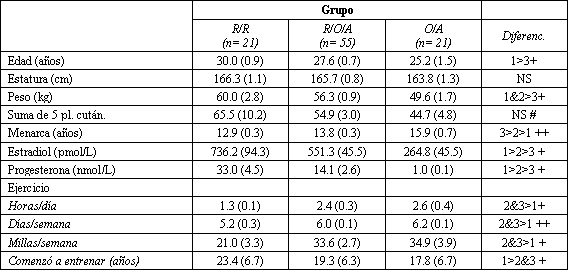
Tabla 2. Características físicas y regímenes de entrenamiento en mujeres,
divididas en tres grupos menstruales. R/R indica “siempre regular”; R/O/A es
“períodos regulares con episodios de oligomenorrea y/o amenorrea”; O/A significa
“oligomenorreica o amenorreica desde la menarca”. NS= no significativa. Los
valores representan las medias (±SE). + P<0,05. ++P<0,01. #Los tamaños de las
muestras para los datos de los pliegues cutáneos son: R/R= 13; R/O/A=29; y
O/A=11.
El peso corporal fue una variable predictiva significativa de la densidad ósea actual en todos los sitios, a pesar de que la historia menstrual también ayudó significativamente a la predicción de las densidades del fémur y de las vértebras (Tabla 3). Un análisis de covariancia, con el peso corporal como covariante para las densidades femoral y vertebral, reportó que hubo diferencias significativas entre los tres grupos menstruales en la columna pero no en el fémur. La influencia del peso corporal fue más evidente en el grupo 3, donde el peso solamente, influyó en el 50% de la variación total de la densidad vertebral (r=0,71, P<0,01). El peso no fue un factor para el grupo 1 (r=0,04), pero fue una variable significativamente predictiva para el grupo 2 (r=0,46, P<0,01). Las variables de entrenamiento jugaron un papel significativo en la predicción de la densidad ósea en otros sitios, mientras que la edad de la menarca fue una variable significativa en la predicción de la densidad del peroné y del radio distal (Tabla 3). La densidad mineral ósea de estas 97 mujeres, cuyas edades variaron entre 18 y 38 años, fue independiente de la edad, excepto para el cuello femoral (r=-0,27, P<0,01). Los coeficientes de correlación en los otros seis sitios variaron desde -0,10 a 0,12. La duración acumulativa de los períodos amenorreicos, que variaron entre 0 a 121 meses (media= 35,2 meses), y de 6 a 156 meses (media= 50,4 meses) para los grupos R/O/A y O/A, respectivamente, no estuvo significativamente relacionada con la densidad ósea en ningún sitio. La edad de la menarca estuvo negativamente correlacionada con la densidad ósea del radio distal (r= -0,28, P<0,01) y del peroné (r= -0,31, P<0,01).

Tabla 3. Ecuaciones de regresión múltiple para predecir la densidad
mineral ósea en siete sitios (N= 97). M indica historia menstrual; P indica peso
corporal (en kg); H representa números de horas por día de ejercicio; D es
número de días por semana de ejercicio; pubertad= edad de la menarca (en años);
SE est= Estimación del error standard.
COMENTARIOS
La oligomenorrea/amenorrea experimentada por muchas atletas jóvenes fue considerada, por tiempos, una condición benigna y reversible hasta que varios investigadores observaron una densidad mineral ósea menor en estas mujeres hipoestrogénicas, comparadas con mujeres que menstruaban normalmente (3, 5, 8). Desde entonces, dos estudios (1, 2) han reportado que este déficit era parcialmente reversible durante el primer año, luego de la reanudación de la menstruación. Sin embargo, estudios posteriores (9, 10) sugieren que algunas mujeres podrían no recuperar completamente la pérdida ósea, ocasionada por largos períodos de interrupción en los ciclos normales de menstruación. Un resumen reciente (9), confirmó nuestro informe previo (10), sobre el hecho que la historia menstrual, así como el estado menstrual actual, influyen significativamente en la densidad mineral. Utilizando técnicas de tomografía computada, Cann y cols. (9) concluyeron que la mejor variable para predecir la densidad trabecular era la historia menstrual, y que la amenorrea, sino se la trataba a tiempo, conducía a la pérdida irreversible de masa ósea.
Nuestros datos actuales sugieren que el problema se limita a sitios específicos y que no representa una desmineralización general del esqueleto. Estudios previos (3,5,8) con atletas amenorreicas y eumenorreicas han examinado la densidad ósea en dos sitios, vértebras lumbares y radio. El hecho de observar una menor densidad ósea en la columna pero no en el radio en atletas amenorreicas, llevó a la conclusión que el estado hipoestrogénico de estas mujeres afectaba al hueso trabecular, pero no al cortical. Si esto es así, uno también podría suponer que hay diferencias entre los grupos menstruales en el radio distal (20% trabecular) y en el cuello del fémur (50% a 75% trabecular). Sin embargo, no se encontraron tales diferencias. Una vez que los datos de la cabeza de fémur fueron corregidos por las diferencias de peso corporal entre grupos, los mismos sólo se diferenciaron en la densidad de las vértebras lumbares. Parecería que cualquier déficit en la densidad ósea, generados por episodios previos de oligomenorrea o amenorrea, se limita a las vértebras. Esta pérdida preferencial en las vértebras difiere de la osteoporosis de tipo uno o postmenopáusica, en la cual la disminución de la masa ósea y el aumento de las fracturas se ve tanto en el radio distal como en las vértebras. Pudiera ser que el estilo de vida activo de las jóvenes amenorreicas atenúe la pérdida ósea en sitios apendiculares. También es posible que la densidad ósea en el punto radial ultral-distal, donde la proporción de hueso trabecular es mayor, pueda discriminar entre los grupos.
La densidad ósea en los siete puntos tuvo una relación significativa con el peso corporal. Existen tres posibles explicaciones para esta relación: (1) el peso corporal es representativo del tamaño corporal, y las mujeres más grandes tienen una mayor masa ósea; (2) el peso corporal es la carga de trabajo en ejercicios de sobrecarga, y el esqueleto aumenta la masa ósea en respuesta al mayor stress mecánico; y (3) hay un aumento en la conversión de andrógenos a estrón en el tejido adiposo de las mujeres más obesas.
Debido a que la suma de los cinco pliegues cutáneos, que representa una estimación de la masa grasa subcutánea, en cada grupo menstrual tuvo un promedio de 44% a 64% de la norma para mujeres sedentarias de la misma edad (media, 102,2 mm; n=385) (11), es poco probable que los niveles más altos de estrón en las mujeres pesadas, pero aún magras, sea un factor. De hecho, Buchanan y cols. (12) en un estudio reciente, observaron que no había relación entre los niveles de estrón y la densidad ósea vertebral (r=0,19) en 30 mujeres jóvenes de peso similares. Debido a que el peso corporal es una variable significativamente predictiva tanto para los puntos que soportan peso como para los que no lo soportan, las mujeres más pesadas podrían haber tenido un potencial biológico para una mayor masa ósea y el beneficio de un mayor stress mecánico durante ejercicios de sobrecarga.
Sin embargo, nuestros datos sugieren que hay una importante interacción entre el patrón menstrual, el peso corporal, y la densidad vertebral. Los niveles normales de estrógeno aparentemente superan cualquier efecto negativo que pueda ocasionar la disminución de peso corporal. A medida que las irregularidades menstruales aumentaban en seriedad, el peso se convertía en un factor más importante. Si se pudiera asumir que el stress mecánico en los ejercicios de sobrecarga aumenta en la medida en que aumenta el peso, parecería razonable pensar que el ejercicio tendría un efecto positivo sobre la masa ósea, aún en estados hipoestrogénicos. Hay algunas evidencias que sostienen esta hipótesis. Rigotti y cols. (13) observaron que las mujeres activas, en un grupo con anorexia nerviosa, tenían una mayor densidad en el radio que las mujeres sedentarias. Un efecto similar se observó en la columna vertebral. Se reportó que corredoras de elite que eran amenorreicas tenían una menor densidad vertebral que sus compañeras eumenorreicas, pero una mayor densidad que las mujeres amenorreicas sedentarias (6).
Los datos retrospectivos son difíciles de validar. Sin embargo, la mayoría de las mujeres jóvenes están muy concientes de las interrupciones en sus ciclos menstruales, y nuestras participantes no tuvieron dificultad en recabar su historia menstrual desde la pubertad. Muchas de ellas tenían un registro con los períodos menstruales y fueron muy específicas en las edades cuando cesaron o comenzaron a ser irregulares sus ciclos menstruales. Cualquier error de asignación a los tres grupos menstruales (R/R, R/O/A, u O/A) es mínimo.
La estimación de la duración total de los períodos amenorreicos puede ser menos precisa, debido a que esto requiere no sólo la recordación del evento, si no también la duración de cada uno. Los errores de estimación pueden explicar porqué la duración acumulativa de los períodos amenorreicos no fue una variable predictiva para la densidad ósea en ninguno de los siete puntos. A pesar de que Lloyd y cols. (14) reportaron una asociación significativa entre el número de ciclos ausentes desde la menarca y la densidad vertebral actual en jóvenes atletas universitarias esto era con referencia a las diferencias entre los promedios, no un coeficiente de correlación o una regresión lineal significativa. El efecto de la duración total de los períodos amenorreicos en nuestro estudio podría haber sido disminuido por la reanudación de la menstruación en algunas participantes, con una consecuente ganancia en densidad ósea. También es posible, como sugirieron Cann y cols. (9), que la pérdida ósea sea más rápida en los 3 o 4 años siguientes al comienzo de la amenorrea, y que luego la tasa de pérdida disminuya con el tiempo. Si esto es así, el marco de oportunidad para prevenir la pérdida con un tratamiento adecuado, estaría dentro de este período de tiempo.
Es prematuro establecer inequívocamente que la disminución de la densidad ósea observada en jóvenes atletas amenorreicas sea irreversible. La duración promedio desde la reanudación de los ciclos menstruales de las examenorreicas en nuestro grupo fue de 4,7 años. Con un período más largo de ciclos regulares, se podría reestablecer una mayor masa ósea. Debido a que el pico de densidad ósea cortical se da al final de la cuarta década de vida (15) y el promedio de edad de nuestro grupo era de sólo 27,6 años, aún puede haber una oportunidad para que las mujeres de bajo peso con una historia de oligomenorrea/amenorrea aumenten la masa ósea femoral. Sin embargo, es menos cierta la edad pico para la densidad ósea trabecular; puede ocurrir al final de la adolescencia como en los primeros años de la tercer década (16,17). Si es así, es poco probable que la densidad ósea vertebral de estas mujeres retorne a los niveles normales. Nuestra experiencia con cinco mujeres en un estudio previo (1) sugiere que hay un límite en la cantidad de masa ósea que se puede recuperar luego de la reanudación de los períodos menstruales.
Los datos recogidos con estas 97 jóvenes deportistas sugieren que extensos períodos de oligomenorrea/amenorrea pueden resultar en una disminución irreversible de la densidad ósea vertebral. La situación es aún más seria para aquellas mujeres con un peso corporal bajo. Varios estudios (6,18,19) han reportado un aumento en la incidencia de fracturas entre las atletas amenorreicas. En nuestro estudio, ya ha habido una fractura femoral y otra pélvica en el grupo 3. El potencial para las fracturas osteoporósicas prematuras, si declina aún más la densidad ósea de estas mujeres, es un hecho que preocupa en gran medida a los investigadores. Sólo el 22% de estas mujeres activas habían tenido siempre períodos regulares, el 14% había experimentado oligomenorrea, y el 64% había tenido al menos un período amenorreico mayor a 6 meses. Esto representa una gran proporción de atletas jóvenes que están en riesgo de adquirir osteoporosis.
A pesar de que aún no se entiende completamente la etiología de esta forma de amenorrea, hay estudios (1,2) que reportan que atletas que moderan sus programas de entrenamiento y aumentan de peso, usualmente reanudan los ciclos normales. Para aquellas mujeres que se resisten a hacer estos cambios, algunas formas de terapia son aconsejables para prevenir lo que puede llegar a ser una pérdida irreversible de masa ósea vertebral.
Este estudio fue financiado por el National Dairy Board y fue administrado en cooperación con el National Dairy Council, Rosemont, I 11.
Para solicitar copias dirigirse a: Department of Medicine, Pacific Medical Center, 1200 S 12th Ave., Seattle, WA 98144(Dr. Drinkwater).
Referencias
1. Drinkwatr BL, Nilson K, Ott S, Chesnut CH III (1986). Bone mineral density after resumption of menses in amenorrheic women. JAMA; 256: 380-382
2. Lindberg JS, Powell MR, Hunt MM, Ducey DE, Wade CE (1987). Increased vertebral bone mineral in response to reduced exercise in amenorrheic runners. West J Med; 146: 39-42
3. Drinkwater BL, Nilson K, Chesnut CH III, Bremner WJ, Shainholtz S, Southworth MB (1984). Bone mineral content of amenorrheic and eumenorrheic athletes. N Engl J Med; 311: 277-281
4. Flint MF, Drinkwater BL, Wells CL, Horvath SM (1977). Validity of estimation body fat of female effect of age and fitness. Hum Biol; 49: 572
5. Cann CE, Martin MC, Genant HK, Jaffe RB (1984). Decreased spinal mineral content in amenorrheic women. JAMA; 251: 626-629
6. Marcus R, Cann C, Madvig P, et al (1985). Menstrual function and bone mass in elite women distance runners. Ann Intern Med; 102: 158-163
7. Lindberg JS, Fears WB, Hunt MM, Powell MR, Boll D, Wade C (1984). Exercise-induced amenorrhea and bone density. Ann Intern Med; 101: 647-648
8. Nelson ME, Fisher EC, Catsos PD, Meredith CN, Turksoy RN, Evans WJ (1986). Diet and bone status in amenorrheic runners. J Clin Nutr; 43: 910-916
9. Cann CE, Cavanaugh DJ, Schnurpfiel K, Martin MC (1988). Menstrual history is the primary determinant of trabecular bone density in women. Med Sci Sports Exerc; 20 (suppl 2): S59. Abstract
10. Drinkwater BL, Bruemmer B, Chesnut CH III (1987). Menstrual history and bone mineral density in female athletes. Med Sci Sports Exerc; 19 (suppl 2): S12. Abstract
11. Drinkwater BL (1988). Training of female athletes. In: Dirix A, Knuttgen HG, Tittel K, eds. The Olympic Book of Sports Medicine. Boston, Mass: Blackwell Scientific Publications Inc; 309-327
12. Buchanan JR, Myers C, Lloyd T, Leuenberger F, Demers LM (1988). Determinants of peak trabecular bone density in women: the role of androgens, estrogen, and exercise. J Bone Min Res; 3: 673-680
13. Rigotti NA, Nussbaum SR, Herzog DB, Neer RM (1984). Osteoporosis in women with anorexia nervosa. N Engl J Med; 311: 1601-1606
14. Lloyd T, Myers C, Buchanan JR, Demers LM (1988). Collegiate women athletes with irregular menses during adolescence have decreased bone density. Obstet Gynecol; 72: 639-642
15. Riggs BL, Melton LJ (1986). Involutional osteoporosis. N Engl J Med; 314: 1676-1686
16. Buchanan JR, Myers C, Lloyd T, Greer RB III (1988). Early vertebral bone loss in normal premenopausal women. J Bone Min Res; 3: 583-587
17. Gilsantz V, Gibbens DT, Carlson M, Boechat MI, Cann C, Schulz EE (1988). Peak trabecular vertebral density: a comparison of adolescent and adult females. Calcif Tissue Int; 43: 260-262
18. Barrow GW, Sha S (1988). Menstrual irregularity and stress fractures in collegiate female distance runners. Am J Sports Med; 16: 209-216
19. Lloyd T, Triantafyllou SJ, Baker ER, et al (1986). Women athletes with menstrual irregularity have increased musculoskeltal injuries. Med Sci Sports Exerc; 18: 374-379