La Ingesta Aguda de Carbohidratos Dietarios afecta la Utilización de Sustratos en Mujeres Activas Saludables
Samuel A Headley, Sara Gregory, Richard Wood, Tracey Matthews, Deborah VanLangen y Jason Sawyer
Department of Exercise Science and Sports Studies, Springfield College, Springfield, MA, USA.
Artículo publicado en el journal PubliCE del año 2010.
Publicado 19 de octubre de 2017
Resumen
Palabras clave: distribución de macronutrientes, ejercicio, bajo consumo de carbohidratos
INTRODUCCIÓN
Se sabe que la creciente prevalencia de las enfermedades cardiovasculares y metabólicas es una preocupación importante para las naciones desarrolladas. Se ha establecido que los efectos metabólicos de una única comida, que incluye niveles de triacilglicéridos post-prandiales, glucosa e insulina, contribuye de manera independiente al riesgo de sufrir enfermedades cardiovasculares y metabólicas (Petitt et al., 2003; Pfeiffer et al., 2005). Además, el medio metabólico que resulta de las comidas individuales con el correr del tiempo puede determinar un patrón metabólico que contribuye al desarrollo de la obesidad y la hiperinsulinemia, que a su vez puede contribuir de manera indirecta al desarrollo de enfermedades cardiovasculares y metabólicas (Zhang et al., 2004). Varios estudios han demostrado que el ejercicio realizado antes de las comidas altas en grasas y altas en carbohidratos con distribuciones variadas de macronutrientes puede alterar de manera beneficiosa la respuesta post-prandial, atenuando la hipertrigliceridemia post-prandial y mejorando la sensibilidad post-prandial a la insulina (Kolifa et al., 2004; Petit et al., 2003; Zhang et al., 2004). Además, varias investigaciones han demostrado que la restricción de la ingesta de carbohidratos dietarios puede mejorar el perfil de riesgo aterogénico, alterando los niveles circulantes de glucosa, insulina y lipoproteínas (Feinman ay Volek, 2008; Wood y Fernandez, 2009).
El efecto de alterar el contenido de carbohidratos y grasas de una única comida sobre las respuestas metabólicas ha sido intensamente estudiado en individuos obesos, sedentarios y en atletas. Kern et al. (2007) determinaron que el ejercicio aeróbico realizado durante 30 minutos al 70% del VO2máx disminuía la glucosa en sangre e incrementaba los ácidos grasos libres circulantes (FFAs) de manera similar después de una comida alta en carbohidratos y alta en grasas en mujeres muy poco activas (menos de 2hrs de ejercicio/semana). De manera similar, Marion-Latard et al. (2003) reportaron que en comparación con la sesión de descanso del control, el ejercicio aeróbico realizado al 50% del VO2máx aumentó las concentraciones plasmáticas de los FFAs, aumentó la oxidación de grasas y bajó los niveles de insulina plasmática tanto en los individuos sedentarios delgados como en los obesos. El ejercicio y el descanso fueron precedidos por un desayuno alto en carbohidratos compuesto de 63% de carbohidratos, 11% de proteínas y 22% de grasas.
Schrauwen et al. (1997) examinaron la respuesta al ejercicio después de una dieta ya sea reducida en grasas o alta en grasas en personas delgadas y obesas sin entrenamiento. Los investigadores determinaron que el ejercicio que disminuye el glucógeno incrementó la oxidación de grasas después de ambas dietas, la reducida en grasas y la elevada en grasas. No obstante, la oxidación de grasas fue mayor cuando el ejercicio se combinó con una dieta alta en grasas. Los resultados fueron similares en los individuos delgados y en los obesos. Steigler et al. (2008) compararon la oxidación de grasas en individuos inactivos después de una comida alta en proteínas y alta en grasas cuando el ejercicio aeróbico se realizó al 65% VO2reserva antes de la ingesta de la comida. El ejercicio pre-prandial aumentó la oxidación de grasas después de cada comida de manera similar en los individuos delgados y en los obesos; sin embargo, los individuos obesos demostraron mayores niveles de insulina por un período de tiempo mayor luego de la ingesta de la comida. Matsuo y Suzuki (1999) compararon el ejercicio pre-prandial y post-prandial en combinación con una comida ya sea alta en carbohidratos (80% de carbohidratos y 5% de grasas) o una comida alta en grasas (37% de carbohidratos y 48% de grasas). Los sujetos eran mujeres jóvenes (20 a 21 años de edad) sedentarias. El ejercicio post-prandial aumentó la oxidación de grasas después de las comidas; no obstante, el mayor incremento en la oxidación de grasas se observó con el tratamiento que combinaba el ejercicio post-prandial y una comida alta en grasas.
La mayoría de las investigaciones con respecto a las respuestas metabólicas a las comidas de distribuciones de varios macronutrientes se ha llevado a cabo en individuos sedentarios obesos/con sobrepeso, en hombres o en atletas. En este sentido, hay una carencia de literatura que concierne a las mujeres en buen estado de salud, de mediana edad y moderadamente activas, que cumplan las recomendaciones para obtener 30 minutos de actividad aeróbica la mayoría de los días de la semana (Pate et al., 1995). Los individuos pasan una gran proporción de las horas en que están despiertos en estado post-prandial, y los niveles elevados de TG post-prandial, glucosa e insulina se han asociado con un riesgo incrementado de enfermedades cardiovasculares y metabólicas (Petit et al., 2003; Pfeiffer et al., 2005). En este sentido, analizar los efectos metabólicos agudos de una única comida, en combinación con el ejercicio aeróbico, en varias poblaciones es esencial para comprender la manera en que el metabolismo post-prandial contribuye al desarrollo de la enfermedad crónica. La información recopilada a través de dichas investigaciones puede ser útil para brindar información a las intervenciones que apuntan a reducir el riesgo de enfermedades alterando la composición de los macronutrientes de la dieta o incrementando el nivel de actividad. El presente estudio se diseñó con el fin de probar la hipótesis de que los niveles promedio de insulina post-prandial, glucosa, TG y FFAs serían diferentes después de una comida baja en carbohidratos y baja en grasas en mujeres adultas moderadamente activas. Además, se examinó la hipótesis de que una única serie de ejercicios de 30 minutos de intensidad moderada alteraría las respuestas metabólicas a la redistribución de macronutrientes.
MÉTODOS
Participantes
Los sujetos de esta investigación fueron 8 mujeres premenopáusicas de entre 20 y 45 años de edad reclutadas de universidades e instalaciones recreacionales locales. La pre-menopausia se ha definido como la ausencia de 2 ciclos menstruales o menos durante el último año. Las participantes tenían un índice de masa corporal (IMC) de entre 20 kg·m-2 y 30 kg·m-2. Todas las participantes estaban moderadamente entrenadas, lo cual se definió como una participación de una actividad aeróbica por más de o igual a 3 días por semana durante al menos 6 meses. Las participantes no tomaban ninguna medicación de la que se supiera que afecta el metabolismo, no eran fumadoras, no padecían de ninguna enfermedad metabólica y no habían intentado perder peso de manera activa en los últimos 6 meses. A las participantes se las examinó durante la fase folicular del ciclo menstrual (días 5-13) y habían estado tomando anticonceptivos hormonales durante al menos 6 meses. Antes de participar en el estudio, las participantes completaron un consentimiento informado, un cuestionario de historial médico y un cuestionario de información demográfica. Las participantes formaron parte del estudio de manera voluntaria. Antes de la recopilación de los datos, el Comité de Revisión Institucional de la Universidad de Springfield revisó y aprobó todos los procedimientos.
Evaluación de la Utilización de Sustratos
La utilización de sustratos durante el descanso y el ejercicio se determinó mediante la tasa de intercambio respiratorio (RER). Las mediciones de intercambio de gas se tomaron utilizando el carro metabólico Physiodyne Max-II (Fitness Instrument Technologies, Quogue, NY), que se calibró según las instrucciones del fabricante antes de cada sesión de prueba. El RER se determinó como el índice de dióxido de carbono producido y el oxígeno consumido según lo medido por el carro metabólico. Para convertir el RER a energía de carbohidratos y grasas se utilizó una tabla (Wilmore et al., 2008).
Análisis de Sangre
Se efectuaron recolecciones de muestra de sangre, mediante la técnica de venopuntura, para el análisis de las concentraciones de insulina, glucosa, FFA y triacilglicéridos después de 30 minutos de descanso en ayunas, 55 minutos después del consumo de comida e inmediatamente después de 30 minutos de ejercicio aeróbico. Después de la coagulación, la sangre se centrífugo en 1500 g, durante 15 min a 4o C, cuyo suero resultante se dividió en alícuotas. La glucosa y los FFA se analizaron utilizando un kit de ensayo enzimático (Wako Chemicals, Richmond, VA). Los TG se analizaron utilizando un kit de ensayo enzimático (Roche Diagnostics, Indianapolis, IN) según las instrucciones del fabricante. La insulina se analizó utilizando un kit de ensayo inmunoabsorbente ligado a enzimas (ELISA) (Calbiotech, Spring Valley, CA). Las absorbancias para todos los ELISA y ensayos enzimáticos se leyeron utilizando un lector de absorbancias de microplacas MRX Revelation (Dynex Technologies, Chantilly, VA). El C.V. promedio fue de 4.26%, 9.49%, 6.28% y 16.71% para los TG, la insulina, la glucosa y los FFA, respectivamente.
Protocolo Experimental
Las participantes realizaron 3 sesiones de prueba. La sesión inicial incluyó el papeleo (consentimiento informado, antecedentes médicos, información demográfica), una prueba de VO2pico, un análisis de grasa corporal y la explicación del diario de comidas de 3 días. La composición corporal se analizó por medio del análisis de impedancia bioeléctrica (BIA) (Tanita BC-418, Tokyo, Japón). Dos días antes de la visita inicial, se contactó a las participantes por teléfono o e-mail con motivo de las directrices para el BIA. Las participantes debían hacer ayuno durante 12 horas, abstenerse de realizar ejercicios dentro de las 12 horas de la prueba, abstenerse de beber alcohol o consumir diuréticos durante las 48 horas previas a la prueba y orinar 30 minutos antes de la prueba. La prueba del VO2pico se llevó a cabo en una cinta ergométrica utilizando una modificación del protocolo de carrera de McConnell (McConnell, 1988). La prueba terminaba cuando la participante finalizaba voluntariamente la prueba o cuando se cumplía uno de los siguientes criterios: el incremento de la carga no provocaba un incremento concomitante en la frecuencia cardíaca, (HR) un RER mayor a 1.15, o un índice de esfuerzo percibido (RPE) mayor a 17 utilizando la escala de Borg. A las participantes se les dio un diario de comida de 3 días para determinar la composición de macronutrientes y el contenido calórico de la dieta habitual antes de las sesiones de prueba.
Los tratamientos se llevaron a cabo en orden aleatorio. Antes de la segunda sesión de prueba, las participantes completaron el diario de comidas de 3 días. El análisis dietario se llevó a cabo utilizando el programa Food Processor (ESHA Research, Salem, OR). A las participantes se las evaluó por la mañana, después de un ayuno de 12 horas. Al llegar al laboratorio de rendimiento humano, las participantes se sentaron en silencio durante 10 minutos, luego de los cuales se insertó la boquilla. Las mediciones de intercambio de gas se tomaron utilizando el carro metabólico durante 20 minutos y se promediaron durante los últimos 10 minutos del período de ayuno. Luego, las participantes consumieron ya sea la comida de prueba LF o LC, descritas en la Tabla 1. Las mediciones de intercambio de gas se tomaron durante 55 minutos durante el periodo post-prandial de descanso. A las participantes se les permitió leer o escuchar música durante este período de tiempo. Las mediciones se promediaron durante los primeros 25 min. y los últimos 30 min previos al comienzo del ejercicio, a las participantes se les dio un descanso de 5 minutos. Se les permitió beber agua ad libitum durante todas las sesiones. Las mediciones de intercambio de gas se tomaron de manera continua y se promediaron durante el período de 30 min. de ejercicio.
El ejercicio se llevó a cabo sobre una cinta ergométrica a una intensidad correspondiente al 60% a 65% del VO2pico de la participante, obtenido a partir de la prueba en cinta ergométrica durante la visita inicial. La intensidad del ejercicio se determinó a partir de la velocidad de la cinta ergométrica y se graduó sobre una cinta ergométrica previamente calibrada. Los protocolos de ejercicios idénticos, con respecto a la velocidad y la graduación de la cinta ergométrica, se realizaron en las sesiones de prueba LF y LC para cada sujeto. La recolección de la sangre venosa se produjo durante los últimos 10 minutos del ayuno y el período post-prandial, y otra vez inmediatamente después del ejercicio. El suero se analizó para la insulina, la glucosa, los TG y los FFA. La tercera sesión de prueba siguió el mismo protocolo que la segunda sesión de prueba. A las participantes se les dio un registro de dieta de 3 días y se les instruyó que lo siguieran de la manera más estricta posible.
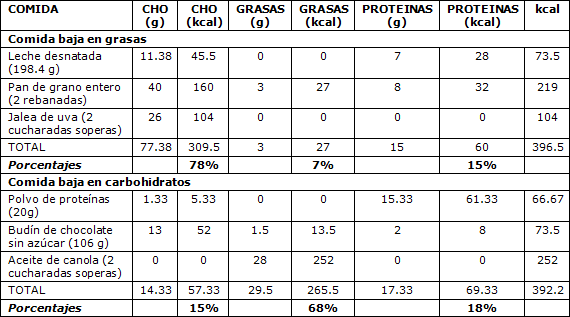
Tabla 1. Composiciones de las comidas de prueba
Análisis Estadísticos
Para analizar los datos para los períodos de ayuno, post-prandial y de ejercicio del RER se utilizó un análisis de varianza (ANOVA) factorial para medidas repetidas de 2X4. Para analizar los datos para los periodos de ayuno, post-prandial y de ejercicio de todas las demás variables se utilizó un ANOVA factorial para medidas repetidas de 2X3. Las variables independientes fueron el tiempo y la comida de prueba. Las variables dependientes incluyeron el RER, la insulina, la glucosa, los FFA y los TG. Los períodos de tiempo para el RER fueron en ayunas, post-prandial de 0 a 25 min, post-prandial de 25 a 55 min, y post-ejercicio. Los períodos de tiempo para la glucosa, la insulina, los TG y los FFA fueron en ayunas, post-prandial y post-ejercicio. Si se hallaba un efecto principal significativo para el tiempo, entonces se computaban las comparaciones apareadas. Si se hallaba una interacción significativa, se computaba una prueba de efectos simples. Todos los datos se reportaron como medias + DE (n = 8). Los datos del RER, la glucosa, la insulina, los FFA y los TG en ayunas, post-prandial y post-ejercicio se obtuvieron para todas las participantes y períodos de tiempo, con excepción de los FFA del ejercicio, de los cuales no se pudo disponer para la participante 2 debido a errores técnicos. Para hallar diferencias sería necesario realizar un análisis de potencia post-hoc para el RER revelado con un medio efecto de 8 participantes (potencia estimada = 0.83) (Cohen, 1988).
RESULTADOS
Todos los datos se presentaron como medias (DE). Un total de 8 participantes formaron parte de la investigación. La edad promedio para las participantes fue de 33.0 (6.3) años. En la Tabla 2 se reportan las estadísticas descriptivas para la edad, el peso, el índice de masa corporal (IMC), la grasa corporal, el consumo pico de oxígeno y el nivel de actividad.
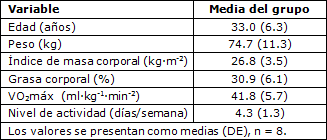
Tabla 2. Información demográfica de las participantes.
Dieta Habitual
A fin de controlar la dieta habitual entre la segunda y la tercera sesión, a las participantes se les indicó que comieran de manera similar y que completaran un diario de dieta de 3 días antes de cada sesión de prueba. La cantidad absoluta de grasa, proteínas y carbohidratos en las dietas habituales no fueron significativamente diferentes (p > 0.05) antes de las dos sesiones. La composición promedio de macronutrientes de la dieta habitual antes de la sesión LC fue de 36% de grasas, 45% carbohidratos y 17% de proteínas. La composición promedio de macronutrientes de la dieta habitual antes de la sesión LF fue de 33% de grasas, 48% carbohidratos y 15% de proteínas.
Datos del Ejercicio
El porcentaje promedio del VO2pico alcanzado durante la sesión de prueba LC fue del 68.4 (6.5) %. El porcentaje promedio del VO2pico alcanzado durante la sesión de prueba LF fue del 62,4 (5,6) %. Aunque las participantes realizaron el mismo protocolo de ejercicios durante ambas sesiones de prueba, el consumo de oxígeno relativo durante el ejercicio fue significativamente mayor durante la sesión de prueba LC (p < 0.05) que durante la sesión de prueba LF. El consumo de oxígeno durante el ejercicio fue significativamente mayor (p < 0.05) durante la sesión LC en comparación con la sesión LF, también cuando se lo expresa en términos absolutos [2.1 (0.4) L·min-1 para LC vs. 1.9 (0.3) L·min-1 para LF].
El gasto energético durante el ejercicio fue significativamente mayor (p < 0.05) durante la sesión de prueba LC en comparación con la sesión LF [305 (54) kcal y 281 (50) kcal, respectivamente]. El porcentaje de energía total gastada que derivó de los carbohidratos durante el ejercicio fue significativamente mayor (p < 0.05) en la sesión LF en comparación con la sesión LC [53 (14) % en LF y 36 (15) % en LC]. Por el contrario, el porcentaje de energía que derivó de las grasas fue significativamente mayor (p < 0.05) durante el ejercicio en la sesión LC, en comparación con LF [63 (15) % en LC vs. 47 (14) % en LF]. La energía derivada de las grasas fue significativamente mayor (p < 0.05) durante el ejercicio LC en comparación con el ejercicio LF [193 (57) kcal vs. 131 (44) kcal, respectivamente], mientras que la energía derivada de los carbohidratos fue significativamente más baja (p < 0.05) en LC vs. LF [112 (56) kcal vs. 150 (58) kcal]. Se oxidaron significativamente más gramos de grasa durante el ejercicio en la sesión LC cuando se lo comparó con el ejercicio durante la sesión LF [21.4 (6.3) g en LC vs. 14.6 (4.8) g en LF, p = 0.01].
Datos Metabólicos
No hubo una interacción significativa (p > 0.05) entre las comidas de prueba para los valores en ayunas de RER, glucosa, insulina, TG o FFA. Existió un efecto principal significativo (p < 0.05) de tiempo para la glucosa. Los valores de glucosa no fueron significativamente diferentes (p > 0.05) entre los periodos de tiempo en ayunas y post-prandial [LC: 91.8 (5.9) mg·dL-1 en ayunas 82.2 (11.5) mg·dL-1 post-prandial; LF: 88.7 (9.6) mg·dL-1 en ayunas y 90.3 (16.3) mg·dL-1 post-prandial]. Los valores de glucosa después del ejercicio fueron significativamente mayores (p < 0.05) que los valores post-prandiales para ambas comidas de prueba [96.3 (16.1) mg·dL-1 para LC y 96.11 (16.1) mg·dL-1 para LF].
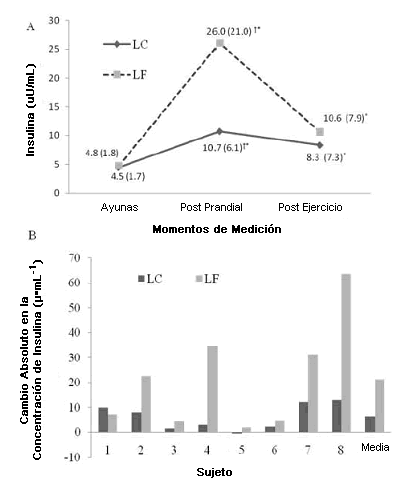
Figura 1. Respuestas promedio e individuales a la insulina para probar comidas.
Para todas las demás variables, se halló una interacción significativa (p < 0.05) entre la comida de prueba y el tiempo. Aunque los niveles de insulina después de ambas comidas, los niveles post-prandiales de insulina fueron significativamente más bajos (p < 0.05) después de la comida LC, en comparación con la comida LF. No hubo diferencias significativas (p > 0.05) en los valores de insulina entre las comidas de prueba para el período posterior al ejercicio. En la Figura 1a y b se presentan los niveles promedio de insulina sérica, 55 min post-prandial y post-ejercicio y los datos individuales de las participantes para el cambio absoluto en las concentraciones de insulina después de la comida LC y LF respectivamente.
No hubo diferencias significativas (p > 0.05) en las concentraciones post-prandiales de FFA entre las comidas LF y LC. Los niveles de FFA después del ejercicio fueron significativamente mayores (p < 0.05) después de la comida LC. De manera similar, tampoco hubo diferencias significativas (p > 0.05) para los TG post-prandiales entre las comidas LF y LC, no obstante después del ejercicio los niveles de los TG fueron significativamente más bajos (p < 0.05) después de la ingesta de comida LF, en comparación con la comida LC (Figura 2 y Figura 3).
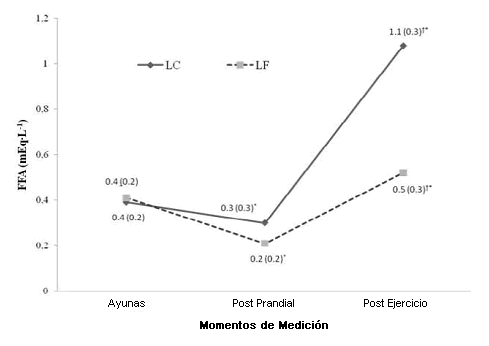
Figura 2. Niveles de ácidos grasos libres después de las comidas de prueba a lo largo del tiempo.
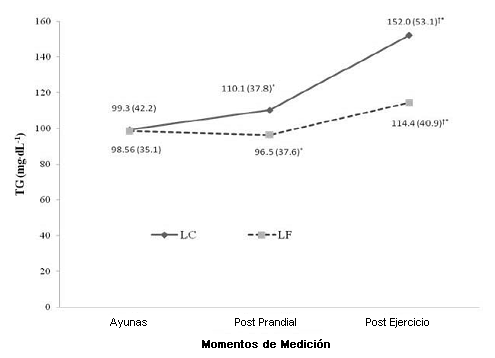
Figura 3. Niveles de triacilglicéridos después de las comidas de prueba a lo largo del tiempo.
El RER post-prandial desde el min. 0 al min. 25 fue significativamente más elevado (p < 0.05) después de la comida LF, en comparación con la comida LC. El RER post-prandial desde el min. 25 al min. 55 fue significativamente más elevado (p < 0.05) después de la comida LF. El RER durante el ejercicio de 30 min fue significativamente más elevado (p < 0.05) después de la comida LF, en comparación con la comida LC (Tabla 3).

Tabla 3. Datos del índice de intercambio respiratorio. Los valores se presentan como medias (SD), n = 8. Las mediciones del índice de intercambio respiratorio representan los promedios durante el período en ayunas (20 min.), post-prandial (0 a 25 min y 25 a 55 min) y de ejercicios (30 min). † Interacción significativa del tiempo y el tipo de comida de prueba entre la medición en ayunas y la medición post-prandial a los 25 min. Ŧ Interacción significativa del tiempo y el tipo de comida de prueba entre la medición post-prandial a los 25 min y la medición post-prandial a los 55 min. § Interacción significativa del tiempo y el tipo de comida de prueba entre la medición post-prandial a los 55 min y la medición durante el ejercicio.
DISCUSIÓN
La distinción de las consecuencias metabólicas de la manipulación dietaria y la actividad aguda previas al desarrollo de la obesidad y la enfermedad pueden brindar información para los programas de prevención de enfermedades.
El principal hallazgo del presente estudio fue que el RER fue más bajo durante el descanso de 25 min y 55 min después de la ingesta de una comida LC en mujeres moderadamente activas y en buen estado de salud que consumían una dieta habitual variada. Además, el RER fue significativamente más bajo durante los 30min de ejercicio aeróbico en cinta ergométrica después de la comida LC. El RER es un indicador de utilización de sustratos, así como un RER más bajo indica una mayor oxidación de lípidos y un RER más elevado es indicador de una mayor oxidación de carbohidratos (Ferrannini, 1988). Por lo tanto, los valores del RER vistos en el presente estudio indican que hubo una mayor oxidación de lípidos y una menor oxidación de carbohidratos después de la comida LC en el descanso y durante el ejercicio en mujeres activas y en buen estado de salud de entre 20 y 45 años de edad. Estos hallazgos están respaldados por las mediciones de sangre de FFA e insulina. Los niveles de insulina disminuyeron, mientras que los niveles de FFA fueron mayores después de la comida LC, respaldando la conclusión de que hubo una mayor movilización de lípidos después de la comida LC en esta población.
Los resultados son similares a los reportados por Bowden y McMurray (2000) cuando compararon el RER después de una comida alta en carbohidratos (HC) y alta en grasas (HF) en mujeres altamente entrenadas (VO2máx ≥ 50 ml·kg-1·min-1) de entre 21 y 45 años de edad. En concordancia con el presente estudio, el RER fue más bajo, indicando que la oxidación de grasas fue mayor después de la comida HF en comparación con la comida HC en ambos períodos post-prandiales, de 30 y 60 min. En el presente estudio la comida LF estaba compuesta de 78% de CHO, 7% de grasas y 15% proteínas, y la comida LC estaba compuesta de 15% de CHO, 68% grasas y 18% de proteínas. Las comidas LF y LC contenían 396 kcal y 392 kcal, respectivamente. Las comidas HC y HF utilizadas en la investigación realizada por Bowden y McMurray (2000) eran de 76% de CHO, 23% de grasas, 5% de proteínas y 21% de CHO, 72% de grasas y 8% de proteínas, respectivamente. La comida HC proporcionaba 494 kcal y la comida HF, 500 kcal. El mayor contenido calórico, el contenido proteico más bajo y las composiciones de macronutrientes diferentes pueden explicar los valores de RER más elevados que reportaron Bowden y McMurray. Similar a las respuestas vistas en mujeres altamente entrenadas, Ezell et al. (1999) reportaron que el RER aumentó durante el ejercicio después de una comida alta en carbohidratos en mujeres sedentarias. Las mujeres sedentarias completaron 1 hora de pedaleo al 60 a 65% del VO2máx después de la ingesta de una comida de prueba. La comida de prueba consistió de 384 kcal con una composición de macronutrientes de 29% de grasas, 14% de proteínas y 57% de CHO.
Los niveles post-prandiales de insulina fueron más bajos 60 min después de la comida LC, en comparación con el período posterior a la comida LF. Estos resultados concuerdan con Knuth et al. (2008), quienes determinaron que los niveles de insulina fueron inferiores 60 min después de una comida alta en grasas, en comparación con 60 min posteriores a la misma comida con 1 g de CHO por kg de masa corporal agregado en hombres y mujeres inactivos (se definió como inactividad a menos de 2 hs de actividad/semana). Los investigadores también reportaron que la biodisponibilidad de los FFA disminuyó y los niveles de glucosa aumentaron de forma concomitante con el incremento de los niveles de insulina cuando se agregó CHO a la comida HF. Estos resultados no concuerdan con el presente estudio, en el que los FFA y los niveles de glucosa no fueron significativamente diferentes después de diferentes comidas de prueba durante el descanso. Las diferencias pueden atribuirse a las distintas distribuciones de los macronutrientes de las comidas de prueba utilizadas. En el presente estudio, los niveles de insulina fueron menores a los valores post-prandiales después del ejercicio sin importar qué comida se consumió. No hubo mayores diferencias en los valores de insulina entre las comidas de prueba después de 30 min de ejercicio aeróbico. Se han reportado hallazgos similares después de 30 min de ejercicio en mujeres sedentarias (Ezell et al., 1999).
Una observación interesante del presente estudio fue la variación individual en la respuesta a la insulina post-prandial entre los sujetos. Como se ilustra en la Figura 2, las respuestas de la insulina a la comida LF demostraron una mayor variabilidad que la respuesta a la comida LC. Después de la comida LC, el cambio absoluto en la insulina varió de una reducción de 0.4 µ·L-1 a un incremento de 12.9 µ·L-1. En comparación, el cambio absoluto en la insulina después de la comida LF varió de un incremento de 1.77 a 63.5 µ·L-1. Las respuestas individuales a una comida alta en carbohidratos sugieren grados diferentes de “tolerancia a los carbohidratos” en base a las características individuales, posiblemente incluyendo la dieta habitual, el nivel de actividad y la genética. Se garantiza que se realizarán más investigaciones sobre los mecanismos subyacentes que explican la variación individual en la respuesta de la insulina a las comidas altas en carbohidratos.
Luego de 30 min de ejercicio los niveles de FFA y TG fueron mayores con la comida LC, en comparación con la comida LF. Más disminuciones en los niveles de insulina junto con una actividad incrementada del sistema nervioso simpático y la demanda de combustible pueden haber promovido la movilización de los lípidos y explicar porqué las diferencias en los niveles de FFA aparecieron después del ejercicio y no durante el descanso. Otros investigadores también han reportado que los niveles de ácidos grasos libres aumentaron de manera significativa con respecto a los valores iniciales después de 30 min de ejercicio aeróbico en individuos inactivos (Ezell et al., 1999; Knuth et al., 2008). Knuth et al. (2008) también hallaron que al incrementar el contenido de carbohidratos de una comida, se atenuó la respuesta de los TG 60 min después de la ingesta de la comida. Los niveles elevados de TG después de una comida LC y 30 min de ejercicio pueden explicarse mediante los niveles de insulina más bajos. Los niveles de insulina más bajos, junto con las demandas del ejercicio, pueden haber llevado a una inhibición disminuida de la lipasa sensible a hormonas (HSL) y una activación reducida de la lipoproteinlipasa (LPL) en el tejido adiposo. Además, el ejercicio se llevó a cabo una hora después de la ingesta de la comida, lo cual no es suficiente tiempo para completar la digestión y la absorción de la grasa dietaria. Por lo tanto, los TG circulantes elevados pueden haber sido un reflejo del continuo proceso y transporte de quilomicrones. Se ha reportado que las concentraciones de triacilglicéridos alcanzan su pico entre las 2 y 4 hs posteriores a una comida alta en grasas en hombres con síndrome metabólico (Plaisance et al., 2008).
La presente investigación tuvo varias limitaciones. Las mediciones de los niveles de glicerol sérico hubieran proporcionado un indicador más preciso de la lipólisis. Además, el análisis de los parámetros de la sangre y de la utilización de sustratos en la recuperación del ejercicio pudo haber sido beneficioso. Se ha demostrado que la utilización de los lípidos prevalece durante la recuperación del ejercicio de resistencia sin consumo compensatorio de energía (Kolovou y Bilianou, 2008). Es necesario que se realicen más investigaciones para determinar los efectos a largo plazo de la redistribución de macronutrientes dietarios sobre el metabolismo y el almacenamiento de grasas en las mujeres moderadamente activas antes del desarrollo de una enfermedad metabólica o cardiovascular. Por último, dichas investigaciones pueden ayudar en la prevención de estas condiciones.
CONCLUSIÓN
En resumen, los principales hallazgos del presente estudio han sido que en las mujeres adultas, moderadamente activas, la ingesta de una única comida LC dio como resultado un RER reducido durante el descanso y durante el ejercicio, y una respuesta disminuida de la insulina durante el periodo post-prandial, en comparación con una comida LF. Los valores del RER sugirieron que el consumo de una única comida LC incrementó la oxidación de grasas, mientras que la comida LF dio como resultado una disminución en la respuesta lipolítica y mayores niveles de insulina. Se ha demostrado una respuesta similar en individuos sedentarios y obesos y en atletas; no obstante, según se sabe, este es el primer estudio que muestra las consecuencias metabólicas drásticas de una única comida en mujeres moderadamente activas que habitualmente comían una dieta variada de macronutrientes. Treinta minutos de ejercicio aeróbico dieron como resultado niveles de insulina equivalentes entre las comidas LC y LF, indicando que el efecto del ejercicio sobre los niveles de insulina fue mayor que el efecto de una única comida. Estos resultados demuestran una posible función del ejercicio aeróbico en la prevención de enfermedades crónicas, alterando y atenuando los efectos del consumo dietario sobre el metabolismo.
Puntos Clave
- El contenido relativo de carbohidratos de una única comida tiene un impacto significativo sobre el metabolismo post-prandial y la utilización de sustratos en mujeres activas y en buen estado de salud.
- Una única serie de ejercicios aeróbicos realizada dentro del término de una hora de la ingesta de comida tiene el potencial para modificar la respuesta post-prandial.
- Las intervenciones que apuntan a mejorar la composición corporal y a prevenir la enfermedad crónica deberían concentrarse en la redistribución de macronutrientes dietarios y el metabolismo post-prandial junto con el entrenamiento.
AGRADECIMIENTOS
Se agradece a las participantes del presente estudio por su tiempo y esfuerzo. Este estudio ha sido financiado por el fondo de investigación para estudiantes graduados y el departamento de estudios del ejercicio y el deporte de la universidad de Springfield.
Referencias
1. Bowden, V.L. and McMurray, R.G (2000). Effects of training status on the metabolic responses to high carbohydrate and high fat meals. International Journal of Sport Nutrition and Exercise Metabolism 10, 16-27
2. Burger, H.G., Dudley, E.C., Cui, J., Dennerstein, L. and Hopper, J.L (2000). A prospective longitudinal study of serum testosterone, dehydroepiandrosterone sulfate, and sex hormone-binding globulin levels through the menopause transition. The Journal of Clinical Endocrinology & Metabolism 85(8), 2832-2838
3. Cohen, J (1988). Statistical Power Analysis for the Behavioral Sciences. 2nd edition. Lawrence Eribaum Associates, Hillsdale, NJ
4. De Glisezinski, I., Moro, C., Pilard, F., Marion-Latard, F., Harrant, F., Meste, M., Berian, M. Crampes, F., & Riviere, D (2003). Aerobic training improves exercise-induced lipolysis in SCAT and lipid utilization in overweight men. American Journal of Physiology, Endocrinology, & Metabolism 285, E984-E990
5. Ezell, D.M., Geiselman, P.J., Anderson, A.M., Dowdy, M.L., Wombie, L.G., Greenway, F.L. and Zachwieja, J.J (1999). Substrate oxi-dation and availability during acute exercise in non-obese, obese, and post-obese sedentary females. International Journal of Obesity, 23, 1047-1056
6. Feinman R.D. and Volek J.S (2008). Carbohydrate restriction as a default treatment for type 2 diabetes and metabolic syndrome. Scandinavian Cardiovascular Journal 42, 256-63
7. Ferrannini, E (1988). The theoretical bases of indirect calorimetry: A review. Metabolism 37(3), 287-301
8. Flatt, J.P., Ravussin, E., Acheson, K.J. and Jequier, E (1985). Effects of dietary fat on post-prandial substrate oxidation and on carbohy-drate and fat balances. Journal of Clinical Investigation 76, 1019-1024
9. Henriksson, J. and Knol, M (2005). A single bout of exercise is followed by a prolonged decrease in the interstitial glucose concentration in skeletal muscle. Acta Physiologica Scandinavia 185, 313-320
10. Jamurtas, A.Z., Koutedakis, Y., Paschalis, V., Tofas, T., Yfanti, C., Tsiokanos, A., Koukoulis, G., Kouretas, D., & Loupos, D (2004). The effects of a single bout of exercise on resting en-ergy expenditure and respiratory exchange ratio. European Journal of Applied Physiology 92, 393-398
11. Kern, M., Broder, H.D., Edmondson, J.I. and Cannon, D.T (2007). Diet composition does not alter energy expenditure, substrate me-tabolism, or excess post-exercise oxygen consumption in healthy, non-exercise trained women. Nutrition Research 27, 665-671
12. Knuth, N.D., Remias, D.B. and Horowitz, J.F (2008). Adding carbohy-drate to a high-fat meal blunts post-prandial lipemia in women and reduces meal-derived fatty acids in systemic circulation. Applied Physiology, Nutrition, and Metabolism 33, 315-325
13. Kolifa, M., Petridou, A. and Mougios, V (2004). Effects of prior exer-cise on lipemia after a meal of moderate fat content. European Journa of Clinical Nutrition 58(10), 1327-35
14. Kolovou, G.D. and Bilianou, H.G (2008). Influence of aging and meno-pause on lipids and lipoproteins in women. Angiology 59(2), 54S-57S
15. Kuo, C.C., Fattor, J.A., Henderson, G.C. and Brooks, G.A (2004). Lipid oxidation in fit young adults during postexercise recovery. Journal of Applied Physiology 99, 349-356
16. Labayan, I., Forga, L. and Martinez, J.A (1999). Nutrient oxidation and metabolic rate as affected by meals containing different pro-portions of carbohydrate and fat, in healthy young women. European Journal of Nutrition 38, 158-166
17. Marion-Latard, F., Crampes, F., Zakaroff-Girard, A., De Glisezinski, I., Harrant, I., Stich, V., Thalamus, C., Riviera, D., LaFontan, M., & Berian, M (2003). Post-exercise increase of lipid oxidation after a moderate exercise bout in untrained healthy obese men. Hormone and Metabolic Research 35, 97-103
18. Matsuo, T. and Suzuki, M (1999). Effects of dietary composition and exercise timing on substrate utilization and sympathoadrenal function in healthy young women. Metabolism 48(12), 1596-1602
19. Mayes, J.S. and Watson, G.H (2004). Direct effects of sex steroid hormones on adipose tissues and obesity. Obesity Reviews 5, 197-216
20. McConnell, T. R (1988). Practical considerations in testing the VO2max in runners. Sports Medicine 5, 57-68
21. Nagai, N., Sakane, N. and Moritani, T (2005). Metabolic responses to high-fat or low-fat meals and association with sympathetic nervous system activity in healthy young men. Journal of Nu-tritional Science and Vitaminology 51, 355-360
22. Pate, R.R., Pratt, M., Blair, S. N., Haskell, W.L., Macera, C.A., Bou-chard, C., Buchner, D., Ettinger, W., Heath, G.W., King, A. C (1995). Physical activity and public health. A recommendation from the Centers for Disease Control and Prevention and the American College of Sports Medicine. JAMA 273, 402-407
23. Petit, D.S. and Cureton, K J (2003). Effects of prior exercise on post-prandial lipemia. Metabolism 52(4), 418-424
24. Pfeiffer, M., Ludwig, T. and Wenk, C (2005). The influence of walking performed immediately before meals with moderate fat content on post-prandial lipemia. Lipids in Health and Disease 4, 24
25. Plaisance, E.P., Mestek, M.L., Mahurin, A.J., Taylor, J.K., Moncada-Jimenez, J. and Grandjean, P.W (2008). Post-prandial triglyeride responses to aerobic exercise and extended-release niacin. . American Journal of Clinical Nutrition 88, 30-37
26. Schiffelers, S.H., Saris, W.M. and van Baak, M.A (2001). The effect of an increased free fatty acid concentration on thermogenesis and substrate oxidation in obese and lean men. International Jour-nal of Obesity 25, 33-38
27. Schrauwen, P., Lichtenbelt, W.D., Saris, W.M. and Westerterp, K.R (1997). Role of glycogen-lowering exercise in the change of fat oxidation in response to a high-fat diet. American Journal of Physiology 273, E623-E629
28. Steigler, P., Sparks, S.A. and Cunliffe, A (2008). Moderate exercise, post-prandial energy expenditure, and substrate use in varying meals in lean and obese men. International Journal of Sport Nutrition and Exercise Metabolism 18, 66-78
29. Tentolouris, N., Pavlatos, S., Kokkinos, A., Perrea, D., Pagoni, S. and Katsilambros, N (2008). Diet-induced thermogenesis and sub-strate oxidation are not different between lean and obese women after two different isocaloric meals, one rich in protein and one rich in fat. Metabolism, Clinical and Experimental 57, 313-320
30. Wilmore, J.H., Costill, D.L. and Kenney, W.L (2008). Physiology of sport and exercise. 4th edition. Human Kinetics, Champaign, IL
31. Wood, R.J. and Fernandez, M.L (2009). Carbohydrate-restricted vs. Low-glycemic index diet for the treatment of insulin resistance and metabolic syndrome. Nutrition Reviews 67(3), 179-83
32. Zhang, J.Q., Ji, L.L., Nunez, G., Feathers, S. and Hart, C.L (2004). Effect of exercise timing on post-prandial lipemia in hyper-triglyceridemic men. Canadian Journal of Applied Physiology 29(5), 590-603
33. Zumoff, B., Strain, G.W., Miller, L.K. and Rosner, W (1995). Twenty-four-hour mean plasma testosterone concentration declines with age in normal premenopausal women. Journal of Clinical Endocrinology and Metabolism 80(4), 1429-1430