La Suplementación de la Dieta con Ácido Lipoico Inhibe el Estrés Oxidativo Inducido por el Ejercicio
Angela Pendleton, Shawn Stover y Sunam Gurung
Department of Biology and Environmental Science, Davis & Elkins College, Elkins, West Virginia, Estados Unidos.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2008.
Publicado 28 de noviembre de 2008
Resumen
Palabras clave: antioxidante, peroxidación, malondialdehido
INTRODUCCION
Como consecuencia del metabolismo celular normal se produce la generación de especies reactivas del oxígeno (ROS) tales como el oxígeno singlete, el radical superóxido, y el radical hidroxilo (1). El daño molecular relacionado a las ROS incluye ruptura de las hebras y modificaciones de una sola base del ADN (2), oxidación de las cadenas laterales de aminoácidos y fragmentación de polipéptidos (3), y degradación de los ácidos grasos poliinsaturados y fosfolípidos por peroxidación de los lípidos (4). La inactivación de las ROS en el cuerpo se lleva a cabo mediante el sistema de defensa antioxidante endógeno que incluye la actividad de las enzimas, tales como la superóxido dismutasa (SOD), glutatión peroxidasa (GPx), y glutatión reductasa (GR), junto con antioxidantes exógenos consumidos a través de la dieta (1). El estrés oxidativo puede ser definido como la condición en la cual la producción celular de ROS excede la capacidad fisiológica del cuerpo para inactivarlas (4).
El aumento en el consumo de oxígeno durante el ejercicio aeróbico está acompañado por un aumento en las ROS. El ejercicio aeróbico agudo genera ROS que originan una perturbación en el transporte de electrones y provoca una excesiva producción de radicales superóxido (4). Sin embargo, el entrenamiento de resistencia a largo plazo reduce eficientemente el daño asociado con el mayor consumo de oxígeno, reforzando las defensas antioxidantes del cuerpo. Ha sido demostrado que, en respuesta al entrenamiento de resistencia, aumentan las actividades de las enzimas antioxidantes GPx (5), GR (5), y SOD (6).
El ejercicio anaeróbico agudo puede promover la oxidación de los lípidos. En ratas, un único esprint realizado a una velocidad de 45 m/min eleva los hidroperóxidos de lípidos y las sustancias reactivas al ácido tiobarbitúrico (TBARS) en el músculo esquelético, indicando una peroxidacíon de lípidos significativa (7). En ratones, seis esprints de 30 s a una velocidad de 30 m/min aumentaron significativamente la concentración de malondialdehido (MDA), un marcador de peroxidación de lípidos, en el músculo esquelético (8). En seres humanos, seis esprints de 150 m aumentaron significativamente los niveles plasmáticos de MDA (9). Además, estudios anteriores indican que el entrenamiento de esprint puede atenuar los efectos del estrés oxidativo. En ratas, luego del entrenamiento de esprint se produce un aumento significativo en las actividades de las enzimas GPx y GR en los músculos cardíaco y esquelético (10). En ratones, el entrenamiento de esprint reduce la peroxidación de lípidos en el músculo esquelético, tal como lo indica la disminución en la concentración de MDA (8). En seres humanos, el entrenamiento de esprint produce una disminución en las concentraciones plasmáticas de MDA y carbonilos proteicos, ambos biomarcadores de estrés oxidativo, cuando se los comparó con sujetos desentrenados (11).
En los tejidos humanos, el ácido α-lipoico endógeno (LA) puede encontrarse en cantidades trazas en los complejos enzimáticos de α-cetoácido deshidrogenasa, α-cetoglutarato deshidrogenasa, y piruvato deshidrogenasa (12). El LA exógeno es incorporado por una variedad de células y reducido a dihidrolipoato o DHLA por NADH o por enzimas NADPH-dependientes (13). Tanto el LA como el DHLA desempeñan su actividad antioxidante a través de la quelación de metales de transición como hierro, cobre, y mercurio (14). Además, las formas oxidadas y reducidas del ácido lipoico pueden inactivar/secuestrar una gran cantidad de especies reactivas de oxígeno y de nitrógeno, entre las que se pueden incluir, al peróxido de hidrógeno, el radical hidroxilo, y el radical óxido nítrico (15). Finalmente, el DHLA es un agente reductor fuerte y es capaz de regenerar algunos de los antioxidantes fisiológicos más importantes, como la vitamina C, vitamina E, y glutatión (13).
El glutatión desempeña un papel fundamental en la defensa de los tejidos contra el estrés oxidativo (16).
La disponibilidad de cisteína, un precursor de la síntesis de glutatión, es un determinante crítico de los niveles de glutatión celular (17). El DHLA proporciona la cisteína a través de la reducción de la cistina que abunda en el espacio extracelular (18). Al reducir la cistina a cisteína, el DHLA se oxida a LA que es incorporado por las células y nuevamente reducido a DHLA. De esta manera, el DHLA, un potente agente reductor, puede ser continuamente regenerado (17).
Hay abundante evidencia que demuestra la efectividad de la suplementación con LA sobre la reducción de la peroxidación de lípidos. Manda et al. (19) observaron una disminución significativa en la generación de TBARS en el tejido cerebelar de ratones irradiados con rayos X luego del tratamiento con LA. Baydas et al. (20) demostraron un efecto protector mediado por LA contra la peroxidation de lípidos en las células gliales de ratas diabéticas.
Finalmente, un estudio de Sundaram y Panneerselvan (21) informó que la administración de LA junto con carnitina, un metabolito mitocondrial, produce una disminución significativa en la peroxidación de lípidos del músculo esquelético en ratas de edad avanzada.
En el presente estudio se plantearon las siguientes hipótesis: 1) La peroxidación de lípidos inducida por el ejercicio en las fibras de contracción rápida del músculo esquelético puede ser significativamente reducida mediante la suplementación de la dieta a largo plazo con LA, y 2) La peroxidación de lípidos inducida por el ejercicio en las fibras de contracción rápida del músculo esquelético puede reducirse aún más, si la suplementación con LA se combina con el entrenamiento de esprints de alta intensidad a largo plazo.
METODOS
Animales
Este estudio fue aprobado por el Comité Institucional de Uso y Cuidado Animal de la Universidad Davis & Elkins. Veinticuatro ratones albinos ICR machos (CD-1®) (Harlan, Indianapolis, IN), que tenían entre 5-7 semanas de vida al comienzo del estudio, fueron colocados individualmente en jaulas ventiladas (Maxi-Miser Positive Individual Ventilation System, Thoren Caging Systems, Inc., Hazelton, PA). Las jaulas fueron colocadas en un cuarto mantenido entre 18-24°C con ciclos de 12 hs de luz – 12 hs de oscuridad. Los 24 ratones fueron asignados de manera aleatoria a tres grupos: control (n=8), grupo que recibió la suplementación con ácido lipoico (LA, n=10), y grupo que recibió la suplementación con ácido lipoico y realizó el entrenamiento de esprint (LA+Ex, n=6). Inicialmente, cada grupo tenía ocho ratones. Sin embargo, dos ratones en el grupo LA+Ex se negaron a correr en la cinta rodante durante la primer semana de entrenamiento y por lo tanto fueron transferidos al grupo LA.
Suplementación Dietaria
Todos los ratones recibieron y consumieron aproximadamente seis gramos de comida diariamente (Dieta Fortificada para Ratas y Ratones, Kaytee Products, Inc., Chilton, WI). El ácido α-lipoico (Sigma, St. Louis, MO) fue mezclado con la comida en polvo y proporcionado a los ratones de los grupos LA y LA+Ex en una dosis de 150 mg/kg de peso corporal dos días por semana durante 12 semanas. Todos los ratones podían beber agua libremente.
Protocolos de Ejercicio
Los ratones del grupo LA+Ex participaron en un programa de entrenamiento de alta intensidad que consistió en correr en cinta rodante dos días por semana durante 12 semanas. Cada sesión incluyó tres a seis esprints de 30 s a una velocidad de 24-30 m/min con una pendiente de 5-15° (Tabla 1), con un intervalo de recuperación de 1 min entre cada esprint.
Los ratones de los grupos LA y Control no realizaron el entrenamiento. Al final del período de entrenamiento, los ratones entrenados y los que no realizaron entrenamiento realizaron seis esprints consecutivos de 30 s en una cinta rodante para roedores a una velocidad de 30 m/min (15° pendiente), con un intervalo de recuperación de 1 min entre cada esprint. Una rejilla electrificada (0,1 mA) colocada en la parte posterior de la cinta rodante fue utilizada con moderación para motivar a los ratones para correr. Todos los procedimientos de ejercicios fueron llevados a cabo entre las 8:00 y 9:00 de la mañana
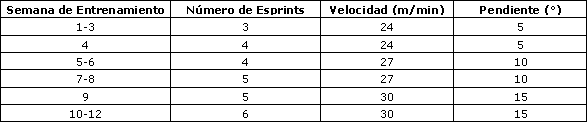
Tabla 1. Programa de entrenamiento de los ratones.
Determinación de la Peroxidación de los Lípidos
Los ratones fueron sacrificados mediante dislocación cervical. El sacrificio de los animales que realizaron ejercicio fue llevado a cabo inmediatamente después del intervalo de 1 min de recuperación final. Se extrajeron los músculos soleo y extensor largo de los dedos (EDL) de los miembros posteriores, fueron enjuagados con agua destilada fría, homogeneizados en buffer Tris-HCl 20 mM (pH 7,4), y se los hizo reaccionar con N-metil-2-fenilindol (R1) a 45°C. El R1 se combina con MDA para generar un cromóforo estable con absorbancia máxima a 586 nm (Ensayo Colorimétrico para peroxidación de lípidos, Oxford Biomedical Research, Oxford, MI). Para descontar la absorbancia base, se utilizaron controles negativos que contenían Tris-HCl en lugar de los homogenatos de tejido. Las muestras experimentales y control fueron analizadas espectrofotométricamente a 586 nm. Las concentraciones de MDA fueron calculadas a partir de los valores de absorbancia, utilizando la siguiente fórmula: [MDA]=([A586 - b]/a) x df dónde [MDA] es la concentración de MDA en μM en la muestra, A586 es la absorbancia neta de la muestra a 586 nm, a es la pendiente de la curva patrón de MDA (el patrón de MDA se incluye en el kit comercial de ensayo), b es la ordenada al origen de la curva patrón, y el df es el factor de la dilución de la muestra.
Análisis Estadísticos
Para determinar la variabilidad entre los valores promedio de los grupos se utilizó un análisis de la varianza (ANOVA) de una vía. Para establecer comparaciones específicas de grupo en el ANOVA de una vía se utilizó el test-t de dos muestras. Todos los test-t fueron de dos colas y para considerar las diferencias como estadísticamente significativas, se fijó un nivel de alfa de p<0,05. Los datos se expresan como valores medios±desviación estándar.
RESULTADOS
En los ratones que recibieron la suplementación dietaria con ácido lipoico durante 12 semanas, no se observaron cambios en la concentración de MDA en las fibras del músculo soleo con predominio de fibras de contracción lenta. Sin embargo, la concentración de MDA disminuyó drásticamente en las fibras del músculo EDL con predominio de fibras de contracción rápida (11,067±1,63 μM), con respecto al control (16,370±1,20 μM), indicando una disminución significativa en la peroxidación de los lípidos (Figura 1). Además, los ratones que habían realizado el entrenamiento de esprint y que habían recibido la suplementación con LA durante 12 semanas también presentaron una disminución significativa en la concentración de MDA en el EDL (11,225±1,28 μM), respecto al control (Figura 1). No se observaron diferencias significativas entre los grupos LA y LA+Ex.
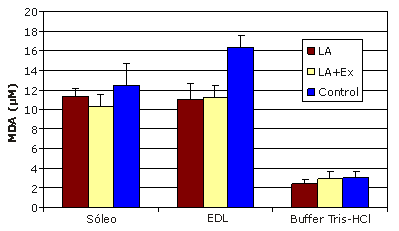
Figura 1. Resultados de la suplementación con ácido lipoico y entrenamiento de esprint. Los datos se expresan como valores medios±DS; * Presenta diferencias significativas respecto al control (p<0,05); Las muestras que contenían solamente el buffer de homogeneización (Tris-HCl) fueron analizadas para descontar la absorbancia no específica.
DISCUSION
En el presente estudio, los ratones de los grupos experimental y control participaron en una sesión de ejercicio agudo anaeróbico que consistió en seis esprints consecutivos de 30 s en una cinta rodante para roedores a una velocidad de 30 m/min (15° pendiente), con un intervalo de recuperación de 1 min entre cada esprint. Ha sido previamente demostrado que este protocolo induce eficazmente la peroxidación de lípidos en las fibras del músculo esquelético de contracción rápida, tal como lo indica el aumento significativo en la concentración de MDA en el EDL (8). Sin embargo, el mecanismo por el cual el ejercicio anaeróbico agudo provoca estrés oxidativo no ha sido establecido con claridad. Se ha sugerido que la potencia glucolítica alcanza un nivel máximo al comienzo del ejercicio de alta intensidad y es seguida por una síntesis de ATP mitocondrial significativa (22, 23). Además de la contribución del metabolismo aeróbico, y la posterior perturbación en el transporte de electrones, el aumento de las ROS generado por el ejercicio de esprint también puede ser afectado por la isquemia/reperfusión. El consumo de oxígeno repentino que se produce luego de un esprint puede producir la reacción de los intermediarios metabólicos acumulados para generar elevados niveles de ROS (4, 24).
Investigaciones previas también han señalado los efectos beneficiosos del entrenamiento de esprint de alta intensidad. La peroxidación de lípidos, tal como lo indica la concentración de MDA, disminuye significativamente en el EDL de contracción rápida después de 12 semanas de entrenamiento de esprint (8). El mecanismo que se encuentra detrás de la reducción de la peroxidación no está claro. Es posible que el efecto beneficioso se deba a una mayor capacidad para realizar la fosforilación oxidativa.
Estudios previos han observado un aumento en la masa mitocondrial en respuesta a las condiciones de estrés oxidativo (25, 26). Además, un aumento en el glutatión reducido (GSH) podría contribuir a la adaptación al entrenamiento. Se ha observado que el entrenamiento de resistencia aumentaría el contenido de GSH en los músculos de los miembros posteriores de perros (27) y ratas (6). El entrenamiento de esprint de alta intensidad podría producir un efecto similar.
El GSH desempeña un importante papel en la defensa celular contra el estrés oxidativo inactivando las ROS, ya sea directamente o actuando como sustrato para la GPx (16). La conversión de GSH a GSSG, la forma oxidada de la molécula, es catalizada por la GPx durante la detoxificación reductiva del peróxido de hidrógeno (28). El GSH se regenera a partir de GSSG por la actividad de la GR (29). Aunque algunas células epiteliales tienen la capacidad de incorporar el GSH intacto (30), la mayoría de las células recurren a la síntesis de novo para mantener las reservas celulares. El GSH se sintetiza en un proceso de dos pasos que involucra las enzimas, γ-glutamato-cisteina ligasa (GCL) y glutatión sintetasa (GS). La GCL cataliza la reacción intracelular que produce la unión de un residuo de cisteína que contiene un grupo sulfidrilo a un residuo de glutamato. La actividad de GS agrega un residuo de glicina para completar el tripéptido (16).
Normalmente, las ROS son rápidamente degradadas por los mecanismos defensivos. Sólo se observan efectos tóxicos de estrés oxidativo cuando la tasa de formación de ROS excede la tasa de destrucción de las mismas.
Estudios previos han demostrado que el LA puede inhibir efectivamente los efectos adversos del estrés oxidativo, tanto in vitro y como in vivo. Se ha informado que el LA protege los cultivos de neuronas contra la citotoxicidad inducida por el glutamato a través de la regeneración de los niveles de GSH (31).
Además, ha sido demostrado que, en ratas de edad avanzada, una dieta suplementada con LA mejora el funcionamiento mitocondrial, aumenta la tasa metabólica, y disminuye la peroxidación de lípidos inhibiendo la pérdida de GSH asociada con la edad (32).
En el presente estudio, se planteó la hipótesis que la peroxidación de lípidos en el EDL se reduciría significativamente gracias a la suplementación dietaria con LA durante 12 semanas, y que la peroxidación de lípidos en el EDL se reduciría aún más si la suplementación con LA durante 12 semanas se combina con la realización de entrenamiento de esprints de alta intensidad durante el mismo tiempo.
Si bien los datos apoyaron la primera hipótesis, no se encontraron diferencias significativas entre los grupos LA y LA+Ex, en lo que se refiere a la peroxidación de lípidos (Figura 1). Es posible que haya un máximo en la cantidad de GSH que pueda ser regenerado. Para establecer si esto realmente es así, se debería cuantificar una regulación en ascenso (upregulation) de GSH inducida por la suplementación con LA y/o por el entrenamiento con esprints.
Conclusión
En síntesis, los resultados del presente estudio coinciden con resultados encontrados en trabajos anteriores en los que se observó una disminución en la peroxidación de lípidos en respuesta al entrenamiento de esprint de alta intensidad a largo plazo (8). Además, los resultados indican que la suplementación dietaria a largo plazo con LA también podría reducir el impacto del estrés oxidativo previniendo la excesiva peroxidación de lípidos. Sin embargo, los efectos de los dos tratamientos no parecerían ser aditivos, debido a que no se encontraron diferencias significativas entre los grupos LA y LA+Ex.
Agradecimientos
El equipamiento empleado en nuestra investigación fue adquirido mediante subsidios del Programa Experimental de Virginia Oriental para Estimular la Investigación Competitiva (WVEPSCoR) y la Red IDeA de Excelencia en Investigaciones Biomédicas de Virginia Oriental (WV-INBRE). El proyecto descripto fue apoyado por el Centro Nacional de Recursos para Investigación (NCRR), que forma parte de los Institutos Nacionales de Salud (NIH).
Los contenidos de esta publicación son solamente responsabilidad de los autores y no necesariamente representan las opiniones oficiales de NCRR o NIH.
El apoyo fue proporcionado por un subcontrato de la Corporación de Investigación de la Universidad de Virginia Oriental bajo un Acuerdo de Prioridad NIH a través de la Corporación de Investigación de la Universidad de Marshall.
Referencias
1. Sen C. K., Packer L. and Hanninen O., editors (1994). Exercise and Oxygen Toxicity. Amsterdam: Elsevier Science
2. Halliwell B. and Guttheridge J. M. C (1989). Free Radicals in Biology and Medicine. 2nd edition. New York: Clarendon Press, Oxford University Press
3. Levine R. L. and Stadtman E. R (2001). Oxidative modification of proteins during aging. Exp Gerentol 36: 1495-1502
4. Bloomer R. J. and Goldfarb A. H (2004). Anaerobic exercise and oxidative stress a review. Can J Appl Physiol 29(3):245-263
5. Venditti P. and Di Meo S (1997). Effect of training on antioxidant capacity, tissue damage, and endurance of adult male rats. Int J Sports Med 18:497-502
6. Leeuwenburgh C., Hollander J., Leichtweis S., Fiebig R., Gore M. and Ji L. L (1997). Adaptations of glutathione antioxidant system to endurance training are tissue and muscle fiber specific. Am J Physiol 272: R363-R369
7. Alessio H. M., Goldfarb A. H. and Cutler R. G (1988). MDA content increases in fast- and slow-twitch skeletal muscle with intensity of exercise in a rat. Am J Physiol 255:C874-C877
8. Cunningham P., Geary M., Harper R., Pendleton A. and Stover S (2005). High intensity sprint training reduces lipid peroxidation in fast-twitch skeletal muscle. JEPonline 8(6):18-25
9. Marzatico F., Pansarasa O., Bertorelli L., Somenzini L. and Della Valle G (1997). Blood free radical antioxidant enzymes and lipid peroxides following long-distance and lactacidemic performances in highly trained aerobic and sprint athletes. J Sports Med Phys Fitness 37:235-239
10. Atalay M., Seene T., Hanninen O. and Sen C. K (1996). Skeletal muscle and heart antioxidant defenses in response to sprint training. Acta Physiol Scanda 158:129-134
11. Bloomer R. J., Falvo M. J., Fry A. C., Schilling B. K., Smith W. A. and Moore C. A (2006). Oxidative stress response in trained men following repeated squats or sprints. Med Sci Sports Exerc 38(8):1436-1442
12. Reed L. J (1998). From lipoic acid to multi-enzyme complexes. Protein Sci 7: 220-224
13. Packer L., Witt E. H. and Tritschler H. J (1995). Alpha-lipoic acid as a biological antioxidant. Free Radic Biol Med 19: 227-250
14. Packer L., Witt E. H., Tritschler H. J., Wessel K. and Ulrich H (1995). Antioxidant properties and chemical implications of alpha-lipoic acid. In: Packer L and Cadenas E, editors. Biothiols in Health and Disease. New York: Marcel Dekker, 479
15. Packer L., Kraemer K. and Rimbach G (2001). Molecular aspects of lipoic acid in the prevention of diabetes complications. Nutrition 17: 888-895
16. Griffith O. W (1999). Biologic and pharmacologic regulation of mammalian glutathione synthesis. Free Radic Biol Med 27: 922-935
17. Sen C. K (1997). Nutritional biochemistry of cellular glutathione. J Nutr Biochem 8: 660-672
18. Han D., Handelman G., Marcocci L., Sen C. K., Roy S., Kobuchi H., Flohe L. and Packer L (1997). Lipoic acid increases de novo synthesis of cellular glutathione by improving cysteine utilization. Biofactors 6:321-328
19. Manda K., Ueno M., Moritake T. and Anzai K (2007). Radiation-induced cognitive dysfunction and cerebellar oxidative stress in mice: protective effect of alpha-lipoic acid. Behav Brain Res 177 (1): 7-14
20. Baydas G., Donder E., Kiliboz M., Sonkaya E., Tuzcu M., Yasar A. and Nedzvetskii V. S (2004). Neuroprotection by alpha-lipoic acid in streptozotocin-induced diabetes. Biochemistry 69 (9): 1001-1005
21. Sundaram K. and Panneerselvam K. S (2006). Oxidative stress and DNA single strand breaks in skeletal muscle of aged rats: role of carnitine and lipoic acid. Biogerontology 7 (2): 111-118
22. Smith J. C. and Hill D. W (1991). Contribution of energy systems during a Wingate power test. Br J Sports Med 25 (4): 196-199
23. Nioka S., Moser D., Lech G., Evengelisti M., Verde T., Chance B. and Kuno S (1998). Muscle deoxygenation in aerobic and anaerobic exercise. Adv Exp Med Biol 454: 63-70
24. Jackson M. J (2005). Exercise and oxygen radical production by muscle. In: Sen CK, Packer L and Hanninen O, editors. Handbook of Oxidants and Antioxidants in Exercise. Amsterdam: Elsevier Science, 57-68
25. Lee H., Yin P., Lu C., Chi C. and Wei Y (2000). Increase of mitochondria and mitochondrial DNA in response to oxidative stress in human cells. Biochem J 348: 425-432
26. Lee H., Yin P., Chi C. and Wei Y (2002). Increase in mitochondrial mass in human fibroblasts under oxidative stress and during replicative cell senescence. J Biomed Sci 9 (6): 517-526
27. Kretzschmar M. and Muller D (1993). Aging, training, and exercise: a review of effects of plasma glutathione and lipid peroxidation. Sports Med 15: 196-209
28. Meister A (1983). Selective modification of glutathione metabolism. Science 220: 472-477
29. Schultz G. E., Schirmer R. H., Sachsenheimer W. and Pai E. F (1978). The structure of the flavoenzyme glutathione reductase. Nature 273: 120-124
30. Hagen T. M., Aw T. Y. and Jones D. P (1988). Glutathione uptake and protection against oxidative injury in isolated kidney cells. Free Radic Res 32 (2): 115-124
31. Hagen T. M., Ingersoll R. T., Lykkesfeldt J., Liu J., Wehr C. M., Vinarsky V., Bartholomew J. C. and Ames A. B (1999). (R)-alpha-lipoic acid-supplemented old rats have improved mitochondrial function, decreased oxidative damage, and increased metabolic rate. FASEB J 13 (2): 411-418
32. Kobayashi M. S., Han D. and Packer L (2000). Antioxidants and herbal extracts protect HT-4 neuronal cells against glutamate-induced cytotoxicity. Free Radic Res 32 (2): 115-124