Los Suplementos de Proteínas-carbohidratos y Carbohidratos Post-ejercicio incrementan el Glucógeno Muscular en Hombres y Mujeres
Mark A Tarnopolsky1, M. Bosman2, J. R Macdonald2, D. Vandeputte2 y J. Martin2
1Department of Medicine, McMaster University, Hamilton, Ontario, Canadá.
2Department of Kinesiology, McMaster University, Hamilton, Ontario, Canada L8S 4K1.
Artículo publicado en el journal PubliCE, Volumen 0 del año 1997.
Publicado 1 de septiembre de 2003
Resumen
Palabras clave: diferencias sexuales, fórmula definida, ejercicio
INTRODUCCIÓN
El tiempo de la provisión de nutrientes después del ejercicio se ha convertido en un tema popular en los años recientes (3, 11, 26). Es sabido que los suplementos con carbohidratos provistos dentro de los primeros minutos de la culminación del ejercicio resultan en una más rápida repleción del glucógeno muscular comparado con el mismo suplemento provisto 2 h después de culminar el ejercicio (11). Se piensa que el mecanismo responsable para esta observación está relacionado a los efectos combinados de la insulina y los transportadores de glucosa GLUT-4 estimulados por la contracción muscular (6). La migración de estos transportadores desde los sitios intracelulares al sarcolema y los túbulos T del músculo, está parcialmente mediada por la fosfatidilinositol 3-quinasa (8). La implicancia práctica de estos hallazgos es la posibilidad de acentuar la repleción de glucógeno simplemente alternando el tiempo de provisión de los nutrientes (i.e., proveyendo nutrientes inmediatamente terminado el ejercicio).
Se ha sugerido que la combinación de un suplemento de proteínas (Pro) y CHO provisto inmediatamente después del ejercicio puede potenciar la secreción de insulina y la repleción de glucógeno (26). Por ejemplo Zwadzki et al. (26) encontraron que la elevación de la insulina y que la tasa de restitución de glucógeno fue un 39% mayor con un suplemento combinado de CHO-Pro comparado a un suplemento de sólo CHO. El factor que aportó confusión en este último estudio fue la provisión de más de 43% de energía en el tratamiento CHO-Pro comparado con el tratamiento de CHO, así dos variables cambiaron simultáneamente. Por este motivo, un propósito del presente estudio fue comparar la tasa de resíntesis de glucógeno después del ejercicio de resistencia mientras el contenido de energía de todos los tratamientos se mantenía constante.
Además, la mayoría de las investigaciones que han sido conducidas para examinar los suplementos después del ejercicio han usado exclusivamente sujetos varones (5, 11, 26). Más allá de las tendencias inherentes al sexo, también existe un cúmulo de evidencia acerca de las diferencias sexuales en las respuestas metabólicas al ejercicio de resistencia (22-24). Estas diferencias pueden estar relacionadas a nuestros hallazgos recientes acerca de que los hombres, pero no las mujeres, incrementan la concentración de glucógeno en respuesta al aumento en el contenido de CHO de la dieta del 60 al 75% de la ingesta energética (21). Por esta razón, un segundo propósito de estudio fue examinar a restitución de glucógeno post-ejercicio en ambos sexos.
Tuvimos tres hipótesis previas. 1) No habría deferencia en la tasa de restitución de glucógeno entre los suplementos de CHO y CHO-Pro-Grasa, sin embargo habría una mayor tasa de restitución de glucógeno en comparación con el placebo. 2) La tasa de restitución de glucógeno para las mujeres podría ser menor a aquella observada en hombres. 3) Las mujeres tendrían un menor índice de intercambio respiratorio (RER) durante el ejercicio de resistencia (indicando una mayor oxidación de grasas).
MÉTODOS
Sujetos
Dos grupos de hombres (n =8) y mujeres (n =8) atletas participaron voluntariamente en este estudio. El estudio fue aprobado por el Comité de Ética de la Universidad de MacMaster, y se obtuvo un informe de consentimiento por escrito antes de todos los procedimientos experimentales. Se les explicó a cada sujeto los beneficios y riesgos de participar en este estudio. Fueron reclutados aquellos hombres que poseían un pico de consumo de oxígeno (VO2 pico) de al menos 55 ml • kg−¹ • min−¹. Las mujeres fueron apareadas a los hombres a través de los antecedentes de entrenamiento y se requirió que tuvieran un VO2 pico de al menos 50 ml • kg−¹ • min−¹. Los agrupamientos para igualar los grupos, basados en estos parámetros, fueron confirmados por la similitud en el VO2 pico cuándo se expresó por kilogramo de masa magra (Tabla 1).
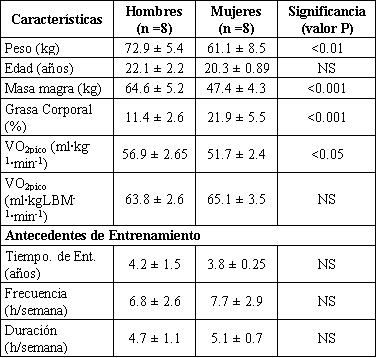
Tabla 1. Características de los sujetos. Los valores son presentados como
medias ±DS; n, número de sujetos. LBM, masa magra; VO2 pico, pico de consumo de
oxígeno; NS, no significativo. Valores P independientes del test-t.
Todos las mujeres fueron eumenorreicas durante por lo menos 6 meses antes de la evaluación, y tres estaban tomando anticonceptivos orales. Las mujeres fueron evaluadas durante la mitad de la fase folicular de su ciclo menstrual. Esta fase fue seleccionada para una determinación más precisa del comienzo de la fase folicular (día 1 de la menstruación) en comparación con la fase lutea (ovulación) y también para la comparación con nuestros trabajos previos (17, 22).
Diseño
Los sujetos participaron en un tratamiento doble ciego, triple, controlado con Pl. El Tratamiento 1, CHO-Pro-Grasa, tuvo un 66% de CHO, 23% de Pro y 11% de Grasas. Específicamente, los CHO tenían 56% de sacarosa y 46% de un polímero de glucosa provenientes de cereales de almíbar sólidos, Pro =proteína de leche; Grasa = aceite de canola, girasol y maíz, con vitaminas y minerales y saborizante (bebida deportiva comercialmente disponible, Mead-Johnson, Canada). Tratamiento 2, tratamiento sólo de CHO, incluyó 100% CHO, como se describió anteriormente. El tratamiento 3, usado como un Pl, poseía sucralosa (derivado de la sacarosa no reconocido como un CHO por el cuerpo, así como vitaminas, minerales, y saborizantes). Cada sujeto completó los tres tratamientos separados por 3-4 semanas entre cada tratamiento. Cada tratamiento tuvo una duración de 5 días y fue idéntico en términos de ejercicio, y prescripción de la dieta (ver protocolo experimental). La secuencia del tratamiento fue seleccionada al azar. Sin embargo, debido a un error de los técnicos que cegaron el estudio, todos los sujetos participaron en cada tratamiento en la misma secuencia [i.e. todos los sujetos recibieron los suplementos en el mismo orden listado anteriormente, no obstante ellos y los otros investigadores fueron cegados para la asignación de los suplementos (doble ciego)]. El VO2 pico fue determinado sobre un ciclo ergómetro frenado eléctricamente dentro de las dos semanas del comienzo de los tratamientos experimentales utilizando un sistema computarizado abierto de recolección de gases como fue descripto previamente (17). Se consideró al VO2 pico como al valor más alto recolectado durante un protocolo estándar e incremental en cicloergómetro, con la culminación de la evaluación después que los valores del consumo de oxígeno alcanzaran (VO2) una meseta para tres lecturas, RER >1.12, y un mantenimiento de la revolución del pedal por encima de ~60 rpm. La densidad corporal fue determinada a través del peso hidrostático, y el porcentaje de grasa se calculó como se describió anteriormente (17).
Todos los sujetos registraron 4 días de dieta, que fueron analizados usando un software de análisis nutricional (Nutritionist IV; First Data Bank, San Bruno, CA). Las dietas individuales fueron diseñadas para cada sujeto con el objeto de que sean isoenergéticas e isonitrogenadas para los tres tratamientos. El único parámetro diferente fue la composición del suplemento consumido luego del ejercicio en el día 1 (día de práctica) y el día 5 (día de evaluación). Por ejemplo, en la evaluación del tratamiento Pl, la bebida Pl fue entregada después del ejercicio y un suplemento de CHO-Pro-Grasas fue suministrado con la cena. Se realizó lo contrario con el tratamiento CHO-Pro-Grasa; es decir, el suplemento Pl fue entregado con la cena. Para el tratamiento CHO, un suplemento de CHO-Grasa fue suministrado con la cena (Tabla 2). Por ello durante el periodo de 24h la energía y la composición nutricional para cada tratamiento fue idéntica (Tabla 3). Las dietas fueron rígidamente controladas durante los 5 días de protocolo experimental para cada uno de los tres tratamientos. Se instruyó a los sujetos a consumir solo la dieta empaquetada provista en los días 1, 4 y 5. Se analizaron las listas de chequeo individuales durante los días alternados (días 2 y 3). La obediencia fue medida mediante el análisis de las listas de chequeo de dieta que fueron devueltas por cada sujeto. Además, los días en los que la comida fue empaquetada, los sujetos devolvieron cualquier comida no ingerida, para el pesaje. La aparente obediencia en la ingesta energética fue >96% de la distribuida.
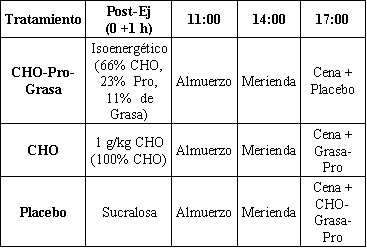
Tabla 2. Hora de la entrega de nutrientes. Almuerzo, merienda y cena para
cada sujeto en cada tratamiento, basados en los valores de la ingesta dietaria
habitual. CHO, carbohidratos; Pro, proteínas; Ej, ejercicio.
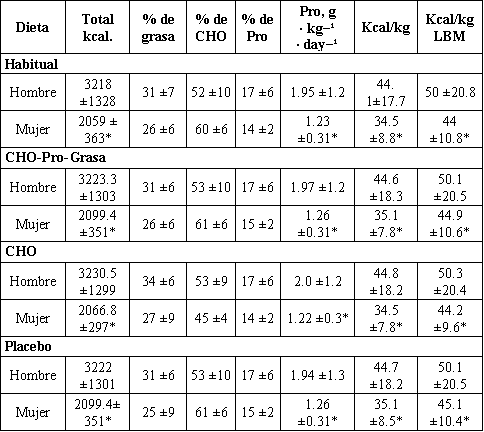
Tabla 3. Datos nutricionales habituales y durante los tratamientos. Los
valores son presentados como medias ± DS.
Protocolo Experimental
Durante cada uno de los 5 días del período experimental los sujetos se adhirieron al régimen post-ejercicio para simular un programa de entrenamiento típico: en los días 1 y 5, los sujetos se ejercitaron en un cicloergómetro a una carga de trabajo predeterminada para promover el 65% del VO2 pico durante 90 minutos. El día 1 fue designado como un tratamiento de práctica en preparación para el día 5 y fue realizado por la tarde (17:00 a 20:00 hs), consumiendo idénticos suplementos post-ejercicio a los descriptos anteriormente para el día 5. No se realizaron ejercicios durante las 24 hs previas a esos días de evaluación. En el día 2, los sujetos arribaron al laboratorio en ayuno (7:00-9:00) y se ejercitaron a una alta intensidad en el cicloergómetro a una carga seleccionada para producir el 75% del VO2 pico. El ejercicio fue finalizado cuándo los sujetos no podían sostener >60 rpm. En el día 3 los sujetos pedalearon 45 minutos al 65% del VO2 pico y en el día 4 descansaron.
En el día 5 los sujetos llegaron en ayunas (07:00-09:00), y se les insertó un catéter plástico calibre 22 en la vena antecubital para obtener muestras sanguíneas. Posteriormente se colectaron las muestras sanguíneas en tubos heparinizados precongelados, cada 30 minutos durante el ejercicio y cada 20 minutos después de finalizado el ejercicio hasta las dos horas posteriores al mismo. Se recolectaron muestras adicionales 3 y 4 horas después del ejercicio, y el catéter fue posteriormente removido. Estos tubos fueron inmediatamente centrifugados y partes del plasma fueron reservadas a –50° C para análisis subsecuentes de insulina y glucosa.
Después de completar el ejercicio, se obtuvo una biopsia muscular del vasto lateral utilizando una técnica de punción modificada de Bergström. Se entregó un suplemento (CHO-Pro-Grasa en el tratamiento 1, CHO en el tratamiento 2, y Pl en el tratamiento 3) inmediatamente después de la biopsia muscular [tiempo 0 (t =0)] y a 1 h (t = 1) después del primer suplemento. Se realizó una segunda biopsia en el vasto lateral contralateral 4 horas después del primer suplemento (t =+4). Todas las muestras obtenidas a partir de las biopsias fueron teñidas y disecadas libres de tejido conectivo visible, enfriadas en nitrógeno líquido, y posteriormente reservadas a –50° C para posteriores análisis de glucógeno muscular.
Durante cada tratamiento tratamiento, se recolectaron muestras de orina cada 24 hs durante el día 4 (descanso) y el día 5 (ejercicio de evaluación). Se tomó parte de la orina y se reservó a –50° C para análisis subsecuentes de creatinina y urea total nitrogenada.
Orina y Plasma
Se analizaron todas las muestras para insulina a través de radioinmunoensayo (Diagnostics Products, Los Angeles, CA). La glucosa fue determinada por espectrofotometría (Kit 135, Sigma Diagnostics, Products, St. Louis, MO). Los coeficientes de variación intra-ensayo para la insulina y la glucosa fueron < 5%.
Para determinar urea nitrogenada (procedure 640, Sigma Diagnostics) y creatina en orina (Kit 555-A, Sigma Diagnostic) se midieron muestras de orina en ejercicio (día 5) y reposo (día 4) durante 24 horas utilizando espectrofotometría.
Análisis de Glucógeno Muscular
Antes del análisis, las muestras musculares fueron liofilizadas y pulverizadas, y cualquier remanente visible de sangre o tejido conectivo fue removido antes del pesaje. La concentración de glucógeno fue determinada por un método adaptado del descripto por Bergmeyer (1). Brevemente, 160 µl de NaOH fueron agregados a ~2.0-4.0 mg de músculo seco (dm) y mezclados completamente. Después de la incubación a 80° C durante 10 min, se agregaron 640 µl de una solución ácido-buffer combinada (HCl-citrato) para neutralizar la muestra. Después se agregaron 40 µl de una solución reactiva [en mM: 375 tritanolamina, 150 KOH, 112.5 Mg (Ac)2-H2O, 3.75 EDTA-Na2-H2O], con una solución de 5 µl de 45 mM de ATP, 5 µl de 60 mM de una solución de ditiotretiol, y 10 µl de una solución de 30 mM de NAD. Posteriormente se realizaron mediciones de absorciometría de fondo con un espectrofotómetro a 340 nm (modelo 1201; Shimadzu, Tokio, Japan). Después se agregaron 4 µl de una solución combinada de glucosa-6-fosfato dehidrogenasa/HK (200 unidades de glucosa -6-fosfato deshidrogenasa con 200 U HK, disuelta en 800 µl de agua doblemente destilada; Sigma Chemical, St. Louis, MO). La absorciometría a 340 nm fue posteriormente medida 15 min después del agregado de la solución enzimática. Para la determinación de glucógeno la absorciometría de fondo fue restada de la reacción de absorciometría, y el valor obtenido fue graficado frente a una curva estándar de glucógeno (Sigma Chemical). Las concentraciones de glucógeno muscular son presentadas como mmoles de glucógeno por kilogramo de músculo seco de peso por hora.
Cálculos
La tasa de resíntesis de glucógeno muscular se calculó a partir de la ecuación: Tasa =(Gpost – Gpre) / t, dónde Gpre es la concentración de glucógeno inmediatamente previa al ejercicio, Gpost es la concentración de glucógeno muscular 4 horas después del ejercicio, y t es el tiempo entre dos biopsias.
Análisis Estadísticos
Los datos sanguíneos y musculares fueron analizados mediante el uso de mediciones-repetidas de análisis de varianza (sexo x tiempo x condición) (versión 5.0 Statistica, Statsoft, Tulsa, OK). Cuándo se encontró una interacción significativa, se utilizó un análisis post hoc Tukey para localizar las diferencias apareadas. Se analizó el dato integrado del área bajo la curva para la glucosa e insulina usando mediciones repetidas de análisis de varianza a una vía (versión 5.0 Statistica). La significancia estadística fue aceptada en P <0.05. Los valores son expresados como medias ±DS.
RESULTADOS
Oxidación de Sustratos
Los valores de RER durante los 90 minutos del ejercicio fueron significativamente menores para las mujeres en comparación con los hombres, para todos los tratamientos (CHO-Pro-Grasas: 0.902 ±0.04 vs. 0.934 ±0.03, mujeres vs hombres respectivamente; CHO: 0.882 ±0.04 vs. 0.902 ±0.03, mujeres vs hombres, respectivamente; Pl: 0.896 ±0.03 vs. 0.918 ±0.02, mujeres vs hombres, respectivamente; P <0.05). No hubo diferencias significativas entre sexos o tiempo en el VO2 o frecuencia cardiaca para ninguno de los tres tratamientos (Tabla 4). No hubo diferencias entre los tratamientos en la urea nitrogenada o creatinina durante 24 hs. Hubo una tendencia de mayor concentración de urea nitrogenada o creatinina durante 24 hs en el día de ejercicio (día 5) comparada con el día de descanso (día 4) [no significativa (NS)]. No hubo diferencias entre hombres y mujeres en la urea nitrogenada y creatinina durante 24 h. El costo total de energía de la serie de ejercicio al 65% del VO2 pico durante los 90-min para los hombres fue de 1214, 1198, y 1214 kcal para los tratamientos de CHO-Pro-Grasa, CHO, y Pl, respectivamente. Similarmente el costo total de energía para las mujeres al 65% del VO2 pico fue de 910, 899, y 963 kcals para los tratamientos de CHO-Pro-Grasa, CHO, y Pl, respectivamente. Los lípidos contribuyeron al ~29 % del costo total de energía para las mujeres y 23 % para los hombres en la serie de 90 minutos de ejercicio para los tres tratamientos (P <0.005). Los carbohidratos contribuyeron al 75% del costo de energía de los tres tratamientos para los hombres y 68% para las mujeres (P <0.005). Las proteínas contribuyeron al 2% del costo energético para de los 90 min de ejercicios para los hombres y 3% para las mujeres (NS; calculado del RER y urea usando ecuaciones de la referencia 9).
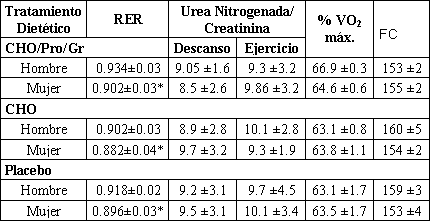
Tabla 4. Utilización de substratos y consumo de oxígeno durante los
tratamientos. Los valores son presentados como medias ±DS. Datos de ejercicio
[índice de intercambio respiratorio (RER), máximo consumo de oxígeno (VO2 máx.),
frecuencia cardiaca] son presentados a lo largo de los 90 minutos de ejercicio.
*Valores significativamente menores para mujeres comparadas con hombres; P
<0.005.
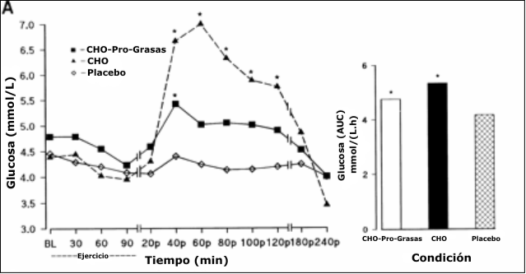
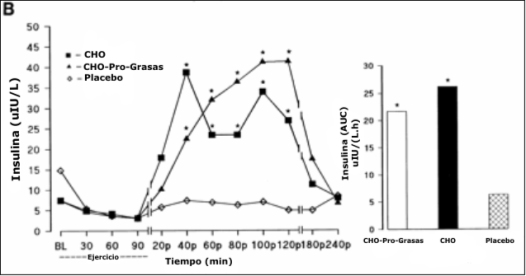
Figura 1. Concentración de glucosa plasmática durante y después del ejercicio
de resistencia al 65% del pico de consumo de oxigeno para cada tratamiento; BL,
reposo; CHO, carbohidratos; Pro, proteínas. Los datos para hombres y mujeres
unidos debido a que no hubo efecto significativo para los sexos. Derecha: área
integrada bajo la curva (AUC). B: concentración de insulina plasmática en los
mismos momentos para cada tratamiento (unidos entre sexos). Derecha: AUC
integrada. * P<0.05 con respecto al placebo.
Insulina y Glucosa
No hubo diferencias en las concentraciones plasmáticas de insulina entre los tratamientos al comienzo del ejercicio, al final del ejercicio, y al tiempo de la segunda biopsia (4 hs después del ejercicio). Las concentraciones plasmáticas de insulina fueron significativamente mayores para la condición CHO-Pro-Grasas vs. Pl en los siguientes tiempos 20, 40, 60, 80 y 120 minutos después del ejercicio (Figura 1B; P <0.01). Similarmente, la condición CHO elevó significativamente las concentraciones de insulina plasmática a los 20, 40, 60, 80, 100, y 120 min después del ejercicio en comparación con Pl (P <0.01). El área total integrada bajo la curva para la insulina fue significativamente mayor para los tratamientos CHO-Pro-Grasas (alrededor de tres veces) y para el tratamiento CHO (alrededor de 4 veces) vs. el tratamiento Pl [ (21.66 vs. 26.2 vs. 6.34) µIU • L−¹ • h−¹ en los tratamientos CHO-Pro-Grasa vs. CHO vs. Pl, respectivamente; P < 0.01]. No hubo diferencias significativas entre mujeres y hombres.
No hubo diferencias entre tratamientos en la concentración plasmática de glucosa en reposo o durante el ejercicio. El tratamiento de CHO resultó en una mayor concentración de glucosa plasmática a los 40, 60, 80, 100 y 120 min en comparación con el tratamiento Pl (P <0.01; Figura 1 A). El tratamiento CHO-Pro-Grasas resultó en un incremento en la glucosa vs. el tratamiento Pl, aunque sólo a los 40 min fue significativamente diferente (P <0.05). El área bajo la curva de glucosa no fue estadísticamente diferente entre los tratamientos de CHO-Pro-Grasas y el tratamiento de CHO 4.75 vs. 5.35 mM/h, respectivamente), pero estos fueron mayores a los del tratamiento Pl (4.06 mM/h, (P <0.05; Figura 1 A, derecha). No hubo diferencias significativas entre hombres y mujeres.
Glucógeno
Las tasa de recuperación de glucógeno muscular después del ejercicio para los tratamientos CHO-Pro-Grasas y CHO fueron significativamente mayores (P <0.05) en comparación con el tratamiento Pl [en mmol • kg de músculo seco−¹ • h−¹ (hombres vs. mujeres, respectivamente): CHO-Pro-Grasas, 25.5 vs. 23.5, CHO, 40.0 vs. 34.5; Pl, 3.0 vs. 12.0]. No hubo diferencias significativas en la tasa de recuperación de glucógeno muscular después del ejercicio entre mujeres y hombres para ninguno de los tres tratamientos (Figura 2). Para los tratamientos CHO-Pro-Grasas y CHO, la concentración de glucógeno muscular fue significativamente mayor (P <0.001) a t =+4 h en comparación con el tiempo inmediato después del ejercicio (t =0) (CHO-Pro-Grasas, de 142.4 ±69 a 245.2 ±75 mmol/kg de músculo seco; CHO, de 163.4 ±53.6 a 312.8 ±56 mmol/kg de músculo seco). El tratamiento Pl no resultó en un incremento en la concentración de glucógeno muscular después de 4 h (de 210 ±68 a 237 ±80 mmol/kg de músculo seco; NS). Los análisis Post hoc demostraron que la concentración de glucógeno muscular a t =0 fue mayor para el tratamiento Pl comparado con los tratamientos CHO-Pro-Grasa y CHO (P <0.01).
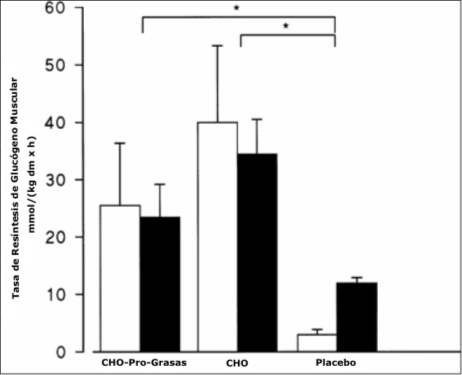
Figura 2. Tasa de resíntesis de glucógeno para cada tratamiento durante las 4
horas posteriores del ejercicio. Barras blancas, hombres; barras negras,
mujeres. * P <0.05 comparadas con placebo.
DISCUSIÓN
Nosotros hemos demostrado que las tasas de resíntesis de glucógeno muscular son similares para suplementos isoenergéticos de CHO y CHO-Pro-Grasa, y que ambos son mejores que el Pl. Contrariamente a nuestra otra hipótesis, la tasa de resíntesis de glucógeno fue similar en hombres y mujeres.
Algunos han cuestionado el valor práctico de la ingesta de suplementos después del ejercicio debido a la observación de que las concentraciones de glucógeno muscular no fueron diferentes 8 y 48 hs después de la culminación del ejercicio, cuándo el CHO fue provisto inmediatamente después del ejercicio o luego de un retraso de 2 h de finalizado el ejercicio (16). Sin embargo, hay muchos ejemplos dónde la suplementación temprana después del ejercicio puede ser de un beneficio práctico: 1) cuándo un atleta está entrenando o compitiendo más que una vez por día, 2) cuándo un atleta se ejercita en la tarde en un día y nuevamente la próxima mañana, y 3) cuándo un atleta no es capaz de consumir una dieta con alto contenido de CHO durante el periodo de 24 h posterior del ejercicio.
El hallazgo de respuestas similares de la insulina después del ejercicio, con diferentes suplementos, es consistente con algunos (5, 18a) pero no con todos los estudios (21, 26). Zwadzki y colegas (26) encontraron que las concentraciones plasmáticas de insulina y la tasa de resíntesis de glucógeno fue mayor para suplementos de CHO-Pro que en suplementos con sólo CHO. Sin embargo, en ese estudio no es posible separar la co-intervención del agregado de la ingesta energética (+43%) de los cambios en la composición de los macronutrientes (26). El hecho de no hallar diferencias en la resíntesis de glucógeno entre los suplementos de CHO y CHO-Pro-Grasa sugiere que la ingesta energética pudo haber contribuido a las observaciones realizadas en el estudio anterior (6). El hallazgo en las respuestas similares de la insulina y glucosa fue también confirmado en otros estudios, dónde suplementos isoenergéticos de CHO y CHO-Pro (5) y CHO-Pro-Grasa (observaciones no publicadas por B.D. Roy y M.A. Tarnopolsky) fueron comparados después de un ejercicio de fuerza. Puede ser argumentado que el contenido mínimo de grasa del suplemento usado en nuestro estudio pudo haber confundido los resultados inhibiendo el vaciado gástrico, así potencialmente inhibiendo la rápida provisión de CHO al músculo y CHO-Pro al páncreas para la liberación de insulina. No creemos que la inhibición gástrica fuese un factor importante, debido a que la insulina se elevó rápidamente en el tratamiento CHO-Pro-Grasa y no fue estadísticamente diferente al tratamiento de CHO en ningún momento después del suplemento. Además, durante el período de 24 h después del ejercicio de resistencia, la adición de cantidades similares de grasa a la dieta no empeoró la resíntesis de glucógeno en un estudio de ocho atletas bien entrenados en resistencia (3). La fuente de CHO usada en este estudio fue sucrosa (conteniendo fructuosa) y polímeros, en vez de la glucosa usada en el estudio de Zawadzki et al. (26). Sin embargo, hubo respuestas de la insulina muy similares a las observadas en el estudio de Zawadzki. Por ello es improbable que esto pueda haber alterado los resultados. Además, la comparación más importante en el presente estudio fue que entre los tratamientos de CHO y CHO-Pro-Grasa, la fuente de CHO fue idéntica.
También puede ser argumentado que el orden de los tratamientos en nuestro estudio pudo haber influenciado los resultados. Sin embargo, no encontramos diferencias significativas entre tratamientos en el VO2, frecuencia cardiaca, RER, insulina, o glucosa durante el ejercicio. Debería ser negado un efecto del entrenamiento debido a que nosotros estudiamos a atletas entrenados en resistencia quienes estaban acostumbrados a estas intensidades de entrenamiento y separamos los tratamientos cerca de 1 mes. Sin embargo la concentración de glucógeno después del ejercicio fue significativamente mayor para el tratamiento Pl comparado con los otros tratamientos debido a dos bajas (una en cada sexo). Estos sujetos eran predominantemente corredores, y es posible que hubieran desarrollado una forma más eficiente de pedaleo en los tratamientos subsecuentes. Una mayor dependencia del gastrocnemio y los isquiotibiales (por el uso de las punteras) podría reducir el trabajo del cuadriceps. Menores concentraciones de glucógeno pueden resultar en una mayor tasa de resíntesis de glucógeno per se (18, 27). Sin embargo esta diferencia es solo significativa cuándo las concentraciones de glucógeno muscular son <120 mmol/kg de músculo seco (18). El 27% de la diferencia en la concentración de glucógeno entre los dos tratamientos con suplementos comparados con el tratamiento de Pl cayó dentro del rango (120-280 mmol/kg de músculo seco) que se ha demostrado que no tiene efecto sobre la tasa de resíntesis de glucógeno (18). Además, los valores de glucógeno después del ejercicio para los tratamientos de CHO-Pro-Grasa y CHO fueron casi idénticos, y la comparación entre estos dos tratamientos fue la medición más importante en el presente estudio.
Un punto fuerte en el presente estudio fue la provisión a cada sujeto en cada tratamiento de viandas de comida empaquetadas que contenían la misma energía que sus dietas habituales. Nosotros también controlamos la ingesta energética durante 24 h a través de la provisión de suplementos complementarios más tarde durante el día para asegurarnos que la composición de macronutrientes sea la misma durante el período de 24 hs. Esto es importante para examinar el verdadero efecto del tiempo de la provisión de los macronutrientes, sin confusión por la ingesta extra de energía. Una ventaja práctica de esta aproximación es que nosotros encontramos que las mujeres y aquellos que consumen una dieta restringida en calorías son reacios a consumir energía adicional. Otra ventaja posible de la combinación de suplementos después del ejercicio es que ellos proveen macronutrientes “balanceados”. Por ejemplo, si uno debería entregar una bebida con CHO de 1g/kg después del ejercicio a t= 0 y t =+1h a una mujer con un peso de 60 kg, el contenido energético podría ser de 480 kcal. Con una ingesta de ~2000 kcal, esta cantidad representaría el ~25% de la ingesta diaria como un azúcar simple. Si esto fuera parte de una dieta habitual limitaría la ingesta de vitaminas, calcio, hierro, y otros minerales (25) que pueden ser de particular importancia para la atleta femenina (7, 12). Además, el entrenamiento de resistencia habitual incrementa los requerimientos de proteínas para atletas hombres (14, 23) y mujeres (17).
Nuestro grupo ha demostrado previamente que hombres, pero no mujeres, incrementan la concentración de glucógeno en respuesta a un incremento en los CHO dietarios del 60 al 75% de la ingesta energética total (24). Los resultados del presente estudio, sin embargo, fueron contradictorios a nuestra hipótesis previa y no mostraron una diferencia entre sexos en la tasa de repleción de glucógeno. Este es un importante hallazgo para mujeres atletas, quienes podrían tener una habilidad limitada para supercompensar las reservas de glucógeno (24). Como la provisión de suplementos durante el período temprano después del ejercicio puede permitir la supercompensación de glucógeno en mujeres, queda por ser explorado.
Nuestros hallazgos de un menor RER para las mujeres en el presente estudio ha sido demostrado en tres de nuestros trabajos previos (17, 22, 24) y de otros estudios (2, 5, 10). El hallazgo del RER indica una mayor oxidación de lípidos y una menor oxidación de CHO para las mujeres durante el ejercicio al 65% del VO2 pico. Nosotros encontramos una tendencia a una mayor excreción de urea en el día de ejercicio para hombres y mujeres. Esto sugiere una tendencia a una mayor de oxidación proteica de todo el cuerpo consecuente con el estrés del ejercicio (17). Contrariamente a nuestro trabajo en suplementación nutricional después de ejercicios de fuerza (observaciones no publicadas de B.D. Roy y M.A. Tarnopolsky), nosotros no demostramos una supresión de la excreción de urea para los dos tratamientos con suplementos en comparación tratamiento con placebo. Esto puede estar relacionado a diferentes situaciones metabólicas después de este tipo de actividades. Después del entrenamiento de fuerza, por ejemplo, nosotros encontramos que la reducción en la excreción de urea para el tratamiento con suplemento inmediato disminuyó comparativamente la excreción de 3-metilhistidina (indicativo de una menor degradación de proteínas miofibrilares) (18a). Aunque la 3 metilhistidina no se midió en este estudio, es improbable que el ejercicio habitual de resistencia al 65% del VO2 pico pudiera estar asociado con rupturas de proteínas miofibrilares (4). Por ello la tendencia a un incremento en la excreción de urea en el día del ejercicio estuvo probablemente causada por un incremento en la oxidación de proteínas durante (13, 17) y no después del ejercicio.
En resumen, nosotros demostramos que, en comparación a una bebida con Pl, los suplementos con CHO y CHO-Pro-Grasa cuándo se dan inmediatamente después del ejercicio de resistencia, resultan en una más rápida velocidad de resíntesis de glucógeno. De manera importante, este hallazgo es verdadero tanto para atletas de sexo masculino como femenino.
Agradecimientos: Agradecemos a Roxana Birsan por la asistencia técnica. Nota al pie de página: Este trabajo fue financiado por un subsidio de Mead-Johnson, Canadá.
Dirección para el pedido de reimpresiones: M. Tarnoplosky, Depts. Of Neurology, Physical Medicine, and Kinesiology, Rm. 205, Ivor Wynne Centre, Macmaster Univ., Hamilton, Ontario, Canada L8S 4K1 (Correo electrónico: tarnopol@mamaster.ca).
Referencias
1. Bergmeyer, H. U. (Editor) (1985). Methods of Enzymatic Analysis. New York: Academic, vol. VI, p. 11-18
2. Blatchford, F. K., R. G. Knowlton, and D. A. Schneider (1985). Plasma FFA responses to prolonged walking in untrained men and women. Eur. J. Appl. Physiol. 53: 343-347
3. Burke, L. M., G. R. Collier, S. K. Beasley, P. G. Davis, P. A. Fricker, P. Heeley, K. Walder, and M. Hargreaves (1995). Effect of coingestion of fat and protein with carbohydrate feedings on muscle glycogen storage. J. Appl. Physiol. 78: 2187-2192
4. Calles-Escandon, J., J. J. Cunningham, R. Jacob, J. Loke, G. Husgaar, and P. Felig (1984). Influence of exercise on urea, creatinine, and 3-methylhistidine excretion in normal man. Am. J. Physiol. 246 ((Endocrinol. Metab. 9): E334-E338
5. Chandler, R. M., H. K. Byrne, J. G. Patterson, and J. L. Ivy (1994). Dietary supplements affect the anabolic hormones after weight-training exercise. J. Appl. Physiol. 76: 839-845
6. Coderre, L., K. V. Kandror, G. Vallega, and P. F. Pilch (1995). Identification and characterization of an exercise-sensitive pool of glucose transporters in skeletal muscle. J. Biol. Chem. 46: 27584-27588
7. Deuster, P. A., S. B. Kyle, P. B. Moser, R. A. Vigersky, A. Singh, and E. B. Schoomaker (1986). Nutritional survey of highly trained women runners. Am. J. Clin. Nutr. 45: 954-962
8. Folli, F., M. J. Saad, J. M. Backer, and C. R. Kahn (1993). Regulation of phosphatidylinositol 3-kinase in liver and muscle of animal models of insulin-resistant and insulin-deficient diabetes mellitus. J. Clin. Invest. 92: 1787-1794
9. Frayn, K. N (1983). Calculation of substrate oxidation rates in vivo from gaseous exchange. J. Appl. Physiol. 55: 628-634
10. Froberg, K., and P. K. Pedersen (1984). Sex differences in endurance capacity and metabolic response to prolonged, heavy exercise. Eur. J. Appl. Physiol. 52: 446-450
11. Ivy, J. L., A. L. Katz, C. L. Cutler, W. M. Sherman, and E. F. Coyle (1988). Muscle glycogen synthesis after exercise: effect of time of carbohydrate ingestion. J. Appl. Physiol.: 1480-1485
12. Janssen, G. M. E., C. J. J. Graef, and W. H. M. Saris (1989). Food intake and body composition during a training period to run a marathon. Int. J. Sports Med. 10 Suppl. 1: S17-S21
13. Lamont, L. S., D. G. Patel, and S. C. Kalhan (1990). Leucine kinetics in endurance-trained humans. J. Appl. Physiol. 69: 1-6
14. Meredith, C. N., M. J. Zackin, W. R. Frontera, and W. J. Evans (1989). Dietary protein requirement and body protein metabolism in endurance trained men. J. Appl. Physiol. 66: 2850-2856
15. Nygaard, E (1981). Women and exercise: with special reference to muscle morphology and metabolism. In: Biochemistry of Exercise, edited by J. Poortmans, and G. Niset. Baltimore, MD: Univ. Park Press, vol. IV-B, p. 161-175
16. Parkin, J. A., M. F. Carey, I. K. Martin, L. Stojanovska, and M. A. Febbraio (1997). Muscle glycogen storage following prolonged exercise: effect of timing of ingestion of high glycemic index food. Med. Sci. Sports Exerc. 29: 220-224
17. Phillips, S. M., S. A. Atkinson, M. A. Tarnopolsky, and J. D. MacDougall (1993). Gender differences in leucine kinetics and nitrogen balance in endurance athletes. J. Appl. Physiol. 75: 2134-2141
18. Price, T. B., D. L. Rothman, R. Taylor, M. J. Avison, G. I. Shulman, and R. G. Shulman (1994). Human muscle glycogen resynthesis after exercise: insulin-dependent and -independent phases. J. Appl. Physiol. 76: 104-111
19. Roy, B. D., M. A. Tarnopolsky, J. D. MacDougall, J. Fowles, and K. E. Yarasheski (1997). Effect of glucose supplement timing on protein metabolism after resistance training. J. Appl. Physiol. 82: 1882-1888
20. Roy, D., and A. Marette (1996). Exercise induces the translocation of GLUT-4 to transverse tubules from an intracellular pool in rat skeletal muscle. Biochem. Biophys. Res. Commun. 223: 147-152
21. Spiller, G. A., C. D. Jensen, T. S. Pattison, C. S. Chuck, J. H. Whittim, and J. Scala (1987). Effect of protein dose on serum glucose and insulin response to sugars. Am. J. Clin. Nutr. 46: 474-480
22. Tarnopolsky, L. J., J. D. MacDougall, S. A. Atkinson, M. A. Tarnopolsky, and J. R. Sutton (1990). Gender differences in substrate for endurance exercise. J. Appl. Physiol. 68: 302-308
23. Tarnopolsky, M. A., S. A. Atkinson, and J. D. MacDougall (1988). Influence of protein intake and training status on nitrogen balance and lean body mass. J. Appl. Physiol. 64: 187-193
24. Tarnopolsky, M. A., S. A. Atkinson, S. M. Phillips, and J. D. MacDougall (1995). Carbohydrate loading and metabolism during exercise in men and women. J. Appl. Physiol. 78: 1360-1368
25. Van Erp-Baart, A. M. J., W. M. H. Saris, R. A. Binkhorst, J. A. Vos, and J. W. H. Elvers (1989). Nationwide survey on nutritional habits in elite athletes. Part II. Mineral and vitamin intake. Int. J. Sports Med. 10 Suppl.: S11-S14
26. Zawadzki, K. M., B. B. Yaspelkis III, and J. L. Ivy (1992). Carbohydrate-protein complex increases the rate of muscle glycogen storage after exercise. J. Appl. Physiol. 72: 1854-1859
27. Zachwieja, J. J., D. L. Costill, D. D. Pascoe, R. A. Robergs, and W. J. Fink (1991). Influence of muscle glycogen depletion on the rate of synthesis. Med. Sci. Sports Exerc. 23: 44-48