Mecanismos Fisiológicos y Celulares Potenciales del Ejercicio que Reducen el Riesgo de Complicaciones Graves y Mortalidad Después de la Infección por SARS-COV-2
Potential Physiological and Cellular Mechanisms of Exercise that Decrease the Risk of Severe Complications and Mortality Following Sars-Cov-2 Infection
Johan Jakobsson1, Ian Cotgreave2, Maria Furberg3, Niklas Arnberg3 y Michael Svensson1
1Section of Sports Medicine, Department of Community Medicine and Rehabilitation, Umeå University, 901 87 Umeå, Sweden
2Division of Biomaterials and Health, Department of Pharmaceutical and Chemical Safety, Research Institutes of Sweden, 151 36 Södertälje, Sweden
3Department of Clinical Microbiology, Umeå University, 901 87 Umeå, Sweden
Artículo publicado en el journal Revista de Educación Física, Volumen 1, Número 165 del año 2022.
Publicado 11 de enero de 2022
Resumen
Palabras clave: virus, inmunología, actividad física, ejercicio, salud, COVID-19, SARS-CoV-2, obesidad
Abstract
Keywords: virus, immunology, physical activity, exercise, health, COVID-19, SARS-CoV-2, obesity
INTRODUCCIÓN
La enfermedad por coronavirus 2019 (COVID-19), que es causada por el síndrome respiratorio agudo severo coronavirus 2 (SARS-CoV-2), aumentó rápidamente a una magnitud pandémica durante el primer trimestre de 2020 [1]. La gravedad de COVID-19 parece ser una consecuencia neta de la combinación de la infección por SARS-CoV-2 y la aptitud cardiorrespiratoria y metabólica, la edad, el sexo y la etnia de la persona [2, 3, 4, 5, 6]. Algunas personas que se infectan con SARS-CoV-2 presentan síntomas leves o nulos de la enfermedad, mientras que otras se enferman críticamente y dependen de cuidados intensivos con mal pronóstico [7].
Los factores fisiológicos y celulares que interactúan y determinan la vulnerabilidad de un individuo al SARS-CoV-2 aún no se han determinado. La investigación ha puesto de relieve varios factores de riesgo predisponentes para la mortalidad con COVID-19, muchos de los cuales están relacionados con una baja aptitud cardiorrespiratoria y metabólica, incluida la obesidad, las enfermedades cardiovasculares (ECV), la diabetes [2,4,8,9,10] y el síndrome metabólico (MetS) [11]. Es razonable suponer que un estilo de vida físicamente activo da como resultado adaptaciones inducidas por estrés fisiológico y molecular en todos los tejidos afectados por el ejercicio, que pueden ser protectores después de la infección por SARS-CoV-2, en contraste con el estilo de vida sedentario asociado con la obesidad [12].
El objetivo de esta revisión narrativa es resaltar los posibles mecanismos fisiológicos, celulares y moleculares afectados por la actividad física (AF) regular y el ejercicio que pueden regular las defensas antivirales y determinar el curso y el resultado del COVID-19. En primer lugar, nuestro objetivo es explicar el deterioro de la forma física debido a la inactividad física y el sedentarismo. En segundo lugar, se revisa brevemente la biología del SARS-CoV-2. Por último, nuestro objetivo es esclarecer los efectos fisiológicos y celulares del ejercicio sobre el estado físico y el potencial del ejercicio como medida protectora contra las complicaciones graves inducidas por la infección por SARS-CoV-2. Además del sistema inmunológico, también los sistemas cardiovascular, respiratorio, renal y hormonal, así como el músculo esquelético, la epigenética y la función mitocondrial en relación con la AF regular y la defensa antiviral se discuten en aspectos novedosos.
DEFINICIONES
La AF se define como cualquier movimiento corporal generado por la contracción de los músculos esqueléticos que eleva el gasto energético por encima de la tasa metabólica en reposo [13]. El ejercicio es una subcategoría de AF que se planifica y estructura, favoreciendo la aptitud física. La Organización Mundial de la Salud (OMS) recomienda 150 a 300 min de intensidad moderada (3 a 6 equivalentes metabólicos, 1 equivalente metabólico = 3.5 ml de O2 por kg de peso corporal por minuto) o 75 a 150 min de intensidad vigorosa ( >6 equivalentes metabólicos) de AF por semana para adultos [14]. Para conferir beneficios adicionales para la salud, se sugieren 300 min de AF de intensidad moderada o 150 min de AF de intensidad vigorosa por semana. Estar físicamente activo implica cumplir con estas pautas y no cumplirlas se considera inactivo físicamente [15]. El comportamiento sedentario se define como cualquier comportamiento de vigilia con un gasto de energía ≤1.5 equivalentes metabólicos mientras está sentado o acostado. En consecuencia, una persona puede ser físicamente activa y aun así clasificarse como sedentaria.
ESTADO FÍSICO Y DE SALUD, INMUNIDAD E INFECCIÓN
Un estilo de vida sedentario con obesidad o MetS aumenta el riesgo de enfermedad grave debido a infecciones virales [16,17]. Por el contrario, la AF produce efectos protectores contra infecciones bacterianas y virales [18,19,20,21]. Aún no se ha determinado cómo se puede extrapolar este conocimiento al COVID-19. Sin embargo, los datos emergentes indican que la obesidad, la diabetes y el MetS son algunos de los principales factores de riesgo asociados con la gravedad y la mortalidad del COVID-19 [4,8,22,23,24]. Aunque la obesidad está estrechamente asociada con todas las características del MetS, incluida la adiposidad abdominal, la hipertensión, la dislipidemia y la resistencia a la insulina [25,26], la AF y una buena condición cardiorrespiratoria son factores importantes que contrarrestan el MetS, incluso en individuos obesos [27]. Los factores de riesgo relacionados con la obesidad son más o menos tratables con el ejercicio [28], y la investigación epidemiológica ha demostrado claramente que la AF regular reduce el riesgo de comorbilidades y mortalidad por todas las causas [29,30]. Varios de los factores de riesgo y comorbilidades antes mencionados son la inflamación sistémica sostenida de bajo grado, caracterizada por niveles elevados de citocinas proinflamatorias y una regulación alterada de la fibrinólisis [31]. En este contexto, la actividad física y el ejercicio, o la falta del mismo, juegan un papel importante en efectos de amplio alcance sobre las funciones cerebrales, cardiorrespiratorias, metabólicas, endocrinas, musculares e inmunológicas.
DETERIORO DEL ESTADO FÍSICO DURANTE UN BREVE PERÍODO DE INACTIVIDAD FÍSICA
Los cierres y restricciones han afectado a la mayoría de la humanidad durante la pandemia de COVID-19. Las medidas de protección destinadas a frenar la propagación de COVID-19 han afectado las posibilidades de AF y ejercicio según los datos recuperados de rastreadores de actividad y teléfonos móviles de todo el mundo [32,33]. Estas restricciones temporales han afectado negativamente las crisis ya en curso de inactividad física y obesidad que se abordan con frecuencia durante la pandemia de COVID-19 [34,35,36]. Los estudios longitudinales han demostrado que, en algunas cohortes, los bloqueos de COVID-19 condujeron a un aumento del peso corporal, el consumo de bocadillos y de alimentos ultraprocesados, mientras que la actividad disminuyó [37].
La inactividad física y el tiempo sedentario se asocian con múltiples enfermedades crónicas y mortalidad prematura y contribuyen a una importante carga económica en todo el mundo [38]. Se ha indicado que la inactividad física es la causa del 9% de las muertes en todo el mundo [39]. La inactividad física desempeña un papel, independientemente de otros factores, en la disminución de la aptitud cardiovascular y muscular y, por tanto, en la edad de aparición de las enfermedades crónicas, disminuyendo la calidad de vida y acortando la duración de la salud [40]. El tiempo total sentado, independientemente de la AF, se asocia con un mayor riesgo de varias enfermedades crónicas importantes y mortalidad por todas las causas [41]. La inactividad física y el tiempo sedentario también son predictores sustanciales de hospitalización y se han descrito como el factor central del riesgo de mortalidad en estudios longitudinales [42]. Por el contrario, un aumento de la actividad física a cualquier intensidad, de cualquier duración y menos tiempo sedentario se asocian con un riesgo reducido de mortalidad prematura [30]. En términos de AF, hacer algo es mejor que no hacer nada [29,30]; aunque más es mejor, una pequeña dosis de AF correspondiente a 75 min por semana, por debajo de las recomendaciones actuales, reduce sustancialmente la mortalidad [43].
Los cambios en los patrones de AF se reflejan rápidamente en la fisiología humana. Esto se ejemplifica por los efectos de 2 semanas de un recuento de pasos reducido, que deterioró la sensibilidad a la insulina multiorgánica y la masa muscular, y aumentó la adiposidad central y hepática y la dislipidemia [44,45]. A corto plazo, el tiempo sentado prolongado tiene un impacto negativo en los marcadores metabólicos, que se ve atenuado por la AF [46]. En particular, desde la perspectiva del COVID-19, la inactividad física per se se asocia con una inflamación sistémica de bajo grado [47], que se ve agravada por la obesidad [48], en particular la obesidad abdominal [49]. Sin duda, esta es una preocupación importante dadas las restricciones, la movilidad general y la AF durante la pandemia de COVID-19.
En consecuencia, la inactividad física y un estilo de vida sedentario están relacionados con un aumento de la mortalidad por todas las causas, y sólo unos pocos días de sedentarismo son suficientes para inducir efectos negativos sobre el metabolismo, la aptitud cardiorrespiratoria y la aptitud del músculo esquelético.
SARS-CoV-2 y COVID-19
El SARS-CoV-2 pertenece a la familia Coronaviridae dentro del orden de los Nidovirales. Se transmite entre humanos principalmente a través de gotitas, pero también por contacto y/o aerosoles [50]. El virus se dirige principalmente al tracto respiratorio, pero en algunos pacientes con enfermedad grave, el virus se disemina a otros órganos, incluidos el corazón, el hígado, el cerebro, los riñones [51] y el intestino [52]. Los viriones infecciosos están equipados con un genoma de ARN monocatenario de sentido positivo que es inusualmente grande en comparación con otros virus de ARN. El genoma codifica varias proteínas estructurales y no estructurales, incluida la proteína de pico de unión al receptor (S), la proteína de membrana (M), la proteína de la envoltura (E) y una proteína de la nucleocápside (N) [53]. El tropismo celular y tisular parece depender en gran medida, pero no del todo, de la expresión del receptor de entrada de la enzima convertidora de angiotensina 2 (ACE2), así como de las proteasas celulares, incluida la TMPRSS2 [54]. Los anticuerpos neutralizantes se dirigen principalmente a la proteína S, que contiene un nivel relativamente alto de glucanos unidos a N en comparación con las glucoproteínas virales de otros virus que se unen al receptor [55]. Estos glicanos protegen parcialmente a la proteína S de los anticuerpos neutralizantes. Para interactuar con el receptor ACE2, las proteasas, incluida la TMPRSS2, escinden y activan la proteína S, que sufre un cambio conformacional, lo que da como resultado la exposición del dominio de unión al receptor y facilita una interacción de alta afinidad con la ACE2 (Figura 1) [52, 54,56,57].
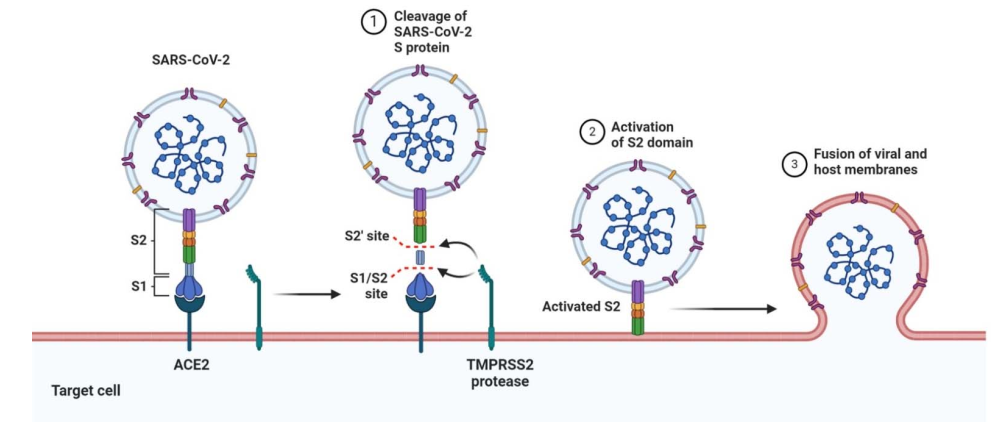
Figura 1. Cómo el SARS-CoV-2 puede desencadenar la tormenta de citocinas que conduce a un COVID-19 severo. El virus infecta las células epiteliales del pulmón y es detectado por macrófagos residentes, que desencadenan la producción de interferones y citocinas. Cuando se atraen más células inmunes, se producen más citocinas, lo que conduce a una tormenta de citocinas. El daño celular puede ocurrir a través de la formación de fibrina y vasos sanguíneos debilitados, lo que lleva a la acumulación de líquido en los alvéolos, insuficiencia respiratoria y deterioro general de la función de los órganos.
Estudios recientes sugieren que el sulfato de heparano [58] y la neuropilina 1 [59] son factores adicionales del huésped que pueden utilizarse para la adhesión y la entrada celular del SARS-CoV-2 además de ACE2 y TMPRSS2, que juntos contribuyen y regulan la infección SARS-CoV-2 y el tropismo tisular. La infección también activa la inmunidad innata, que consume energía adicional. Después de la entrada de la célula, el SARS-CoV-2 regula a la baja la expresión de ACE2 [60]. Esto contribuye a la reducción de la captación de más virus, pero también a la inflamación y el flujo sanguíneo, lo que puede conducir a un fallo multiorgánico debido a la sobreactivación de la angiotensina (Ang) II [61]. De gran interés aquí es la consecuencia de la interacción fisiológico-celular de Ang II-ACE-ACE2 después de la infección por SARS-CoV-2 desde la perspectiva del ejercicio versus el MetS.
El COVID-19 afecta principalmente al sistema respiratorio, aunque son frecuentes las manifestaciones extrapulmonares múltiples [62]. La infección inicial de las células epiteliales y la infección secuencial de las células endoteliales capilares pulmonares provocan un influjo de células inflamatorias, lo que provoca endotelialitis, engrosamiento de la pared alveolar y formación de membranas hialinas, que se visualizan en la autopsia [63,64]. Los infiltrados intersticiales de leucocitos y el edema crean las opacidades típicas en vidrio esmerilado que se observan en la tomografía computarizada. En última instancia, la fuga vascular de la neumonía y la acumulación de líquido provocan edema pulmonar, insuficiencia respiratoria, hipoxia e hipercapnia (Figura 2). Algunos pacientes críticamente enfermos desarrollan síndrome de dificultad respiratoria aguda fulminante (ARDS), choque séptico o insuficiencia multiorgánica, y la insuficiencia respiratoria es la principal causa de muerte en pacientes con COVID-19 [65,66].
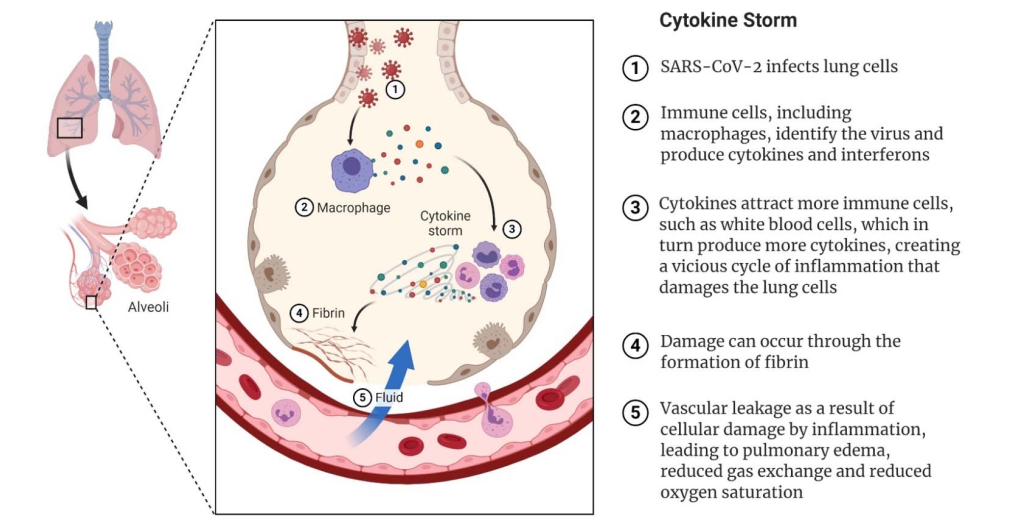
Figura 2. Mecanismo de entrada del virus SARS-CoV-2. La proteína de pico de unión al receptor (S) se acopla con el receptor ACE2 del huésped. La TMPRSS2 escinde y activa la proteína S, que sufre un cambio conformacional, lo que facilita la interacción con el ACE2 del huésped, impulsando la fusión de las membranas viral y del huésped. Estudios recientes también sugieren que la proteína S interactúa con el sulfato de heparano celular adyacente al sitio de unión de ACE2 (no representado).
La neumonía causada por el SARS-CoV-2 suele ir acompañada de niveles elevados de proteína C reactiva (PCR), equivalentes a los observados en la neumonía bacteriana, y la secreción de hialuronano, que afecta la oxigenación [67]. Algunos pacientes desarrollan un síndrome hiperinflamatorio y coagulopatía con estado protrombótico. Las complicaciones trombóticas incluyen manifestaciones arteriales y venosas [62]. Los pacientes críticamente enfermos tienen niveles muy altos de marcadores inflamatorios, como CRP, velocidad de sedimentación globular, fibrinógeno, ferritina, interleucina (IL)-1, IL-6 y dímero D. Rara vez se observa leucocitosis y es común la linfocitopenia. Niveles elevados de CRP y dímero D y recuentos bajos de linfocitos se asocian con un peor pronóstico y muerte [68,69]. La coagulación intravasal diseminada (DIC) es un fenómeno frecuente [70]. Sin embargo, la hipercoagulopatía asociada al COVID-19 está dominada por la trombosis, mientras que el sangrado es la característica más prominente de la DIC. Se ha notificado la presencia de endoteliopatía en COVID-19 y es probable que se asocie con enfermedad grave y muerte [62]. Un subgrupo de pacientes desarrolla un síndrome de tormenta de citocinas, con liberación descontrolada de citocinas y de consecuencias devastadoras para el huésped (Figura 2). La tormenta de citocinas y la hipercoagulopatía provocan la destrucción de los pulmones, insuficiencia multiorgánica y tendencias trombóticas, y la microtrombosis de los pulmones agrava aún más la destrucción del tejido pulmonar. La lesión pulmonar inmunomediada (por ej., DIC y ARDS) se asocia con resultados adversos en pacientes con COVID-19 [63]. La respuesta hiperinflamatoria a la infección puede ser responsable de muchas de las complicaciones habituales de la enfermedad, como daño pulmonar, insuficiencia renal, complicaciones cardiovasculares, problemas neurológicos y daño hepático [71].
Los reguladores redox, los factores mitocondriales y los ARN sin codificar son factores del huésped afectados por el ejercicio y pueden determinar el resultado de la infección por SARS-CoV-2 [72]. La actividad física y el ejercicio inducen varias líneas de estrés, seguidas de adaptaciones si el ejercicio se repite a lo largo del tiempo [28]. Las adaptaciones son específicas del tipo, volumen e intensidad del entrenamiento e incluyen adaptaciones fisiológicas y celulares en muchos órganos [73,74,75,76]. Algunas respuestas adaptativas al estrés después del ejercicio incluyen adaptaciones neuromusculares, respiratorias, cardiovasculares, hormonales, inmunológicas y celulares que mejoran o mantienen los factores que afectan la resistencia, la fuerza y la movilidad, así como también la salud. En este contexto, los mecanismos celulares y fisiológicos que determinan el resultado del COVID-19, los efectos de la AF y el estado de aptitud física son de interés al examinar las diferencias en el impacto del virus en jóvenes frente a ancianos, y en hombres frente a mujeres, como se indica en los estudios epidemiológicos [4].
EFECTOS DE LA ACTIVIDAD FÍSICA Y EL EJERCICIO EN LA BIOLOGÍA HUMANA EN VISTA DEL COVID-19
Los estudios epidemiológicos han demostrado que la AF regular reduce la incidencia de infecciones bacterianas y virales a lo largo de la vida de un individuo y disminuye la mortalidad y la incidencia de influenza y neumonía [77,78]. Los estudios prospectivos han demostrado consistentemente que los niveles elevados de aptitud cardiorrespiratoria y AF regular mejoran la función inmunológica, lo que confirma la asociación. Con respecto al COVID-19 y la aptitud física, algunos estudios han demostrado efectos protectores de una mayor aptitud física (medida como fitness cardiorrespiratorio (VO2máx), fuerza muscular, participación deportiva, ritmo de marcha o atención a las pautas de AF). Un estudio informó que la capacidad máxima de ejercicio se asocia de forma independiente e inversa con la probabilidad de hospitalización debido a COVID-19 [79]. Aunque se justifican más estudios, se argumentó que el fitness cardiorrespiratorio refleja directamente la función integrada de múltiples sistemas de órganos y la capacidad de un individuo para tolerar el estrés cardiopulmonar. Otro fundamento fisiológico es la función inmunológica mejorada con la AF moderada. Otro estudio mostró que las personas mayores de 50 años que realizan AF dos veces por semana o más a menudo tienen un riesgo menor de hospitalización por COVID-19, y el efecto protector se explica por la fuerza muscular [80]. Otros han encontrado que la participación deportiva regular, independientemente del sexo y la edad, afecta positivamente el resultado clínico de los pacientes hospitalizados con COVID-19 [81]. Un estudio sobre el ritmo de caminata autoinformado, una medida simple de la aptitud física, informó que los caminantes lentos tienen casi el doble de riesgo de COVID-19 severo y letal en comparación con los caminantes rápidos [5]. Un estudio observacional prospectivo en pacientes hospitalizados con COVID-19 que evaluó la fuerza muscular al ingreso observó que la duración de la estancia hospitalaria fue significativamente más corta entre los pacientes en el tercil más alto de fuerza [82]. Recientemente, un estudio que investigó una cohorte de 76.395 adultos surcoreanos encontró que los adultos que participaban en los niveles recomendados de AF tenían una menor probabilidad de infección por SARS-CoV-2, enfermedad grave por COVID-19 y muerte relacionada con COVID-19 [83]. En el estudio mencionado anteriormente, los autores argumentan que la inmunovigilancia mejorada, el inicio retardado de la inmunosenescencia y la inflamación sistémica reducida, todo se discutirá aquí, como posibles explicaciones como efectos inmunológicos que disminuyen el riesgo de infección y la gravedad debido al COVID-19.
Tejido adiposo, obesidad, METS y efectos endócrinos en relación con el COVID-19 y los efectos del ejercicio
Varios de los efectos perjudiciales del envejecimiento y la inflamación sistémica de bajo grado (específicamente la inmunosenescencia y la inflamación, discutidas más adelante) van de la mano con los efectos de la obesidad, el MetS y la inactividad física [21]. Aunque la obesidad y el MetS son factores de riesgo de mortalidad cardiovascular [84], también conducen a una disminución de la función inmunitaria [85], similar a la inmunosenescencia. Con respecto al COVID-19, el MetS se asocia con una mayor mortalidad en las infecciones por SARS-CoV [86,87] y MERS-CoV [88,89]. También se determinó que la obesidad fue un factor de riesgo para la pandemia de H1N1 2009 [90].
La expansión de la masa de tejido adiposo (TA) durante la obesidad es un factor clave en el aumento de la inflamación sistémica. El estado inflamatorio obeso se caracteriza por niveles elevados de TNF-α, IL-1β, IL-6, IL-17, IL-22 y CRP [91,92,93], que también se observa en individuos sedentarios y físicamente inactivos [47,49,94]. En la obesidad se observan niveles reducidos de adipocinas antiinflamatorias y protectoras de órganos (citocinas secretadas por el TA) [95]. Los receptores tipo Toll (TLR) proinflamatorios también se sobreexpresan en sujetos obesos [96], como se analiza más adelante. La acumulación de TA, especialmente de TA abdominal, aumenta la infiltración por macrófagos proinflamatorios de tipo M1, lo que reduce la presencia de macrófagos M2 antiinflamatorios [91,92,97]. A su vez, los macrófagos M1 liberan adipocinas proinflamatorias, que incluyen TNF-α, IL-1B e IL-6. Este cambio hacia los macrófagos M1 juega un papel central en la inflamación sistémica inducida por la obesidad [98]. Algunos han llamado al estado de obesidad inflamatoria basal una barrera para la inducción de una respuesta antiviral robusta, lo que permite un aumento de la diseminación y transmisión viral [17]. Muchos argumentan que el TA es un reservorio para una extensa propagación viral y una mayor diseminación, sobre todo debido al estado proinflamatorio e inmunodeprimido que se describe a continuación. Esto también es argumentado por Ryan y Caplice [99], ya que las células residentes en el TA son un objetivo comprobado para múltiples virus: influenza A, SARS-CoV, adenovirus y macrófagos objetivo del HIV; Linfocitos diana del SARS-CoV y del HIV; y adipocitos diana de H1N1, influenza A y adenovirus.
Al igual que otros coronavirus, el SARS-CoV-2 activa el inflamasoma 3 (NLRP3) que contiene el dominio NACHT, LRR y pirina, aumentando la producción de citocinas proinflamatorias [100,101,102,103]. Según lo revisado por Freeman y Swartz [104], NLRP3 tiene un papel conocido en ARDS hiperinflamatorio, el MERS-COV grave y la infección por SARS-CoV, y los estudios iniciales han indicado su implicación en el COVID-19 grave [105]. La obesidad, al igual que el envejecimiento, desencadena la activación del inflamasoma NLRP3 [106,107]. Por tanto, la hiperactividad de la NLRP3 inducida por la edad (inflamatoria) y la inducida por la obesidad podría predisponer a los pacientes a la tormenta de citocinas que se observa a menudo en el COVID-19 grave [106]. Por tanto, varios inhibidores de la NLRP3 se encuentran en ensayos preclínicos o clínicos para el tratamiento de COVID-19, como lo resumieron van den Berg y te Velde [108]. En general, se ha demostrado que los individuos obesos son más susceptibles a otras infecciones, con tormentas de citocinas más intensas debido a la inflamación sistémica inducida por la obesidad [109].
En las personas obesas, la respuesta de los anticuerpos a la vacuna antigripal está alterada [110]. Los adultos obesos vacunados tienen el doble de riesgo de contraer influenza en comparación con los adultos vacunados no obesos [110]. En consecuencia, el medio principal para prevenir la influenza, y especulativamente el COVID-19, podría debilitarse debido a la obesidad. Esto es problemático dado el aumento significativo de la obesidad en todo el mundo en las últimas décadas. Un estudio inicial mostró que la obesidad central, así como la hipertensión y la dislipidemia, se asocian con títulos de anticuerpos más bajos 1-4 semanas después de la segunda inoculación con una vacuna de ARNm de COVID-19 [111]. Otro estudio mostró que un IMC más alto se asocia con títulos de anticuerpos más bajos en los trabajadores sanitarios italianos [112]. Además, en las personas obesas, la duración de la diseminación del virus de la influenza A se prolonga [113], lo que podría aumentar la transmisión viral. Esto también se ha visto con el SARS-CoV-2; los pacientes obesos requieren estancias hospitalarias más prolongadas y una mayor duración (6 días) para obtener un frotis nasal o un orofaríngeo negativo [114].
Tanto la obesidad como la inactividad física pueden provocar anomalías endócrinas. Debido al aumento de la actividad del eje hipotalámico-pituitario-adrenal (HPA), los individuos con obesidad abdominal tienen una mayor secreción de cortisol [115]. Además de la corteza suprarrenal, la producción de cortisol por los adipocitos también está elevada en condiciones hiperinsulémicas [116]. El exceso de cortisol, a su vez, se asocia con un aumento de la adiposidad abdominal y varias secuelas cardiovasculares, que incluyen, entre otras, hipertonía, hiperglucemia, resistencia a la insulina, dislipidemia y MetS [117]. En consecuencia, los niveles elevados de cortisol inducidos por la obesidad y la inactividad física aumentan el riesgo de varias comorbilidades y factores de riesgo de COVID-19 grave [4,24,118]. Los músculos esqueléticos contraídos liberan mioquinas que ejercen efectos endócrinos sobre la adiposidad abdominal, mientras que otras mioquinas tienen efectos parácrinos locales en las vías de señalización implicadas en la oxidación de grasas [119]. Por lo tanto, la inactividad física conduce a una disminución metabólica, mientras que la AF regular permite el mantenimiento del peso y/o la reducción de la obesidad abdominal y la inducción de un entorno antiinflamatorio.
Como la expresión de ACE2 es un factor clave para la entrada del SARS-CoV-2 en las células huésped, es razonable suponer que los niveles bajos de ACE2 protegerían contra la infección, la amplificación viral y, en última instancia, un resultado letal de COVID-19. Sin embargo, según un modelo reciente de dinámica viral y expresión génica de ACE2 en ratas y seres humanos, existe una fuerte correlación negativa entre ACE2 y la letalidad [120]. Esta hipótesis concuerda con la investigación que demuestra que el receptor ACE2 se expresa en niveles más bajos en hombres que en mujeres y disminuye con la edad, la comorbilidad relacionada con la inflamación y con niveles reducidos de testosterona y estrógeno [121].
Con respecto a las hormonas sexuales, la AF y la inmunidad, los hombres con niveles de testosterona por debajo de lo normal tienen concentraciones más altas de citocinas proinflamatorias (IL-1β, IL-2 y TNFα) [122,123], que pueden contrarrestarse con suplementos de testosterona [124]. En este sentido, se ha demostrado que el ejercicio atenúa la disminución de la testosterona relacionada con la edad en los hombres sedentarios [125,126]. Aunque el ejercicio podría disminuir el descenso de testosterona relacionada con la edad, parece no tener un efecto significativo sobre los niveles basales en hombres de mediana edad [127]. En general, se piensa que la testosterona es algo inmunosupresora, mientras que el estrógeno es un potenciador natural de la inmunidad [128,129]. En las mujeres, el estrógeno aumenta la inmunidad humoral y se ha demostrado que es antivírico y protege contra varios virus, incluidos la influenza A, el HIV, el Ébola, la hepatitis C y el citomegalovirus humano [130]. Esta protección se debe a varios mecanismos, incluido el aumento de las células T específicas de virus (VST) en los pulmones [131]. En mujeres posmenopáusicas, el ejercicio puede aumentar los niveles de estrógeno, incluso en mujeres sedentarias. Un pequeño número de estudios ha examinado el papel de la testosterona en el COVID-19. En contraste con la reputación inmunosupresora de la testosterona, algunos estudios han encontrado que los niveles bajos de testosterona antes de la infección, o los niveles bajos de testosterona durante la infección, están relacionados con peores resultados de COVID-19 [132,133]. Sin embargo, estos fueron estudios preliminares y no ensayos controlados aleatorios rigurosos. En particular, los niveles de testosterona disminuyen durante la infección [134], lo que hace que la asociación de niveles más bajos y peores resultados sea una profecía autocumplida. Además, los niveles más bajos de testosterona a menudo se acompañan de afecciones comórbidas y un bajo estado metabólico, que incluyen obesidad, diabetes y MetS [135]. Por lo tanto, la testosterona posiblemente desempeña un papel en el impulso de ACE-2 y de TMPRSS2 para aumentar la entrada viral [135], pero aún no hay evidencia sólida que muestre que la testosterona explique por qué los hombres tienen una tasa de mortalidad desproporcionadamente alta de COVID-19.
El sistema inmunológico en relación con el COVID-19 y los efectos del ejercicio
La respuesta inmunológica del huésped después de la infección por SARS-CoV-2 es crucial para la progresión del COVID-19. Una respuesta inmunitaria apropiada y bien regulada con una interacción equilibrada entre las respuestas inmunes innata y adaptativa es clave para controlar la gravedad del COVID-19 [136].
El sistema inmunológico está influenciado por la AF y el estado físico [78,91,119,137,138]. El deterioro de la competencia inmunitaria asociado con la edad, la inmunosenescencia, es una transformación profunda y multifacética que ocurre gradualmente con la edad en los seres humanos [139,140,141,142,143,144,145,146,147] y está muy influenciada por la AF regular durante la vida. Dado que la gran mayoría de las muertes por COVID-19 ocurren en ancianos y los datos patológicos apuntan a que tanto la inmunosenescencia como la inflamación/inflamación sistémica son los principales factores de riesgo de mortalidad [49,91,106,137,146,148,149,150,151], los efectos de la AF regular son de gran interés.
Los TLR son componentes vitales del sistema inmunológico innato e importantes para la detección de patógenos y respuestas antivirales [152]. Con la edad avanzada, la función de los TLR se desregula, lo que da como resultado una señalización de los TLR y una producción de citocinas inapropiadas [143,153]. Se ha sugerido que la expresión regulada a la baja de los TLR en monocitos y macrófagos, con producción reducida de citocinas proinflamatorias, es un efecto antiinflamatorio del ejercicio [91,150,154,155]. Por el contrario, una aptitud metabólica baja, como la obesidad con resistencia a la insulina o MetS, puede aumentar la expresión de TLR4 [156]. Las alteraciones inducidas por el ejercicio en la señalización de los TLR, como la reducción de la señalización de TLR4 [157], podrían atenuar los efectos perjudiciales de la inflamación sistémica de bajo grado, mejorando la salud general y la capacidad de recuperación. Posteriormente, esto puede atenuar la hiperactivación de los macrófagos derivados de los monocitos que contribuyen a la tormenta de citocinas y a la hiperinflamación en el COVID-19 (Figura 3).
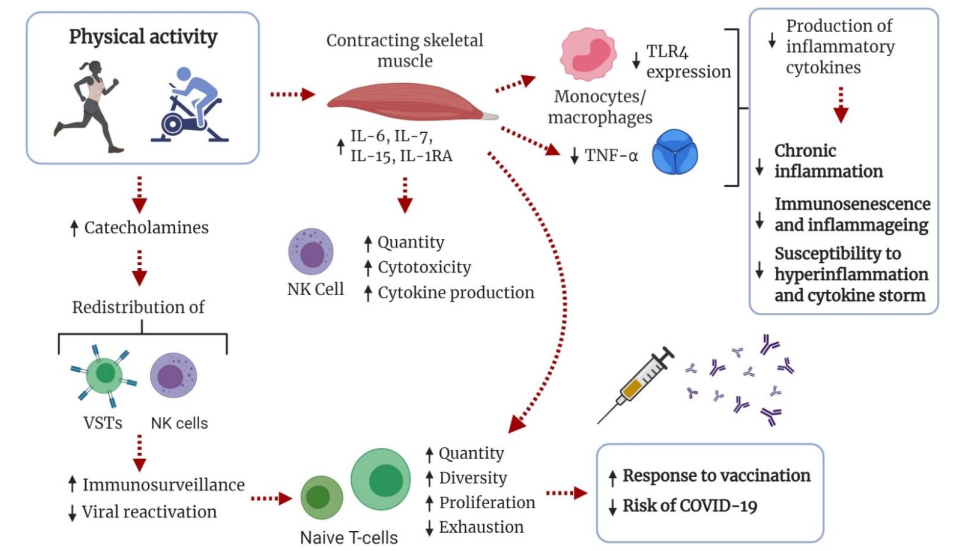
Figura 3. Esquema de adaptaciones inmunológicas influenciadas por la actividad física (AF) que podrían incrementar la tolerancia al COVID-19. En respuesta al aumento de los niveles de catecolaminas, las células T específicas de virus (VST) y las células asesinas naturales (NK) se redistribuyen en los tejidos. La inmunovigilancia aumenta y la reactivación viral disminuye, lo que evita la senescencia de las células T y aumenta el número y la diversidad de las células T vírgenes. Se sabe que esto aumenta la respuesta a la vacunación contra la influenza y disminuye el riesgo de infección. Durante el ejercicio, el músculo esquelético libera mioquinas con efectos antiinflamatorios. Es importante destacar que se inhibe la producción del factor de necrosis tumoral alfa (TNF-α). La AF regular puede conducir a una expresión regulada a la baja de los receptores tipo Toll (TLR) en monocitos y macrófagos, lo que conduce a una producción reducida de citocinas proinflamatorias.
La proteína SARS-CoV-2 S interactúa con los TLR, especialmente TLR4 [158,159], lo que da lugar a respuestas inflamatorias. Por lo tanto, en pacientes obesos con expresión aumentada de TLR4, el TA, que ya está inflamado, crea un entorno favorable para la interacción SARS-CoV-2-TLR4, exacerbando la producción de citocinas proinflamatorias y aumentando la gravedad del COVID-19 [160]. El tratamiento con antagonistas de TLR4 se ha utilizado con éxito durante otras infecciones virales. Como se resume en otra parte [161], los antagonistas de TLR4 reducen constantemente la producción de quimiocinas y citocinas, lo que mitiga los síntomas de la enfermedad. El exceso de activación de TLR4 juega un papel en la patogenia de las enfermedades virales. Varios autores han sugerido ensayos clínicos para probar los antagonistas de TLR4 en el tratamiento del COVID-19 grave [162]. Sin embargo, aunque aún no hay datos de ensayos clínicos que respalden su uso, es esencial controlar las condiciones relacionadas con un resultado adverso en el COVID-19, como ser físicamente activo, no obeso y metabólicamente saludable.
El ejercicio y la actividad física conducen a una redistribución inmunoestimuladora de células NK y VST mediada por las catecolaminas [78,146,149,163]. Esto aumenta la vigilancia inmunitaria y la apoptosis de las células T senescentes y reduce la reactivación del citomegalovirus, el virus de Epstein-Barr y el virus de la varicela zóster. En consecuencia, se evita la acumulación de células T senescentes, mientras que se mantiene el recuento y la diversidad de células T vírgenes. Los datos en animales y en humanos apoyan la idea de que la AF regular de intensidad moderada mejora la eficacia de la defensa viral y reduce la morbilidad y la mortalidad en infecciones virales y enfermedades respiratorias [21,78]. Es importante destacar que se ha demostrado que el aumento de la AF mejora la respuesta inmunológica a la vacunación contra la influenza [164,165]. Tanto la exposición aguda como crónica al ejercicio parecen mejorar la respuesta inmunológica a la vacunación [166], pero el régimen de ejercicio óptimo, las relaciones dosis-respuesta y la importancia clínica aún no se han aclarado por completo. El aumento de la AF también se asocia con un mejor control de las infecciones virales latentes [167] y un menor riesgo de neumonía [18] y mortalidad por enfermedades infecciosas [19]. Los datos emergentes muestran que la gravedad de la tormenta de citocinas del COVID-19 y sus complicaciones se asocian con linfopenia, con recuentos más bajos y VST agotados, linfocitos T CD4+ y CD8+ y linfocitos NK [168,169,170]. También se ha demostrado que el ejercicio de alta intensidad mejora el perfil efector de las células T CD8+ en ratones [171] y en humanos obesos [172]. En consecuencia, los efectos antiinmunosenescentes de la AF regular podrían ser una medida importante para mantener la resistencia contra el COVID-19 y otras infecciones virales con el avance de la edad (Figura 3).
En el contexto de los leucocitos, se ha demostrado que los adultos mayores físicamente activos tienen una mayor actividad de la telomerasa y una mayor longitud de los telómeros leucocitarios en comparación con sus pares físicamente inactivos [173,174]. Este contexto se asocia con una mejor supervivencia de la sepsis y una menor gravedad del ARDS [175]. Recientemente, se descubrió que la longitud más corta de los telómeros de los leucocitos se asociaba con un mayor riesgo de resultados adversos del COVID-19, independientemente de otros factores de riesgo importantes, incluida la edad cronológica [176,177]. Como revisó Garatachea [178], la actividad física habitual, especialmente el ejercicio aeróbico, así como una buena aptitud cardiorrespiratoria, se asocian con una mayor longitud de los telómeros leucocitarios.
La AF tiene efectos antiinflamatorios importantes para atenuar no sólo la inflamación, sino también la inflamación sistémica general, como se observa en las poblaciones físicamente inactivas y obesas. Las citocinas liberadas por la contracción de los músculos esqueléticos (“mioquinas”) tienen efectos antiinflamatorios, inmunorreguladores y promotores de la salud locales y pleiotrópicos [179]. Con series de ejercicio de carga suficiente, la IL-6 se libera exponencialmente con la duración del ejercicio [180]. Con niveles aumentados de IL-6, hay un aumento de múltiples veces en los niveles circulantes de citocinas antiinflamatorias IL-10 e IL-1ra). Es importante destacar que la liberación de la IL-6 inducida por el ejercicio inhibe la producción de la citocina proinflamatoria TNF-α [91,181], un regulador maestro de la producción de citocinas inflamatorias [182] muy involucrado en la tormenta de citocinas del COVID-19 (Figura 3). Aunque la IL-6 se conoce tradicionalmente como una citocina proinflamatoria vital en el inicio de la respuesta inmunológica aguda, la investigación ahora respalda la IL-6 como una citocina multifacética capaz de provocar efectos tanto proinflamatorios como antiinflamatorios según el contexto [183]. Además, la IL-7 [184] y la IL-15 [185], que son factores proliferativos de linfocitos [186], se liberan durante el ejercicio, lo que favorece la función y la proliferación de células inmunitarias, principalmente de células T vírgenes. La IL-15 también es esencial para mantener la memoria de las células T CD8+ [187] y la activación, producción y citotoxicidad de las células NK [188], lo que la convierte en un factor importante en la estimulación de las respuestas inmunitarias a las infecciones. Estos cambios transitorios inducidos por el ejercicio conducen a una mejor protección contra la inflamación sistémica sostenida de bajo grado y las citocinas proinflamatorias [180,181]. También es importante mencionar que estos efectos antiinflamatorios se observan tanto en personas jóvenes como en ancianos, y son aún más evidentes en condiciones patológicas, como la obesidad, ECV y diabetes tipo II [47,180,189].
En resumen, la conexión entre la inactividad física, la obesidad y el MetS con una defensa viral disminuida es evidente, creando un caso inmunológico para aumentar la AF y reducir la obesidad y el MetS en la sociedad [21]. En comparación con un individuo no apto, obeso y físicamente inactivo, un individuo en forma, delgado y físicamente activo ha mejorado la función inmunológica y las defensas virales. En los ancianos, los efectos antiinmunosenescentes y antiinflamatorios de la AF son de particular interés para aumentar la resiliencia contra el COVID-19 y su tormenta de citocinas.
El sistema cardiovascular en relación con el COVID-19 y los efectos del ejercicio
Además del estado hiperinflamatorio y la coagulopatía, las características fisiopatológicas del sistema cardiovascular observadas en los pacientes con COVID-19 incluyen efectos perjudiciales sobre el corazón y el compartimento vascular [190].
Con respecto a la salud cardíaca, el entrenamiento físico y el entrenamiento de la resistencia, en particular, generan efectos anatómicos, funcionales [191] y metabólicos [192] sobre el sistema cardiovascular que promueven la salud general y la resistencia física.
Es importante destacar que la AF mitiga varios de los factores de riesgo cardiovascular y metabólico asociados con la gravedad del COVID-19, entre los que destaca el MetS [193]. En resumen, los efectos terapéuticos de la AF mejoran la coagulación y la homeostasis fibrinolítica, la función endotelial y la regulación de la presión arterial, aumentan el volumen sanguíneo y la fracción de eyección cardíaca y reducen la demanda de oxígeno del miocardio y la agregación plaquetaria [28]. Esto podría disminuir algunas de las principales complicaciones cardiovasculares causadas por el COVID-19, como miocarditis, shock cardiogénico y tromboembolismo. Debido a la adaptación celular al estrés temporal inducido por el ejercicio, el entrenamiento se ha propuesto como una estrategia de preacondicionamiento para la cardioprotección contra el daño miocárdico por isquemia/reperfusión [194,195].
La inmunopatología vascular, la coagulopatía y la trombosis son características bien reconocidas de las anomalías pulmonares en el COVID-19 que se correlacionan con el riesgo de mortalidad. Un desequilibrio entre los activadores e inhibidores de la coagulación y el sistema fibrinolítico se observa comúnmente en la obesidad, y un mayor nivel de obesidad se correlaciona positivamente con la gravedad y la mortalidad del COVID-19 [196]. Por lo tanto, el equilibrio hemostático alterado en personas con sobrepeso, con aumento de la coagulación y alteración de la fibrinólisis, antes de la infección por el SARS-CoV-2 puede aumentar el riesgo de COVID-19 grave. Por lo tanto, el ejercicio regular es un método natural para prevenir o reducir la inflamación y preservar o restaurar la hemostasia. Los estudios indican un efecto positivo del ejercicio sobre la regulación tanto de la coagulación como de la fibrinólisis [197]. Esto se ve reforzado por el hecho de que la AF regular reduce la mortalidad por todas las causas y las cardiovasculares [198] independientemente de la intensidad de la AF [199]. Las respuestas adaptativas adicionales al ejercicio están indicadas por la disminución de la agregación de glóbulos rojos en hombres obesos [200] y la mejora de la presión arterial sistólica en hombres y mujeres con hipertensión pulmonar.
Debido a la adaptación vascular a la AF y al ejercicio, el sistema renina-angiotensina (RAS), que incluye a ACE2, es de particular interés en el resultado de la infección por el SARS-CoV-2. La ACE2 escinde Ang II en Ang (1-7) [201]. El RAS es un sistema endócrino complejo que desempeña una función importante en el control de la homeostasis metabólica y cardiovascular. En individuos con baja aptitud física y/o enfermedad cardiometabólica, existe un desequilibrio entre los ejes RAS, que han sido descritos en profundidad por otros [202]. En resumen, el ejercicio cambia el equilibrio del RAS hacia el eje protector ACE2/Ang (1-7)/proto-oncogén, receptor acoplado a proteína G (MAS) en relación con el eje receptor ACE/Ang II/angiotensión II tipo I (AT1R). Este último eje suele estar hiperactivo en personas con diabetes, obesidad, hipertensión y/o inflamación sistémica de bajo grado sostenida [203]. De manera similar, el aumento de la Ang II se asocia con síndromes de vasculopatía y coagulopatía en pacientes con COVID-19 [204]. Por el contrario, la activación del eje ACE2/Ang (1-7)/MAS es antiinflamatoria y vasodilatadora, y tiene varios efectos protectores sobre los sistemas cardiovascular y renal, como las funciones antitrombolíticas.
La manipulación del RAS, equilibrándolo hacia el brazo protector, se considera una terapia potencial para el COVID-19 [205]. En consecuencia, refuerza la importancia de la actividad física y el ejercicio para mejorar el estado físico y el resultado clínico del COVID-19. Esto también ha sido argumentado por otros [206,207], sugiriendo que niveles más altos de fitness cardiorrespiratorio pueden conferir protección inmune innata contra el COVID-19 al atenuar la tormenta de citocinas al modular la actividad del RAS y de la ACE2. Según lo revisado por Magalhaes, y cols. [208], el brazo protector del RAS juega un papel central en el COVID-19. Los inhibidores de la ACE antihipertensivos se han utilizado con éxito en el tratamiento del COVID-19 grave [205,209], y se están realizando varios ensayos clínicos que sugieren que la Ang (1-7) se puede utilizar para tratar el COVID-19 (consulte https://clinicaltrials.gov/ct2/show/NCT04332666, consultado el 5 de junio de 2021, https://www.clinicaltrials.gov/ct2/show/NCT04401423, consultado el 5 de junio de 2021 y https://clinicaltrials.gov/ct2/show/NCT04375124, consultado el 5 de junio de 2021). En particular, los inhibidores de la ACE actúan modulando el RAS de manera similar a la respuesta a la actividad física y al ejercicio.
En conjunto, el ejercicio tiene un efecto positivo sobre el equilibrio hemostático y la presión arterial, lo que puede prevenir la alta resistencia a la fricción y el estrés del roce en la pared vascular, la coagulopatía y la trombosis, lo que reduce el riesgo de COVID-19 grave. Además, un eje RAS bien regulado y un eje ACE2/Ang (1-7)/MAS activado inducido por la actividad física y el ejercicio podría ser un factor significativo en la disminución de la gravedad del COVID-19. Estas adaptaciones se resumen en la Figura 4.
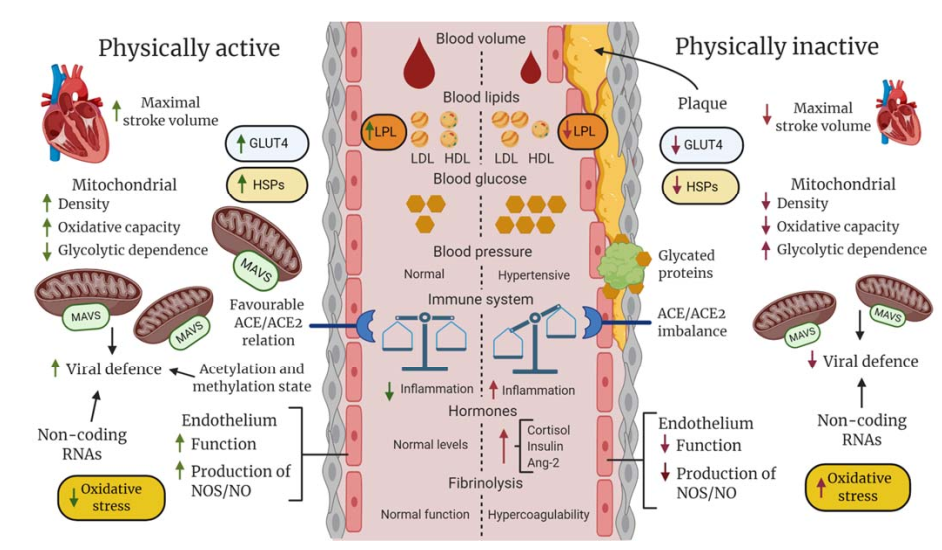
Figura 4. Descripción hipotética de las diferencias entre individuos aptos (físicamente activos y no obesos) y no aptos (físicamente inactivos y obesos) con respecto a los componentes vasculares, sanguíneos y celulares generales que podrían determinar colectivamente el resultado clínico después de la infección por SARS-CoV-2. A nivel sistémico, la actividad física (AF) regular, como el entrenamiento con ejercicios, promueve la homeostasis hormonal y mejora la contracción máxima y el volumen sanguíneo, mejorando la perfusión sanguínea y la saturación de oxígeno de los tejidos. En un estado inadecuado con hipertensión, un desequilibrio entre los sistemas inmunológico innato y adaptativo, el aumento de la agregación plaquetaria, la dislipidemia y los niveles de glucosa anormalmente altos aumentan el riesgo de depósito de lípidos, glicación de proteínas y formación de coágulos, respuestas inflamatorias en la pared vascular y aterosclerosis, que disminuyen la perfusión sanguínea y la saturación de oxígeno, lo que podría provocar un infarto en el peor de los casos. A nivel celular, el estrés metabólico y mecánico temporal inducido durante la AF da como resultado una mejor defensa contra el estrés (por ej., proteínas de choque térmico [HSP], antioxidantes), una mejor capacidad mitocondrial en la producción de trifosfato de adenosina aeróbico y una respuesta antiviral (proteína de señalización antiviral mitocondrial [MAVS]), mejor captación y utilización de glucosa y ácidos grasos a través de una mayor expresión del transportador de glucosa tipo 4 (GLUT-4) y de la lipoproteína lipasa (LPL), y funciones endoteliales mejoradas, incluido el equilibrio entre ACE/ACE2, producción de óxido nítrico (NO) y liberación de endotelina. La AF regular también puede producir un equilibrio favorable entre factores epigenéticos que facilitan la expresión de genes que codifican proteínas que mejoran las funciones celulares generales y activan proteínas y genes no codificantes que inhiben la amplificación del SARS-CoV-2.
El sistema respiratorio en relación con el COVID-19 y los efectos del ejercicio
Desde una perspectiva pulmonar, la AF puede aumentar la fuerza y la resistencia de los músculos respiratorios [210]. Aunque no mejora directamente la función pulmonar, puede hacerlas más eficientes y reducir el trabajo respiratorio. Con respecto al daño del tejido pulmonar y al ARDS, la AF puede aumentar la capacidad de difusión de los alvéolos pulmonares. El entrenamiento de resistencia es especialmente eficaz de esta manera [211]. Los adultos mayores con una buena forma física tienen una mayor capacidad de difusión en comparación con sus pares menos aptos y de la misma edad [212]. En ratones, se ha demostrado que el ejercicio aeróbico atenúa la lesión pulmonar aguda al modular el equilibrio de las especies inflamatorias y reactivas del oxígeno (ROS) [213,214,215].
La obesidad también juega un papel en la disfunción respiratoria. Se asocia con un volumen pulmonar bajo y una fuerza de los músculos respiratorios bajos [216]. La obesidad altera los mecanismos respiratorios al aumentar la resistencia de las vías respiratorias y el intercambio de gases [216]. Además, la apnea obstructiva del sueño (AOS) es más común en los adultos obesos que en los de peso normal. Sin embargo, la obesidad también puede conllevar el síndrome de hipoventilación por obesidad (SHO), y algunas personas padecen ambas afecciones. En el SHO, los individuos obesos experimentan hipoxia e hipercapnia inducidas por hipoventilación independientemente de la hora del día, mientras que la AOS causa hipoventilación sólo durante el sueño [217]. La AOS o el OHS preexistentes limitan gravemente la función respiratoria y, una vez afectados por el COVID-19, hay una capacidad de reserva mínima. En consecuencia, se requiere más ventilación mecánica en pacientes obesos hospitalizados con COVID-19 [218]. La adiposidad abdominal también puede obstruir la posición en decúbito prono necesaria para evitar la intubación en pacientes con COVID-19 críticamente enfermos. Otros han informado de que la adiposidad abdominal y la alta deposición de grasa intramuscular son factores de riesgo independientes de la enfermedad de cuidados intensivos, ventilación mecánica y muerte [219,220]. Por lo tanto, el ejercicio regular y no ser obeso podrían mejorar la resiliencia respiratoria en el COVID-19 debido a la mayor tolerancia al estrés pulmonar.
Los riñones y el sistema gastrointestinal en relación con el COVID-19 y los efectos del ejercicio
La función renal reducida es un factor de riesgo de mortalidad por el COVID-19 [4]. La lesión renal aguda (IRA) y la enfermedad renal crónica (ERC) se evaluaron en un metaanálisis reciente, y ambas demostraron una fuerte asociación con la gravedad de la enfermedad y la mortalidad en el COVID-19 en comparación con pacientes sin ERC o IRA [221]. La ERC y la IRA están estrechamente relacionadas con la diabetes [222], y la glucemia en ayunas es un predictor independiente de la mortalidad para el COVID-19 en pacientes sin un diagnóstico previo de diabetes [223]. Además, la ACE2 se expresa en gran medida en los riñones [224], lo que ofrece una alta posibilidad de infiltración del SARS-CoV-2 y posterior regulación a la baja de la ACE2 por el SARS-CoV-2. Por tanto, una expresión reducida de ACE2 en los riñones, que reduce la relación ACE/ACE2, se ha sugerido como una posible causa de vasoconstricción local e inflamación, necrosis y daño renal en pacientes con COVID-19 [225,226].
La AF previene muchos de los factores de riesgo asociados con el desarrollo de ERC, como la hipertensión diabética [227]. Algunos de los efectos atribuidos a esto incluyen la preservación o mejora de la sensibilidad a la insulina, la tolerancia a la glucosa, la función endotelial vascular, el equilibrio hormonal y los perfiles de adipocitocinas alterados, que se pueden lograr mediante la AF.
Aunque el efecto directo de la AF y el ejercicio sobre los riñones y la función renal en humanos sigue sin estar claro, la AF previene y reduce muchos de los factores de riesgo antes mencionados [227]. En este sentido, el gen que codifica la proteína Klotho es un factor atractivo sugerido como una proteína anti-envejecimiento en el estudio distintivo de Kuro-o et al. [228]. Klotho es crucial para el desempeño del factor de crecimiento de fibroblastos (FGF) y participa en una multitud de funciones reguladoras, el metabolismo de los ácidos grasos y la glucosa, y acciones antiinflamatorias y antioxidantes [229]. En este contexto, Klotho apoya y preserva las funciones de los vasos sanguíneos y los riñones [230]. Klotho se expresa abundantemente en los riñones y el cerebro y modestamente en el músculo esquelético [228]. La forma circulante secretada de Klotho (S-Klotho) disminuye con la edad, la ERC y la ECV [231]. Curiosamente, una cohorte prospectiva de 10 a 13 años de varones de mediana edad sin ninguna enfermedad subyacente demostró que un S-Klotho bajo al inicio predice un mayor riesgo de desarrollar glucosa plasmática en ayunas (FPG) alta [232]. La FPG elevada es un estado prediabético que también aumenta el riesgo de desarrollar hipertensión y enfermedad renal [233] y de muerte por el COVID-19 [223].
Un estudio de cohorte de atletas másters de velocidad mostró que tenían mejor función renal, menor grado de inflamación y niveles más altos de Klotho que sus pares sanos pero desentrenados de la misma edad [234]. Esto está de acuerdo con otros estudios que encontraron niveles más altos de S-Klotho en los atletas en comparación con los controles sanos [235] y un nivel más alto con el entrenamiento de ejercicio de intensidad moderada [236]. Curiosamente, se ha demostrado una relación positiva entre el nivel de S-Klotho y la capacidad de oxidación de grasas en reposo, así como durante el ejercicio [237]. En ratas, el entrenamiento de resistencia da como resultado un aumento de los niveles de Klotho en el cerebro y en los riñones, acompañado de un aumento de la esperanza de vida y la atenuación de la producción excesiva de ROS [238]. En ratones, el nivel de proteína de Klotho se reduce de forma aguda en el músculo esquelético después de una serie de ejercicio exhaustivo, acompañado de un aumento marcado en 24 h en comparación con el valor inicial [239]. La disminución aguda de Klotho en el músculo esquelético puede contribuir al aumento de S-Klotho observado en estudios en humanos, que indican un papel de S-Klotho como una mioquina que preserva la salud en la prevención del COVID-19 grave. Además, un marcado aumento agudo de la S-Klotho por el ejercicio observado en corredores de resistencia, pero no en velocistas [240], sugiere que el aumento de S-Klotho podría depender del nivel y la composición del fitness aeróbico. Una liberación de Klotho en el torrente sanguíneo desde el músculo esquelético, a pesar de una expresión por masa relativamente baja, podría potencialmente explicar una cantidad significativa de S-Klotho, particularmente como un efecto del entrenamiento físico, porque la masa muscular comprende aproximadamente el 30-40% de la masa corporal total. En consecuencia, el Klotho derivado del músculo puede representar una mioquina novedosa que puede ayudar a explicar algunos de los efectos sobre la salud y antienvejecimiento de la AF a través de efectos antiinflamatorios, antioxidantes y la preservación de las funciones de los vasos, que en última instancia protegen contra el COVID-19 grave. El Klotho es un candidato prometedor para predecir el estado de salud y como biomarcador para evaluar el progreso de la rehabilitación posterior al COVID-19.
En conjunto, se acepta generalmente que la AF previene el desarrollo de la hipertensión [28], la resistencia a la insulina [46,241], la disfunción endotelial [28] y la inflamación sistémica [91,150,151]. Aún no se han descubierto los factores reguladores que subyacen al aumento de los niveles de Klotho y la mejora de la relación ACE2/ACE en los riñones en relación con los factores del estilo de vida, como el ejercicio.
Los síntomas gastrointestinales (GI), como la diarrea, la náuseas y el dolor abdominal, se observan con frecuencia en pacientes con COVID-19 [242]. La alta expresión de ACE en el tracto GI [243] puede explicar en parte la vulnerabilidad del tracto GI al SARS-CoV-2. La investigación sobre los efectos de la AF y el ejercicio en el tracto gastrointestinal es limitada. Sin embargo, la AF regular parece mejorar la composición de la microbiota y la homeostasis del sistema inmunológico [244]. La disbiosis intestinal y un intestino permeable pueden contribuir a la inflamación sistémica que generalmente se observa en el MetS. Las observaciones clínicas demuestran que muchos pacientes con COVID-19 tienen síntomas gastrointestinales graves y el ARN del SARS-CoV-2 detectable en las heces, junto con disbiosis del microbioma e indicadores inflamatorios [245]. Un estudio clínico que incluyó a pacientes con diabetes tipo 2 mostró que 6 meses de ejercicio, combinado con restricción calórica, mejoraron la composición de la microbiota intestinal y la función como barrera intestinal y redujeron el crecimiento excesivo de micelios intestinales y la inflamación sistémica [246]. Además, un creciente cuerpo de evidencia indica que la obesidad, el MetS, la disbiosis intestinal y el asma están estrechamente asociados. Curiosamente, la mejora del control del asma, la función pulmonar y la hiperreactividad de las vías respiratorias se observan a menudo después de la cirugía bariátrica, lo que también va acompañado de una mejora del ecosistema microbiano intestinal y del control glucémico [247]. Por lo tanto, la evidencia indica un estrecho vínculo inmunológico entre el tracto gastrointestinal y las vías respiratorias. En este punto, se ha propuesto un eje intestino-pulmón que afecta el resultado de las infecciones microbianas y la progresión de varias enfermedades [248].
Queda por dilucidar si el ejercicio mejora la disbiosis de la mucosa en los pulmones y los intestinos, previniendo así el desarrollo del COVID-19 grave. Sin embargo, es aconsejable mantener la función como barrera intestinal y controlar la inflamación sistémica siendo metabólicamente saludable.
Músculo esquelético en relación con el COVID-19 y los efectos del ejercicio
El uso regular de los músculos esqueléticos a través de la AF y el entrenamiento físico tiene efectos fundamentales en varios niveles fisiológicos, incluido un aumento agudo en la utilización de ácidos grasos y la glucosa, seguido de adaptaciones musculares que mejoran la absorción de estos componentes energéticos durante el ejercicio [249]. Estas adaptaciones al entrenamiento son importantes para manejar el desafío del aumento agudo de glucosa y lípidos en sangre después de una comida, evitando el estrés vascular sostenido por estos factores y, en última instancia, evitando la ECV (Figura 4). El papel del ejercicio agudo y la adaptación al entrenamiento en relación con el metabolismo de la glucosa y de las grasas y la prevención de la ECV y la diabetes tipo 2 se revisan en profundidad en otro lugar [250,251,252].
Las adaptaciones fisiológicas, celulares y moleculares contrastantes se desarrollan a través de un estilo de vida con o sin AF regular. La AF regular, en particular el entrenamiento con ejercicios recurrentes, da como resultado una capacidad mejorada dentro de los sistemas de energía para satisfacer la mayor demanda de trifosfato de adenosina (ATP) durante la AF [253]. El entrenamiento físico también da como resultado adaptaciones relacionadas con otros desafíos, como el estrés mecánico, térmico y hormonal, aumento de los niveles de ROS [254], disminución del pH y oxígeno sanguíneo y muscular, la acumulación de metabolitos y cambios en la homeostasis iónica.
Tanto los entrenamientos de resistencia como los de fuerza [255] van acompañados de un aumento agudo de la presión sanguínea (PS). Durante el levantamiento de pesas puede producirse una PS sistólica y diastólica extremadamente alta, ejemplificada por un valor medio de grupo de 320/250 mmHg (máximo de 480/350 mmHg) durante un press de piernas con gran carga [256]. Teniendo esto en cuenta, se ha demostrado que el ejercicio regular reduce la PS en reposo en sujetos hipertensos [257,258]. Además, la AF y el entrenamiento físico mejoran la hemodinámica y previenen el daño vascular. La exposición inducida por el ejercicio a la presión hidrostática y el stress de roce conduce a adaptaciones que pueden prevenir las respuestas proinflamatorias y la vasculopatía después de la infección por el SARS-CoV-2. Estos incluyen una mayor expresión de la óxido nítrico sintasa endotelial (eNOS), que promueve la vasodilatación a través del NO, aumento de la capilaridad, aumento del tono autónomo y producción del vasoconstrictor endotelina-1 [259]. Todos estos pueden prevenir las respuestas proinflamatorias y la vasculopatía después de la infección por el SARS-CoV-2. En ratas obesas, se ha demostrado que el entrenamiento de resistencia modula las vías cardíacas RAS, mejorando la vía ACE2 sobre la vía ACE [260]. Las ratas hipertensas sometidas a entrenamiento de la resistencia tienen presión arterial reducida, niveles disminuidos del receptor AT1R de Ang II y niveles aumentados del MAS del receptor Ang- (1-7) en el tejido cerebral, con una disminución paralela en la producción de ROS [261].
Una posible respuesta adaptativa en humanos al entrenamiento físico, como la reducción de la señalización celular en la vía Ang II y el aumento de la actividad de la vía ACE2-Ang- (1-7) -MAS, también puede mejorar el metabolismo energético celular, además de aumentar las defensas contra el ROS. Además de los efectos negativos sobre el sistema vascular del RAS hiperactivado, se ha demostrado que la Ang II suprime la fosforilación de la proteína quinasa activada por AMP (AMPK) en el músculo esquelético de ratas [262]. Este es un hallazgo importante, ya que la AMPK es un regulador central de la adaptación al entrenamiento físico, como la mejora de la sensibilidad a la insulina y la captación de glucosa [263]. Como la hiperglucemia es un factor de riesgo de ECV y del COVID-19 grave [223], las funciones metabólicas del músculo esquelético son de gran importancia para la salud. Mantener la masa muscular y la función con la AF es crucial para mantener la sensibilidad a la insulina y la eliminación de la glucosa y proteger contra las comorbilidades [264]. El músculo esquelético disfuncional, como se observa con la inactividad crónica, el envejecimiento y el daño tisular, es una causa desencadenante en afecciones como la diabetes tipo II, las enfermedades cardiovasculares y el cáncer.
La epigenética en relación con el COVID-19 y los efectos del ejercicio
Los factores epigenéticos están modulados por el ejercicio [265] y pueden desempeñar un papel protector en las respuestas fisiológicas y celulares a la infección viral. La epigenética incluye factores que regulan la expresión génica mediante metilación y acetilación de histonas, metilación de ADN/ARN, remodelación de cromatina y ARN no codificantes [266]. Recientemente, se sugirió un papel de los microARN (miARN) en la regulación de los procesos de traducción implicados en la infección por el SARS-CoV-2 y su enfermedad, el COVID-19, ya sea bloqueando o degradando el ARNm con la posterior eliminación o supresión de genes específicamente relacionados [267,268]. Los miARN son ARN no codificantes que desempeñan un papel en la regulación de la expresión génica, se unen a los ARNm de genes diana e inducen la degradación del ARNm para inhibir la síntesis de proteínas [269]. Un posible papel del miARN en las enfermedades pulmonares se ejemplifica por los niveles elevados de varias secuencias que se encuentran en el plasma de pacientes con enfermedad pulmonar obstructiva crónica (EPOC) [270] y pueden desempeñar un papel en el COVID-19. Curiosamente, una investigación reciente identificó 42 miARN antivirales humanos potenciales que se predice que se dirigen al SARS-CoV-2 [271]. Entre estos, se ha demostrado que el miR-125a circulatorio aumenta en respuesta al ejercicio de alta intensidad [272], así como el miR-23b en el músculo esquelético después del ejercicio aeróbico, pero sin aumentos concordantes en el miR-23b vesicular plasmático [273,274,275,276]. El rol de los miARN inducidos por el ejercicio en la obstrucción de la expresión génica viral es un apasionante campo de investigación para el futuro. La firma del miARN en el sistema cardiorrespiratorio, el músculo esquelético, los riñones, el cerebro, los vasos sanguíneos y el plasma sanguíneo pueden responder al ejercicio y correlacionarse con el estado físico; por lo tanto, pueden tener un papel protector en la defensa contra los efectos perjudiciales del SARS-CoV-2.
Se podría plantear la hipótesis de que la característica protectora de la AF regular y el entrenamiento físico implica la inhibición de la expresión génica de la célula huésped que de otro modo sería "secuestrada" por el SARS-CoV-2 en el desarrollo del COVID-19. Se ha demostrado que el ejercicio induce cambios epigenéticos significativos, tanto con respecto a la acetilación como a la metilación de histonas [277,278]. La acetilación y metilación de histonas son procesos reguladores reversibles que facilitan y obstruyen, respectivamente, la expresión génica [279]. Sin embargo, la investigación epigenética en biología del ejercicio se encuentra en una etapa temprana y está fuertemente sesgada hacia la investigación de la función muscular. No obstante, en el contexto de grupos vulnerables con mayor riesgo de desarrollar el COVID-19, se ha observado hipermetilación del ADN en el músculo con el envejecimiento [280] y se ha revertido en la diabetes tipo 2 con el entrenamiento [280]. Se ha demostrado un aumento de la acetilación de histonas en el músculo esquelético después del entrenamiento de la fuerza [281], así como una mayor frecuencia de hipometilación de todo el genoma, que se conservó durante un período de desentrenamiento y se mejoró en respuesta al reentrenamiento [282]. Recientemente se identificaron cambios en los ARN no codificantes largos derivados del hospedador (ARNnc) en los tejidos pulmonares de pacientes con COVID-19 [283]. Se ha sugerido que los LncRNA desempeñan un papel importante en la regulación de las respuestas inmunitarias y las comorbilidades [284]. Curiosamente, se ha demostrado que los LncRNA se expresan de forma diferencial en el músculo esquelético entre diferentes protocolos de entrenamiento [285]. Sin embargo, quedan por investigar las funciones específicas de los LncRNA en la respuesta del huésped al SARS-CoV-2, o en la biología del ejercicio.
En conjunto, la AF y el ejercicio dan como resultado cambios epigenéticos (Figura 4) junto con una mayor expresión de genes relacionados con funciones musculares mejoradas [286,287,288,289]. Aún no se ha determinado si los cambios en la firma epigenética observados en el músculo esquelético humano después del entrenamiento corresponden a cambios similares en el sistema cardiovascular-respiratorio, aunque esto se ha enfatizado [290,291,292,293]. Aunque son especulativos, los cambios epigenéticos antes mencionados podrían potencialmente estar involucrados en el aumento de la resistencia a la infección viral, incluida la infección por SARS-CoV-2.
Salud mitocondrial en relación con el COVID-19 y los efectos del ejercicio
La mitocondria es la usina aeróbica que genera ATP esencial en todas las células que contienen esta organela. Más allá de la síntesis de ATP, la mitocondria produce cofactores, lípidos y factores de señalización celular y desempeña un papel en el metabolismo de los esteroides, la homeostasis del calcio y la apoptosis [294]. Además, en los últimos años se ha descubierto un papel vital de la mitocondria en la defensa antiviral [295].
La calidad y cantidad de la masa mitocondrial dentro de cada célula son importantes para la tasa de síntesis de ATP, la flexibilidad del sustrato, las respuestas al estrés, la homeostasis, la tasa metabólica celular, la salud y la supervivencia. Por lo tanto, la capacidad mitocondrial puede ser un factor crucial en los órganos infectados por el SARS-CoV-2. En relación con los factores de riesgo asociados con el COVID-19, una reducción de la AF da como resultado una reducción de la capacidad oxidativa mitocondrial y de la señalización de la insulina en el músculo esquelético humano [296]. Además, se ha sugerido que la hiperglucemia y la sobreproducción de ROS por las mitocondrias son un desencadenante importante de la inflamación y del daño vascular observados en la diabetes tipo 2 [297]. La inflamación sistémica sostenida de bajo grado, que se observa comúnmente en individuos con alto riesgo de COVID-19 [298], se asocia con un aumento de la producción de ROS mitocondriales en el endotelio, así como con la disfunción vascular [299]. Por tanto, es probable que las citocinas proinflamatorias y los ROS produzcan un círculo vicioso en los pacientes con COVID-19 [300]. A diferencia de la AF reducida, se ha demostrado que el aumento de la AF mediante el entrenamiento de la resistencia mejora la función mitocondrial y la capacidad de oxidación de lípidos en sujetos delgados y obesos [301], y mejora la sensibilidad a la insulina y la captación de glucosa [302]. Se ha planteado la hipótesis [303], y ahora se ha demostrado [304], que el SARS-CoV-2 manipula el metabolismo mitocondrial. Los hallazgos de los pacientes con COVID-19 sugieren que la disfunción mitocondrial impulsa una respuesta inmune sistémica en la patogénesis del COVID-19. Como lo sugirieron Ajaz y cols. [304] y otros [305,306], el mantenimiento de la función y la salud mitocondrial es esencial para una respuesta adecuada del sistema inmunológico innato para contrarrestar la modulación del SARS-CoV-2.
La biogénesis mitocondrial, el proceso que aumenta la densidad de las mitocondrias y la capacidad de oxidación aeróbica después del ejercicio, no se limita sólo al músculo esquelético. Esto se ejemplifica por el aumento de la capacidad respiratoria mitocondrial, el equilibrio redox, la abundancia de superóxido dismutasa de manganeso (MnSOD) y la biodisponibilidad del NO en las arterias de los ratones después del entrenamiento [307]. Además, se ha demostrado que el entrenamiento físico en ratas aumenta la actividad de las enzimas antioxidantes en varios tejidos, incluidos el cerebro, el hígado, los pulmones y los músculos [308]. Se esperaría que esto disminuyera el tono pro-oxidativo del medio intracelular, favoreciendo un ambiente más reducido y fisiológicamente ventajoso para llevar a cabo procesos celulares normales. Además, se ha demostrado que el nivel de proteína de choque térmico 70 (HSP70) se regula al alza en los pulmones de las ratas después del entrenamiento físico, lo que atenúa el edema pulmonar agudo inducido por el calor, la inflamación y el daño isquémico y oxidativo en los pulmones [309]. Es probable que el estrés térmico agudo medido durante el ejercicio, con una temperatura de 38-40°C en el ‘core’ [310] y el músculo esquelético y el cerebro, sea otro factor que estimule la expresión de las HSP en muchos órganos [311]. En relación con el panorama de factores de riesgo de COVID-19, se ha propuesto que un desequilibrio entre la HSP70 extracelular (eHSP70) y la HSP70 intracelular (iHSP70), que se contrarresta con el ejercicio, juega un rol en la diabetes tipo 2, siendo la eHSP más pro- inflamatorio y iHSP70 más antiinflamatorio y asociado con una mejor sensibilidad a la insulina [312] (Figura 4). Los individuos con enfermedades crónicas que son de naturaleza inflamatoria (obesidad, diabetes tipo 2, ECV) tienen una respuesta antiinflamatoria de choque térmico alterada y suprimida. Por lo tanto, los inflamasomas NF-kB y NLRP3 se activan, lo que conduce a una tormenta de citocinas masiva, que predispone a estos pacientes al COVID-19 severo, como también lo discutieron Heck y cols. [313].
Podríamos especular aún más que una diferencia en la vulnerabilidad al COVID-19 entre individuos aptos y no aptos físicamente está relacionada con las diferencias en el nivel y las interconexiones entre la exposición inflamatoria, la citoprotección y la capacidad mitocondrial. En consonancia con esta especulación, la disfunción mitocondrial que se observa generalmente con el envejecimiento y en las comorbilidades relacionadas con el síndrome metabólico y la inflamación sistémica de bajo grado se ha destacado en relación con el mal pronóstico de COVID-19 [314]. También se puede especular que el ejercicio regular produce algún mecanismo antivírico en las células huésped que inhibe la maquinaria de replicación del SARS-CoV-2 invasor y, por lo tanto, la patogenia del COVID-19. Aquí, el efecto del entrenamiento físico sobre la proteína de señalización antiviral mitocondrial (MAVS) y los factores reguladores es interesante, pero aún no se ha explorado. Según lo revisado por Refolo y cols. [295], el signalosoma MAVS puede inducir rápidamente la expresión de cientos de genes con propiedades antivirales en respuesta a la infección con un virus de ARN. Esto es discutido más a fondo por Burtscher, Millet y Burtscher [306], quienes abogaron por la integridad mitocondrial y, por lo tanto, una MAVS mejorada. Sin embargo, el aumento del metabolismo de los ácidos grasos podría favorecer la replicación viral en individuos obesos. Varios estudios han demostrado que las gotitas de lípidos intracelulares interactúan con los virus de ARN y pueden apoyar su replicación y la producción de mediadores inflamatorios [315,316]. Por lo tanto, el aumento de la función mitocondrial y el metabolismo de los lípidos a través de la AF regular y la no obesidad pueden ser otros factores que afectan el resultado del COVID-19 entre individuos aptos y no aptos físicamente [305]. Además, el aumento de la densidad mitocondrial (es decir, mayor número y tamaño de mitocondrias) en todos los tejidos afectados por un aumento de la tasa metabólica debido al entrenamiento físico puede aumentar la densidad de la MAVS, lo que mejora la respuesta antiviral después de la infección por SARS-CoV- 2 (Figura 4). Por último, se ha demostrado una función mitocondrial mejorada en las plaquetas sanguíneas con el ejercicio, en pacientes con accidente cerebrovascular [317] y en pacientes con insuficiencia cardíaca [318], junto con una capacidad aeróbica mejorada. Por lo tanto, la función mitocondrial mejorada en las plaquetas después de la AF y el ejercicio puede reducir la trombogénesis y el riesgo de coagulopatía después de la infección por el SARS-CoV-2.
CONCLUSIONES
La pandemia de COVID-19 ha desenmascarado la vulnerabilidad de la humanidad a las amenazas biológicas. La vejez y la obesidad con una o más comorbilidades son factores de riesgo claramente definidos para desarrollar un COVID-19 grave. Todos estos factores de riesgo están asociados con un estilo de vida sedentario y un bajo fitness cardiorrespiratorio. Sin embargo, la AF, como el ejercicio, genera respuestas celulares y fisiológicas que apoyan la salud y la movilidad y previenen las comorbilidades y la mortalidad. Es evidente que faltan investigaciones sobre los efectos de las infecciones virales a nivel de los mecanismos celulares y fisiológicos en relación con la aptitud física. Con suerte, estos vínculos potenciales se explorarán en el futuro a la luz de la pandemia del COVID-19. Se deben realizar esfuerzos contra la pandemia de obesidad e inactividad física para aumentar el fitness cardiorrespiratorio, metabólico e inmunológico promedio de la población, aumentando así las defensas antivirales del huésped y la resistencia pandémica de la humanidad. La disminución de la respuesta a la vacunación y la diseminación prolongada del virus en individuos obesos también debe ser enfatizada e investigada más a fondo en estudios controlados. La investigación sobre los regímenes de ejercicio, incluida la modalidad, la duración y la intensidad, así como para aumentar la aptitud inmunológica y la respuesta inmunológica a la vacunación, beneficiarán a nuestra sociedad en futuras pandemias. La prevención y el tratamiento de la obesidad y la baja aptitud física probablemente mejorarían la resistencia de la humanidad frente a un desafío viral global, tan acertadamente ilustrado por la pandemia actual del COVID-19.
Financiamiento
Esta investigación no recibió financiación externa.
Agradecimientos
Todas las figuras se realizaron utilizando BioRender.com. Figura 1: Adaptado de "Cytokine storm" (2021), recuperado de https://app.biorender.com/biorender-templates, consultado el 10 de junio de 2021. Figura 2: Adaptado de "Mechanism of SARS-CoV-2 Viral Entry ”(2021), recuperado de https://app.biorender.com/biorender-templates, consultado el 10 de junio de 2021.
Conflictos de interés
Los autores declaran no tener ningún conflicto de intereses.
Referencias
1. Ver las 318 referencias bibliográficas en el artículo original: (https://doi.org/10.3390/sports9090121). Potential Physiological and Cellular Mechanisms of Exercise That Decrease the Risk of Severe Complications and Mortality Following SARS-CoV-2 Infection.