Principios Metabólicos de los Efectos de la Suplementación con Creatina sobre el Rendimiento Deportivo
Diego Alexander Bonilla Ocampo
Departamento de Bioquímica y Biología Molecular. Universidad Distrital Francisco José de Caldas, Carrera 3 # 26 A 40, Bogotá D.C., Colombia.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2013.
Publicado 10 de julio de 2013
Resumen
Palabras clave: Sistema Cr/PCr/CK, Monohidrato de Creatina, Suplemento Ergogénico, Metabolismo Energético Miocelular, Ejercicio de Resistencia, Cascada de Señalización
1. INTRODUCCIÓN
La creatina (Cr) fue descubierta en 1832 por el científico francés Michel Eugene Chevreul quien extrajo un nuevo constituyente orgánico de la carne y lo denominó Creatina, nombre proveniente del griego κρέας = kreas carne (Williams et al. 1999). La Cr (N-(aminoiminometil)-N-metil-glicina, CAS 57-00-1, 2006) es un metabolito semejante en su dimensión molecular a un aminoácido (Figura 1), con una masa molecular de 131.13 g mol-1 y un punto de fusión es 303 °C (Pischel & Gastner 2007).
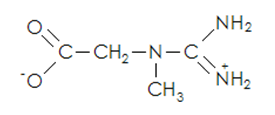
Figura 1. Estructura Molecular de la Creatina
La síntesis endógena de Cr se fundamenta primero en la transferencia del grupo amidino de la arginina al grupo amino de la glicina, produciendo ornitina y guanidinoacetato, reacción catalizada por la enzima L-Arginina:Glicina Amidinotransferasa (AGAT – EC 2.1.4.1) (Brosnan & Brosnan 2007). El guanidinoacetato es metilado sobre el nitrógeno original de la glicina usando S-adenosilmetionina (AdoMet) como el donador del grupo metilo. Esta reacción produce Cr y S-adenosilhomocisteína (AdoHcy) y la cataliza la enzima Guanidinoacetato N-Metiltransferasa (GAMT – EC 2.1.1.2) (da Silva et al. 2009; Stout et al. 2008). La síntesis de Cr representa una considerable carga metabólica, en particular con respecto a la utilización de aminoácidos. Es relevante la relación de la síntesis de Cr con la ingesta diaria de glicina, arginina y metionina. La síntesis de 1.0 g Cr día-1 tiene un valor de 7.6 mmol, esto se compara a la ingesta diaria de cerca de 78 mmol de glicina, 37 mmol de arginina y 19 mmol de metionina (estos valores están basados en la ingesta de 80 g proteína día-1). Por consiguiente la síntesis de Cr consume cerca del 10% de la glicina dietaria ya que una molécula entera de glicina es incorporada a una molécula de Cr (Brosnan et al. 2007). En humanos, el hígado es el órgano más importante que contribuye a la biosíntesis de Cr mientras que el riñón juega solo un papel secundario. Ambos tejidos presentan gran actividad de AGAT y GAMT, aunque en el hígado la actividad es mayor (Brosnan & Brosnan 2007). Además, la actividad de AGAT ha sido detectada también en corazón, pulmón, bazo, músculo, cerebro, testículos y timo, donde se ha estimado que la cantidad total de AGAT en estos tejidos es cercana a las encontradas en riñón y páncreas (Wyss & Kaddurah-Daouk 2000; Stout et al. 2008). La Cr es degradada espontáneamente en una reacción monomolecular a creatinina (Crn, Mr 113.1), la cual es cuantitativamente excretada en la orina (Uzzan et al. 2009). La taza de excreción está estimada más o menos en el 1.7% del pool de Cr total (TCr) en el cuerpo por día. Como más del 90% de las moléculas de Cr y PCr se encuentran en el músculo esquelético, la excreción de Crn varía en función del género y la edad; así, la taza de excreción de Crn tiene su máximo nivel entre los 18 y 29 años, con una relación de 23.6 mg Crn por kilogramo de peso cada 24 horas (Brosnan & Brosnan 2007). De esta manera, el requerimiento diario de Cr ya sea por la dieta o por la síntesis endógena en un hombre de 70 Kg es aproximadamente de 2 g día-1 (Harris et al. 1992). Sin embargo, puesto que muchos atletas pesan más de 70 Kg y ya que el entrenamiento intenso promueve la degradación proteica, incrementando los niveles de Crn en suero y orina, atletas que llevan a cabo entrenamiento intenso tienen un mayor turnover y requerimiento diario de Cr (por ejemplo de 2 a 3 g día-1) (Williams et al. 1999). La Cr se encuentra primordialmente en los vertebrados, y puesto que se concentra principalmente en el tejido muscular, las fuentes primarias son el pescado y las carnes rojas, aunque trazas de Cr pueden ser encontradas en algunas plantas (Balsom et al. 1994). Ahora bien, la Cr es requerida principalmente por células con requerimientos energéticos altos y variables (Wallimann et al. 2011); sin embargo, los tejidos que almacenan las más altas concentraciones de este metabolito no sintetizan su propia Cr sino que la obtienen desde el torrente sanguíneo por un específico transportador denominado CreaT, hoy en día conocido como SLC6A8 ya que mediante clonación molecular ha sido caracterizado por ser parte de una amplia familia de transportadores de neurotransmisores dependientes de Na+ y Cl-, conocida como la familia 6 de transportadores de solutos (SLC6) (Snow & Murphy 2001; Peral et al. 2002; Christie 2007). Cerca del 95% de las reservas de Cr en el cuerpo se hallan al interior del músculo esquelético, el otro 5% restante se encuentra en el corazón, cerebro, hígado, riñón, testículos y células fotorreceptoras de la retina (Snow & Murphy 2001; Speer et al. 2004; Wallimann & Hemmer 1994; Wallimman et al. 2011). La concentración promedio de Cr en el tejido muscular es de 120 mmol Kg-1 de masa muscular (Stout et al. 2008). En el músculo, la Cr se encuentra en un 33% en forma aislada y el 67% restante en forma de fosfocreatina (PCr), la forma cargada energéticamente vía creatina cinasa (CK - EC 2.7.3.2) (Figura 2). En las fibras musculares tipo I la concentración de PCr es ligeramente más baja (entre un 15 y 20%) en comparación con las fibras tipo II (Chicharro & Fernández 2006). Las concentraciones citosólicas de Cr y PCr en el miocito son de 13 - 27 mM, respectivamente (Brosnan et al. 2007). La PCr y Cr en relación al ATP y ADP son moléculas más pequeñas y menos cargadas negativamente que pueden encontrarse en concentraciones mucho mayores en muchas de las células y tejidos que contienen CK, en relación con eso permiten un mayor flujo intracelular de fosfatos de alta energía. Además, el delta de energía libre de Gibbs (∆G°’) a pH 7.0 para la hidrólisis de PCr es de 245.0 kJ mol-1 comparado con los 231.8 kJ mol-1 para el ATP, implicando que en tejidos con un sistema activo de CK, la fosforilación potencial pueda ser regulada a un nivel mayor que en tejidos desprovistos del sistema CK (Brosnan & Brosnan 2007). Este factor es esencial para el funcionamiento óptimo de algunas ATPasas celulares, por ejemplo las ATPasas miofibrilares (Wallimann 2009). Durante el ejercicio intenso, la Cr en su forma energéticamente cargada, la PCr, está disponible en las fibras musculares para la regeneración inmediata de ATP mediante una reacción catalizada por la CK en un proceso rápido y anaeróbico (Figura 2) (Chicharro & Fernández 2006).
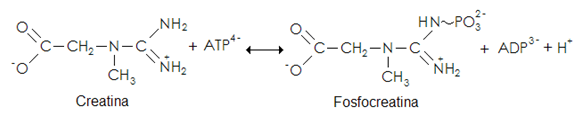
Figura 2. Reacción catalizada por la CK.
El metabolismo de los fosfágenos o fosfatos de alta energía, como la PCr, proporciona la energía necesaria para la contracción muscular al inicio de la actividad y durante ejercicios explosivos, muy breves y de elevada intensidad. En los periodos de inactividad muscular la PCr es rápidamente resintetizada, paradójicamente la síntesis de PCr a partir de Pi y Cr precisa la energía procedente de la hidrólisis del ATP (Bessman & Carpenterm 1985). Como se está en fase de recuperación el ATP se está sintetizando por los sistemas aeróbicos y parte de este ATP irá destinado a ceder su energía para reponer las concentraciones basales de PCr (Chicharro & Fernández 2006).
La Cr cristaliza con agua en un prisma monoclínico reteniendo una molécula de agua de cristalización por molécula de Cr (Pischel & Gastner 2007), formando el popular suplemento dietario Monohidrato de Cr, el cual hace parte de los suplementos nutricionales frecuentemente consumidos por atletas de élite y personas del común debido a su ratificados efectos ergogénicos (Hespel 1999; Barbero 1999; Casey & Greenhaff 2000; González et al. 2003; Maughan et al. 2004; Kreider et al. 2003b, 2010; Wallimann 2008; Stec & Rawson 2010; Kreider & Jung 2011; Del Favero et al. 2011; Kim et al. 2011; Carrillo & Gilli 2011). Sin embargo, los principios metabólicos que explican los efectos positivos sobre el rendimiento deportivo tras los periodos de suplementación con Cr permanecen sin ser dilucidados completamente, por lo tanto resulta pertinente realizar un arqueo bibliográfico al respecto para establecer un punto de referencia para futuras investigaciones en este campo y asimismo analizar los posibles mecanismos a través de los cuales se puede dar explicación a los efectos que trae la suplementación con Cr.
2. Fundamentos Metabólicos de la Suplementación con Creatina sobre la Resistencia a la Fatiga
2.1. Fosfocreatina
El evento principal tras la ingesta de Cr es el aumento de las concentraciones séricas y musculares de Cr, sin cambio alguno en los niveles de ATP (Derave et al. 2004; Brosnan et al. 2007; Kreider & Jung 2011). Por ejemplo, tras consumir 5 g de Cr se alcanza un valor de concentración de Cr en plasma de 600-800 μM después de 1 hora de ingesta; por el contrario, en respuesta a bajas dosis (<2 g Cr) el incremento sanguíneo es insignificante. Asimismo, cuando se ingieren altas dosis de Cr (20 g), la concentración plasmática de este metabolito incrementa unas 50 veces con respecto al estado basal alcanzado un valor máximo de 2.17 ± 0.66 mM, aproximadamente 2.5 horas después de la ingesta (Mesa et al. 2002). En músculo, las concentraciones de PCr y Cr antes de los periodos de suplementación son aproximadamente de 85 y 41 mmol Kg-1 masa seca respectivamente, lo que equivale a una concentración intramuscular de TCr en el orden de 40-50 mM (100-150 mmol Kg-1 masa seca). Sin embargo, tras la suplementación con Cr los niveles de TCr incrementan cerca de 25% (Persky & Brazeau 2001), y si la ingesta está acompañada de ejercicio en un 37% (Brosnan et al. 2007). Harris et al. (1992) reportaron un incremento significativo en la concentración de TCr en el músculo cuádriceps femoral en el hombre tras la administración de 20-30 g Cr día-1 durante 2 días, sugiriendo que el 20-40% de tal incremento es debido a un aumento en la concentración de PCr. Casey et al. (1996b) mostraron que la ingestión de 20 g Cr día-1 durante 5 días aumenta en 23.1 ± 4.7 mmol Kg-1 masa seca la concentración de TCr muscular. Posteriormente, Smith et al. (1998) demostraron que la suplementación con Cr incrementa la concentración muscular de PCr en un 15% en sujetos jóvenes y en un 30% en sujetos de la tercera edad durante el reposo, además de aumentar el tiempo en alcanzar el agotamiento en ambos grupos (desde 118 ± 34 hasta 154 ± 70 segundos). En este sentido, se ha reportado que la suplementación con Cr incrementa aproximadamente en un 20% el contenido muscular de PCr, generalmente de 70-90 a 85-105 mmol Kg-1 peso seco (The American College of Sports Medicine Roundtable 2000). Así, el ejercicio parece ser un potente estímulo para la captación de Cr por el músculo esquelético (Brosnan et al. 2007). Por otro lado, un factor fundamental que limita el aumento en los niveles de PCr tras la administración de Cr, es la existencia de sujetos que no responden a la suplementación con Cr (Greenhaff et al. 1994, 1996; Casey & Greenhaff 2000; Syrotuik & Bell 2004). Una de las razones por la que existen sujetos que no responden a la suplementación con Cr es que la captación de Cr es inversamente proporcional al contenido inicial de TCr muscular en los sujetos (Volek & Rawson 2004). De esta forma, se ha establecido que aquellos sujetos que experimentan altos incrementos en sus concentraciones de TCr presentan valores iniciales de 120 mmol Cr Kg-1 masa seca o incluso menos, por ejemplo los vegetarianos (Kreider 1998b). Se ha sugerido que este fenómeno sirve al músculo para controlar el valor límite de TCr intracelular. Hoy en día, está claro que la suplementación con Cr a corto y largo plazo incrementa la concentración de TCr en el músculo esquelético humano. En consecuencia, se podría pensar que la relación PCr/TCr (no confundir con la relación PCr/Cr) podría disminuir tras los periodos de suplementación durante los periodos de reposo muscular. Así, partiendo del equilibrio de la reacción de la CK, esta reducción de la relación PCr/TCr implica un incremento citoplasmático de ADP y una disminución de la energía libre de Gibbs de la hidrólisis del ATP en el músculo, lo cual parece contrario a los beneficios ergogénicos reportados tras la suplementación con Cr. No obstante, Brault et al. (2007) demostraron que las concentraciones musculares de PCr y TCr incrementan linealmente a lo largo de la suplementación con Cr (PCr 11.7 ± 2.3% vs. TCr 14.9 ± 4.1%), al haber estudiado los cambios de estos metabolitos en biopsias del vasto lateral de hombres adultos después de 5 días de administración de monohidrato de Cr (0.43 g kg-1 peso corporal d–1) usando RMN de 31P y 1H. Estos resultados indican que la suplementación con Cr no altera la relación PCr/TCr y desde aquí la energía libre de Gibbs de la hidrólisis de ATP en el músculo humano en reposo, lo que implica que durante la ingesta de Cr los niveles de TCr mantienen su homeostasis normal debido al aumento y contribución del ~70% de PCr y ~30% de Cr.
2.1.1. Creatina y la Cinética de PCr
El modelo análogo-eléctrico de Meyer (1989), acerca del control respiratorio, postula que la constante de tiempo (τ) para el descenso exponencial en la concentración de PCr después del inicio de contracciones musculares se da en función de la resistencia mitocondrial y la capacitancia metabólica. El modelo predice que un incremento en la densidad mitocondrial generaría una menor τ (provocando una cinética más rápida de PCr), mientras que un aumento en la capacitancia metabólica, determinado por el contenido de TCr muscular, generaría una mayor τ (provocando una cinética más lenta de PCr). De acuerdo con esta predicción, Meyer (1998) reportó que la depleción del contenido de TCr del músculo gastronecmio, por la administración de β-GPA en ratas, genera una cinética significativamente más rápida de PCr evidenciada en una disminución de la τ de este metabolito. Además, se ha reportado que un incremento en la actividad de citrato sintasa, inducido por entrenamiento aeróbico en ratas, tiene el mismo efecto que la depleción de TCr sobre la cinética de PCr, es decir una reducción de la τ de la PCr que genera una cinética más rápida de PCr en el músculo (Jones et al. 2009). Actualmente, está bien establecido que la concentración de PCr y la VO2 varían con perfiles cinéticos similares después del inicio del ejercicio hasta que se alcanza un nuevo estado en donde participa el metabolismo oxidativo. Esto datos indican que la regulación de la respiración mitocondrial está íntimamente ligada, mediante la reacción de la CK, a las relaciones de ATP/ADP y/o PCr/Cr (Jones et al. 2009; Kemp 2009). Esto fue demostrado por Francescato et al. (2008) al verificar experimentalmente las relaciones entre los fosfatos de alta energía y/o sus cambios en la τ de la cinética de la PCr en humanos. Estos autores encontraron que: 1) la concentración de PCr y su τ al descanso estuvieron entre los valores de la literatura, entre 27.5 ± 2.2 mM y 23.9 ± 2.9 segundos, respectivamente; 2) desde el inicio hasta la fase estable del ejercicio, la concentración de PCr disminuyó significativamente (22 ± 6%), sin diferencias entre las tres repeticiones del ejercicio; 3) además, la τ de la PCr en los individuos se relacionó linealmente con la concentración de PCr en el reposo. Estos datos soportan la idea de que en humanos, la concentración de PCr controla el tiempo de curso del metabolismo oxidativo en el músculo esquelético al comienzo del ejercicio, siendo uno de los principales controles de la fosforilación oxidativa. La contundente relación entre la τ de la cinética de la PCr y la concentración de PCr durante el descanso concuerda con el hecho de que la PCr, al ser una reserva energética, regula y mantiene en leve tiempo de curso el metabolismo oxidativo hasta que se alcanza una nueva fase estable caracterizada por la intervención de otras fuentes energéticas. Además, la relación observada en el trabajo anterior soporta el modelo lineal del control respiratorio propuesto por Meyer (1989), en donde la reacción de la CK es considerada un condensador químico de la respiración mitocondrial siendo la capacitancia proporcional al contenido de TCr (Francescato et al 2008). Colectivamente, estos datos proveen evidencia fuerte de la noción de que la τ de la concentración de PCr y la VO2 conforman un simple modelo lineal del control respiratorio (Kemp 2009). Recientemente, Jones et al. (2009) realizaron un estudio con 7 sujetos saludables que completaron una serie de transiciones del ejercicio extensor de rodilla desde moderado a pesado al interior de un equipo de RMN (31P) antes y después de un periodo de suplementación con monohidrato de Cr (20 g día-1) de 5 días para analizar el efecto de la Cr sobre la cinética de la PCr. Los resultados mostraron que la administración de Cr generó un incremento del ~8% en la relación PCr/ATP (inicial 4.66 ± 0.27 vs. final 5.04 ± 0.22, P<0.05) consistente con el incremento significativo en el contenido de TCr muscular; además, la τ de la PCr incrementó después de la carga con Cr durante el ejercicio de moderada intensidad y su subsecuente recuperación al igual que durante el ejercicio de alta intensidad, pero sin cambios durante la recuperación siguiente de éste último. La magnitud del incremento de la concentración de PCr después de la ingesta de Cr se correlacionó con la disminución de la cinética de la concentración de PCr en las transiciones de las dos clases de ejercicio. Los datos anteriores demuestran, por primera vez, que un incremento en la concentración muscular de PCr tras la suplementación con Cr genera una reducción en la degradación de la PCr muscular durante el ejercicio y la recuperación subsecuente en humanos. Adicionalmente, Barker et al. (2008) demostraron que no existen diferencias relacionadas con la edad o el sexo en la cinética de la concentración de PCr en el músculo cuádriceps, ni al inicio ni al final del ejercicio, en humanos. Estos resultados indican que después de la transición de un estado metabólicamente mayor a uno menor, o viceversa, el control de la fosforilación oxidativa mitocondrial es independiente de la edad y del sexo, lo cual concuerda con la capacidad comparable del metabolismo oxidativo en el músculo de niños y adultos.
Ciertamente, la suplementación con Cr además de regular las concentraciones musculares de ATP y ADP, incrementa los niveles de PCr celular generando un aumento de la τ para el descenso exponencial en la concentración de PCr a través de la reacción de la CK. Esto implica que los efectos ergogénicos de la Cr se sustenten desde variables cinéticas del proceso de degradación de PCr, además del incremento en la concentración de éste, con el objetivo de generar una mayor dependencia del metabolismo de los fosfatos de alta energía que conlleva a la menor acumulación de moléculas inhibidoras del proceso de contracción, producción de energía y desempeño de las ATPasas intramusculares.
2.2. Pi y H+
Durante los cortos periodos del ejercicio de alta intensidad, el Pi y los cationes H+ se acumulan en el músculo esquelético originando la fatiga. La acumulación de Pi impide la contracción muscular, afectando principalmente las fibras musculares de contracción rápida, debido a que inhibe las APTasas de miosina y SERCA, reduce la energía libre de Gibbs de la hidrólisis del ATP, altera el estado de los puentes cruzados actinomiosínicos y desacopla los receptores de dihidropiridina y de rianodina (Chicharro & Fernández 2006; Davies et al. 2011). Además, recientemente se ha evidenciado que la fase inicial de reducción de la fuerza, tras la fatiga, es acompañada de un incremento en la concentración de Pi y una reducción de Ca2+ tetánico mioplasmático en ratones, por lo que se ha sugerido una posible precipitación de CaPi en el retículo sarcoplasmático (Allen et al. 2011). Debido a que la hidrólisis neta de PCr consume iones H+ se ha postulado que tal mecanismo es el primer buffer muscular que contribuye a la regulación de la acidosis intracelular durante el ejercicio físico, cuando la reacción de la CK favorece la resíntesis de ATP desde PCr (Mesa et al. 2002). Esto ha sido confirmado por Rico-Sanz (2000), quien realizó un estudio en 8 hombres entrenados para examinar, mediante RMN de 31P, el metabolismo energético durante ejercicio isométrico de flexión plantar (pantorrilla) al 32 ± 1% y 79 ± 4% de la contracción voluntaria máxima antes y durante un periodo de ingesta de Cr de 5 g día-1 x 11 días. Al 79% de la contracción voluntaria máxima, los valores de Pi y pH fueron similares al final de las series tras 4 y 11 días de suplementación. En contraste, el ejercicio a 32% produjo un mayor pH y menor acumulación de Pi tras la suplementación con Cr sugiriendo una mayor resíntesis aeróbica de PCr durante el ejercicio. Los hallazgos de Rico-Sanz (2000) fueron extrapolados al ejercicio máximo por Yquel et al. (2002), quienes analizaron las mismas variables por RMN de 31P en 9 sujetos que ejecutaron 8 series del ejercicio de flexión plantar antes y después de la ingestión de Cr (20 g día-1 x 6 días), encontrando que solo después de los 30 segundos de recuperación se evidencia una menor acumulación de Pi y mayor pH, con respecto al estado basal. En este sentido, los investigadores concluyeron que el mayor rendimiento muscular observado tras la suplementación con Cr se debe a una mayor resíntesis de PCr, menor acumulación de Pi y mayor pH. Estos estudios demuestran que la acumulación de Pi y H+ disminuye tras la administración de Cr sugiriendo que la relación de la producción neta de H+ también se reduce (Dos Santos 2001). De hecho, la carga con Cr (20 g día-1 x 7 días) incrementa el umbral anaeróbico desde 2.2 hasta 2.5 L min-1 (Mesa et al. 2002), lo que implica una optimización de la obtención de energía durante la ausencia de oxígeno. Ahora bien, debido a que muchas personas entrenan constantemente y consumen Cr para optimizar su rendimiento deportivo, se puede pensar que los efectos que trae la ingesta de este suplemento sobre algunas constantes fisiológicas, como el pH, haría necesaria la idea de modificar los análisis de laboratorio. Sin embargo, el estudio de Ropero-Miller et al. (2000) demostró que los cambios de pH que experimenta el músculo no son reflejados en los análisis de muestras de sangre y orina. A pesar de que algunos estudios soportan un aumento del pH muscular durante y después del ejercicio tras la ingesta de Cr, algunas investigaciones no evidencian cambio alguno. Por ejemplo, en el trabajo de Jones et al. (2009), el pH muscular no presentó diferencias significativas entre las condiciones control y la carga con Cr en momentos de pre-ejercicio, final del ejercicio o al final del periodo de recuperación. Por otro lado, la inevitable disminución en la generación de ATP durante el ejercicio permite un incremento en el contenido de ADP el cual estimula la reacción de la adenilato cinasa (2ADP à ATP + AMP) la cual genera la formación de AMP que es rápidamente desaminado a monofosfato de inosina (IMP) y amonio por medio de la AMP desaminasa. El IMP resultante es en últimas transformado a hipoxantina. Así, durante el ejercicio los niveles de IMP, amonio e hipoxantina incrementan, de hecho los niveles plasmáticos de amonio e hipoxantina son considerados marcadores de pérdida de nucleótidos de adenina en el ejercicio de alta intensidad (Mesa et al. 2002). En este sentido, Greenhaff et al. (1993) reportaron un incremento de PCr tras la suplementación con Cr y una menor acumulación de amonio e hipoxantinas en plasma, además se ha mostrado que la ingesta de Cr reduce significativamente los niveles de amonio en sangre durante ejercicio máximo (Mesa et al. 2002). Estos hallazgos sugieren que la suplementación con Cr puede inducir a un declive de amino e hipoxantina muscular mediante la mayor regeneración de ATP lo que generaría un incremento en el performance en ejercicio intermitente de alta intensidad (McConell et al. 2005). Estos efectos a nivel micro evidenciados en menores concentraciones de metabolitos implicados en la fatiga muscular (Pi, H+, IMP, etc.) y mayores concentraciones de PCr han sido corroborados externamente mediante un retardo de la fatiga en los sujetos suplementados con Cr (Dos Santos 2001). Rawson et al. (2010) realizaron un estudio de doble ciego con placebo controlado con 20 hombres/mujeres saludables para determinar si bajas dosis de Cr (0.03 g Kg-1 peso corporal día-1 x 6 semanas) podría reducir la fatiga muscular inducida por 5 series de extensiones de rodilla concéntricas. Tras la suplementación, los resultados revelaron que las bajas dosis de Cr incrementan significativamente la Cr plasmática (+182%, P=0.03) y aumentan la resistencia a la fatiga durante las series 2 (7%), 3 (9%) y 5 (11%), en comparación con la línea base (P<0.05). Pocos estudios como el de Cooke et al. (1995) no reflejan una mejora en la resistencia a la fatiga después de la suplementación con Cr a pesar de utilizarse ejercicio de alta intensidad y de corta duración posiblemente por el mínimo incremento de TCr en los sujetos, teniendo en cuenta que en este estudio no se midió el contenido de TCr tras la suplementación.
2.2. Homeostasis del Ca2+
El calcio (Ca2+) es un ión esencial en el cuerpo humano que cumple funciones críticas en los espacios intra y extracelular en concentraciones determinadas. Además del importante rol en la matriz mineral del hueso, el Ca2+ actúa en la transmisión del impulso nervioso, la contracción muscular, la coagulación sanguínea, la secreción hormonal y la adhesión intercelular. Ahora bien, el balance de Ca2+ es particularmente regulado por actividades sinérgicas de la absorción gastrointestinal, la excreción renal, la reabsorción del hueso y el sistema vitamina D/hormona paratiroidea (McCarthy & Kumar 1997). Asimismo, varios sistemas de enzimas, bombas específicas para el Ca2+ y canales de iones trabajan juntas para mantener el control de la concentración de este ión en el citosol (Scarpa et al. 1992; Green et al. 1999). Una de estas enzimas es la CK, la cual provee la energía para el secuestramiento de Ca2+ en el retículo sarcoplasmático por la Ca2+-ATPasa (SERCA). En este sentido, Rossi et al. (1990) demostraron que la isoforma muscular de CK coinmunolocaliza en el retículo sarcoplasmático. Pulido et al. (1998) examinaron el efecto de la exposición de Cr 20 mM sobre la regulación del Ca2+ (usando Fura-2) en un cultivo de miotubos mdx de ratón, debido a su similitud con células de pacientes con distrofia muscular de Duchenne (DMD), las cuales exhiben alta concentración de Ca2+. Como control positivo usaron α-metilprednisolona, una hormona esteroide que inhibe el incremento de Ca2+ inducido por el estrés. La exposición de los miotubos a choque hipo-osmótico y a altas concentraciones de Ca2+ extracelular generaron un incremento de Ca2+ citosólico entre los 2-10 minutos en los cultivos. No obstante, el pretratamiento con Cr atenúo el incremento de Ca2+ y restauró los niveles cerca de los valores basales (desde 118±12 nM a 62±17 nM, P<0.001 para el efecto inducido por el choque osmótico y desde 112±15 nM a 59±17nM, P<0.001 para el efecto inducido por el aumento de Ca2+ extracelular) tal como lo hizo el control positivo. Posteriormente, Duke & Steele (1999) llevaron a cabo una investigación para examinar el efecto de la PCr sobre la regulación del Ca2+ liberado por el retículo sarcoplasmático en fibras musculares esqueléticas en ratas. Monitoreando la concentración de Ca2+ con Fura-2, los autores observaron que la ausencia de PCr y la inhibición de CK con 2,4-dinitro-1-fluorobenceno (DNFB) generaron una leve liberación de Ca2+ desde el retículo sarcoplasmático. Por lo tanto, la reducción de la concentración de PCr o más bien el déficit energético del sistema Cr/PCr/CK puede perjudicar la regulación del Ca2+ por el retículo sarcoplasmático debido a la limitada regeneración local de ATP necesaria para la captación del catión por las Ca2+-ATPasas, esto es coherente con el hecho que bajos niveles de PCr y altos niveles de Ca2+ están implicados en la fatiga muscular (Li et al. 2002). Kindig et al. (2005), al investigar el efecto de la inhibición aguda de CK con yodoacetamida y DNFB, evidenciaron de manera inesperada una notable disminución en la concentración muscular de Ca2+, lo que implica que variaciones en el sistema Cr/PCr/CK regula tanto los procesos de liberación como de captación de Ca2+. Ahora bien, Gallo et al. (2008) realizaron un estudio para evaluar los efectos de la suplementación con Cr sobre el proceso de adaptación muscular en ratas Sprague-Dawley, resaltando el análisis por Western Blot de algunas proteínas que regulan el Ca2+ miocelular como SERCA y parvalbúmina. Tras someter a los animales a un periodo de suplementación con Cr (solución 1% de Cr) acompañado de un protocolo de ejercicio aeróbico (correr sobre ruedas), caracterizado por facilitar la transición de fibras rápidas a fibras lentas, los autores encontraron un incremento significativo en la expresión de SERCA2 y una disminución de parvalbúmina, de manera que la regulación de ambas proteínas tras la ingesta de Cr es compensada por el incremento en la captación de Ca2+ por el retículo sarcoplasmático. Recientemente, Calderón-Rivera et al. (2010) evaluaron si la Cr regula el acoplamiento de excitación-contracción en el músculo esquelético al exponer miotubos de la línea celular C2C12 a una concentración 25 mM de Cr (2-4 horas). La exposición con Cr aumentó la función del canal de voltaje liberador de Ca2+ también conocido como receptor de rianodina, el cual representa un paso crítico durante la excitación-contracción. Tal efecto fue evidenciado en un incremento de Ca2+ transitorio (+140%) con respecto al grupo control. En consecuencia, los autores concluyeron que la incubación de miotubos a corto plazo con Cr incrementa la actividad del canal de voltaje liberador de Ca2+ sin efecto alguno sobre la actividad del receptor de dihidropiridina, la liberación de Ca2+ inducida por la cafeína o la cinética del Ca2+ transitorio. Aunque durante la investigación no se evidenció algún efecto de la Cr sobre SERCA, los autores sugirieron que un incremento en la recaptación de Ca2+ o un aumento de la carga de Ca2+ en el retículo sarcoplasmático podría explicar la estimulación del canal de voltaje liberador de Ca2+ por la Cr. Otro mecanismo que podría mediar la modulación sobre el receptor de rianodina es la posible disminución en la concentración de Mg2+, un potente inhibidor de este receptor, debido a que la Cr reduce la concentración de Mg2+ libre al promover la regeneración de ATP y el correspondiente quelato Mg2+-ATP (Calderón-Rivera et al. 2010).
En efecto, la administración de Cr parece regular la captación de Ca2+ por SERCA y la liberación de Ca2+ transitorio durante el proceso de excitación-contracción. Aunque en la investigación de Calderón-Rivera et al. (2010) no se demostró que la Cr estimulara la bomba de Ca2+ del retículo sarcoplasmático los mismos autores infieren que dicho estímulo solo es evidente cuando SERCA trabaja a bajo rendimiento tras un agotamiento de las reservas de ATP y PCr, requisito que no se evidenció en este estudio in vitro. Sin embargo, Gallo et al. (2008) evidenciaron una vía alterna en la regulación del Ca2+ miocelular tras la ingesta de Cr in vivodebido al aumento y reducción en la expresión de SERCA2 y parvalbúmina, respectivamente. A pesar de los hallazgos documentados hasta ahora, la necesidad de resultados contundentes y reproducibles en las investigaciones hace que dichos efectos presenten un amplio rango de incertidumbre. Ahora bien, cabe resaltar que los resultados emanados de investigaciones netamente in vitro y más aún sobre estudios de células animales nos brindan mecanismos y componentes teóricos válidos que por ningún motivo se pueden extrapolar al metabolismo del cuerpo humano. Particularmente, el metabolismo de la Cr haciendo uso del sistema de isoformas de CK ha sido una de las adaptaciones energéticas que ha adquirido el cuerpo humano, respaldado por el hecho que las isoformas de CK se encuentran en todos los procesos fisiológicos que involucren la hidrólisis de ATP para su funcionamiento. Yang et al. (2010) realizaron un nuevo hallazgo sobre la regulación del intercambiador de Na+/Ca2+ (presente principalmente en células cardíacas y neuronales), mediante análisis de coinmunoprecipitación, al mostrar que la región C-terminal de las isoformas mt-CK y M-CK interactúan con este importante regulador del flujo de Ca2+ en momentos de necesidad energética celular. Este hallazgo confirma la importancia del sistema Cr/PCr/CK durante el requerimiento energético en la mayoría de células de nuestro cuerpo, aparte de la inminente regulación de la concentración intracelular de Ca2+.
Está claro que la suplementación con Cr no incrementa las concentraciones de ATP en músculo en reposo pero se ha demostrado que ayuda a mantener las concentraciones de éste durante contracciones máximas debido al incremento de la concentración, tasa de resíntesis y mayor τ de PCr. Así, para que la suplementación con Cr sea efectiva, se deben incrementar las cantidades de TCr al interior del músculo contribuyendo a la reposición de PCr y ATP durante el ejercicio (Kreider 1998a; Wallimann 2008). Además, basándose en el modelo del control respiratorio establecido por Meyer (1989) se ha calificado a la reacción de la CK como un condensador químico que regula el metabolismo oxidativo, en donde la capacitancia es proporcional al contenido de TCr. En este sentido, al inicio del ejercicio de moderada intensidad, y en ausencia de alguna producción detectable de lactato, la hidrólisis de PCr llena el vacío entre el requerimiento energético y la energía producida por vías oxidativas representando una pronta fuente de energía disponible en el músculo esquelético (Francescato et al. 2008). Ahora bien, durante el ejercicio de alta intensidad y corta duración, el primer buffer regulador de la fatiga muscular (acumulación de Pi, IMP, H+, Ca2+, etc.) es la hidrólisis de PCr vía CK; así, el retraso de la fatiga tras la ingestión de Cr en este tipo de actividades puede provenir de la reducción de metabolitos implicados en la fatiga muscular permitiendo repeticiones explosivas y continuas en el entrenamiento de muchos deportes intermitentes en la mayoría de sujetos.
3. Fundamentos Metabólicos de la Suplementación con Creatina sobre la Síntesis de Proteína Muscular
El incremento en la síntesis de proteína muscular es uno de los efectos que conlleva la administración de Cr durante el ejercicio de resistencia. Sin embargo, se ha convertido en un importante punto de debate debido a los discordantes hallazgos de varias investigaciones (Louis et al. 2003a, b). No obstante, bajo el respaldo de trabajos que se vienen realizando desde hace dos décadas, que demuestran un incremento en el tamaño de las fibras musculares tras diferentes períodos de suplementación, está claro que la ingesta de Cr acompañada de un protocolo de ejercicios de resistencia optimiza notablemente la síntesis proteica evidenciada en el mayor tamaño de las fibras musculares en los sujetos suplementados en comparación con los sujetos control (Volek et al. 1999; Casey et al. 1996a; Williams et al. 1999; Willoughby & Rosene 2001; Kutz & Gunter 2003; Burke et al. 2003; Syrotuik & Bell 2004; Rawson & Persky 2007; Smith et al. 2006; Cribb & Hayes 2006; Cribb et al. 2007; Saremi et al. 2010); asimismo, estudios in vitro también han mostrado un incremento del diámetro de miotubos tras la administración de Cr con respecto a los controles (Ingwall 1976; Fry & Morales 1980; Deldicque et al. 2007; Deldicque et al. 2008; O’Connor et al. 2008; Ohira et al. 2011).
3.1. Creatina y el Regulador Principal de la Síntesis de Proteínas, mTOR
mTOR (mammalian target of rapamycin) es una proteína cinasa de 289 kDa, específica de Ser/Thr perteneciente a la clase de proteínas PI3K, caracterizada por ser un regulador clave en el control de la traducción. mTOR presenta diversos dominios reguladores que se encuentran al interior de un complejo que puede ser de dos tipos; mTORC1, el cual activa corriente abajo S6K1 (conocida también como p70s6k) y la proteína ligada al factor eucariótico de iniciación 4E (4E-BP1, eukaryotic initiation factor 4E binding protein) (Drummond et al. 2009), y mTORC2, el cual es requerido para la fosforilación y activación en el residuo de Ser 473, punto de máxima activación, de Akt/PKB por medio de la cual puede estar involucrado en la regulación de la iniciación y elongación de la traducción (Schiaffino & Mammucari 2011). Algunas investigaciones se han realizado con el objetivo de identificar el efecto de la suplementación con Cr sobre alguna de las proteínas involucradas en la cascada de señalización de mTOR. Deldicque et al. (2005) evaluaron el estado de fosforilación de S6K1 y 4E-BP1 tras la administración de Cr, encontrándose que tras 3 horas postejercicio el estado de fosforilación de S6K1 incrementó cerca del 400% en los grupos placebo (P<0.001) y Cr (P<0.05) con respecto a sus estados en el reposo. Sin embargo, el estado de fosforilación retornó a su valor basal a las 24 horas postejercicio observándose que la Cr no evidenció un efecto adicional sobre S6K1. Por otro lado, la fosforilación de la fracción γ de 4E-BP1 (la fracción γ representa la mayor forma fosforilada de la proteína) fue mayor en el grupo Cr con respecto al placebo a las 24 horas postejercicio, sin cambios notorios en otros momentos. En 2007, Deldicque et al. reportaron un incremento significativo en el estado de fosforilación de S6K1 con respecto al control, al exponer un cultivo de células musculares C2C12 a una concentración de Cr 5 mM. Posteriormente, Deldicque et al. (2008) evaluaron nuevamente el estado de fosforilación de S6K1 y 4E-BP1, mediante Western Blot, después de un periodo de suplementación con Cr (21 g día-1, grupo Cr) o maltodextrina (21 g día-1, placebo) durante 5 días, con la variante que las biopsias musculares del vasto lateral fueron tomadas pre-ejercicio, inmediatamente post-ejercicio, 24 horas post-ejercicio y 72 horas post-ejercicio para observar el efecto a largo plazo. Los resultados mostraron que inmediatamente post-ejercicio el estado de fosforilación de 4E-BP1 en Thr 37/46 (P<0.01) disminuyó en un 75% en el grupo de Cr con respecto al estado inicial. La misma tendencia de inhibición sobre S6K1, al analizar fosforilación en Thr 389, fue observada inmediatamente postejercicio aunque sin significancia estadística. A las 24 horas postejercicio, dos de los nueve sujetos mostraron un elevado estado de fosforilación de S6K1 mientras el resto permaneció sin cambio alguno. En el grupo Cr disminuyó el estado de fosforilación de 4E-BP1 a las 24 horas postejercicio en un 30% con respecto al placebo (P<0.05). De esta manera, los resultados de estas investigaciones parecen no mostrar efecto alguno de la suplementación con Cr sobre la actividad de S6K1; no obstante, parece interesante que la asociación de la fosforilación de esta cinasa y la masa muscular haya sido demostrada en humanos después de 12 semanas de entrenamiento en ejercicios de resistencia (Drummond et al. 2009), lo que haría necesario la evaluación del efecto de la ingesta de Cr sobre S6K1 a largo plazo y no un efecto inmediato a los 5 días de suplementación como se ha pretendido hasta ahora. Por otro lado, aunque existe una inhibición potencial de 4E-BP1, el supresor de la traducción, hay que tener en cuenta que se ha establecido de manera general que la fosforilación de 4E-BP1 se reduce durante el ejercicio de resistencia y se mantiene aún durante la recuperación postejercicio, lo que indicara que el incremento en la síntesis de proteína muscular inducido por las contracciones musculares es independiente de los cambios en la fosforilación de la 4E-BP1 (Drummond et al. 2009).
3.1.1. Activación de mTOR - Posible efecto indirecto mediado por la Creatina
Se ha demostrado que Akt/PKB puede activar directamente el complejo mTORC1 mediante fosforilación o indirectamente fosforilando e inhibiendo los complejos de esclerosis tuberosa 1 y 2 (TSC1/TSC2), además un nuevo regulador negativo de mTORC1 es el sustrato-40 de Akt rico en prolina (PRAS40, proline-rich Akt substrate-40) el cual es caracterizado por unirse a mTOR vía raptor bloqueando la señalización de mTORC1 (Schiaffino & Mammucari 2011). Adicionalmente, mTORC1 es también regulado positivamente por aminoácidos, particularmente leucina, en donde han sido implicadas dos proteínas: la proteína vacuolar tipo-34 (Vps34) y la proteína cinasa cinasa cinasa cinasa-3 mitogénica activada (MAP4K3, mitogen activated protein kinase kinase kinase kinase-3) (Mackenzie et al. 2009). Por último, debido a que la síntesis de proteínas es un proceso celular energéticamente costoso existe un regulador específico en la función de mTORC1 cuando la energía no es suficiente; así, mTORC1 es inhibido por la proteína cinasa estimulada por AMP (AMPK, AMP-activated protein kinase) a través de un incremento en la actividad de TSC2 y por fosforilación directa del raptor (Drummond et al. 2009). Teniendo en cuenta los tres pilares de regulación de mTOR es probable considerar un efecto indirecto sobre mTOR tras la suplementación con Cr.
3.1.1.1. Creatina y activación de la cascada de señalización de IGF-I/Akt-PKB
Deldicque et al. (2005) evaluaron el efecto que tiene la administración de Cr en fases de pre y postejercicio sobre el ARNm de IGF-I e IGF-II. Para esto realizaron un diseño de doble ciego con seis hombres físicamente activos, tres sujetos tomaron 21 g de Cr durante 5 días (grupo Cr) y los otros tres ingirieron 21 g de maltodextrina (grupo placebo), que fueron sometidos a series de 10 repeticiones de press de pierna al 70% de su volumen de carga máxima. Al analizar las biopsias del vasto lateral mediante el análisis de la Reacción en Cadena de la Polimerasa en Tiempo Real (RT-PCR, Real Time - Polymerase Chain Reaction) se observó que en la biopsia preejercicio del grupo Cr se expresó más ARNm para el IGF-I (+30%, P<0.05) e IGF-II (+40%, P=0.054) en comparación con el placebo, aunque no hubo un efecto adicional después del ejercicio. Luego, Burke et al. (2008) demostraron que la suplementación con Cr acompañada de un programa de ejercicios de resistencia incrementa la concentración intramuscular de IGF-I al realizar un estudio con 42 sujetos, 24 hombres y 18 mujeres con una experiencia mínima de un año en ejercicios de resistencia, quienes fueron asignados aleatoriamente a los grupos Cr (0.25 g Cr por Kg de masa magra durante 7 días seguido de 0.06 g Cr por Kg de masa magra durante 49 días; 12 hombres y 10 mujeres) o placebo (12 hombres y 8 mujeres), realizando un programa de entrenamiento de resistencia durante 8 semanas. Los resultados de los análisis inmunohistoquímicos mostraron una mayor acumulación de IGF-I intramuscular en el grupo Cr (+78%) con respecto al placebo (+54%; P=0.06) demostrando que la suplementación con Cr aumenta el contenido de IGF-I muscular después de entrenamiento de resistencia de alta intensidad en humanos. Por otro lado, Deldicque et al. (2007) encontraron un incremento del 60% (P<0.001) en el estado de fosforilación de Akt/PKB a las 72 y 96 horas del proceso de diferenciación celular in vitro, además GSK3β también evidenció un aumento significativo en el estado de fosforilación al final de la diferenciación (+70%, P<0.001), sugiriendo un efecto mediador de la Cr sobre ciertas proteínas corriente arriba que regulan el estado de fosforilación de la Akt/PKB, resaltando la vía IGF-I/PI3K. Se ha demostrado que el estado de fosforilación de Akt/PKB y GSK3β se ve incrementado a las pocas horas de realizar ejercicio de resistencia a una intensidad moderada; de acuerdo con esto, Snow et al. (2008) determinaron los efectos de un protocolo de ejercicios de resistencia con y sin administración de Cr sobre el estado de fosforilación de algunas proteínas involucradas en la cascada de Akt/PKB. Para cumplir con este objetivo 16 hombres fueron suplementados aleatoriamente con 0.4 g Kg-1 de monohidrato de Cr + 0.4 g Kg-1 de glucosa (grupo Cr) o 0.8 g Kg-1 de glucosa (grupo placebo) durante 5 días y se ejercitaron a una sola pierna en cicla estática al 65% de su consumo máximo de oxígeno (VO2) hasta el agotamiento. Las proteínas citosólicas y nucleares fueron separadas y los niveles de fosforilación de Akt/PKB, GSK3β, mTOR, 4E-BP1, FOXO 1 y FOXO 3a fueron analizados por Western Blot observándose un aumento significativo en el estado de fosforilación de Akt/PKB (activada) y de GSK3β (inhibida), en el grupo Cr con respecto al placebo, a los 1 y 5 días. No hubo efectos importantes en los niveles de fosforilación de mTOR, 4E-BP1, FOXO 1 y FOXO 3a. Safdar et al. (2008) reportaron un incremento en el contenido de ARNm (2.1 veces) y proteína (4.2 veces) de Akt/PKB en el músculo esquelético de 6 hombres bajo un protocolo de ingesta aguda de Cr con respecto al placebo (Figura 4). Recientemente, Caretti et al. (2010) encontraron que al exponer un cultivo de cardiomiocitos isquémicos H9c2 a una concentración 2.5 mM Cr + 5 mM D-Ribosa el estado de fosforilación de Akt/PKB incrementó significativamente con respecto al control. De esta manera, se puede relacionar el incremento en masa magra reportado después de la suplementación con Cr con la estimulación de varias vías de señalización relacionadas con IGF-I, entre las que se destaca la vía PI3K/Akt-PKB/mTOR la cual juega un importante rol en la regulación de la hipertrofia muscular. Haciendo a un lado el efecto directo que tiene Akt/PKB sobre la maquinaría proteica de mTOR y específicamente sobre raptor, GSK3β ha sido relacionada en la hipertrofia de miotubos gracias a un mecanismo descrito recientemente. GSK3β es capaz de fosforilar e inhibir a la nebulina localizada sobre el disco Z del sarcómero, previniendo así la interacción entre ésta con la proteína del síndrome neuronal Wiscott-Aldrich (N-WASP, neuronal Wiscott-Aldrich syndrome protein), la cual está implicada en el ensamblaje y polimerización de la actina, y en sí sobre el proceso de miofibrilogénesis (Schiaffino & Mammucari 2011). Así, se podría inferir que el efecto que tiene la suplementación con Cr sobre la cascada de señalización IGF-1/Akt controla el crecimiento miofibrilar y su mantenimiento por medio de la vía GSK3β/nebulina/N-WASP.
3.1.1.2. Creatina y homeostasis de algunos aminoácidos
Parise et al. (2001) demostraron que la suplementación con Cr sin presencia de un programa de ejercicios reduce la tasa de flujo y la oxidación de leucina, solamente en hombres, sugiriendo que la ingesta de Cr atenúa la relación de degradación de ciertas proteínas manifestada en la disminución de la cinética de leucina sérica e intramuscular. Por otro lado, Derave et al. (2004) llevaron a cabo un estudio de doble ciego con 16 jóvenes (12 hombres y 4 mujeres entre los 18.8 ± 0.3 años) durante 20 semanas utilizando un protocolo de ingesta aguda de Cr y analizando el efecto sobre algunos compuestos guanidino. Para el análisis de las muestras plasmáticas se utilizó un analizador de aminoácidos adaptado a la determinación de compuestos guanidino, además estos compuestos fueron separados en una columna de intercambio catiónico y posteriormente detectados por fluorescencia usando el método de ninhidrina, incluyendo Cr y Crn en la detección (las medidas se llevaron a cabo en la línea base y las semanas 1, 10 y 20 post-suplementación). En el grupo Cr se detectó que los niveles plasmáticos de Cr fueron 10 veces más altos que la línea base después de la fase de carga y permanecieron 5 veces más altos durante las restantes 19 semanas de investigación, soportando el incremento observado en otros estudios. Los resultados mostraron que las concentraciones plasmáticas de arginina estuvieron entre 80-100 μM durante todo el tiempo del estudio; no obstante, a la altura de la semana 20 las concentraciones de este aminoácido fueron significativamente diferentes entre el placebo y Cr, 88.8 y 98.3 μM respectivamente (P<0.05). Interesantemente, varios de los metabolitos fueron sensibles a la suplementación con Cr, por ejemplo los niveles de L-homoarginina estuvieron elevados durante la semana de suplementación con Cr a altas dosis (20 g día-1, semana 1), es substancial notar que la L-homoarginina puede reemplazar a la arginina como sustrato de la óxido nítrico sintasa (NOS) en la formación de óxido nítrico (NO). En este sentido, los autores sugirieron que la incrementada disponibilidad de L-homoarginina conlleva a una inhibición de la síntesis de guanidinosuccinato desde argininosuccinato, posiblemente debido a que el incremento de L-homoarginina permite un aumento en la producción de NO y una menor disponibilidad de radicales hidroxilo necesarios para la formación de argininosuccinato. De acuerdo con lo anterior, los resultados mostraron que tras la ingesta de Cr los niveles de guanidinosuccinato disminuyeron desde 290 nM, línea base, hasta 214 nM después de la primera semana de suplementación. Así, estos datos sugieren que el aumento de la concentración plasmática de L-homoarginina tras el consumo de Cr puede influenciar vías secundarias de los compuestos guanidino, entre las que se destacan la generación de NO. Un incremento en el flujo sanguíneo muscular mediado por una mayor producción de NO, ya sea por arginina u homoarginina, podría canalizar una alta proporción de aminoácidos absorbidos hacia el músculo (Paddon-Jones et al. 2004). En circunstancias en las cuales los niveles plasmáticos de aminoácidos esenciales (AAEs) exceden sus concentraciones en el músculo, se puede esperar que un aumento en la distribución de AAEs, por un flujo sanguíneo estimulado, resulte así en un incremento en la cinética hacia el miocito e incorporación a las proteínas musculares. Ésta posibilidad es soportada por el hecho que la ingestión de AAEs inmediatamente antes del ejercicio de resistencia (el flujo sanguíneo muscular es alto durante el ejercicio) provoque una mayor respuesta anabólica en la proteína muscular que cuando los mismos aminoácidos son ingeridos después del ejercicio cuando el flujo sanguíneo muscular retorna a su estado basal (Paddon-Jones et al. 2004). Las propiedades vasodilatadoras de la arginina/L-homoarginina parecen mejorar la tolerancia al ejercicio en la mayoría de la población por medio de un incremento en el flujo sanguíneo coronario y/o periférico. En tales instancias, las propiedades vasodilatadoras facilitan un aumento en la distribución de O2, el cual ayuda a sufragar la alta demanda causada por la actividad física, además en algunas instancias la arginina/L-homoarginina puede actuar como un secretagoge promoviendo la liberación de la hormona del crecimiento por medio de una inhibición en la secreción de somatostatina (Paddon-Jones et al. 2004). De acuerdo con esto, Schedel et al. (2000) reportaron un incremento significativo (80%) en los niveles de la hormona del crecimiento en respuesta a la ingesta de 20 g Cr día-1. A pesar de las relaciones descritas, Jahangir et al. (2009) determinaron los efectos de la Cr sobre la vasodilatación endotelial en pacientes con enfermedad arterio-coronaria, encontrando que la administración de este compuesto no altera la acción de la L-arginina sobre la función vascular. Sin embargo, se requiere mayor investigación en cuanto a la evaluación de un posible efecto vasodilatador de la Cr en sujetos saludables y más aún en individuos ejercitados físicamente. Resaltando la función que tendría un incremento en la concentración de leucina intramuscular sobre la regulación de mTOR, Mackenzie et al. (2009) mostraron que sesiones de contracciones de alta resistencia en ratas aumentan la concentración de leucina e incrementaron la actividad de Vps34 y S6K1. El tiempo de curso de la activación de S6K1 sugiere que Vps34 no está involucrada en la activación temprana de S6K1 pero puede jugar un rol prolongado en la activación de mTORC1, esto significa que un incremento en la concentración de aminoácidos tras ejercicio de resistencia es un resultado directo del tipo de sesión de entrenamiento. Curiosamente, un incremento del 17.5% de leucina genera una máxima fosforilación de S6K1 en ovocitos, lo que implica que Vps34 puede ser activada de manera secundaria por un incremento de leucina intramuscular generada desde la degradación proteica o la acelerada entrada de BCAAs al músculo después de las contracciones de resistencia, esto fue demostrado por Mackenzie et al. (2009) al exponer un cultivo de células C2C12 a leucina 320 μM. Es importante notar que Vps34 no es la única cinasa que podría ligar los aminoácidos a mTOR ya que las MAP4K3 son otra clase de cinasas que son sensibles a los aminoácidos y activan S6K1 pero no Akt/PKB y por lo tanto no son activadas por insulina (Mackenzie et al. 2009; Drummond et al. 2009). En resumen, se podría relacionar el efecto que tiene la suplementación con Cr sobre la regulación de la cinética de leucina, la mayor disponibilidad de arginina/L-homoarginina y la posible activación de mTOR vía Vps34 y otras rutas de señalización sensibles a la concentración de aminoácidos.
3.1.1.3. Creatina y la posible Inactivación de AMPK
La gran mayoría de las investigaciones centradas en la suplementación con Cr han demostrado un incremento en el contenido de Cr muscular (en promedio, 35% grupo Cr versus 7% grupo placebo) y en la síntesis de PCr muscular tras los periodos de suplementación. Igualmente, se ha mostrado un incremento general del 10-40% en las reservas de Cr y PCr muscular usando el protocolo de ingesta aguda (Greenhaff 1996; The American The American College of Sports Medicine Roundtable 2000). Ponticos et al. (1998) elucidaron un mecanismo complejo de regulación de AMPK por la PCr y la Cr. Los autores mostraron in vitro que las concentraciones intramusculares de PCr inhiben AMPK y que la Cr antagoniza esta inhibición, lo que implica que AMPK es sensible a la relación PCr/Cr más que a la concentración de cada metabolito. Así, un descenso de la relación PCr/Cr permite la activación de AMPK, de la misma manera que una reducción de la relación ATP/AMP activa esta cinasa en el hígado (Kemp et al. 1999; Jørgensen et al. 2006). Debido a que la activación de AMPK se da en respuesta a un descenso de recursos energéticos durante la contracción muscular, permitiendo la activación corriente abajo de proteínas reguladoras de la oxidación de CHO y lípidos, un incremento en el rendimiento energético gracias al aumento del sistema de fosfágenos tras la suplementación con Cr (Greenhaff et al. 1994; Hultman et al. 1996; Williams et al. 1999; Mesa et al. 2002) permitiría la inhibición directa y/o temporal sobre AMPK durante el trabajo muscular. Adicionalmente, Gallo et al. (2008) mostraron que la suplementación con Cr en ratas previene el incremento en la expresión de citrato sintasa y 3-hidroxiacil-CoA deshidrogenasa tras ejercicio aeróbico, teniendo en cuenta que la expresión de estas enzimas de referencia mitocondrial aumenta significativamente después de este tipo de entrenamiento con respecto al control no ejercitado. De hecho, la ausencia de un incremento del contenido de citrato sintasa y 3-hidroxiacil-CoA deshidrogenasa tras la administración con Cr coincide con una posible inhibición de AMPK, cuya activación está relacionada directamente con la biogénesis mitocondrial (Jørgensen et al. 2006). En contraste, Ceddia & Sweeney (2004) reportaron que la exposición por 48 horas de Cr 0.5 mM en un cultivo de células musculares de rata L6 aumenta en dos veces el estado de fosforilación de las subunidades de AMPK, justificado por una disminución en la relación de PCr/Cr desde 0.67 a 0.37 lo que habría causado la activación de AMPK. Aunque en este estudio las células musculares fueron incubadas en un medio con una concentración fisiológica de Cr, las concentraciones de Cr y PCr incrementaron nueve y diez veces, respectivamente, datos que se encuentran lejos del incremento promedio de estos metabolitos (~10-40%) tras la suplementación con Cr en músculos humanos (Kreider & Jung 2011). Por otro lado, Op’t Eijnde et al. (2005) al analizar los efectos de la inmovilización (2 semanas) y entrenamiento de rehabilitación (6 semanas) en combinación con la ingesta de Cr sobre la expresión y estado de fosforilación de AMPK encontraron que la inmovilización no afectó significativamente la expresión de las subunidades α1, α2 o β2 ni el estado de fosforilación de AMPK α1 en los grupos placebo y Cr. Además, independiente del suplemento recibido, el reentrenamiento incrementó el estado de fosforilación de AMPK en un ~25% (P<0.05) con respecto a la línea base sin diferencias entre los grupos. En consecuencia, aunque los estudios realizados que han evaluado la actividad y expresión de AMPK en periodos de administración de Cr no han evidenciado resultados reproducibles, es posible que tras la normalización de estudios y al utilizar protocolos de suplementación que contribuyan a un incremento de la tasa PCr/Cr, en sujetos que respondan a la suplementación con Cr, se inhiba temporalmente AMPK durante entrenamiento de resistencia.
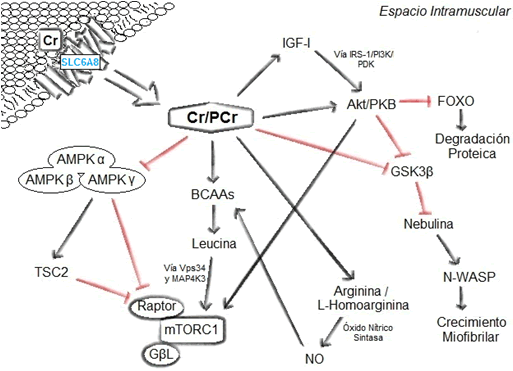
Figura 3. Posible regulación ejercida por la Cr sobre mTOR. Tras la suplementación con Cr ésta ingresa al interior del miocito a través del CreaT/SLC6A8 incrementando la relación tisular PCr/Cr. Durante el ejercicio de resistencia la aumentada relación PCr/Cr, además de prevenir energéticamente el agotamiento de ATP, incrementa el estado de fosforilación de Akt/PKB y posiblemente inhiba AMPK permitiendo la activación indirecta de mTOR. Además, la homeostasis de algunos aminoácidos, especialmente leucina, regularía igualmente mTOR. (Para detalles ver las páginas anteriores).
En resumen, se evidencian diferentes efectos de la suplementación con Cr adjunta o no a un protocolo de entrenamiento de resistencia sobre la regulación de distintas biomoléculas que posiblemente medien la activación mTOR. En la Figura 3 se recapitula gráficamente la regulación indirecta que probablemente proporcione la administración de Cr a la activación de mTOR durante y después del desarrollo de ejercicios de resistencia.
3.2. Creatina y Diferenciación Celular - Relación con Hipertrofia
3.2.1. Creatina e Hinchamiento Celular ‘Cell Swelling’
En general, la mayoría de las investigaciones centradas en la evaluación de los efectos de la suplementación con Cr han reportado un incremento en el contenido de volumen del fluido intracelular sin cambios notorios en el volumen del espacio externo de la célula (Ziegenfuss et al. 1998, 2000; Volek et al. 2001; Kilduff et al. 2004; Safdar et al. 2008; Lopez et al. 2009). Se ha postulado que la razón del incremento de agua intracelular es la elevada carga osmótica asociada con el incremento en la concentración de Cr al interior de la célula tras el periodo de suplementación (Bemben & Lamont 2005). Muchos aminoácidos, incluyendo la Cr, ingresan al interior de la célula por sistemas de transporte dependientes de Na+, los cuales convierten la energía del gradiente electroquímico del Na+ a través de la membrana plasmática en gradientes de aminoácidos activos osmóticamente en donde cada gradiente provoca un tránsito de agua al interior de la célula estimulando el hinchamiento celular (Haussinger et al. 1993). Además, una vez al interior de la célula, la PCr, gracias a su naturaleza de zwitterion estabiliza la membrana plasmática uniéndose a las cabezas de los fosfolípidos disminuyendo la fluidez membranal y la pérdida del contenido citoplasmático (Persky & Brazeau 2001; Rawson & Persky 2007). Ahora bien, existe evidencia trascendental de que el estado de hidratación celular es un importante factor que controla el turnover celular (el término turnover hace referencia tanto a la síntesis como a la degradación proteica (Chicharro & Fernández 2006)); de esta manera, un incremento en la hidratación celular actúa como una señal proliferativa anabólica mientras que el encogimiento celular es catabólico y antiproliferativo (Haussinger et al. 1993). Se ha postulado que un aumento del volumen celular puede estimular PI3K y activar la cascada de las MAPK conllevando a la activación de p38, JNK/SAPK o las isoformas de ERK (Lang et al. 1998). Adicionalmente, la esfingosina cinasa (SPHK1), enzima que cataliza la fosforilación de esfingosina a esfigonsina-1-fosfato (S1P), también es activada por un incremento en el volumen celular y se encuentra relacionada con el proceso de proliferación y diferenciación miocelular debido a que S1P es una molécula bioactiva que se une a los receptores de S1P activando vías mitogénicas de señalización que involucran las MAPK, PLD y Rho (Murray et al. 2003; Krauss 2003). En este sentido, Safdar et al. (2008) examinaron el efecto de un periodo de suplementación con Cr (20 g día-1 x 3 días seguido de 5 g día-1 x 7 días) o dextrosa (grupo placebo), en ausencia de ejercicio, sobre la expresión de genes, ARNm y proteína de una amplia gama de moléculas osmosensibles utilizando microarreglos (~7500 genes), RT-PCR y el análisis de proteínas cinasas KPKS 1.0 Kinetworks (78 proteínas) en biopsias del vasto lateral. Los resultados mostraron un incremento significativo (5 veces con respecto al placebo) en la expresión del ARNm y contenido proteico del gen de SPHK1, al igual que un aumento significativo en otros genes osmosensibles implicados en la traducción de señales (Figura 4A). El estudio de Safdar et al. (2008) también reveló un incremento significativo con respecto al placebo en el contenido de proteína y ARNm de las MAPK terminales p38 y ERK6 (Figura 4B). La activación de p38-MAPK es necesaria durante el proceso de diferenciación miogénica, además de estar implicada en el metabolismo de la glucosa y el gasto energético (Akimoto et al. 2005). p38 puede ser activada por insulina en varios sistemas celulares incluyendo miotubos L6 (Al-Khalili et al. 2004).
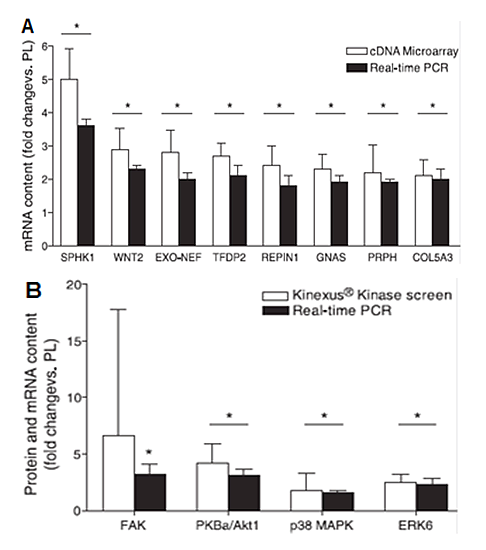
Figura 4. Efecto de la suplementación con Cr sobre la expresión de genes osmosensibles in vivo. A, contenido de ARNm [promedio de veces vs. placebo (PL)] de los 8 genes en los que aumentó significativamente la expresión después de la suplementación con monohidrato de Cr utilizando microarreglos de ADNc y RT-PCR. B, contenido de proteína y ARNm [promedio de veces vs. placebo (PL)] de los 4 genes en los que aumentó significativamente la expresión después de la suplementación con Cr utilizando el análisis de cinasas Kinexus y RT-PCR. Para ambas gráficas, los datos son promedios ± SD. * Diferencia significativa con respecto al placebo, P<0.05. Reproducido con autorización de Safdar et al. 2008.
Los mecanismos bajo los cuales p38 regula la adaptación muscular tras el entrenamiento de resistencia fueron descritos por Akimoto et al (2005) quienes reportaron, en respuesta a una sesión voluntaria de ejercicio inducido en ratones, un incremento en la expresión del ARNm del proliferador activado por el receptor γ co-activador 1α (PGC-1α), el cual promueve la biogénesis mitocondrial y la formación de fibras tipo I en el músculo esquelético, además de la simultánea activación de la vía p38. Deldicque et al (2007) encontraron que la adición de Cr a un medio de cultivo de células miogénicas C2C12 anticipó los cambios en el estado de fosforilación de p38, disminuyendo tempranamente el nivel de fosforilación y maximizando el incremento del mismo, además de generar mayor expresión de la cadena pesada de miosina (MHC) II. Este efecto potencial sobre p38 fue evaluado utilizando SB 202190, un inhibidor de p38, el cual abolió completamente la expresión de MHC II mientras que la adición de Cr no pudo revertir este efecto, sugiriendo un rol principal de p38 durante el crecimiento miocelular. Sin embargo, Deldicque et al. (2008) no reportaron efecto alguno sobre el estado de fosforilación de p38 tras la administración de Cr (21 g día-1 x 5 días) en sujetos que realizaban una sesión de entrenamiento de resistencia. Ahora bien, aunque las MAPK están implicadas en la diferenciación celular también son conocidas por inducir apoptosis, siendo JNK/SAPK más preponderante; sin embargo, un estudio realizado por Caretti et al. (2010) ha demostrado que la administración de Cr + D-ribosa a cardiomiocitos expuestos a condiciones propensas a apoptosis, isquemia e interacción con doxorubicina, disminuye el nivel de muerte celular en un 30% tras un análisis microscópico utilizando azul de tripan y MTT posiblemente a través de una modulación de caspasa-3.
En resumen, el incremento en el estado de hidratación celular tras la suplementación con Cr probablemente genera un aumento en el proceso de miogénesis, el cual a su vez involucra progresivamente la proliferación, diferenciación y fusión de mioblastos a través de SPHK1/MAPK y otras moléculas señalizantes. Además, las similitudes en los cambios en la cinética de la leucina observados tras la ingesta de Cr en la investigación de Parise et al. (2001) con las infusiones salinas hipo-osmóticas, sugieren que el monohidrato de Cr puede atenuar el balance de fluido celular y reducir la proteólisis tanto como la oxidación de leucina.
3.2.2. Creatina y Factores Reguladores Miogénicos
Requiere especial atención el efecto que tiene la suplementación con Cr sobre los factores de transcripción miogénicos, el destino de activación final de las cascadas de señalización analizadas anteriormente, que influyen directamente sobre el proceso de diferenciación celular. La diferenciación del músculo esquelético sigue un programa específicamente regulado por la expresión de genes. Varias proteínas son esenciales para la diferenciación incluyendo los factores de transcripción miogénicos básicos helix-loop-helix (bHLH) MyoD, Miogenina, Myf5 y MRF4/Myf6/Herculin (también conocidos como factores reguladores miogénicos, MRFs) y otros factores transcripcionales como el MEF2, sustrato directo de p38-MAPK (Perry & Rudnicki 2000). En primer lugar, la familia de factores de transcripción MEF2 tiene un papel clave en la diferenciación muscular y en la activación de genes asociados a la regeneración muscular como la cofilina (una proteína reguladora de actina) y la vimentina. Son cuatro las isoformas de MEF2 (A-D) que han sido identificadas y todas excepto MEF2-B son expresadas en el músculo esquelético. En miotubos diferenciados, MEF2 está localizado en el núcleo en donde se une a secuencias específicas de ADN, incluyendo las de los MRFs, activando su transcripción. Estos factores actúan en múltiples puntos del lineamiento miogénico para establecer la identidad de mioblastos y el control terminal de la diferenciación (Al-Khalili et al. 2004). En el trabajo de Deldicque et al. (2008) se evidenció un aumento del doble en el nivel de expresión de MEF2 en el núcleo con respecto al estado inicial tras la suplementación con Cr. Aunque en el estudio anterior no se observaron diferencias significativas de la expresión mionuclear de MEF2 entre los grupos Cr y placebo, Ju et al. (2005) reportaron un aumento significativo en las isoformas musculares de MEF-2 en ratas alimentadas con Cr (2% dieta) con respecto a los grupos control (Figura 5).
Fig. 5 Efecto de la administración de Cr sobre las isoformas de MEF2 en ratas. Se pueden observar los Blots representativos y sus respectivas cuantificaciones densitométricas para las isoformas MEF-2A (A), MEF-2C (B) y MEF-2D (C) en los extractos nucleares de los músculos extensor largo de las ratas control y las alimentadas con Cr. arb. units.; unidades arbitrarias. * Diferencia significativa con respecto al control, P<0.05. Reproducido con autorización de Ju et al. 2005.
Los MRFs son necesarios para la determinación, terminación de la diferenciación y mantenimiento del músculo esquelético. La sobreexpresión de estos factores convierte células no musculares en una línea miogénica, además la habilidad de cada factor de iniciar la expresión de uno o más de los otros tres MRFs sugiere que estos forman un loop regulador cruzado. Experimentos enfocados en la activación de genes por los MRFs sugieren que MyoD y Myf5 actúan en la determinación del linaje del mioblasto mientras Miogenina y MRF4 son importantes para la diferenciación y mantenimiento del estado final de este proceso (Perry & Rudnicki 2000), además se ha evidenciado que estos MRFs se unen a las regiones promotoras y enhancers corriente abajo de algunos genes específicos musculares como el MHC, α-actina, TpI y CK (Willoughby & Rosene 2003). Hespel et al. (2001) investigaron el efecto de la suplementación oral con Cr durante un periodo de inmovilización-rehabilitación y subsecuente ejercicio de pierna sobre la expresión de factores de transcripción miogénicos en humanos, encontrando que la expresión de los MRFs no evidenció cambio alguno durante las tres primeras semanas de investigación en ambos grupos; sin embargo, a la altura de la semana 10 de rehabilitación la expresión de Miogenina fue mayor en el grupo placebo pero no en el de Cr, mientras que en éste último grupo se evidenció un mayor contenido de MRF4 en relación al placebo (P<0.05). En adición, el cambio en la expresión de MRF4 correlacionó con el incremento en el diámetro de la fibra muscular (r=0.73, P<0.05). Al finalizar la investigación no se encontraron cambios significativos en la expresión de Myf5 y MyoD. Consecutivamente, Willoughby & Rosene (2003) examinaron el efecto de 12 semanas de suplementación con Cr y ejercicio pesado de resistencia (3 veces a la semana 3 sets de 6-8 repeticiones al 85-90% de la repetición máxima de press de pierna, extensión de rodilla y curl de pierna) sobre la expresión de CK, MyoD, Miogenina, MRF4 y Myf5 mediante un estudio de doble ciego. Después del entrenamiento, la expresión del ARNm de CK, así como la expresión de proteína y ARNm de Miogenina y MRF4, incrementó significativamente en el grupo Cr con respecto al placebo y al control. En el caso de la proteína y ARNm del MyoD, los grupos Cr y placebo presentaron mayores diferencias en relación al control (P<0.05) pero sin diferencias entre ellos mismos. No fueron encontradas diferencias significativas en la proteína ni el ARNm del Myf5. La expresión de los ARNm para los diferentes tipos de MHC y para CK ha sido caracterizada por estar regulada a nivel pretraduccional por los MRFs, de tal manera que la suplementación con Cr y el ejercicio de resistencia, al incrementar la expresión de estos factores de transcripción podría sustentar el efecto notable sobre la expresión de las diferentes isoformas de MHC (Willoughby & Rosene 2001) y CK muscular (Willoughby & Rosene 2003). No obstante, Machado et al. (2009) demostraron que la suplementación con Cr durante ejercicio de resistencia no tiene efecto alguno sobre la actividad de CK sérica, la cual se usa como un marcador fisiológico de ciertos desordenes miopáticos y musculares. Por otro lado, la miostatina (también conocida como factor de crecimiento y diferenciación 8, GDF8) es un miembro de la superfamilia TGFβ que actúa sobre el músculo esquelético como un inhibidor del crecimiento. En experimentos utilizando la mutación de genes, se ha encontrado que la supresión de miostatina en células musculares causa hipertrofia muscular mientras que un incremento de miostatina es acompañado de atrofia muscular. Saremi et al. (2010) realizaron un estudio para analizar mediante ELISA el efecto de la suplementación con Cr durante 8 semanas de entrenamiento de resistencia sobre los niveles de miostatina en suero y el factor de crecimiento y diferenciación asociado a la proteína-1 del suero (GASP-1, growth and differentiation factor-associated serum protein-1) en hombres. GASP-1 ha sido recientemente definido como una proteasa que se une directamente a la miostatina madura y su propéptido inhibiéndola, de este modo tiene un rol crítico controlando la función de esta molécula catabólica muscular. El ejercicio de resistencia causó una disminución significativa en los niveles de miostatina en suero, así como un incremento en GASP-1. Precisamente los niveles de GASP-1 fueron incrementados en los grupos Cr y placebo desde la línea base hasta la semana 8 sin evidenciarse diferencias entre ambos grupos. No obstante, el grupo Cr mostró una mayor reducción de miostatina sérica entre las semanas 4 y 8 en comparación con el grupo placebo (P<0.05). Este es el primer estudio en demostrar que la ingesta de Cr junto con un programa de entrenamiento de resistencia amplifica el efecto inducido por el ejercicio sobre los niveles de miostatina en suero, además de ratificar los incrementos en la fuerza y masa muscular.
3.2.3. Creatina y Fusión de Mioblastos
La formación y el crecimiento de las miofibras o miotubos son reguladas por dos tipos eventuales de fusión; en el primero, los mioblastos diferenciados se fusionan entre ellos para formar pequeños miotubos que contienen pocos núcleos; mientras en el segundo tipo, los mioblastos diferenciados se fusionan con las células de los miotubos existentes formando miofibras más largas que contienen múltiples núcleos. La fusión celular es un proceso ordenado que involucra la migración, el contacto célula-célula y la adhesión a través del alineamiento y fusión de membranas plasmáticas (O’Connor et al. 2008). Antes y durante la fusión ocurre una extensiva reorganización citoesquelética donde los ensamblajes dinámicos que regulan la fusión celular son dependientes de la hidrólisis de ATP, si bien la polimerización y disociación de los monómeros de actina puede requerir hasta el 50% del gasto energético celular (Perry & Rudnicki 2000). O’connor et al. (2008) realizaron un completo estudio para identificar el efecto que tiene la administración de Cr in vitro e in vivosobre la fusión de mioblastos de ratón Balb/c con miotubos desarrollados. Al exponer los cultivos de mioblastos a diferentes concentraciones de monohidrato de Cr los autores encontraron principalmente los siguientes efectos: 1) la Cr incrementa la adición mionuclear y el crecimiento de miotubos a una concentración 12.5 mM. 2) El crecimiento mediado por la Cr es dependiente de la polimerización de actina, como revelo el análisis con lacuntrulina B. 3) La motilidad celular no es alterada tras el tratamiento con Cr. 4) La actividad de CK es necesaria para la adición de mionúcleos mediada por la Cr. Por último, 5) La Cr incrementa la regeneración de miofibras in vivotras la lesión del músculo tibial anterior con una inyección intramuscular de BaCl2. En este sentido, el músculo esquelético presenta una remarcada capacidad para adaptarse a demandas fisiológicas como el crecimiento, el entrenamiento y las lesiones. Los procesos por los cuales estas adaptaciones ocurren son generalmente atribuidos a la pequeña población de células satélite que reside en el músculo esquelético adulto (Al-Khalili et al. 2004). Las células satélite están localizadas entre el sarcolema y la lámina basal de la fibra muscular (Perry & Rudnicki 2000), siendo físicamente distintas a estas últimas, y permaneciendo normalmente en un estado no proliferativo e inactivo (Al-Khalili et al. 2004). No obstante, en respuesta a estímulos como miotraumas, las células satélite comienzan a activarse, proliferar y expresar marcadores miogénicos, cuando realizan este último proceso son también llamadas mioblastos. Finalmente, estas células se fusionan con las fibras musculares existentes agrandándolas o se fusionan entre ellas para formar nuevas miofibras durante la regeneración del músculo esquelético dañado (Al-Khalili et al. 2004). Justamente, el crecimiento muscular adulto ocurre a través de la hipertrofia de las miofibras vía IGF-I, la cual se correlaciona con un incremento en el número de mionúcleos, siendo la célula satélite la fuente de nuevos mionúcleos (Barton-Davis et al. 1999); asimismo, Gerber et al. (2005) ya habían demostrado un incremento en el proceso de diferenciación en un cultivo de osteoblastos tras la exposición con Cr vía IGF-I. Estudios en humanos han reportado que el entrenamiento de resistencia incrementa la proporción de células satélite y el número de mionúcleos en los músculos entrenados lo cual sugiere que el entrenamiento induce la activación de este tipo de células como un mecanismo adaptivo durante la hipertrofia muscular; de acuerdo con esto, el trabajo de Olsen et al. (2006) mostró que la suplementación con Cr (6 g Cr + 14 g CHO día-1) en sujetos que realizan un protocolo de entrenamiento de resistencia (16 semanas) aumenta la proporción de células satélite con respecto al grupo placebo, además de incrementar el número de mionúcleos por fibra. Dangott et al. (2000) ya había reportado un incremento en la actividad mitótica de las células satélite en el músculo esquelético de ratón tras un periodo de suplementación con Cr.
En resumen, la suplementación con Cr en presencia de un programa de entrenamiento de resistencia incrementa la masa muscular a través de la activación de diversos objetivos que regulan positivamente la síntesis de proteína, entre los que se destacan: el incremento en la expresión de ARNm de IGF-I e IGF-II, activación de Akt/PKB, activación de la cascada de las MAPK (principalmente p38), mayor contenido de ARNm y proteína de SPHK1, mayor expresión de MEF-2, aumento en la expresión de ARNm y proteína de los factores de transcripción Miogenina y MRF4, reducción de la concentración de miostatina sérica, incremento en la proliferación y diferenciación de las células satélite y aceleración en el proceso de fusión de mioblastos. Alternativamente, esta investigación propone una activación indirecta de mTOR a través de la mayor disposición de aminoácidos (principalmente leucina), la activación de Akt/PKB y la posible inhibición de AMPK.
4. Fundamentos Metabólicos de la Suplementación con Creatina sobre la Ganancia de Fuerza Muscular
Cada vez que un grupo muscular se contrae desarrolla una fuerza que desencadena un trabajo, este último es la expresión de un proceso energético que efectúa la transformación de energía química en trabajo mecánico y energía calorífica. Así, la cantidad de energía química transformada en trabajo mecánico en relación a la totalidad de la energía utilizada se llama rendimiento (Álvarez et al. 2006). El ser humano puede desarrollar una gran cantidad de trabajo en un tiempo muy breve a través de las fuentes energéticas basadas en el sistema de fosfágenos (Murray et al. 2003), en esta fuente de energía se basan las actividades deportivas definidas como de potencia o de músculo morado en las cuales se imprimen grandes aceleraciones contra la gravedad (Álvarez et al. 2006). Además, el principio de la sobrecarga progresiva establece que para aumentar la fuerza o la potencia muscular, las demandas puestas en el músculo tienen que aumentarse sistemática y progresivamente sobre un período de tiempo y la carga de trabajo tiene que ser de una magnitud tal que produzca adaptaciones fisiológicas; de acuerdo con esto, para que pueda haber un incremento en el desarrollo de la fuerza el individuo deberá entrenarse con cargas equivalentes a por lo menos el 60% de su repetición máxima (1-RM), si el individuo trabaja con cargas menores al 60% estará desarrollando resistencia muscular (Hoeger 2005). Los efectos de la suplementación con Cr se han manifestado especialmente durante los ejercicios de elevada intensidad, de corta duración, de series repetidas y con poco tiempo de descanso entre ellas. Existe evidencia substancial que indica que la suplementación con Cr durante entrenamiento de resistencia incrementa la fuerza muscular y el número de repeticiones durante el ejercicio; en comparación, con un programa de resistencia solamente (Greenhaff et al. 1993; Earnest et al. 1995; Lemon et al. 1995; Vandenberghe et al. 1996a, b, 1997a; Maganaris & Maughan 1998; Kilduff et al. 2002; Dempsey et al. 2002; Warber et al. 2002; Rawson & Volek 2003; Bemben 2005; Izquierdo et al. 2002, 2006; Johnson et al. 2006; Maus 2007; Gorostiaga 2007; Chilibeck et al. 2007; Poprzęcki et al. 2008; Rahmani-Nia et al. 2008; Stout et al. 2008; Cooke et al. 2009; Stec & Rawson 2010; Kreider & Jung 2011; Del Favero et al. 2011; Zuniga et al. 2011). Aunque existe una considerable variabilidad en los sujetos que ingieren Cr durante entrenamiento de resistencia, se ha estipulado un aumento en: la fuerza voluntaria máxima del 5-15%, la ejecución de contracciones musculares repetidas al esfuerzo máximo del 5-15% y la potencia muscular del 1-5% (Kreider 2003a). Adicionalmente, los sujetos no entrenados han experimentado un amplio incremento de fuerza tras la suplementación con Cr con respecto a sujetos entrenados sin suplementación (31% Cr versus 14% Placebo) (Rawson & Volek 2003). No obstante, Eckerson et al. (2008) reportaron que la administración de un suplemento de Cr acompañado de sales de fosfato durante 30 días (5 g Cr + 4 g fosfatos día-1) no incrementa la capacidad de trabajo anaeróbico. En este sentido, Kilduff et al. (2002) encontraron que la administración de 20 g Cr + 180 g dextrosa día-1 durante 5 días no tiene efecto alguno sobre el pico de fuerza y la fuerza total en los sujetos suplementados; sin embargo, cuando el grupo Cr fue dividido en los sujetos que respondían y que no respondían a la ingesta de Cr el pico isométrico de fuerza y la producción de fuerza total fue significativamente mayor en el grupo de sujetos que respondía a la Cr con respecto al grupo placebo. De esta manera, los autores infirieron que el primer resultado fue enmascarado por el desempeño de los sujetos que no respondían a la Cr. De acuerdo con esto, se ha establecido que un 20-30% de los individuos no responde a la suplementación con Cr, esto significa que evidencian un aumento menor a 10 mmol kg-1 de masa seca (8%) en la concentración de TCr en el músculo después de haber ingerido durante cinco días 20 g Cr día-1 (4 dosis x 5 g Cr disueltas en 250 mL) (Greenhaff et al. 1996).
4.1. Creatina y Mecanismos que alteran la Fuerza Muscular
El desarrollo de fuerza en un músculo o grupo de músculos está determinado por la cantidad de unidades motoras activadas y por el grado de activación individual de cada una de ellas. Por lo tanto, hay dos mecanismos de control de la fuerza muscular por el sistema nervioso: reclutamiento del número de unidades motoras activas, las unidades motoras se activan o reclutan de una forma selectiva siguiendo el llamado ‘principio del tamaño’, primero lo hacen las de menor tamaño (tipo I), posteriormente las de tamaños superiores IIA y por último las IIX; así cuando se requieren niveles bajos de fuerza, esta se suministra por la puesta en marcha de unidades motoras tipo I y ante mayores necesidades se van reclutando progresivamente las otras; frecuencia de descarga de cada unidad motora, un único potencial en el nervio produce una fuerza contráctil débil mientras que al aumentar la frecuencia de descarga la fuerza resultante aumenta hasta llegar a un límite máximo que es la contracción tetánica. Al comienzo de la activación la descarga de las motoneuronas es de baja frecuencia (5-10 por seg) pero puede alcanzar tasas mayores (60 o más por seg), este control se emplea en el desarrollo de altos niveles de fuerza (Chicharro & Fernández 2006). Así, la fuerza de las contracciones tetánicas puede estar influenciada por numerosos factores que incluyen la concentración de Ca2+ intracelular, la elasticidad y el tamaño muscular (Cooke 2005). De esta manera, la intensidad de la fuerza muscular depende del número de fibras musculares que toman parte en la contracción y es aproximadamente proporcional a la sección transversal del músculo (Murray et al. 2003). Sin duda alguna, el incremento en la fuerza muscular y el mejoramiento del rendimiento en el weightlifting después de la ingestión de Cr más un programa de entrenamiento de resistencia es justificado desde varios mecanismos que incluyen la ganancia de masa corporal magra, el incremento en MHC, el aumento en la sección transversal del músculo (ver sección 2) o simplemente por el incremento en la intensidad de los ejercicios individuales tras el mantenimiento de la demanda de ATP por la PCr durante el ejercicio (Rawson & Volek 2003). Por otra parte, el aumento en la fuerza muscular debido a la suplementación con Cr ha sido atribuido al hecho de que al comienzo de cada serie del ejercicio se parte de unas altas concentraciones de PCr en comparación con el grupo placebo (Bemben & Lamont 2005). Greenhaff et al. (1994) reportaron que la administración de Cr (20 g día-1 x 5 días) incrementa la concentración de TCr y la resíntesis de PCr desde el segundo minuto de recuperación de contracciones intensas en sujetos que responden a la suplementación. El incremento en la resíntesis de PCr durante los periodos de recuperación entre las series del ejercicio de alta intensidad y corta duración evidenciado tras la suplementación con Cr afecta notablemente el “performance” deportivo. Este punto es clave para regular un aumento en la fuerza muscular y el número de repeticiones debido a que durante este tipo de ejercicio la contribución de la PCr a la producción de energía es muy elevada; es así, que los ejercicios de fuerza constituyen un buen modelo para el estudio de los efectos de la suplementación con Cr porque su intensidad es muy elevada, su duración es muy corta y suelen realizarse en series repetidas con poco tiempo de recuperación (Gorostiaga 2007). El tres veces campeón mundial de powerlifting, Hatfield FC (2006), conocido mundialmente como “Dr. Squat”, ha citado 38 factores que influyen en el desarrollo de la fuerza muscular, aunque la mayoría de ellos son subjetivos y hacen referencia a efectos mediados por otros factores alejados del campo científico como la motivación, concentración, incentivación, indumentaria y hasta factores espirituales. Sin embargo, menciona que uno de los factores importantes es la recuperación muscular tras el entrenamiento y la ausencia de lesiones. El daño del músculo esquelético inducido por el ejercicio concéntrico/excéntrico es relacionado con la no familiarización a la actividad física y con las contracciones intensas con altas cargas que provocan la disrupción de la ultraestructura muscular normal. Este desgaste se ve manifestado en la alteración de la función del sarcolema y del retículo sarcoplasmático, lo cual genera un incremento de Ca2+ intracelular y la subsecuente activación de vías degradativas, iniciando gran cantidad de eventos que provocan disminución de la fuerza muscular, incremento del dolor e inflamación incluyendo el daño de la función muscular (Cooke 2005). Cooke et al. (2009) demostraron que la suplementación con Cr mejora significativamente la recuperación de la función del músculo extensor de rodilla tras las lesiones causadas por el propio entrenamiento; así, el grupo suplementado con Cr (1.5 g kg-1 peso corporal día-1) tuvo un mayor incremento de fuerza en la extensión isocinética (>10%) e isométrica (>21%) de rodilla durante el periodo de recuperación tras el daño muscular causado por el ejercicio. Además, la actividad de CK fue significativamente más baja (en promedio 84%) después de las 48 (P<0.01), 72 (P<0.001), 96 horas (P<0.0001) y 7 (P<0.001) días de recuperación en el grupo Cr. Los autores sugirieron que este efecto mediado por la Cr puede ser debido en parte a un más rápido crecimiento muscular durante el periodo de recuperación, igualmente la baja actividad de CK en los días posteriores es un indicador de menor daño muscular. Cooke (2005) ya había mostrado que la suplementación con Cr y proteína juega un papel importante en la recuperación muscular tras las lesiones sufridas por el ejercicio gracias a una reducción de la necrosis fibrilar y al aumento en la regeneración muscular. Vandenberghe et al. (1997a) demostraron que los efectos de la suplementación con Cr a largo plazo sobre la fuerza muscular y el mejoramiento del rendimiento también se evidencian en mujeres. En su estudio encontraron que la fuerza y PCr muscular, la capacidad de ejecutar ejercicio intermitente y la masa libre de grasa permanecieron en un nivel alto en el grupo Cr, con respecto al placebo, durante 10 semanas sin entrenamiento. En realidad, la suplementación con Cr parece aumentar la recuperación de la fuerza muscular tras las microlesiones que sufre el músculo al someterse a ejercicio de resistencia. Sin duda alguna, el incremento del amortiguamiento energético inducido por la relación PCr/Cr durante la contracción muscular ejerce un papel importante en los mecanismos de adaptación corporal que incluyen la asimilación de la fuerza muscular y que se evidencian en un mayor entrenamiento vigoroso, menor fatiga e incluso mayor rendimiento durante las repeticiones de los ejercicios (Hespel & Derave 2007). Además, el aumento de los niveles de PCr y Cr parece mejorar la capacidad de regeneración de ATP durante la recaptación de Ca2+ por SERCA (ver sección 3), prestando importancia a la minimización de vías degradativas como las proteasas y lipasas activadas por Ca2+ que generan un mayor deterioro muscular (Cooke 2005). El otro factor importante enunciado por Hatfield (2006) corresponde a la menor aparición de lesiones que en últimas, impiden el desarrollo muscular y la ganancia de fuerza. Algunos de los sujetos que han ingerido Cr han relatado que sufren de calambres musculares después de la suplementación (Mesa et al. 2001), aunque sus testimonios han sido anecdóticos en su naturaleza y no sustanciales, especialmente cuando el diseño de la investigación ha incluido grupos control y grupos ciegos (Bemben & Lamont 2005). De esta manera, no existe evidencia directa que justifique que la administración de Cr pueda inducir calambres musculares (Kim et al. 2011), y dado que sean experimentados son probablemente debidos a la mayor intensidad de entrenamiento o a la disrupción en el balance electrolítico, ya que muchos autores están de acuerdo con que una adecuada hidratación durante el ejercicio reduce significativamente este tipo de lesión (Bemben & Lamont 2005). Soportando lo anteriormente dicho, Greenwood et al. (2003a) demostraron que la suplementación con Cr (15.75 g día-1 x 5 días seguido de 5 g día-1) durante 3 años no incrementa la incidencia de lesiones o calambres en jugadores universitarios de futbol americano de la División IA de la NCAA. Los datos fueron presentados como el número total de lesiones tratadas por usuarios de Cr/lesiones totales observadas y la relación en porcentaje en casos de usuarios de Cr durante el tiempo de la investigación; calambres (37/96, 39%), deshidratación (8/28, 36%), tensiones musculares (18/42, 43%), tirones musculares (25/51, 49%), lesiones no coyunturales (44/132, 33%), lesiones coyunturales (39/104, 44%), sujetos ausentes debido a lesiones (19/41, 46%), jugadores ausentes en la última temporada (3/8, 38%) y total de sujetos lesionados/ausentes (205/529, 39%). Adicionalmente, la suplementación con Cr a largo plazo (20 g día-1 x 5 días seguido de 10 g día-1 x 51 días) no tiene efectos secundarios sobre marcadores séricos de disfunción renal ni efectos negativos sobre la filtración glomerular, permeabilidad glomerular, reabsorción tubular ni patologías hepáticas (Mesa et al. 2002). Igualmente, Schröder et al. (2005) demostraron que la ingesta de Cr a largo plazo (5 g día-1) no genera ningún tipo de trastorno metabólico, al evaluar 16 marcadores clínicos de daño hepático, renal o muscular en un grupo de 18 jugadores profesionales de básquetbol suplementados durante 3 años. Por el contrario, se han descrito efectos negativos en pacientes con previa enfermedad renal que tras ingerir 15 g Cr día-1 durante 7 días más una dosis de mantenimiento de 2 g Cr día durante 49 días ven deteriorada su función renal, la cual se restablece tras detener la ingesta de creatina (Mesa et al. 2002). Así, Kim et al. (2011) infieren que altas dosis de Cr (>3-5 g día-1) no pueden ser consumidas por individuos con enfermedad renal o por quienes presentan un riesgo potencial de disfunción renal (diabetes, hipertensión, tasa de filtración glomerular reducida, etc.). De esta manera, por razones de seguridad debe ser considerada una investigación pre-suplementación de la función renal, aunque en sujetos saludables esto no es necesario. Por otro lado, el ejercicio físico y de distintos grados de entrenamiento ha generado numerosos efectos sobre la eficacia de la transmisión neuromuscular; el aumento de actividad física produce una hipertrofia en la sinapsis neuromuscular que es independiente de la hipertrofia muscular. En el individuo adulto las motoneuronas y, en menor medida, el propio músculo liberan factores neuronotróficos como BDNF y neurotrofina 4 (NT-4) los cuales mejoran la transmisión neuromuscular espontánea (Chicharro & Fernández 2006). La actividad física ha demostrado incrementar la función cognitiva en animales y humanos resaltando el incremento en la expresión de BDNF en el hipocampo, un área integral para el aprendizaje y la memoria, a tal punto que se ha estipulado que debido a la actividad metabotrófica de BDNF (que influye sobre aspectos críticos del metabolismo energético) se puede justificar el efecto sobre la cognición al relacionar el metabolismo energético y la plasticidad sináptica. Gomez-Pinilla et al. (2008) evidenciaron en ratas un incremento en los niveles de ARNm de BDNF en el hipocampo e interesantemente una correlación positiva entre este factor con los niveles de mi-CK ubicua tras el ejercicio. Así, los autores mostraron que al inhibir la acción de BDNF usando una específica quimera inmunoadhesiva que imita el rol del receptor de BDNF y por tanto ‘secuestra’ selectivamente este factor se abolió completamente el aumento inducido por el ejercicio en los niveles de ARNm de mi-CK. De acuerdo con estos hallazgos, la Cr parece estar relacionada directamente con BDNF a través del metabolismo energético vía CK. Esto es coherente con el hecho que Rae et al. (2003) hayan mostrado que la suplementación con Cr en humanos (5 g día-1 x 6 semanas) incrementa significativamente la memoria y la inteligencia, posiblemente tras el aumento energético neuronal. Además, es relevante observar que la actividad muscular también aumenta la producción de NT-4 por la fibra muscular (Chicharro & Fernández 2006). Si bien no existe una relación directa entre la Cr y NT-4, Ducray et al. (2005) mostraron que la administración crónica de Cr (5 mM) y NT-4/5 (10 ng mL-1) incrementó significativamente el número de neuronas inmunoreactivas que expresan NOS en un cultivo de células neuronales de rata. Aunque ambos factores neuronotróficos parecen estar relacionados en cierta medida con la Cr a través de la homeostasis energética celular, se deberían llevar a cabo estudios para analizar un posible aumento del rendimiento neuromuscular tras la suplementación con Cr que genere en últimas mayor producción de fuerza muscular además de la optimización del rendimiento cognitivo.
Actualmente, existen tres teorías que explican el hecho de que la ingesta de Cr mejore la fuerza muscular durante ejercicio anaeróbico. Primero, se ha mencionado que tras la suplementación con Cr los niveles totales de Cr y PCr incrementan significativamente y generan un mayor potencial energético que permite una mayor biodisponibilidad de ATP durante ejercicio anaeróbico de muy corta duración (<30 seg). Segundo, el mejoramiento en el rendimiento físico en ejercicio anaeróbico intermitente es debido al aumento en la relación de resíntesis de PCr durante los períodos de descanso entre las series del ejercicio. Tercero, el uso de Cr tiene un efecto potencial en la disminución de la acumulación de Ca2+, H+ y Pi mediante el efecto buffer que ejerce la reacción de la CK y la aparente inhibición de glucólisis (Poprzęcki et al. 2008), lo cual permite una más rápida recuperación muscular tras los miotraumas inducidos por el ejercicio. Sin embargo, debe tenerse en cuenta la variabilidad en los sujetos que responden y los que no responden a la suplementación, ya que como se ha observado el incremento de la relación intramuscular de PCr/Cr es el que atribuye el efecto ergogénico a la suplementación con Cr.
5. Fundamentos Metabólicos de la Suplementación con Creatina sobre la Síntesis/Ahorro de Glucógeno
Robinson et al. (1999) reportaron por primera vez que la suplementación con Cr junto con una dieta alta en CHO durante 5 días después de ejercicio exhaustivo incrementa en un 23% el glucógeno muscular comparado con una dieta alta en CHO sin Cr. Nelson et al. (2001) demostraron que un protocolo de carga de CHO incrementa en un 41% el glucógeno muscular y fue aumentado adicionalmente en un 12% cuando fue seguido por un periodo de carga con Cr durante 5 días. Op’t Eijnde et al. (2001b) mostraron que la ingesta de Cr no tiene un efecto sobre el glucógeno muscular durante 2 semanas de inmovilización, pero encontraron un aumento del 46% en los niveles de glucógeno con respecto al placebo durante 3 semanas de entrenamiento de fuerza de rehabilitación. Siguiendo los mismos parámetros que el estudio anterior, Derave et al. (2003) desarrollaron un estudio que involucró 2 semanas de inmovilización de pierna y 6 semanas de una fase de entrenamiento de rehabilitación, este grupo mostró que la suplementación con Cr aumenta el glucógeno muscular post-entrenamiento en un 35% con respecto al placebo. Van Loon et al. (2004) demostraron que un régimen de carga con Cr durante 5 días aumenta el glucógeno muscular en un 14% comparado con el placebo, aunque no hubo diferencia en los niveles de glucógeno después de las 6 semanas de la fase de mantenimiento que consistía de 2.5 g Cr día-1. Debido a que la dosis de mantenimiento no fue efectiva para conservar una elevada concentración de Cr muscular, se ha establecido que un incremento significativo de Cr muscular es un prerrequisito para el aumento en el almacenamiento de glucógeno (Volek & Rawson 2004). Cribb & Hayes (2006) demostraron que la ingesta inmediatamente antes y después al ejercicio de un suplemento de proteína/Cr/CHO incrementa en un ~25% la concentración de glucógeno muscular tras el programa de entrenamiento en comparación con la ingesta del mismo suplemento por las mañanas y en las noches. Hoy en día, es debatido si la suplementación con Cr es capaz de ahorrar el contenido de glucógeno durante ejercicio exhaustivo. Sewell et al. (2008) demostraron que 5 días de suplementación con Cr bajo condiciones de una dieta controlada habitual no tiene efecto alguno sobre el glucógeno muscular en la recuperación o después de ejercicio continuo hasta la agotamiento; no obstante, como los autores sugieren, cualquier incremento en el almacenamiento de glucógeno asociado a la Cr es el resultado de una interacción entre la suplementación con Cr y algunos mecanismos reguladores del almacenamiento de glucógeno muscular. Rico-Sanz et al. (2008) también encontraron que la suplementación con Cr + CHO (21 g Cr día-1 x 5 días) no tiene efecto significativo sobre la concentración de glucógeno muscular con respecto al placebo, como lo revelaron análisis de RMN. Igualmente, Onofre et al. (2008) no evidenciaron efecto alguno tras la suplementación con Cr sobre el contenido de glucógeno hepático en ratas sometidas a ejercicio físico. Recientemente, Roschel et al. (2010) realizaron un estudio con ratas suplementadas con Cr y sometidas a ejercicio intermitente para determinar el efecto sobre el contenido de glucógeno muscular y la resistencia a la fatiga, encontrando que: 1) los grupos Cr y placebo presentaron una disminución del contenido de glucógeno del músculo sóleo con respecto a la línea base, sin diferencias entre ambos grupos; 2) el grupo Cr mostró un mayor contenido de glucógeno del músculo gastronecmio en comparación con el placebo; 3) aunque los análisis de lactato en sangre no reflejaron diferencias entre los grupos durante el reposo, después del calentamiento y tras el primer set de ejercicios, se observó un descenso significativo de las concentraciones de lactato en el grupo Cr durante los sets 2, 3, 4, 5 y 6. El mayor hallazgo de esta investigación fue que 5 días de suplementación con Cr ahorra el contenido de glucógeno del músculo gastronecmio, pero no del músculo sóleo, después de ejercicio intermitente en ratas. La ausencia de cambios significativos en el glucógeno del músculo sóleo no es sorprendente ya que refleja el menor contenido de Cr y glucógeno en las fibras tipo I (oxidativa, sóleo) con respecto a las tipo II (glucolítica, gastronecmio).
5.1. Creatina y Reguladores Metabólicos de la Síntesis de Glucógeno
Está bien establecido que el sistema Cr/PCr/CK juega un rol crucial en la provisión de energía durante el ejercicio intermitente de alta intensidad. Ante la disminución intramuscular de PCr, la provisión de energía se hace más dependiente de la glucólisis (y el glucógeno muscular) para proveer el ATP necesario. Roschel et al. (2010) sugieren que un incremento en el contenido de PCr (y en su resíntesis en los periodos de descanso entre las series) durante ejercicio intermitente podría apaciguar el agotamiento de ATP, seguido por una menor dependencia de la glucólisis, lo cual podría ahorrar los depósitos de glucógeno muscular. En este sentido, a continuación se enuncian posibles mecanismos que justifican el incremento/ahorro de glucógeno muscular.
5.1.1. Creatina e Inhibición de la Glucólisis
Essén & Kaijser (1978) ya habían examinado los posibles factores que regulan la glucólisis y que alteran la utilización de CHO y lípidos durante ejercicio intermitente al exponer a 7 y 6 hombres a ejercicio intermitente y ejercicio continuo hasta el agotamiento en cicloergómetro, respectivamente. Durante el ejercicio continuo se evidenció una rápida disminución de glucógeno y una acumulación de glicerol-1-fosfato, lactato y malato, metabolitos involucrados en la reoxidación del NADH formado en glucólisis. En contraste, el ejercicio intermitente demostró una baja tasa de glucogenólisis y unos menores niveles de glicerol-1-fosfato, lactato y malato, insinuando un menor uso de la glucólisis durante este tipo de ejercicio, a pesar de realizarse a la misma intensidad que el ejercicio continuo. El estudio también reflejó un incremento de ATP, PCr y malato durante el descanso entre las series del ejercicio intermitente provocando una disminución de la glucólisis. Los altos niveles de PCr ya habían sido reportados anteriormente por inhibir parcialmente PFK además de potenciar el efecto inhibidor del ATP (Stout et al. 2008; Mesa et al. 2002). De acuerdo con esto, Safddar et al. (2008) ratificaron que un periodo de suplementación con Cr de 10 días disminuye en un 21% el contenido de ARNm de PFK en humanos con respecto al placebo, según lo reflejaron análisis de microarreglos. PFK es una enzima glucolítica clave que funciona como una válvula de flujo direccional, cuya inhibición trae como consecuencia una acumulación de G6P la cual activa alostéricamente a la GS en momentos de descanso muscular. Por ende, los frecuentes lapsos de reposo del ejercicio intermitente pueden contribuir en el mantenimiento de los niveles de ATP, PCr y malato y consecuentemente inhibir la glucólisis. La tendencia a un incremento en la relación glucosa-6-fosfato/fructosa-1,6-bifosfato al final del reposo comparado con las series de actividad física en el ejercicio intermitente soporta la idea de que la inhibición ocurra en el paso de PFK (Essén & Kaijser 1978). Adicionalmente, la PCr no solo inhibe la actividad de PFK sino que también puede estimular la actividad de fructosa-1,6-bifosfatasa en un ~60% como demostraron Fu & Kemp (1973), en un estudio in vitro donde las concentraciones de PCr que activan esta enzima (1-2 mM) se encuentran entre el rango fisiológico y son las mismas que inhiben PFK. Es decir, desde 1973 se sugiere que la PCr actúa como un regulador en la resíntesis de glucógeno después de la contracción muscular. Por otro lado, varios autores han reportado una menor acumulación de lactato después de la administración de Cr en estudios in vivoe in vitro (Balsom et al. 1994; Brönnimann 1995; Hultman et al. 1996; Dos Santos 2001; Mesa et al. 2002; Ceddia et al. 2004; Stout et al. 2008; Roschel et al. 2010). Greenhaff et al. (1994) evidenciaron una reducción en la concentración de lactato muscular en humanos suplementados con Cr y sometidos a contracciones inducidas eléctricamente, soportando la idea de que el sistema glucolítico anaeróbico es menos utilizado como fuente energética durante ejercicio intermitente y altas concentraciones de Cr. Precisamente, la suplementación con Cr optimiza el rendimiento en programas de ejercicio de alta intensidad y de corta duración (Barnett et al. 1996; Vandenberghe et al. 1996a, b, 1997a; McNaughton et al. 1998; Williams et al. 1999; Finn et al. 2001; Dempsey et al. 2002; Biwer et al. 2003; Gorostiaga 2007; Del Favero et al. 2011; Kreider & Jung 2011), pues los resultados efectivos de la administración de Cr sobre la supercompensación del glucógeno muscular han sido evidenciados en programas de entrenamiento intermitente. Por otro lado, la ingesta de este suplemento no parece tener efecto alguno sobre la homeostasis del glucógeno en sujetos que se entrenan continuamente hasta el agotamiento ni en personas que no realizan ningún tipo de actividad deportiva.
5.1.2. Creatina y Regulación de Glucógeno Sintasa
GS es regulada alostéricamente por G6P y adicionalmente mediante un mecanismo reversible de fosforilación y defosforilación permitiendo su inactivación y activación respectivamente. En general, la fosforilación disminuye la actividad de GS debido a un incremento en su Km hacia su sustrato UDP-glucosa y un aumento en la Ka hacia G6P. Por otro lado, G6P también induce un incremento en la susceptibilidad de GS a la acción de fosfatasas y una reducción hacia el efecto de PKA (Connett & Sahlin 2011). En este sentido, GS presenta nueve sitios de fosforilación potencial: los sitios 2 y 2a correspondientes a Ser7 y Ser10, respectivamente, localizados cerca de la región aminoterminal; y por lo menos siete sitios en las regiones 3a-c, 4, 5, 1a-b que se encuentran entre los 100 residuos de la región carboxiterminal. La fosforilación en los sitios 2, 2a, 3a y 3b disminuyen la actividad de la enzima mucho más que la fosforilación en los demás sitios, los cuales presentan un menor o ningún efecto sobre la actividad de GS. La fosforilación inicial en el sitio 5 por caseína cinasa 2 genera un lugar de reconocimiento de GSK3, la cual de manera secuencial fosforila los sitios 4, 3c, 3b y 3a de GS. Este fenómeno ha sido llamado fosforilación jerárquica y ha sido demostrado también en los sitios aminoterminal en donde la modificación del sitio 2 por PKA, AMPK y otras cinasas es un prerrequisito para la fosforilación en el sitio 2a por caseína cinasa 1 (Nielsen & Richter 2003). La reposición de las reservas de glucógeno involucra un incremento en la actividad de GS después del ejercicio. Sin embargo, ha sido propuesto que a pesar de la degradación de glucógeno durante el ejercicio existen mecanismos que al mismo tiempo promueven la actividad de GS y en sí la síntesis de glucógeno. La regulación de GS por el ejercicio no es dependiente del receptor muscular de insulina ni de PI3K sugiriendo que la insulina y el ejercicio utilizan diferentes vías de señalización para activar GS, aunque los efectos estimulatorios no son siempre aditivos permitiendo establecer que afectan los mismos sitios de fosforilación en GS (Astorino & Kravitz 2000; Nielsen & Richter 2003; Johnson et al. 2004; Ivy 2004). Por otro lado, la actividad de GS es inversamente proporcional al contenido de glucógeno muscular. Así, se ha pensado que el incremento en la actividad de GS inducido por el ejercicio puede ser el resultado de una disminución del contenido de glucógeno durante la contracción. En el músculo esquelético, se ha demostrado que GS está ligada a partículas de glucógeno y a las miofibrillas, ya que glucogenina está particularmente asociada con la actina muscular en la banda I del sarcómero muscular y la proteína interactuante entre glucogenina y GS interactúa con la proteína miofibrilar desmina, de tal forma que la actividad de GS es dependiente del tipo de fibra. Esta localización citoesquelética de GS en momentos de agotamiento de glucógeno, indicaría que la síntesis de esta reserva energética en cercanía a las proteínas contráctiles del músculo es un mecanismo de gran importancia. Durante la etapa inicial de la síntesis de glucógeno, glucogenina y GS están adjuntas pero al final del proceso estas se disocian, ya que la sintasa se mueve por las extensiones del glucógeno durante la ramificación. Si la actividad de GS es alta solo cuando ésta se encuentra ligada a la glucogenina, como sugieren algunos estudios in vitro, se podría explicar por qué la actividad de GS disminuye con el crecimiento de las partículas de glucógeno (Nielsen & Richter 2003). Además, teniendo en cuenta que GSK3 fosforila consecutivamente los sitios 4, 3a, 3b y 3 c de GS cuando el sitio 5 es fosforilado por caseína cinasa 2, se ha demostrado que la actividad de las subunidades α y β de GSK3 disminuye en respuesta al ejercicio (Connett & Sahlin 2011). Snow et al. (2008) demostraron que la suplementación con Cr en sujetos expuestos a un protocolo de ejercicios de resistencia, incrementa el estado de fosforilación de Akt/PKB y GSK3β a los 1 y 5 días con respecto al placebo. Deldicque et al. (2007) evidenciaron un incremento de un +70%, P<0.001 en el estado de fosforilación de GSK3β tras la administración de Cr in vitro. Aunque no se ha postulado un mecanismo inhibitorio directo de la Cr sobre GSK3, se podría explicar la inactivación de esta última tras la suplementación con Cr debido a un incremento en la expresión del IGF-I (Deldicque et al. 2005; Burke et al. 2008) y al aumento en la actividad de Akt/PKB (ver sección 2.1.1.1.), reguladores corriente arriba de la actividad de GSK3. Esto concuerda con el hecho que la suplementación con Cr disminuye en 0.79 veces (21%) el contenido de ARNm de glucógeno fosforilasa (sustrato de Akt/PKB) con respecto al placebo, tal como demostraron en su estudio Safdar et al. (2008), en donde paralelamente la concentración de ARNm y proteína de Akt/PKB incrementó en un 2.1 y 4.2 veces con respecto al grupo placebo, respetivamente. Ahora bien, basados en la noción de que AMPK es un sensor del contenido energético celular, se ha propuesto que la activación de AMPK puede disminuir la actividad de GS durante el ejercicio, evidenciando una reducción del consumo de energía necesaria para la incorporación de UDP-glucosa al glucógeno (Connett & Sahlin 2011). Esto es soportado por el hecho de que el residuo de Ser7 de GS es sustrato de AMPK in vitro e in vivo. La fosforilación de GS en el residuo Ser7 incrementa la susceptibilidad del residuo Ser10 para la fosforilación por caseína cinasa 1, asimismo la fosforilación de estos dos sitios disminuye la actividad de la enzima significativamente (Nielsen & Richter 2003). Como se analizó en la sección 2.1.1.3., un aumento del sistema de fosfágenos tras la ingesta de Cr permitiría una menor contribución de otros sistemas que regulan la producción de energía en el miocito durante el trabajo muscular mediante un posible mayor tiempo de inhibición de AMPK. De esta manera, la inhibición temporal de AMPK durante las grandes cargas con Cr justificaría en cierta medida la supercompensación de glucógeno muscular en sujetos o que responden a la suplementación. Por otro lado, cambios en el estado de hidratación celular han sido establecidos por influenciar los niveles de glucógeno (Volek & Rawson 2004). Peak et al. (1992) investigaron in vitro los efectos de cambios en el pH y en el volumen celular en la síntesis de glucógeno y en la glucólisis evidenciando que: 1) la acidificación celular inhibe y estimula la glucólisis y la síntesis de glucógeno, respectivamente. Este último efecto es debido a los cambios iónicos secundarios que involucran la entrada de Na+ permitiendo el hinchamiento celular; 2) el hinchamiento hipo-osmótico estimula la glucólisis solo bajo condiciones alcalinas y favorece la síntesis de glucógeno en una amplia gama de condiciones. Por ende los autores concluyeron que la síntesis de glucógeno es más sensible a los cambios en el volumen celular mientras que la glucólisis a los cambios en el pH. Además del efecto anabólico, se ha asignado un efecto anticatabólico que incluye la inhibición de la degradación proteica y de glucógeno durante el hinchamiento celular (Haussinger et al. 1993; Lang et al. 1998). Precisamente se podría esperar que se estimule la síntesis de glucógeno muscular debido al aumento en el estado de hidratación celular tras la suplementación con Cr, tal que algunos autores sugieren que una concentración de 30 mmol Cr kg-1 de masa seca es suficiente para inducir la síntesis de glucógeno (Mesa et al. 2002).
En resumen, el incremento significativo de PCr tras la ingesta de Cr y la subsecuente disponibilidad de ATP durante los periodos de descanso del ejercicio intermitente, concuerda con el hecho que la influencia combinada de estos metabolitos en el retardo de la glucólisis al inicio de cada nuevo set de repeticiones (vía PFK y fructosa-1,6-bifosfatasa) genera una menor contribución del metabolismo de CHO, evidenciado en la menor acumulación de lactato muscular al finalizar el ejercicio, y una mayor participación de los fosfatos de alta energía, lípidos u otras moléculas en la obtención de energía durante ejercicio de alta intensidad y corta duración. Esto de una u otra forma podría explicar el efecto ergogénico de la Cr sobre los niveles de glucógeno que han sido mostrados por afectar el rendimiento del ejercicio de alta intensidad en algunos estudios, incluyendo el ejercicio de resistencia (Op’t Eijnde et al. 2001a, b; Volek & Rawson 2004; Roschel et al. 2010). Por último, la Cr, debido a su homeostasis durante las sesiones de ejercicio, posiblemente regula la síntesis de glucógeno a través de la inhibición y/o activación de ciertas proteínas reguladoras de GS, resaltando la vía IGF-I/Akt-PKB/GSK3, la posible inhibición de AMPK y el hinchamiento celular.
6. Fundamentos Metabólicos de la Suplementación con Creatina sobre la Regulación de GLUT-4
Op’t Eijnde et al. (2001b) evidenciaron por primera vez un efecto protector de la Cr sobre la pérdida de GLUT-4 durante periodos de inmovilización y un incremento significativo (~40%) en la concentración de GLUT-4 durante entrenamiento de rehabilitación en sujetos suplementados con Cr. Años más tarde, Derave et al. (2003) examinaron los efectos de la suplementación con Cr + proteína sobre el contenido de GLUT-4 muscular durante un protocolo de inmovilización-rehabilitación, encontrando que la expresión de GLUT-4 se redujo significativamente por la inmovilización en los grupos placebo y Cr con respecto a los niveles basales, sin cambios significativos en el grupo Cr + proteína; sin embargo, durante el reentrenamiento la concentración de GLUT-4 incrementó en los grupos Cr (~24%) y Cr + proteína (~33%) en comparación con el placebo. Basados en estos resultados los autores concluyeron que la ingesta de Cr estimula el contenido de GLUT-4 en el músculo humano solo cuando es combinado con cambios en el nivel de actividad habitual. Si el impacto de la captación de Cr sobre la expresión de GLUT-4 es restringido al limitado grupo de músculos entrenados, entonces se podría esperar un breve mejoramiento en la tolerancia a la glucosa en el cuerpo entero. Basados en esta hipótesis, en el mismo estudio de Derave et al. (2003) se llevaron a cabo un test de tolerancia a la glucosa oral (OGTT) y la cuantificación de insulina por radioinmunoensayo para analizar el comportamiento en los tres grupos del experimento. Los resultados mostraron que la suplementación con Cr + proteína durante el periodo de rehabilitación de 6 semanas generó una reducción substancial del área bajo la curva de glucosa durante las 2 horas del OGTT, lo cual indica un mejoramiento de la tolerancia a la glucosa en el reentrenamiento, debido posiblemente a un incremento en la sensibilidad a la insulina más que a un aumento en la secreción de la misma (Rooney et al. 2003). Así, ya que el grupo muscular entrenado representa solo una pequeña parte de la masa muscular total, no se podría atribuir el aumento en la tolerancia de glucosa al incremento en la expresión de GLUT-4 en la pierna experimental tras la ingesta de Cr, de tal forma que los autores sugirieron que el efecto sobre la tolerancia a la glucosa es independiente de la regulación sobre GLUT-4. Ju et al. (2005) demostraron que la expresión de GLUT-4 aumentó significativamente en los músculos extensor largo, tríceps y epitroclear en un grupo de ratas alimentadas con Cr (2% monohidrato de Cr) con respecto al control. A pesar de los hallazgos anteriores, algunos estudios no han reportado cambios sobre el contenido de ARNm y proteína de GLUT-4 tras la suplementación con Cr (Op’t Eijnde et al. 2001a; van Loon et al. 2004; Safdar et al. 2008).
6.1. Creatina y Regulación de GLUT-4
Debido a que algunas investigaciones han evidenciado un aumento en la expresión y estado de fosforilación de AMPK tras la administración de Cr (Op’t Eijnde et al. 2001a; Ceddia & Sweeney 2004; Ju et al. 2005), varios autores han llegado a sugerir que los efectos de la suplementación con Cr sobre GLUT-4 se relacionan con la activación de AMPK. Sin embargo, Op’t Eijnde et al. (2005) demostraron que la suplementación con Cr no tiene efecto alguno sobre la expresión ni actividad de AMPK durante la inmovilización o durante el entrenamiento, sugiriendo así que AMPK probablemente no está implicada en los efectos benéficos de la suplementación con Cr sobre GLUT-4 muscular durante inmovilización y entrenamiento de rehabilitación. Así, los efectos reportados de la ingesta de Cr sobre el contenido de glucógeno y GLUT-4 muscular están desligados totalmente de un aumento en la expresión o estado de fosforilación de AMPK. Es importante notar que la variabilidad de la tasa PCr/Cr se debe principalmente a la existencia de sujetos que responden y que no responden a los periodos de suplementación, entre algunos otros factores (cantidad de Cr ingerida, tipo de protocolo de ejercicio, etc.); por esta razón, se hace necesaria la realización de investigaciones futuras en sujetos que respondan a la suplementación con Cr y durante distintos protocolos de entrenamiento para evaluar la activación o inhibición de AMPK. Ahora bien, la exclusión de AMPK en la regulación de GLUT-4, provee evidencia para sugerir que el incremento en la captación de glucosa en el músculo se produce mediante un aumento en la sensibilidad hacia la insulina tras la ingesta de Cr, respaldado por los resultados del OGTT de Derave et al. (2003). En este sentido, la activación de la cascada de señalización de IGF-I/PI3K/PDK1/Akt-PKB tras la suplementación con Cr (ver sección 2.1.1.1.), parece constatar el efecto sobre la regulación del transporte de glucosa en el músculo humano a través de la regulación ejercida por la vía de señalización de la insulina sobre la translocación de GLUT-4 (Goodyear & Kahn 1998; Shepherd & Kahn 1999; Dohm 2002; Holmes & Dohm 2004). Por otra parte, Ju et al. (2005), al analizar por Western Blot el contenido mionuclear de las isoformas de MEF2 en ratas suplementadas con Cr, reportaron incrementados niveles proteicos de MEF2-A (~70%), MEF2-C (~60%) y MEF2-D (90%) en los extractos nucleares del músculo extensor largo con respecto al grupo control (Figura 5). Además, el EMSA reveló que la actividad de unión de MEF2 a su secuencia de reconocimiento en el gen GLUT-4 incrementó en un ~40% en las ratas alimentadas con Cr en comparación con el control. De esta forma, los autores sugirieron que la ingesta de Cr incrementa el contenido nuclear de las isoformas de MEF2 y la actividad de unión a la región promotora del gen GLUT-4, lo cual correlaciona con la incrementada expresión de GLUT-4 en este estudio. Estos resultados demuestran que la administración de Cr incrementa la expresión de MEF2 (posiblemente vía p38-MAPK), el cual a su vez genera una mayor transcripción y expresión del gen GLUT-4.
De acuerdo con los párrafos anteriores, es posible que a través de la activación de la vía IGF-I/PI3K/Akt-PKB y un aumento en la expresión de MEF2 nuclear, la suplementación con Cr estimule la transcripción y/o translocación de GLUT-4 en el miocito durante cambios en los niveles de actividad muscular. No obstante, cuando en los tejidos musculares humanos y animales hay depleción de Cr, estos se adaptan estructuralmente incrementando la expresión de enzimas oxidativas como mi-CK, succinato deshidrogenasa, citrato sintasa e incluso GLUT-4 para suplir la energía anaeróbica brindada por el sistema PCr-ATP (Mesa et al. 2002). De acuerdo con esto, Ren et al. (1993) demostraron que al suplementar ratas con ácido β-guanidinopropiónico (β-GPA), el cual reduce las concentraciones de Cr y PCr al competir estructuralmente por el CreaT/SLC6A8, incrementó la expresión de ARNm y proteína de GLUT-4 en un ~40% y ~50%, respectivamente; además de aumentar en un ~40-50% la concentración de citocromo c y las actividades de citrato sintasa y hexocinasa. Esto demuestra que la adaptación muscular y enzimática tras la depleción de Cr incrementa la capacidad oxidativa de las fibras musculares (Roussel et al. 2000). Debido a que la suplementación con Cr ha mostrado beneficiar energéticamente el metabolismo anaeróbico, no tiene sentido inferir que la ingesta de Cr incrementa durante el ejercicio de alta intensidad y corta duración la expresión y/o translocación de GLUT-4, ya que en cierta medida estaría incrementando el metabolismo aeróbico. Así, la administración de Cr solamente aumenta el contenido de GLUT-4 muscular durante periodos de cambio drástico en la actividad física.
CONCLUSIÓN
El monohidrato de Cr es un poderoso suplemento ergogénico utilizado frecuentemente por practicantes de deportes de alta intensidad y corta duración, debido a sus ratificados efectos positivos sobre el performance deportivo en este tipo de entrenamiento, además de tener enorme potencial en el tratamiento de diverso tipo de enfermedades. Los fundamentos metabólicos que sustentan los efectos de la suplementación con Cr sobre el entrenamiento de resistencia se basan principalmente en el mayor rendimiento del sistema energético Cr/PCr/CK, la activación de vías de señalización anabólicas (IGF-I/Akt y MAPK, entre otras) y el incremento/disminución en la expresión de ciertas moléculas claves en ciertos procesos metabólicos y de remodelación muscular. Investigaciones futuras enfocadas en la suplementación con Cr durante entrenamiento de resistencia deberían evaluar la expresión de factores neuronotróficos, el posible efecto vasodilatador en sujetos saludables, el potencial ergogénico de la suplementación con cafeína tras la fase de carga con Cr, los efectos ergogénicos de nuevas formas de Cr y especialmente la normalización de los estudios.
AgradecimientosQuiero agradecer especialmente a la profesora MSc. Luz Y. Moreno por su asesoría, recomendaciones y apoyo a lo largo de mi investigación, así como a Damaris E. Montañez por su ayuda en la recolección de los artículos revisados. Igualmente agradezco al equipo de docentes relacionados con el departamento de Bioquímica y Biología Molecular de la Universidad Distrital Francisco José de Caldas. Por último, agradezco de manera especial al Doctor Dean A. Sewell por sus sugerencias durante la construcción analítica de este manuscrito.
Referencias
1. Akimoto T, Pohnert SC, Li P, Zhang Mei, Gumbs C, Rosenberg PB, Williams RS & Yan Z (2005). Exercise Stimulates Pgc-1α Transcription in Skeletal Muscle through Activation of the p38 MAPK Pathway. J Biol Chem, 280(20):19587–19593
2. Al-Khalili L, Krämer D, Wretenberg P and Krook A (2004). Human Skeletal Muscle Cell Differentiation is Associated with Changes in Myogenic Markers and Enhanced Insulin-Mediated MAPK and PKB Phosphorylation. Acta Physiol Scand, 180, 395–403
3. Allen DG, Clugston E, Petersen Y, Röder IV, Chapman B & Rudolf R (2011). Interactions between Intracellular Calcium and Phosphate in Intact Mouse Muscle during Fatigue. J Appl Physiol 111 (2); 358-366
4. Álvarez Velásquez IM, Álvarez Velásquez FF, Álvarez Barreras F & Mena R (2006). El Proceso de Asimilación de la Fuerza en el Músculo del Ser Humano. Ra Ximhai, vol. 2, número 002; pp. 533-548
5. Astorino T & Kravitz L (2000). Glycogen and Resistance Training. IDEA Personal Trainer (July-August), IDEA Health & Fitness©
6. Balsom PD, Söderlund K & Ekblom B (1994). Creatine In Humans With Special Reference To Creatine Supplementation. Sports Med. 18, 268-280
7. Barbero JC (1999). Fundamentación y Consideraciones sobre la Suplementación con Creatina: Moda ó Ayuda Ergogénica. Departamento de Educación Física y Deportiva, Universidad de Granada, España. Código HUM – 0586
8. Barker AR, Welsman JR, Fulford J, Welford D, Armstrong N (2008). Muscle Phosphocreatine Kinetics in Children and Adults at the Onset and Offset of Moderate-Intensity Exercise. J Appl Physiol 105: 446–456
9. Barnett C, Hinds M & Jenkins D (1996). Effects of Oral Creatine Supplementation on Multiple Sprint Cycle Performance. Austr. J. Sports Med. 28, 35-39
10. Barton-Davis ER, Shoturma DI & Sweeney HL (1999). Contribution of Satellite Cells to IGF-I Induced Hypertrophy of Skeletal Muscle. Acta Physiol Scand 167, 301-305
11. Bemben MG & Lamont HS (2005). Creatine Supplementation and Exercise Performance, Recent Findings. Sports Med; 35 (2): 107-125
12. Bessman SP & Carpenterm CL (1985). The Creatine-Creatine Phosphate Energy Shuttle. Ann. Rev. Biochem. 54:831-862
13. Biwer CJ, Jensen RL, Schmidt WD & Watts PB (2003). The Effect of Creatine on Treadmill Running with High-Intensity Intervals. J. Strength. Cond. Res. 17, 439-445
14. Brault JF, Towse TF, Slade JM & Meyer RA (2007). Parallel Increases in Phosphocreatine and Total Creatine in Human Vastus Lateralis Muscle During Creatine Supplementation. IJSNEM 17 (6) [Abstract]
15. Brönnimann M (1995). Spitzenleistungen ohne “sauer” zu werden? . Move 6: 5–6
16. Brosnan ME & Brosnan JT (2007). Creatine: Endogenous Metabolite, Dietary and Therapeutic Supplement. Annu. Rev. Nutr. 27:241–61
17. Brosnan ME, Edison EE, da Silva R & Brosnan JT (2007). New Insights into Creatine Function and Synthesis. Advan. Enzyme Regul. 47 252–260
18. Burke DG, Chilibeck PD, Parise G, Candow DG, Mahoney D & Tarnopolsky M (2003). Effect of Creatine and Weight Training on Muscle Creatine and Performance in Vegetarians. Med. Sci. Sports Exerc. 35, 1946-1955
19. Burke DG, Candow DG, Chilibeck PD, MacNeil LG, Roy BD, Tarnopolsky MA & Ziegenfuss T (2008). Effect of Creatine Supplementation and Resistance-Exercise Training on Muscle Insulin-Like Growth Factor in Young Adults. International Journal of Sport Nutrition and Exercise Metabolism 18, 389-398
20. Calderón-Rivera A, Vega AV & Ávila G (2010). Creatine Supplementation Upregulates Excitation-Contraction Coupling in C2C12 Myotubes. Journal of Receptor, Ligand and Channel Research 3, 63–71
21. Carrillo P & Gilli MV (2011). Los Efectos que Produce la Creatina en la Performance Deportiva. Invenio 14 (26); 101-115
22. Casey A, Constantin-Teodosiu D, Howell S, Hultman E & Greenhaff PL (1996). Creatine Ingestion Favorably Affects Performance and Muscle Metabolism During Maximal Exercise in Humans. Am J Physiol 271: E31-E37
23. Casey A, Constantin-Teodosiu D, Howell S, Hultman E. & Greenhaff PL (1996). The Metabolic Response of Type I and II Muscle Fibres during Repeated Bouts of Maximal Exercise in Humans. Am Physiol; 271:E38-E43
24. Casey A & Greenhaff PL (2000). Does Dietary Creatine Supplementation Play a Role in Skeletal Muscle Metabolism and Performance? . Am J Clin Nutr 72: 607S–617S
25. Caretti A, Bianciardi P, Sala G, Terruzzi C, Lucchina F & Samaja M (2010). Supplementation of Creatine and Ribose Prevents Apoptosis in Ischemic Cardiomyocytes. Cell Physiol Biochem;26:831-838
26. Ceddia RB & Sweeney G (2004). Creatine Supplementation Increases Glucose Oxidation and AMPK Phosphorylation and Reduces Lactate Production in L6 Rat Skeletal Muscle. J Physiol 555 (2) : 409-421
27. Chanutin A (1925). The Fate of Creatine when Administred to Man. J Biol Chem 67, 29-41
28. Chicharro J & Fernández A (2006). Fisiología del Ejercicio. Madrid: Ed Médica Panamericana
29. Chilibeck PD, Magnus C & Anderson M (2007). Effect of In-Season Creatine Supplementation on Body Composition and Performance In Rugby Union Football Players. Appl. Physiol. Nutr. Metab. 32: 1052–1057
30. Christie DL (2007). Functional Insights into the Creatine Transporter. Subcellular Biochemistry 46: 99-118
31. Connett RJ & Sahlin Kent (2011). Control of Glycolysis and Glycogen Metabolism. Comprehensive Physiology Published Online: 1 Jan 2011, DOI: 10.1002/cphy.cp120119
32. Cooke WH, Grandjean PW & Barnes WS (1995). Effect of Oral Creatine Supplementation on Power Output and Fatigue during Bicycle Ergometry. J. Appl. Physiol. 78(2): 670-673
33. Cooke MB (2005). The Effects of Nutritional Supplementation on Regeneration of Muscle Function After Damage. Tesis de Doctorado para la obtención del título de Doctor en Fisiología, Facultad de Salud, Ingeniería y Ciencias, Universidad de Victoria, Victoria, Australia
34. Cooke MB, Rybalka E, Williams AD, Cribb PJ & Hayes A (2009). Creatine Supplementation Enhances Muscle Force Recovery after Eccentrically-Induced Muscle Damage in Healthy Individuals. Journal of the International Society of Sports Nutrition, 6:13
35. Cribb PJ & Hayes A (2006). Effects of Supplement-Timing and Resistance Exercise on Skeletal Muscle Hypertrophy. Med. Sci. Sports Exerc. in press, Nov
36. Cribb PJ, Williams AD, Stathis CG, Carey MF & Hayes A (2007). Effects of Whey Isolate, Creatine and Resistance Training on Muscle Hypertrophy. Med. Sci. Sports Exerc. in press
37. da Silva, Robin P., Nissim, Itzhak., Brosnan, Margaret E. & Brosnan, John T (2009). Creatine Synthesis: Hepatic Metabolism of Guanidinoacetate and Creatine in the Rat In Vitro and In Vivo. Am. J. Physiol. Endocrinol. Metab. 296:E256-E261
38. Dangott B, Schultz E & Mozdziak PE (2000). Dietary Creatine Monohydrate Supplementation Increases Satellite Cell Mitotic Activity during Compensatory Hypertrophy. Int J SportsMed 21, 13–16
39. Davies RC, Eston RG, Fulford J, Rowlands AV & Jones AM (2011). Muscle Damage Alters the Metabolic Response to Dynamic Exercise in Humans: a 31P-MRS Study. J Appl Physiol 111 (3); 782-790
40. Del Favero S, Roschel H, Artioli G, Ugrinowitsch C, Costa A, Barroso R, Negrelli AL, Otaduy MC, da Costa Leite C, Lancha-Junior HA & Gualano B (2011). Creatine but not Betaine Supplementation Increases Muscle Phosphorylcreatine Content and Strength Performance. Amino Acids Jul 9. [Epub ahead of print]
41. Deldicque L, Louis M, Theisen D, Nielens H, Dehoux M, Thissen JP, Rennie MJ & Francaux M (2005). Increased IGF mRNA in Human Skeletal Muscle after Creatine Supplementation. Med. Sci. Sports Exerc, Vol. 37, No. 5, pp. 731-736
42. Deldicque L, Theisen D, Bertrand L, Hespel P, Hue L, Francaux M (2007). Creatine Enhances Differentiation of Myogenic C2C12 Cells by Activating both p38 and Akt/PKB Pathways. Am J Physiol Cell Physiol 293: C1263–C1271
43. Deldicque L, Atherton P, Patel R, Theisen D, Nielens H, Rennie MJ, Francaux M (2008). Effects of Resistance Exercise with and without Creatine Supplementation on Gene Expression and Cell Signaling in Human Skeletal Muscle. J Appl Physiol 104: 371–378
44. Dempsey RL, Mazzone MF & Meurer LN (2002). Does Oral Creatine Supplementation Improve Strength? A meta-analysis. The Journal of Family Practice vol. 51, No.1
45. Derave W, Op’t Eijnde B, Verbessem P, Ramaekers M, Van Leemputte M, Richter EA & Hespel P (2003). Combined Creatine and Protein Supplementation in Conjunction with Resistance Training Promotes Muscle GLUT-4 Content and Glucose Tolerance in Humans. J Appl Physiol 94: 1910–1916
46. Derave W, Marescau B, Eede EV, Op‘t Eijnde, De Deyn PP & Hespel P (2004). Plasma Guanidino Compounds are altered by Oral Creatine Supplementation in Healthy Humans. J Appl Physiol 97: 852–857
47. Derave W, Straumann N, Olek RA & Hespel P (2006). Electrolysis Stimulates Creatine Transport and Transporter Cell Surface Expression in Incubated Mouse Skeletal Muscle: Potential Role of Reactive Oxygen Species. Am J Physiol Endocrinol Metab (July 18), Article in press
48. Dohm GL (2002). Invited Review: Regulation of Skeletal Muscle GLUT-4 Expression by Exercise. J Appl Physiol 93: 782–787
49. Dos Santos MG (2001). Estudio del Metabolismo Energético Muscular y de la Composición Corporal de Atletas por Métodos no Destructivos. Tesis de Doctorado para la obtención del título de Doctor en Bioquímica y Biología Molecular, Facultad de Ciencias, Departamento de Bioquímica y Biología Molecular, Universidad Autónoma de Barcelona, Barcelona, España
50. Drummond MJ, Dreyer HC, Fry CS, Glynn EL & Rasmussen BB (2009). Nutritional and Contractile Regulation of Human Skeletal Muscle Protein Synthesis and mTORC1 Signaling. Articles in Press. J Appl Physiol doi:10.1152
51. Ducray A, Kipfer S, Huber A, Andres RH, Seiler RW, Schlattner U, Wallimann T & Widmer HR (2005). Creatine and Neurotrophin 4/5 Promote Survival of Nitric Oxide Synthase Expressing Interneurons in Striatal Cultures. Neurosci Lett. Nov 25; 16314046. (Abstract)
52. Duke AM & Steele DS (1999). Effects of Creatine Phosphate on Ca2+ Regulation by the Sarcoplasmic Reticulum in Mechanically Skinned Rat Skeletal Muscle Fibres. Journal of Physiology, 517.2, pp. 447—458
53. Earnest CP, Snell PG, Rodriguez R & Almada AL (1995). The Effect of Creatine Monohydrate Ingestion on Anaerobic Power Indices, Muscular Strength and Body Composition. Acta Physiol Scand 153: 207–209
54. Eckerson JM, Bull AA & Moore GA (2008). Effect of Thirty Days of Creatine Supplementation with Phosphate Salts on Anaerobic Working Capacity and Body Weight in Men. Journal of Strength & Conditioning Research: Volume 22 - Issue 3 - pp 826-832
55. Essén B & Kaijser L (1978). Regulation of Glycolysis in Intermittent Exercise in Man. J. Physiol., 281, pp. 499-511
56. Finn JP, Ebert TR, Withers RT, Carey MF, Mackay M, Phillips JW & Febbraio MA (2001). Effect of Creatine Supplementation on Metabolism and Performance in Humans during Intermittent Sprint Cycling. Eur. J. Appl. Physiol. Occup. Physiol. 84, 243
57. Francescato MP, Cettolo V & di Prampero PE (2008). Influence of Phosphagen Concentration on Phosphocreatine Breakdown Kinetics, Data From Human Gastrocnemius Muscle. J Appl Physiol 105: 158–164
58. Fry DM & Morales MF (1980). A Reexamination of The Effects of Creatine on Muscle Protein Synthesis in Tissue Culture. J Cell Biol 84: 294-297
59. Fu YJ & Kemp RG (1973). Activation of Muscle Fructose-1,6-Diphosphatase by Creatine Phosphate and Citrate. J. biol. Chem. 248, 1124-1125
60. Gallo M, MacLean I, Tyreman N, Martins KJ, Syrotuik D, Gordon T & Putman CT (2008). Adaptive Responses to Creatine Loading and Exercise in Fast-Twitch Rat Skeletal Muscle. Am J Physiol Regul Integr Comp Physiol 294:R1319-R1328
61. Gerber I, ap Gwynn I, Alini M & Wallimann T (2005). Stimulatory Effects of Creatine on Metabolic Activity, Differentiation and Mineralization of Primary Osteoblast-Like Cells in Monolayer and Micromass Cell Cultures. European Cells and Materials, Vol. 10: 8-22
62. Gomez-Pinilla F, Vaynman S & Ying Z (2008). Brain-Derived Neurotrophic Factor Functions as a Metabotrophin to Mediate the Effects of Exercise on Cognition. Eur J Neurosci. December; 28(11): 2278–2287
63. González R, García D & Herrero JA (2003). La Suplementación Con Creatina en el Deporte y su Relación con el Rendimiento Deportivo. Revista Internacional de Medicina y Ciencias de la Actividad Física y el Deporte 3 (12): 242-259
64. Goodyear LJ & Kahn BB (1998). Exercise, Glucose Transport and Insulin Sensitivity. Annu Rev Med 49: 235-261
65. Gorostiaga EM (2007). Creatina: Bases Fisiológicas, Efectos y Aplicación al Entrenamiento Deportivo. Centro de Estudios Investigación y Medicina del Deporte de Navarra, Instituto Navarro de Deporte
66. Green AL, Simpson EJ, Littlewood JJ & MacDonald IA (1996). Carbohydrate Ingestion Augments Creatine Retention during Creatine Feeding in Humans. Acta Physiol Scand 158: 195-202
67. Green HJ, Grange F, Chin C, Goreham C, and Ranney D (1999). Exercise-Induced Decreases in Sarcoplasmic Reticulum Ca2+-ATPase Activity Attenuated by High-Resistance Training. Acta Physiol Scand 164: 141–146
68. Greenhaff PL, Casey A, Short AH, et al (1993). Influence of Oral Creatine Supplementation on Muscle Torque during Repeated Bouts of Maximal Voluntary Exercise in Man. Clin Sci; 84: 565-71
69. Greenhaff PL, Bodin K, Söderlund K & Hultman E (1994). Effect of Oral Creatine Supplementation on Skeletal Muscle Phosphocreatine Resynthesis. Am. J. Physiol. 266, E725-E730
70. Greenhaff PL (1996). Creatine Supplementation: Recent Developments. Brit. J. Sports Med. 30, 276-277
71. Greenwood M, Kreider RB, Melton C, Rasmussen C, Lancaster S, Cantler E, Milnor P & Almada A (2003). Creatine Supplementation during College Football Training does not Increase the Incidence of Cramping or Injury. Cell Biochem 244: 83–88
72. Greenwood M, Kreider MB, Earnest C, Rasmussen C & Almada A (2003). Differences In Creatine Retention Among Three Nutritional Formulations Of Oral Creatine Supplements. JEP online; 6(2):37-43
73. Harris RC, Söderlund K & Hultman E (1992). Elevation of Creatine in Resting and Exercised Muscle of Normal Subjects by Creatine Supplementation. Clinical Sci. 83, 367-374
74. Haussinger D, Roth ER, Lang F & Gerok W (1993). Cellular Hydration State: An Important Determinant of Protein Catabolism In Health And Disease. Lancet; 341:1330-1332
75. Hespel P (1999). Impact of Creatine Supplementation on Muscle Performance during Exercise, Training and Rehabilitation. Meeting Internazionale on: "CREATINA: dalla Scienza di Base all Applicatione Clinica". Fondazione Giovanni lorenzini, Medical Science Foundation, Via Appiani, 7-20121 Milano, I, Abstract book p 11
76. Hespel P, Op‘t Eijnde B, Leemputte MV, Ursø B, Greenhaff PL, Labarque V, Dymarkowski S, Hecke PV & Richter EA (2001). Oral Creatine Supplementation Facilitates The Rehabilitation of Disuse Atrophy and Alters The Expression of Muscle Myogenic Factors In Humans. Journal of Physiology, 536.2, 12464, pp.625–633
77. Hespel P & Derave W (2007). Ergogenic Effects of Creatine in Sports and Rehabilitation. Subcellular Biochemistry Volume 46; 245–259
78. Hoeger B (2005). Guía 4. Fuerza Muscular. Programa de Educación Física, Universidad de los Andes, Mérida, Venezuela
79. Holmes B & Dohm GL (2004). Regulation of GLUT-4 Gene Expression during Exercise. Med. Sci. Sports Exerc., Vol. 36, No. 7, pp. 1202–1206
80. Hultman E, Söderlund K, Timmons JA, Cederblad G & Greenhaff PL (1996). Muscle Creatine Loading In Men. J. Appl. Physiol. 81, 232-237
81. Ingwall JS (1976). Creatine and the Control of Muscle-Specific Protein Synthesis in Cardiac and Skeletal Muscle. Circ. Res. 38: I115–I123
82. Ivy JL (2004). Regulation of Muscle Glycogen Repletion, Muscle Protein Synthesis and Repair Following Exercise. Journal of Sports Science and Medicine 3, 131-138
83. Izquierdo M, Ibanez J, González-Badillo JJ & Gorostiaga EM (2002). Effects of Creatine Supplementation on Muscle Power, Endurance and Sprint Performance. Med Sci. Sports Exerc.34, 332-343
84. Izquierdo M, Ibañez J, Gorostiaga EM & González-Badillo JJ (2006). Efectos de la Suplementación con Creatina sobre la Potencia Muscular, la Resistencia y la Velocidad en Jugadores de Balonmano. G-SE Standard. 18/12/2006. g-se.com/a/689
85. Jahangir E, Vita JA, Handy D, Holbrook M, Palmisano J, Beal R, Loscalzo J & Eberhardt RT (2009). The Effect of L-arginine and Creatine on Vascular Function and Homocysteine Metabolism. Vascular Medicine 14: 239–248
86. Johnson NA, Stannard SR & Thompson MW (2004). Muscle Triglyceride and Glycogen in Endurance Exercise: Implications for Performance. Sports Med; 34 (3): 151-164
87. Johnson S, Knopps D, Miller J, Gorshe J & Luzinski C (2006). The Effects of Creatine Monohydrate on 1-RM Bench Press. J. Undergrad. Kin. Res.; 1(2): 8-14
88. Jones AM, Wilkerson DP & Fulford J (2009). Influence of Dietary Creatine Supplementation on Muscle Phosphocreatine Kinetics during Knee-Extensor Exercise in Humans. Am J Physiol Regul Integr Comp Physiol 296: R1078–R1087
89. Jørgensen SB, Richter EA & Wojtaszewski JF (2006). Role of AMPK in Skeletal Muscle Metabolic Regulation and Adaptation in Relation to Exercise. J Physiol 574.1; pp 17–31
90. Ju JS, Smith JL, Oppelt PJ & Fisher JS (2005). Creatine Feeding Increases GLUT4 Expression in Rat Skeletal Muscle. Am J Physiol Endocrinol Metab 288: E347–E352
91. Kemp BE, Mitchelhill KI, Stapleton D, Michell BJ, Chen ZP & Witters LA (1999). Dealing with Energy Demand: The AMP-Activated Protein Kinase. TIBS 24; 22-25
92. Kemp G (2009). Interpreting the Phosphocreatine Time Constant in Aerobically Exercising Skeletal Muscle. J Appl Physiol 106:350
93. Kilduff LP, Vidakovic P, Cooney G, Twycross-Lewis R, Amuna P, Parker M, Paul L & Pitsiladis YP (2002). Effects of Creatine on Isometric Bench-Press Performance in Resistance Trained Humans. Med Sci. Sports Exerc. 34, 1176-1183
94. Kilduff LP, Georgiades E, James N (2004). The Effects of Creatine Supplementation on Cardiovascular, Metabolic and Thermoregulatory Responses during Exercise in the Heat in Endurance-Trained Humans. Int. J. Sport Nutr. Exerc. Metab 14, 443-460
95. Kim HJ, Kim CK, Carpentier A, Poortmans JR (2011). Studies on the Safety of Creatine Supplementation. Amino Acids. May;40(5):1409-18
96. Kindig CA, Howlett RA, Stary CM, Walsh B & Hogan MC (2005). Effects of Acute Creatine Kinase Inhibition on Metabolism and Tension Development in Isolated Single Myocytes. J Appl Physiol 98: 541–549
97. Krauss G (2003). Biochemistry of Signal Transduction and Regulation. Third, Completely Revised Edition. Germany. WILEY-VCH Verlag GmbH & Co. KGaA, Weinheim
98. Kreider RB (1998). Creatine, The Next Ergogenic Supplement? . In: Sportscience Training & Technology. Internet Society for Sport Science. http://www.sportsci.org/traintech/creatine/rbk.html
99. Kreider RB (1998). Creatine Supplementation and Exercise Performance: An Update. Journal of the American College of Nutrition 17 (3), 216–234
100. Kreider RB (2003). Effects of Creatine Supplementation on Performance and Training Adaptations. Mol Cell Biochem 244: 89–94
101. Kreider RB, Almada AL, Antonio J, Broeder C, Earnest C, Greenwood L, Greewood M, Incledon T, Kalman DS, Kerksick C, Kleiner SM, Lowery LM, Leutholtz B, Mendel R, Rasmussen CJ, Stout JR, Weir JP, Willo (2003). Exercise & Sport Nutrition: A Balanced Perspective for Exercise Physiologists. Professionalization in Exercise Physiology Online
102. Kreider RB, Wilborn CD, Taylor L, Campbell B, Almada AL, Collins R, Cooke M, Earnest CP, Greenwood M, Kalman DS, Kerksick CD, Kleiner SM, Leutholtz B, Lopez H, Lowery LM, Mendel R, Smith A, Spano M, W (2010). ISSN Exercise & Sport Nutrition Review: Research & Recommendations. Journal of the International Society of Sports Nutrition, 7:7 http://www.jissn.com/content/7/1/7
103. Kreider RB & Jung YP (2011). Creatine Supplementation in Exercise, Sport, and Medicine. Journal of Exercise Nutrition & Biochemistry 15 (2); 53-69
104. Kutz MR & Gunter MJ (2003). Creatine Monohydrate Supplementation on Body Weight and Percent Body Fat. J. Strength Cond. Res. 17, 817-821
105. Lang F, Busch GL, Ritter M, Völkl H, Waldegger S, Gulbins E & Häussinger D (1998). Functional Significance of Cell Volume Regulatory Mechanisms. Physiological Reviews Vol. 78, No. 1
106. Lemon P, Boska M, Bredle D, Rogers M, Ziegenfuss T & Newcomer B (1995). Effect of Oral Creatine Supplementation on Energetic during Repeated Maximal Muscle Contraction. Medicine & Science in Sports & Exercise, 27, S204
107. Li JL, Wang XN, Fraser SF, Carey MF, Wrigley TV & McKenna MJ (2002). Effects of Fatigue and Training on Sarcoplasmic Reticulum Ca2+ Regulation in Human Skeletal Muscle. J Appl Physiol 92: 912–922
108. Lopez RM, Casa DJ, McDermott BP, Ganio MS, Armstrong LE & Maresh CM (2009). Does Creatine Supplementation Hinder Exercise Heat Tolerance or Hydration Status? A Systematic Review with Meta-Analyses. Journal of Athletic Training; 44(2):215-223
109. Louis M, Poortmans JR, Francaux M, Berre J, Boisseau N, Brassine E, Cuthbertson DJ, Smith K, Babraj JA, Waddell T & Rennie MJ (2003). No Effect of Creatine Supplementation on Human Myofibrillar and Sarcoplasmic Protein Synthesis after Resistance Exercise. Am J Physiol Endocrinol Metab 285, E1089–E1094
110. Louis M, Poortmans JR, Francaux M, Hultman E, Berre J, Boisseau N, Young VR, Smith K, Meier-AugensteinW, Babraj JA, Waddell T & Rennie MJ (2003). Creatine Supplementation has no Effect on Human Muscle Protein Turnover at Rest in the Postabsorptive or Fed States. Am J Physiol Endocrinol Metab 284, E764–E770
111. Machado M, Pereira R, Sampaio-Jorge F, Knifis F & Hackney A (2009). Creatine Supplementation: Effects on Blood Creatine Kinase Activity Responses to Resistance Exercise and Creatine Kinase Activity Measurement. Brazilian Journal of Pharmaceutical Sciences 45 (4), 751-757
112. Mackenzie MG, Hamilton DL, Murray JT, Taylor PM & Baar K (2009). mVps34 is Activated Following High-Resistance Contractions. J Physiol 587.1 pp 253–260
113. Maganaris CN & Maughan RJ (1998). Creatine Supplementation Enhances Maximum Voluntary Isometric Force and Endurance Capacity in Resistance Trained Men. Acta Physiol. Scand. 163, 279-287
114. Maughan RJ, King DS & Lea T (2004). Dietary supplements. Journal of Sports Sciences 222, 95-113
115. Maus MJ (2007). Der Kreatin Report. Copyright by GMC GmbH und www.fitforhealth.de
116. McCarthy JT & Kumar R (2000). Divalent Cation Metabolism; Calcium, Chapter 15: Disorders of Water, Electrolytes, and Acid-Base. Vol. 1. R. W. Schrier (Ed.). The Atlas of Diseases of the Kidney Series)
117. McConell GK, Shinewell J, Stephens TJ, Stathis CG, Canny BJ & Snow RJ (2005). Creatine Supplementation Reduces Muscle Inosine Monophosphate during Endurance Exercise in Humans. Med Sci Sports Exerc 37, 2054-2061(Abstract)
118. McNaughton LR, Dalton B & Tarr J (1998). The Effects of Creatine Supplementation on High-Intensity Exercise Performance in Elite Performers. Eur. J. Appl. Physiol. 78:236-240
119. Mesa J, Ruiz J, Hernández J, Mula F, Castillo M & Gutiérrez A (2011). Creatina como Ayuda Ergogénica. Efectos Adversos. Archivos de Medicina del Deporte XVIII (86), 613-619
120. Mesa J, Ruiz J, González-Gross M, Gutiérrez A & Castillo M (2002). Oral Creatine Supplementation and Skeletal Muscle Metabolism in Physical Exercise. Sports Med 32 (14): 903-944
121. Meyer RA (1989). Linear Dependence of Muscle Phosphocreatine Kinetics on Total Creatine Content. Am. J. Physiol. 257 (Cell Physiol. 26): C1149-C1157
122. Murphy R, McConell G, Cameron-Smith D, Watt K, Ackland L, Walzel B, Wallimann T & Snow R (2001). Creatine Transporter Protein Content, Localization and Gene Expression in Rat Skeletal Muscle. Am J Physiol Cell Physiol 280: C415–C422
123. Murray R, Granner D, Mayes P & Rodwell V (2003). Harper’s Illustrated Biochemistry 26th Edition. Ed. Lange Medical Books/McGraw-Hill
124. Nelson AG, Arnall DA, Kokkonen J, Day R & Evans J (2001). Muscle Glycogen Supercompensation is Enhanced by Prior Creatine Supplementation. Med Sci. Sports Exerc. 33, 1096-1100
125. Nielsen JN & Richter EA (2003). Regulation of Glycogen Synthase in Skeletal Muscle during Exercise. Acta Physiol Scand, 178, 309–319
126. O’Connor RS, Steeds CM, Wiseman RW & Pavlath GK (2008). Phosphocreatine as an Energy Source for Actin Cytoskeletal Rearrangements during Myoblast Fusion. J Physiol 586.12, pp 2841–2853
127. Ohira Y, Matsuoka Y, Kawano F, Ogura A, Higo Y, Ohira T, Terada M, Oke Y & Nakai N (2011). Effects of Creatine and Its Analog, β-Guanidinopropionic Acid, on the Differentiation of and Nucleoli in Myoblasts. Biosci. Biotechnol. Biochem., 75 (6), 1085–1089
128. Olsen S, Aagaard P, Kadi F, Tufekovic G, Verney J, Olesen JL, Suetta C & Kjær M (2006). Creatine Supplementation Augments the Increase in Satellite Cell and Myonuclei Number in Human Skeletal Muscle Induced by Strength Training. J Physiol 573, 525–534
129. Onofre T, Gualano B, Dias M, Ozores V & Lancha Jr AH (2008). Efeitos da Suplementação de Creatina na Captação de Glicose em Ratos Submetidos ao Exercício Físico. Rev Bras Med Esporte – Vol. 14, No 5 – Set/Out
130. Op’t Eijnde B, Richter EA,Henquin JC, Kiens B & Hespel P (2001). Effect of Creatine Supplementation on Creatine and Glycogen Content in Rat Skeletal Muscle. Acta Physiol Scand 171, 169–176
131. Op’t Eijnde B, Urso B, Richter EA, Greenhaff PL & Hespel P (2001). Effect of Oral Creatine Supplementation on Human Muscle GLUT4 Protein Content after Immobilization. Diabetes 50, 18–23
132. Op’t Eijnde B, Derave W, Wojtaszewski JF, Richter EA & Hespel P (2005). AMP Kinase Expression and Activity in Human Skeletal Muscle: Effects of Immobilization, Retraining and Creatine Supplementation. J Appl Physiol 98: 1228–1233
133. Paddon-Jones D, Børsheim E & Wolfe RR (2004). Potential Ergogenic Effects of Arginine and Creatine Supplementation. J Nutr 134: 2888S–2894S
134. Parise G, Mihic S, MacLennan D, Yarasheski KE & Tarnopolsky MA (2001). Effects of Acute Creatine Monohydrate Supplementation on Leucine Kinetics and Mixed-Muscle Protein Synthesis. J Appl Physiol 91: 1041–1047
135. Peak M, Al-Habori M & Agius L (1992). Regulation of Glycogen Synthesis and Glycolysis by Insulin, pH and Cell Volume: Interactions Between Swelling and Alkalinization in Mediating the Effects of Insulin. Biochem. J. 282, 797-805
136. Peral MJ, García-Delgado M, Calonge ML, Durán JM, De La Horra MC, Wallimann T, Speer O & Ilundáin AA (2002). Human, Rat and Chicken Small Intestinal Na+–Cl- Creatine Transporter: Functional, Molecular Characterization and Localization. Journal of Physiology 545.1; 133–144
137. Perry RL & Rudnicki MA (2000). Molecular Mechanisms Regulating Myogenic Determination and Differentiation. Frontiers in Bioscience 5, d750-767
138. Persky AM & Brazeau GA (2001). Clinical Pharmacology of the Dietary Supplement Creatine Monohydrate. Pharmacol Rev 53:161–176
139. Pischel I & Gastner T (2007). Creatine – Its Chemical Synthesis, Chemistry and Legal Status. Subcellular Biochemistry 46: 275-289
140. Ponticos M, Lu QL, Morgan JE, Hardie DG, Partridge TA & Carling D (1998). Dual Regulation of the AMP-Activated Protein Kinase Provides a Novel Mechanism for the Control of Creatine Kinase in Skeletal Muscle. The EMBO Journal Vol.17 No.6 pp.1688–1699
141. Poprzęcki S, Zając A, Czuba M & Waśkiewicz Z (2008). The Effects of Terminating Creatine Supplementation and Resistance Training on Anaerobic Power and Chosen Biochemical Variables in Male Subjects. Journal of Human Kinetics volume 20, 99‐110
142. Pulido SM, Passaquin AC, Leijendekker WJ, Challet C, Wallimann T & Ruëegg UT (1998). Creatine Supplementation Improves Intracellular Ca2+ Handling and Survival in mdx Skeletal Muscle Cells. FEBS Letters 439; 357-362
143. Rae C, Digney AL, McEwan SR & Bates TC (2003). Oral Creatine Monohydrate Supplementation Improves Brain Performance: A Double-Blind, Placebo-Controlled, Cross-Over Trial. Proc. R. Soc. Lond. B 270, 2147-2150
144. Rahmani-Nia F, Rahnama N & Garazhian Y (2008). The Comparative Effects of Oral Creatine Supplementation and High Protein on Muscular Strength and Body Composition. International Journal of Sports Science and Engineering, Vol. 02 (4): 223-230
145. Rawson ES & Volek JS (2003). Effects of Creatine Supplementation and Resistance Training on Muscle Strength and Weightlifting Performance. J. Strength Cond. Res. 17(4):822–831
146. Rawson ES & Persky AM (2007). Mechanisms of Muscular Adaptations to Creatine Supplementation. International SportMed Journal, Vol.8 (2): 43-53
147. Rawson ES, Stec MJ, Frederickson SJ & Miles MP (2010). Low-dose Creatine Supplementation Enhances Fatigue Resistance in the Absence of Weight Gain. Nutrition http://www.ripped4less.com
148. Ren JM, Semenkovich CF & Holloszy JO (1993). Adaptation of Muscle to Creatine Depletion: Effect on GLUT-4 Glucose Transporter Expression. Am J Physiol 264 (Cell Physiol. 33): C146-C150
149. Rico-Sanz J, Thomas EL, Jenkinson G, Mierisová S, Iles R & Bell JD (1999). Diversity in Levels of Intracellular Total Creatine and Triglycerides in human Skeletal Muscles Observed by 1H-MRS. J Appl Physiol 87(6): 2068–2072
150. Rico-Sanz J (2000). Creatine Reduces Human Muscle PCr and pH Decrements and Pi Accumulation during Low-Intensity Exercise. J Appl Physiol 88: 1181–1191
151. Rico-Sanz J, Zehnder M, Buchli R, Kühne G & Boutellier U (2008). Creatine Feeding does not Enhance Intramyocellular Glycogen Concentration during Carbohydrate Loading: an In Vivo Study by 31P- and 13C-MRS. Journal of Physiology and Biochemistry, ISSN 1138-7548, Vol. 64 (3): 189-196
152. Robinson TM, Sewell DA, Hultman E & Greenhaff PL (1999). Role of Submaximal Exercise in Promoting Creatine and Glycogen Accumulation in Human Skeletal Muscle. J. Appl. Physiol. 87, 598-604
153. Rooney K, Bryson J, Digney AL, Rae CD & Thompson CH (2003). Creatine Supplementation Affects Glucose Homeostasis but Not Insulin Secretion in Vegetarians. Ann Nutr Metab 47: 11–15
154. Ropero-Miller JD, Paget-Wilkes H, Doering PL & Goldberger BA (2000). Effect of Oral Creatine Supplementation on Random Urine Creatinine, pH, and Specific Gravity Measurements. Clinical Chemistry 46, No. 2; pp 295-297
155. Roschel H, Gualano B, Marquezi M, Costa A & Lancha AH (2010). Creatine Supplementation Spares Muscle Glycogen during High Intensity Intermittent Exercise in Rats. Journal of the International Society of Sports Nutrition 7:6
156. Rossi AM, Eppenberger HM, Volpe P, Cotrufo R, Wallimann T (1990). Muscletype MM Creatine Kinase is Specifically Bound to Sarcoplasmic Reticulum and Can Support Ca2+ Uptake and Regulate Local ATP/ADP Ratios. J Biol Chem.; 265(9):5258–5266
157. Roussel D, Lhenry F, Ecochard L, Sempore B, Rouanet JL & Favier R (2000). Differential Effects of Endurance Training and Creatine Depletion on Regional Mitochondrial Adaptations in Rat Skeletal Muscle. Biochem J 350: 547-553
158. Safdar A, Yardley NJ, Snow R, Melov S & Tarnopolsky MA (2008). Global and Targeted Gene Expression and Protein Content in Skeletal Muscle of Young Men Following Short-term Creatine Monohydrate Supplementation. Physiol Genomics 32: 219–228
159. Saremi A, Gharakhanloo R, Sharghi S, Gharaati MR, Larijani B & Omidfar K (2010). Effects of Oral Creatine and Resistance Training on Serum Myostatin and GASP-1. Molecular and Cellular Endocrinology 317, 25–30
160. Scarpa A, Carafoli E & Papa S (1992). Ion Motive ATPases: Structure, Function and Regulation. Annals NY Academiy Sciences 671
161. Schedel JM, Tanaka H, Kiyonaga A, Shindo M & Schutz Y (2000). Acute Creatine Loading Enhances Human Growth Hormone Secretion. J Sports Med Phys Fitness 40:336-342
162. Schiaffino & Mammucari (2011). Regulation of Skeletal Muscle Growth by the IGF1-Akt/PKB Pathway: Insights from Genetic Models. Skeletal Muscle 1:4
163. Schröder H, Terrados N & Tramullas A (2005). Risk Assessment of the Potential Side Effects of Long-Term Creatine Supplementation in Team Sport Athletes. Eur J Nutr 44 : 255-261
164. Sewell DA, Robinson TM & Greenhaff PL (2008). Creatine Supplementation Does Not Affect Human Skeletal Muscle Glycogen Content In The Absence Of Prior Exercise. J. Appl. Physiol. 104:508-512
165. Shepherd PT & Kahn BB (1999). Glucose Transporters and Insulin Action; Implications for Insulin Resistance and Diabetes Mellitus. The New England Journal of Medicine Volume 341 Number 4; 248-257
166. Smith SA, Montain SJ, Matott RP, Zientara GP, Jolesz FA & Fielding RA (1998). Creatine Supplementation and Age Influence Muscle Metabolism during Exercise. J. Appl. Physiol. 85(4): 1349–1356
167. Smith CA, Chetlin RD, Gutmann L, Yeater RA & Always SE (2006). Effects of Exercise and Creatine on Myosin Heavy Chain Isoform Composition in Patients with Charcot–Marie–Tooth Disease. Muscle Nerve 34: 586–594
168. Snow RJ & Murphy RM (2001). Creatine and the Creatine Transporter: A Review. Molecular and Cellular Biochemistry 224: 169–181
169. Snow RJ, Wright CR, Quick MJ, Garnham AP, Watt KK & Russell AP (2008). The Effects of Acute Exercise and Creatine Supplementation on Akt Signalling in Human Skeletal Muscle. Proceedings of the Australian Physiological Society Vol. 39, 92P
170. Speer O, Neukomm LJ, Murphy RM, Zanolla E, Schlattner U, Henry H, Snow RJ & Wallimann T (2004). Creatine Transporters: A Reappraisal. Mol Cell Biochem 256/257: 407-424
171. Stec MJ & Rawson ES (2010). Benefits of Creatine Supplementation for Older Adults. Brazilian Journal of Biomotricity 4 (4): 215-226
172. Stout JR, Antonio J & Kalman D (2008). Essentials of Creatine in Sports and Health. United States of America. Ed Humana Press Inc
173. Syrotuik DG & Bell GJ (2004). Acute Creatine Monohydrate Supplementation: A Descriptive Physiological Profile of Responders vs. Nonresponders. J. Strength. Cond. Res. 18, 610-617
174. The American College of Sports Medicine Roundtable (2000). The Physiological and Health Effects of Oral Creatine Supplementation. Med. Sci. Sports Exerc., Vol. 32, No. 3, pp. 706–717
175. Uzzan M, Nechrebeki J, Zhou P & Labuza TP (2009). Effect of Water Activity and Temperature on the Stability of Creatine during Storage. Drug Development and Industrial Pharmacy 35(8): 1003–1008
176. van Loon LJ, Murphy R, Oosterlaar AM, Cameron-Smith D, Hargreaves M, et al (2004). Creatine Supplementation Increases Glycogen Storage but Not GLUT-4 Expression In Human Skeletal Muscle. Clin. Sci. (Lond.) 106:99–106
177. Vandenberghe K. et al (1996). Caffeine Counteracts the Ergogenic Action of Muscle Creatine Loading. J. Appl. Physiol. 80, 452-457
178. Vandenberghe K, Goris M, Van Hecke P, Van Leemputte M, Van Gerven L, Hespel P (1996). Prolonged Creatine Intake Facilitates the Effects of Strength Training on Intermittent Exercise Capacity. Insider 4(3): 1–2
179. Vandenberghe K, Goris M, Van Hecke P, Van Leemputte M, Vangerven L & Hespel P (1997). Long-Term Creatine Intake is Beneficial to Muscle Performance During Resistance Training. J. Appl. Physiol. 83(6): 2055–2063
180. Vandenberghe K, Van Hecke P, Van Leemputte M, Vanstapel F & Hespel P (1997). Inhibition of Muscle Phosphocreatine Resynthesis by Caffeine after Creatine Loading. Med Sci Sports Exerc 29: S249 (Abstract)
181. Volek JS, Duncan ND, Mazzetti SA, Staron RS, Putukian M, Gómez AL, Pearson DR, Fink WJ & Kraemer WJ (1999). Performance and Muscle Fiber Adaptations to Creatine Supplementation and Heavy Resistance Training. Med Sci Sports Exerc 31, 1147-1156
182. Volek JS, Mazzetti SA, Farquhar WB, Barnes BR, Gomez AL & Kraemer WJ (2001). Physiological Responses to Short-Term Exercise in the Heat after Creatine Loading. Med Sci Sports Exerc 33(7); 1101-1108
183. Volek JS & Rawson ES (2004). Scientific Basis and Practical Aspects of Creatine Supplementation for Athletes. Nutrition 20; 609–61
184. Wallimann T & Hemmer W (1994). III-2 Creatine Kinase in Non-Muscle Tissues and Cells. Mol. Cell. Biochem. 133/134: 193-220
185. Wallimann T (2008). Mehr Energie – Mehr Leistung, Kreatin – Warum, Wann und für Wen?. Schweizer Zeitschrift für Ernärungsmedizin 5
186. Wallimann T (2009). Kreatin in der Allgemeinmedizin, Mehr Energie - Mehr Leistung. Ars. Medici. Dossier. VII+VIII, 28-31
187. Wallimann T, Tokarska-Schlattner M & Schlattner U (2011). The Creatine Kinase System and Pleiotropic Effects of Creatine. Amino Acids 40:1271–1296
188. Warber JP, Tharion WJ, Patton JF, Champagne CM, Mitotti P & Lieberman HR (2002). The Effect of Creatine Monohydrate Supplementation on Obstacle Course and Multiple Bench Press Performance. J. Strength Cond. Res. 16, 500-508
189. Williams MH, Kreider RB & Branch JD (1999). Creatine; The Power Supplement. United States of America. Ed Human Kinetics
190. Willoughby DS & Rosene J (2001). Effects of Oral Creatine and Resistance Training on Myosin Heavy Chain Expression. Med Sci Sports Exerc;33:1674
191. Willoughby DS & Rosene JM (2003). Effects of Oral Creatine and Resistance Training on Myogenic Regulatory Factor Expression. Med. Sci. Sports Exerc., Vol. 35, No. 6, pp. 923-929
192. Wyss M & Kaddurah-Daouk R (2000). Creatine and Creatinine Metabolism. Physiol. Rev. 80: 1107–1213
193. Yang YC, Fann MJ, Chang WH, Tai LH, Jiang JH & Kao LS (2010). Regulation of Sodium-Calcium Exchanger Activity by Creatine Kinase under Energy-Compromised Conditions. The Journal of Biological Chemistry Vol. 285, No. 36, pp. 28275–28285
194. Yquel RJ, Arsac LM, Thiaudiere E, Canioni P & Manier G (2002). Effect of Creatine Supplementation on Phosphocreatine Resynthesis, Inorganic Phosphate Accumulation and pH during Intermittent Maximal Exercise. J Sports Sci 20: 427–437
195. Ziegenfuss T, Lowery LM & Lemon P (1998). Acute Fluid Volume Changes in Men during Three Days of Creatine Supplementation. J. Exerc. Physiol. Online, 1-3
196. Ziegenfuss T, Lemon P, Rogers MR, Ross R & Yarasheski KE (2000). Ingestion: Effects on Muscle Volume, Anaerobic Power, Fluid Volumes, and Protein Turnover. Med. Sci. Sports Exerc. 29, S127
197. Zuniga JM, Housh TJ, Camic CL, Hendrix CR, Mielke M, Johnson GO, Housh DJ & Schmidt RJ (2012). The Effects of Creatine Monohydrate Loading on Anaerobic Performance and 1-RM Strength. J Strength Cond Res. 26(6):1651-1656