Actividad Física y Salud del Esqueleto en Adolescentes
Physical Activity and Skeletal Health in Adolescents
Donald A Bailey1 y Alan D Martin2
1College of Physical Education, University of Saskatchewan, Saskatoon SK, Canada S7N OWO.
2School of Human Kinetics, University of British Columbia, Vancouver, BC, Canada V6T 1W5.
Artículo publicado en el journal Revista de Educación Física, Volumen 1, Número 4 del año 2024.
Publicado 4 de enero de 2024
Resumen
Palabras clave: estructura ósea, ejercicio, osificación, adolescencia, pubertad
Abstract
Keywords: skeletal, activity, exercise, health, adolescents
INTRODUCCIÓN
El interés en la fragilidad del esqueleto en la vejez ha resultado en un considerable caudal de investigaciones para identificar factores subyacentes de riesgo que reducen los niveles de densidad ósea ante la edad avanzada, particularmente en mujeres, donde el problema es pronunciado. Tres factores determinantes se han advertido como contribuyentes a explicar la disminución de masa ósea en poblaciones de edad mayor: a) déficit en el alcance de un pico suficiente de masa ósea durante los años crecimiento; b) falla en mantener este pico de masa ósea por un período suficiente, durante los años adultos; y c) pérdida acelerada de hueso en los años finales de la vida (Chesnut, 1991). Es probable que, una masa ósea insuficiente en los años de la vejez sea el resultado de la combinación de estos tres factores. Nuestra comprensión de la osteoporosis en la vejez se halla limitada por nuestra falta de conocimiento en lo concerniente a los determinantes para el acrecentamiento de la masa ósea durante los años del crecimiento. El establecimiento de un nivel óptimo de masa ósea durante los años del crecimiento es una consideración crucial, en términos de una adecuada longevidad esquelética. La masa ósea del adulto, a cualquier edad, es un reflejo del hueso ganado durante su desarrollo, y a la vez a la subsiguiente pérdida ósea con el avance de la edad. Desde el momento en que la pérdida ósea es una normal consecuencia de la edad, aquellos quienes adquieren una mayor masa ósea durante las primeras dos décadas de vida deberían poder reducir los riesgos de problemas de salud, asociados con fragilidad esquelética en la tercera edad. Al menos un 90 %, y probablemente más, del total de los recursos óseos del adulto han sido depositados hacia el final de la adolescencia (Glastre y cols., 1990; Matkovic y cols., 1990). Esto ha dirigido el estudio hacia los factores que pueden acrecentar la ganancia ósea en los niños, y es la génesis del concepto de “pico de masa ósea”.
Hay todavía varios informes importantes que hurgan en el tema del pico de masa ósea y necesitan clarificación. Mientras que el concepto de masa ósea no es ambiguo, las mediciones más actuales son de “densidad mineral ósea” (BMD), típicamente en la cadera o en columna lumbar, aunque algunas veces para el cuerpo entero. Por lo tanto, los valores para el pico de BMD para diferentes sitios del esqueleto pueden ocurrir a distintas edades. Los estudios longitudinales para establecer esta evidencia no se han hecho aún. Las mujeres tienen un pico de masa ósea menor que los hombres porque sus esqueletos son de menor tamaño físico; no obstante el dimorfismo en los valores de BMD es todavía controversial y puede variar con el sitio esquelético estudiado (Bonjour y cols., 1991). Por ejemplo, mientras un estudio mediante Tomografía Computada demostró que no había diferencias entre la densidad vertebral de jóvenes de ambos sexos (Gilsanz y cols., 1988), se ha presentado evidencia de que las mujeres adultas tienen mayor BDM lumbar que sus pares masculinos (Kelly y cols., 1990). Algunos de los problemas en esta área se relacionan con diferencias en las técnicas de medición inherentes al BMD (Katzman y cols., 1991; Kroger y cols., 1992); pero no los discutiremos en este trabajo.
Mientras hay algunas preguntas sin respuesta acerca del pico de masa ósea, sí está claro que la adolescencia es una etapa crucial en términos de acumulación de densidad ósea (Ott, 1991). Los determinantes de la masa ósea durante la adolescencia incluyen: factores genéticos, factores de carga mecánica (ej., actividad física), suficiencia nutricional (ej., calcio), funcionamiento hormonal, y otros factores (ej., drogas). Debería notarse que cada factor que influye en el acrecentamiento de la densidad ósea durante la adolescencia interactúa con los demás. Por ejemplo, el estrés mecánico sobre los huesos durante la actividad física puede llevar a un incremento de la densidad mineral de los huesos (BMD). Sin embargo, bajos niveles de estrógenos endógenos asociados con disfunción menstrual en las jóvenes puede llevar a una reducción de densidad ósea, o impedir tasas normales de incremento (Loucks, 1985). Esto se observa, generalmente, cuando se producen altos niveles de actividad en coincidencia con privación nutricional (Yaeger y cols., 1993). Por ende, el efecto positivo de la carga mecánica está influido por el estado hormonal y nutricional. Hay una relación sinergética entre actividad física y nutrición. Los efectos beneficiosos de la actividad física no se cumplen si el calcio de la dieta es insuficiente (Kanders y cols., 1988). A la inversa, la suplementación con calcio, en ausencia de una actividad que estimule sobrecarga leve con pesos, es inefectiva en términos de mantenimiento óseo (Kanis, 1991), mientras que la ingesta de calcio adecuada durante el período vivido, aumenta los efectos del ejercicio sobre la construcción de los huesos (Helioua y Anderson, 1989). Debería, por lo tanto, hacerse notar que el calcio, por sí sólo, no es causante de salud esquelética, aunque sea una condición necesaria para ésta; las cargas mecánicas son el factor preeminente en términos de integridad esquelética (Heaney, 1991).
La posibilidad de aumentar la densidad ósea durante los años de crecimiento es un área de considerable interés, especialmente en vista de la alta relación entre el estado de la densidad ósea del adulto y el riesgo de fractura en la población de tercera edad. La fragilidad del esqueleto en la vejez representa el mayor problema de salud a través de su asociación con fracturas relacionadas con la edad, particularmente vertebrales, de cadera y de extremidad distal del radio. Cerca de un millón de estas fracturas ocurren anualmente en los EEUU (Melton, 1990). Se estima que un tercio de todas las mujeres mayores de 65 años sufrirán una fractura vertebral alguna vez en su vida (Riggs y Melton, 1986). Un estudio reciente sugiere que, en las mujeres post-menospáusicas, ha habido un incremento estadísticamente significativo en la incidencia de fracturas vertebrales, a consecuencia de traumas mínimos o moderados, asociados a inactividad física como un factor contribuyente (Cooper y cols., 1992). La enormidad de este problema, y los costos asociados a él, pueden crecer sólo en respuesta al rápido incremento del número de personas de tercera edad en la población.
Ha sido bien documentado que la frecuencia de fracturas se incrementa cuando la masa ósea y la densidad de la misma decrecen (Melton y cols., 1986; Wasnich, 1991); por ende la baja densidad ósea es uno de los mayores determinantes de fracturas (Johnston y Slmenda, 1991). Mientras que el factor genético es muy importante en el estado de densidad ósea, un estudio reciente de 40 familias, indica que cerca de la mitad de la variancia de la densidad ósea mineral es atribuible a influencias no hereditarias (Krall y Dawson-Hughes, 1993), y hay considerable evidencia de que la inactividad física puede ser un importante factor (Eisman y cols., 1991). El potencial que tiene un esfuerzo físico con ligeros pesos (weight-bearing exercise) en reducir la tasa de pérdida de la densidad ósea en los adultos, ha sido ampliamente estudiado y hay una buena cantidad de excelentes revisiones que cubren este tópico (Drinkwater, 1990; Snow-Harter y Marcus, 1991; Gutin y Kaspar, 1992).
LOS EFECTOS DE LA CARGA MECÁNICA
Los efectos de cargas mecánicas variables sobre el esqueleto, particularmente en desuso, han sido apreciados por más de un siglo, pero solamente en los últimos 20 años los investigadores han intentado conocer los mecanismos que relacionan causa y efecto. Sin embargo, las últimas técnicas que permiten colocar medidores de tensión o dinamómetros sobre las superficies de los huevos en vivo, y el uso de sensores que transmiten regímenes específicos de carga, son altamente invasivos, lo que las hace viables, por ahora, solamente en animales de experimentación (Lanyon, 1992). Con el refinamiento reciente de la desintometría ósea, han sido publicados moderados cúmulos de información sobre densidad ósea y ejercicio en adultos; referente a estudios en niños, exceptuando algunos reportes acerca de los valores normales, no existen datos. Afortunadamente, tiene consistencia la evidencia que sugiere que, los valores en animales son relevantes para seres humanos, y que las relaciones entre ejercicios y hueso son suficientemente compatibles, por lo que, los trabajos publicados sobre animales y humanos adultos podrían aprovecharse para anticipar algunas conclusiones y recomendaciones con respecto a los adolescentes.
Algunas series de estudios en animales, particularmente aquellos trabajos de Lanyon y cols. (1992), han demostrado que la variable clave que es intermediaria entre cargas esqueléticas (actividad física) y masa ósea, es la tensión mecánica inducida (“strain”). Los cambios en las tensiones internas del hueso definidos como los cambios fraccionados en la dimensión del hueso en respuesta a una modificación de la carga, aparentemente activa los osteocitos, los cuales alteran el delicado balance entre la reabsorción y formación ósea. Si se aplican repetidamente, cargas crecientes, como en el caso de un ejercicio regular, hay una formación de hueso neta. Este aumento de masa ósea tiene el efecto de reducir la tensión interna de una carga dada, porque, la misma carga se distribuye sobre una cantidad mayor de hueso. Esto limita la orientación hacia la formación de masa ósea, hasta que un nivel de masa ósea es alcanzado, ante el cual la tensión es normalizada, y será alcanzado un balance entre reabsorción y formación, ahora a un nivel más alto de masa ósea. En este momento, la reabsorción ósea es igual a la formación ósea, hasta que haya futuros cambios en las cargas. Este aspecto del control de masa ósea tiene efecto localizado, ya que las tensiones mecánicas difieren grandemente en diferentes partes del esqueleto, pudiendo haber pérdida neta y ganancia neta de hueso que ocurra simultáneamente, inclusive en partes adyacentes de un mismo hueso.
Los efectos de las cargas sobre las células óseas están relacionados directamente con el nivel de tensión (“strain”). Quizás, el hallazgo más sorprendente en la investigación sobre las cargas y hueso, es que se necesitan muy pocas repeticiones para obtener un efecto osteogénico máximo. Tan pocos como cuatro ciclos de carga por día fueron suficientes para prevenir reabsorción ósea asociada con el desuso, y 36 ciclos consecutivos de cargas fueron tan buenos promotores de formación ósea, como un número de ciclos mucho más alto (Rubin y Lanyon, 1984). Resumiendo, estos resultados de estudios en animales dan respaldo al concepto que, el tipo óptimo de ejercicio formador de hueso sería el que provee altos niveles de tensión, a altas frecuencias de tensión, distribuidas a través de todo el esqueleto.
Los estudios en adultos, tomados en su conjunto han mostrado que los programas de ejercicios incrementan la densidad mineral ósea, o por lo menos, reducen la tasa de pérdida; en algunos trabajos, la dificultad en hallar dichos efectos, podría atribuirse a problemas metodológicos. Los regímenes de ejercicios varían ampliamente, y a menudo, no son específicos para el para el sitio óseo medido. Las diferencias entre los que practican ejercicios y los grupos control (sedentarios), con respecto a la tasa de cambio de sus densidades óseas están, típicamente, en el orden de un pequeño porcentaje anual. Sobre todo, la evidencia sugiere que los efectos positivos de los ejercicios en los huesos de adultos, son modestos en términos breves, pero pueden ser bastante más notorios en programas más intensos que sobrecarguen el sistema muscular durante períodos más prolongados (Marcus y cols. 1992). Sin embargo, en niños, nuestro conocimiento acerca de los efectos de programas de actividad física a largo plazo, sobre el aumento de la densidad ósea es incompleto, y los estudios en poblaciones pediátricas se han llevado a cabo, en forma reciente.
REVISIÓN DE LA LITERATURA PEDIÁTRICA
Mientras aún existen vacíos en nuestra comprensión del rol preciso de la actividad física en la acumulación de mineral óseo durante los años del crecimiento, han sido reportados un número importantes de estudios que asocian la densidad mineral ósea (BDM) con la actividad física, en los grupos etarios por debajo de los 21 años. La siguiente revisión estará restringida a esta población, lo máximo posible, y versará primordialmente sobre estudios en los cuales la variable dependiente es el contenido mineral del hueso (BMC) o la densidad mineral ósea (BMD), medidas por absorciometría fotónica simple o dual (SPA o DPA, respectivamente), absorciometría de dual energía por rayos X (DEXA), o tomografía cuantitativa computarizada (QCT).
Todos los estudios de actividad física que han sido revisados, ya sea en forma de resúmenes o lectura del trabajo completo, están en la Tabla 1. Además, como consecuencia de que los efectos de la actividad física sobre la densidad ósea pueden ser modulados por causas nutricionales y niveles hormonales, los estudios en adolescentes que versan sobre estos importantes factores interactuantes han sido revisados. Los estudios de actividades han sido categorizados de acuerdo al diseño experimental seguido. Esto incluye:
- Pruebas controladas (ramdomizadas y no ramdomizadas, o sea al azar y no al azar), y estudios de observación prospectiva.
- Estudios de observación horizontales (transversales), incluyendo estudios que usan cuestionarios retrospectivos que proveen patrones de historia de la actividad física durante la adolescencia.
- Estudios unilaterales donde ha sido sometido a “stress” un miembro preferentemente, donde cada niño actuó, con su otro miembro, como su propio control.

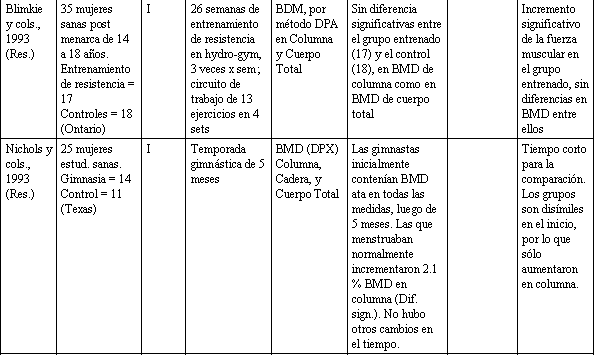
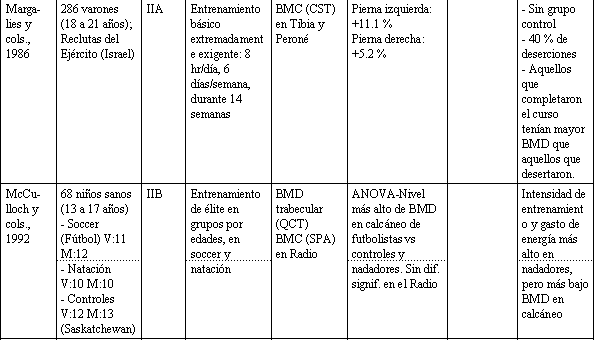
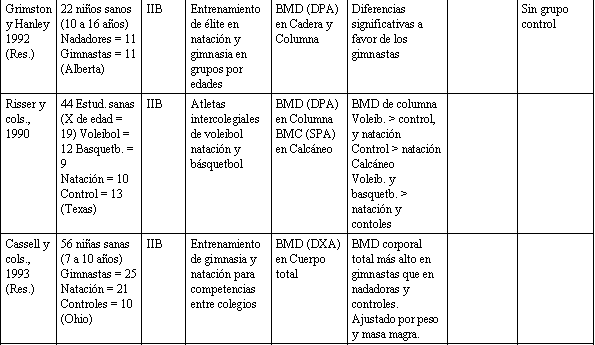
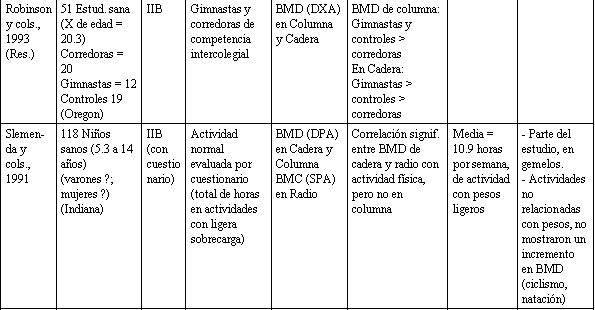

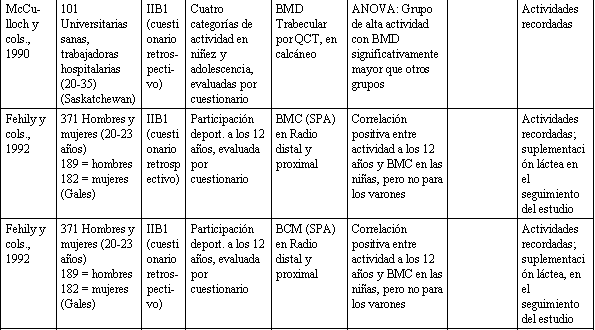


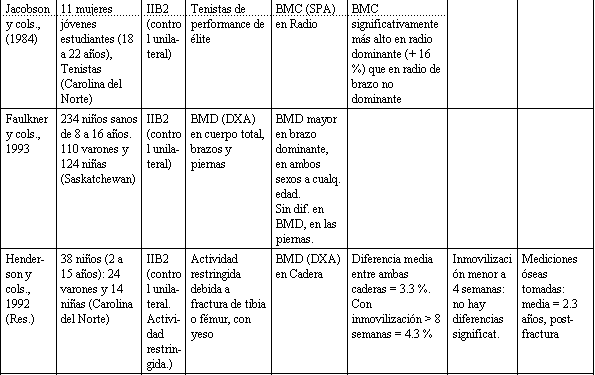

Tabla 1. Relación entre actividad física y la salud del esqueleto.
Estudios en niños y adolescentes.
Nivel I = Trabajo controlado
Nivel IIA = Estudio de observación prospectiva
Nivel IIB = Estudios de observación horizontal (transversal)
Nivel IIB1 = Estudios por cuestionario retrospectivo
Nivel IIB2 = Estudio con control unilateral
Experimentos controlados y estudios de observación prospectiva
Ha sido demostrado que varones jóvenes que experimentaron un entrenamiento militar básico extremadamente exigente, de 8 horas diarias durante 14 semanas, incrementaron el BMC de sus tibias y peronés significativamente (Margulies y cols., 1986). No obstante, 2 trabajos en jóvenes mujeres reportaron cambios solamente modestos, o ningún beneficio, con un programa de entrenamiento de resistencia de 3 sesiones semanales, por períodos de 6 y 8 meses. Snow-Harter y cols. (1992), asignaron (elección al azar) 30 mujeres (edad media: 19,9 años), separándolas en entrenamiento de resistencia con pesas, carrera y grupo control. Después de 8 meses no hubo diferencias en BMD entre los grupos, observables a nivel del fémur proximal; los incrementos en columna lumbar fueron pequeños: + 1.3 % para corredoras, + 1.2 % para el grupo de resistencia, y - 0.8 %, para el grupo control.
En un estudio similar de 6 meses de duración, Blinkie y cols. (1993), asignaron a 35 jovencitas (14-18 años), tanto a un grupo de entrenamiento de resistencia con pesas, o bien a un grupo de control. Mientras que el grupo de entrenamiento con pesas mostró un incremento significativo en fuerza, no hubo diferencias en BMD entre los grupos, en columna lumbar ni en cuerpo total. Nichols y cols., (1993), compararon un grupo de colegialas gimnastas con un grupo control, antes y después de 1 temporada de 5 meses de gimnasia. No hallaron diferencias significativas en BMD, tanto en fémur proximal como en cuerpo total, luego de este período. Aquéllas gimnastas que estaban menstruando regularmente mostraron un incremento de 2.1 % en columna lumbar. Los resultados de estos estudios prospectivos sugerirían que la actividad física debiera ser vigorosa si se desea modificar el BMD en individuos jóvenes. Esto coincide con los resultados de los estudios en animales; sin embargo, se necesitan trabajos de mayor duración con muestras poblacionales más grandes, para evaluar esta hipótesis.
Estudios de observación horizontal o transversal
Ha habido un número de estudios que han comparado atletas adolescentes que toman parte en varios deportes, vs. grupos de control, y cada uno entre sí. Estos estudios dan una consecuente visión a la relación entre la actividad física y BDM. El valor de la gimnasia es sugerido por varios estudios (Grimston y Hanley, 1992; Cassel y cols., 1993; Robinson y cols., 1993). Otras actividades productoras de sobrecarga como el fútbol (soccer) (McCulloch y cols., 1992), y voleibol (Risser y cols., 1990), parecen beneficiar al esqueleto, mientras que la natación, que fue estudiada en cuatro de las investigaciones mencionadas anteriormente, parece tener un efecto despreciable sobre el BMD de los huesos que conllevan actividades físicas con sobrecarga. Mientras la evidencia referente a las ventajas de la natación están en duda, considerando datos indirectos (Slemenda y cols., 1991) y datos ya revisados en animales (Lanyon, 1992), parece prudente recomendar actividades con ligera sobrecarga de pesas para favorecer una óptima salud esquelética en los adolescentes. Varios estudios han usado cuestionarios de actividades física para clasificar a los sujetos, según niveles de actividad. Dos estudios recientes en niños y adolescentes usaron cuestionarios para determinar niveles de actividad habitual, y ambos reportaron una significativa pero modesta asociación entre actividad física y BMD en la cadera, pero no en la columna vertebral (Slemenda y cols., 1991; Kroger y cols., 1992).
Los cuestionarios retrospectivos en adultos, para recabar una historia de actividad durante la infancia y la adolescencia, han producido resultados equívocos. Talmage y Anderson (1984), y Tylavsky y cols. (1992), han reportado una relación significativa entre actividad durante infancia vs. BMD en el adulto. Sin embargo, Kriska y cols. (1988), fallaron en mostrar este tipo de relación; Fehily y cols. (1992), reportaron dicha relación en mujeres, pero no en varones. Desafortunadamente, el sitio esquelético evaluado, en todos estos estudios, no fue un sitio sensible a actividades con sobrecarga ligera de pesas, tal es la parte media o el extremo distal del radio. Solamente en un estudio, de McCulloch y cols. (1990), fue medido un sitio sensible a actividad de sobrecarga con pesas ligeras. Estos investigadores reportaron una correlación significativa entre BMD del calcáneo, en mujeres jóvenes adultas y los niveles de actividad física en la niñez.
Estudios unilaterales
Las actividades infantiles que exigen preferencialmente un lado del cuerpo, con respecto al otro, aportan evidencias que los factores mecánicos locales pueden modular el BMD durante los años del crecimiento, al margen y además de las consideraciones genéticas. Esto ha sido demostrado en estudios, que compararon los brazos, dominante y no dominante, en pequeños jugadores de beisbol de liga menor (Watson, 1974), jugadores de tenis jóvenes, (Jacobson y cols., 1984), y en un estudio reciente de niños normales, saludables (no dirigido), que no estaban involucrados más que en sus actividades rutinarias de cada día (Faulkner y cols., 1993). En coincidencia con la hipótesis de que hay una relación entre actividad física y masa ósea, existen los resultados de un estudio hecho por Miller y cols. (1991). Estos investigadores estudiaron la relación entre muscular y BMD, en niños, y reportaron una correlación entre medidas de perímetros, cercanos al sitio correspondiente de medición de BMD (por ej., perímetro del muslo vs. BMD de cadera).
Mientras los estudios mencionados más arriba, sugieren que la BMD (densidad mineral ósea) puede ser aumentada por factores de sobrecarga mecánica locales, quedan más preguntas que respuestas cuando ello se relaciona con prescribir actividades, tal es: ¿“cómo y cuánto?”, ¿“cuán a menudo?”, ¿“con qué intensidad?” y ¿“de qué tipo”?. Hay, sin embargo, una parte de evidencia sobre la cual no hay disputas. La inmovilización y la inactividad van en detrimento del esqueleto. Desde los vuelos espaciales, el yeso después de una lesión, guardar cama, tanto en los estudios en adultos, como en animales, todos han demostrado el riesgo de la inmovilización para el esqueleto. Esto ha impulsado un cambio completo en el manejo clínico de la enfermedad y las lesiones en los últimos 30 años, en los que la movilización temprana y la actividad son estimulados, y se minimiza el período de inactividad.
Mientras la mayoría de los datos sobre inmovilización han sido recolectados en adultos, han habido algunos estudios recientes en niños que enfatizan la importancia del movimiento durante los años del crecimiento. Henderson y cols. (1992), midieron la BMD de ambas caderas en niños que habían sufrido una fractura, sin complicaciones, de la tibia o del fémur, en promedio 2,3 años antes. Los resultados indicaban que el niño fracturado presentaba un déficit residual de BMD en el lado de la lesión, y los niños manejados con más largos períodos de inmovilización tenían más grandes diferencias bilaterales en BMD femoral. En un tipo de estudios similar en niños con enfermedad de Legg-Calve Parthes unilateral, Bailey y cols. (1992), hallaron una diferencia significativa entre la cadera involucrada y la no involucrada, al medir la BMD femoral. Estos estudios sostienen la afirmación de que las actividades de sobrecarga con pesas livianas tienen una influencia marcada en el acrecentamiento de BMD en el fémur proximal, en los niños en crecimiento, y enfatizan las consecuencias de la inmovilidad sobre el esqueleto.
Nutrición en la Niñez, Actividad Física y Hueso
Con respecto al rol de la actividad física sobre el hueso, es importante reconocer que la suficiencia nutricional, representada por un adecuado aporte de calcio, es una condición necesaria para la salud esquelética y un importante factor habilitante en términos de actividad relacionada con el mantenimiento de la densidad ósea en adultos (Prince y cols., 1990). La relación exacta entre actividad física, ingesta de calcio y acumulación de hueso en niños que están creciendo no está aún bien entendida, pero existe un estudio especialmente notable: Matkovic y cols. (1979), investigaron masa ósea e incidencia de fracturas en las poblaciones de dos regiones geográficamente dispares de Croacia; una de ellas con alta ingesta de calcio y la otra con bajo aporte . Los residentes de la región con aportes de calcio elevados tenían una masa ósea significativamente más grande y una reducida incidencia de fracturas. Las diferencias entre regiones fueron reportadas, por grupos de edad, hasta los 75 años; ambos grupos mostraron pérdidas óseas con el avance de la edad. Con esto se concluyó que la masa ósea más elevada, en la región con alto aporte de calcio, la que fue mantenida a lo largo de toda la vida, era debida, presumiblemente, a la formación de mayor masa ósea en la niñez. Esto sugiere que el aporte de calcio fue un importante factor en el joven. Un interesante concepto que aportó adicionalmente este estudio, no comentado por los autores, fue que se observó un gasto energético un 20 % más alto en la población con alta ingesta de calcio con respecto a la otra población, sugiriendo un rol importante para la actividad física durante la niñez (Kanis, 1991).
La importancia de la ingesta de calcio durante la adolescencia ha sido indicada por un estudio de Sandler y cols. (1985), quienes reportaron una relación entre el mineral óseo del radio en un grupo de mujeres post-menospaúsicas, y el consumo de leche que ellas mismas referían, durante la niñez y adolescencia. Los investigadores concluyeron que, una consumición adecuada de leche es necesaria durante la niñez, para asegurar, una masa ósea óptima, al margen de los límites genéticos.
Los trabajos prospectivos en niños son escasos, pero entre 22 gemelos pre-puberales idénticos, tratados, unos con 1000 mg de calcio/día, y los otros con placebo, durante 3 años, el grupo tratado con calcio tuvo incrementos significativamente mayores de la BMD en el radio y columna lumbar que el grupo al que se le dio placebo (Johnson y otros, 1992). No hubo, en cambio, beneficios observables de gemelos que fueron intra o post-puberales. En otro estudio intervencionista, en niñas de 14 años, durante dos años, hubo una tendencia a más alta BMD en el grupo de niñas con suplementación elevada (1637 mg/día), en comparación con el otro grupo de baja suplementación (270 mg/día), aunque no se reportó como estadísticamente significativo (Matkovic y cols., 1990).
Los estudios transversales que investigaron la ingesta cálcica dietaria y BMD, en niños sanos, han sido equívocos. Algunos han reportado una relación positiva entre BMD y calcio dietario (Chan y cols., 1991); otros han reportado que no existe dicha relación (Gilsanz y cols., 1988). Un estudio reciente sugiere que, en niños que tienen una ingesta de calcio dietario en los niveles recomendados, no se aprecian efectos de la suplementación Ca++ sobre la BMD (Grimston y cols., 1992). La cuestión de “qué es una adecuada ingesta de calcio”, aún está siendo debatida. Sobre la base de valores conocidos para la absorción de calcio, tasas de incremento en el esqueleto y pérdidas obligatorias, en niños y adolescentes, Peacock (1991) sugiere que es improbable que obtengan un nivel óptimo en el pico de masa ósea aquellos niños con promedio diario de ingesta de calcio por debajo de 1000 mg/día en varones, y 850 mg/día en mujeres. Heaney (1991), tomando en consideración los mismos factores de Peacock, recomienda una ingesta de 1500 mg de calcio/día para asegurar cumplimentar el nivel de pico de masa ósea programado genéticamente.
Estado Hormonal del Adolescente, Actividad Física y Hueso
Los efectos promotores de formación ósea por la carga mecánica están modulados por ciertas hormonas. Los estrógenos y la progesterona son de particular interés en los adolescentes. Los efectos protectores del estrógeno sobre el hueso han sido bien establecidos en mujeres; los estados hipoestrogénicos como la menopausia, se asocian con pérdidas óseas rápidas, y si esta condición se hace crónica, puede llevar a una baja densidad ósea. El reemplazo hormonal ha demostrado reducir consistentemente esta pérdida. Esto tiene importantes implicancias para la prescripción de ejercicios en adolescentes. Variada documentación reporta una menarca retrasada en jovencitas que entrenan intensivamente en actividades que requieren magreza para un rendimiento de élite. Esto sugiere la posibilidad de un retraso en la protección esquelética por los estrógenos. Inclusive, luego de la menarca, algunas jóvenes a menudo, menstrúan irregularmente, con meses en blanco, constituyendo también un riesgo esquelético. Por ejemplo, en un estudio de mujeres jóvenes (media de edad: 19 años), la densidad ósea de la columna lumbar estuvo en relación inversa a la cantidad de menstruaciones perdidas hasta la menarca (entendiendo así a los casos en que su aparición fue tardía; Lloyd y cols., 1988). Aunque no existe una medición simple y directa de la protección de los estrógenos, Dhuper y cols. (1990), crearon un sistema de puntaje de estrógenos para mujeres jóvenes que integra: los efectos de la edad de la menarca, irregularidad de los ciclos menstruales, y otros factores que afectan los estrógenos, tales como el uso de anticonceptivos orales. Este índice fue medido en mujeres de 18 a 20 años de edad, y se lo halló positivamente asociado con datos de densidad ósea en ciertos sitios esqueléticos. Los autores concluyeron en que en bajas condiciones de estrógenos “la actividad sola es insuficiente para mantener la densidad ósea de los huesos estimulados”.
Los reportes de la literatura confirman el riesgo de la amenorrea crónica para el hueso (definida en forma variada, pero tipificada como dos o menos menstruaciones en el año precedente) en mujeres adultas, pero hay muy pocos estudios en adolescentes. En un solo estudio, mujeres amenorreicas, en edades entre 15 y 21 años tenían un BMD lumbar 13 % por debajo que sus pares eumenorreicas (White y cols. 1991). Varios estudios han reportado una asociación de baja BMD con trastornos alimentarios, en particular con anorexia nerviosa para la cual, la amenorrea es uno de los criterios diagnósticos esenciales. Bachrach y cols. (1991), encontraron bajos BMD lumbar y total del cuerpo, en jóvenes anoréxicas entre 12 y 20 años: estaban 18 al 26 % por debajo de las jóvenes sanas. La incidencia de los desórdenes alimentarios es alta en mujeres jóvenes atléticas, por lo que, su disfunción menstrual puede aparecer a causa de algunas combinaciones adversas de bajo nivel de adiposidad corporal, baja ingesta calórica y alto gasto energético. Al margen de su origen, la amenorrea prolongada en mujeres jóvenes se presenta como un serio riesgo potencial para el esqueleto y la pérdida ósea puede no ser reversible: dos años después de la reiniciación de las menstruaciones con peso corporal óptimo, en una anoréxica recuperada, el BMD en cuatro sitios estaba 56 % al 82 % inferior a los valores normales (Baum, 1987). No hay estudios que demuestren completa reversibilidad de las pérdidas de hueso debidas a la anorexia nerviosa; estos déficit de mineral óseo sufridos durante la adolescencia pueden no ser completamente reversibles (Bachrach y cols., 1991). El ejercicio no aparece como protector contra este tipo de osteopenia. Incluso combinándolos con suplementación con calcio y vitamina D, el estradiol plasmático en adolescentes que corren más de 32 km por semana, declina más o menos en un año, en comparación con corredoras eumenorreicas (Baer y cols., 1992). Estas observaciones sugieren que los efectos promotores de formación de hueso por la dieta y el ejercicio, no son adecuados para detener o reemplazar las pérdidas que induce la baja concentración de estrógenos. La restauración del hueso más bien depende de la recuperación del peso, reiniciación de los ciclos reproductivos normales, y el inicio, duración y severidad de la fase de pérdida ósea que existió previamente.
En varones, Krabbe y cols. (1979), notaron un dramático incremento en la testosterona sérica entre los 13 y 14 años, el cual fue seguido inmediatamente por un rápido ascenso en el BMC del antebrazo; la pubertad retrasada se evidenció por la continuidad de valores bajos de testosterona sérica, posponiendo el ascenso del BMC y así como la estatura. La pubertad retrasada también es causa de reducción del BMD en adultos jóvenes, sugiriendo que el desarrollo cronológico de la pubertad es un importante determinante del pico de densidad ósea en los hombres (Finkelstein y cols., 1992).
Es posible que pueda ocurrir un aumento compensatorio (catch-up) pero no ha sido aún demostrado. Los efectos del ejercicio sobre el estado hormonal en varones no han sido investigados, pero los pocos estudios llevados a cabo en hombres jóvenes, sugieren que la testosterona sérica puede estar reducida crónicamente (Arce y de Souza, 1993). Si estos efectos se confirman, sería posible afirmar que el entrenamiento de resistencia durante la adolescencia, en varones, afectaría la maduración en los jóvenes, y por ende, la densidad ósea.
RECOMENDACIONES
Uno de los principales objetivos de las investigaciones relacionadas con el hueso en niños y adolescentes, es identificar y dar tratamiento a aquellos factores que ayudarán en la consecución de un pico de masa ósea ya que, tanto como los adultos jóvenes, ellos no deben tener una densidad mineral ósea menor que la correspondiente a su potencial genético. Mientras que aún hay muchas preguntas sin responder acerca de los complicados mecanismos que controlan el desarrollo de la densidad ósea, ya es posible ofrecer algún aviso prudente a la gente joven, basándonos en la revisión de literatura precedente sobre estudios de investigación pertinentes.
Sugerencias de actividad física para la salud ósea
- Establecer un fuerte compromiso, a lo largo de la vida, con la actividad física y el ejercicio.
- Las actividades que cargan y transportan el propio peso son mejores que las que soportan el propio peso, como la natación y el ciclismo.
- Una actividad diaria corta e intensa es mejor que otra, prolongada pero hecha infrecuentemente.
- Las actividades que incrementan la fuerza muscular deberían ser promovidas por estar relacionadas directamente con la densidad ósea.
- Dichas actividades deberían trabajar todos los grandes grupos musculares.
- Deberían evitarse la inmovilización y los períodos de inmovilidad; cuando esto no sea posible (reposo en cama durante una enfermedad), al menos algunos breves movimientos diarios de sobrecarga muscular activa pueden ayudar a reducir las pérdidas óseas.
Otras sugerencias para la salud ósea
- En mujeres jóvenes, un anormal retraso de la menarca y menstruaciones irregulares crónicas deberían evitarse, utilizando medios naturales para restaurar un buen balance energético (disminuyendo las actividades de resistencia y aumentando la ingesta calórica), lo que puede ser suficiente para normalizar dichas disfunciones. Los atletas y entrenadores deberían ser instruidos sobre los riesgos potenciales de la disfunción menstrual sobre el esqueleto.
- Ingerir una dieta balanceada que contenga los valores dietarios recomendados de calcio. La sustitución de la leche por suplementos bebibles dietéticos no es recomendable. Las bebidas gaseosas son sumamente acidificadas con un alto contenido de fósforo, lo que puede aumentar la excreción de calcio.
- Las niñas de 13 a 20 años (adolescentes) deberían evitar el cigarrillo porque es antiestrogénico, y puede interferir con la obtención de un pico normal de masa ósea.
- Los patrones inadecuados o patológicos de nutrición son destructivos para el esqueleto. Estos desórdenes, a menudo se inician en la adolescencia y son frecuentes en atletas mujeres jóvenes; también aparecen en niñas adolescentes que no realizan actividad física. Los padres, entrenadores y maestros deberían ser alertados sobre los peligros de un comportamiento alimentario extremo.
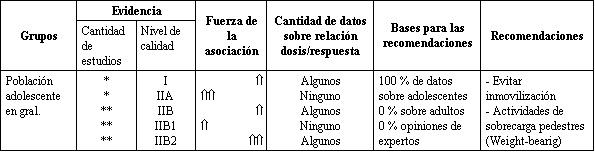
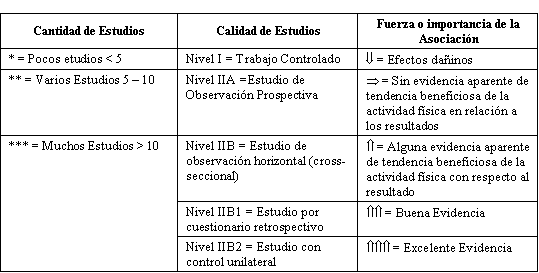
Tabla 2. Sumario de hallazgos sobre actividad física y salud esquelética
y adolescentes: Recomendaciones.
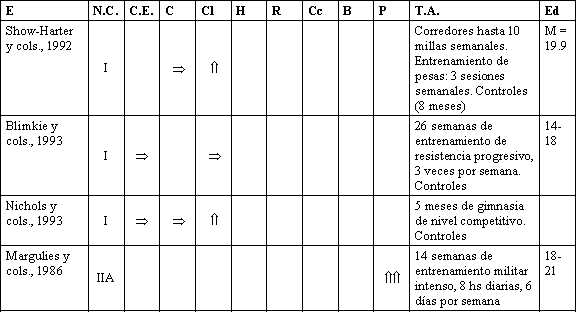

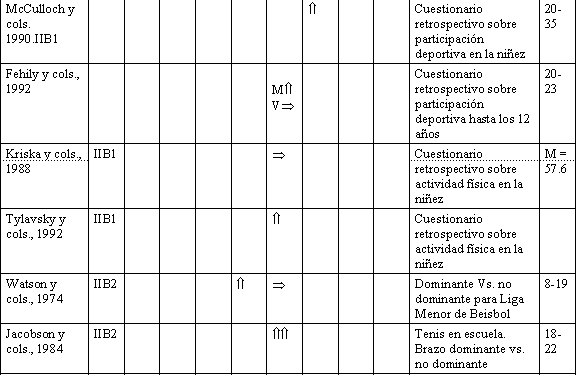
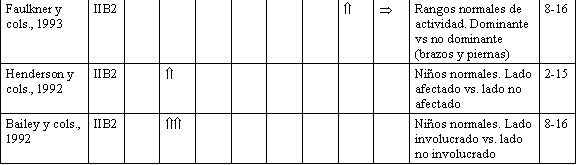
Tabla 3. Estudios Óseos en Niños y Adolescentes, hasta los 20 años.
Sitios específicos con mayor fuerza de Asociación para BMD/BMC
E: Estudio. N.C.: Nivel de Calidad. C.E.: Cuerpo Entero.
C.: Cadera. Cl.: Columna. H.: Húmero. R.: Radio. Cc.:
Calcáneo. B.: Brazos. P.: Piernas. T.A.: Tipo de Actividad.
Ed.: Edad.
Referencias
1. Arce JC, and de Souza MJ (1993). Exercise and male infertility. Sports Medicine. 15(3): 146-169
2. Bachrach LK, Guido D, Katzman DK, Litt IF, Marcus R (1990). Decresed bone density in adolescents girls with anorexia. Pediatrics (86(3): 440-447
3. Bachrach LK, Katzman DK, Litt IF (1991). Recovery fromostepenia in adolescent girls with anorexia nervosa. Journal of Clinical Endocrinology and Metabolim, 72: 602-606
4. Baer JT, Taper LJ, Gwazdauskas FG, Walberg JL, Novascone M, Ritchey SJ, Thye FW (1992). Diet, hormonal and metabolic factors affecting bone mineral density in adolescent amenorrheic and eumenorrheic runners. Journal of Sports Medicine and Physical Fitness. 32(1): 51-58
5. Bailey D, Daniels K, Dzus A, Yong-Hing K, Drinkwater D, Wilkinson A, Houston S (1992). Bone mineral density in the proximal femur of children with Legg Calve Perthes Disease. Journal Bone Mineral Research 7:(S1) S287
6. Baum ML, Kramer EL, Sanger JJ, Pena A (1987). Stress fractures and reduced bone mineral density with prior anorexia nervosa (letter). Journal of Nuclear Medicine 9: 1506-1507
7. Bell NH, Shary J, Stevens J, Garza M, Gordon L, Edwards J (1991). Demostration that bone mass in greater in black than in white children. Journal of Bone and Mineral Research. 6(7): 719-723
8. Blimkie C, Rice S, Webber C, Martin J, Levy D, and Gordon C (1993). Effects of resistance training on bone mass and density in adolescent females. (Abstract). Medicine and Science in Sports and Exercise. 25(5): S48
9. Bonjour JP, Theintz G, Buchs B, Slosman D, and Rizzoli R (1991). Critical years and stages of puberty for spinal and femoral bone mass accumulation during adolescence. Journal of Clinical Endocrinology Metabolism. 73: 555-563
10. Cassell C, Benedict M, Uetrect G, Ranz J, Ho M, and Specker B (1990). Bone mineral density in young gymnasts and swimmers. (Abstract). Medicine and Science in Sports and Exercise. 25(5): S49
11. Chan GM (1991). Dietary calcium and bone mineral status of children and adolescents. American Journal of Disabled Children. 145: 631-634
12. Chesnut C (1991). Theoretical overview: Bone development, peak bone mass, bone loss, and fracture risk. American Journal of Medicine. 91(5B), 2S-4S
13. Dhuper S, Warren M, Brooks-Gunn J, Fox R (1990). Effects of hormonal status on bone density in adolescent girls. Journal of Clinical Endocrinology and Metabolism. 71: 1083-1088
14. Drinkwater BL (1990). Physical exercise and bone health. Journal of American Medical Women´s Association. 45(3), 91- 97
15. Eisman J, Sambrook P, Kelly P, and Pocock N (1991). Exercise and its interaction with genetic influences in the determination of bone mineral density. American Journal of Medicine. 91(5B): 55-95
16. Faulkner R, Houston C, Bailey D, Drinkwater D, McKay H, & Wilkinson A (1993). Comparison of bone mineral content and bone mineral density between dominant and non-dominant limbs in children 8-16 years of age. American Journal of Human Biology (In Press)
17. Fehily A, Coles R, Evans W, and Elwood P (1992). Factors affectign bone density in young adults. American Journal of Clinical Nutrition. 56: 579-86
18. Finkelstein JS, Neer RM, Biller BM, Crawford JD, Klibanski A (1992). Osteopenia in men with a history of delayed puberty. New England Journal of Medicine. 326: 600-604
19. Gilsanz V, Gibbens DT, Roe TF, Carlson M, Senac MO, Boechat MI, Huang HK, Schulz EE, Libanati MD, and Cann CC (1988). Vertebral bone density in children: Effect of puberty. Radiology. 166: 847-850
20. Glastre C, Braillon P, David L, Cochat P, Meunier PJ, & Delmas PD (1990). Measurement of bone mineral content of the lumbar spine by dual energy X-ray absorptiometry in normal children: correlations with growth parameters. Journal of Clinical Endocrinology and Metabolism. 70(5), 1330-1333
21. Grimston SK, and Hanley DA (1992). Bone mineral density in children in related to mechanical loading regime. (Abstract). Medicine and Science in Sports and Exercise. 24(5): S1) S45
22. Grimston S, morrison K, Harder J, & Hanley D (1992). Bone mineral density during puberty in western Canadian children. Bone and Mineral. 19: 85-96
23. Gutin B, and Kasper M (1992). Can vigorous exercise play a role in osteoporosis prevention? A review. Osteoporosis International. 2: 55-69
24. Halioua L, Anderson J (1989). Lifetime calcium intake and physical activity habits: Independent and combined effects on the radial bone of healthy premenopausal caucasian women. American Journal of Clinical Nutrition 49: 534-551
25. Heaney R (1991). The effect of calcium on skeletal development, bone loss, and risk of fractures. American Journal of Medicine. 91(5B), 23S-28S
26. Henderson R, Kemp G & Campion H (1992). Residual bonemineral density and muscle strength after fractures of the tibia or femur in children. Journal of Bone and Joint Surgery. 74A: 211-218
27. Jacobson P, Beaver W, Grubb S, Taft T, & Talmage R (1984). Bone density in women. Journal of Orthopaedic Research. 2: 328-332
28. Johnson C, Miller J, Slemenda C, Reister T, Hui S, Chistian J, and Peacock M (1992). Calcium supplementation and increases in bone mineral density in children. New England Journal of Medicine. 327: 82-87
29. Johnson B, & Slemenda C (1991). Risk prediction in osteoporosis: A theoretical overview. American Journal of Medicine. 91(5B): 47S-48S
30. Kanders B, Dempster DW, and Lindsay R (1988). Interaction of calcium nutrition and physical activity on bone mass in young women. Journal of Bone and Mienral Research 3(2): 145-149
31. Kanis JA (1991). Calcium requirements for optimal skeletal health in women. Calcified Tissue International. 149S: S33- S41
32. Katzman D, Bachrach L, Carter D, and Marcus R (1991). Clinical and anthropometric correlates of bone mineral acquisition in healthy adolescent girls. Journal of Clinical Endocrinology Metabolism. 73: 1332-39
33. Kelly PJ, Twomey L, Sambrook PN, and Eastman JA (1990). Sex differences in peak adult bone mineral density. Journal of Bone and Mineral Research. 5(11): 1169-75
34. Krabbe S, Christiansen C, Rodbro P, Transbol Y (1979). Effect of puberty on rates of bone grown and mineralisation. Archieves of Disease in Childhoob. 54: 950-953
35. Krall EA, Dawson-Hughes B (1993). Heritable and lifestyle determinants of bone mineral density. Journal of Bone and Mineral Research. 8(1): 1-9
36. Kriska A, Sandler R, Cauley J, LaPorte R, Hom D, and Pambianco G (1988). The assessment of historical physical activity and its relation to adult bone parameters. American Journal of Epidemiology. 127: 1053-63
37. Kroger H, Kotaniemi A, Vainio P, and Alhava E (1992). Bone densitometry of the spine and femur in children by dual- energy X-ray absorptiometry. Bone and Mineral. 17: 75-85
38. Lanyon LE (1992). Control of bone architecture by functional load bearing. Journal of Bone and Mineral Research. 7(Suppl.2): S369-S375
39. Li JY, Specker BL, Ho ML, Tsan RC (1989). Bone mineral content in black and white children 1 to 6 years of age. American Journal of Disease of Children. 143: 1346-1349
40. Lloyd T, Myers K, Buchanan JR, Demers LM (1988). Collegiate women athetes with irregular menses during adolescence have decreased bone density. Obstretics and Gynecology. 72: 639-642
41. Louks A, and Horvath S (1985). Athletic amenorrhea - A review. Medicine and Science in Sports and Exercise. 17: 45
42. Marcus R, Drinkwater B, Dalsky G, Dufer J, Raab D, Slemenda C, & Snow-Harter C (1992). Osteoporosis and exercise in women. Medicine and Science in Sprts and Exercise. 24((6S): S301-S307
43. Margulies JY, Simkin A, Leidhter I, Bivas A, Steimberg R, Giladi M, Stein M, Kashtan H, & Milgro C (1986). Effect of intense physical activity on the bone-mineral content in the lower limbs of young adults. Journal of Bone and Joint Surgery 68A 1090-1093
44. Matkovic V, Fontana D Tominac C, Goel P, and Chesnut CH (1990). Factors which influence peak bone mass formation: A study of calcium balance and the inheritance of bone mass in adolescent females. American Journal of clinical Nutrition. 52: 878-888
45. McCulloch RG, Bailey DA, Houston CS, and Dodd BL (1990). Effects of physical activity, dietary calcium intake and selected lifestyle factors on bone density in young women. Canadian Medical Association Journal. 142: 221-227
46. McCulloch R, Bailey D, Whalen R, Houston C, Faukner R, & Craven B (1992). Bone density and bone mineral content of adolescent soccer athletes and competitive swinmmers. Pediatric Exercise Science. 4: 319-330
47. Melton JL (1990). Osteoporosis. In: Berg R, and Cassells J. (eds.) The second fifty years. Promoting health and preventing disability. National Academy Press. Washington. p 76
48. Miller JZ, Slemenda CW, Meaney FJ, Reisler TK, Hui S, Jhonston CC (1991). The relationship of bone mineral density and anthopometric variables in healthy male and female children. Bone and mineral. 14:(137-152)
49. Nichols D, Sanborn C, Bonnick S, Ben-Ezra V, and DiMarco N (1993). The effects of a competitive season on bone mineral density in female gymnast. (Abstract). Medicine and Science in Sports and Exercise. 25(5): S49
50. Ott S (1991). Bone density in adolescents. New England Journal of Medicine. 325: 1646-1647
51. Peacock M (1991). Calcium absortion efficiency and calcium requirements in children and adolescents. American Journal of Clinical Nutrition. 54: 251S-265S
52. Prince R, Smith M, Price R, Lawson N, Dick I, and Harris M (1990). Screening folowed by a randomized placebo controlled study of osteoporosis prevention. Bone and mineral. 10: S304
53. Riggs B, and Melton L (1986). Involutional osteoporosis. New England Journal of Medicine. 341: 1676-86
54. Risser W, Lee E, Leblanc A, Poindexter W, Risser J, and Scheneider V (1990). Bone density in eumenorrheic female college athletes. Medicine and Science in Sports and Exercise. 22(5): 570-574
55. Robinson T, Snow-Harter C, Gillis D, and Shaw J (1993). Bone mineral density and menstrual cycle status in competitive female runners and gymnasts (Abstract). Medicine and Science in Sports and Exercise. 25(5): S49
56. Rubin CT, Lanyon LE (1984). Regulation of bone formation by applied dynamic loads. Journal of Bone and Joint Surgery (Am). 66: 397-402
57. Sandler RB, Slemenda CW, LaPorte RE, Cauley JA, Schramm MM, Barrest MC, and Kriska AM (1985). Postmenopausal bone density and milk consumption in childhood and adolescence. American Journal of Clinical Nutrition 42: 270-274
58. Slemenda CW, Milder JZ, Hui Sl, Reisler TK, and Johnston CC (1991). Role f physical activity in the development of skeletal mass in children. Journal of Bone Mineral Research. 6: 1227-1233
59. Snow-Harter C, Bouxsein M, Lewis B, Carter D, and Marcus R (1992). Effects of resistance and endurance exercise om bone mineral status of young women: A randomized exercise intervention trial. Journal of Bone and Mineral Research. 7: 761-769
60. Snow-Harter c, and Marcus R (1991). Exercise, bone mineral density and osteoporosis. Exercise Sport Science Review. 19: 351-388
61. Talmage RU, and Anderson JJB (1984). Bone density loss in women: Effects of childhood activity, exercise, calcium intake and estrogen theraphy. Calcified Tissue International. 36: 552
62. Tylavsky F, Anderson J, Talmage R, and Taft T (1992). Are calcium intakes and physical activity patterns during adolescence related to radial bone mass of college-age females?. Osteoporosis International. 2: 232-240
63. Washnich R (1991). Bone mass measurements in diagnosis and assessment of therapy. American Journal of medicine. 91 (5B): 47S-48S
64. Watson R (1974). Bone grown and physical activity in young males. In: Mazess R (ed) . International Conference on Bone mineral Measurements (DHEW Publication, NHI 75-683). Washington. pp. 380-385
65. White CM, Hergenroeder AC, Kish WJ (1992). Bone mineral density in 15- to 21- year old eumenorrheic and amenhorreic subjects. American Journal of Disease of Children. 146: 31-35
66. Yeager K, Agostini R, Nattiv A, and Drinkwater B (1993). The female athletes triad: Disodered eating, amenorrhea, osteoporosis. Medicine and Science in Sports and Exercise. 25(8): In Press