Amortiguación Ácido-Base Sanguínea: Explicación de la Efectividad de la Ingesta de Bicarbonato y Citrato
Exercise Physiology Laboratories, Exercise Science Program, Department of Phsysical Performance and Development, The University of New Mexico, Albuquerque, New Mexico 87131.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2002.
Publicado 2 de enero de 2003
Resumen
Palabras clave: acidosis, ácido carbónico, citrato
INTRODUCCIÓN
Debido a la confusión que existe acerca de la bioquímica celular de la acidosis metabólica (14), a los fisiólogos del ejercicio frecuentemente se les pregunta acerca de la interpretación y aplicación de estos conocimientos. A este autor se le ha preguntado recientemente acerca de la amortiguación de la acidosis, con un énfasis particular en el rol del bicarbonato. Por ejemplo, ha habido inquietudes acerca del pk’ del ácido carbónico (3.77) y acerca de porque la ingesta de citrato puede incrementar la capacidad sanguínea de amortiguación de protones. Esta comunicación explica la razón por la cual el bicarbonato (HCO3−) (pk’= 10.2) puede funcionar como el mayor amortiguador sanguíneo del cuerpo entre un rango de ph de 7.2 a 7.4, a pesar de tener el ácido carbónico de un pk’ tan bajo. Además, es dada una aclaración de porque tiene la ingesta de citrato un efecto alcalinizante sanguíneo.
El sistema de Amortiguación Sanguínea del Bicarbonato
Como fue previamente explicado (14), el pk’ de un grupo funcional ácido se refiere al ph, en el cual la mitad de las moléculas están deprotonadas (ionizadas). En otras palabras, este es el ph cuando hay un equilibrio dinámico entre los protones que dejan y los que se vuelven a unir al grupo funcional ácido de la molécula. Los ácidos fuertes o grupos funcionales ácidos tienen un pk’ mucho más bajo de 7, y los ácidos débiles tienen valores de pk’ cercanos a 7.
Si se añaden a la sangre moléculas que están ionizadas y de pk’ cercano a 7.4 (± 0.1 unidades), las mismas se van a unir a protones y van a aumentar el ph. La magnitud del cambio del ph va a depender de el número de moléculas que son añadidas (fuerza molar), y de la cercanía del pk’ a un ph de 7.4. Consecuentemente, para que un amortiguador funcione adentro del cuerpo, debe ser capaz de combinarse con un protón libre cerca del ph fisiológico. Para las células, este ph esta entre 7.0 y 6.2, y para la sangre está entre 7.4 y 7.2. Estos rangos representan los valores de ph desde el reposo hasta el ejercicio intenso en los dos tejidos, respectivamente.
En este punto radica la confusión, si el bicarbonato es el principal amortiguador sanguíneo, y si fácilmente se une a protones formando ácido carbónico, como puede esto ser verdadero, si el pk’ del ácido carbónico es tan bajo (Tabla 1).
El bajo pk’ del ácido carbónico significa que este no puede ser formado a partir de un protón y bicarbonato a menos que el ph sanguíneo baje a cerca de 3.8. Esto obviamente no ocurre in vivo, sin embargo el bicarbonato es nuestro principal amortiguador sanguíneo.
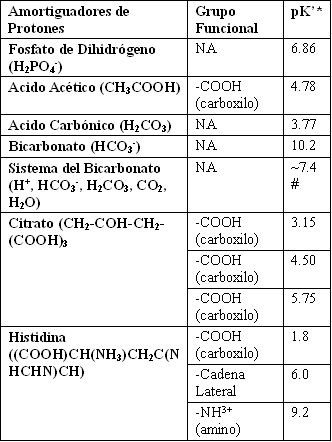
Tabla 1. Valores de pk’ de los componentes del sistema amortiguador del
bicarbonato, y amortiguadores de protones sanguíneos y celulares, con valores
de pk’, cercanos al ph fisiológico.
* Para 25º C ; # una estimación debido a fluctuaciones en el PACO2, PaCO2, y
CaCO2 (disuelto). Lehninger et al. (6).
Más abajo es presentada una descripción bioquímica frecuentemente citada sobre el sistema amortiguador del bicarbonato.
H+ + Na+HCO3- ' H2CO3
La simple descripción de arriba está muy incompleta, y no provee evidencia de la discrepancia entre los valores de pk’ de los componentes, y la amortiguación funcional del sistema cerca de un ph de 7.4 (Tabla 1). Esta discrepancia es explicada a través de cómo el sistema amortiguador sanguíneo del bicarbonato no es dependiente de las cualidades ácido-base del bicarbonato y el ácido carbónico, solos. El poder amortiguador del sistema del bicarbonato es dependiente de la presencia combinada de bicarbonato, la enzima anhidrasa carbónica. Y de las reservas corporales de CO2 (sangre y pulmones), como es descrito más abajo.
H+ + Na+HCO3- ' H2CO3 ' CO2 + H2O ' CO2
Esta descripción más compleja del sistema amortiguador del bicarbonato revela que ahora hay tres constantes de reacciones químicas para considerar:
K1 = [H+] [HCO3-] / [H2CO3]
K2 = [H2CO3] / [CO2d] [H2O]
K3 = [CO2d] / [CO2g]
Donde = CO2d = CO2 disuelto y CO2g = CO2 gaseoso
Cada una de estas constantes necesita ser computada dentro de la nueva constante de equilibrio total que describe el verdadero potencial amortiguador del sistema. Como fue explicado por Lehninger (6), “[El sistema amortiguador del bicarbonato] es extraordinario, …uno de sus componentes, el ácido carbónico, es formado a partir de dióxido de carbono disuelto y agua”. Las tres constantes de equilibrio combinadas aumentan el pk’ del sistema a cerca de 7.4, haciéndolo un amortiguador efectivo contra la acidosis sanguínea. Es desafortunado que la bioquímica más compleja de esta reacción no sea mencionada en la mayoría de los libros de texto de fisiología del ejercicio.
Suplementación del Sistema muscular y sanguíneo
Las diferencias entre el ph de la sangre y de los músculos, y las cualidades únicas del sistema amortiguador del bicarbonato, hacen difícil la suplementación del potencial amortiguador de ácido del cuerpo. Para incrementar la capacidad amortiguadora de ácido sanguínea, se debería incrementar tanto la capacidad del sistema del bicarbonato (eg. Ingesta/infusión de bicarbonato de sodio), como así también añadir moléculas a la sangre, que tengan un pk’ cercano a 7.4. Para incrementar la capacidad amortiguadora muscular, se debería añadir una molécula dentro de las células musculares que tenga un pk’ cercano a 7.0. De forma alternativa, pueden ser añadidas al cuerpo moléculas que consuman un protón, y por esto funcionen indirectamente como amortiguador. Yo voy a discutir mas adelante sobre esta opción, relativa a la ingesta de citrato de sodio.
Ya que la molécula de fosfato tiene un oxígeno extremo, con un pk’ cercano a 6.8, este es un muy buen amortiguador celular (Fig.1). La histidina, un aminoácido, es también un buen amortiguador celular debido al pk’ de 6.0 de su cadena lateral (Tabla 1). Sin embargo, el potencial amortiguador sanguíneo del fosfato y la histidina es pobre debido a sus relativamente bajas concentraciones sanguíneas. El bicarbonato de sodio y el citrato de sodio (Fig. 1) han sido las dos opciones investigadas, con el objetivo de aumentar la capacidad amortiguadora sanguínea.
Existe una abundancia de investigaciones sobre la efectividad de la ingesta de bicarbonato de sodio para incrementar el ph sanguíneo, la amortiguación y su influencia sobre el rendimiento en el ejercicio intenso (4, 7, 8). Las investigaciones también demostraron la efectividad de la ingesta de citrato para incrementar el ph sanguíneo y el bicarbonato (1-3, 9, 11-13, 16). Sin embargo, el rendimiento del ejercicio intenso parece ser menos incrementado luego de la ingesta de citrato, comparado con al ingesta de bicarbonato. ¿Dadas las características del pk’ del citrato, porque aumenta este el ph sanguíneo y el bicarbonato?
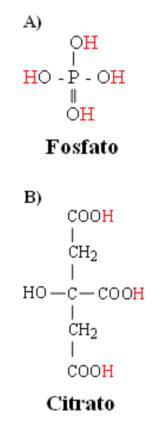
Figura 1. Estructura química del a) fosfato y b) citrato. Ver Tabla 1, para
las características de pk’ de cada molécula.
Ingesta de Citrato y Amortiguación de Protones
El citrato contiene tres grupos funcionales carboxílicos ácidos (Fig. 1). Sin embargo, a un ph fisiológico, el valor relativamente bajo de pk’ de cada grupo funcional (Tabla 1) causa que cada uno este completamente ionizado, resultando en una gran carga negativa (-3).
Hay varios mecanismos propuestos acerca de cómo la ingesta de citrato, mejora la fisiología ácido-base sanguínea. Por ejemplo, los mecanismos propuestos para el incremento del ph sanguíneo y el HCO3-, luego de la ingesta de citrato, incluyen:
1. Amortiguación celular y sanguínea de protones (11).
2. Consumo de protones durante la oxidación del citrato en el ciclo de los
ácidos tricarboxílicos (16).
3. Producción de bicarbonato como un producto del metabolismo (12, 16).
4. La carga negativa del citrato aumenta el gradiente de carga entre la sangre
y las células, causando una disminución de los protones y un incremento del
HCO3- (5).
5. Potenciación de la inhibición de la fosfofructo quinasa por parte del ATP,
lo que causa una disminución de la velocidad de la glucólisis y de la
producción de protones (5).
La investigación de la ruta metabólica del citrato reveló que durante el ciclo de los ácidos tricarboxílicos, hay una salida neta de protones (15), y que de este modo, no hay consumo de protones durante el metabolismo del citrato. Además, no hay bicarbonato formado a partir del metabolismo del citrato. Ya que un metabolismo del citrato como este, no puede contribuir a una mayor capacidad de tolerar la liberación incrementada de protones.
Consecuentemente, los mecanismos que quedan para explicar los efectos alcalinizantes de la ingesta de citrato, están relacionados a una amortiguación fundamental, y/o a la explicación electroquímica de Kowalchuk et al. (5). Esta última explicación electroquímica es más consistente con las pobres características amortiguadoras de protones del citrato.
RECOMENDACIONES
Para rectificar el concepto erróneo del sistema amortiguador del bicarbonato, los libros de texto y las explicaciones dadas en conferencias sobre este sistema, necesitan destacar la importancia del CO2 y como modifica este la naturaleza del pk’ del sistema, comparado con el pk’ de sus componentes clave (H2CO3 y del HCO3−). Además, la mejor explicación de los efectos alcalinizantes de la ingesta del citrato, parece ser su gran carga negativa, que causa una disminución de los protones sanguíneos y un incremento del HCO3− para prevenir alteraciones en las diferencias de cargas a través de las membranas celulares (5).
Referencias
1. Ball D, Maughan RJ (1997). The effect of sodium citrate ingestion on the metabolic response to intense exercise following diet manipulation in man. Exp Physiol 82(6):1041-56
2. Cox G, Jenkins DG (1994). The physiological and ventilatory responses to repeated 60 s sprints following sodium citrate ingestion. J Sports Sci 12(5):469-75
3. Hausswirth C, Bigard AX, Lepers R, Berthelot M, Guezennec CY (1995). Sodium citrate ingestion and muscle performance in acute hypobaric hypoxia. Eur J Appl Physiol Occup Physiol 71(4):362-8
4. Horswill CA, Costill DL, Fink WJ, Flynn MG, Kirwan JP, Mitchell JB, Houmard JA (1998). Influence of sodium bicarbonate on sprint performance: relationship to dosage. Med Sci Sports Exerc 20(6):566-9
5. Kowalchuk JM, Maltais SA, Yamaji K, Hughson RL (1989). The effect of citrate loading on exercise performance, acid-base balance and metabolism. Eur J Appl Physiol Occup Physiol 58(8):858-64.
6. Lehninger AB, Nelson DL, Cox MM (1993). Principles of biochemistry (second edition). New York, NY, Worth Publishers
7. Matson LG, Tran ZV (1993). Effects of sodium bicarbonate ingestion on anaerobic performance: a meta-analytic review. Int J Sport Nutr 3(1):2-28
8. McNaughton L, Backx K, Palmer G, Strange N (1999). Effects of chronic bicarbonate ingestion on the performance of high-intensity work. Eur J Appl Physiol Occup Physiol 80(4):333-6
9. McNaughton L, Cedaro R (1992). Sodium citrate ingestion and its effects on maximal anaerobic exercise of different durations. Eur J Appl Physiol Occup Physiol 64(1):36-41
10. McNaughton L, Dalton B, Palmer G (1999). Sodium bicarbonate can be used as an ergogenic aid in high-intensity, competitive cycle ergometry of 1 h duration. Eur J Appl Physiol Occup Physiol 80(1):64-9
11. McNaughton LR (1990). Sodium citrate and anaerobic performance: implications of dosage. Eur J Appl Physiol Occup Physiol 61(5-6):392-7
12. Parry-Billings M, MacLaren DP (1986). The effect of sodium bicarbonate and sodium citrate ingestion on anaerobic power during intermittent exercise. Eur J Appl Physiol Occup Physiol 55(5):524-9
13. Potteiger JA, Webster MJ, Nickel GL, Haub MD, Palmer RJ (1996). The effects of buffer ingestion on metabolic factors related to distance running performance. Eur J Appl Physiol Occup Physiol 72(4):365-71
14. Robergs R.A (2001). Exercise-induced metabolic acidosis: Where do the protons come from?. Sportscience 5(2), www.sportsci.org/jour/0102/rar.htm
15. Stryer L (1988). Biochemistry (third edition). New York, NY: W.H. Freeman
16. Tiryaki GR, Atterbom HA (1995). The effects of sodium bicarbonate and sodium citrate on 600 m running time of trained females. J Sports Med Phys Fitness 35(3):194-8