Aspectos Bioquímicos del Transportador de Creatina SLC6A8 y Estrategias para Incrementar la Captación de Creatina por el Miocito
Biochemical Features of Creatine Transporter SLC6A8 and Strategies for Increasing Creatine Uptake by Myocyte
Universidad Distrital Francisco José de Caldas, Departamento de Bioquímica y Biología Molecular, Carrera 3 # 26 A 40 Bogotá D.C., Colombia.
Artículo publicado en el journal Revista de Entrenamiento Deportivo, Volumen 27, Número 4 del año 2013.
Publicado 6 de febrero de 2013
Resumen
El ácido α-metilguanidinoacético, conocido popularmente como creatina (Cr), es una biomolécula requerida principalmente por células con requerimientos energéticos altos y variables; sin embargo, los tejidos que almacenan las más altas concentraciones de este metabolito no sintetizan su propia Cr sino que la obtienen desde el torrente sanguíneo por un específico transportador denominado CreaT, conocido como SLC6A8. La presente revisión tiene como objetivo realizar un resumen del estado del arte en lo referente a los parámetros bioquímicos del CreaT/SLC6A8 que permitan explicar algunas estrategias para incrementar la captación de Cr en el miocito. Así, se encontró que ciertos mecanismos para aumentar la captación y retención de Cr en el músculo esquelético están ligados totalmente a componentes nutricionales adicionales (CHO, BCAAs, proteína, etc.) y aspectos temporales del protocolo de suplementación, los cuales son justificados por los aspectos bioquímicos del CreaT/SLC6A8 (regulación por cinasas, valor de Km, actividad de simportador, posible translocación endosomal, entre otros). De esta manera, es de particular importancia que estudios posteriores se centren principalmente en la regulación del CreaT/SLC6A8 con el objetivo de crear estrategias para el tratamiento de enfermedades crónicas atribuidas a la deficiencia de Cr en distintos tipos de células debido a problemas en su transporte.
Palabras clave: transportador de creatina. creat/slc6a8. suplementación con creatina. captación de creatina. rendimiento deportivo.
Abstract
α-methylguanidine acetic acid, popularly known as creatine (Cr), is a biomolecule mainly required by cells with high and variable energetic needs. However, these tissues storing the higher concentrations of this metabolite cannot synthetize their own Cr but must uptake it from bloodstream by means of a specific carrier named CreaT, nowadays known as SLC6A8. The main aim of this review is to update the state of the art in regard to biochemical parameters of CreaT/SLC6A8 in order to explain and analyze some strategies to maximize Cr uptake by myocyte. Thus, it was found that certain mechanisms to augment Cr uptake and retention in the skeletal muscle are linked to extra nutritional substances (CHO, BCAAs, protein, etc.) and temporal aspects of the supplementation protocol, which are justified by the biochemistry features of CreaT/SLC6A8 (kinase regulation, Km value, symporter activity, possible endosomal trafficking, among others). In this way, it is so important that future researches focus mostly on CreaT/SLC6A8 regulation, for the purpose of creating strategies for chronic diseases treatment attributed to Cr deficiency in different types of cells, mainly due to defects in transport.
Keywords: creatine transporter. creat/slc6a8. creatine supplementation. creatine uptake. sports performance.
INTRODUCCIÓN
La Cr en su forma libre y fosforilada tiene un papel esencial en el mantenimiento y distribución de los niveles de ATP en tejidos con altas y fluctuantes demandas energéticas como el músculo, cerebro y corazón (Wallimann et al. 2011), hasta tal punto que alteraciones en las concentraciones de Cr en estos tejidos producen marcados cambios funcionales que generan diverso tipo de enfermedades (Patra et al. 2008; Balestrino et al. 2009; Nasrallah et al. 2010). La concentración de Cr en el músculo esquelético está altamente regulada por el CreaT/SLC6A8, el cual ha sido caracterizado por hacer parte de una amplia familia de transportadores de neurotransmisores dependientes de Na+ y Cl- conocida como la familia 6 de transportadores de solutos (SLC6) (Snow & Murphy 2001; Peral et al. 2002; Christie 2007), el cual es necesario para dirigir la Cr endógena y exógena al interior de las células musculares (Km entre 15-77 μM) (Snow & Murphy 2001). Ahora bien, aunque ni la creatinina (Crn) ni la fosfocreatina (PCr) son sustratos del CreaT/SLC6A8, el ácido β-guanidinopropiónico (β-GPA) es el mejor inhibidor competitivo de la captación de Cr, por encima del guanidinoacetato y el 4-guanidinobutirato (Christie 2007). El CreaT/SLC6A8 está relacionado con los transportadores del ácido γ-aminobutírico (GAT) y el transportador de norepinefrina (NET), Dodd & Christie (2007) utilizando la estructura en alta resolución del transportador de leucina (LeuT) diseñaron mutaciones basadas en la comparación de secuencias del CreaT/SLC6A8 y el GAT en un intento por alterar la especificidad de sustrato del CreaT/SLC6A8. Estos autores mostraron que la combinación de sustituciones de 2 o 3 aminoácidos en cuatro posiciones específicas genera la pérdida en la actividad del transporte de Cr y aumenta el transporte del ácido γ-aminobutírico, lo cual fue corroborado por la sensibilidad hacia el ácido nipecótico, un inhibidor competitivo de los GAT. No obstante, la modificación del sitio de unión del CreaT/SLC6A8 no fue suficiente para lograr el transporte del sustrato, lo que indica que residuos adicionales deben mediar los cambios conformacionales requeridos para la difusión de la Cr desde el sitio de unión al sarcoplasma. Por otro lado, varios anticuerpos dirigidos contra secuencias de péptidos en las regiones N- y C-terminal del CreaT/SLC6A8 han sido utilizados en análisis inmunohistoquímicos que indican que el CreaT/SLC6A8 está particularmente asociado con el sarcolema de las fibras musculares tipo I y tipo II. Sin embargo, deben tenerse en cuenta falsos positivos cuando se analizan resultados de estudios en los cuales estos anticuerpos son usados para cuantificar la alta o baja regulación de la proteína del CreaT/SLC6A8, especialmente si es analizado por Western Blot, debido a que los anticuerpos que reconocen las regiones N- y C-terminal del CreaT/SLC6A8 pueden reaccionar también con las especies de 55 y 70 kDa presentes en la mitocondria, además el anticuerpo C-terminal ha mostrado reconocer componentes E2 de deshidrogenasas mitocondriales (Speer et al. 2004). Debido a que el mecanismo fundamental que sustenta los efectos ergogénicos de la suplementación con Cr es el incremento en la concentración intramuscular de TCr se deben tener en cuenta los factores que regulan el CreaT/SLC6A8 y que en sí optimizan o no la captación de Cr.
CREAT: REGULACIÓN POR CINASAS Y TEORÍA DE TRANSLOCACIÓN
El CreaT/SLC6A8 como la mayoría de transportadores presenta residuos de aminoácidos que pueden ser fosforilados por diferentes cinasas dependiendo de su secuencia de reconocimiento. Shojaeifard et al. (2006a, b), utilizando la técnica de fijación de voltaje con dos electrodos (TEV), analizaron el efecto potencial de las isoformas de la cinasa inducida por suero y glucocorticoides (SGK) en la regulación de CreaT/SLC6A8 en un cultivo de ovocitos de rana Xenopus Laevis que fueron modificados genéticamente con el gen que codifica para CreaT/SLC6A8, SGK1, SGK3 y las mutaciones específicas S422DSGK1 (cinasa activa) y K127NSGK1 (cinasa inactiva). Los resultados mostraron que los ovocitos que expresaron CreaT/SLC6A8 junto con SGK1 y SGK3 tipo silvestre manifestaron un incremento de aproximadamente dos veces en la corriente interna con respecto al grupo de células que expresaban solamente CreaT/SLC6A8 (los análisis cinéticos revelaron que las isoformas de SGK aumentan la corriente máxima de transporte sin alterar significativamente la afinidad del CreaT/SLC6A8 por la Cr). El estudio también mostró que el efecto de SGK1 requiere la actividad cinasa funcional, ya que el incremento en la corriente interna en los ovocitos que expresaron CreaT/SLC6A8 + S422DSGK1 se anuló cuando se realizó la coexpresión de CreaT/SLC6A8 con la mutante inactiva K127NSGK1. Shojaeifard et al. (2005, 2006a) también demostraron que mTOR regula CreaT/SLC6A8, al utilizar la misma metodología con la que se examinó el efecto de SGK. Estos autores encontraron que en los ovocitos que expresaban CreaT/SLC6A, la corriente máxima inducida por el transporte de Cr incrementó significativamente por la coexpresión de mTOR. Esto se corroboró por la preincubación de los ovocitos en rapamicina (50 nM) durante 32 horas, lo cual disminuyó la corriente inducida por la Cr y abolió la estimulación por mTOR. Asimismo, el efecto de mTOR sobre el CreaT/SLC6A8 fue revertido por la coexpresión adicional de la mutante inactiva de K119NSGK1 sugiriendo que la estimulación de CreaT/SLC6A8 por mTOR es mediada por mecanismos que por lo menos parcialmente son acompañados de SGK1. Posteriormente, Strutz-Seebohm et al. (2007), haciendo uso de los mismos métodos experimentales de Shojaeifard (2006a), pretendieron identificar el mecanismo de regulación de mTOR/SGK sobre CreaT/SLC6A8. Debido a que el CreaT/SLC6A8 carece del sitio putativo consenso de fosforilación de SGK1/SGK3 (RXRXXS/T y RRXS/T), estos autores postularon que estas isoformas de SGK estimulan el transporte de Cr probablemente vía fosfatidilinositol-3-fosfato-5-cinasa (PIKfyve/PIP5K3), la cual ha sido caracterizada por regular el transportador de glucosa GLUT-4. De esta manera, los resultados mostraron que la corriente máxima inducida por el transporte de Cr incrementa significativamente por la coexpresión de PIKfyve en ovocitos que expresaban CreaT/SLC6A8. No obstante, el efecto de PIKfyve sobre el transporte de Cr fue abolido por el reemplazo del residuo de serina por alanina en la secuencia consenso de SGK (S318APIKfyve), por lo que la coexpresión de S318APIKfyve anuló el efecto de SGK1 sobre la actividad del CreaT/SLC6A8. Estas observaciones sugieren que mTOR/SGK1 regula el CreaT/SLC6A8 a través de la fosforilación y activación de moléculas de señalización corriente abajo entre las que se destacan la activación de PIKfyve y subsecuente formación de fosfatidilinositol-3,5-bifosfato (PI(3,5)P2) (Figura 1).
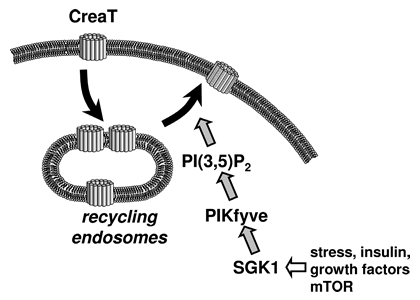
Figura 1. Diagrama esquemático de la translocación endosomal del CreaT/SLC6A8. El diagrama muestra un posible mecanismo de regulación del tráfico endosomal del CreaT/SLC6A8 entre la membrana plasmática y endosomas de reciclaje. mTOR, la insulina o factores de crecimiento estimulan SGK1, la cual al ser activada fosforila y así activa PIKfyve permitiendo el incremento en la formación de PI(3,5)P2, el cual incrementa la translocación de CreaT/SLC6A8 a la membrana plasmática. (Reproducido con autorización de Strutz-Seebohm et al. 2007).
Debido a que SGK1 incrementa la actividad y la abundancia en la membrana celular de una amplia variedad de canales de iones y transportadores, y teniendo en cuenta que PI(3,5)P2 es un potente modulador del reciclamiento vesicular ya que estimula la exocitosis de vesículas en ovocitos y células mamíferas, es posible que un mecanismo similar cause la estimulación y translocación del CreaT/SLC6A8 (Strutz-Seebohm et al. 2007). El CreaT/SLC6A8 también es regulado a través de vías de señalización celular que involucran PKC, ya que los esteres de forbol, activadores de PKC, son conocidos por reducir la actividad del CreaT/SLC6A8 de la misma manera como ha sido observado en los otros transportadores de la familia SLC6. Es probable que la activación de PKC promueva la internalización del CreaT/SLC6A8 por endocitosis (Christie 2007; Balestrino et al. 2009). Adicionalmente, se ha reportado una disminución en la expresión del CreaT/SLC6A8 en la superficie celular en respuesta a la droga inmunosupresora ciclosporina A cultivos de células musculares C2C12 (Tran et al. 2000). Derave et al. (2006) mostraron por primera vez que la estimulación eléctrica de músculos esqueléticos incubados de ratón estimula el transporte de Cr mediante un aumento en la expresión del CreaT/SLC6A8 en la membrana celular posiblemente por translocación endosomal. Dado que el incremento en la expresión ocurrió rápidamente (<30 min), la translocación desde un pool o vesícula intracelular de CreaTs/SLC6A8s al sarcolema más que la síntesis de proteína de novo justifican tal aumento. Sin embargo, este efecto no pudo ser causado por las contracciones musculares per se, lo que hace concebible que el incremento de CreaT/SLC6A8 en el sarcolema sea mediado por la generación de especies oxigeno reactivas inducida por la electrólisis. Es interesante observar que SGK3 es activada tras la acumulación de H2O2 (Shojaeifard 2006a), hecho que fue observado después del protocolo de estimulación eléctrica. Almeida et al. (2006) demostraron in vitro que la Cr no solo es sintetizada y captada por la neuronas centrales sino que también es liberada por exocitosis dependiendo de un potencial de acción, lo que además de implicar a la Cr como agente neuromodulador podría significar que existen ciertos mecanismos fisiológicos de translocación vesicular en la homeostasis de la Cr, tanto en el control mismo de los niveles de Cr como posiblemente en el CreaT/SLC6A8. Recientemente, Li et al. (2010) detectaron por medio de tinción inmunofluorescente que el CreaT/SLC6A8 se distribuye sobrelapándose con AMPK en la región apical de los túbulos proximales en la línea celular S3 de ratón y en células de rata nativa. Utilizando TEV en ovocitos, los autores mostraron que AMPK actúa como un inhibidor reversible de tipo no competitivo, manifestado en una reducción en la velocidad máxima (Vmáx) de Michaelis-Menten, al disminuir la corriente inducida por el transporte electrogénico de Cr durante la activación de AMPK en este tipo de células. Además, los análisis con rapamicina y 5-aminoimidazol-4-carboxiamida-1-β-D-ribofuranosil-5-monophosphate (ZMP), activador de AMPK, mostraron una inhibición de la corriente de transporte inducida por la Cr. Al no haber una inhibición aditiva por ZMP, los autores sugirieron que AMPK inhibe el CreaT/SLC6A8 indirectamente a través de la vía de mTOR y no por fosforilación directa. Por el contrario, Darrabie et al. (2011) reportaron un aumento significativo en el transporte de Cr en cultivos de cardiomiocitos neonatales de rata y células cardiacas HL-1 incubadas en un medio sin Cr o con AICAR, activador de AMPK, debido a alteraciones en la Vmáx que correlacionaron con cambios en el contenido de proteína total del CreaT/SLC6A8 en la superficie celular. De esta manera, este trabajo sugiere un posible rol positivo de AMPK en la modulación del transporte de Cr en cardiomiocitos in vitro, basándose en que durante fallas del corazón en humanos se observan alteraciones críticas en el transporte de Cr generando el desbalance energético característico de la falla del miocardio (Darrabie et al. 2011).
En resumen, debido a que los estudios sobre la regulación del CreaT/SLC6A8 han reportado una disminución de la actividad del transportador en diferentes condiciones sin un cambio en la Km, se ha sugerido que hay una disminución en la actividad intrínseca y/o una reducción en el número de transportadores funcionales en la membrana plasmática. De esta forma, la relación máxima de transporte de Cr puede ser regulada por medio de la translocación del CreaT/SLC6A8 al sarcolema bajo diferentes circunstancias (ejercicio, patologías, etc.) que requieren de más investigación. Asimismo, se hacen necesarios futuros trabajos para dilucidar el efecto regulador que ejerce AMPK y otras cinasas sobre el CreaT/SLC6A8 en el músculo esquelético, así como también en otros órganos que expresan este transportador.
SUPLEMENTACIÓN Y CAPTACIÓN DE CREATINA
Las células musculares no sintetizan Cr, de manera tal que captan la Cr circulante por medio del CreaT/SLC6A8. Por consiguiente, es esencial saber si la suplementación con Cr ejerce algún tipo de regulación sobre el CreaT/SLC6A8. Además, si se pueden diseñar estrategias para incrementar la regulación del transportador entonces sería posible aumentar la captación de Cr al interior del músculo, y aún más en el cerebro para facilitar el uso de Cr como un agente neuroprotector. Se han llevado a cabo pocos estudios para comprender como el CreaT/SLC6A8 es regulado en relación a los niveles tisulares de Cr, particularmente en el músculo. No obstante, deficiencias en la especificidad de algunos de los anticuerpos disponibles para el CreaT/SCL6A8 han limitado ampliamente la comprensión de la regulación de la actividad de éste transportador a nivel celular, tanto así que el entendimiento de la regulación del CreaT/SCL6A8 está muy atrasado en comparación con la regulación de otros miembros de la familia de transportadores de neurotransmisores SLC6 (Christie 2007). Los valores de Km determinados para el CreaT/SCL6A8 son más bajos que la concentración de Cr en la sangre (50-100 μM), lo que significa que el transportador trabaja normalmente cerca a la saturación. Si la tasa de captación de Cr está cerca de su capacidad máxima entonces la regulación del nivel de CreaT/SLC6A8 en la membrana plasmática podría alterar la captación de Cr (Mesa et al. 2002; Christie 2007). Así, la captación máxima de Cr en las células musculares es inducida probablemente por concentraciones por encima de 300-400 μmol L-1; de hecho, después de la ingestión oral de 5 g de Cr, el valor máximo de Cr sérica alcanza los valores plasmáticos de 600-800 μmol L-1 en 1 hora. Considerando la Km, esta concentración es óptima para maximizar la captación de Cr en los miocitos (Persky & Brazeau 2001; Mesa et al. 2002). Sin embargo, algunos estudios han reportado que el contenido de Cr extracelular regula el transporte de Cr. Por ejemplo, Loike et al. (1988), al examinar el efecto de la Cr extracelular sobre la captación de Cr en mioblastos L6, miotubos L6 y células musculares humanas, evidenciaron una disminución en el transporte de éste metabolito en las células expuestas a Cr 5 mM mientras que dicha relación fue lineal en las células sin Cr, lo que indica que la células expuestas a una alta concentración de Cr exhiben una baja regulación en la actividad de transporte. A pesar de la diferencia de transporte de Cr en los dos tipos de cultivo, el valor de Km fue similar en las células expuestas o no a Cr, 60 y 40 μM respectivamente. Así, las células cultivadas por 24 horas en Cr 5 mM exhibieron una reducción del 75% en la tasa de transporte de Cr. Sin embargo, esta disminución fue parcialmente anulada por la adición de 10 μg mL-1 de ciclohexamida, un inhibidor de la síntesis de proteína, sugiriendo así que altas concentraciones de Cr extracelular inducen la expresión de una proteína que inactiva o remueve los transportadores de Cr desde el sarcolema por endocitosis, ya que en los datos cinéticos no se observaron cambios en la afinidad del CreaT/SLC6A8 por la Cr. Brault et al. (2003) reportaron que durante la suplementación con Cr (1% dieta) en ratas Sprague-Dawley la tasa de captación de Cr disminuye en un 45% solo en el músculo gastronecmio blanco, sin cambios significativos en los músculos sóleo y gastronecmio rojo; por otro lado, la depleción de TCr muscular tras la administración de β-GPA (1% dieta) incrementó la entrada de Cr en el sóleo (21%) y el gastronecmio rojo (22%). De esta manera, la entrada de Cr se relaciona de manera inversa con la cantidad de TCr según el tipo de músculo; por ejemplo, la captación de Cr fue menor en el músculo gastronecmio blanco el cual presentó el mayor contenido de TCr debido a que contiene gran cantidad de fibras glucolíticas de contracción rápida tipo II. Rico-Sanz et al. (1999) ya habían examinado las concentraciones de diferentes compuestos implicados en el metabolismo energético muscular mediante RMN en humanos, encontrando menores concentraciones de Cr en fibras musculares oxidativas (sóleo) y mayores niveles en fibras musculares glucolíticas (gastronecmio y tibial anterior). Esto implica que existen factores que controlan la captación de Cr según el tipo de fibra muscular, lo cual explicaría la influencia de la TCr muscular inicial y las variaciones en la acumulación de TCr muscular durante la suplementación con Cr. Así, parece que la adaptación fisiológica de la concentración de CreaT/SLC6A8, según el tipo de fibra muscular, regula la tasa de captación de Cr más que un efecto mediado por esta última. En este sentido, Murphy et al. (2001) demostraron en ratas una relación inversamente proporcional entre la concentración de Cr y el contenido de CreaT/SLC6A8 en las fibras musculares. Los resultados del estudio mostraron que la concentración de TCr es mayor en el músculo gastronecmio blanco que en el gastronecmio rojo y sóleo, mientras que los análisis de Western Blot e inmunohistoquímica revelaron un mayor contenido proteico del CreaT/SLC6A en el músculo sóleo con respecto al músculo gastronecmio rojo y de éste último con respecto al gastronecmio blanco. Estos datos indican que el contenido de CreaT/SLC6A8 es mayor en las fibras de contracción lenta tipo I debido a la menor concentración de Cr en estas fibras. Este simple mecanismo de adaptación fisiológica puede explicar el fenómeno de los sujetos que responden y los que no responden a la suplementación con Cr. Infortunadamente, la mayoría de las investigaciones en el campo de la suplementación con Cr y la regulación del CreaT/SLC6A8 se han realizado en modelos de animales, como se demostró anteriormente. Por otro lado, Guerrero-Ontiveros & Wallimann (1998) reportaron que la suplementación crónica con Cr en ratas disminuía la expresión del CreaT/SLC6A8 in vivo. Sin embargo, hasta la fecha, no han sido confirmados cambios significativos en la expresión del CreaT/SLC6A8 en respuesta al aumento en la Cr extracelular en humanos tras la suplementación con Cr (Schoch 2007; Christie 2007). Además, los trabajos que han analizado el efecto de la suplementación con Cr sobre la regulación de CreaT/SLC6A8 no han estimado cambios significativos en la Km pero si disminuciones en la Vmáx (Christie 2007).
Teniendo en cuenta los niveles intracelulares de Cr, se ha establecido que los sujetos que no responden a la suplementación presentan un incremento en la concentración de Cr menor a 20 mmol kg-1 después de una fase de carga con 20 g Cr día-1 x 5 días (Greenhaff 1996; Syrotuik & Bell 2004). Por el contrario, relacionando varias características fisiológicas se ha postulado un perfil general de los sujetos que responden a los periodos de ingesta de Cr como sigue; 1) poseer bajos niveles iniciales de Cr intramuscular y ser capaces de absorber/captar grandes cantidades de Cr durante la suplementación, 2) tener un mayor porcentaje de fibras tipo II, 3) tener un mayor área de sección transversal y 4) poseer mayor cantidad de masa libre de grasa. Estos datos sugieren que el perfil biológico de un individuo puede determinar parcialmente la eficacia de un protocolo de suplementación con Cr mediante una regulación feedback del CreaT/SLC6A8 (Schoch et al. 2006).
MECANISMOS PARA INCREMENTAR LA CAPTACIÓN DE CREATINA
- Ejercicio y Activadores del Gradiente de Concentración de Na+
Debido a que el ejercicio físico incrementa el flujo sanguíneo en el músculo, la ingestión de Cr después de 1 hora de ejercicio físico submáximo aumenta la acumulación de Cr muscular con respecto a la parte contralateral no ejercitada, posiblemente debido al aumento en la liberación de insulina tras el ejercicio (Mesa et al. 2002; Brosnan et al. 2007). También se ha reportado que la ingesta de grandes cantidades de CHO simples durante los periodos de administración de Cr genera una mayor captación de ésta última (Green et al. 1996; Steenge et al. 1998; Mesa et al. 2002; Greenwood et al. 2003), debido particularmente a la liberación de insulina más que a un mecanismo inherente de los CHO. De acuerdo con esto, Steenge et al. (1998) demostraron que infusiones de insulina incrementan la acumulación muscular y plasmática de Cr en humanos con respecto al estado basal. Se ha propuesto que la insulina facilita el transporte de Cr mediante el incremento de la actividad de la bomba Na+/K+ (Balestrino et al. 2009). Odoom et al. (1996) reportaron que no solo la insulina sino también IGF-I, T3 (~70 μmol L-1), amilina (~60 nmol L-1) e isoproterenol (agonista β) incrementan la acumulación de Cr en una línea de mioblastos esqueléticos G8 de ratón, todos estos compuestos son conocidos por estimular la actividad de la ATPasa Na+/K+ estimulando así el cotransporte de Na+/Cr. Adicionalmente, la isoprenalina (agonista β no específico) y el clenbuterol (agonista β2) incrementan la concentración de TCr en un 40-60% y 30% respectivamente (Mesa et al. 2002); no obstante, el uso de estas sustancias da prueba positiva de doping. Además, Steenge et al. (2000) reportaron un aumento significativo (~25%) en la retención de Cr en el cuerpo entero, con respecto al placebo, tras la suplementación con 5 g Cr + 50 g proteína + 47 g CHO, así como también al consumir 5 g Cr + 96 g CHO. A fin de alcanzar un valor máximo de las concentraciones de Cr e insulina simultáneamente, se ha recomendado un lapso de 30 minutos entre la ingesta de Cr + proteína y la subsecuente bebida de CHO (500 mL ~50 g de CHO simples) (Mesa et al. 2002).
- Electrolitos
Estudios in vitro han reportado que las concentraciones de electrolitos extracelulares influencian la captación de Cr por las células musculares. De hecho, la captación de Cr aumenta hiperbólicamente con relación a la concentración de Cl- extracelular, aunque respecto a la concentración de Na+ extracelular la relación es sigmoidea. De acuerdo con esto, Odoom et al. (1996) reportaron que una reducción en la concentración de Na+ extracelular (desde 145 a 25 mM) disminuye la captación de Cr muscular en un 77%. No obstante, actualmente no hay evidencia de estudios in vivo que sugirieran tal dependencia. Esto se debe particularmente a que la variabilidad de las concentraciones de Na+ y Cl- extracelular es mínima en los experimentos in vivo con respecto a los estudios in vitro, lo que hace improbable que cambios en las concentraciones extracelulares de estos electrolitos in vivo sean capaces de afectar la captación de Cr por las células musculares (Mesa et al. 2002).
- Cafeína
El consumo de cafeína ha sido caracterizado por incrementar el rendimiento deportivo durante el ciclismo de alta intensidad en humanos, por lo que también es considerada una ayuda ergogénica en cierto tipo de deportes (Kreider et al. 2010). La cafeína actúa directamente sobre el músculo esquelético permitiendo el aumento en la transmisión del estímulo neuronal particularmente en la unión motoneurona-músculo, además de bloquear los receptores de adenosina en el sistema nervioso central interrumpiendo la fatiga durante ejercicio aeróbico en humanos y animales (Franco et al. 2011). No obstante, varios autores han sugerido que el efecto ergogénico y la captación de Cr muscular disminuye cuando ésta es ingerida con cafeína (Kreider 1998a, 2003; Mesa et al. 2002; Vandenberghe 1996a, 1997b). Hespel et al. (2002) realizaron un doble ciego con 10 sujetos para examinar el efecto de la suplementación con Cr + cafeína sobre el tiempo de relajación muscular tras estimulación eléctrica del cuádriceps femoral (2 seg contracción, 2 seg descanso). Aunque la suplementación con Cr (20 g día-1 x 4 días) disminuyó en un ~5% el tiempo de relajación muscular con respecto al placebo, la administración de Cr + 5 mg kg-1 cafeína incrementó el tiempo de relajación en un ~10% con respecto al consumo de Cr. A pesar de que la ingesta paralela de Cr + cafeína atenúa los efectos ergogénicos que presenta la administración solamente de Cr, se ha reportado que el consumo de cafeína después del periodo de carga con Cr promueve ciertos aspectos ergogénicos en humanos durante ejercicio aeróbico (Doherty et al. 2002). Lee et al. (2010) investigaron, en 12 hombres físicamente activos, los efectos de la ingestión aguda de cafeína sobre el rendimiento de carrera de alta intensidad en cicloergómetro después de una carga de 5 días con Cr (20 g día-1). Los resultados mostraron que durante las series 1 y 2, el poder promedio y máximo fue significativamente mayor en el grupo Cr + Cafeína en comparación con el grupo Cr + placebo. Además, durante la mayoría de las series el contenido de lactato y glucosa plasmática incrementaron significativamente en el grupo Cr + cafeína, sugiriendo un aumento en la capacidad oxidativa. Recientemente, Franco et al. (2011) reportaron que altas dosis de Cr + cafeína no afectan la composición de masa magra corporal en ratas Wistar sometidas a entrenamiento de salto vertical. Los autores suplementaron ratas con Cr (fase de carga: 0.430 g Kg-1 peso corporal x 7 días, fase de mantenimiento: 0.143 g Kg-1 peso corporal x 35 días), cafeína (15 mg Kg-1 de peso corporal x 42 días), Cr + cafeína o placebo. No hubo diferencias significativas entre los grupos para el porcentaje de proteína y agua corporal, mientras que la suplementación solamente con cafeína disminuyó de manera significativa el porcentaje de grasa con respecto a los grupos Cr.
Las observaciones anteriores permiten establecer que no es recomendable ingerir simultáneamente Cr + cafeína debido a la anulación de los efectos ergogénicos de la suplementación con Cr. No obstante, la cafeína es considerada un suplemento ergogénico que aumenta la resistencia a la fatiga y disminuye las concentraciones musculares de K+ durante ejercicio intermitente de alta intensidad, tal como mostraron Mohr y col. (2011). En este sentido, después de realizado el periodo de carga con Cr el consumo de cafeína optimiza el rendimiento en ejercicios aeróbicos de alta intensidad, posiblemente mejorando el rendimiento en deportes que no han evidenciado mejoras tras la ingesta de Cr [fútbol (Dos Santos 2001; Williams 2007), tenis (Pluim et al. 2006), ciclismo, etc.] aunque se requiere mayor investigación en cuanto a esto se refiere.
- Creatina y Suplementos Comerciales
Hoy en día abundan complementos que contienen Cr creando confusión en los deportistas que consumen este suplemento. Sin embargo, la única diferencia a nivel químico entre todas estas sales estriba en la cantidad de Cr libre que contienen, así por ejemplo el monohidrato de Cr contiene 880 mg de Cr libre por cada gramo, el malato de dicreatina solo 650 mg g-1 y el citrato de Cr tan solo 400 mg g-1 (Power GYM; Jäger et al. 2011). Otros suplementos de Cr que se encuentran en el mercado mundial son: α-cetoglutarato de Cr, gluconato de Cr, Cr etil éster, Cr-metil éster, Cr magnesio, Cr efervescente, piruvato de Cr, taurinato de Cr, creatinato de carnitina, Cr alcalina, solución de Cr intravenosa, entre otros (Maus 2007; Jäger et al. 2011). Spillane et al. (2009), al evaluar la supuesta mayor biodisponibilidad de Cr tras la suplementación con Cr etil éster en conjunción con entrenamiento de resistencia, encontraron que en comparación con el monohidrato de Cr la ingesta de Cr etil éster no incrementa o mejora ciertas variables relacionadas con el rendimiento deportivo. Por otro lado, Schoch (2007), teniendo en cuenta que el extracto de canela (CinnulinTM) ha presentado características similares a los efectos de la insulina, ha sugerido que la elaboración de un suplemento de monohidrato de Cr combinado con CinnulinTM incrementara la captación de Cr muscular. Tras un régimen de suplementación de 7 semanas con monohidrato de Cr + CinnulinTM, los resultados mostraron un incremento en la 1-RM en press de pierna, masa magra del muslo y contenido de agua corporal con respecto al grupo monohidrato de Cr, a pesar de que no hubo diferencias significativas en la concentración intramuscular de Cr entre ambos grupos. Por su parte, Tarnopolsky & Safdar (2008) evaluaron un posible efecto agregado de la ingesta de Cr + ácido linoleico con respecto al efecto individual del monohidrato de Cr en sujetos de la tercera edad; sin embargo, los resultados no mostraron que la suplementación con Cr + ácido linoleico incremente los efectos ergogénicos evidenciados tras la administración de monohidrato de Cr. En conclusión, mientras la seguridad, eficacia y estado de regulación del monohidrato de Cr está claramente definida en casi todos los mercados globales (Jäger et al. 2011), en la actualidad se requiere mayor investigación en estas mismas variables en cuanto a nuevas formas de Cr se refiere.
RECOMENDACIONES
Particularmente, el monohidrato de Cr parece ser la mejor presentación que brinda buena proporción, efectividad y economía a la hora de obtener los efectos benéficos de la suplementación con Cr sobre el rendimiento deportivo (Greenwood et al. 2003; McDowall 2007; Kreider et al. 2010; Jäger et al. 2011; Bonilla 2013). No obstante, a continuación se enumeran algunos consejos fundamentados en las investigaciones llevadas a cabo hasta hoy en día que proporcionan una mejor captación de Cr tras los periodos de suplementación:
1) Consumir preferiblemente monohidrato de Cr en vez de otros suplementos.
2) Consumir 30-60 minutos antes y 30-60 minutos después del ejercicio (según la fase de ingesta de Cr en la cual se encuentre el sujeto, ver Tabla 1).
3) Disolver en agua a temperatura ambiente o en una bebida alta en Na+ y consumir inmediatamente (no se recomienda disolver en cafeína, bebidas cítricas o con pH bajo). Para deportes aeróbicos es recomendable consumir cafeína ~1 hora después de la fase de carga con Cr ¡NUNCA AMBOS AL MISMO TIEMPO!
4) Debido a que la insulina es una de las hormonas que ejerce mayor influencia en el aumento de la retención de Cr hay algunas formas de potenciar este efecto:
- Consumir con nutrientes y biomoléculas como la taurina, fosfatos y cromo (Power GYM).
- Consumir CHO simples o de alto índice glucémico (500 mL, ~50 g) 30 minutos después de la ingesta de Cr.
5) Ingerir simultáneamente con un suplemento de BCAAs y proteína (~50 g), preferiblemente en la toma después del ejercicio.
6) Consumir por lo menos dos litros de agua por día, particularmente durante la fase de carga (HorleysTM Intelligent Sports Nutrition).
7) Realizar cada ~6 semanas un lavado (wash-out) de los depósitos de Cr suprimiendo por completo el consumo de ésta durante 2 semanas. Después, repetir el ciclo de suplementación.
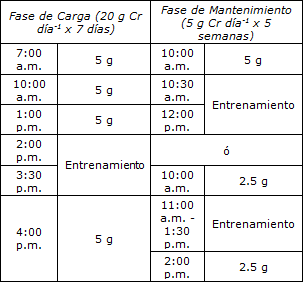
Tabla 1. Horarios recomendados para ingerir Cr. Los datos presentados suponen un incremento en la captación de Cr a lo largo del día durante las dos fases de suplementación (basado en los hallazgos de distintas investigaciones resumidas en el texto). La rutina de entrenamiento se fundamenta en el tiempo estándar de 1 hora y media para entrenamiento de resistencia con pesas (el horario del ejercicio puede variar entre el rango de las tomas de Cr a lo largo del día siempre y cuando esté antes y después de cada ingesta). Durante la fase de mantenimiento se recomienda consumir Cr en dos dosis de 2.5 g. Basado en HorleysTM Intelligent Sports Nutrition. Fact Sheet Creatine; Micronized Creatine Monohydrate ®. www.horleys.com
Las anteriores pautas de dosificación son recomendadas para deportes de fuerza, culturismo y fitness. Para la mayoría de personas saludables 20 y 3-5 g de Cr por día es una dosis adecuada para la fase de carga y de mantenimiento, respectivamente, mientras que para personas saludables con un peso mayor a 95 Kg se sugiere ingerir 30 g de fase de carga y 5 g de fase de mantenimiento.
CONCLUSIONES
El mejor protocolo para incrementar los depósitos de Cr en sujetos saludables es: realizar una fase de carga (~0.3 g Cr Kg-1 día-1) durante 5-7 días, proseguir con la fase de mantenimiento (0.03 g Cr Kg-1 día-1) durante 4-5 semanas, después de ~6 semanas detener la suplementación con Cr durante dos semanas (washout) y repetir el ciclo. Simultáneamente, los mecanismos para optimizar la captación de Cr son: consumir preferiblemente monohidrato de Cr que contenga adicionalmente taurina, fosfatos y cromo, disolver en agua a temperatura ambiente o en una bebida alta en electrolitos y consumir inmediatamente (nunca consumir con cafeína o bebidas cítricas), ingerir paralelamente un suplemento de BCAAs y proteína (~50 g) y consumir 30 min después una bebida de CHO simples (500 mL, ~50 g). Tener en cuenta consumir el suplemento de Cr (con los compuestos adicionales mencionados) 30-60 min antes y 30-60 min después del ejercicio, resaltando beber ~2 L de agua durante la fase de carga.
Referencias
1. Almeida LS, Salomons GS, Hogenboom F, Jakobs C, Schoffelmeer AN. (2006). Exocytotic Release of Creatine in Rat Brain. Synapse 60
2. Balestrino M, Gandolfo C & Perasso L. (2009). Controlling the Flow of Energy: Inhibition and Stimulation of the Creatine Transporter. Current Enzyme Inhibition 5, 223-233.
3. Bonilla DA. (2013). Principios Metabólicos de los Efectos de la Suplementación con Creatina sobre el Rendimiento Deportivo. PubliCE Standard.
4. Brault JJ, Abraham KA & Terjung RL. (2003). Muscle Creatine Uptake and Creatine Transporter Expression in Response to Creatine Supplementation and Depletion. J Appl Physiol 94: 2173–2180.
5. Brosnan ME, Edison EE, da Silva R & Brosnan JT. (2007). New Insights into Creatine Function and Synthesis. Advan. Enzyme Regul 47; 252–260.
6. Christie DL. (2007). Functional Insights into the Creatine Transporter. Subcellular Biochemistry 46: 99-118.
7. Darrabie MD, Arciniegas AJ, Mishra R, Bowles DE, Jacobs DO & Santacruz L. (2011). AMPK and Substrate Availability Regulate Creatine Transport in Cultured Cardiomyocytes. Am J Physiol Endocrinol Metab 300
8. Derave W, Straumann N, Olek RA & Hespel P. (2006). Electrolysis Stimulates Creatine Transport and Transporter Cell Surface Expression in Incubated Mouse Skeletal Muscle: Potential Role of Reactive Oxygen Species. Am J Physiol Endocrinol Metab. 291
9. Dodd JR & Christie DL. (2007). Selective Amino Acid Substitutions Convert the Creatine Transporter to a γ-Aminobutyric Acid Transporter. The Journal of Biological Chemistry Vol. 282, No. 21, pp. 15528–15533.
10. Doherty M, Smith PM, Davison RC & Hughes MG. (2002). Caffeine is Ergogenic after Supplementation of Oral Creatine Monohydrate. Med Sci Sports Exerc 34, 1785-1792.
11. Dos Santos MG. (2001). Estudio del Metabolismo Energético Muscular y de la Composición Corporal de Atletas por Métodos no Destructivos. Tesis de Doctorado para la obtención del título de Doctor en Bioquímica y Biología Molecular, Facultad de Ciencias, Departamento de Bioquímica y Biología Molecular, Universidad Autónoma de Barcelona, Barcelona, España.
12. Franco FS, Costa NM, Ferreira SA, Carneiro-Junior MA & Natali AJ. (2011). The Effects of a High Dosage of Creatine and Caffeine Supplementation on the Lean Body Mass Composition of Rats Submitted to Vertical Jumping Training. Society of Sports Nutrition, 8:3.
13. Green AL, Simpson EJ, Littlewood JJ & MacDonald IA. (1996). Carbohydrate Ingestion Augments Creatine Retention during Creatine Feeding in Humans. Acta Physiol Scand 158: 195-202.
14. Greenhaff PL. (1996). Creatine Supplementation: Recent Developments. Brit. J. Sports Med. 30, 276-277.
15. Greenwood M, Kreider MB, Earnest C, Rasmussen C & Almada A. (2003). Differences In Creatine Retention Among Three Nutritional Formulations Of Oral Creatine Supplements. JEP online; 6
16. Guerrero-Ontiveros ML & Wallimann T. (1998). Creatine Supplementation in Health and Disease. Effects of Chronic Creatine Ingestion In Vivo: Downregulation of the Expression of Creatine Transporter Isoforms in Skeletal Muscle. Molecular and Cellular Biochemistry 184: 427–437.
17. Hespel P, Op‘t Eijnde B & Van Leemputte M. (2002). Opposite Actions of Caffeine and Creatine on Muscle Relaxation Time in Humans. J Appl Physiol 92: 513–518.
18. HorleysTM Intelligent Sports Nutrition (.). Fact Sheet Creatine; Micronized Creatine Monohydrate®.. www.horleys.com
19. Jäger R, Purpura M, Shao A, Inoue T & Kreider RB. (2011). Analysis of the Efficacy, Safety and Regulatory Status of Novel Forms of Creatine. Amino Acids 40:1369–1383.
20. Kreider RB. (1998). Creatine, The Next Ergogenic Supplement? In: Sportscience Training & Technology. Internet Society for Sport Science. http://www.sportsci.org/traintech/creatine/rbk.html
21. Kreider RB. (2003). Effects of Creatine Supplementation on Performance and Training Adaptations. Mol Cell Biochem 244: 89–94.
22. Kreider RB, Wilborn CD, Taylor L, Campbell B, Almada AL, Collins R, Cooke M, Earnest CP, Greenwood M, Kalman DS, Kerksick CD, Kleiner SM, Leutholtz B, Lopez H, Lowery LM, Mendel R, Smith A, Spano M, Wildman R, Willoughby DS, Ziegenfuss TM & Antonio J. (2010). ISSN Exercise & Sport Nutrition Review: Research & Recommendations. Journal of the International Society of Sports Nutrition, 7:7 http://www.jissn.com/content/7/1/7
23. Lee CL, Lin JC & Cheng CF. (2011). Effect of Caffeine Ingestion after Creatine Supplementation on Intermittent High-Intensity Sprint Performance. Eur J Appl Physiol 111
24. Li H, Thali RF, Smolak C, Gong F, Alzamora R, Wallimann T, Scholz R, Pastor-Soler NM, Neumann D & Hallows KR. (2010). Regulation of the Creatine Transporter by AMP-Activated Protein Kinase in Kidney Epithelial Cells. Am J Physiol Renal Physiol 299: F167–F177.
25. Loike JD, Zalutsky DL, Kaback E, Miranda AF & Silverstein SC. (1988). Extracellular Creatine Regulates Creatine Transport in Rat and Human Muscle Cells. Proc. Natl. Acad. Sci. Vol. 85, pp. 807-811.
26. Maus MJ. (2007). Der Kreatin Report. Copyright by GMC GmbH und www.fitforhealth.de
27. McDowall JA. (2007). Supplement Use by Young Athletes. Journal of Sports Science and Medicine 6, 337-342.
28. Mesa J, Ruiz J, González-Gross M, Gutiérrez A & Castillo M. (2002). Oral Creatine Supplementation and Skeletal Muscle Metabolism in Physical Exercise. Sports Med 32
29. Mohr M, Nielsen JJ & Bangsbo J. (2011). Caffeine Intake Improves Intense Intermittent Exercise Performance and Reduces Muscle Interstitial Potassium Accumulation. J Appl Physiol 111
30. Murphy R, McConell G, Cameron-Smith D, Watt K, Ackland L, Walzel B, Wallimann T & Snow R. (2001). Creatine Transporter Protein Content, Localization and Gene Expression in Rat Skeletal Muscle. Am J Physiol Cell Physiol 280: C415–C422.
31. Nasrallah F, Feki M & Kaabachi N. (2010). Creatine and Creatine Deficiency Syndromes: Biochemical and Clinical Aspects. Pediatr Neurol 42: 163-171.
32. Odoom JE, Kemp GJ & Radda GK. (1996). The Regulation of Total Creatine Content in a Myoblast Cell Line. Mol Cell Biochem 158
33. Patra S, Bera S, SinhaRoy S, Ghoshal S, Ray S, Basu A, Schlattner U, Wallimann T, Ray M. (2008). Progressive decrease of phosphocreatine, creatine and creatine kinase in skeletal muscle upon transformation to sarcoma. FEBS Journal 275
34. Peral MJ, García-Delgado M, Calonge ML, Durán JM, De La Horra MC, Wallimann T, Speer O & Ilundáin AA. (2002). Human, Rat and Chicken Small Intestinal Na+–Cl- Creatine Transporter: Functional, Molecular Characterization and Localization. Journal of Physiology 545.1; 133–144.
35. Persky AM & Brazeau GA. (2001). Clinical Pharmacology of the Dietary Supplement Creatine Monohydrate. Pharmacol Rev 53:161–176.
36. Pluim BM, Ferrauti A, Broekhof F, Deutekom M, Gotzmann A, Kuipers H & Weber K. (2006). The Effects of Creatine Supplementation on Selected Factors of Tennis Specific Training. Br J Sports Med 40: 507–512.
37. Power GYM (,). The Nutrition Science.. CREAPLUS®. www.powergym.net
38. Rico-Sanz J, Thomas EL, Jenkinson G, Mierisová S, Iles R & Bell JD. (1999). Diversity in Levels of Intracellular Total Creatine and Triglycerides in human Skeletal Muscles Observed by 1H-MRS. J Appl Physiol 87
39. Schoch RD, Willoughby D & Greenwood M. (2006). The Regulation and Expression of the Creatine Transporter: A Brief Review of Creatine Supplementation in Humans and Animals. Journal of the International Society of Sports Nutrition. 3
40. Schoch RD. (2007). The Effects of a Creatine Supplement Formulation Containing Cinnamon Extract on Creatine Uptake, Creatine Transporter Expression, Insulin Signaling, and Muscle Performance in Males. Tesis de Maestría para la obtención del título de Master de Ciencias en Educación, Facultad de Licenciatura, Departamento de Salud, Performance Humano y Recreación, Universidad de Baylor, Texas, Estados Unidos.
41. Shojaeifard MB, Christie DL & Lang F. (2005). Stimulation of the Creatine Transporter SLC6A8 by the Protein Kinases SGK1 and SGK3. Biochem Biophys Res Commun 334, 742–746.
42. Shojaeifard MB. (2006). Regulation of Membrane Transporters by Kinases. Tesis de Doctorado para la obtención del título de Doctor en Ciencias Naturales, Facultad de Biología, Universidad Eberhard Karls, Tübingen, Alemania.
43. Shojaeifard MB, Christie DL & Lang F. (2006). Stimulation of the Creatine Transporter SLC6A8 by the Protein Kinase mTOR, Biochem. Biophys. Res. Commun. 341, 945–949.
44. Snow RJ & Murphy RM. (2001). Creatine and the Creatine Transporter: A Review. Molecular and Cellular Biochemistry 224: 169–181.
45. Speer O, Neukomm LJ, Murphy RM, Zanolla E, Schlattner U, Henry H, Snow RJ & Wallimann T. (2004). Creatine Transporters: A Reappraisal. Mol Cell Biochem 256/257: 407-424.
46. Spillane M, Schoch R, Cooke M, Harvey T, Greenwood M, Kreider R & Willoughby DS. (2009). The Effects of Creatine Ethyl Ester Supplementation Combined with Heavy Resistance Training on Body Composition, Muscle Performance, and Serum and Muscle Creatine Levels. Journal of the International Society of Sports Nutrition 6:6.
47. Steenge GR, Lambourne J, Casey A, Macdonald IA & Greenhaff PL. (1998). Stimulatory Effect of Insulin on Creatine Accumulation in Human Skeletal Muscle. Am J Physiol 275: E974–E979.
48. Steenge GR, Simpson EJ & Greenhaff PL. (2000). Protein- and Carbohydrate-Induced Augmentation of Whole Body Creatine Retention in Humans. J Appl Physiol 89: 1165–1171.
49. Strutz-Seebohm N, Shojaiefard M, Christie DL, Tavare JM, Seebohm G & Lang F. (2007). PIKfyve in the SGK1 Mediated Regulation of the Creatine Transporter SLC6A8. Cell Physiol Biochem; 20:729-734.
50. Syrotuik DG & Bell GJ. (2004). Acute Creatine Monohydrate Supplementation: A Descriptive Physiological Profile of Responders vs. Nonresponders. J. Strength. Cond. Res. 18, 610-617.
51. Tarnopolsky MA & Safdar A. (2008). The Potential Benefits of Creatine and Conjugated Linoleic Acid as Adjuncts to Resistance Training in Older Adults. Appl. Physiol. Nutr. Metab. 33: 213–227.
52. Tran TT, Dai W & Sarkar HK. (2000). Cyclosporin A Inhibits Creatine Uptake by Altering Surface Expression of the Creatine Transporter. J Biol Chem 275: 35708–35714.
53. Vandenberghe K. et al. (1996). Caffeine Counteracts the Ergogenic Action of Muscle Creatine Loading. J. Appl. Physiol. 80, 452-457.
54. Vandenberghe K, Van Hecke P, Van Leemputte M, Vanstapel F & Hespel P. (1997). Inhibition of Muscle Phosphocreatine Resynthesis by Caffeine after Creatine Loading. Med Sci Sports Exerc 29: S249.
55. Wallimann T, Tokarska-Schlattner M & Schlattner U. (2011). The Creatine Kinase System and Pleiotropic Effects of Creatine. Amino Acids 40:1271–1296.
56. Williams J. (2007). The Acute Effects of Creatine Monohydrate Loading on Simulated Soccer Performance. Tesis de Maestría para la obtención del título de Master de Ciencias de la Salud, División de Deporte y Recreación, Universidad Tecnológica de Auckland, Auckland, Nueva Zelanda.