Bioquímica de la Acidosis Metabólica Inducida por el Ejercicio
Robert A Robergs1, Daryl L Parker2 y Farzenah Ghiasvand1
1Exercise Physiology Laboratories, Exercise Science Program, Department of Phsysical Performance and Development, The University of New Mexico, Albuquerque, New Mexico 87131.
2Exercise Science Program, California State University-Sacramento, Sacramento, California 95819.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2004.
Publicado 28 de febrero de 2007
Resumen
Palabras clave: músculo esquelético, lactato, ácido-base, acidosis láctica
INTRODUCCION
Durante el ejercicio, el incremento en el lactato sanguíneo y muscular y la disminución coincidente en el pH en ambos tejidos ha sido tradicionalmente explicada por la producción de ácido láctico. Tal interpretación tradicional asume que debido al relativamente bajo pKa (pH=3.87) del grupo funcional ácido carboxílico del ácido láctico, hay una inmediata y casi total ionización del ácido láctico a través del rango del pH de la célula muscular (~6.2 – 7.0) (12, 28, 40-46, 54). Esta interpretación es mejor representada por el contenido de numerosos libros de texto de fisiología del ejercicio, fisiología, y bioquímica que explican la acidosis por la producción de ácido láctico, causando la liberación de un protón (H+) y dejando el producto final que es la sal del ácido, el lactato. Este proceso ha sido llamado acidosis láctica (27). De acuerdo a esta presentación, cuando hay un incremento rápido en la producción de ácido láctico, el H+. libre puede ser amortiguado por al bicarbonato causando la producción no metabólica de dióxido de carbono (CO2). El desarrollo de la acidosis y el aumento del contenido de CO2 estimulan un incremento en la velocidad de la respiración causando la relación temporal entre el lactato y los umbrales ventilatorios (25, 32, 44, 53).
Esta revisión apoya el trabajo previo de numerosos científicos que han criticado el concepto de la acidosis láctica y presentaron explicaciones alternativas de la bioquímica de la acidosis metabólica (4, 7, 10, 11, 16, 34, 55, 57, 60, 61, 63). La explicación de la acidosis metabólica no es apoyada por la bioquímica fundamental, no tiene ningún apoyo basado en investigaciones, y deja una huella negativa para todos los campos de la ciencia clínica, básica y aplicada y profesiones que todavía aceptan estos conceptos. No obstante, las afirmaciones que implican que el “ácido láctico” o la “acidosis láctica” causan la acidosis metabólica pueden ser todavía encontradas en la literatura actual (1, 2, 13, 19, 22, 48, 51, 53, 59, 62) y continúan siendo una explicación para la acidosis metabólica en actuales libros de bioquímica, fisiología del ejercicio, y fisiología ácido-base. Claramente, académicos, investigadores, y estudiantes de ciencias básicas y aplicadas, incluyendo especialistas médicos, necesitan reevaluar su entendimiento acerca de la bioquímica de la acidosis metabólica.
Dada la importancia básica, aplicada y clínica de un correcto entendimiento de las causas de la acidosis, el propósito de esta revisión es: 1) presentar una breve historia del descubrimiento y aislamiento del ácido láctico y las primeras investigaciones que establecieron la asociación entre producción de lactato muscular y acidosis, 2) identificar que el ácido láctico y la acidosis láctica no tienen apoyo desde los hechos, 3) revisar la bioquímica fundamental de las reacciones en el músculo esquelético en contracción que alteran tanto la producción como el consumo de H+., 4) proporcionar la verdadera explicación bioquímica de la acidosis metabólica y presentar y explicar un modelo de estos eventos, 5) proporcionar evidencia de investigaciones que refuta el concepto de acidosis láctica, 6) presentar datos que comparan la liberación de lactato y protones desde el músculo esquelético, así como, de producción intramuscular de lactato y protones, y 7) identificar los argumentos clave para la necesidad de corregir la forma en la cual la acidosis es explicada, enseñada e interpretada en el campo académico, así como en la investigación básica y aplicada.
UNA BREVE HISTORIA ACERCA DEL ACIDO LACTICO
Debido a la importancia y aceptación del ácido láctico en la bioquímica metabólica y la fisiología humana, está garantizada una corta historia acerca del ácido láctico. Esta historia no es solo interesante por si misma, sino que revela y ayuda a entender la primera aceptación incorrecta del concepto de acidosis láctica.
Descubrimiento y Aislamiento
El químico sueco Carl Wilheim Scheele (17) descubrió primero al ácido láctico en 1780. Scheele encontró al ácido láctico en muestras de leche cortada y lo aisló en condiciones relativamente impuras. El origen de la leche del primer descubrimiento del ácido láctico condujo a la aceptación del nombre trivial de esta molécula (“láctico”, de o relacionado a la leche). Sin embargo, el verdadero nombre químico del ácido láctico es ácido 2-hidroxipropanóico. El nombre trivial aceptado para la sal de sodio del ácido láctico es lactato sódico (Figura 1).
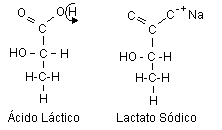
Figura 1. Estructura química del ácido láctico y la sal de sodio,
lactato. Cuando el protón del grupo funcional ácido carboxílico (-COOH) del
ácido láctico se disocia (COO-
+ H+), un catión interactúa iónicamente con el oxígeno
cargado negativamente del grupo carbonilo, formando la sal del ácido, el
lactato. En este ejemplo, el catión es el sodio (Na+).
La impureza de la muestra original de Scheele del ácido láctico condujo a críticas considerables acerca de la existencia de tal ácido, en explicaciones alternativas fue planteado que los hallazgos de Scheele constituían una muestra de ácido acético impuro. No obstante, para 1810 los químicos habían verificado la presencia del ácido láctico en otros tejidos orgánicos, como la leche fresca, carne de buey, y sangre (17). En 1883, habían sido preparadas muestras de ácido láctico puro y fue determinada la fórmula del ácido láctico. El hallazgo acerca de que el ácido láctico existe en múltiples isómeros ópticos (isómeros D- y L-) fue hecho en 1869 (17), y es el isómero L- el que tiene actividad metabólica biológica. Debido a la prevalencia de la formación de ácido láctico en la reacciones de fermentación, la misma fue la principal dirección de las primeras preguntas científicas en el área de la bioquímica de la producción de ácido láctico.
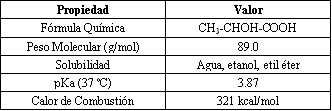
Tabla 1. Resumen de las propiedades físicas del ácido láctico.
Propiedades Físicas
La Tabla 1 proporciona un resumen de las propiedades conocidas del ácido láctico que tienen relevancia para su funcionamiento en el metabolismo celular. El trabajo para identificar las propiedades químicas y físicas del ácido láctico fue complicado por la tendencia de las soluciones de ácido láctico a formar ésteres intermoleculares, formando estructuras de polilactato, tales como el ácido lactoiláctico formado por dos moléculas. No obstante, el descubrimiento de que el ácido láctico podría cristalizar ocurrió ya en 1895 (17). El trabajo subsiguiente en la cuantificación de las propiedades físicas del ácido láctico fue complicado por las dificultades para purificar muestras, y las investigaciones con exactitud aceptada para muchas, pero no todas, las propiedades no se realizaron hasta 1960.
Aplicaciones Diversas
El hecho de que el ácido láctico sea una molécula que aparece naturalmente, con la detección original en productos alimenticios, condujo a la posibilidad de usarlo en la industria alimenticia. Tal aplicación proyectada fue ayudada por la solubilidad del ácido láctico, su suave gusto ácido, y sus probadas funciones como conservante. No es sorprendente que el ácido láctico haya sido usado para acidificar comidas y bebidas, ayudar a la fermentación de la col a sauserkraut, conservar pepinos, como ingrediente en la elaboración y condimentación de la cerveza, como ingrediente para hacer queso, como una fuente de calcio (lactato cálcico) en la comida para bebés, y como ingrediente para el pan (17). Los polímeros del ácido láctico han sido usados para mejorar la función de muchos polímeros y resinas usadas en la industria de la construcción.
Orígenes y Aceptación Continua del Concepto de la “Acidosis Láctica”
La presencia de lo que ha sido llamada “acidosis láctica” en los humanos, la cual es una extensión de la interpretación anteriormente mencionada de la producción de “ácido láctico” en la fermentación, puede ser encontrada en las investigaciones pioneras de la bioquímica del músculo esquelético durante el ejercicio. Dos primeros pioneros de estas investigaciones fueron Otto Meyerhoff y Archibald V. Hill (Figura 2), quienes en 1922 recibieron el premio Nobel por su trabajo en la energética del catabolismo de los carbohidratos en el músculo esquelético (14, 15, 35, 47). En particular Meyerhoff elucidó la mayoría de las rutas glucolíticas y demostró que el ácido láctico era producido como una reacción adicional de la glucólisis en ausencia de oxígeno. Hill cuantificó la liberación de energía a partir de la conversión de la glucosa a ácido láctico y propuso que la oxidación de la glucosa en tiempos de disponibilidad de oxígeno limitada, así como cuando las demandas energéticas de la contracción muscular exceden las de la oxidación que implica al oxígeno, puede suministrar una fuente rápida y grande de energía para abastecer a la contracción muscular.
Hill fue notablemente impresionante en sus habilidades para usar el sentido común en sus teorías científicas. Por ejemplo, en aquel tiempo, una creencia común era que, “en el músculo este oxígeno es usado durante la contracción en si misma en alguna clase de cambio químico explosivo el cual induce movimiento” (15). Para Hill, tal explicación era inconsistente con la observación de que los músculos en un ambiente hipóxico aun podían contraerse y podían hacerlo durante varios minutos. Claramente, una fuente metabólica adicional de energía que no dependía del oxígeno estaba disponible para abastecer a la contracción muscular.

Figura 2. Archivald V. Hill (izquierda) y Otto Meyerhoff (derecha).
Figuras tomadas con permiso de la Fundación Nobel.
Los propios experimentos de Hill acerca de la máxima tasa de consumo de oxígeno durante el ejercicio (que para ese tiempo se pensaba que estaba limitada a 4 l/min), así como las estimaciones de la liberación de calor a partir de la conversión de glucosa a lactato y la energética de la contracción muscular, revelaron que la contracción muscular intensa requería un intercambio de energía equivalente a aproximadamente ocho veces la máxima tasa de consumo de oxígeno conocida (14, 29).
El trabajo de Hill y Meyerhoff cementó la aceptación de la producción de ácido láctico y la acidosis en la mente de los bioquímicos y fisiólogos. Hill documentó y explicó la lógica acerca de que el músculo tiene una fuente inmediata y poderosa de producción de energía para abastecer a las contracciones musculares rápidas e intensas, y Meyerhoff reveló la bioquímica acerca de cómo tal fuente resultó en la producción de ácido láctico. Había conocimientos insuficientes acerca de la química ácido-base en aquel tiempo para comprender la ionización de moléculas distintas a los ácidos tradicionales y había también conocimientos insuficientes acerca de la respiración mitocondrial para reconocer los roles de la mitocondria para alterar el equilibrio celular de protones. La abundancia de investigaciones, aún en aquel tiempo, acerca de la producción de ácido láctico durante la fermentación y su presencia en numerosos tejidos animales estableció la conexión entre anaerobiosis, producción de ácido láctico, y acidosis. Tal conexión aceptada fue asumida como causa y efecto en el trabajo aplicado de Hill y el trabajo en ciencia básica de Meyerhoff. Además, es fácil comprender como la calidad de premio Nobel del trabajo de Hill y Meyerhoff fue prueba suficiente para el mundo científico en ese tiempo para la interpretación acerca de que la producción de lactato y la acidosis eran causa y efecto.
La aceptación no cuestionada de la acidosis láctica es un sello de casi todas las investigaciones en ciencia básica y aplicada del metabolismo muscular desde 1920. Por ejemplo, Margaria et al. (32) demostraron que la concentración de ácido láctico en la sangre es concomitante con los cambios en el pH sanguíneo. Un ejemplo clásico más reciente de esta investigación e interpretación es la de Sahlin et al. (42). Estos investigadores midieron el pH muscular, lactato, y piruvato durante el ejercicio y la recuperación, a partir de diferentes intensidades de ejercicio agotador. Las gráficas de la suma de lactato y piruvatro en función del pH muscular revelaron una notable relación lineal entre las dos variables (Figura 3). Además, tal linealidad fue mantenida a pesar de las diferentes intensidades de ejercicio y condiciones de ejercicio vs. recuperación. Nuestra ilustración y el análisis de los resultados de Sahlin usando datos combinados de ejercicio y recuperación, revelaron las siguientes estadísticas: r=0.912; Sy.x=0.083 unidades de pH.
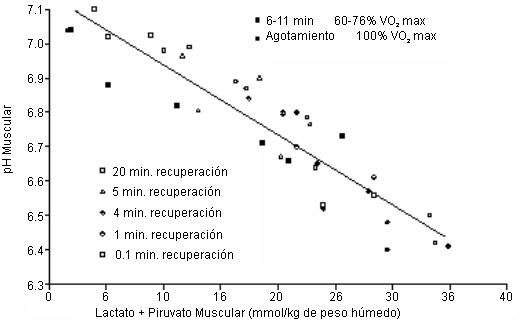
Figura 3. Figura original redibujada a partir de datos de Sahlin et al.
(42) (Figuras 1 y 2, p. 46), que muestra la relación lineal entre la suma del
lactato y piruvato muscular vs. el pH muscular. Los datos son combinados a
partir de diferentes intensidades de ejercicio y diferentes duraciones de la
recuperación luego del ejercicio hasta el agotamiento (ver las inscripciones de
la figura original).
Naturalmente, la relación lineal entre el pH muscular y la suma del lactato y piruvato, los cuales en este tiempo eran todavía interpretados como ácidos metabólicos, constituía evidencia indirecta fuerte para la relación de causa-efecto entre la producción de lactato y piruvato y la acidosis. Estudios más recientes también aceptaron una interpretación causa-efecto entre la disminución en el pH sanguíneo o muscular con incrementos en la producción de “ácido láctico” (1, 2, 13, 19, 49, 53, 59).
EL CONSTRUCTO DEL ACIDO LACTICO Y LA ACIDOSIS LACTICA
La breve evaluación histórica anterior acerca de la investigación de la acidosis, ácido láctico y lactato revela que ninguna evidencia experimental ha mostrado jamás revelar una relación causa-efecto entre la producción de lactato y la acidosis. Las investigaciones pasadas acerca de este tópico que son usadas para apoyar el concepto de la acidosis láctica están basadas enteramente en correlaciones, las cuales cuanto más permanecen siendo evidencia indirecta. A pesar de los esfuerzos de los académicos para enseñar a los estudiantes que los resultados de la correlación no implican causa y efecto, parece que en el tópico de la acidosis láctica, los científicos y académicos destacados a nivel mundial han y continúan cometiendo este error. Por lo tanto, hay una necesidad de definir que es hecho y que es constructo. Un hecho es definido como “algo que tiene existencia real; que tiene realidad objetiva” (58). De manera contraria, cuando se aplica al tópico de métodos y diseños de investigación, un constructo es definido como una interpretación no probada y no real que ha sido erróneamente aceptada como un hecho. La creencia acerca de que la producción de lactato libera un protón y causa la acidosis (acidosis láctica) es un constructo, y como tal, necesita ser corregida.
CRITICAS PASADAS DEL CONSTRUCTO DE LA ACIDOSIS LACTICA
A pesar de la aceptación común del constructo de la acidosis láctica, su continua promoción y amplia aceptación no ha estado libre de críticas. Examinar la literatura desde el final de 1960 hasta 1990 revela que diferentes fisiólogos que estaban intentando explicar el daño isquémico del tejido miocárdico por la acidosis metabólica, cuestionaron la creencia común acerca de que la producción de ácido láctico era la fuente de producción de H+.(4, 7, 10, 11, 16, 60, 63). De hecho, un número de investigadores durante esta era coincidían con que la hidrólisis del ATP acoplada con la glucólisis, constituían la fuente principal de producción de H+., resultando en la disminución del pH muscular y sanguíneo. Taffaletti (55) también estableció claramente que la producción de lactato consumía protones y más importante, separó el incremento de la producción de lactato de la liberación de protones y la acidosis durante la acidosis láctica. Estos científicos creían que “solo entendiendo estos importantes hechos bioquímicos pueden los clínicos encontrar el diagnóstico y tratamiento en una base firme y racional” (63). Como fue previamente identificado, parece que esta crítica no ha sido aceptada o reestudiada en detalle durante los últimos 25 años, siendo todavía aceptada la relación causa-efecto entre la acidosis y la producción de “ácido láctico” y publicada en ciencia básica, fisiología aplicada e investigación médica. Claramente se necesita una presentación de la bioquímica de la acidosis para desbaratar la aceptación y propagación contínua del constructo de la acidosis láctica.
BIOQUIMICA DE LA ACIDOSIS METABOLICA INDUCIDA POR EL EJERCICIO
Revisión
Una evaluación de las reacciones bioquímicas que sostienen el catabolismo energético muscular revela que el equilibrio de protones en una célula muscular puede ser influenciado por los sistemas energéticos fosfágeno, glucolítico y respiración mitocondrial que funcionan para producir ATP celular. A continuación sigue una revisión de cada uno de los sistemas energéticos con el propósito de identificar las reacciones que implican la liberación y consumo de protones.
Sistema Fosfágeno
La reserva celular de fosfocreatina proporciona un sistema metabólico casi inmediato para producir ATP durante el inicio y segundos iniciales de la contracción muscular. También se cree que la fosfocreatina es importante para la transferencia general de grupos fosfato desde la mitocondria a través de todo el citosol, y por esto podría también ser importante para todos los estados metabólicos de las células musculares. La estructura química de los sustratos y productos de la reacción de la creatinquinasa es proporcionada en la Figura 4.
La reacción de la creatinquinasa es alcalinizante para la célula, ya que un protón es consumido en esta reacción. El protón es requerido para reemplazar el grupo fosfato de la fosfocreatina, completando al segundo grupo funcional amino (NH2) de la creatina.
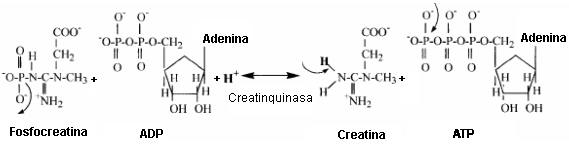
Figura 4. Estructura química de los sustratos y productos de la reacción
de la creatinquinasa. Es requerido un protón para completar la estructura de la
creatina luego de que el fosfato es removido de la fosfocreatina hasta el ADP,
formando ATP.
La Figura 4 también revela que el incremento de la concentración de Pi durante el ejercicio intenso no es el resultado de la reacción de la creatinquinasa, como es frecuentemente erróneamente entendido. La acumulación de Pi intramuscular resulta de las condiciones celulares caracterizadas por la velocidad de demanda de ATP, la cual excede el aporte del mismo por parte de la respiración mitocondrial. Durante esta condición hay un incremento en la dependencia del recambio o turnover citosólico de ATP (no mitocondrial). Tal hidrólisis adicional de ATP produce Pi a una tasa que ahora excede la velocidad de entrada de Pi a la mitocondria, causando la acumulación de Pi. Va a ser dado un contenido más detallado de las condiciones celulares asociadas con el incremento del recambio de ATP no mitocondrial, ya que esta condición causa la acidosis.
Glucólisis
La glucólisis es abastecida por la producción de glucosa-6-fosfato (G6P), la cual es derivada desde la glucosa sanguínea o el glucógeno muscular. A pesar de que el glucógeno proporciona la mayor parte de los carbohidratos que abastecen a la glucólisis muscular durante el ejercicio intenso, las explicaciones bioquímicas tradicionales de la glucólisis describen a la vía comenzando por la glucosa y consistiendo de 10 reacciones que resultan en la formación de piruvato. El uso del glucógeno como el sustrato principal (glucogenólisis) difiere de la glucólisis evitando la primera reacción y compartiendo así las nueve reacciones restantes. La distinción simple entre el origen de la glucosa y el glucógeno de la glucólisis es importante, ya que como será mostrado, la liberación de protones desde la glucólisis difiere dependiendo de si es usada la glucosa o el glucógeno muscular para formar G6P para así abastecer a la glucólisis.
Las reacciones de la glucólisis están resumidas en la Tabla 2. Un escrutinio cuidadoso de la tabla revela lo siguiente: 1) A pesar de la convención académica, las múltiples fuentes de producción de G6P en el músculo esquelético (glucosa sanguínea y glucógeno endógeno) indican que la primera reacción de la glucólisis es la reacción de la G6P isomerasa, no la reacción de la hexoquinasa. Por lo tanto, la glucólisis consiste de nueve reacciones cuando se incluye la reacción de la triosafosfato isomerasa. 2) Para la producción de 2 piruvatos, hay una liberación neta de 2 protones cuando la glucosa es la fuente de G6P, y 1 protón cuando el glucógeno es la fuente. Usar glucógeno como fuente de G6P, en vez de glucosa sanguínea, es menos acidificante para el músculo durante el ejercicio intenso. 3) La liberación neta de protones ocurre en la glucólisis para las reacciones que finalizan en fosfoenolpiruvato. Así, la acumulación de intermediarios glucolíticos antes de la formación de piruvato durante el ejercicio intenso causa una mayor liberación de protones en comparación con la oxidación de G6P a piruvato. 4) El primer intermediario ácido carboxílico de la glucólisis es el 3-fosfoglicerato a partir de la reacción de la fosfoglicerato quinasa. Los intermediarios glucolíticos subsiguientes son todas moléculas con grupos funcionales ácidos carboxílicos, sin embargo estas moléculas son todas producidas como sales ácidas y no como ácidos.
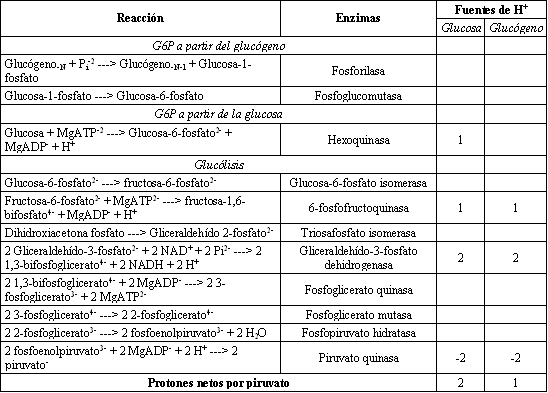
Tabla 2. Reacciones de la glucólisis balanceadas para cargas, protones y
agua. La fuente de protones se refiere al número de protones liberados (números
positivos) o consumidos (números negativos). Glucosa y glucógeno se refieren al
sustrato que abastece a la glucólisis. Adaptado de Stryer (54).
La Tabla 3 presenta los valores de pKa para los intermediarios ácidos de la glucólisis. El término “intermediario ácido” es engañoso. Aunque estas moléculas son estructuras ácidas carboxílicas, el contenido bioquímico subsiguiente va a mostrar que estas moléculas están formadas por sales ácidas, y como tales, ninguna molécula está nunca en una forma ácida, y no funciona como una fuente de protones.

Tabla 3. Valores de pKa de los “intermediarios ácidos” de la glucólisis y
el lactato. Datos de la Ref. 4a.
Presentar las estructuras químicas para los sustratos y productos de la reacción de la fosfoglicerato quinasa es importante para demostrar que la glucólisis no produce ácidos metabólicos que liberen protones (Figura 5).
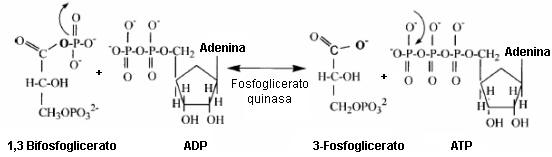
Figura 5. Sustratos y productos de la reacción de la fosfoglicerato
quinasa. El producto 3-fosfoglicerato es el primer “ácido carboxílico” formado
en la glucólisis. La transferencia de fosfato de esta reacción revela que un
protón nunca estuvo presente para ser liberado al citosol y alterar el
intercambio celular de protones y el pH. Así, el 3-fosfoglicerato y todos los
intermediarios “ácidos carboxílicos” glucolíticos restantes no funcionan como
ácidos, ya que nunca tienen un protón que pueda ser liberado a la solución. Las
flechas que salen de un enlace representan la ruptura de un enlace/grupo. Las
flechas que apuntan a un enlace representan la adición de un átomo/grupo.
La reacción de la fosfoglicerato quinasa implica la transferencia de un fosfato desde el carbono 1 del 1,3 bifosfoglicerato. La salida de este grupo fosfato deja una carga negativa en el grupo funcional ácido carboxílico (ionizado). Este grupo funcional permanece igual para el 2-fosfoglicerato, fosfoenolpiruvato, piruvato y lactato. Esta bioquímica fundamental constituye una evidencia clara para el error en el concepto de la acidosis láctica, así como, en la producción de ácidos metabólicos en la glucólisis. En realidad, nunca hay un protón que pueda disociarse en ningún intermediario ácido glucolítico (Tabla 3).
La Tabla 2 revela que la glucólisis libera protones. El protón liberado en la glucólisis está asociado con la hidrólisis del ATP en las reacciones de la hexoquinasa y la fosfofructoquinasa, así como en la oxidación del gliceraldehído 3-fosfato en la reacción de la gliceraldehído 3-fosfato dehidrogenasa. Las estructuras químicas para estas reacciones son presentadas en las Figuras 6, 7, y 8.
Las Tablas 1 y 2 y las Figuras 6-8 revelan que la liberación de protones en la glucólisis ocurre sin ninguna producción de ácidos metabólicos. Los resúmenes metabólicos de la glucólisis que comienzan con la glucosa o glucógeno son los siguientes:
Glucosa + 2 ADP + 2 Pi + 2 NAD+ ---> 2 piruvato + 2 ATP + 2 NADH + 2 H2O + 2 H+ (1)
GlucógenoN + 3 ADP + 3 Pi + 2 NAD+ --->
GlucógenoN-1 + 2 piruvato + 2 ATP + 2 NADH + 2 H2O + H+. (2)
Reacción de la Lactato Dehidrogenasa
Desde una perspectiva bioquímica la producción celular de lactato es beneficiosa para varias reacciones. Primero, la reacción de la lactato dehidrogenasa (LDH) produce NAD+ citosólico, apoyando así la demanda del sustrato NAD+ de la reacción de la gliceraldehído 3-fosfato dehidrogenasa. Esto mantiene mejor el potencial redox citosólico (NAD+/NADH), apoya el flujo continuo de sustratos a través de la fase dos de la glucólisis y de este modo permite continuar la regeneración de ATP a partir de la glucólisis. Otra función importante de la reacción de la LDH es que por cada molécula de piruvato catalizada a lactato y NAD+, hay un protón consumido, lo que hace que esta reacción funcione como un amortiguador o buffer en contra de la acumulación celular de protones (acidosis). Las estructuras químicas para la reacción de la LDH son presentadas en la Figura 9.
En la reacción de la LDH, dos electrones y un protón son removidos desde el NADH, y un protón adicional es ganado a partir de la solución para apoyar la reducción de 2 electrones y 2 protones de piruvato a lactato. Consecuentemente, la reacción de la LDH es alcalinizante en la célula, no acidificante, lo cual es la base del constructo de la acidosis láctica.
Hay beneficios adicionales de la reacción de la LDH. El lactato producido es removido de la célula por el transportador monocarboxilato (12, 20, 21, 30, 37, 62). El lactato es sacado fuera de la célula original, donde puede ser captado y usado como sustrato para el metabolismo de otros tejidos, tales como otras células musculares (esqueléticas y cardíacas), el hígado, y los riñones. Teniendo en cuenta que el transportador monocarboxilato es también un simporte para la remoción de protones desde la célula, la producción de lactato también proporciona los medios para ayudar en el flujo de protones desde la célula. Así, el lactato y un protón dejan la célula estequiométricamente por medio de este mecanismo transportador. Sin embargo, esto no significa que la producción de lactato es una fuente de protones. Como ha sido presentado anteriormente, no hay evidencia bioquímica que sostenga que la producción de lactato libere un protón, y la evidencia de las investigaciones es clara para cuantificar una remoción de protones mucho mayor que de lactato desde el músculo esquelético en contracción (19). De manera contraria, la química orgánica de la reacción de la LDH claramente revela que la producción de lactato consume protones. La interpretación fisiológica correcta de estos hechos bioquímicos es que la producción de lactato retarda un desarrollo metabólico de la acidosis, así como ayuda en la remoción de un protón de la célula.
El Acoplamiento de la Glucólisis y la Producción de Lactato
Los productos finales de la glucólisis y de la reacción de la lactato dehidrogenasa son presentados en la ecuación (3). Cuando el piruvato que proviene de la glucólisis es convertido en lactato, no hay producción neta de protones cuando se comienza desde glucosa, y hay una disminución de un protón y una ganancia de un ATP adicional cuando se empieza con glucógeno:
glucosa + 2 ADP + 2 Pi ---> 2 lactato + 2 ATP + 2 H2O (3)
glucógenoN + 3 ADP + 3 Pi + H+ ---> glucógenoN-1 + 2 lactato + 3 ATP + 2 H2O (4)
Este acoplamiento es importante para muchas células del cuerpo, siendo las células rojas de la sangre un buen ejemplo. Las células rojas sanguíneas están desprovistas de mitocondrias y dependen de la glucólisis para la generación de ATP usando glucosa como el sustrato glucolítico principal. Los dos protones producidos en la glucólisis son equilibrados por el consumo de dos protones para convertir dos piruvatos a lactato, y el potencial redox citosólico de las células rojas sanguíneas también es mantenido por el NAD+ producido a partir de la reacción de la LDH. Para las células rojas sanguíneas, la producción de lactato es esencial para prevenir una acidosis y mantener el NAD+ celular.
En el músculo esquelético, la presencia de mitocondrias y la implicancia de glucógeno como fuente de glucosa-6-fosfato para abastecer la glucólisis altera la estequiometría entre el flujo glucolítico, liberación de protones, y consumo de lactato y protones. Además, la alta tasa metabólica que ocurre durante la contracción muscular, y por lo tanto la alta tasa de hidrólisis y regeneración de ATP implica un estrés metabólico único no visto en tejidos no musculares.
Hidrólisis del ATP como Fuente Principal de H+
La remoción del fosfato terminal del ATP para formar ADP y la liberación concomitante de energía libre y Pi, requieren la participación del agua como un sustrato adicional. Las estructuras químicas para esta reacción son presentadas en la Figura 10.
El Pi producido en la reacción de la ATPasa tiene el potencial para amortiguar el protón libre que es liberado. Los tres átomos de oxígeno con enlace simple del Pi tienen los siguientes valores de pK*: 2.25, 6.82, y 12.38 (28, 54). Así un átomo de oxígeno es capaz de protonarse dentro del rango de pH fisiológico intracelular (rango de pH celular ~ 6.1 a 7.1) convirtiendo el Pi desde HPO42- a H42PO4-. Consecuentemente, a medida que el Pi se incrementa durante el ejercicio intenso, la capacidad amortiguadora de protones del Pi es cuantificada por el grado de acumulación de Pi cuando el pH celular cae debajo de 6.8.
A primera vista, el potencial de amortiguamiento del Pi disminuye la importancia de la hidrólisis del ATP como una fuente significativa de liberación de protones que contribuye a la acidosis. Sin embargo, esta no es la verdad. El incremento en el Pi intracelular no es proporcional, y en de hecho es considerablemente menor, que la acumulación total de hidrólisis de ATP. Durante la hidrólisis del ATP, el ADP y el Pi producidos funcionan como sustratos para la glucólisis para producir ATP (Tabla 2, Figura 11), dejando que el protón libre se acumule cuando los sistemas de amortiguamiento y transporte para el flujo de protones desde la célula han sido sobrepasados. El Pi libre también es un sustrato para la glucogenólisis y es transportado a la mitocondria como un sustrato en la fosforilación oxidativa. Así, la acumulación de Pi no es estequiométrica con el recambio del ATP y ocurre cuando hay una mayor tasa de recambio o turnover de ATP citosólico que de aporte de ATP celular.
*Nota del traductor: Aquí el autor se refiere al pKa del ácido poliprótico fosfórico.
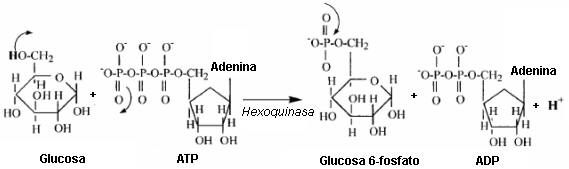
Figura 6. Sustratos y productos de la reacción de la hexoquinasa. El
protón liberado a partir de esta reacción viene del grupo hidroxilo del sexto
carbono de la glucosa. Las flechas que salen de un enlace representan la ruptura
de un enlace/grupo. Las flechas que apuntan a un enlace representan la adición
de un átomo/grupo.
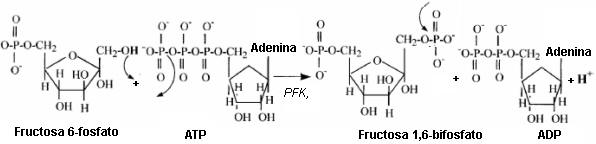
Figura 7. Sustratos y productos de la reacción de la fosfogructoquinasa (PFK).
El protón liberado a partir de esta reacción viene del grupo hidroxilo del sexto
carbono de la fructosa-6-fosfato. Las flechas que salen de un enlace representan
la ruptura de un enlace/grupo. Las flechas que apuntan a un enlace representan
la adición de un átomo/grupo.
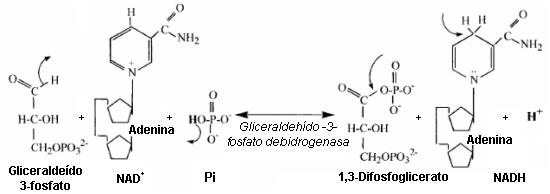
Figura 8. Sustratos y productos de la reacción de la gliceraldehído-3-fosfato
dehidrogenasa. Dos electrones y un protón son usados para reducir al NAD+
a NADH. El protón restante, el cual en esta gráfica es explicado por el protón
liberado del fosfato inorgánico, es liberado a la solución. Las flechas que
salen de un enlace representan la ruptura de un enlace/grupo. Las flechas que
apuntan a un enlace representan la adición de un átomo/grupo.
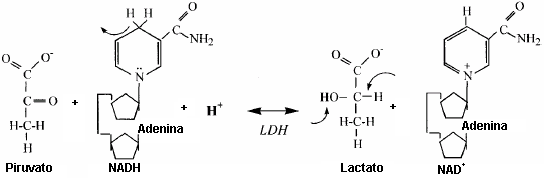
Figura 9. Sustratos y productos de la reacción de la lactato
dehidrogenasa (LDH). Dos electrones y protones se pierden del NADH y un protón
es consumido desde la solución para reducir el piruvato a lactato. Las flechas
que salen de un enlace representan la ruptura de un enlace/grupo. Las flechas
que apuntan a un enlace representan la adición de un átomo/grupo.
Un modelo diagramático de la conexión acoplada entre la glucólisis y entre síntesis y ruptura citosólica de ATP, ADP y Pi es presentada en la Figura 11. Cuando la producción de lactato se suma a la glucólisis y asumiendo que el recambio de ATP a partir del metabolismo no es apoyado por la respiración mitocondrial, la tasa de liberación de protones es igual a la tasa de recambio de ATP. Bajo estas circunstancias, habría una rápida liberación de protones, un rápido exceso de la capacidad de remoción y amortiguamiento celular de protones y un rápido inicio de la acidosis metabólica celular. Cuando se combina la hidrólisis del ATP y la conversión de glucosa a lactato (Ec. 3 y Figura 10), el contenido de la Figura 11 y la Tabla 2 puede ser resumido en la Ec. (5). La ecuación (6) presenta la ecuación resumida de la conversión de glucógeno a lactato:
glucosa ---> 2 lactato + 2 H+ (5)
glucógeno ---> 2 lactato + H+ (6)
Obviamente, en las ecuaciones 5 y 6 parece como si el ácido láctico hubiera sido producido. Sin embargo, tal como es detallado en este manuscrito, asumir que una ecuación así de resumida constituye evidencia de la acidosis láctica es una interpretación basada en una explicación sobresimplificada de la bioquímica de la acidosis metabólica. El contenido de la Figura 10 muestra claramente que la fuente de los dos protones de la ecuación 5 es la hidrólisis del ATP, no la producción de lactato.
NADH + H+ como una Fuente de H+
La acumulación adicional de H+ podría resultar de la acumulación de NADH + H+ producida por la reacción de la gliceraldehído-3-fosfato dehidrogenasa. Estos productos se incrementarían durante cualquier condición celular que cause una mayor tasa de flujo de sustratos a través de la glucólisis que la tasa de captación de electrones y protones por parte de la mitocondria, o producción de lactato (Figura 9).
Importancia de la Respiración Mitocondrial
Aunque la acidosis metabólica es causada por catabolismo citosólico (no mitocondrial), el entendimiento de porque y cuando ocurre la acidosis metabólica en el músculo en contracción es en parte explicado conociendo como y porque la función mitocondrial puede ser limitante de la velocidad de la regeneración de ATP. Ver a la acidosis metabólica como un evento no mitocondrial es un error, que será explicado, la función limitante de la velocidad de la mitocondria es una razón importante para la necesidad de depender más en el recambio no mitocondrial de ATP, lo cual causa la acidosis metabólica.
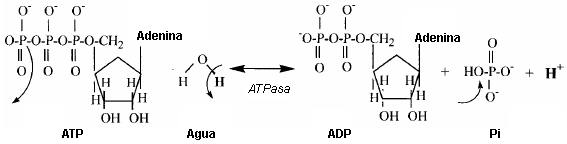
Figura 10. Sustratos y productos de la reacción de la ATPasa. Esta
reacción es calificada como una reacción de hidrólisis (ATP hidrólisis) debido a
la implicancia de una molécula de agua. Se requieren un átomo de oxígeno, 2
electrones y un protón de la molécula de agua para completar el producto de
fosfato inorgánico de la reacción. El protón restante de la molécula de agua es
liberado a la solución. Las flechas que salen de un enlace representan la
ruptura de un enlace/grupo. Las flechas que apuntan a un enlace representan la
adición de un átomo/grupo.
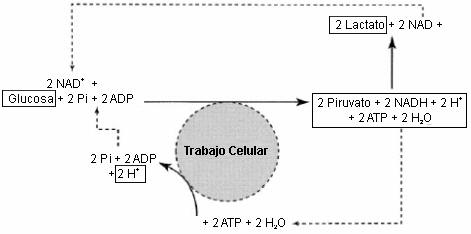
Figura 11. Regeneración glucolítica del ATP acoplada a la hidrólisis del
ATP, tal como sería el caso durante la contracción del músculo esquelético sin
ninguna contribución del ATP a partir de las respiración mitocondrial. La fuente
de protones que pueden acumularse en el citosol es la hidrólisis del ATP. El
equilibrio de estas reacciones deja las moléculas señaladas con rectángulos
(glucosa ---> 2 lactato + 2H+, ec. 5).
En la Figura 12 es presentado un resumen conciso de los eventos metabólicos clave en la mitocondria. El metabolismo mitocondrial funciona para liberar electrones y protones a partir de los sustratos, producir dióxido de carbono, y usar los electrones y protones eventualmente para producir ATP. Las moléculas principales implicadas en estas funciones son el acetil-CoA, NAD+, FAD+, oxígeno molecular, ADP, Pi, electrones y protones. Es importante señalar que cada ADP, Pi y protón es transportado dentro de la mitocondria (6, 23) (Figuras 12 y 13). Los protones son requeridos para la reducción del oxígeno molecular, y el ADP y el Pi son requeridos para la regeneración del ATP. Tal mecanismo de transporte conecta el metabolismo citosólico y mitocondrial. Esto es especialmente cierto para la transferencia moléculas de Pi y protones entre el citosol y la mitocondria. Los sistemas de transporte de protones entre el citosol y la mitocondria revelan el poder de la respiración mitocondrial para contribuir al control del equilibrio de protones dentro de la célula durante condiciones de contracción muscular que dependen de la respiración mitocondrial para el recambio de ATP.
La Figura 14, A y B, presenta dos escenarios del metabolismo pertinentes al estudio de la acidosis. La Figura 14 A describe el movimiento de sustratos formados por cadenas carbonadas, electrones, protones y moléculas de fosfato dentro y entre el citosol y la mitocondria durante ejercicio de intensidad moderada en estado estable, donde la tasa de la glucólisis y la subsiguiente entrada de piruvato en la mitocondria para la oxidación completa y la regeneración mitocondrial de ATP alcanzan la tasa de demanda citosólica de ATP. De manera contraria, la Figura 14 B relaciona el ejercicio en estado no estable como es tipificado por el ejercicio intenso, alcanzándose la fatiga volitiva en un marco de tiempo de 2-3 min. En cada ejemplo de la figura, la magnitud de las flechas es proporcional al flujo de sustratos a través de esa reacción o vía.
En base de la bioquímica presentada anteriormente, la Figura 14 indica el cambio en el flujo de protones a medida que el ejercicio progresa desde el estado estable al estado no estable. La hidrólisis del ATP requerida para abastecer el trabajo celular, es central para el equilibrio celular de protones. Esta es claramente la fuente principal de liberación de protones en el músculo esquelético en contracción, y cuando el NADH y los protones de las reacciones citosólicas son producidos a velocidades que exceden la capacidad mitocondrial, la reducción citosólica es ayudada por la producción de lactato, la cual esencialmente explica la liberación de protones a partir de la glucólisis. Sin embargo, teniendo en cuenta que la hidrólisis del ATP excede a todas las otras reacciones, la tasa de liberación de protones eventualmente excede el amortiguamiento metabólico de protones de la producción de lactato y la ruptura de la fosfocreatina, así como el amortiguamiento de los protones por parte del Pi, aminoácidos y proteínas. Además, una vez que la máxima capacidad de remoción de lactato/protón de la célula, es excedida, esto resulta en la acumulación de protones (disminuyendo el pH celular). También, notar que la Figura 14 B muestra claramente que la acumulación de Pi intramuscular es la hidrólisis del ATP, no la ruptura de la fosfocreatina, lo cual es todavía interpretado erróneamente por muchos fisiólogos (59).
El otro mensaje adicional subyacente de la Figura 14 es que la capacidad celular mitocondrial es fundamental para entender la acidosis metabólica. La capacidad mitocondrial para tomar protones y electrones citosólicos retarda la dependencia sobre la glucólisis y el sistema fosfágeno para la regeneración de ATP, esencialmente funcionando como un depósito de protones para su uso en la fosforilación oxidativa. La acidosis metabólica ocurre cuando la tasa de hidrólisis de ATP, y de este modo la tasa de demanda de ATP, excede la tasa a la cual el ATP es producido en la mitocondria. La máxima tasa de regeneración de ATP a partir de los sistemas energéticos principales del músculo esquelético es proporcionada en la Tabla 4.
Un estudio clásico que muestra la importancia de la captación mitocondrial de protones fue conducido por Vaghy (57). Vaghy examinó la fosforilación oxidativa en mitocondrias de corazón de conejo aisladas y los cambios en el pH en la misma muestra. Fue sugerido que cuando la fosforilación oxidativa fue bloqueada, ya sea, por inhibidores o por la ausencia de oxígeno, la concentración de protones se incrementaría considerablemente. Los resultados de la investigación de Vaghy revelaron que durante condiciones isquémicas había una disminución en el consumo neto de protones por parte de la fosforilación oxidativa y que esta alteración al metabolismo juega un rol importante en el desarrollo de la acidosis del miocardio. Además, Vaghy confirmó experimentalmente la idea de que cuando la glucólisis y la hidrólisis del ATP no están acopladas a la respiración mitocondrial, se desarrolla la acidosis. Sin embargo, la interrogante acerca de donde provienen los protones no fue clarificado en esta investigación.
EVIDENCIA ADICIONAL DE INVESTIGACIONES PARA LAS REACCIONES DE LIBERACION Y CONSUMO DE PROTONES DEL CATABOLISMO
Aunque la bioquímica de la acidosis metabólica inducida por el ejercicio es incuestionable, hay considerable apoyo de investigaciones y de este modo validación de el recambio no mitocondrial de ATP como la causa de la acidosis. Por ejemplo, varios investigadores han señalado que la afirmación acerca de que el “ácido láctico” es la fuente de H+, es inexacta. Gevers (10, 11) puso primero su atención a la muy importante posibilidad de que los protones podrían ser generados en cantidad significativa en el músculo por procesos metabólicos distintos a la reacción de la lactato dehidrogenasa. El sugirió que la fuente principal de protones era el recambio de ATP producido por la glucólisis. Este importante concepto, totalmente contrario al concepto general de ese tiempo acerca de que el “ácido láctico” es el producto final de la glucólisis, generó poco interés por seis años.
No fue hasta 1983 que Hochachka y Mommsen (16) redescubrieron este concepto y escribieron una extensa revisión acerca de este tópico. Hochachka et al. apoyaron la idea de Gevers acerca de que la acidosis metabólica que resulta de la glucólisis es principalmente debido a la hidrólisis del ATP que realiza la miosín ATPasa que produce ADP, Pi y H+. De acuerdo a estos autores, solo el ADP y el Pi son reciclados por la glucólisis para producir ATP, dejando H+ atrás para su acumulación en el citosol.
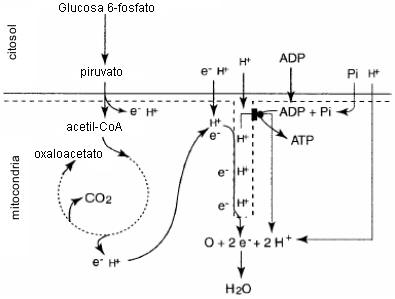
Figura 12. Resumen de las reacciones principales de la respiración
mitocondrial que apoyan la regeneración de ATP. Notar que cada ADP, Pi,
electrón (e-) y protón (H+) citosólico puede entrar en la
mitocondria (ya sea directamente o indirectamente) y funciona como un sustrato
para la fosforilación oxidativa.
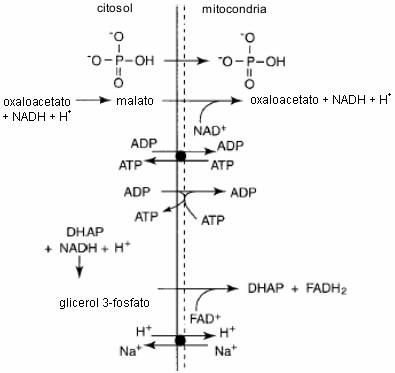
Figura 13. Ejemplos de los metabolitos citosólicos que pueden difundir o
ser transportados a al mitocondria. Notar que los protones (H+)
pueden entrar a la mitocondria indirectamente por medio de las lanzaderas malato-aspartato
y glicerol-fosfato o directamente por medio de diferentes mecanismos de
intercambio de cationes. Notar que no son presentadas las reacciones completas
para simplificar el diagrama.
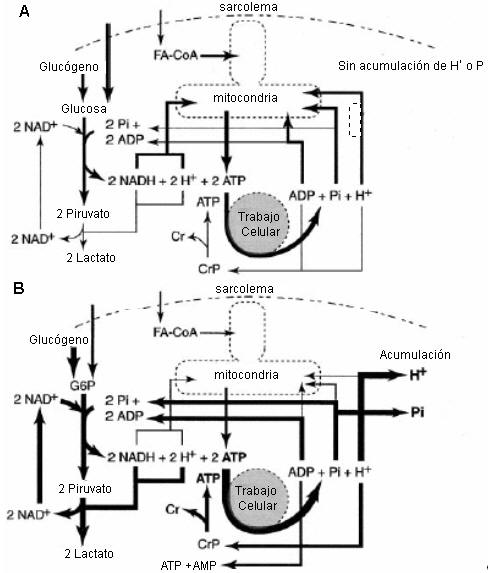
Figura 14. Dos diagramas que representan el metabolismo energético en el
músculo esquelético durante dos intensidades de ejercicio diferentes. A: Estado
estable al 60% del VO2
máx. Notar que los micronutrientes son una mezcla de glucosa sanguínea,
glucógeno muscular, ácidos grasos libres sanguíneos, y lípidos intramusculares.
Los ácidos grasos libres sanguíneos y la lipólisis intramuscular producen
eventualmente las moléculas de ácidos grasos activadas (FA-CoA). El piruvato,
NADH y los protones producidos a partir del flujo de sustratos a través de la
glucólisis son predominantemente consumidos por la mitocondria como sustratos
para la respiración mitocondrial. Lo mismo ocurre para los productos de la
hidrólisis del ATP (ADP, Pi, H+). Puede ser planteado que
tal escenario metabólico se produce en un pH neutral para las células
musculares. B: ejercicio intenso de corta duración a ~ 110% del VO2
máx., causando una fatiga volitiva en ~ 2-3 min. El tamaño de las flechas
aproxima la implicancia de la dependencia relativa de esa reacción y el destino
aproximado de los productos. Notar que el Pies también un sustrato de
la glucogenólisis. En este escenario celular la hidrólisis del ATP ocurre a una
tasa que no puede ser 100% apoyada por la respiración mitocondrial. Así, hay un
incremento de la dependencia para el uso de ADP celular para la regeneración de
ATP a partir de la glucólisis y la reacción de la creatinquinasa, bajo estas
condiciones celulares, un Pi y un protón son liberados al citosol.
Sin embargo, la magnitud de la liberación de protones es mayor que para el Pi
debido a la necesidad de reciclar el Pi como sustrato en la
glucólisis y la glucogenólisis. Tal como es explicado en el texto, la
acumulación final de protones constituye un equilibrio entre las reacciones que
consumen y liberan protones, el amortiguamiento celular, y el transporte de
protones fuera de la célula. Este diagrama también muestra claramente que la
causa bioquímica de la acumulación de protones no es la producción de lactato,
sino la hidrólisis del ATP.
En otras palabras, la generación glucolítica de ATP y la hidrólisis de ATP catalizada por la ATPasa están, hasta cierto grado, acopladas (Figura 11). Busa y Nuccitelli (4) también comentaron este tópico en una opinión que plantearon en una invitación en 1984. Estos autores esencialmente reafirmaron los escritos de Gevers (10, 11) y Hochachka y Mommsen (16). Tal como fue establecido por Busa y Nuccitelli (4), “la hidrólisis del ATP, no la acumulación de lactato, constituye la fuente dominante de carga ácida intracelular que acompaña a la anaerobiosis”.
Para demostrar experimentalmente que la producción de lactato no contribuye a la acidosis o que la disminución de la producción de lactato exacerba la acidosis, la glucólisis, la producción de lactato y la respiración mitocondrial necesitan ser desacopladas en forma controlada. En un estudio de resonancia magnética nuclear-31P (RMN), Smith et al. (48) investigaron el rol de la producción de “ácido láctico” en un corazón de hurón aislado usando tres aplicaciones diferentes de cianiada (la cianida bloquea la respiración mitocondrial), cianida más iodoacetato (inhibe la glucólisis) y cianida más una solución libre de glucosa (restringe el sustrato de la glucólisis). Los resultados experimentales indicaron que cuando solo fue aplicada cianida al músculo cardíaco, hubo una acumulación neta de lactato y H+. Cuando la glucólisis fue bloqueada (cianida más solución libre de glucosa), hubo menos producción de lactato, una mayor tasa de hidrólisis de ATP no mitocondrial, e incremento de la acidosis. Como se esperaba, también fue observado un incremento de la acidosis con menos producción de lactato cuando la cianida más el iodoacetato fue aplicado al miocardio. De este modo, los autores concluyeron que el incremento de la acidosis producido por la cianida cuando la glucólisis es completamente inhibida (en la presencia de iodoacetato) ocurrió debido a la más rápida hidrólisis de ATP intracelular. Además, estos resultados muestran el rol de la producción de lactato para atenuar una acidosis en desarrollo.
Comentarios posteriores de MacRae y Dennos (31) indicaron que la generación metabólica de protones durante el ejercicio intenso es una consecuencia del aumento en el recambio glucolítico de ATP con el incremento de la tasa de trabajo. Cuando el ATP es resintetizado por la glucólisis, en vez de por la fosforilación oxidativa o la fosfocreatina, los protones producidos por la hidrólisis del ATP no son reutilizados en la respiración mitocondrial. De manera contraria, durante el ejercicio en estado estable los protones generados a partir de la glucólisis son transportados a la mitocondria y usados directamente en la formación de agua o usados en la cadena de transporte de electrones (EIC) para producir un gradiente de H+. a través de la membrana interna de la mitocondria que facilita la síntesis del ATP a través de la ATPasa F0F1. De este modo, estos protones son generados sin tener en cuenta la formación de lactato o el transporte de piruvato a la mitocondria para su oxidación.

Tabla 4. Tasas máximas estimadas de regeneración de ATP a partir de los
principales sistemas energéticos en el músculo esquelético. Adaptado de Sahlin
(46).
Por lo tanto, un incremento en la concentración citosólica de H+. debe también coincidir con una disminución en potencial redox citosólico, el cual desplaza colectivamente el equilibrio de la LDH hacia la producción de lactato (piruvato- + NADH + H+.---> lactato + NAD+). Así la formación de lactato y el flujo desde los músculos que trabajan es más una consecuencia que una causa de la acidosis.
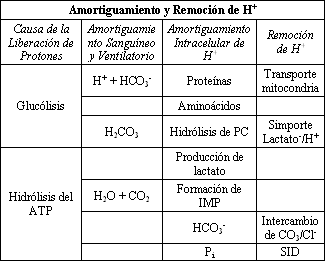
Tabla 5. Causas de la acidosis y del amortiguamiento de protones en el
músculo esquelético. HCO3-,
bicarbonato; H2CO3: ácido carbónico; PC, fosfocreatina;
SID, fuerte diferencia iónica.
Noakes (34) reconoció y apoyó las opiniones de Gevers (10, 11) estableciendo que los protones liberados a partir de la hidrólisis del ATP no son necesarios para las resíntesis de ATP por parte de la vía glucolítica. El también sugirió que primero algunos de los protones generados por las altas tasas de ruptura glucolítica del ATP, son tomados por la mitocondria con el piruvato. Algunos son usados en la reducción del pirutavo a lactato y algunos son amortiguados por los residuos de histidina y Pi intracelulares. Consecuentemente, los protones intracelulares no amortiguados dejan la célula a través de intercambiadores de Na+ /H+ y simportes de H+ + lactato- y pueden alterar el pH sanguíneo, lo cual coincide con un incremento en la concentración de lactato sanguíneo.
COMPONENTES DE LA PRODUCCION, AMORTIGUAMIENTO Y REMOCION CELULAR DE PROTONES
La causa de la acidosis metabólica no es meramente la liberación de protones, sino un desequilibrio entre la tasa de liberación de protones y la tasa de amortiguamiento y remoción de protones. Tal como ha sido previamente demostrado a partir de la bioquímica fundamental, la liberación de protones ocurre a partir de la glucólisis y la hidrólisis del ATP. Sin embargo, no hay una disminución inmediata en el pH celular debido a la capacidad y los múltiples componentes del amortiguamiento y remoción celular de protones (Tabla 5). El sistema de amortiguamiento intracelular, el cual incluye a aminoácidos, proteínas, Pi, HCO3-, hidrólisis de la fosfocreatina (PC) y producción de lactato, recoge o consume H+. para proteger la célula contra la acumulación intracelular de protones. Los protones son también removidos del citosol por el transporte mitocondrial, transporte a través del sarcolema (simportes de lactato-/H+.intercambiadores de Na+/H+) y un intercambiador dependiente de bicarbonato (HCO3-/Cl-) (Figura 13). Tales sistemas intercambiadores de membrana son cruciales para la influencia del enfoque de fuerte diferencia iónica para entender la regulación ácido-base durante la acidosis metabólica (5, 26). Sin embargo, cuando la tasa de producción de H+. excede la tasa o capacidad para amortiguar o remover protones del músculo esquelético, se origina la acidosis metabólica. Es importante señalar que la producción de lactato actúa tanto como un sistema amortiguador, consumiendo H+., y como removedor de protones, transportando H+. a través del sarcolema, para proteger la célula contra la acidosis metabólica.
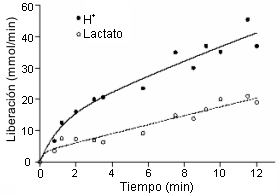
Figura 15. Datos de remoción de protones y lactato desde un músculo
esquelético en contracción. La figura es una presentación original de datos de
Juel et al. (19).
LA ESTEQUIOMETRIA DE LA PRODUCCION DE LACTATO Y LA ACUMULACION DE PROTONES EN EL MÚSCULO ESQUELETICO EN CONTRACCION
Aparte de hechos bioquímicos, la evidencia adicional más fuerte para la acidosis del recambio no mitocondrial de ATP en el músculo en contracción proviene de una compilación de investigaciones que permite hacer cálculos de los componentes de la liberación, amortiguamiento y remoción de protones, presentados en la Tabla 5.
Juel et al. (19) cuantificaron la liberación de lactato y protones desde el músculo esquelético en contracción durante un ejercicio de extensión de rodilla realizado con una pierna. Los datos de la Figura 15 fueron obtenidos a partir de datos de liberación de lactato y protones durante un ejercicio incremental hasta la fatiga y tomados de esta presentación original. Claramente, la liberación muscular de protones fue mayor que la liberación de lactato, incrementándose la diferencia con el incremento de la intensidad del ejercicio con una relación de casi el doble para la liberación de protones en relación al lactato en el agotamiento.
Cuando el interés está puesto sobre el recambio intracelular no mitocondrial de ATP y en el equilibrio entre protones y lactato, el mejor ejercicio y modelo de investigación para usar es el modelo de flujo sanguíneo ocluido del cuadriceps (50), ya que esto minimiza el efecto del flujo sanguíneo sobre la remoción de protones y lactato a partir del músculo activo. Sin embargo, los mayores cálculos de recambio no mitocondrial de ATP (370 mmol/kg de peso seco) provienen de Bangsbo et al. (1), quien cuantificó metabolitos musculares y flujo de lactato sanguíneo desde el cuadriceps durante un ejercicio de extensión dinámica de rodillas unilateral hasta el agotamiento. Bangsbo y colaboradores (1, 2) argumentaron que cuando se explica totalmente la producción muscular de lactato (acumulación, remoción y oxidación), es obtenida una estimación más válida del recambio de ATP no mitocondrial (ATP-NM). La ecuación generalmente aceptada (2) para este cálculo es presentada en la ecuación 7.
ATP-NM=(Δ PC + Δ ATP)*(1.5*Δ La) (7)
Cuando se combinaron datos de tejidos múltiples (1, 33, 50, 51), con datos de Spriet y colaboradores (50, 51) usados para acumulación de metabolitos musculares durante el ejercicio intenso hasta la fatiga y datos de Bangsbo et al. (1) para ATP-NM, los datos conjuntamente apoyan la bioquímica que prueba el origen de el recambio no mitocondrial de la acidosis metabólica del músculo esquelético inducida por el ejercicio. Por ejemplo, la Figura 16 representa el equilibrio bioquímico de los protones, si se asume que la producción de lactato causa la acidosis. Los datos publicados revelan que la capacidad amortiguadora del músculo (estructural y metabólica) es casi el doble que la producción de lactato. No hay ninguna estequiometría para la afirmación acerca de que la producción de lactato directamente libera protones y causa la acidosis láctica.
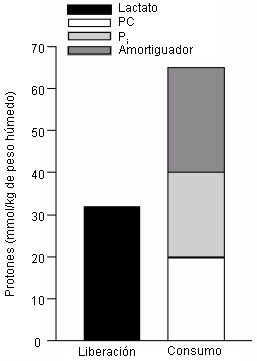
Figura 16. Comparación entre la liberación teórica de protones a partir
de la producción de lactato con la capacidad amortiguadora muscular del músculo
esquelético conocida (estructural y bioquímica). Por ejemplo, si la producción
de lactato liberara protones, entonces la magnitud de las 2 columnas de los
datos deberían ser iguales. Datos de lactato, PC y Pi, muscular de
Spriet et al. (49, 50). Datos para la capacidad amortiguadora muscular (por
titulación) de Sahlin (38) a 42 slykes* para una disminución del pH muscular
desde 7.0 a 6.4.
* Nota del traductor: la capacidad de amortiguamiento (β) puede ser medida en slykes, donde 1 slyke representa el número de μmol de base requeridos para titular el pH de 1 g de peso húmedo de tejido en una unidad de pH a través del rango de pH de 6.5 a 7.5.
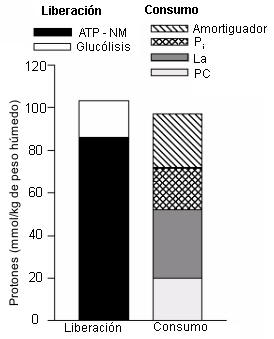
Figura 17. Equilibrio entre la liberación y el consumo intramuscular de
protones basado en la bioquímica fundamental, tal como es explicado en el texto.
Datos de recambio no mitocondrial de ATP (ATP-NM) de Bansbo et al. (1) a 370
mmol/kg de peso seco. Datos de la glucólisis de Spriet et al. (50) a 73.8 mmol
de unidades glucosídicas/kg de peso húmedo. Datos del lactato, PC, Pi
y capacidad amortiguadora muscular correspondientes a la Figura 16.
Cuando se evalúa las investigaciones pasadas que presenten evidencia que apoye el recambio de ATP no mitocondrial como causa de la acidosis metabólica, la estequiometría es mucho más impresionante. Estos datos son presentados en la Figura 17. Cuando los principales consumidores de protones son combinados, hay una igualdad aproximada entre liberación (ATP-NM y glucólisis) y consumo de protones. Aquí se presenta una ligera discrepancia, pero en realidad ocurre un consumo adicional de protones por medio de las reservas musculares de bicarbonato, un pequeño flujo de protones que ocurre sin tener en cuenta los modelos de ejercicio que tienen flujo sanguíneo cero, y la influencia de la fuerte diferencia iónica entre el sarcolema de las fibras musculares en contracción (5, 12, 26). Además, nosotros presentamos datos asumiendo ionización completa de metabolitos clave como ATP, ADP, y Pi. Esto no es enteramente exacto, sin embargo los ajustes basados en el equilibrio de protones a partir de la ionización fraccional proporcionan complicaciones innecesarias para el equilibrio de protones, no cambian la descripción relativa de los datos, y de este modo no alteran la causa de la acidosis.
Los datos de las Figuras 16 y 17 son muy importantes, ya que muestran que el recambio no mitocondrial de ATP no es solo una explicación teórica de la acidosis metabólica, tal como ha sido establecido por algunos autores debido a la ecuación 5. El hecho es que las investigaciones claramente apoyan la estequimetría del recambio no mitocondrial de ATP como la causa de la acidosis metabólica. De este modo, las investigaciones también desacreditan claramente la interpretación de que la acidosis es causada por la producción de lactato. Consecuentemente, nosotros mostramos que la bioquímica del metabolismo apoya el recambio no mitondrial del ATP como la causa de la acidosis. Además, nosotros presentamos datos de investigaciones experimentales que a través de mediciones directas y cálculos indirectos de estequiometría de equilibrio de protones y lactato en un músculo esquelético en contracción, prueban que la acidosis metabólica es causada por un incremento de la dependencia sobre el recambio no mitocondrial de ATP y no por la producción de lactato.
¿ES REALMENTE TAN IMPORTANTE LA DIFERENCIA ENTRE LA PRODUCCION DE LACTATO Y LA VERDADERA CAUSA BIOQUIMICA DE LA ACIDOSIS?
Esta es la pregunta crucial que todo fisiólogo debe ser capaz de contestar. Hay varios ejemplos acerca de porque la causa correcta de la acidosis metabólica necesita ser aceptada, comunicada en educación, y usada en la interpretación y publicación de investigaciones.
Validez Científica
La razón más importante para descartar el concepto de la acidosis láctica es que es inválido. No tiene ninguna justificación bioquímica y, para ninguna sorpresa, ningún apoyo de investigaciones. Hemos sido criticados por nuestra postura que plantea la necesidad de cambiar el modo en que se enseña e interpreta la acidosis metabólica en base a la ecuación 5 (glucosa ---> 2 lactato + 2 H+.). Sin embargo, esta es una ecuación resumida que no representa causa y efecto, tal como fue previamente descrito e ilustrado en la Figura 10. Por lo tanto, el concepto de acidosis láctica mantiene la evidencia de la inercia científica y académica de 1920 que, fuera de simple conveniencia y desinterés, todavía continúa vigente en la actualidad. Nosotros esperamos que los académicos y profesionales que continúan aceptando el constructo de la acidosis láctica cambien inmediatamente la forma de enseñar e interpreten este tópico.
Educación
La educación es una fuerza poderosa que puede inducir a cambiar o a reforzar un error. En vez de continuar reforzando el error, los educadores necesitan reconocer su poder para reformar como los estudiantes y académicos explican y discuten de la misma manera todos los asuntos que pertenecen a la acidosis metabólica y a la amortiguación de protones del músculo esquelético La correcta enseñanza de la acidosis metabólica es crucial para la promoción y aceptación del correcto entendimiento de la acidosis metabólica inducida por el ejercicio.
Entrenamiento en la Fisiología del Deporte
Es asumido que la producción de lactato causa la acidosis, luego es una extensión lógica hipotetizar que reduciendo la producción de lactato para una dada demanda celular de ATP se debería retardar la acidosis. Si la disminución de la tasa de producción de lactato es realizada estimulando el incremento de la respiración mitocondrial [tal como a través de la infusión/ingestión de cloroacetato (18)], tal estrategia deberían incrementar también la captación de protones y disminuir/retardar la acidosis. Sin embargo, tal como es claro a partir de la bioquímica, para una dada tasa de respiración mitocondrial, la disminución de la producción de lactato va a disminuir el amortiguamiento y remoción de protones desde el músculo esquelético e incrementar la velocidad de inicio y empeorar la severidad de la acidosis. En base a la bioquímica del metabolismo muscular, la mejor forma para disminuir la acidosis metabólica es disminuyendo el recambio no mitocondrial de ATP, estimulando la respiración mitocondrial. Para una dada demanda de ATP, cualquier esfuerzo por disminuir la producción de lactato sin incrementar la respiración mitocondrial va a empeorar la acidosis metabólica.
Cuantificando el Amortiguamiento: la Unidad del Slyke
La capacidad o valor amortiguador de una solución fue cuantificada y definida por primera vez por van Slyke en 1922 (24, 38). Esta definición inicial estuvo basada en la cantidad de H+. o OH- libres adicionados para causar una unidad de cambio en el pH (ΔH+./ΔpH). Típicamente, la masa de referencia del músculo es 1 kg. En 1955 fue recomendado que el nombre de Slyke fuera usado como la unidad de expresión para la capacidad amortiguadora (β) de un tejido cuando se la cuantifica a través del índice ΔH+./ΔpH, y la unidad del slyke ha sido usada para cuantificar el amortiguamiento de protones desde entonces.
Tradicionalmente, la capacidad amortiguadora del músculo esquelético es medida in vitro y es influenciada por los constituyentes estructurales del músculo esquelético. Consecuentemente, la capacidad amortiguadora no incluye la remoción de protones por el metabolismo o la transferencia de protones desde el citosol a la mitocondria o fuera de la célula. Sahlin (38) cita a estos dos componentes del amortiguamiento celular de protones como estructurales y metabólicos, representando la combinación la capacidad total de amortiguamiento de protones in vivo.
Desafortunadamente, cuando se intenta cuantificar la capacidad amortiguadora del músculo esquelético in vivo la determinación de los protones adicionados a la célula es difícil. Para hacer este proceso más fácil, frecuentemente los investigadores han asumido que la fuente de protones es la producción de ácidos metabólicos: a saber, ácido láctico y pirúvico. Obviamente, esto ha sido incorrecto. El resultado ha sido la estimación incorrecta del amortiguamiento de protones, variando esos valores desde 60 a 80 slykes (24, 38, 49, 50). Cuando se basa solamente en la producción de lactato corregida para el agua muscular [Spriet et al. (50) usaron 3.3 l/kg de peso húmedo], es obtenido un valor de 74.5 slykes, lo cual claramente muestra el sesgo de esta unidad cuando se asume que la producción de lactato es el factor que más contribuye a la liberación de protones durante el catabolismo muscular. Como está claro a partir de esta revisión, tal enfoque para cuantificar el amortiguamiento de protones del músculo esquelético es inválido y su uso no debería nunca haber sido asociado con la unidad slyke.
En base al contenido de esta revisión, la mejor estimación de la capacidad amortiguadora de un músculo, la cual por supuesto va a variar con el grado y calidad del entrenamiento de un dado individuo, es de 208 slykes. Este valor es obtenido a partir de los datos de la Figura 17, donde 2-3 min de ejercicio intenso hasta la fatiga volitiva están asociados con una disminución del pH desde 7.0 a 6.4, y a la liberación/producción de 125 mmol de H+./kg de músculo (125/0.6=208). La capacidad amortiguadora total del músculo es la suma de los componentes del amortiguamiento estructura y metabólico. Los datos de la Figura 17 proporcionan una estimación del amortiguamiento metabólico que es de 120 (72/0.6) slykes, con 88 slykes representados por el amortiguamiento estructural. Interesantemente, nuestra estimación de amortiguamiento estructural es similar a la reportada por Sahlin (38). Las estimaciones de investigaciones anteriores de la capacidad amortiguadora muscular asumiendo la estimación de que la producción de lactato y piruvato liberan protones constituye una subestimación grosera de la verdadera capacidad amortiguadora muscular, ya que la misma no explica toda la liberación de protones (hidrólisis no mitocondrial), y al asumir que la producción de lactato es una fuente de protones en vez de un consumidor de los mismos, subestima el amortiguamiento metabólico de protones.
CONCLUSIONES Y RECOMENDACIONES
No hay ningún apoyo bioquímico para el constructo de la acidosis láctica. La acidosis metabólica es causada por un incremento en la dependencia del recambio no mitocondrial de ATP. La producción de lactato es esencial para el músculo para producir NAD+ citosólico para apoyar la regerenación continua de ATP por la glucólisis. La producción de lactato también consume dos protones y, por definición, retarda la acidosis. El lactato también facilita la remoción de protones desde el músculo. Aunque la acumulación de lactato sanguíneo o muscular es un buen indicador del incremento de la liberación de protones y el potencial de disminución del pH celular y sanguíneo, tales relaciones no deberían ser interpretadas como causa y efecto.
Las interpretaciones anteriormente mencionadas de la bioquímica de la producción de lactato y la acidosis también están apoyadas por la evidencia de la investigación. Por lo tanto, la evidencia de las investigaciones también está en contra el concepto de la acidosis láctica. Cuantificar el recambio no mitocondrial de ATP durante el ejercicio intenso en bicicleta ergométrica y asumir que este valor es idéntico a la liberación de protones, revela una estequiometría casi perfecta para conocer los componentes del consumo de protones dentro del músculo esquelético en contracción. De manera contraria, los datos de investigaciones de la producción de lactato muscular y liberación de protones producen una esquequiometría lactato/protón de 1:3 (33: 103 mmol de H+./kg de peso húmedo; Figuras 16 y 17).
Educar a los estudiantes acerca de la causa bioquímica correcta de la acidosis es extremadamente importante por razones de credibilidad académica y validez científica. Además, las interpretaciones incorrectas pasadas de la acidosis metabólica han producido aplicaciones de investigación e interpretaciones de datos, cuestionables, siendo el mejor ejemplo de este error, el cálculo indirecto de la unidad de slyke de amortiguamiento muscular de protones [((Δlactato + Δpiruvato)/ΔpH) ~ (ΔH+./ΔpH)].
Se recomienda enérgicamente que todos los educadores e investigadores incorporen la aplicación de la causa correcta de la acidosis a su práctica profesional
Agradecimientos
Queremos destacar nuestro reconocimiento a los científicos y académicos que precedieron nuestros esfuerzos para criticar constructivamente al concepto de la acidosis láctica. Estos individuos y sus becarios (4, 7, 10, 11, 16, 34, 55, 57, 60, 61, 63) representan colectivamente la fuente original de inspiración para escribir esta revisión. Tal inspiración, combinada con el mensaje ampliamente ignorado acerca de que la acidosis no es causada por la producción de lactato, alimentó nuestro deseo de escribir una revisión amplia y crítica acerca de un componente tan importante de la fisiología básica, aplicada y clínica, y del metabolismo muscular.
Referencias
1. Bangsbo J, Gollnick PD, Graham TE, JueC, Kiens B, Mizuno M, and Saltin B (1990). Anaerobic energy produstion and O2 Deficit-debt relationship during exhautive exercise in humans. Physiol 422: 539
2. Bangsbo J (1998). Quantification on anaerobic energy production during intense exercise. Med Sci Sport Exerc 30: 47-52
3. Bernardi P (1999). Mitochondrial transport of cations: channels, exchangers, and permeability transition. Physiol Rev 79: 11271155
4. Busa WB and Nuccitelli R (1984). Metabolic regulation via intracellular pH. Am J Physiol Regul Integr Comp Physiol 246: R409R438
5. Clarence DH (1966). The Handbook of Biochemistry and Biophysics. Cleveland, OH: World
6. Corey HE (2003). Stewart and beyond: new models of acid-base balance. Kidney Int 64: 777787
7. Davis EJ, Bremer J, and Akerman KE (1980). Thermodynamic aspects of translocation of reducing equivalents by mitochondria. J Biol Chem 255: 22772283
8. Dennis SC, Gevers W, and Opie LH (1991). Protons in ischemia: where do they come from; where do they go to?. J Mol Cell Cardiol 23: 10771086
9. Finkel KW and DuBose TD (2002). Metabolic acidosis. In: Acid-Base and Electrolyte Disorders: A Companion to Brenner and Rectors The Kidney, edited by DuBose TD and Hamm LL. Philadelphia, PA: Saunders, p. 5566
10. Fitts RH and Holloszy JO (1976). Lactate and contractile force in frog muscle during development of fatigue and recovery. Am J Physiol 231: 430433
11. Gevers W (1977). Generation of protons by metabolic processes in heart cells. J Mol Cell Cardiol 9: 867874
12. Gevers W (1979). Generation of protons by metabolic processes other than glycolysis in muscle cells: a critical view [letter to the editor]. J Mol Cell Cardiol 11: 328
13. Hagberg H (1985). Intracellular pH during ischemia in skeletal muscle: relationship to membrane potential, extracellular pH, tissue lactic acid and ATP. Pflu¨gers Arch 404: 342347
14. Harmer AR, McKenna MJ, Sutton JR, Snow RJ, Ruell PA, Booth J, Thompson MW, Mackay NA, Stathis CG, Crameri RM, Carey MF, and Eager DM (2000). Skeletal muscle metabolic and ionic adaptations during intense exercise following sprint training in humans. J Appl Physiol 89: 17931803
15. Hill AV, Long CNH, and Lupton H (1924). Muscular exercise, lactic acid, and the supply and utilization of oxygen. Proc R Soc Lond B Biol Sci 16: 84137
16. Hill AV (1926). Croonian lecture. Proc R Soc Lond B Biol Sci 100: 87
17. Hochachka PW and Mommsen TP (1933). Protons and anaerobiosis. Science 219: 13911397
18. Holten CH, Muller A, and Rehbinder D (1971). Lactic Acid: Property and Chemistry of Lactic Acid and Derivatives. Germany: Verlag Chemie
19. Howlett RA, Heigenhauser GJF, and Spriet LL (1999). Skeletal muscle metabolism during high-intensity sprint exercise is unaffected by dichloroacetate or acetate infusion. J Appl Physiol 87: 17471751
20. Juel C, Klarskov C, Nielsen JJ, Krustrup P, Mohr M, and Bangsbo J (2004). Effect of high intensity intermittent training on lactate and H_ release from human skeletal muscle. Am J Physiol Endocrinol Metab 286: E245E251
21. Juel C (1996). Lactate/proton co-transport in skeletal muscle: regulation and importance for pH homeostasis. Acta Physiol Scand 156: 369374
22. Juel C (1977). Lactate-proton cotransport in skeletal muscle. Physiol Rev 77: 321358
23. Juel C (1988). Muscle pH regulation: role of training. Acta Physiol Scand 162: 359366
24. Kaplan RS (2001). Structure and function of mitochondrial anion transport proteins. J Membr Biol 179: 165183
25. Karlsson J (1971). Lactate and phosphagen concentrations in working muscle of man. Acta Physiol Scand Suppl 358: 172
26. Katz A and Sahlin K (1988). Regulation of lactic acid production during exercise. J Appl Physiol 65: 509518
27. Kowalchuk JM, Heigenhauser GJF, Lindinger MI, Sutton JR, and Jones NL (1988). Factors influencing hydrogen ion concentration in muscle after intense exercise. J Appl Physiol 65: 20802089
28. Laski ME and Wesson DE (2002). Lactic acidosis. In: Acid-Base and Electrolyte Disorders: A Companion to Brenner and Rectors The Kidney, edited by DuBose TD and Hamm LL. Philadelphia, PA: Saunders, p. 835108
29. Lehninger AL (1982). The Principles of Biochemistry (2nd ed). New York: Worth
30. Lindinger MI and Heigenhauser GJ (1991). The roles of ion fluxes in skeletal muscle fatigue. Can J Physiol Pharmacol 69: 246253
31. Lusk G (1928). The Elements of the Science of Nutrition. Philadelphia: Saunders
32. MacRae HSH and Dennis SC (1995). Lactic acidosis as a facilitator of oxyhemoglobin dissociation during exercise. J Appl Physiol 78: 758760
33. Margaria R, Edwards HT, and Dill DB (1933). The possible mechanisms of contracting and paying the oxygen debt and the role of lactic acid in muscular contraction. Am J Physiol 106: 689715
34. Medbo JO and Tabata I (1993). Anaerobic energy release in working muscle during 30 s to 3 min of exhaustive bicycling. J Appl Physiol 75: 16541660
35. Noakes TD (1997). Challenging beliefs: ex Africa semper aliquid novi. Med Sci Sports Exerc 29: 571590
36. Raju TN (1998). The Nobel Chronicles. 1922: Archilbald Vivian Hill (18861977), Otto Fritz Meyerfhoff (18841951). Lancet 352: 1396
37. Robergs RA (2001). Exercise-induced metabolic acidosis: where do the protons come from?. Sportscience 5 [sportsci.org/jour/0102/rar. htm, 2001]
38. Roth DA and Brooks GA (1990). Lactate transport is mediated by a membranebound carrier in rat skeletal muscle sarcolemmal vesicles. Arch Biochem Biophys 279: 377385
39. Sahlin K and Henriksson J (1984). Muscle buffer capacity and lactate accumulation in skeletal muscle of trained and untrained men. Acta Physiol Scand 122: 331339
40. Sahlin K, Edstrom L, Sjoholm H, and Hultman E (1981). Effects of lactic acid accumulation and ATP decrease on muscle tension and relaxation. Am J Physiol Cell Physiol 240: C121C126
41. Sahlin K, Edstrom L, Sjoholm H, and Hultman E (1981). Effects of lactic acid accumulation and ATP decrease on muscle tension and relaxation. Am J Physiol Cell Physiol 240: C121C126
42. Sahlin K, Harris RC, Nylind B, and Hultman E (1976). Lactate content and pH in muscle samples obtained after dynamic exercise. Pflu¨gers Arch 367: 143149
43. Sahlin K, Katz A, and Henriksson J (1987). Redox state and lactate accumulation in human skeletal muscle during dynamic exercise. Biochem J 245: 551556
44. Sahlin K, Tonkonogi M, and Soderlund K (1998). Energy supply and muscle fatigue in humans. Acta Physiol Scand 162: 261266
45. Sahlin K (1978). Intracellular pH and energy metabolism in skeletal muscle of man. Acta Physiol Scand Suppl 455: 750
46. Sahlin K (1986). Metabolic changes limiting muscle performance. In: Biochemistry of Exercise, edited by Saltin B. Champaign, IL: Human Kinetics, vol. 16, p. 323344
47. Sahlin K (1985). NADH in human skeletal muscle during short-term intense exercise. Pflu¨gers Arch 403: 193196
48. Shampo MA and Kyle RA (1999). Otto MeyerhoffNobel Prize for studies of muscle metabolism. Mayo Clin Proc 74: 67
49. Smith GL, Donoso P, Bauer CJ, and Eisner DA (1993). Relationship between intracellular pH and metabolite concentrations during metabolic inhibition in isolated ferret heart. J Physiol 472: 1122
50. Spriet LL, Sodeland K, Bergstrom M, and Hultman E (1987). Aerobic energy release in skeletal muscle during electrical stimulation in men. J Appl Physiol 62: 611615
51. Spriet LL, Sodeland K, Bergstrom M, and Hultman E (1987). Skeletal muscle glycogenolysis, glycolysis, and pH during electrical stimulation in men. J Appl Physiol 62: 616621
52. Spriet LL (1992). Anaerobic metabolism in human skeletal muscle during short-term, intense activity. Can J Physiol Pharmacol 70: 157165
53. Stringer W, Casaburi R, and Wasserman K (1992). Acid-base regulation during exercise and recovery in humans. J Appl Physiol 72: 954961
54. Stringer W, Wasserman K, Casaburi R, Porzasz J, Maehara K, and French W (1994). Lactic acidosis as a facilitator of oxyhemoglobin dissociation during exercise. J Appl Physiol 76: 14621467
55. Stryer L (1995). Biochemistry (4th ed). San Francisco: Freeman
56. Tafaletti JG (1991). Blood lactate: biochemistry, laboratory methods and clinical interpretation. CRC Crit Rev Clin Lab Sci 28: 253268
57. Trump BD, Mergner WJ, Kahng MW, and Saladino AJ (1976). Studies on the subcellular pathophysiology of ischemia. Circulation 53: I17I26
58. Vaghy PL (1979). Role of mitochondrial oxidative phosphorylation in the maintenance of intracellular pH. J Mol Cell Cardiol 11: 933940
59. No disponible (1984). Websters Ninth New Collegiate Dictionary. Springfield: Merriam-Webster
60. Westerblad H, Allen DG, and Lannergren J (2002). Muscle fatigue: lactic acid or inorganic phosphate the major cause?. News Physiol Sci 17: 1721
61. Wilkie DR (1979). Generation of protons by metabolic processes other than glycolysis in muscle cells: a critical view. J Mol Cell Cardiol 11: 325330
62. Williamson JR, Schaffer SW, Ford C, and Safer B (1976). Contribution of tissue acidosis to ischemic injury in the perfused rat heart. Circulation 53: I3I16
63. Wilson MC, Jackson VN, Heddle C, Price NT, Pilegaard H, Juel C, Bonen A, Montgomery I, Hutter OF, and Halestrap AP (1998). Lactic acid efflux from white skeletal muscle is catalyzed by the monocarboxylate transporter isoform MCT3. J Biol Chem 273: 1592015926
64. Zilva JF (1978). The origin of the acidosis in hyperlactataemia. Ann Clin Biochem 15: 4043