Carbohidratos para el Ejercicio: Demandas en la Dieta para un Rendimiento Óptimo
Human Perfomance Laboratory, Ball State University, Muncie, Indiana, U.S.A.
Artículo publicado en el journal PubliCE, Volumen 0 del año 1989.
Publicado 14 de abril de 2003
INTRODUCCIÓN
Al margen de los límites impuestos por los factores hereditarios y por los niveles de mejoría de la condición física asociada con el entrenamiento, ningún otro factor juega un papel tan importante para el rendimiento como la nutrición. Desde la década de 1930 se conoce que los carbohidratos contenidos en la alimentación (CHO) aumentan el rendimiento, particularmente durante el ejercicio prolongado (22,63). En estos primeros estudios se utilizó el intercambio gaseoso de oxígeno y dióxido de carbono para demostrar que, durante el ejercicio intenso, los CHO sirven como combustible principal para los músculos (22). También se observó que cuando los sujetos consumían dietas ricas en CHO tendían a lograr una mayor resistencia y a utilizar más energía derivada de los CHO, durante el ejercicio en steady-state (a intensidad estable). Los mecanismos subyacentes de este cambio hacia la mayor oxidación de CHO y mejoría en el rendimiento sólo han sido analizados en forma reciente, utilizando mediciones invasivas del glucógeno muscular y hepático, y a través del uso de isótopos (11, 12, 90, 91). El objetivo de esta revisión es mostrar la importancia del CHO endógeno y del CHO ingerido durante el rendimiento muscular. Se prestará especial atención a la influencia del azúcar en la dieta sobre la reserva glucogénica muscular y hepática.
UTILIZACIÓN DEL GLUCÓGENO MUSCULAR
La producción de adenosín trisfosfato (ATP) durante el esfuerzo muscular intenso depende de la disponibilidad de glucógeno muscular y de glucosa sanguínea. A pesar de que es posible realizar esfuerzos leves con bajos niveles de los CHO mencionados, la deplección de estos combustibles hace que sea imposible que los músculos alcancen los requerimientos de ATP y que mantengan la tensión contráctil necesaria para el rendimiento deportivo (36, 71, 130). Si bien las grasas y las proteínas contribuyen al “pool” energético utilizado durante la actividad muscular, estas fuentes, por si solas, no pueden respaldar las demandas del músculo ante el ejercicio agudo e intenso. La oxidación de grasas durante el ejercicio intenso depende de la producción de intermediarios en el ciclo de Krebs (e.g., citrato) durante la ruptura de CHO. Por lo tanto, cuando hay una deplección glucogénica en los músculos, las fibras no pueden producir suficientes cantidades de estos metabolitos intermediarios para apoyar al metabolismo de las grasas. Aún con adecuadas cantidades de glucógeno muscular las demandas de proteínas y grasas son menores. Se ha calculado que aún en una maratón, menos del 1% de las reservas orgánicas totales de grasas y proteínas pueden ser oxidadas, mientras que en en mismo tiempo de esfuerzo se puede producir una deplección glucogénica total en el hígado y en los músculos utilizados durante la actividad (27). Al comienzo del ejercicio, el glucógeno muscular es la principal fuente de CHO utilizada para generar energía. Esta evidencia se ilustra en la Fig. 1, que muestra la rápida disminución del glucógeno muscular durante los primeros minutos, en una prueba de 3 horas sobre la cinta ergométrica.
A pesar de que el test se realizó a una intensidad constante, la tasa de glucógeno utilizado por el músculo gemelo fue mayor durante los primeros 90 minutos de ejercicio (la mitad del tiempo). De allí en adelante el uso de glucógeno se hizo más lento, a medida que se vacilaban las reservas. El sujeto sintió solamente un malestar moderado durante la primera parte de la carrera, cuando la tasa de uso de glucógeno muscular era rápida. Sólo cuando el glucógeno muscular estaba casi depletado, el sujeto experimentó una fatiga severa.
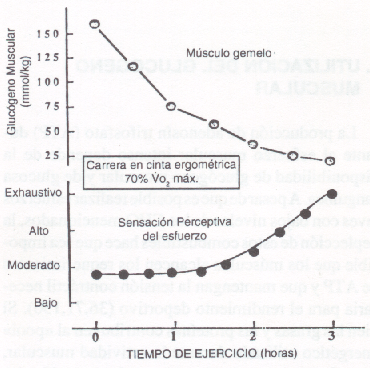
Figura 1. Contenido de glucógeno muscular y tasa subjetiva de
percepción de esfuerzo (escala de Borg), durante una carrera en cinta
ergométrica de tres horas de duración. Notar que durante la primera mitad del
ejercicio (90´) el glucógeno fue utilizado a una tasa mayor que durante los 90
minutos finales del mismo.
La tasa de deplección del glucógeno muscular depende del número de factores que incluyen la intensidad del ejercicio, la condición física, la modalidad del ejercicio, la temperatura ambiente, y la dieta pre-ejercicio (16, 22). Cuando el flujo de oxígeno a los músculos en ejercicio no cubre en forma adecuada las demandas para el metabolismo oxidativo, hay una mayor dependencia del CHO para producir energía. Se ha demostrado que existe una relación exponencial entre la tasa de utilización del glucógeno muscular y la intensidad del ejercicio (%VO2 máx.). Este punto está ilustrado en la Fig.2. Cuando se camina al 20% - 30% del VO2 máx, se oxida muy poco glucógeno muscular (0,3 mmol/kg x min-1), mientras que contracciones máximas repetidas pueden elevar la velocidad de uso de glucógeno a más de 40 mmol/kg x min-¹.
Es difícil predecir en forma exacta el grado de vaciamiento del glucógeno muscular durante series de ejercicio de diferentes duraciones. Por ejemplo, 2 horas de ciclismo al 30% del VO2 máx sólo reducirá el glucógeno muscular en un 20%, mientras que si el ejercicio se realiza al 75% del VO2 máx. se producirá una deplección casi total (69,85). Estos resultados demuestran que hay un marcado incremento en el uso del glucógeno muscular cuando la intensidad del esfuerzo se acerca a niveles máximos y/o supramáximos.
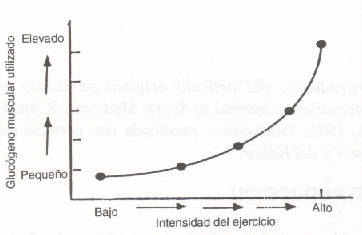
Figura 2. Efectos de la velocidad de carrera sobre la tasa de
utilización del glucógeno muscular. La misma puede ser 40 veces más rápida
durante una carrera de alta velocidad, comparado a los valores durante una
caminata (29).
Los primeros estudios realizados por Christensen y Hanssen (22) mostraron que a niveles de ejercicio por debajo del 95% del VO2 máx. del corredor , tanto los CHO como las grasas son utilizados como combustible. Sin embargo, por encima de esta intensidad, los CHO son utilizados casi con exclusividad; por lo tanto, una intensidad elevada en la primera fase de una serie de ejercicios puede llevar a la deplección glucogénica y a la fatiga prematura. Cuando los niveles de glucógeno muscular son muy bajos, se debe reducir la intensidad del ejercicio a fin de disminuir las demandas de CHO, permitiendo que de esta manera que los músculos utilicen más las grasas (11, 12, 36).
El ejercicio realizado a altas temperaturas también puede aumentar las demandas de CHO. Fink y cols. (55) han demostrado un aumento del 76% en el uso de glucógeno muscular durante 75 minutos de ejercicio en comparación con un ejercicio similar realizado en un clima más frío (temp. = 9ªC; humedad = 55%). Este aumento en la dependencia del glucógeno muscular parece estar causado por una reducción en el flujo sanguíneo muscular, y a la vez, por un incremento en la temperatura intramuscular. Por lo tanto, es aparente que una cantidad de factores ambientales también podría influenciar la tasa de uso de CHO durante el ejercicio.
También se debería mencionar que las demandas de glucógeno muscular no son compartidas de igual manera por todas las fibras de un músculo en ejercicio. Los músculos del ser humano están compuestos por, al menos, dos tipos diferentes de fibras musculares. A aquellas que tienen una alta capacidad oxidativa y que son relativamente lentas para contraerse, se las conoce como fibras de tipo Y. Las fibras de tipo II tienen una baja capacidad para el metabolismo oxidativo, un alto potencial glucolítico, y son más veloces para contraerse. Existen dos subgrupos de fibras de tipo II, de las cuales las de tipo IIa parecen ser más comúnmente reclutadas, en contraposición con las del tipo IIb que son menos usadas. El patrón de deplección del glucógeno de las fibras I y II depende de la intensidad del ejercicio. Durante el ejercicio prolongado con una intensidad menor al 70% del VO2 máx, la deplección glucogénica es mayor en las fibras de tipo I, lo que sugiere que estas fibras tienen la gran responsabilidad del desarrollo de la tensión en tales actividades (36, 62, 128).
A medida que aumentan los requerimientos de tensión, se agregan al trabajo las fibras de tipo IIa y, finalmente, las de tipo IIb. Durante una contracción máxima, el sistema nervioso intenta reclutar todos los tipos de fibras. Con las intensidades más altas de esfuerzo (75%-90% VO2 máx.), son frecuentemente reclutadas las fibras de tipo II, y su glucógeno es depletado a una tasa mayor que las fibras de tipo I. Esto no se debería interpretar como que las fibras de tipo I son menos usadas que las de tipo II durante contracciones máximas; simplemente refleja la mayor capacidad glucolítica y la mayor dependencia del glucógeno que tienen las fibras de tipo II. En realidad, durante las contracciones musculares de alta intensidad todas las fibras musculares son reclutadas. En la Fig.3 se ilustra la distribución del glucógeno muscular usado por las fibras de tipo IIa, y IIb de los músculos del muslo durante el ciclismo. Cuando el glucógeno es depletado en las fibras de tipo I, las fibras de tipo II parecen no ser capaces de generar una tensión suficiente y/o no pueden ser fácilmente reclutadas para compensar la pérdida en la tensión muscular. Ha surgido la teoría que las sensaciones de fatiga muscular y la pesadez que ocurren durante un ejercicio de larga duración, reflejan la incapacidad de algunas fibras químicas musculares de responder a las demandas del ejercicio y mantener su tensión.
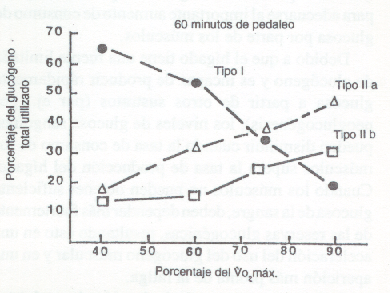
Figura 3. Distribución de glucógeno muscular utilizado por las figuras
de tipo I, IIa, y IIb, en el vasto lateral del muslo, durante ciclismo a varias
intensidades.
Además de depletar selectivamente el glucógeno de las fibras de tipo I y II, el ejercicio puede exigir una demanda inusualmente intensa en grupos musculares selectos. Por ejemplo, durante una carrera de 2 horas en cinta ergométrica, con carrera cuesta arriba, cuesta abajo, y sin inclinación, se utilizaron mayores cantidades de glucógeno del gemelo y del sóleo que del vasto lateral. Esto sugiere que los músculos flexores de la planta (gemelos y sóleo) son más susceptibles de depletarse durante una carrera de fondo que los músculos del muslo, confirmado, por lo tanto, la fatiga a los músculos de la parte inferior de la pierna. Por otro lado, los ciclistas muestran una mayor deplección glucogénica en el vasto lateral y otros músculos del muslo que lo que se podría observar en el pedestrismo. Por lo tanto, diferentes modalidades de ejercicio pueden llevar al uso específico de ciertos grupos musculares, con una concomitante deplección glucogénica y fatiga muscular localizada.
El glucógeno muscular, por si sólo, no puede brindar todo el CHO necesario para un ejercicio de varias horas de duración. Se ha mostrado que la glucosa que llega al músculo por vía sanguínea, aporta una cantidad considerable de energía durante un ejercicio de resistencia. También se produce una ruptura del glucógeno hepático, y éste es liberado a la sangre, y distribuido a los músculos, brindando así una constante fuente de glucosa. En las primeras etapas del ejercicio, la producción de energía necesita relativamente poca cantidad de glucosa sanguínea, pero en las últimas etapas de un evento de resistencia, la glucosa sanguínea puede hacer una gran contribución a las necesidades energéticas de los músculos. Cuanto más largo es el período de ejercicio, mayor debe ser la producción de glucosa a partir del hígado, para adecuarse al importante aumento de consumo de glucosa por parte de los músculos.
Debido a que el hígado tiene una fuente limitada de glucógeno y es incapaz de producir rápidamente glucosa a partir de otros sustratos (e.g., por neoglucogénesis), los niveles de glucosa sanguínea pueden disminuir cuando la tasa de consumo de los músculos supera la tasa de producción del hígado. Cuando los músculos no pueden obtener suficiente glucosa de la sangre, deben depender más fuertemente de las reservas glucogénicas, resultando esto en una aceleración del uso del glucógeno muscular y en una aparición más pronta de la fatiga.
Se debe remarcar que la deplección glucogénica y la hipoglucemia parecen limitar el rendimiento y causar fatiga en actividades que duran 60 minutos o más. En eventos más cortos, es más probable que la fatiga sea el resultado de una acumulación de productos metabólicos residuales, como la producción de lactato o iones de hidrógeno dentro de las fibras musculares.
RESERVAS DE GLUCÓGENO Y RENDIMIENTO
En el ser humano, la reserva del glucógeno hepático y muscular depende, casi exclusivamente, del consumo de CHO a través de la alimentación. Como se mencionó anteriormente, durante períodos de ejercicio prolongado y durante el ayuno, el hígado moviliza sus reservas a fin de mantener la glucosa sanguínea. Como consecuencia de un ejercicio intenso de 60 minutos de duración, se observó que el glucógeno hepático disminuye un 55% (de 244 a 111 mmol/kg de tejido) (70). Los estudios han demostrado que las reservas de glucógeno hepático disminuirán rápidamente si a un individuo en reposo se le niegan los CHO por sólo 24 horas. En combinación con dietas bajas en CHO, un entretenimiento intenso puede vaciar las reservas de glucógeno hepático. Al contrario de algunos animales, el hombre es incapaz de generar una cantidad significativa de glucógeno muscular o hepático por gluconeogénesis. La rata, por ejemplo, puede usar varios precursores (e.g., glicerol, lactato, etc.) para resintetizar glucógeno hepático, aún cuando no consuma alimentos. Los humanos, sin embargo, deben depender de la ingesta de CHO para reponer estas reservas. Se ha mostrado que una simple ingesta de CHO puede llevar rápidamente el glucógeno hepático a niveles normales (70).
La cantidad de glucógeno muscular almacenado es regulado por el nivel de actividad del individuo, por su estado de entrenamiento, y por el contenido de CHO en la alimentación. Se ha observado que los sujetos desentrenados, que están en reposo y están bien alimentados, poseen valores de glucógeno muscular que varían entre 70 y 110 Mmol unidades de glucosyl/kg de peso húmedo (16,72). Por otro lado, los atletas entrenados en resistencia tienen valores de glucógeno muscular entre 140 y más de 230 mmol/kg de peso húmedo (72, 104, 124). Los mayores niveles de glucógeno muscular observados en individuos entrenados parecen estar causados por la influencia combinada del ejercicio crónico, la deplección glucogénica, y la curva de supercompensación por la ingesta de CHO.
La enzima clave en la regulación de la reserva glucogénica en el músculo es la glucógeno sintetasa (glucosa-UPD: α-4-glucosil-trasferasa; EC 2.4.1.11). Esta enzima existe en dos formas, una dependiente de glucosa (6-P (forma D), y otra independiente de glucosa 6-P (forma I). En el extracto crudo del músculo la transformación de I a D ocurre en presencia de ATP y magnesio(60). Una variedad de factores hormonales y no hormonales influyen en la actividad de esta enzima. En los trabajos realizados por Adolfsson y Ahren (3), y Larner y cols. (93), se puede observar una revisión detallada del sistema de la enzima glucógeno sintetasa.
En un grupo de sujetos normales (72) se observó una relación inversa (r= -0,88) entre el contenido de glucógeno muscular y la actividad de la sintetasa I, en porcentaje de actividad total. Consecuentemente, cuando el glucógeno muscular es depletado al final del ejercicio, la actividad de la sintetasa I muestra un dramático aumento. Esta enzima es, además activada por la infusión de insulina y/o glucosa; por lo cual, no es sorprendente que estimule una rápida resíntesis del glucógeno muscular luego del ejercicio, cuando se ingieren CHO. La tasa más alta de resíntesis del glucógeno muscular (0,4 a 0,5 Mmol de unidades de glucosyl/kg/min) se produce en el músculo depletado de glucógeno durante la infusión de glucosa. En la sección 10 de este artículo se discutirá en detalle la influencia de los CHO específicos en los alimentos, sobre la tasa y cantidad de reserva de glucógeno muscular.
Como se observó previamente, la degradación de glucógeno muscular durante series prolongadas de ejercicios de resistencia es más rápida en los primeros minutos de la activad; luego se hace más lenta durante las últimas etapas de la misma. Además, hay un marcado incremento en el uso de glucógeno muscular cuando la intensidad del esfuerzo se acerca a niveles máximos y/o supramáximos. A tasas de esfuerzo por encima del 70% del VO2 máx., el contenido inicial del glucógeno muscular es crítico para la capacidad del individuo, de mantener tal ejercicio por más de una hora (14). Como se destaca en la Fig. 4, cuánto más altas son las reservas iniciales de glucógeno muscular, el sujeto podrá continuar por más tiempo el ejercicio a una carga determinada (>70 % VO2 máx.). Con un contenido inicial de glucógeno de aproximadamente 100 mmol/kg, Bergstrom y cols. (14) observaron que los sujetos podían tolerar una intensidad de esfuerzo del 75% VO2 máx. durante 115 minutos. Cuando el glucógeno muscular era reducido a 35 mmol/kg, a través de una dieta baja en CHO, un esfuerzo al 75% del VO2 máx. podía ser sostenido sólo por unos 60 minutos. Una dieta rica en CHO, durante 3 días, dio como resultado un contenido glucogénico de 200 mmol/kg, y un tiempo de trabajo hasta el agotamiento de 170 minutos.
El contenido glucogénico del músculo tiene un efecto sobre la potencia máxima, tanto en un ejercicio de corta duración como en eventos de más de una hora (56,66); sin embargo, aparentemente el decremento en el contenido glucogénico parece tener sólo una influencia menor sobre el rendimiento de la velocidad, a menos que los niveles caigan por debajo de 40 mmol/kg (66,80). En el período final de un evento de resistencia, por ejemplo, cuando un atleta debe acelerar hasta la meta, el nivel de glucógeno muscular puede ser el factor decisivo entre ganar o perder.
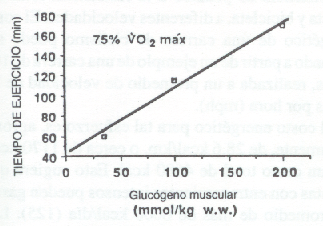
Figura 4. Efectos del contenido inicial de glucógeno muscular sobre el tiempo
o duración del ejercicio, antes de llegar a la fatiga exhaustiva.
CONTRIBUCIONES DE LA GLUCOSA SANGUÍNEA AL METABOLISMO MUSCULAR
La glucosa sanguínea también sirve como principal contribuyente para el “pool” de sustratos metabólicos para la actividad muscular. Durante el reposo, el consumo de glucosa que hace el músculo, es menor al 10% del consumo total de oxígeno del músculo (7). Sin embargo, durante una carga de ciclismo, moderada a intensa, el consumo neto de glucosa de los músculos de la pierna aumenta de 10 a 20 veces por encima del valor de reposo (132). Durante las últimas etapas de un ejercicio prolongado, la fracción de energía derivada de la glucosa sanguínea aumenta, y puede ser responsable del 75% -90% del metabolismo de CHO del músculo (132). Este gran drenaje de la glucosa sanguínea necesita un concomitante aumento en la producción de glucosa hepática, para demorar la aparición de la hipoglucemia por esfuerzo. Debido a que el hígado es el principal contribuyente de glucosa a la sangre, el aumento de las demandas impuestas por la actividad muscular resulta en una rápida disminución del glucógeno hepático, y en una mayor dependencia en la gluconeogénesis.
Se ha demostrado que durante 4 horas de ejercicio moderado, el glucógeno hepático puede ser depletado en un 75% con un aumento en la producción de glucosa, a partir de precursores tales como el lactato, piruvato, glicerol y aminoácidos glucogénicos (51, 131). A pesar de estos mecanismos para aumentar la producción y liberación de glucosa, a medida que el ejercicio continúa por más de 40-60 minutos, se puede producir un desbalance entre la producción hepática y la utilización periférica de glucosa (130). Por lo tanto, los atletas que compiten en eventos que duran 3 horas o más, pueden volverse hipoglucémicos; los valores de glucosa sanguínea alcanzan valores menores a 2,5 mmol/l (95).
A pesar de que hay una información limitada acercada de la deplección de glucógeno hepático durante el ejercicio en humanos (70), los estudios con ratas han demostrado que el entrenamiento de resistencia aumenta el contenido hepático en reposo en un 70% de 42,3 (SE ± 6,6) a 72,1 (SE ± 5,0) mg/g de peso húmedo (9). Además, las tasas de deplección del glucógeno hepático durante el ejercicio fueron menores en ratas entrenadas que en no entrenadas. Al final de 45´ de carrera, la concentración de glucógeno en el hígado de los animales entrenados disminuyó un 28%, en comparación con la reducción del 93% observada en ratas no entrenadas (9). Es difícil explicar por qué hay diferencias en los valores de glucógeno hepático entre los animales entrenados y no entrenados. La tasa más lenta de glucógeno hepático utilizada por las ratas entrenadas puede ser el resultado de un menor incremento en los niveles de dicha hormona circulante y una mejor capacidad gluconeogénica del hígado en los animales entrenados (9,67). También es posible que estos animales experimenten una menor reducción en el flujo sanguíneo hepático durante el ejercicio que las ratas desentrenadas. Esto disminuirá el nivel de ejercicio reduciendo, por lo tanto, la estimulación para la glucogenólisis (115, 116).
A pesar de la dramática caída de glucógeno hepático observada durante el ejercicio, es sorprendente que la liberación de glucosa hepática pueda ser tan paralela con la utilización de glucosa del músculo, y que los niveles de glucosa sanguínea no caigan hasta que las reservas de glucógeno hepático disminuyan a niveles muy bajos, aún en personas desentrenadas. Aparentemente, este fino control de glucosa sanguínea durante el ejercicio es logrado como consecuencia de una disminución en la liberación de insulina del páncreas, y de un incremento en la sensibilidad del tejido a la insulina circundante. Durante un ejercicio prolongado, la insulina plasmática puede caer en un 50 % del nivel de reposo. Además, series agudas e intensas de ejercicio aumentan la sensibilidad muscular hacia la glucosa e insulina. Este aspecto se demuestra en la Fig. 5. Los mecanismos responsables de este fino control de la glucosa sanguínea y el manejo de las ingestas de CHO durante el ejercicio, aún no están completamente entendidos, pero probablemente están ligados al incremento en la permeabilidad de la membrana y al aumento en el número de receptores para la insulina, a lo largo de la membrana de la célula muscular. Posteriormente, se hará una especial mención de los procesos de ingesta y absorción de glucosa durante el ejercicio.
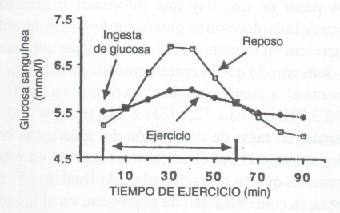
Figura 5. Cambios en la glucosa sanguínea luego de una ingesta de
azúcar de 70 g, bajo condiciones de reposo y ejercicio. Notar el menor
incremento en la glucosa cuando los sujetos estaban corriendo (ref. 29).
REQUERIMIENTOS DE CALORÍAS Y DE CARBOHIDRATOS DE LOS DEPORTES
Sólo se posee de una información limitada para describir el gasto real de CHO durante las actividades deportivas. Los requerimientos técnicos para que sean precisas las mediciones fuera del laboratorio son difíciles y, a menudo, poco prácticos. La información que se brinda es esta sección del artículo se limita a nuestros estudios realizados con corredores y nadadores competitivos, los cuales se hicieron durante sesiones de atletismo y en pileta de natación. A pesar de que esta visión de las demandas energéticas para deportistas competitivos es limitada, nos brinda alguna indicación sobre las demandas totales de calorías y de CHO que tienen la mayoría de los atletas, que entrenan en forma diaria e intensa durante varias horas. El entrenamiento para deportes competitivos puede aumentar el gasto energético diario en un 25%-50%. Los corredores de larga distancia, por ejemplo, comúnmente corren entre 15-40 km/día con un promedio de gasto de 55-64 kcal/km (26, 30, 82). Por lo tanto, estos corredores pueden gastar entre 900 y 2400 kcal/día durante el entrenamiento. El gasto energético en otras actividades, tales como el ciclismo, difiere de lo observado en el pedestrismo. El gasto energético en el ciclismo aumenta aproximadamente en relación al cuadrado de la velocidad, y no en relación cúbica con la misma, como uno podría esperar (125). Esto se debe a la contribución variada de la resistencia de pedaleo a la resistencia total del ciclista y la bicicleta, a diferentes velocidades. El costo energético de una carrera de ciclismo puede ser estimado a partir de un ejemplo de una carrera de 160 km, realizada a un promedio de velocidad de 40 km por hora (km/h).
El costo energético para tal esfuerzo es, aproximadamente, de 28,6 kcal/km, o cerca de 1170 kcal/h, a un costo total de 4680 kcal. Esto sugiere que ciclistas con entrenamientos intensos pueden gastar un promedio de 6000 kcal/día (125). Los extremos superiores del gasto energético para ciclistas competitivos entrenados, que recorrieron 540 km en 19,3 horas están estimados entre 9500-13850 kcal (83).
En cuanto al entrenamiento de los nadadores, se han reportado distancias de 5 15 km/día. Debido a que su nivel de habilidad, estilo de nado, flotabilidad, y resistencia de fricción acuática influye en el costo energético, es difícil estimar el costo calórico preciso de entrenamiento para este deporte (33,82). Los estudios en nadadores muy hábiles han mostrado que se gastan, aproximadamente 250 kcal/km con el estilo libre, una de las formas más económicas de natación (33,48). Se ha estimado que estos deportistas gastan entre 1250 y 3750 kcal en cada sesión de entrenamiento, más o menos 17-50 kcal/kg de peso, por sesión. En combinaciones con el gasto energético de la vida diaria (30-35 kcal/kg de peso/día) se puede estimar que el gasto total de los nadadores, y quizás de otros deportistas que entrenan en forma intensa, varía entre 47 y 85 kcal/kg de peso corporal/día (48,82). Un deportista que pese 65 kg tendría un gasto energético diario de 3055-5525 kcal.
Como se discutió previamente, una gran parte de la energía para el entrenamiento y la competencia deriva del CHO endógeno, principalmente del glucógeno muscular y hepático. En actividades que duran 60 minutos o más, la energía derivada de los CHO puede variar entre 50 % y 90 % del total de calorías gastadas. Por lo tanto, un atleta de 65 kg de peso que gasta 2000 kcal en el entrenamiento, podría consumir 1000-1800 kcal de CHO, o 250-450 g de CHO. En combinación con los requerimientos normales diarios de CHO (300-350 g/día), tal atleta debería consumir 550-800 g/día, u 8,5-12,3 g/kg de peso corporal. Esto se contrapone a la ingesta normal de sólo 4,5 g CHO/kg/día. La Tabla 1 da algunos ejemplos de las demandas energéticas y de CHO para varias actividades deportivas.
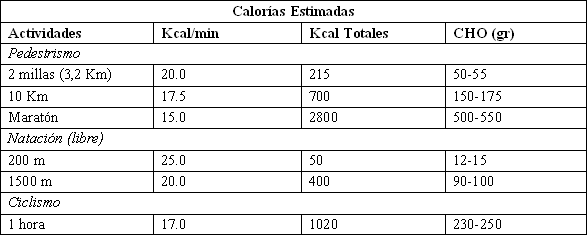
Tabla 1. Gasto energético y de carbohidratos (CHO) estimado, durante
pedestrismo, natación, y ciclismo para una persona de 70 kg.
Sin embargo, los deportistas pueden verse forzados a depender más de las grasas y proteínas cuando las reservas de CHO endógeno son bajas (2, 22, 50). Este punto se ilustra en la Fig. 6 y en la Tabla 2.
Christensen y Hansen (22) observaron que aquellos sujetos que están bajo una dieta rica en grasas, y comienzan un ejercicio esencialmente aeróbico, en la mayoría de ellos menos del 5% de la energía era suministrada por los CHO. Cuando los hombres consumían una dieta rica en CHO (90% de las calorías derivadas de los CHO), las grasas contribuían sólo con el 25%-30% del combustible metabólico. A pesar de que los sujetos bajo una dieta rica en grasas se fatigarán fácilmente con exigencias de cargas muy intensas, aún un hombre mal alimentado podría trabajar por largos períodos, utilizando las grasas como principal combustible, si el esfuerzo es relativamente bajo (30%-40% del VO2 máx.). Los mecanismos responsables de este aumento en la tasa de metabolismo graso, cuando se ingiere una dieta rica en grasas, no deberían atribuirse al aumento en la disponibilidad de las mismas, sino más bien a una falta de CHO.
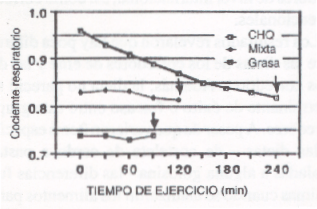
Figura 6. Tasa de intercambio respiratorio durante un trabajo en
bicicleta ergométrica (1080 kgm/min). Se observó la respuesta de CHO luego de:
una dieta rica en carbohidratos (CHO), luego de una dieta normal mixta (MIXTA),
y luego de una dieta rica en grasas (GRASA). Las flechas indican el momento en
que se terminó el ejercicio debido al agotamiento (22).
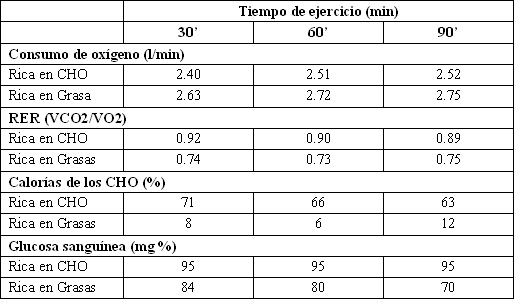
Tabla 2. Consumo de oxígeno y cociente respiratorio (RER) durante 90
minutos de ejercicio, en un sujeto sometido a una dieta rica en grasas; y
nuevamente bajo una dieta rica en carbohidratos (CHO).
HÁBITOS ALIMENTICIOS DE LOS ATLETAS
Los atletas imponen una considerable demanda sobre sus reservas energéticas durante los períodos de entrenamiento y competencia. Desafortunadamente, la mayoría de ellos gastan un tiempo y un esfuerzo importante en el perfeccionamiento de las habilidades y en llegar al tope de la condición física, pero ignoran la nutrición y los períodos de descanso adecuados. No es extraño detectar que el empeoramiento en el rendimiento de un deportista se deba a una mala alimentación (35). No se dispone de mucha información concerniente a los hábitos alimenticios de los atletas. Para tener alguna perspectiva de este problema, se registraron las dietas de corredores fondistas, altamente entrenados, durante un período de tres días antes de una maratón (26). Los 22 corredores (11 hombres y 11 mujeres) estudiados incluían a competidores de nivel internacional, así como a corredores recreacionales.
Los resultados revelaron que hay poca diferencia entre las dietas de los corredores de élite y las de los otros corredores. Además, la dieta no pareció ser la determinante de éxito o fracaso entre este grupo de corredores. A pesar de que variaron ítems específicos en las dietas - de costeleta de cerdo a pasta, de ensaladas a alguna golosina - las diferencias fueron mínimas cuando se analizaron los alimentos para sus porcentajes de grasa, proteína y CHO, o cantidades de vitaminas y minerales. Una observación interesante fue cuan cerca estuvieron los atletas de alcanzar el Margen Dietario Recomendado (MDR), que representa el patrón establecido por el Comité de Alimentos y Nutrición del Consejo Nacional de Investigación de la Academia Nacional de Ciencias.
Se observó que los carbohidratos contribuían con el 50% de la ingesta calórica total de los corredores. A la luz de la necesidad de observar una dieta rica en CHO cuando se está entrenado en fondo, en primera instancia podríamos considerar como bajo el consumo de CHO de estos corredores. Una vista más cercana de las dietas reveló que la ingesta calórica total era casi el 50% mayor de lo que se podría esperar para individuos de pesos similares (65,7 kg) (Tabla 3). Por lo tanto, se estimó que estos corredores consumían más CHO que los suficientes para alcanzar las demandas energéticas necesarias para el entrenamiento. Además se observó que estos corredores consumían cantidades adecuadas de vitaminas y minerales, por lo menos para igualar el MDR. A menos que la ingesta vitamínica de un corredor caiga muy por debajo del MDR por un largo período de tiempo, no es de esperar que se produzcan efectos negativos sobre el rendimiento. A pesar de que las dietas ricas en CHO simples tienden a ser deficientes en algunas de las vitaminas del complejo B, en este estudio sólo se observó a dos corredores que consumían menos vitamina B 12 que lo recomendado por el MDR.
A pesar de que algunos expertos han sugerido que la dieta de cada persona debería contener 1000 mg de vitamina C por día, el MDR sólo recomienda 55 mg/día, valor muy debajo de lo consumido por lo consumido por los deportistas del estudio mencionado anteriormente. La mayoría de los corredores evaluados no utilizaban suplementos de vitaminas o minerales, evidencia contraria a algunos estudios recientes sobre los hábitos de los corredores (38). Además, estos atletas consumían más cantidades de minerales y fibras que las adecuadas.
En los últimos 3 días antes de la maratón, los corredores cambiaron tanto su entrenamiento como sus hábitos alimenticios. Cuando antes corrían un promedio de 13,5 km/día, ahora redujeron el kilometraje diario a 4 km. En un intento aparente por repletar sus músculos de glucógeno, los corredores aumentaron su ingesta calórica diaria de 3012 kcal (durante el entrenamiento), a un promedio de 3730 (durante el periodo pre-maratón). Varios de los corredores varones consumieron más de 5000 kcal, casi el doble de su tasa de gasto calórico durante ese período.
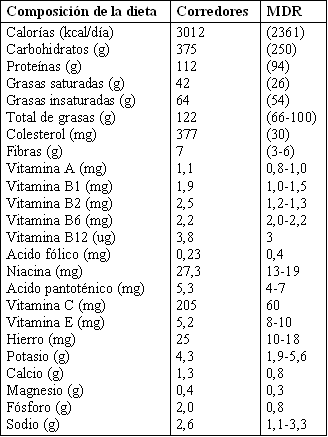
Tabla 3. Comparación de dietas de corredores con el MDR (Margen Dietario
Recomendado). Los números entre paréntesis muestran las estimaciones de los
valores promedio en la dieta Norteamericana, que pueden o no ser saludables. Aún
donde el nutriente es bajo (como con el ácido fólico y la vitamina E), esto no
indica necesariamente una deficiencia, ya que el MDR es de alguna manera
arbitrario, con un amplio margen de seguridad (137).
Debido a que los maratonistas habían reducido sus kilometrajes de entrenamiento, ellos sólo gastaban cerca de 2526 kcal/día, mientras que consumían 3730 kcal/día. El balance produce un excedente de 1204 kcal, lo que en teoría podría haber resultado en el almacenamiento de 0,5 kg de grasa innecesaria y no productiva. Sin embargo, partiendo de nuestra discusión previa acerca de la importancia de los CHO alimenticios, se podría especular que es mejor comer muchos alimentos, principalmente con CHO, que correr el riesgo de no tener las suficientes reservas de glucógeno muscular y hepático al momento de la competencia.
En un intento por comparar la ingesta de nutrientes de corredores de mediana edad (hombres y mujeres) con la de individuos sedentarios, Blairs y cols. (15) utilizaron una encuesta alimenticia durante tres días para evaluar a 61 corredores (34 hombres y 27 mujeres) vs. 80 personas sedentarias elegidas al azar (38 hombres y 42 mujeres). La observación más sorprendente de este estudio fue que ambos grupos consumieron sólo el 38,6 %-39,8 % del total de calorías en la forma de CHO. Esto es sustancialmente menor que el nivel esperado de 50 % - 55 % encontrado en una dieta mixta “normal”, y está por debajo del valor del 50 % reportado por Costill y Higdon (26) para un grupo de corredores altamente entrenados. Este estudio también reportó la fracción de CHO derivados de la sucrosa, el almidón, y otros CHO (Tabla 4). Es interesante señalar que los corredores sólo obtuvieron el 15,5 % (15,1 g/1000 ckal) de sus CHO a partir de la sucrosa, y el 84,5 % a partir del almidón y otros CHO. También parece que el grupo control consumía más CHO que los corredores. Esto puede ser una mala interpretación, ya que los corredores eran significativamente más livianos (62 kg) que los sujetos en el grupo control (76 kg), y gastaban más calorías/kg de peso corporal (42 kcal/kg) que el grupo control (28,5 kcal/kg). Consecuentemente, la cantidad de CHO consumido por unidad de peso corporal era significativamente mayor en los corredores que en los sujetos control.

Tabla 4. Composición de las dietas de hombres y mujeres de mediana edad y
de grupos control sedentarios. Además se muestran los diferentes tipos de
carbohidratos en la dieta.
(*) El porcentaje de kilocalorías no suma el 100%; las calorías provenientes del
alcohol constituyen la diferencia.
Tanto estos resultados, como otras evidencias disponibles sugieren que los requerimientos alimenticios del atleta no son diferentes de aquellos del no atleta, con la excepción del número total de kilocalorías y agua consumida. Por lo tanto, la dieta óptima para deportistas, así como para no deportistas, debe contener cantidades apropiadas de agua, calorías, proteínas, grasas, CHO, minerales y vitaminas en las proporciones adecuadas, independientemente del deporte o de la especialidad dentro de un deporte. En otras palabras, todo lo necesario es una dieta bien balanceada. Las prácticas alimenticias de los atletas a menudo están determinadas por sus puntos de vista acerca de lo que necesitan para lograr el mejor rendimiento deportivo. A pesar de los esfuerzos de nutricionistas, fisiólogos del ejercicio y deportólogos, los atletas y entrenadores por lo general basan sus prácticas nutritivas en viejos conceptos (38). En 1980 nosotros entrevistamos a un grupo de 360 deportistas universitarios, de 15 deportes diferentes para determinar alguno de sus conceptos acerca de la importancia de los CHO para su rendimiento (38). Además, se formularon varias preguntas para facilitar la descripción de los hábitos alimenticios de estos atletas. El 33% indicó que ellos, habitualmente, se abstenían de ingerir CHO en un intento por bajar de peso. Como es de esperar, la mayoría de estos atletas hacían lucha libre (88%), o eran jugadoras de hockey sobre césped. Por otro lado, el 29 % de los deportistas sostuvo que ellos intentaban ingerir cantidades excesivas de CHO, en un esfuerzo por ganar peso. Entre todos estos atletas que eran “consumidores fuertes” de CHO se encontraban participantes en deportes de potencia (por ej., levantadores de pesas y futbolistas).
En un esfuerzo por ganar mayor información intrínseca de los hábitos de CHO en la dieta, asociados con la competición, los atletas fueron encuestados sobre sus hábitos alimentarios pre-competitivos. El 28 % de los varones y mujeres, la mayoría de ellos corredores y ciclistas, mencionaron que habían seguido una dieta especial en CHO, como parte de la preparación para la competición (por ej., sobrecarga con CHO). Las cinco comidas con CHO mas preferidas para la dieta pre-competitiva fueron vegetales (51%), panqueques (44 %), frutas (81 %), bebidas gaseosas (56 %), y cereales (50 %). Cuando se les preguntó si ellos ingerían algún alimento como generador de “energía rápida” antes de la competición, el 63 % contesto que si. Los alimentos con CHO más frecuentemente usados fueron las barras de dulces o chocolate (45 %), bebidas deportivas (45 %) y frutas (45 %). Exactamente 203 atletas (56 % del total) indicaron que ellos consumían alimentos sólidos y/o líquidos con CHO, durante el ejercicio. Los únicos atletas que parecían consumir comida sólida en el curso de competencias de alta intensidad y durante el entrenamiento, eran los ciclistas, y aquellos que participaban en deportes que permiten pequeños períodos de descanso. Un número de 38 atletas participantes en la encuesta indicaron que usaban bebidas deportistas, durante el ejercicio.
Esta encuesta revela que a pesar de los esfuerzos de los nutricionistas y fisiólogos, muchos errores de concepto, aplicaciones y usos ineficientes de la dieta, persisten en la práctica de los atletas. A pesar de que en los últimos años fue ampliamente difundido el rol de los CHO alimenticios sobre el rendimiento deportivo, hay relativamente pocos deportistas que organizan conscientemente la ingesta de este nutriente. También fue sorprendente observar que muchos atletas (por ej., futbolistas) intentaban aumentar su peso ingiriendo cantidades excesivas de calorías, incluyendo CHO. Debido a que es poco probable que ellos hayan querido aumentar su masa grasa, parecería apropiado volcar los esfuerzos para explicar el impacto anatómico/fisiológico de estas calorías “extras” sobre la masa adiposa y el pico de rendimiento.
ABSORCIÓN GASTROINTESTINAL DE LOS CARBOHIDRATOS
Hay beneficios obvios a través de la ingesta de soluciones con CHO durante el ejercicio prolongado, especialmente con altas temperaturas. Estas soluciones pueden minimizar el grado de deshidratación que normalmente se produce por el sudor intenso, reduciendo de esta manera el “estres” sobre el sistema circulatorio. Debido a que muy poca agua, y prácticamente nada de CHO pueden ser absorbidos directamente en el estómago, la tasa de suministro de agua y azúcar al intestino delgado es crítica. A pesar de la abundancia de investigaciones realizadas para describir los factores que influyen en la tasa de vaciado gástrico (estómago) y absorción intestinal, hay bastante confusión y disenso acerca de la composición ideal de los fluidos para utilizar durante el ejercicio. Se ha estudiado en forma extensa el vaciado gástrico y la absorción intestinal de las soluciones de CHO en reposo, y durante variados niveles de esfuerzo muscular (25, 57, 73, 75, 76). Los primeros estudios sugirieron que el ejercicio moderado a intenso inhibía el vaciado gástrico a un bajo nivel (21, 25, 68), mientras que la absorción intestinal de soluciones de CHO podría ser drásticamente perjudicada por el ejercicio (127, 133). Además, Rowell y cols. (1117) mostraron que el flujo sanguíneo esplácnico era sólo del 30-40 % del valor de reposo, a intensidades de esfuerzo que demandan el 70 % del VO2 máx. Williams y cols. (133) demostraron que la excreción urinaria de la 3-O-metil-D-glucosa, ingerida oralmente (un azúcar activamente transportado), se reduce durante el ejercicio en el calor. Debido a que la excreción por la orina de la D-xilosa por ingesta oral (un azúcar absorbido en forma pasiva), no se ve afectada por un ejercicio similar, estos investigadores postularon que el ejercicio reduce el flujo sanguíneo al intestino, y que éste reduce la absorción intestinal activa, pero no la pasiva.
Sin embargo, las investigaciones más recientes no pudieron confirmar estos primeros resultados, y aún sugirieron que la absorción gastrointestinal de soluciones azucaradas puede ser acelerada durante la actividad física intensa (100, 107, 108, 120). A la luz de estas contradicciones, nos parece adecuado hacer un balance entre los estudios recientes y pasados sobre el vaciado gástrico, para determinar las limitaciones del ejercicio y la ingesta de soluciones azucaradas. En 1967, Astrand (2) examinó el consumo de una solución de 40% de glucosa, con sabor a limón, en un grupo de esquiadores de cross-country de Suecia, cada intervalos de 5 a 6 km (25 minutos), a través de una carrera de 50 km. A pesar de que el volumen total de fluido ingerido excedía 1 litro, representando 400 g de azúcar en casi 4 horas de esquí, ninguno de estos hombres experimentaron alguna sensación de llenado gástrico o malestar. En forma similar, Costill y cols. (39) observaron que los maratonistas podían vaciar el 83 %-90 % de una solución de glucosa y electrolitos (2000 ml, 4,4 g % de glucosa, 20 mmol/l de Na+, 15 mmol/l de K+), la que era ingerida a intervalos de 5 min. durante una carrera en cinta ergométrica, durante 2 horas (al 70 % VO2 máx.). en reposo, la tasa de vaciado gástrico parece estar afectada por el volumen, la temperatura, la osmoralidad, el contenido de azúcar y el contenido calórico de la bebida (20,25). Estudios realizados por Costill y Saltin (25) indicaron que estos factores no son afectados durante el ejercicio, mientras que las demandas energéticas sean menores a 60 % - 70 % del VO2 máx. Por sobre de ese nivel de esfuerzo, hay un retraso estable del vaciado gástrico (10,44). Se debe observar que todos estos estudios fueron realizados con un tubo o sonda nasogástrica, colocado antes del ejercicio y previo a la ingesta de las soluciones. Este procedimiento generalmente causa algún displacer y puede haber influenciado en las tasas de vaciado gástrico. Cuando a los sujetos se les permite realizar ejercicios y consumir líquidos sin la molestia del tubo nasogástrico, la tasa de vaciado gástrico parece ser sustancialmente mayor.
Más recientemente, Coyle y cols. (44) compararon la tasa de vaciado de tres soluciones disponibles comercialmente vs. una solución placebo con agua. Ellos observaron que las soluciones más altas en carbohidratos (4,5 g glucosa-fructuosa/100 ml) demoraban significativamente la tasa de vaciado gástrico. Foster y cols. (59) también observaron que las soluciones que contenían mayores cantidades de CHO se vaciaban más lentamente que el agua. Sin embargo, se observó que una solución de 5 g/ 100 ml (5 %) de polímero de glucosa (maltodextrina) se vaciaba más rápido que una concentración similar de glucosa. Parece ser que la ventaja del mayor peso molecular del polímero y de su menor osmoralidad sobre el vaciado gástrico, sólo es experimentada cuando la concentración es de 5 g % o menor. En cualquier caso, se mostró que la tasa de suministro de CHO estaba inversamente relacionada con la concentración de la bebida (59).
Además de los polímeros de glucosa, la respuesta del vaciado gástrico también parece estar afectada por otros azúcares (74, 101). Mientras que la glucosa parece vaciarse en forma lineal, se ha mostrado que la fructuosa abandona el estómago en una tasa exponencial (101). Las soluciones de glucosa se vaciaban a una tasa constante de 0,1 g/min, mientras que se observó que la fructuosa se vaciaba en forma rápida durante los primeros 20 minutos luego de la ingesta , dando paso a una tasa promedio de vaciado de 0,2 g/min.
Se sugirió que una combinación de polímero de glucosa y de fructosa podrían brindar una óptima reposición de fluidos y CHO (22, 74). Seiple y cols. (121) compararon dos bebidas que contenían 3 g % de polímero de glucosa y 2 g % de fructosa vs. una bebida que contenía 5 g % de polímero de glucosa y 2 g % de fructosa. No observaron ninguna diferencia significativa en la tasa de vaciado gástrico entre las dos soluciones. Sin embargo, Neufer y cols. (103) observaron que durante 15 minutos de ejercicio en la cinta ergométrica, una solución de polímero de glucosa-fructosa (4,5 g % de maltodextrina; 2,6 g % de fructosa) se vaciaba más rápido que una que contenía 5,5 g % de maltodextrina y 2 g % de glucosa. Esto sugiere que la glucosa puede ejercer un mayor efecto inhibitorio sobre el vaciado gástrico que una concentración similar de fructuosa.
Contrariamente a estas observaciones, Mitchell y cols. (100) no observaron diferencias entre las tasas de vaciado gástrico de tres soluciones diferentes de CHO que contenían combinaciones de 5 % - 7,5 % de maltodextrinas, glucosa, fructosa, y sacarosa. En promedio, el 94 % - 96 % de las bebidas ingeridas eran vaciadas del estómago durante el período de 2 horas de ejercicio intermitente. Adicionalmente, Segal y cols. (120) reportaron que no hubo diferencias en el tránsito gastrointestinal entre una solución placebo con agua con sabor vs. una solución de 18 g % de glucosa, tomados durante ejercicio intermitente al 74 % del VO2 máx. Por lo tanto, el flujo de salida de soluciones de CHO del estómago, durante ejercicios prolongados, no parece ser un gran problema, como se sugirió en los primeros estudios. A pesar de que hay una variedad de reportes anecdóticos sobre malestar gástrico, asociado con la ingesta de líquidos durante el ejercicio, estos problemas pueden ser complicaciones individuales aisladas.
INGESTAS DE AZÚCAR INMEDIATAMENTE ANTES DEL EJERCICIO
Ha sido bien establecida la importancia de una dieta rica en CHO durante los días previos a un evento extenuadamente de resistencia. Sin embargo, las ingestas de CHO, entre los 15 minutos hasta quizás 4 horas antes del ejercicio, pueden tener un efecto perjudicial sobre el rendimiento (43,58). Como se muestra en la Fig. 7, las ingestas de glucosa durante los 60 minutos antes de comenzar un ejercicio pueden provocar un aumento dramático en la insulina y en la glucosa sanguínea, seguido de un incremento en la oxidación de CHO y, consecuentemente, una brusca caída de la glucosa sanguínea dentro de los primeros minutos del ejercicio (5, 32, 58, 88). Los niveles de glucosa sanguínea están reducidos a pesar del hecho de que los niveles plasmáticos retornen rápidamente al nivel normal, cuando se inicia el ejercicio (19). Coyle y cols. (43) han sugerido que los niveles de glucosa disminuyen debido a los efectos antilipolíticos de la insulina en la célula grasa, y al efecto persistente de la insulina sobre los hepatocitos y las células del músculo.
Sin embargo, estudios recientes han mostrado que el consumo de azúcar, en la forma de una golosina sólida unos 30 minutos antes del ejercicio, mantiene la glucosa sanguínea (99). El uso de glucógeno muscular y la oxidación total de CHO no se vieron afectados por la alimentación pre-ejercicio. En forma similar, Devlin y cols. (49) observaron que una merienda (43 g de CHO, 9 g de grasa y 3 g de proteína) ingerida 30 minutos antes del ejercicio, no perjudicaba el rendimiento de resistencia. De manera contraria a estudios previos, estas dos investigaciones utilizaron ejercicios intermitentes, los que podrían afectar la tasa de liberación de glucosa hepática y la captación de glucosa por parte de los músculos que se contraen.
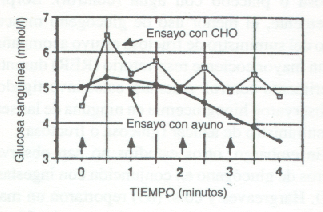
Figura 7. Glucosa sanguínea durante 4 horas de civilismo al 50 % VO2
máx., sin y con ingesta de CHO, cada hora de intervalo. Las flechas hacía arriba
indican el momento de las ingestas.
Se observó que la ingesta de fructosa durante los minutos previos antes del ejercicio produce un menor aumento dramático en la glucosa y la insulina plasmática (47, 64, 88, 89, 99). Además, la fructuosa no parece reducir los niveles de ácidos grasos libres circulantes al mismo nivel que la glucosa (89, 99). Koivisto y cols. (89) observaron una alta relación entre la glucosa sanguínea pre-ejercicio y la subsiguiente disminución en glucosa sanguínea durante el comienzo de la actividad muscular. Debido a que la respuesta insulínica a la fructuosa es menos pronunciada que la observada luego de la ingesta de glucosa o sucrosa, se sugirió que ésta podría ser un mejor alimento pre-ejercicio.
Levine y cols. (94) describieron que había un ahorro de glucógeno muscular luego de una ingesta pre-ejercicio de una solución que contenía 75 g de fructosa, en comparación con una dosis igual de glucosa o placebo con agua (control). Sorprendentemente, el menor uso de glucógeno muscular luego del suministro de fructosa estuvo acompañado por un mayor cociente respiratorio (RER) durante el experimento control. Además, estos investigadores no observaron hipoglucemia en ninguna de las series con suministro de azúcar (glucosa o fructosa).
Sin embargo, otros estudios no han observado ahorros de glucógeno en conjunción con ingestas de CHO. Hargreaves y cols. (65) reportaron un mayor uso glucogénico luego de la ingesta de 50 g de fructosa, vs. lo observado luego de una serie de ejercicio control. Una dosis equivalente de glucosa produjo un mayor uso glucogénico que las series, tanto con fructosa como placebo. En oposición al estudio de Levine y cols. (94), Hargreaves y cols. (65) observaron una caída en la glucosa sanguínea a menos de 3,5 mmo/l durante la serie con glucosa. Una diferencia importante entre estos dos estudios es que los sujetos utilizados por Levine y cols. (94) siguieron un régimen de ejercicio a baja intensidad, dieta rica en CHO 3 días antes de cada esfuerzo, y consumieron una comida rica en CHO, 4 horas antes del ejercicio. Los sujetos en el estudio de Hargreaves y cols. (65) ayunaron (12 horas), y no se los restringió a una dieta rica en CHO en los días precedentes al experimento. En un estudio más reciente, Hargreaves y cols. (66) demostraron que una ingesta de 75 g de glucosa o fructosa antes del ejercicio, no daba como resultado una diferencia significativa en el rendimiento, o en la cantidad de glucógeno muscular utilizado. Estas observaciones fueron confirmadas posteriormente por Koivisto y cols. (88) quienes examinaron los efectos metabólicos y hormonales de una ingesta de fructosa o glucosa de 75 g, 45 minutos antes del ejercicio (a 55 % del VO2 máx.). A estos sujetos se les suministró una dieta rica en CHO durante 2 días, antes del ejercicio experimental. Como se observó anteriormente, este estudio notó un menor incremento en la insulina y glucosa sanguínea luego de la ingesta de fructosa que la de glucosa. Además, el consumo de fructosa no provocó alteraciones en la utilización de glucógeno en comparación con las series de glucosa o placebo.
Decombaz y cols. (47) estudiaron las respuestas metabólicas durante 60 minutos de ejercicio, luego de la ingesta de soluciones de glucosa y fructosa marcadas naturalmente con C 13. Las respuestas hormonales (insulina) y de la glucosa sanguínea, a estas ingestas fueron similares a los estudios previos (64). En concordancia con el estudio de Hargreaves y cols. (64), como resultado de la ingesta de azúcar no aumentó el rendimiento en ejercicios de velocidad, al final de dos horas de ejercicio. El uso de glucógeno durante la serie con fructosa fue de 67 mmol/kg, en comparación con 97 mmol/kg en la serie control.
Esta diferencia no fue estadísticamente significativa (P>0,05). Desafortunadamente, los valores de glucógeno pre-ejercicio difirieron en 33 mmol/kg. Debido a que la tasa de utilización glucogénica durante el ejercicio depende de la concentración inicial (42,61), las diferencias notadas en el estudio de Decombaz y cols. (64) podrían haberse debido al nivel de glucógeno pre-ejercicio. Por lo tanto, no es tan clara la ventaja de la fructosa sobre la glucosa. Se debe observar que grandes ingestas de fructosa (> 75 g) pueden producir una diarrea osmótica debido a una incompleta absorción intestinal (46,133). Además, se ha visto que el consumo de fructosa eleva el lactato sanguíneo, lo que podría tener algún efecto sobre el balance ácido-base y el rendimiento, y podría reflejar una mayor tasa de utilización del glucógeno muscular (46).
Se puede destacar un punto final acerca del metabolismo de la ingesta de CHO antes del ejercicio, a partir de los datos de Satabin y cols. (119). Ellos examinaron la tasa de oxidación de CHO durante un ejercicio de resistencia (al 60 % del VO2 máx.), una hora después de ingerir diferentes alimentos isocalóricos (400 kcal) que contenían ya sea glucosa, triglicéridos de cadena media (TCM), o triglicéridos de cadena larga (TCL). Se efectuó una cuarta evaluación luego de ayunar durante la noche. El metabolismo de estos nutrientes se calculó usando glucosa (U-13C), octanoato (1-13C), y palmitato (1-13C), agregados a la comida. Estas ingestas no tuvieron ningún efecto sobre el tiempo de ejercicio antes de llegar al agotamiento exhaustivo, el que promedió en 116 ± 11 minutos. Durante este período, se oxidó el 80 % de la glucosa, el 45 % de los TCM, y el 9 % de los TCL. Por lo tanto, a pesar de las variaciones en los usos metabólicos de estos combustibles, las ingestas de diferentes CHO y grasas parecieron no tener ninguna influencia sobre el rendimiento de resistencia.
Hasta aquí, hemos considerado sólo la ingesta de azúcar durante los 30-60 minutos antes de una serie de ejercicios. Otro aspecto interesante para todos aquellos que estamos en los deportes es, ¿“cuándo se debe consumir una comida pre-competitiva”?. Debido a que el ayuno de la noche depletará dramáticamente el suministro de glucógeno hepático, las comidas pre-competitivas son esenciales para el rendimiento de resistencia (105). Coyle y cols. (43) observaron que una alimentación rica en CHO (140 g), administrada 4 horas antes de 105 minutos de ciclismo al 70 % del VO2 máx., producía un nivel inicial más alto de glucógeno muscular (42 %) comparado con el nivel inicial, luego de 16 horas de ayuno. A pesar de que esta ingesta fue consumida 4 horas antes del ejercicio, aún se vio una rápida caída en los niveles de glucosa sanguínea y una aceleración en la tasa de oxidación de CHO a lo largo del ejercicio. A pesar de los mayores niveles iniciales de glucógeno muscular (42 %) en la serie con CHO, los niveles glucogénicos al final del ejercicio fueron similares a aquellos observados con la serie en ayuno. Debido a que los sujetos parecían “quemar” glucógeno más rápido cuando comenzaban con valores glucogénicos elevados, uno podría esperar poca ventaja en el rendimiento a partir de esta ingesta pre-ejercicio.
Por el contrario, Neufer y cols. (104) han observado una mejora en el rendimiento cuando se consumía una comida liviana en CHO (200 g de CHO) , 4 horas antes del ejercicio, además de comer una golosina (45 g CHO), inmediatamente antes del esfuerzo. Un grupo de ciclistas varones pedaleó durante 45 minutos al 77% del VO2 máx., en bicicleta ergométrica, y luego durante 15 minutos en el mismo ergómetro. La cantidad total de esfuerzo realizado durante los 15 minutos fue significativamente mayor cuando se habían consumido CHO antes del ejercicio (194.735 ± 9.448 Nm), que luego de una noche de ayuno (159.143 ± 11.407 Nm). A pesar de que no se encontraron diferencias en la cantidad de glucógeno utilizado durante las series con CHO y en ayuno (53,9 ± 3,3 y 56,4 ± 3,3 mmol/kg, respectivamente), la tasa de oxidación de CHO fue significativamente mayor durante el ejercicio de la serie con CHO (4,45 ± 0,14 g/min), en comparación con el tratamiento en ayuno (2,94 ± 0,28 g/min). A pesar de que no es totalmente clara la explicación precisa de la mejora en el rendimiento, con la ingesta de CHO combinada con los alimentos, se sugirió que las ingestas ayudan a mantener las reservas energéticas hepáticas y el mantenimiento de la glucosa en sangre para el metabolismo muscular.
En un esfuerzo por determinar la contribución de una ingesta de glucosa oral al metabolismo muscular, Jandrain y cols. (81) estudiaron a cinco sujetos a los que se les suministraron 100 g de glucosa (C-13), 3 horas antes de una serie de ejercicios de 4 horas. Del total de CHO oxidados durante las 4 horas, 67,5 ± 9,4 g fueron obtenidos del consumo de CHO pre-ejercicio. Se concluyó que 100 g de glucosa administrados 3 horas antes de una serie de 4 horas de ejercicio de intensidad moderada, representa una fuente energética fácilmente disponible para el ejercicio subsiguiente, que tiende a inhibir la hipoglucemia por esfuerzo.
La discusión anterior presenta un panorama algo confuso de los efectos del consumo de CHO antes del ejercicio sobre las concentraciones de glucosa, oxidación de CHO y rendimeinto. Sin embargo, los resultados se pueden describir mejor en la Tabla 5. A pesar de que algunos estudios han sugerido que las ingestas pre-competitivas (0-5 minutos antes del ejercicio) pueden causar una reducción en el uso de glucógeno muscular, estos resultados no han sido observados en forma consistente. Son necesarias investigaciones adicionales para clarificar la interacción entre la ingesta de CHO, la hipoglucemia y el rendimiento.
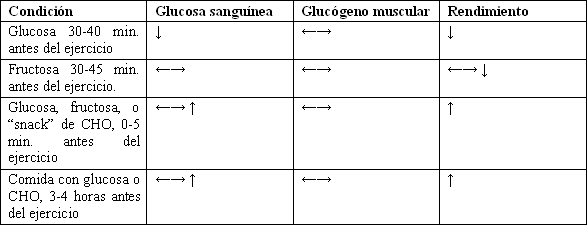
Tabla 5. Efectos de la ingesta de CHO pre-ejercicio sobre la glucosa
sanguínea, el uso de glucógeno muscular y el rendimiento. Todas las series
fueron comparadas con esfuerzos control sin ingesta (ayuno).
(**) Las flechas indican incremento ↑, disminución ↓, o ningún cambio ←→, en
comparación con las condiciones en ayuno.
INGESTAS DE AZÚCAR DURANTE EJERCICIOS PROLONGADOS
La aparición de hipoglucemia durante el pedestrismo y ciclismo de fondo ya fue observada en las primeras décadas de este siglo, y desde entonces fue considerada como uno de los factores responsables de la fatiga en eventos de larga duración (22,95). Sin embargo, Felig y cols. (52) concluyeron que la hipoglucemia durante esfuerzos prolongados no afectada al rendimeinto, ya que su prevención no demorada consistentemente la fatiga. Si bien el ejercicio prolongado hasta la fatiga precipitaba la hipoglucemia (< 2,5 mmol/l) en el 30 % - 40% de los sujetos, la ingesta de glucosa durante el ejercicio no retrasaba el agotamiento, o alteraba las sensaciones subjetivas al esfuerzo. Estos resultados de Felig y cols. (52) son contrarios a otros reportes sobre los efectos de las ingestas de CHO durante ejercicios prolongados (42, 45, 54, 77, 78, 100, 104). Sin embargo, esto no infiere que elevados niveles de glucosa sanguínea aseguren mejorías en el rendimiento (19,56). Un estudio realizado por Flynn y otros (56) demostró que el rendimiento durante un esfuerzo de 2 horas, a una intensidad autoimpuesta, fue similar cuando los sujetos recibieron un placebo, o una de las tres diferentes bebidas de CHO. Los sujetos en esta investigación tenían niveles de glucosa sanguínea significativamente elevados durante las series de CHO y comenzaban el ejercicio con altos valores de glucógeno (180 mmol/kg). Es posible que la demanda de fuentes exógenas de CHO fueran compatibles con las reservadas del glucógeno muscular y hepático durante el ejercicio (61).
Ivy y cols. (77) reportaron un aumento significativo en la producción de esfuerzo sobre los 30-40 minutos finales de una serie de ciclismos de 2 horas, cuando los sujetos ingerían azúcar cada intervalos de 15 minutos durante el ejercicio. Durante una serie control, la glucosa sanguínea y la insulina disminuyeron en forma constante a lo largo del ejercicio alcanzando valores medios respectivos de 3,9 mmol/ 1 y 5,1 uU/ml a las 2 horas. Por otro lado, los consumos de azúcar produjeron un aumento, tanto en la glucosa (4,4 - 6,0 mmol/l) como en la insulina (10 - 14 uU/ml), que permanecieron elevadas a través de la actividad (Fig. 7). Como en el estudio de Felig y cols. (52), los efectos de la ingesta de azúcar sobre la percepción subjetiva al esfuerzo y la fatiga general, fueron inconsistentes entre los sujetos.
Debido a que la glucosa sanguínea sirve como una de las fuentes de CHO para el metabolismo muscular durante el ejercicio, es probable que la hipoglucemia y el agotamiento coincidan sólo cuando otras fuentes endógenas de CHO también estén depletadas. Bajo estas circunstancias, las ingestas de azúcar podrían contribuir más al “pool” energéticos total demorado, por lo tanto, el comienzo de la fatiga. Sin embargo, no hay datos publicados que apoyen el concepto que el consumo de CHO durante el ejercicio reduzca la depencia del músculo en sus propias reservas glucogénicas. Por otro lado varios estudios han demostrado que la glucosa exógena (21,5 - 172 g) consumida en 2-4 horas de ejercicio aumenta la tasa de oxidación de CHO contribuyendo la ingesta de CHO entre 5 % y 55 % del total de CHO oxidado (31, 110, 126). Se ha notado que a intensidades de esfuerzo relativamente bajas (22 % - 51 % del VO2 máx.), la oxidación de glucosa exógena estaba linealmente relacionada con la intensidad del ejercicio (110). Sin embargo, a mayores intensidades había más demanda de las fuentes endógenas de CHO que de la glucosa ingerida.
Existe consenso general acerca que los CHO suministrado durante el ejercicio mejorarán el rendimiento de resistencia. Mitchell y cols. (100) observaron que el rendimiento en velocidad, al final de 2 horas de ejercicio intermitente, era mejorado de igual manera con 33,5; 39,4; 50,1 g de CHO ingeridos cada hora (gCHO/h), comparados con un esfuerzo con placebo (agua). Del mismo modo, Hargreaves y cols. (64) demostraron que la ingesta sólida (golosina) de 42,5 g CHO/h mejoraba el rendimiento en velocidad, luego de 4 horas de ejercicio intermitente. Menores dosis de CHO, por el contrario, no pudieron mejorar el rendimiento. Fielding y cols. (98) reportaron que una menor dosis de CHO (21,5 g/h) mejoraba el tiempo en velocidad de los sujetos, luego de 4 horas de ciclismo, cuando ellos consumían CHO cada 30 minutos durante la serie (10,75 g/30 min). Sin embargo, cuando se les daba 21,5 g cada hora, la mejora en el rendimiento en velocidad no llegaba a ser estadísticamente significativa (P < 0,05). Estos datos sugieren que una dosis de 21,5 g/h podría ser la cantidad mínima de CHO para generar una mejoría en el rendimiento deportivo. Debido a que la mayoría de las otras investigaciones han administrado dosis considerablemente mayores de CHO, no es sorprendente que hayan observado beneficios consistentes en la resistencia, con combinaciones de ingestas dadas inmediatamente antes y durante el ejercicio (42, 45, 77, 78).
La forma de los CHO ingeridos durante una serie de ejercicio no parece ser un problema mayor. Tanto las ingestas de CHO líquidos como sólidos, son igualmente bien toleradas y asimiladas durante el ejercicio prolongado (1-4 horas) (42, 45, 64, 104). Neufer y cols. (104), por ejemplo, han mostrado que suministrar CHO, ya sea en forma líquida o sólida, mejoraba el rendimiento de resistencia en un grado similar, a pesar de que estas ingestas no tenían efectos sobre la tasa de uso del glucógeno muscular.
Los procesos digestivos y destinos metabólicos de diferentes azúcares fueron examinados, en reposo y durante ejercicios prolongados (45, 56, 77, 88, 107, 129). Desde 1920, se propuso que la glucosa era absorbida en forma más rápida que el almidón, polisacárido de la glucosa (6). Como se muestra en la Fig. 8 en condiciones de reposo, los sujetos parecen experimentar un aumento más pronunciado en la glucosa sanguínea luego de la ingesta de 70 g de glucosa, comparado con la disminución de cantidad similar de almidón. Sin embargo, Whalqvist y cols. (129) han observado que esta diferencia está afectada, más probablemente, por la forma alimenticia (líquida vs. sólida) que por las diferencias en la longitud de la cadena de glucosa. En estudios sobre ingesta de glucosa C-14 y fructosa C-14, en reposo y en ejercicio, se ha observado que comienzan a aparecer en la sangre 5-7 minutos luego del consumo (27). Esto sugiere que cualquier diferencia en la tasa de vaciado gástrico y/o absorción de estas moléculas de azúcar debe ser pequeña y parece no tener efecto sobre el suministro a los músculos. También se debe notar que, a pesar de la forma de CHO ingerida (glucosa, fructosa, o polímeros de glucosa), la glucosa sigue siendo la forma principal de azúcar sanguínea (99 % del CHO total). Los intentos para determinar la influencia de las soluciones de glucosa, fructosa, y polímeros de glucosa sobre el rendimiento deportivo no han mostrado relevantes diferencias sobre el mismo entre las diferentes ingestas (45, 56, 77, 88). Por lo tanto, no parece hacer ninguna ventaja principal de dar una forma de CHO sobre otra, sobre la capacidad para mejorar el rendimiento durante ejercicios de resistencia.
Sin importar el tipo de azúcar ingerido, todos parecen convertirse en glucosa durante el proceso de absorción intestinal o través del hígado, sin una diferencia medible en la tasa de aparición en la sangre.
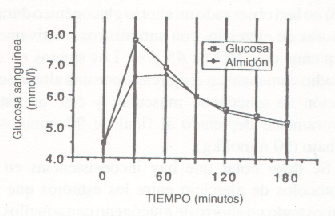
Figura 8. Test de tolerancia con glucosa oral y con almidón (70 g), en
seis hombres sanos (ref. 27).
A pesar de que en general se concuerda en que la ingesta de CHO durante el ejercicio prolongado mejora el rendimiento, el mecanismo responsable de esta mejoría es discutible. Se sugirió que el consumo de CHO puede producir un ahorro de glucógeno muscular, aunque otros investigadores apoyan la idea que el CHO es utilizado directamente como combustible, solamente luego de que los niveles de glucógeno muscular son sustancialmente depletados (42,64). Un estudio realizado por Bagby y cols. (8) demostró que se producía un ahorro de glucógeno muscular y hepático como resultado de la infusión de glucosa, durante el ejercicio con ratas. Los suministros de glucosa también mejoraron el tiempo hasta el agotamiento en estos animales. En forma similar, también se observó en seres humanos que la infusión de glucosa demoraba la tasa de deplección glucogénica durante el ejercicio (11,24). La ingesta oral de CHO (42,5 g CHO/h) en humanos, también reducía la tasa de uso de glucógeno muscular (64).
El hecho de que el uso de glucógeno durante el ejercicio pueda ser reducido con las ingestas de CHO, deja abierta la posibilidad que la resíntesis pueda ocurrir durante el ejercicio, o durante los intervalos de descanso incluidos en los esfuerzos intermitentes (23). Constable y cols. (24) han demostrado que, en ratas, la replección glucogénica puede ocurrir durante ejercicios moderados. Sin embargo, en seres humanos no ocurre durante ejercicios al 50 % del VO2 máx. (18). Por lo tanto, Coyle y cols. (42) reportaron que la tasa de uso de glucógeno muscular era similar, tanto en esfuerzos con suministro de placebo como de CHO, luego de 3 horas de ejercicio. Sin embargo, los sujetos fueron capaces de continuar el esfuerzo durante 60 minutos adicionales cuando habían ingerido CHO. Desafortunadamente, este estudio no utilizó un diseño al azar (randomizado), lo que pudo haber influenciado en la interpretación de los resultados por parte de los autores. Flynn y cols. (56) no han observado un ahorro glucogénico durante 2 horas de ejercicio, con suministros relativamente pequeños de CHO (< 45 g/h). Los sujetos en este estudio comenzaban el ejercicio con una alta concentración de glucógeno muscular, y éste no estaba severamente depletado al final de 90 minutos de trabajo (90 mmol/kg).
Se debe señalar que hay inconsistencias en los protocolos de ejercicio entre los estudios que han demostrado un ahorro de glucógeno, con aquellos que no lo han producido. Se ha demostrado un ahorro glucogénico cuando se usa esfuerzo intermitente (11, 99), pero no cuando se emplearon actividades continuas (42, 56, 104). Ahlborg y Felig (5) han medido el “turnover” o reversibilidad de glucosa durante el ejercicio, con suministro de un bolo de CHO luego de 90 minutos de actividad. Ellos observaron que el consumo de glucosa por los músculos de la pierna, durante el pedaleo no era afectado por la glucosa exógena. Sin embargo, este ejercicio fue realizado a sólo el 30 % del VO2 máx., en sujetos desentrenados. Tal esfuerzo aún en personas no entrenadas, no produciría una gran deplección glucogénica. Esta sola ingesta de un bolo CHO dada luego de 90 minutos de ejercicio, hace que la comparación de los resultados de Haegreaves y cols. (64), y Coyle y cols. (42) sea dificultosa.
Las mediciones de las diferencias arterio-venosas (dif a-v) en la pierna y/o en territorio esplácnico, no permiten una determinación de las contribuciones energéticas de los suministros exógenos de CHO. Estudios recientes utilizando glucosa marcada con isótopos radioactivos en el C-13 han hecho que esta determinación sea posible (111, 112). Estas investigaciones han confirmado los resultados de Ahlborg y Felig (5). Sugiriendo que en la glucosa ingerida es fácilmente disponible para la oxidación, durante una serie de ejercicio. Sin embargo, aún no son claros los caminos y destinos exactos de los CHO administrados en forma oral.
Por lo tanto, hay un consenso general que las ingestas de CHO, durante ejercicios exhaustivos de resistencia, que duran una hora o más, mejoran el rendimiento. A pesar de que hay resultados conflictivos acerca del efecto de estos suministros sobre el uso de glucógeno muscular, hay evidencia sustancial que indica que la ingesta de CHO, ya sea como una sola ración al comienzo del ejercicio, o como consumo frecuente, a lo largo de la actividad, contribuyen marcadamente a la oxidación de CHO durante la misma. Las comparaciones de las ingestas con glucosa, fructosa y sucrosa durante el ejercicio, no han podido demostrar ninguna diferencia entre sus tasas de oxidación, o la contribución de estos azúcares al rendimiento de resistencia.
RESÍNTESIS GLUCOGÉNICA LUEGO DEL EJERCICIO
La deplección del glucógeno muscular por el esfuerzo produce una marcada elevación en la actividad de la glucógeno-sintetasa, complejo enzimático crítico para la replección y almacenamiento del glucógeno muscular. La tasa de resistensis glucogénica luego de un ejercicio intenso está relacionada, en parte, con la actividad muscular de la glucógeno-sintetasa, el contenido de CHO en los alimentos y el trauma muscular experimentado durante el ejercicio (106, 109, 122). Sin activar primero este complejo enzimático por una deplección parcial del glucógeno muscular, aparentemente no se produce, o se produce muy poco, almacenamiento glucogénico. Además, una dieta rica en CHO no aumentará las reservas glucógeno muscular por encima de lo normal (80-120 mmol/kg), a menos que la misma esté precedida por una deplección glucogénica y aun aumento concomitante en la actividad de la sintetasa. Este punto fue demostrado en primer lugar por Bergstrom y Hultman en 1966 (12). Como se muestra en la Fig. 9 la práctica de pedaleo con una pierna disminuyó el glucógeno solo en la pierna en ejercicio, comparada con la pierna contralateral que estuvo inactiva. Luego de ello cuando el sujeto consumió una dieta rica en CHO durante tres días, solo la pierna en ejercicio mostró una curva de superconpensación de las reservas glucógena muscular. Por lo tanto, la tasa de resíntesis glucogénica luego de un ejercicio intenso, parece estar relacionada con la actividad muscular de la glucógeno-sintetasa y el contenido de CHO de la dieta (109).
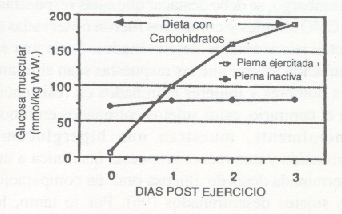
Figura 9. Efecto del ejercicio previo y deplección glucogénica
generada (pierna en ejercicio) sobre la tasa de resíntesis de glucógeno
muscular. Notar que la pierna que no realizó ejercicio (pierna inactiva) no se
benefició de la dieta rica en CHO, en cuanto a nivel de resíntesis de glucógeno
(modificado de la Ref. 12)
Estudios recientes han mostrado que el daño en la fibra muscular asociado con el ejercicio excéntrico, (elongación forzada del músculo activo, por ej., en pedestrismo), pueden demorar la resíntesis glucogénica (106, 122). Se ha observado que la demora en la reacumulación glucogénica, luego de un ejercicio excéntrico intenso, persiste durante 7-10 días. Por ejemplo, luego de una maratón el glucógeno muscular pueden disminuir más de 150 mmol/kg. A pesar de seguir ingiriendo CHO (400 g/día) durante los 7 días siguientes, el glucógeno muscular sólo recuperó el 50 % del nivel pre-competitivo. Sin embargo, cuando no hay daño muscular (por ej. en ciclismo), la resíntesis glucogénica es proporcional al contenido de CHO en la alimentación (41).
Los primeros estudios sobre las reservas de glucógeno muscular durante varios días de entrenamiento de resistencia en carrera, concluyeron que se producía sólo una resíntesis parcial cuando los sujetos consumían una dieta mixta conteniendo 250-350 g de CHO/día (37). Como se muestra en la Fig. 10, hubo una disminución consistente, día por día, en el contenido glucogénico muscular (vasto lateral), a pesar de la ingesta de CHO. Sin embargo, durante un régimen similar de entrenamiento (en ciclismo), nosotros hemos notado que una dieta rica en CHO (550-600 g/día) restauraba en forma efectiva el glucógeno muscular, en las 22 horas entre sesiones de entrenamiento (28). Mac Dougall y cols. (97) observaron que luego de un ejercicio que disminuía el glucógeno muscular al 28 % de su valor pre-ejercicio, una dieta mixta (3100 kcal/24 h) producía una resíntesis completa dentro de las 24 horas (Fig. 11). Sin embargo, ellos notaron que dentro de este período de tiempo, la tasa de resíntesis se podría haber acelerado con una ingesta de CHO mayor que la normal. Por lo tanto, el grado y la tasa de resíntesis glucogénica dependen de un número de factores, entre los cuales se encuentran la severidad del trauma muscular, la magnitud de la deplección glucogénica, y la cantidad de CHO en dieta del individuo.
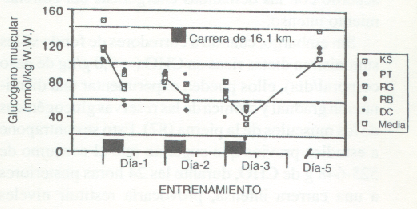
Figura 10. Deplección del glucógeno muscular en tres días sucesivos de
entrenamiento intenso. Los sujetos consumieron una dieta mixta que contenía el
55% de las kcal, provenientes de los CHO (ref. 27).
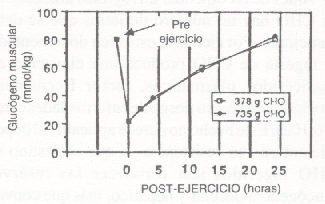
Figura 11. Concentraciones medias del glucógeno muscular en dos
regímenes alimenticios, luego de un ejercicio intenso. Notese que a pesar de la
diferencia en la ingesta de CHO, no hubo diferencias en la tasa de resíntesis
del glucógeno muscular (modificado de la ref. 97.).
Recientemente, en un estudio realizado en este laboratorio (35), se ha ilustrado la importancia de los CHO suministrados en la dieta de los atletas. Doce nadadores altamente entrenados fueron estudiados antes, durante y después de 10 días consecutivos de entrenamiento intenso, con el propósito de determinar los efectos del sobreentrenamiento. Como resultado del aumento en las demandas de entrenamiento, los nadadores experimentaron fatiga muscular local y dificultad para completar las sesiones. Cuatro de los nadadores que fueron clasificados como sobreentrenados, no pudieron mantener la velocidad normal de nado, y fueron incapaces de completar varias de las sesiones. Se observó que estos sujetos tenían valores de glucógeno muscular significativamente más bajos (en el músculo deltoides posterior), producto de una ingesta anormalmente baja de CHO. Los resultados de esta investigación sugieren que algunos nadadores pueden experimentar una fatiga muscular crónica como resultado de la falla de un consumo suficiente de CHO, que esté de acuerdo con las demandas energéticas del entrenamiento intenso.
Sin embargo, cuando a corredores de fondo se les suministran dietas ricas en CHO (~ 9,0 g/kg de peso corporal/día), ellos pueden experimentar una disminución gradual de las reservas glucogénicas de los músculos de la pierna (87). Esto se contrapone a estudios previos que sugerían que el consumo de 525-648 g de CHO, durante las 24 horas posteriores a una carrera intensa, provocará restituir niveles normales de glucógeno (41). Por lo tanto, aparentemente, se necesitan más investigaciones para determinar las interacciones entre la modalidad de entrenamiento (pedestrismo vs. natación vs. ciclismo), con la intensidad del mismo y con los CHO en la dieta, sobre la resíntesis del glucógeno muscular.
Antes de recomendar un régimen alimenticio rico en CHO hay un número de items que se deberían mencionar. Por ejemplo, está bien documentado que la ingesta de CHO produce una elevación en los triglicéridos plasmáticos, factor frecuentemente asociado con un alto riesgo de enfermedades cardíacas (86, 102). Este hecho no parece aplicable al deportista que entrena en resistencia ya que el destino de los CHO ingeridos son fortalecer las reservas de glucógeno muscular y hepático, más que convertirse en lípidos. Por ejemplo, los maratonistas normalmente tienen bajos niveles de triglicéridos (< 0,4 g/l), a pesar de que sus dietas contienen 60 % - 70 % de CHO (40, 41). Junto con esta observación se debe mencionar que hay marcadas diferencias entre los destinos metabólicos de los CHO simples (glucosa) y de los complejos (almidón). Las evaluaciones de los valores de colesterol y triglicéridos, mostraron un incremento de los mismos, cuando la dieta contenía las mismas calorías en forma de almidón. La absorción de una gran dosis de glucosa, que provoca una hiperglucemia temporaria, puede sobrecargar la vía de Embden-Meyerhof e imponer una carga mayor en el “shunt” (desviación) hexosamonofosfato. Esto favorecería la producción de grandes cantidades de NADPH, tendiendo a incrementar la formación de ácidos grasos libres y colesterol. Los CHO complejos, tales como el almidón, producen un menor uso del “shunt” hexosamonofosfato debido a que provocan un menor aumento de glucosa sanguínea y de insulina (27). Sin embargo, se debe destacar que estas respuestas a los CHO simples y complejos fueron observadas en sujetos relativamente desentrenados. Sería una especulación asumir que las respuestas sean similares para hombres y mujeres entrenados en resistencia. Por el contrario, estos sujetos entrenados en fondo, generalmente, muestran una hiperglucemia disminuída y una menor respuesta insulínica a una determinada dosis de glucosa oral, en comparación con sujetos desentrenados (96). Por lo tanto, los atletas de resistencia demuestran una mayor tolerancia a los CHO, desviando la mayor parte de tales ingestas a reservas glucogénicas, con poca perturbación sobre sus lípidos.
En vista de estas diferencias en los CHO simples y complejos, uno podría anticipar una diferencia en la tasa y cantidad de resíntesis glucogénica, luego de dietas ricas en glucosa o almidón. Los primeros estudios de Bergstrom y Hultman (13) mostraron que la infusión de glucosa y fructosa, en hombres haciendo ejercicio producían casi la misma resíntesis glucogénica con el uso de ambas formas de azúcares. Más recientemente, hombres bien entrenados, que ingirieron dietas ya sea de glucosa o almidón (70 % de las calorías) durante dos días, luego de una serie intensa de ejercicios, tuvieron poca diferencia en la resíntesis glucogénica (41). Sin embargo, hubo una tendencia que revela que la dieta con almidón producía una mayor reserva glucogénica, luego de dos días de descanso. Se necesitan realizar investigaciones adicionales para confirmar estos resultados acerca de la mejora en la reserva glucogénica con almidón.
Varios investigadores (17, 23) han hecho comparaciones entre las resíntesis glucogénicas con ingesta de glucosa, fructosa, y sucrosa. Blom y cols. (17) compararon ingesta de glucosa, sucrosa, y fructosa (0,7 g/kg) suministradas cada hora, durante 8 horas. El glucógeno muscular fue evaluado inmediatamente después, y 8 horas luego del ejercicio intenso. La resíntesis glucogénica fue similar luego de las 8 horas, con ingesta de glucosa y sucrosa, pero se observó una tasa de almacenamiento significativamente más lenta luego del consumo de fructosa. Estos resultados fueron confirmados por Conlee y cols., quienes examinaron el efecto de ingestas de glucosa y fructosa sobre la resíntesis de glucógeno muscular en ratas luego de 1 hora de ejercicio. El glucógeno muscular se recuperó más rápido, durante las dos primeras horas de recuperación, en los animales alimentados con glucosa. Por otro lado, la resíntesis del glucógeno hepático se produce más rápidamente con ingestas de fructosa que de glucosa (105). Se cree que esto ocurre debido a que la fructosa es metabolizada principalmente en el hígado (134). Por lo tanto, mientras que la glucosa parece promover la resíntesis glucogénica, más rápidamente, luego de ejercicios intensos, el glucógeno hepático puede ser restaurado más rápido con ingestas de fructosa.
CARGA DE CARBOHIDRATOS
A pesar de que los estudios conducidos en los últimos años de la década del 60´ demostraron que la manipulación ejercicio-dieta podría duplicar las reservas de glucógeno muscular observadas normalmente en sujetos inactivos (4, 12, 14), Cristensen y Hansen (22) fueron los primeros investigadores en usar varias dietas de CHO para mejorar el rendimiento en pruebas de resistencia. Ellos observaron que los sujetos que consumieron una dieta rica en CHO, durante 3 días, desarrollaron cargas intensas de trabajo por más del doble de tiempo, que los hombres con una dieta rica en grasas. Anteriormente en este artículo se postuló que dietas diferentes podían influir marcadamente en las reservas de glucógeno muscular, y que un mayor contenido glucogénico mejoraba el rendimiento de resistencia. Basado en estudios de Bergstrom y cols. (14), Astrand (1) propuso que el plan ideal para alcanzar el máximo almacenamiento glucogénico (carga de glucógeno), en la preparación previa para una competencia de resistencia, sería realizar una serie intensa de entrenamiento, una semana antes de la competencia (ejercicio de deplección), seguida de 3 días de una dieta rica en grasas y proteínas. Esto mantenía bajos los niveles de glucógeno muscular y elevada la actividad de la glucógeno-sintetasa. De allí en adelante, el atleta consumía una dieta rica en CHO durante los días finales hasta la competencia. Se propuso que la intensidad y el volumen de entrenamiento durante esta semana se debía reducir para prevenir un consumo adicional de glucógeno muscular y permitir una “máxima” reserva glucogénica.
Se mostró que este régimen elevaba, en forma efectiva, el glucógeno muscular a valores por encima de 200 mmol/kg, más del doble de los niveles normales (80-100 mmol/kg), observados en sujetos inactivos que consumían sólo una dieta mixta. Los beneficios de este régimen para el rendimiento competitivo fueron demostrados subsiguientemente por Karlsson y Saltin (84). Utilizando un diseño “cruzado”, dos grupos realizaron la fase de deplección del régimen de llenado, y luego consumieron: a) una dieta rica en CHO (70 % de CHO; o b) una dieta mixta durante 3 días, antes de una carrera de 30 km. Los mejores rendimientos se observaron luego del régimen de carga de carbohidratos. Desafortunadamente, tres días de una ingesta baja de CHO produjo que los atletas se volvieran irritables, hipoglucémicos, e incapaces de entrenar. Además, el ejercicio de deplección realizado 7 días antes de la competencia puede no ser de gran interés para el atleta. Como se notó anteriormente, el trauma asociado con tales esfuerzos musculares pueden interferir con la resíntesis glucogénica, y podría también exponer al atleta a un número de lesiones por sobrecarga. Consecuentemente, Sherman y cols. (123) estudiaron un régimen de dieta menos drástico. Ellos observaron que cuando se utilizaba una dieta mixta, durante 3 días, en lugar de la fase pobre en CHO del régimen, el glucógeno muscular alcanzaba los mismos altos niveles como en la rutina descrita por Astrand (1). En la Fig. 12 se muestra una comparación entre el régimen alimenticio propuesto por Sherman y cols. (123) y por Astrand (1). Por lo tanto, parece que ni el ejercicio para la deplección glucogénica, ni los 3 días de dieta baja en CHO, son necesarios para generar una reserva máxima del glucógeno muscular. En nuestros estudios, nosotros hemos observado que todos los atletas entrenados en resistencia son capaces de alcanzar niveles de glucógeno muscular por encima de 190 mmol/kg, simplemente descansando 2-3 días y consumiendo mientras tanto una dieta rica en CHO ( 8 a 10 g de CHO/kg de peso corporal).
Debido a que aproximadamente por cada gramo de glucógeno se almacenan 2,6 g de agua, las reservas de CHO a menudo producen 1-2 kg de aumento en el peso corporal (27, 124). Se sugirió que los cambios agudos en el peso corporal pueden ser un método práctico para monitorear el almacenamiento de glucógeno muscular (27). Desafortunadamente tales indicaciones groseras del contenido de agua en el cuerpo son confundidas por los cambios en la masa grasa y el balance de agua extracelular. No obstante, el peso a primera hora de la mañana, tomado luego de vaciar la vejiga y antes del desayuno, puede brindar una indicación de la preparación individual para el ejercicio de resistencia.
La carga de CHO sólo beneficia al atleta en eventos de larga duración (> 1 hora), en donde se produce fatiga y agotamiento por falta de glucógeno muscular. En series intensas de ejercicio que duren menos de una hora, la fatiga puede ser causada por cambios en el balance ácido-base muscular y/o alguna otra perturbación en la homeostasis celular. Sin embargo, los deportistas que entrenan varias horas por día, deben ser conscientes de las grandes demandas de CHO impuestas por tales esfuerzos, y por ende, de la necesidad de reponer las reservas glucogénicas musculares y hepáticas entre sesiones de entrenamiento (35, 37).
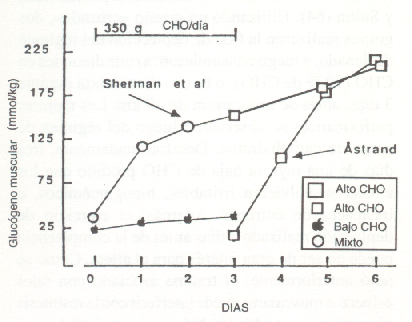
Figura 12. Comparación de dos regímenes alimenticios diseñados para
maximizar las reservas de glucógeno muscular. La principal diferencia entre
estas dos dietas ocurre en los primeros tres días. En el régimen descrito por
Astrand (ref. 1), los sujetos consumieron una dieta baja en CHO, mientras que en
el propuesto por Sherman y cols. (ref. 123) utilizaron una dieta mixta (normal
en CHO), en los días 0 a 3.
CONCLUSIONES
La discusión precedente dejó en claro que los CHO en la alimentación juegan un rol clave en el rendimiento de ejercicios de resistencia, y durante los días consecutivos de entrenamiento intenso. A pesar de que los músculos utilizan una combinación de grasas y CHO como combustibles durante ejercicios de larga duración, las reservas de glucógeno muscular son esenciales para la actividad continua. Cuando el contenido glucogénico de las fibras musculares está depletado, el músculo no puede mantener la tensión necesaria para el esfuerzo intenso. Mientras que el glucógeno muscular puede ser depletado en menos de una hora de ejercicio, su reposición con una dieta rica en CHO puede llevar varios días. Este artículo aportó nuestro conocimiento acerca de la importancia de la ingesta de CHO antes, durante y después del ejercicio.
A pesar de que la ingesta de CHO es esencial para la reposición de las reservas glucogénicas musculares y hepáticas, el consumo de azúcares simples (glucosa y sucrosa) en los últimos 30-45 minutos antes de un ejercicio, puede ocasionar hipoglucemia por esfuerzo y fatiga prematura. Por otro lado, se han observado mejorías en el rendimiento luego de una ingesta de CHO, inmediatamente antes del ejercicio. Los datos sugieren que se debería consumir una comida liviana con CHO (150-500 kcal), 2-4 horas antes del ejercicio. A pesar de que se mostró que la fructosa y el almidón producen un menor aumento en la glucosa sanguínea e insulina, parecen tener el mismo efecto sobre el rendimiento que la glucosa, los polímeros de glucosa, y almidón cuando se las consume inmediatamente antes del esfuerzo.
Una vez que se inicia la actividad, el individuo puede consumir CHO sin la amenaza de volverse hipoglucémico. En realidad, varios estudios han mostrado que el rendimiento de resistencia es marcadamente mejorado con la ingesta de CHO durante el ejercicio. Se ha observado que aun pequeñas cantidades de azúcar (23,5 g/h), ingeridas en intervalos de 15-30 minutos durante un ejercicio prolongado (> 1 hora), previenen la disminución de la glucosa sanguínea, y aumentan la vitalidad durante los últimos minutos del ejercicio. A pesar de que el grado de mejora en el rendimiento parece estar relacionado con la cantidad de CHO consumidos durante el ejercicio, no se ha establecido la máxima cantidad de CHO que puede ser ingerida durante el mismo. Los primeros estudios sugerían que la ingesta de CHO durante el ejercicio podía estar limitada por el vaciado gástrico, ya que se observó que las soluciones ricas en CHO (> 2,5 g/100 ml) demoraban su pasaje a través del estómago, durante el descanso o el ejercicio leve. Sin embargo, evidencias más recientes han mostrado que las soluciones de CHO que contienen 5,0 - 7,5 g/100 ml pueden no demorar el vaciado gástrico, abandonando el estómago casi tan rápido como el agua. Las comparaciones entre soluciones de glucosa, fructosa, polímero de glucosa y sucrosa no han podido mostrar ninguna diferencia, ni en su tasa de vaciado gástrico ni en el impacto sobre el rendimiento. Se necesitan más trabajos de investigación para detallar la composición ideal de CHO, y la cantidad y frecuencia de ingesta para el rendimiento óptimo.
Los estudios han mostrado que el ejercicio de resistencia intenso (> 1 hora) es proporcional al contenido de glucógeno de los músculos que realizan el esfuerzo. La cantidad de glucógeno almacenado en los músculos depende del estado de entrenamiento, previo al ejercicio, y del contenido de CHO de la dieta. Los músculos entrenados en resistencia, bien recuperados, tienden a almacenar casi el doble de glucógeno muscular que el músculo desentrenado. La deplección del glucógeno muscular durante el ejercicio produce un incremento en la actividad de la glucógeno-sintetasa, que es responsable de la resíntesis glucogénica. Luego de un ejercicio intenso, la reposición del glucógeno es proporcional a la cantidad de CHO consumidos durante las primeras 10-24 horas. Si el ejercicio no provoca un daño en las fibras musculares, se puede lograr una resíntesis casi completa dentro de las 24 horas cuando la dieta contiene 9-10 g de CHO/kg de peso corporal/día. Con la excepción de la fructosa, otras formas de CHO (por ejemplo glucosa, polímeros de glucosa y sucrosa) parecen producir casi la misma tasa de resíntesis glucogénica. La fructosa aparentemente muestra una tasa de resíntesis más lenta que las otras formas de CHO. La limitada información sugiere que el almidón puede estimular un mayor almacenamiento glucogénico que la glucosa, pero estas observaciones no han sido confirmadas. Se necesitan más investigaciones para ayudar a entender los mecanismos que inhiben la resíntesis del glucógeno muscular luego de un ejercicio traumáticamente intenso (por ej., ejercicio excéntrico). Se han propuesto varios planes alimenticios para maximizar el contenido de glucógeno del músculo (> 200 mmol/kg), antes un evento intenso de resistencia (por ej., una maratón). A pesar de que los estudios de estos regímenes han demostrado su eficiencia, las claves para el llenado glucogénico máximo son: (1) reducir la intensidad y la duración del entrenamiento para minimizar la oxidación diaria tanto del glucógeno muscular como hepático; y (2) incrementar el porcentaje de CHO en la dieta. No existe ninguna razón para usar una dieta rica en grasas y proteínas, o realizar un ejercicio de deplección para estimular un almacenamiento glucogénico extra. El músculo entrenado en resistencia sólo necesita unos días de descanso y una dieta rica en CHO para permitir una máxima reposición glucogénica.
Es ahora aparente que el CHO encontrado en la alimentación puede jugar un papel significativo en el ejercicio de resistencia. Su inclusión en la dieta diaria del atleta recreacional y competitivo es esencial para el entrenamiento y la competencia óptimos. No obstante, aún no es muy claro nuestro conocimiento acerca de los mecanismos que controlan la oxidación y restauración de CHO, durante y luego del ejercicio. Ojalá, los próximos estudios puedan dilucidar estos sistemas regulatorios, permitiéndonos por lo tanto, sacar el mayor provecho de los beneficios ergogénicos de los CHO en la alimentación.
Referencias
1. Astrand P. O (1967). Diet and athletic performance. Fed Proc 26: 1772-1777
2. Astrand P. O (1967). Interrelation between physical activity and metabolism of carbohydrate, fat and protein. Blix G. (ed): Nutrition and Physical Activity. Uppsala
3. Adolfsson S., Ahren K (1971). Control mechanisms for the synthesis of glycogen in striated muscle.: Pernow B., Saltin B. (eds): Muscle Metabolism During Exercise. New York, Plenum Press, pp 257-272
4. Ahlborg B. J. , Bergstrom J., Brohult J., Ekelund L.G., Hultman E., Maschio G (1967). Human muscle glycogen content and capacity for prolonged exercise after different diets. Foersvarsmedicin 3: 85-99
5. Ahlborg G., Felig P (1977). Substrate utilization during prolonged exercise preceded by ingestion of glucose. Am J Physiol 233: E188-E194
6. Allen F.M (1920). Gross anatomic retions of the pancreas and diabetes. J Exp Med 31: 381
7. Anres R., Cader G., Zierler K.L (1956). The quantitatively minor role of carbohydrate in oxidative metabolism by skeletal muscle in intact man in the basal state. Measurements of oxygen and glucose uptake and carbon dioxide and lactate production in the forearm. J Clin Invest 35: 671-682
8. Bagby G. J., Green H.J., Katsuta S., Gollnick P.D (1978). Glycogen depletion in exercising rats infused with glucose, lactate or pyruvate. J Appl Physiol 45: 425-429
9. Baldwin K. M., Fitts R.H., Fitts R.H., Boots F. W., Winder W. W., Holloszy J.O (1975). Depletion of muscle and liver glycogen during exercise. Pflugers Arch 354: 203-212
10. Baldwin K. M., Fitts R.H., Fitts R.H., Boots F. W., Winder W. W., Holloszy J.O (1975). Depletion of muscle and liver glycogen during exercise. Pflugers Arch 354: 203-212
11. Bergstrom J., Hultman E (1967). A study of the glycogen metabolis exercise in man. Scand J Clin Lab Invest 19: 218-228
12. Bergstrom J., Hultman E (1966). Muscle glycogen synthesis after exercise: an enchanging factor localized to the muscle cell in man. Nature 210: 309-310
13. Bergstrom J., Hultman E (1967). Synthesis of muscle glycogen in man after glucose and fructose infusion. Acta Med Scand 1-15
14. Bergstrom J., Hermansen L., Hultman E., Saltin B (1967). Diet, muscle glycogen and physical performance. Acta Physiol Scand 71: 140
15. Blair S.N., Ellsworth N. , Haskell E. L., Stern M. P., Farquhar J. W., Wood P. D (1981). Comparison of nutrient intake in middle-aged men and women runners and controls. Med Sci Sports Exerc 13: 310-315
16. Blom P., Vollestad N. K., Costill D. L (1986). Factors affecting change exercise. Acta Physiol Scand 128 (suppl 556): 67-74
17. Blom P., Vange O., Kardel K., Hermansen L (1982). Effect of different carbohydrates on rate of muscle glycogen resynthesis after prolonged exercise. Med Sci Sports Exerc 14: 136
18. Bonen A., Ness G. W., Belcastro A. N., Kirby R. L (1985). Mild exercise impedes glycogen repletion in muscle. J Appl Phisiol 58: 1622-1629
19. Bonen A., Malcolm S.A., Kilgour R. D., MacIntyre K. P., Belcastro A. N (1981). Glucose ingestion before and during intense exercise. J Appl Physiol; 50: 766-771
20. Brener W., Hendrix T. R., Mc Hugh P. R (1983). Regulation of the gastric emptying of glucose. Gastroenterology 85: 76-82
21. Campbell J. M. H., Mitchell G. O., Powell A. T. W (1928). The influence of exercise on digestion. Guy´s Hosp Rep 78: 279-293
22. Christensen E. H., Hansen III O (1939). Arbeitsfahigkeitn und Ernanhrung. Skand Arch Physiol 81: 160-171
23. Conlee R. K., Lawler R., Ross P (1982). Effect of fructose or glucose ingestion on glycogen repletion in muscle and liver after exercise or fasting. Med Sci Sports Exerc 14: 137
24. Constable S. H., Young J. C., Higuchi M., Holloszy J. O (1984). Glycogen resynthesis in leg muscles of rats during exercise. Am J Physiol 247: R880-883
25. Costill D. L., Saltin B (1974). Factors limiting gastricemptying during rest and exercise. J Appl Physiol 37: 679-683
26. Costill D. L., Higton H (1982). Facts on food. Runner 66-68, May
27. Costill D. L., Miller J. M (1980). Nutrition for endurance sport: carbohydrate and fluid balance. Int J Sports Med; 1: 2-14
28. Costill D. L (1985). Carbohydrate nutrition before, during, and after exercise. Fed Proc; 44: 364-368
29. Costill D. L (1986). Inside Running: Basics of Sports Physiology. Indianapolis, Bechmark Press, p. 189
30. Costill D. L (1970). Metabolic responses during distance running. J Appl Physiol; 28: 251-255
31. Costill D. L., Bennett a., Branan G., Eddy D. O (1973). Glucose ingestion at rest and during prolonged exercise. J Appl Physiol 34: 764-769
32. Costil D. L., Coyle E., Dalsky G., Evans W., Fink W., Hoopes D (1977). Effects of elevanted plasma FFA and insulin on muscle glycogen usage during exercise. J Appl Physiol; 43: 695-699
33. Costill D. L., Kovaleski J., Porter D., Kirwan J., Fielding R., King D (1985). Energy expenditure during front crawl swimming: predicting success in middle-distance events. Int J Sports Med; 6: 266-270
34. Costill D. L., Sparks K. E., Gregor R., Turner C (1971). Muscle glycogen utilization during exhaustive running. J Appl Physiol; 31: 353-356
35. Costill D. L., Flynn M. G., Kirwan J. P., Houmard J. A., Mitchell J., Thomas R., Park S. H (1989). Effects of repeated days of intensified training on muscle glycogen and swimming performance. Med Sci Sports Exerc
36. Costill D. L., Gollnick P. D., Jansson E. C., Saltin B (1973). Glycogen depletion patterns in human muscle fibers during distance running. Acta Physiol Scand; 89: 374-383
37. Costill D. L., Bowers R., Branam G., Sparks K (1971). Muscle glycogen utilization during prolonged exercise on successive days. J Appl Physiol; 31: 834-838
38. Costill D. L., Sharp R. L., Sherman W (1980). A survey of the nutritional habits among collegiate athletes. in: Misconceptions in Sports Nutrition. Repor I. Rosemont IL, National Dairy Council, p 7
39. Costill D. L., Kammer W. F., Fisher A (1970). Fluid ingestion during distance running. Arch Environ Health; 21: 520-525
40. Costill D. L., Fink W. J., Ivy J. L., Getchell L. H., Witzmann F (1979). Lipid metabolixm in skeletal muscle of endurance trained males and females. J Appl Physiol; 47: 787-791
41. Costill D. L., Sherman W. M., Fink W. J., Maresh C., Witten M., Miller J. M (1981). The role of dietary carbohydrates in muscle glycogen resynthesis after strenous running. Am J Clin Nutr; 34: 1831-1936
42. Coyle E. F., Coggan A. R., Hemmert M. K., Ivy J. L (1986). Muscle glycogen utilization during prolonged strenous exercise when fed carbohydrate. J Appl Physiol, 61: 165-172
43. Coyle E. F., Coggan A. R., Hermmert M. K., Lowe R. C., Walters T. J (1985). substrate usage during prolonged exercise following a pre-exercise meal. J Appl Physiol, 59: 429-433
44. Coyle E. F., Costill D. L., Fink W. J., Hoopes D. G (1978). Gastric emptying rates for selected athletic drinks. Res Q, 49: 119-124
45. Coyle E. F., Hagberg J. M., Hurley B. F., Martin W. h., Ehsani A. A., Holloszi J. O (1983). Carbohydrate feeding during prolonged exercise can delay fatigue. J Appl Physiol; 55: 230-235
46. Crapo P. A., Kolterman O. G (1984). The metabolic effects of 2-week fructose feeding in normal subjects. Am J Clin Nutr 39: 525-534
47. Decombaz J., Sartori D., Arnaul M. J., Thelin A. L. Schurch P., Howald H (1985). Oxidation and metabolic effects of fructose of glucose ingested before exercise. Int J Sports Med; 6: 282-286
48. Dengel D. R., Flynn M. G., Costill D. L., Kirwan J. P (1989). Determinants fo success during thriathlon competition. Med Sci Sports Exerc
49. Delvin J. T., Calles-Escandon J., Horton E. S (1986). Effects of preexercise snack feeding on endurance cycle exercise. J Appl Physiol; 60: 980-985
50. Edwards H. T., Margaria R., Dill D. B (1934). Metabolic rate, blood sugar and the utilization of carbohydrate. Am J Physiol; 108: 203-209
51. Felig P (1973). The glucose-alanine cycle. Metabolism; 22: 179-207, 1073
52. Felig P., Cherif A., Minagawa A., Wahren J (1982). Hypolycemia during prolonged exercise in normal men. Engl J Med; 306: 895-900
53. Fell R. D., Mc Lane J. A., Winder W. W., Holloszy J. O (1980). Preferential resynthesis of muscle glycogen in fasting after exhausting exercise. Am J Physiol; 238: R328-332
54. Fielding R. A., Costill D. L., Fink W. J., King D. S., Hargreaves M., Kovaleski J. E (1985). Effect of carbohydrate feeding frequencies and dosage on muscle glycogen use during exercise. Med Sci Sports Exerc; 17: 472-476
55. Fink W. J., Costill D. L., Van Handel P. J (1975). Leg muscle metabolism during exercise in the heat and cold. Eur J Appl Physiol; 34: 183-190
56. Flynn M. G., Costill D. L., Hawley J. A., Fink W. J., Neufer P. D., Fielding R. A., Sleeper M. D (1987). Influence of selected carbohydrate drinks on cycling performance and glyogen use. Med Sci Sports Exerc; 19: 37-40
57. Foirdtran J. S., Saltin B (1967). Gastric emptying and intestinal absorption during prolonged severe exercise. J Appl Physiol; 23: 331-335
58. Foster C., Costill D. L., Fink W. J (1979). Effects of preexercise feeding on endurance performance. Med Sci Sports; 11: 1-5
59. Foster C., Costill D. L., Fink W. J (1980). Gastric emptying characteristics of glucose and glucose polymer solutions. Res Q; 51: 229-305
60. Friedman D. L., Larner J (1963). Studies of UDPG- transglucosylase II. Interconversion of two forms on muscle UDPG- tranglucosylase by a phosphorylation-dephosphorylation reaction sequence. Biochemistry; 2: 669-675
61. Gollnick P. D., Pernow B., Essen B., Jansson E., Saltin B (1981). Availability of glycogen and plasma FFA for substrate utilization in leg muscle of man during exercise. Clin Physiol, 1: 27-42
62. Gollnick P.D., Armstrong R. B., Saubert IV C. W (1973). Glycogen depletion patterns in human skeletal muscle during prolonged work. Pfluegers Arch; 344: 1-12
63. Haggard H. W., Greenberg L. A (1935). Diet and Physical Efficiency. New Haven, Yale Univ. Press
64. Hargreaves M., Costill D. L., Coggan A., Fink W. J., Nishibata I (1984). Effect of carbohydrate feedings on muscle glycogen utilization and exercise performance. Med Sci Sports Exerc; 16: 219-222
65. Hargreaves M., Costill D. L., Katz A., Fink W. J (1985). Effect of fructose ingestion on muscle glycogen usage during exercise. Med Sci Sports Exerc, 17: 360-363
66. Hargreaves M., Costill D. L., Fink W. J., King D. S., Fielding R. A (1987). Effect of pre-exercise carbohydrate feedings on endurance cycling performance. Med Sci Sports Exerc; 19: 33-36
67. Hartley L. H., Mason J. W., Hogan R. P., Jones L. G., Kotchen T. A., Mougey E. H., Wherry F. E., Ricketts L. L (1972). Multiple hormonal responses to prolonged exercise in relation to physical training. J Appl Physiol; 33: 607-610
68. Hellebrandt F. A., Tepper R. H (1934). Studies on the influence of exercise on the digestive work of the stomach. II. Its effects on emptying time. Am J Physiol; 107: 355-363
69. Hermansen L., Hultman E., Saltin B (1967). Muscle glycogen during prolonged severe exercise. Acta Physiol Scand, 71: 129-139
70. Hultman E., Nilsson L. H (1971). Liver glycogen in man: effects of different diets and muscular exercise. In Pernow B., Saltin B. (eds): Muscle Metabolism During Exercise. New York, Plenum Press, pp 143-151
71. Hultman E (1979). Muscle fuel for competition. Physician Sports Med, January
72. Hultman E., Bergstrom J., Roch-Norlund A. E (1971). Glycogen storage in human skeletal muscle. in Pernow B., Saltin B. (eds): Muscle Metabolism During Exercise. New York, Plenum Press, pp 272-288
73. Hunt J. N., Pathak J. D (1960). The osmotic effect of some simple molecules and ions in gastric emptying. J Physiol; 154: 254-269
74. Hunt J. N., Knox M. T (1968). Regulation of gastric emptying. In Code C. F. (de): Handbook of Physiological Society, 1917-1935
75. Hunt J. N., Knox M. T (1962). The regulation of gastric emptying of meals containing citric acid and salts of citric acid. J Physiol; 163: 34-45
76. Hunt J. N., Knox M. T (1969). The slowing of gastric emptying by nine acids. J Physiol; 201: 161-179
77. Ivy J. L., Costill D. L., Fink W. J., Lower R. W (1979). Influence of caffeine and carbohydrate feedings on endurance performance. Med Sci Sports Exerc; 11: 6-11
78. Ivy S., Williams H (1983). Endurance improved by ingestion of a glucose polymer supplement. Med Sci Sports Exerc; 15: 466-471
79. Jacobs I., Westlin N., Karlsson J., Rasmusson M., Hougthon B (1982). Muscle glycogen and diet in elite soccer players. Eur J Appl Physiol; 48: 297-302
80. Jacobs I, Bar-Or O., Dotan R., Karlsson J., Tesch P (1983). Changes in muscle ATP, CP, glycogen, and lactate after performance of the Wingate Anaerobic Test. In: Knuttgen, H. G., Vogel J. A., Poortmans J. (eds): Biochemistry of Exercise. Champaign, Human Kinetics, pp 234-238
81. Jandrain B., Krzentowski G., Pirnay F., Mosora F., Lacroix M., Luyckx A., Lefebvre P (1984). Metabolic availability of glucose ingested 3 h before prolonged exercise in humans. J Appl Physiol; 56: 1314-1319
82. Kardel K., Costill D (1981). Energiforbruk under Strykeproven. Pa Hjul (Norweigen) June
83. Karlsson J., Saltin B (1971). Diet, muscle glycogen, and endurance performance. J Appl Physiol; 31: 203-206
84. Karlsson J., Saltin B (1970). Lactate, ATP, and CP in working muscles during exhaustive exercise in man. J Appl Physiol; 29: 598-602
85. Katz L. N., Stamler J., Pick R (1958). Nutrition and Atherosclerosis. Philadelphia, Lea and Febiger
86. Kirwan J., Mitchell J., Hourmand J., Costill D., Flynn M., Fink W (1989). Training overload: influence of dietary carbohydrate on chronic muscle fatigue. Ball State University
87. Koivisto V. O., Harkonen M., Karone S., Groop P. H., Elavainio R., Ferrannini E., Sacca L., Defronzo R. A (1985). Glycogen depletion during prolonged exercise: influence of glucose, fructose or placebo. J Appl Physiol; 58: 731-737
88. Koivisto V. O., Karonen S., Nikkila E. A (1981). Carbohydrate ingestion before exercise: comparison of glucose, fructose and sweet placebo. J Appl Physiol; 51: 783-787
89. Krzentowski G., Pirnay F., Luyckx A. S., Lacroix M., Mosora F., Lefebvre P (1984). Effect of physical training on utilization of a glucose load given orally during exercise. Am J Physiol; 246: E412-E417
90. Lacroix M., Mosora F., Pontus M., Lefebvre P., Luyckx A., Lopez-Habbib G (1973). Glucose naturally labeled with carbon-13: use for metabolic studies in man. Science 181: 445-446
91. Lamb D. R., Brodowiczz G. R (1986). Optimal use of fluids of varying formulation to minimize exercise-induced disturbances in homeoestasis. Sports Med; 3: 247-274
92. Larner J., Villar-Palasi C., Goldberg N. D., Bishop J. S., Huijing F., Wenger J. L., Ssko H (1969). Hormonal and nonhormonal control of glycogen systhesis-control of transferase phosphatase and transferanse I kinase. In Gual C. (de): Progress in Endocrinology. Amsterdan, Excerpta Med, Found, pp 135-147
93. Levine L., Evans W. J., Caderette B. S., Fisher E. C., Bullen B. A (1983). Fructose and glucose ingestion and muscle glycogen use during submaximal exercise. A Appl Physiol; 55: 1767-1771
94. Levine S. A., Gordon B., Drick C. L (1924). Some changes in the chemical constituents of the blood following a marathon race. JAMA 82: 1778-1779
95. Lohmann D., Liebdd F., Heilmann W., et al (1978). Diminished insulin response in highly rained athletes. Metabolism; 27: 521-524
96. MacDougall J, D., Ward G, R., Sale D. G., Sutton J. R (1977). Muscle glycogen repletion hight-intensity intermittent exercise. J Appl Physiol; 42: 129-132
97. Maehlum S., Felig P., Wahren J (1978). Splanchmic glucose and muscle glycogen metabolism after glucose feeding during postexercise recovery. Am J Physiol; 235: E255-E260
98. Mc Murray R. G., Wilson J. R., Kitchell B. S (1983). The effects of glucose and fructose on high intensity endurance performance. Res Q Exerc Sport; 54: 156-162
99. Mitchell J. B., Costill D. L., Fink W. J., Houmard J. A., Flynn M. G., Beltz J. D (1987). Effect of carbohydrate ingestion on gastric emptying and exercise performance. Med Sci Sports Exerc
100. Moran T. H., McHugh P. R (1981). Distinctions among three sugars in their effects on gastric emptying and satiety. Am J Physiol; 241: R25-R30
101. Nestel P. J., Barter P. J (1973). Triglyceride clearance during diets rich in carbohydrates and fats. Am J Clin Nutr; 26: 241-245
102. Neufer P. D., Costill D. L., Flynn M. G., Kirvan J. P, Mitchell J. B., Houmard J (1987). Improvements in exercise performance: effects of carbohydrate feeing and diet. J Appl Physiol; 62: 983-988
103. Neufer P. D., Costill D. L., Fink W. J., Kirwan J. P., Fielding R. A., Flynn M. G (1986). Effects of exercise and carbohydrate composition on gastric emptying. Med Sci Sports Exerc; 18, 658-662
104. Nilsson L. H., Hultman E (1973). Liver Glycogen in man: the effect of total starvation or a carbohydrate-poor diet fllowed by carbohydrate refeeding. Scand J Clin Lab Invest; 32: 325-330
105. Owen M. D., Kregel K, C., Wall P. T., Gisolfi C. V (1985). Effects of carbohydrate ingestion on thermoregulation, gastric emptying and plasma volume during exercise in the heat. Abstract, Med Sci Sports Exerc 17; 185
106. Pedersen E.F (1985). Staerke gllukose oplosningers virking pa mavsaekkens optagelse, pa legement vaeskeudbytte og pa blodgluckose koncentration y hvile or under arbejde, MA thesis. August Krogh Institute, Univ. Copenhagen, Denmark
107. Piehl K (1974). Time course for refilling of glycogen stores in human muscle fibers following exercise-induced glycogen depletion. Acta Physiol Scan 90, 297-302
108. Pirnay F., Crielaard J. M., Pallikarakis N, Lacroix M, Mosora F., Drzentowski G., Luyckx A., Lefebvre P. J (1982). Fate of exogenous glucose during exercise of different intensites in humans. J Appl Physiol; 53: 1620-1624
109. Pirnay F., Krzentowski G., Cielaard J. M., Pallikarakis N., Lacroix M., Mosora F., Luyckx A. S., Lefebvre P. J (1981). Oxidation of orally administered naturally labeled 13X-glucose during prolonged muscular exercise. In Poortsmans J., Nisset G. (eds): Biochemistry of Exercise. Baltimore, Univ. Park Press, 4, pp 196-207
110. Pirnay F., Lacroix M., Mosora F., Luyckx A., Lefebvre P (1977). Effect of glucose ingestion on energy substrate utilization during prolonged muscular exercise. Eur J Appl Physiol; 36: 247-254
111. Ravich W. J., Bayless T. M., Thomas M (1983). Fructose: incomplete intestinal absorption in humans. Gastroent; 84: 26-29
112. National Academy of Sciences (1980). Recommended Dietary Allowances, Revised 1980,Food and Nutrition Board. National Research Council, Washington, D. C
113. Rowell L. B (1974). Human cardiovascular adjustments to exercise and thermal stress. Physiol Rev; 54: 75-159
114. Rowell L. B (1971). The liver as an energy source in man during exercise. In: Pernow B., Saltin (eds): Muscle Metabolism During Exercise. New York, Plenum Press, pp 127-141
115. Rowell L. B., Blackmon J. R., Bruce R. A (1964). Indocyanine green clearance and estimated hepatic blood flow during mild exercise to maximal exercise in upright man. J Clin Invest; 43: 1677-1690
116. Saltin B., Karlsson J (1971). Muscle glycogen utilization during work of different intensities. In Pernow B., Saltin B. (eds): Muscle Metabolism During Exercise, New York, Plenum Press, 11: pp 289-300
117. Satabin P., Portero P., Defer G., Bricout J., Guezennec C. Y (1987). Metabolic and hormonal responses to lipid and carbohydrate diets during exercise in man. Med Sci Sports Exerc; 19: 218-223
118. Segal K., Nyman A., Kral J. G., Bjorntorp P., Kotler D. P., et al (1985). Effects of glucose ingestion on submaximal intermitent exericse. Abstract. Med Sci Sports Exerc; 17: 205
119. Seiple R. S., Vivian V. M., Fox E. L., Bartels R. L (1983). Gastric emptying characteristics of two glucose polymer-electrolyte solutions. Med Sci Sports Exerc; 15: 366-369
120. Sherman W., Costill D. L., Fink W., Hagerman F., Armstrong L., Murray T (1983). Effect of a 42.2 km footrace and subsequent rest or exercise on muscle glycogen and enzymes. J Appl Physiol; 55: 1219-1224
121. Sherman W. M., Costill D. L., Fink W. J., Miller J. M (1981). Effect of exercise-diet manipulation on muscle glycogen and its subsequent utilization during performance. Int J Sports Med; 2: 114-118
122. Sherman W. M., Plyley M. J., sharp R. L., Van Handel P. J., McAllister R. M., Fink W. j., Costill D. L (1982). Muscle glycogen storage and its relationship with water. Int J Sports Med; 3: 22-24
123. Sjogaard G., Nielsen B., Mikkelsen F., Saltin B., Burke E (1986). Physiology In Bicycling. Inthaca, N. Y., Movement Publications, p 110
124. Van Handel P. J., Fink W. J., Branam G., Costill D. L (1980). Fate of (14C) glucose ingested during prolonged exercise. Int J Sports Med; 1: 127-131
125. Varro V., Blaho G., Csernay L., Jung Y., Szarva F (1965). Effect of decreased local circulation on the absorptive capacity of a small-intestine loop in the dog. Am J Dig Dis; 10: 170-177
126. Vollestad N. K., Vaage O., Hermansen L (1984). Muscle glycogen depletion patterns in type I and subgroups of type II fibers during prolonged severe exercise in man. Acta Physiol Scand; 122: 433-441
127. Wahlqvist M. L., Wilmshurst E. G., Murton C. R., Richardson E. N (1978). The effect of chain lenght on glucose absorption and the related metabolic response. Am J Clin Nutr; 31: 1998-2001
128. Wahren J (1977). Glucose turnover during exercise in man. Ann NY Acad Sci; 301: 45-55
129. Wahren J (1966). Quantitative aspects of blood flow and oxygen uptake in the forearm during rhythmic exercise. Acta Physiol Scand; 67 (suppl 269): 1-92
130. Wahren J., Felig P., Ahlborg G., et al (1971). Glucose metabolism during exercise in man. J Clin Invest; 50, 2715-2725
131. William J. H., Mager M., Jacobsen E. D (1964). Relationship of mesenteric blood flow to intestinal absorption of carbohydrates. J Lab Clin Med; 63: 853-863
132. Zarkin D., Herman R. H., Gordon W. C (1969). The conversion of glucose and fructose to fatty acids in the human liver. Biochem Med; 2: 427-437