Biosystem. Servicio Educativo.
INTRODUCCIÓN
Durante la última década, numerosos investigadores han aportado profusa y confiable información sobre el metabolismo del ácido láctico (lactato), sustancia generada en las células como producto de la degradación de la glucosa, y especialmente en las células musculares durante el ejercicio. Los trabajos más trascendentes, marcadamente sofisticados, no solo han echado luz sobre la dinámica del lactato en condiciones basales o en el período de post-esfuerzo (o sea, durante los procesos de recuperación del ejercicio o del entrenamiento), sino que han permitido también responder interrogantes fundamentales sobre el papel de su metabolismo durante el propio esfuerzo, en diferentes condiciones respecto de volumen, intensidad, pausa de recuperación y frecuencia de estímulos de trabajo. El primer artículo de esta Sección pretende mostrar sintéticamente un panorama introductorio de la producción y la eliminación de lactato en el ejercicio, atento a que los tests, las evaluaciones y las investigaciones que determinan sus niveles sanguíneos ocupan hoy en el mundo un amplio campo de acción en la metodología de control del entrenamiento deportivo. Al respecto, el primer concepto de la Conferencia “Diagnóstico Médico-Deportivo Mediante Tests de Lactato” dictada por el Dr. Lotar Kipke (Jefe de Investigadores del Servicio Médico-Deportivo de Leipsig, República Democrática Alemana) en el marco del VII Congreso Mundial de Medicina en Natación de la FINA (Londres, 11-15 de Septiembre de 1989) rezó textualmente: “La investigación y el control de los niveles de ácido láctico sanguíneo intra-y post-esfuerzo es una de las más importantes herramientas de diagnóstico y pronostico del rendimiento del entrenamiento y la competencia” (8). Los antecedentes del reconcido fisiólogo, los aportes científicos del Centro de Leipzig, y el nivel de performance alcanzado por los atletas alemanes orientales en los últimos años eximen de mayores comentarios.
El objetivo perseguido al tratar este tema aquí, comprende evitar que gran parte de la información actualmente accesible sobre lactato y ejercicio sea inadecuadamente valorada en virtud de las interpretaciones superficiales o parcializadas sobre este tema que suelen efectuar algunos profesionales ligados a las Ciencias Aplicadas al Deporte, quienes ante la imposibilidad de desarrollar metodologías sistemáticas de control de los niveles de entrenamiento con tests de lactato, desdibujan el papel de este metabolito y el significado de su determinación.
GLUCÓLISIS Y LACTATO
Durante muchos años se pensó que la producción de lactato, interpretado éste como un “producto terminal” de la glucólisis, constituía una vía alternativa de generación de energía, en ausencia de suficiente oxígeno tisular (vía anaeróbica), cuyos efectos residuales sobre la acidez (ph) intracelular bloqueaban metabólicamente la síntesis de ATP, anticipando la aparición de la fatiga. La fundamentación de esta interpretación, sin embargo, ofrece algunas limitaciones importantes que sólo recientemente se han descubierto, y que la tornan perimida. La trascendencia de esta circunstancia otorga especial interés al contenido de este primer artículo, que actualiza razonablemente el problema.
El lactato, en cuanto metabolito intermedio de la degradación de la glucosa, ha sido persistentemente condenado como una sustancia perniciosa que sólo genera fatiga, dolor muscular, angustia y hasta agonía. Durante años fue considerado como “el personaje malo de la película”, interpretando la abundante evidencia ofrecida por multitud de trabajos de investigación, prolijos pero insuficientes, y por la aplicación de metodologías de entrenamiento inadecuadas, que no permitían una racional matabolización del lactato producido durante el ejercicio. Creemos que en la falta de comprensión de estos fenómenos radica uno de los factores limitantes del desarrollo de metodologías correctas de entrenamiento y control por parte de entrenadores y médicos.
Entre los primeros conceptos equivocados que se manejaron figura el de haber creído que la producción de lactato era un recurso inmediato de energía para la contracción muscular. Este concepto fue refutado cuando de demostró que la contracción muscular puede ocurrir con baja tasa de generación y aún en ausencia de lactato. También se pensó equivocadamente que el lactato era generado solamente frente a la ausencia de oxígeno en el medio mitocondrial celular, y en forma proporcional a la misma. Hoy se ha demostrado fehacientemente que la producción de lactato puede tener lugar tanto en presencia como en ausencia de oxígeno.
Normalmente hay una baja concentración de lactato (aproximadamente 1 mMol por lt. en la sangre y en el músculo en condiciones de reposo). Las fuentes de ese lactato son, probablemente, la tasa metabólica de los músculos que funcionan con bajo flujo sanguíneo y su liberación por los glóbulos rojos como producto final de su metabolismo.
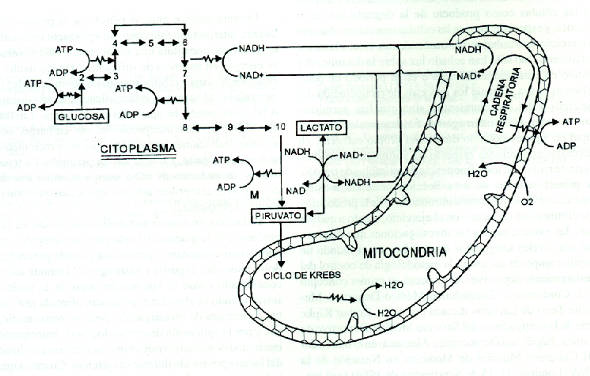
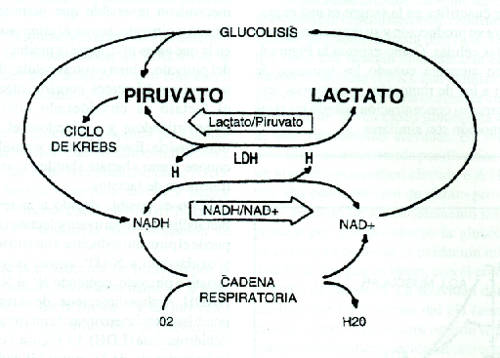
El primer sustrato a considerar en el estudio de la vía de la producción de lactato es la glucosa proveniente de la degradación del glucógeno local. El patrón metabólico de la degradación de la glucosa en las células de los mamíferos se denomina glucólisis, y consiste en una sucesión invariable de 11 reacciones bioquímicas específicamente catalizadas y reguladas por enzimas. La Figura 1 describe el proceso de degradación glucolítica (oxidación) hasta ácido pirúvico (piruvato) y la reducción de este último a lactato. Este proceso de producción de piruvato mediante la degradación de glucosa, que tiene lugar en el citoplasma celular, libera parte de la energía contenida en los enlaces químicos de las moléculas de este glúcido, que puede aprovecharse para efectuar el trabajo químico necesario para la incorporación de fosfato a moléculas de ADP mediante enlaces altamente energéticos, formándose ATP, sustancia que permite almacenar energía de reserva, para su utilización ulterior en la producción de trabajos biológicos diversos. Este mecanismo puede considerarse como una forma de generación de ATP citoplasmático, complementariamente de los procesos que también lo producen en las mitocondrias (el Ciclo de Krebs, que aprovecha precisamente el piruvato producido en la glucólisis, y la cadena respiratoria, que aprovecha el Hidrógeno cedido por la glucosa durante su degradación). Puede observarse, por consiguiente, que existen dos rutas metabólicas principales para las transformaciones que puede sufrir el piruvato: oxidarse toral e irreversiblemente a CO2 y H2O participando en el ciclo de Krebs (iniciando una vuelta del mismo acoplándose a la coenzima A para formar acetil-coenzima A), o reducirse parcial y reversiblemente a lactato.
Figura 1. Interrelaciones entre la glucólisis rápida a piruvato, el trabajo mitocondrial y la producción de lactato. El sentido hacia
abajo indica disminución del nivel energético molecular. Los números indican los
sucesivos metabolitos de la glucólisis, de cuyos nombres se hace abstracción en
mérito a la simplicidad.
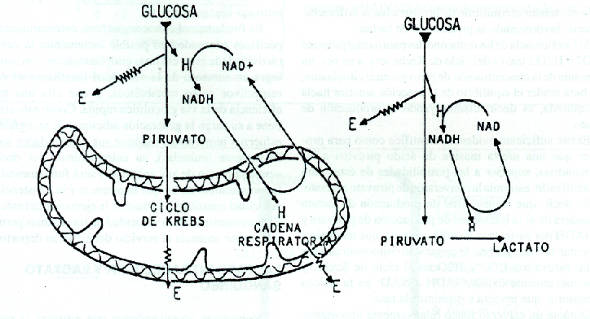
Pasteur había advertido que la glucólisis se retardaba en presencia de O2, por lo que históricamente se concibieron dos formas distintas de glucólisis: una anaeróbica (rápida) y otra aeróbica (lenta). La Figura 2 ilustra una interpretación actual del “efecto Pasteur”. Dado que hoy sabemos que hay también otras razones, aparte de la presencia o no de O2, para que se produzca lactato, estos términos (glucólisis aeróbica, glucólisis anaeróbica) no deberían seguir empleándose por inadecuados al lenguaje usual de científicos y pedagogos. Más propiamente debiera hablarse de glucólisis rápida (en sustitución de anaeróbica) y lenta (en sustitución de aeróbica), al referirse a la producción de moléculas intermediarias metabólicas como el piruvato y el lactato, y debiera calificarse a la glucólisis, en este contexto, como un proceso “no aeróbico”, es decir, que no envuelve al O2. A este respecto, es fundamental comprender el papel que le cabe en el proceso a los llamados “transportadores de hidrógeno”, principalmente al importante de ellos, el NAD.
Figura 2. Ilustración del Efecto Pasteur, a) Si la
velocidad glucolítica es baja como para permitir un trabajo mitocondrial
eficiente, el piruvato y el NADH formados, se oxidan fácilmente, no formandose
predominantemente lactato, b) Si la glucólisis es rápida y si la función
mitocondrial es inadecuada (baja actividad enzimática o pobre aporte de O2), se
forma predominantemente lactato.
PAPEL DEL NAD (NICOTINA-ADENINA-DINUCLEOTIDO) EN SUS FORMAS REDUCIDA Y OXIDADA
El proceso glucolítico expuesto en la Figura 1 tiene la particularidad de que el paso del metabolito “6” al metabolito “7” implica obligadamente la incorporación del H+, que se desprende de la consiguiente oxidación, a moléculas de NAD en su forma oxidada (NAD+) transformándolas en su forma reducida NAD-H2 o, abreviadamente, NADH. De esto se desprende que, para que tenga lugar, se requiere la presencia de NAD+ en el medio, o sea que las moléculas de NADH sucesivamente producidas deben de alguna manera reoxidarse a NAD+ para garantizar la continuidad de la degradación glucolítica.
La reoxidación del NADH, paso fundamental para la continuidad de la glucólisis, tiene lugar principalmente en dos procesos metabólicos diferentes:
- En el primer paso de la cadena respiratoria, que implica la cesión delH+ del NADH para reducir FAD (Flavina-Adenina-Dinucleótido) a FADH dentro de las mitocondrias, con paso ulterior del NAD+ al citoplasma (“Shuttle” de NAD+).
- En la reacción de transformación (reducción) del piruvato a lactato, que implica la cesión delH+ del NAD (en calidad de coenzima de la láctico-dehidrogenasa, LDH) para formar la molécula de este último, con liberación de NAD+ directamente en el citoplasma. En consecuencia, se puede establecer que:
- El destino metabólico de cada molécula de piruvato producida en la glucólisis rápida (completar su oxidación en el Ciclo de Krebs, o reducirse a lactato) estará determinada por la cantidad de NADH presente en el citoplasma o, mejor, por la relación-cociente entre las concentraciones de las formas reducida y oxidada del NAD (NADH/ NAD+): a mayor cantidad de NADH/ NAD+, mayor cociente NADH/ NAD+ y mayor tendencia a la reducción del piruvato a lactato, y viceversa.
- La intensidad de la glucólisis rápida será un determinante importante de la concentración de NADH en el citoplasma: a mayor tasa de glucólisis, mayor concentración de NADH en el citoplasma: y en consecuencia, mayor tendencia a la formación de lactato.
- La eficiencia de la cadena respiratoria para oxidar aeróbicamente al NADH dentro de las mitocondrias será, por su parte, un determinante de la concentración de NAD+ en el citoplasma, a una mayor eficiencia aeróbica mayor concentración de NAD+ (menor cociente NADH/ NAD+) y en consecuencia, menor tendencia a la formación de lactato.
- La intensidad de la producción de piruvato por la glucólisis rápida será también un determinante de la relación de concentraciones entre la [lactato] y la [piruvato] (cociente lactato/piruvato), que influirá en el sentido de la reacción reversible:
PIRUVATO <-------------------------> LACTATO
Haciendo tender el equilibrio de la misma hacia la derecha, es decir, favoreciendo la producción de lactato.
- La eficiencia de las mitocondrias para oxidar piruvato a CO2 y H2O a través del ciclo de Krebs será, a su vez, un atenuante de la concentración de piruvato en el citoplasma, que hará tender el equilibrio de la reacción anterior hacia la izquierda, es decir, disminuyendo la producción de lactato.
Existe suficiente evidencia científica como para proponer que una oferta masiva de ácido pirúvico a las mitocondrias, superior a las posibilidades de éstas para metabolizarlo, estimula la conversión de piruvato a lactato.
Es decir, que la tasa final de producción de lactato dependerá de a) la intensidad de producción de piruvato y NADH por parte de la glucólisis rápida, que tenderá a aumentar la tasa, b) de la capacidad mitocondrial para oxidar piruvato a CO2 y H2O en el ciclo de Krebs, y subsecuentemente oxidar NADH a NAD+ en la cadena respiratoria, que tenderá a disminuir la tasa.
Durante un esfuerzo físico relativamente importante, la velocidad de ruptura glucolítica, generadora de importantes aumentos en los cocientes NADH/ NAD+ y piruvato/lactato, puede aumentar relativamente mucho más que la capacidad oxidativa mitocondrial: esta condición es específicamente importante para entrenadores y técnicos deportivos, porque la velocidad glucolítica está influida en forma casi excluyente por la intensidad del estímulo de esfuerzo, que es uno de los instrumentos metodológicos que ellos utilizan.
Curiosamente, la determinación del destino del piruvato, a ser oxidado en el ciclo de Krebs o a ser reducido a lactato, depende mucho más de la tasa glucolítica determinada por la velocidad o la intensidad del esfuerzo, que de la mayor o menor disponibilidad de O2 a nivel celular.
FUNCIÓN REGULADORA DE LAS ENZIMAS DE LA GLUCÓLISIS
La glucólisis está directamente regulada por las enzimas que catalizan específicamente cada uno de los 11 pasos del camino degradativo hasta piruvato. Una de las enzimas que tiene una función determinante en este proceso es la fosfofructo quinasa (PFK), que cataliza el tercer paso de la glucólisis (Figura 1). Esta enzima es considerada un factor limitante de la velocidad glucolítica cuando el ejercicio alcanza intensidades elevadas. En estas condiciones, su actividad se ve deprimida por diversos factores, entre ellos un nivel citoplasmático elevado a ATP y fosfocreatina, y una alta concentración de citrato proveniente del primer paso del ciclo de Krebs (elemento importante para comprender por qué disminuye la glucólisis generadora de piruvato y se potencia la oxidación mitocondrial alternativa de ácidos grasos libres, con el consiguiente ahorro de hidratos de carbono). La actividad de la PFK es, además inhibida por un descenso del ph (aumento de la acidez) celular, como ocurre cuando se producen aumentos masivos de la concentración de lactato como consecuencia de esfuerzos progresivos e intensos.
Otras enzimas importantes del ciclo glucolítico son la hexoquinasa (paso 1), la fosfoglucomutasa (paso 8) y la piruvato quinasa (paso 10).
Es fundamental conocer que, con entrenamientos específicos adecuados, es posible incrementar la cantidad (actividad) de estas enzimas citoplasmáticas, con lo que se logra un aumento de la velocidad (canalización) de los respectivos pasos metabólicos, y con ella una mayor eficiencia de la vía glucolítica rápida. Como este sistema tiene a su cargo la generación adicional de energía en los esfuerzos importantes (aunque sus posibilidades son relativamente limitadas), su entrenamiento (es decir, “el entrenamiento de sus enzimas”) será fundamental para las prestaciones en las que la potencia y la resistencia a la velocidad constituyen la base de la ejecución del esfuerzo. El entrenamiento de la velocidad de las enzimas permitirá una mayor potencia al servicio del esfuerzo deportivo.
LACTATO INTRACELULAR Y LACTATO SANGUÍNEO
Numerosas investigaciones que estudian la producción de lactato intracelular y su correlación con el lactato presente en la sangre (a la que solamente puede haber llegado atravesando las membranas celulares) demuestran que alrededor de un 50 % del lactato producido es trasportado al compartimiento intravascular, encontrándose este porcentaje influido por la capacidad aeróbica del individuo, por los efectos residuales de la fatiga, y por la acción de otras variables (efectos residuales hormonales, temperatura, etc.) y factores metabólicos de mayor complejidad que exceden el objetivo de este artículo.
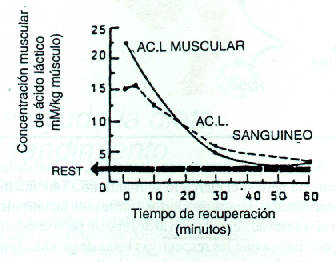
La Figura 3 muestra que la producción de lactato intracelular y su curva de remoción (o desaparición, proceso que analizaremos más abajo y en los artículos siguientes de esta serie) se encuentran altamente correlacionadas. Por lo consiguiente, la medición del lactato sanguíneo ofrece una imagen comparable con lo que ocurre dentro de las células.
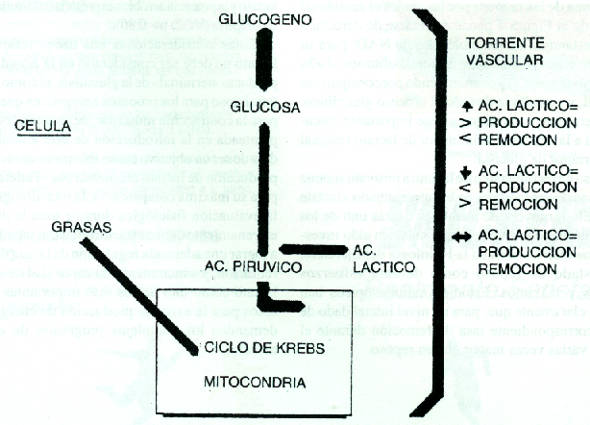
El lactato que se cuantifica en la sangre es una expresión del balance entre su producción y su remoción (eliminación) a cargo de las células. Como expresa la Figura 4, el lactato sanguíneo aumenta cuando los procesos de producción superan a los de remoción, y viceversa, tendiéndose a estabilizarse su concentración cuando las tasas de producción y remoción son similares.
Figura 3
MECANISMOS CELULARES DE PRODUCCIÓN Y REMOCIÓN DE LACTATO
Últimamente se ha profundizado el conocimiento de mecanismo reversible que permite la reconversión de lactato a piruvato, sea en el citoplasma de la propia célula en la que antes tuvo lugar la producción del lactato a partir del piruvato, o bien en otras células del organismo (grupos musculares diferentes, corazón, hígado, etc.), para las que el lactato es considerado como un combustibles, reconvirtiéndose y oxidándose el ácido pirúvico en la mitocondria. Este transporte y reutilización del lactato se conoce como “lactate shuttle” o “mecanismo puente de transporte de lactato”.
Esto es posible debido a la reversibilidad del paso metabólico entre piruvato y lactato (Figura 1), ya que tanto puede el piruvato reducirse a lactato tomando H+ del NADH y oxidándolo a NAD+ y reduciendolo a NADH. Ambas direcciones de la reacción son catalizadas por diferentes isoenzimas de una misma enzima, la láctico dehidrogenasa (LDH). La Figura 5 esquematiza en detalle la importancia de la reversibilidad de esta reacción en virtud de su interrelación con los restantes procesos del metabolismo energético, y el papel de los cocientes lactato/piruvato y NADH/NAD, en la determinación de su sentido.
Este mecanismo reversible es una de las más importantes opciones metabólicas presentes en la célula para reconvertir el lactato generado durante el ejercicio intenso, pudiendo al efecto utilizarse el propio NAD+ brindado por la reacción inversa, o bien el NAD+ proveniente de la dehidrogenación del NADH en el primer paso de la cadena respiratoria de las mitocondrias. Esta segunda posibilidad opera con una probabilidad proporcional al grado de desarrollo del mecanismo oxidativo mitocondrial para cada individuo.
El consumo de NAD+ en la reconversión de lactato a piruvato es una de las razones por las cuales el sentido de la reacción de la Figura 4 puede orientarse de derecha a izquierda, restando a su vez moléculas de NAD+ para su utilización en el paso metabólico del metabolito 6 a 7 de la glucólisis (Figura 1) y disminuyendo por consiguiente su velocidad, y con ella la de todo el proceso glucolítico. Por esta interesante característica, este importante mecanismo opera a la vez como eliminador de lactato residual y como ahorrador de glucosa.
El proceso de reconversión de lactato a piruvato supone una cierta tasa de “recambio” de lactato, llamado “lactate turnover”. El “turnover” de lactato es quizás uno de los fenómenos intracitoplasmáticos que más han sido investigados en los últimos años en la Fisiología del Ejercicio, tanto en estado de reposo como durante esfuerzos submáximos y máximos. Estudios redioisotópicos han demostrado claramente que, para un nivel inicial dado de lactato, la correspondiente tasa de remoción durante el ejercicio es varias veces mayor que en reposo.
Figura 4
Si el ejercicio aumenta en intensidad, el nivel de lactato aumenta pero si el ejercicio se mantiene a una intensidad determinada, dentro de ciertos límites, el lactato alcanza un nivel elevado en relación al de reposo, pero se estabiliza, lo que indica que las respectivas tasas de producción y de remoción han alcanzado valores similares.
Las metodologías radioisotópicas han demostrado que la tasa de remoción de lactato es dependiente de su concentración sanguínea; o sea que cuando el lactato aumenta en la sangre, los mecanismos de remoción se ven estimulados. También hay una relación casi lineal directa entre la potencia de remoción de lactato y la potencia aeróbica expresada en términos de consumo de oxígeno (VO2) (r =0.86).
Figura 5
Estas consideraciones nos hacen reflexionar que el lactato no debe ser considerado en la actualidad como un producto “terminal” de la glucólisis, ni como un metabolito pernicioso para los procesos energéticos que generan ATP para la contracción muscular, de acuerdo con la propuesta planteada en la introducción de este artículo. Si bien no deja de ser un objetivo razonable tratar de reducir la tasa de producción de lactato alcanzada por el atleta al prepararlo para su máxima competencia, la metodología de trabajo y la evaluación fisiológica durante toda la duración de su entrenamiento deben estar dirigidas, mancomunadamente, a lograr una adecuada regulación de la tasa de producción-remoción, y a incrementar la capacidad de utilización del lactato como uno de los más importantes combustibles aptos para la exigente producción de energía celular que demandan los complejos programas de entrenamiento actuales.
REFERENCIAS
1. Brooks, G A, Fahey T (1985). Exercise Physiology. Human Bioenergetics and its Applications. Capítulos 5 (pp. 67-95) y 10 (pp. 189-219). Macmillan Publ. Co. New York
2. Brooks, G A (1986). The lactate shuttle during exercise: Evidence and possible controls. In: Sports Science (Proccedins of the VIII Commonwealth, Glasgow, July 1986)
3. Brooks, G A (1986). The lactate shuttle during exercise and recovery. Med Sci Sport Exerc; 18: 360-368
4. Donovan, C M, Brooks, G A (1987). Endurance training affects lactate clearance, not lactate production. Am J Physiol; 244 (7): E 83-E92
5. Gollnick, P D, Bayly, W M, Hodson, D R (1986). Exercise intensity, training, diet, and lactate concentration in muscle and blood. Med Sci Sport Exerc; 18: 334-340
6. Green, H J, Hughson, R L, Orr, G W, Ranney D A (1983). Anaerobic threshold, blood lactate and muscle metabolites in progressive exercise. J Appl Physiol. Respirat Environ Exersise Physiol; 54 (4): 1028-1032
7. Katz, J (1986). The application of isotopes to the study of lactate metabolism. Med Sci Sport Exerc; 18: 352-359
8. Kipke, L (1989). Sport medical diagnosis by applying the lactate test. In: World FINA Medical Congress Proceedings. The London Hospital Medical College, London, September
9. Lehninger A L (1978). Bioquímica. La Bases Moleculares de la Estructura y la Función Celular (2da. Edición). Caps. 1-3, 1-8, 2-18. Ediciones Omega S.A., Barcelona

Monitoreo de la postura del entrenamiento de baloncesto basado en un dispositivo portátil inteligente
Resumen El contenido relevante del trabajo deportivo de China señaló claramente que es necesario...
Prevalencia de mujeres físicamente activas en riesgo para la tríada femenina deportista en España
Resumen Antecedentes: La tríada de la atleta femenina (Tríada) se refiere a la interrelación entre...

Variación de la recuperación neuromuscular según el tipo de serie en el entrenamiento de fuerza
¿Cuánto tarda realmente en recuperarse un atleta después de una serie al fallo? Un estudio...

Nutrición para atletas tácticos: conocimientos, aplicaciones y lagunas en la investigación
Resumen Los atletas tácticos, incluido el personal militar, los bomberos y el personal de rescate,...

Seguridad de la suplementación con creatina a largo plazo en jugadoras de fútbol: un estudio del mundo real durante la temporada
Resumen Aunque la suplementación con creatina está bien establecida para mejorar el rendimiento...