Cómo es la respuesta molecular aguda de un entrenamiento concurrente en un músculo entrenado vs desentrenado.
Publicado 14 de julio de 2014, 1:42
Habitualmente se sostiene que el ejercicio de fuerza (EF), pero no aeróbico (EA), no aumenta el acrecentamiento de las proteínas miofibrilares para producir una hipertrofia muscular consecuente al entrenamiento crónico (Kraemer y cols. 1995, Coffey y Hawley 2007). Sin embargo, un estudio reciente de Tech y Lundberg demostró que un turno de AE+RE agudo impulsó una respuesta molecular anabólica mayor que el EF sólo (Lundberg y cols. 2012). Intrigados por estos resultados agudos, estos mismos investigadores estudiaron las respuestas globales del músculo posteriormente a un régimen de entrenamiento de EA+EF idéntico (Lundberg y cols. 2013). Se encontró que el método de ejercicio concurrente produjo un aumento sustancialmente mayor en el tamaño del músculo, comparado con el EF sólo (Lundberg y cols. 2013). Así, y en contraste con la creencia general, parece ser que el EA concurrente podría potenciar el estímulo hipertrófico al entrenamiento de EF de corta duración.
La hipertrofia muscular inducida por ejercicio ocurre a través del aumento de la tasa de síntesis de proteínas del músculo y/o la reducida degradación de las mismas, intensificando el recambio neto de proteínas y permitiendo un acrecentamiento de las proteínas (Kumar y cols. 2009). El EF agudo provoca un aumento de 2 a 5 veces de la síntesis de proteínas del músculo, que puede persistir durante 48 hs (Kumar y cols. 2009). De alguna manera poco apreciable, los turnos de EA agudo también estimulan la síntesis de proteínas del músculo (Sheffield-Moore y cols. 2004, Miller 2005, Harber y cols. 2010), aunque en parte debido a una tasa mayor de síntesis en la fracción de las proteínas sarcoplasmáticas (Wilkinson y cols. 2008). Colectivamente, estos registros infieren una mayor actividad contráctil que impone una alteración global, en lugar de un modo específico del metabolismo proteico del músculo no entrenado.
La síntesis de proteínas del músculo esquelético se regula vía las rutas del señalamiento molecular que intensifican la traducción del ARNm. En este sentido, la vía de la diana de rapamicina en células de mamífero (mTOR) se cree que juega un rol principal (Dreyer y cols. 2006, Coffey y Hawley 2007), regulando la eficiencia de la traducción, incluyendo las moléculas en la misma dirección kinasa de p70S6 (p70S6K), la proteína ribosomal S6 (rpS6) y el factor 2 de alargamiento eucariótico (eEF2). La activación de estas proteínas es acompañada por los aumentos en la síntesis de proteínas del músculo, favoreciendo la hipertrofia muscular en respuesta al EF crónico (Mayhew y cols. 2009, Dreyer y cols. 2010). Es interesante observar que, el fuerte señalamiento de la mTOR es evidente después del EF y EA (Dreyer y cols. 2006, Mascher y cols. 2007, Camera y cols. 2010), indicando una capacidad de traducción mejorada después de cualquier modo de ejercicio. Sin embargo, no está claro si esto se traduce en respuestas de señalamiento amplificadas (Lundberg y cols. 2012), inalteradas (Carrithers y cols. 2007) o compuestas (Coffey y cols. 2009), cuando se realizan el EA y el EF simultáneamente. No obstante, algunos recientes resultados de una investigación indican que un paradigma de EA+EF de 5 semanas realizado por sujetos previamente desentrenados (Lundberg y cols. 2013), produjo una hipertrofia muscular mayor que el EF sólo.
Aún más, parece ser que el ejercicio agudo estimula una respuesta celular más transitoria y específica en el músculo entrenado que en el desentrenado (Tang y cols. 2008, Wilkinson y cols. 2008), infiriendo que el entrenamiento crónico hace menos evidente la respuesta inespecífica al ejercicio agudo, evidente en el músculo desentrenado (Kim y cols. 2005, Kumar y cols. 2009).
Eventualmente, esto facilitaría adaptaciones fuertes de fracciones de proteínas específicas, es decir, miofibrilares y mitocondriales, conocidas de ser estimuladas más fácilmente con el entrenamiento de de la fuerza (Tesch 1988, Kim y cols. 2005) y del entrenamiento aeróbico (Hawley 2002), respectivamente.
Mientras los eventos de señalamiento de traducción han sido asociados con la respuesta de síntesis de proteínas del músculo al EF (Mayhew y cols. 2009), unos pocos reportes hacen pensar en una 'foto instantánea' de que marcadores moleculares pueden de hecho pronosticar una sensibilidad adaptativa del músculo al entrenamiento de la fuerza crónico. Por ejemplo, la fosforilación de la p70S6K se correlacionó con el aumento subsecuente en la masa muscular después de 6 semanas de estimulación eléctrica en ratas (Baar y Esser 1999), así como en un entrenamiento de 14 semanas de EF en hombres (Terzis y cols. 2008). Sin embargo, esto no es un hallazgo consistente, y un reciente estudio que emplea 3 regímenes de EF diferentes no confirmó tal relación (Mitchell y cols. 2012). En el nivel de la expresión de los genes, la reducción de la miostatina inducida por el EF agudo se correlacionó con las ganancias subsecuentes en la fuerza de 1RM y el área de corte transversal muscular después del entrenamiento (Raue y cols. 2012).
Dada esta ambigüedad, más evidencia se necesita antes de que marcadores moleculares individuales puedan identificarse para pronosticar resultados fisiológicos a largo plazo, con alguna alguna certeza.
Por esto, Tech y colaboradores, han planteado la hipótesis de que: (i) la expresión aguda del gen y la fosforilación de las proteínas, podrían inferir una respuesta 'anabólica‘ mayor después del EA+EF comparado con EF en el estado desentrenado, pero no en el entrenado; (ii) las respuestas moleculares desplegarían una respuesta más 'específica del modo' en el músculo entrenado que en el músculo desentrenado; y (iii) la p70S6K y la miostatina se correlacionarían con los cambios en el tamaño del músculo y en la función muscular 'in vivo', que son el resultado del entrenamiento de EA+EF y el entrenamiento de EF.
Figura 1. Protocolo-esquema.
Para ello, 10 hombres jóvenes (25+- 4 años, 184+-6cm, y 83±13 kg; sanos y moderadamente activos en deportes recreativos) realizaron un entrenamiento EA+EF (concurrente) y un entrenamiento EF unilateral de una pierna durante 5 semanas. El programa comprendió 15 sesiones de EA y 12 sesiones de EF. Antes y después del entrenamiento, un turno de EF agudo con o sin EA precedente (6 hs) fue completado.
Protocolo del entrenamiento: En resumen, una pierna realizó EA+EF concurrente, mientras el miembro opuesto sólo hizo EF. Se aleatorizaron las piernas seleccionadas para el EA+EF de una manera compensada. El período del entrenamiento de 5 semanas comprendió 15 de EA y 12 sesiones de EF. Para permitir la recuperación entre los turnos, el EF se realizó 6 hs después de la
realización del EA en el mismo día. El EA se dirigió con una sola pierna en cicloergómetro exigiendo y aislando los músculos del extensor de la rodilla (Andersen y col. 1985). Un test incremental fue realizado para evaluar la carga de trabajo máxima (Wmax) y el rendimiento de resistencia (Lundberg y cols. 2013). La resistencia era aumentada por 2.5 N cada 2 minutos hasta el fallo, para mantener una cadencia de 60 rpm. La Wmax fue definida como la última carga de trabajo con éxito completada. Los sujetos pedalearon 40 minutos con una carga de ~70% de Wmax en 60 rpm. Para asegurar los esfuerzos muy extenuantes se supervisaron valuaciones de esfuerzo percibido continuamente de tal forma que la intensidad podría modificarse durante cada sesión. En la realización, la carga de trabajo era aumentada por ~20 W y el ejercicio continuaba hasta al fallo manteniendo la cadencia (~2.5 minutos). El EF comprendió extensiones de rodilla unilaterales concéntricas y excéntricas máximas para ambas piernas usando un ergómetro de extensión de rodillas (Tesch y cols. 2004) (Tecnología de YoYo, Estocolmo, Suecia). Cada pierna realizó 4 series de 7 repeticiones con una recuperación de 2 minutos entre las series.
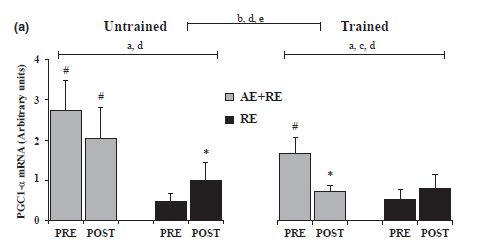
Figura 2 Niveles de PGC-1α antes y después de
3hs del ejercicio de fuerza, con o sin EA+EF precediendo al ejercicio aeróbico
en una condición entrenada vs desentrenada (Fernandez-Gonzalo, T. R. Lundberg
and P. A. Tesch, 2013). Véase cómo reacciona el músculo no entrenado.
Con los resultados, se observó que realizar EA 6hs antes de EF aumentó el señalamiento de la p70S6K y la expresión de MuRF-1/atrogina-1 en el músculo desentrenado comparado con el EF sólo. Igualmente, las respuestas moleculares agudas fueron más ‘refinadas' en el estado entrenado que en el estado desentrenado, como fue indicado por el fallo del EF para provocar una actividad transcripcional mayor de los genes involucrados en las adaptaciones de tipo de resistencia. Merece destacarse que en medio de las adaptaciones moleculares en grande coincidió con los cambios globales del músculo demostrados después del entrenamiento de 5 semanas, ningún único marcador molecular podría pronosticar los cambios inducidos por el entrenamiento en el tamaño del músculo, fuerza o potencia. La fosforilación de la p70S6K tendió a ser mayor después de EA+EF que de EF.
El MuRF-1 y la atrogina-1 mostraron una mayor expresión después de EA+EF agudo que de EF en el estado desentrenado. Dado que ambos genes están envueltos en la degradación de proteínas del proteasoma dependiente (Coffey y Hawley 2007), un evento necesario para el remodelamiento del tejido inducido por ejercicio (Leger y cols. 2006, Cunha y cols. 2012) y crecimiento muscular (Hwee y cols. 2013), es probable la respuesta exacerbada en el estado desentrenado habilitado para una más marcada hipertrofia muscular luego del entrenamiento AE+EF.
Es interesante observar que, MuRF-1 fue inferior en EA+EF, y la atrogina-1 fue similar para las piernas en el estado entrenado. Colectivamente, la sensibilidad de MuRF-1 y de atrogina-1 a las diferentes exigencias del ejercicio impuestas aquí, sostiene la hipótesis de que el EA+EF, y tanto más que el EF, produce un estímulo mayor para el recambio de proteínas del tejido en el estado desentrenado que en el estado entrenado. Aún más y coincidiendo con respuestas del ejercicio de otros genes seleccionados, el MuRF-1 y la atrogin-1 se atenuaron después del entrenamiento crónico. Esta noción apoya el dogma de una progresión rápida en las adaptaciones funcionales y musculares durante la fase de entrenamiento inicial en el estado desentrenado. Así, es bastante evidente que las relaciones entre los marcadores moleculares agudos y las adaptaciones musculares que se manifiestan después del entrenamiento crónico, si están presentes en todas, sos débiles. Por ejemplo, y propuesto como el 'marcador representativo' de la hipertrofia (West y cols. 2010), la p70S6K no se correlacionó con el aumento inducido por el entrenamiento en el tamaño del músculo. Similarmente, la fosforilación de la p70S6K, determinado 1 hs post-EF, no se correlacionó con las ganancias subsecuentes en el tamaño de la fibra muscular o músculo entero, después del 10 semanas de entrenamiento de EF (Mitchell y cols. 2012).
Sumado todo, estos resultados actuales (Mitchell y cols. 2012)) contrastan con la noción de una relación entre la fosforilación de la p70S6K y las ganancias inducidas por entrenamiento en la masa muscular en roedores (Baar y Esser 1999) y en humanos (Terzis y cols. 2008). Imperiosamente, las discrepancias en los resultados de los estudios podrían ser explicadas por factores múltiples inherentes en el diseño del estudio, por ejemplo, momento de la muestra de las biopsias, nivel acondicionando físico de los sujetos y la exigencia del ejercicio en particular empleado. En este contexto, debe recordarse que Baar y Esser (Baar y Esser 1999) analizaron la fosforilación de la p70S6K en cuatro diferentes músculos de ratas 6 hs después de la estimulación eléctrica (dos veces semanalmente durante 6 semanas) y trazaron la variación porcentual en la fosforilación versus el aumento subsecuente en la masa muscular.
Por lo tanto, el estudio de Tech muestra que 5 semanas de entrenamiento AE+EF y de EF altera la respuesta de genes importantes y el señalamiento de proteínas después del ejercicio agudo coincidiendo con adaptaciones musculares crónicas resultantes. La respuesta de la expresión del gen aguda fue típicamente más efímera en el estado entrenado. También parece que el entrenamiento de 5 semanas disminuye la inferencia global de la respuesta aguda mayor 'anabólica' demostrada después del EA+EF en el músculo desentrenado. Esto podría deducir que el EA actúa sinergéticamente sólo con el EF durante el entrenamiento de corta duración, ya que se relaciona al inicio de la hipertrofia muscular. Finalmente, el actual estudio de Tech no provee ninguna evidencia para apoyar la idea que marcadores moleculares seleccionados del músculo esquelético podrían pronosticar las respuestas adaptativas interindividuales diversas al entrenamiento crónico de EF o de EA+EF concurrente.
Bibliografía
Fernandez-Gonzalo, T. R. Lundberg and P. A. Tesch. Acute molecular responses in untrained and trained muscle subjected to aerobic and resistance exercise training versus resistance training alone. Acta Physiol 2013,209,283–294.
Terzis, G., Georgiadis, G., Stratakos, G., Vogiatzis, I., Kavouras, S., Manta, P., Mascher, H. & Blomstrand, E. 2008. Resistance exercise-induced increase in muscle mass correlates with p70S6 kinase phosphorylation in human subjects. Eur J Appl Physiol 102, 145–152.
Coffey, V.G. & Hawley, J.A. 2007. The molecular bases of training adaptation. Sports Med 37, 737–763.
Coffey, V.G., Shield, A., Canny, B.J., Carey, K.A., Cameron-Smith, D. & Hawley, J.A. 2006. Interaction of contractile activity and training history on mRNA abundance in skeletal muscle from trained athletes. Am J Physiol Endocrinol Metab 290, E849–E855.
Coffey, V.G., Pilegaard, H., Garnham, A.P., O’Brien, B.J. & Hawley, J.A. 2009. Consecutive bouts of diverse contractile activity alter acute responses in human skeletal muscle. J Appl Physiol 106, 1187–1197.
Dreyer, H.C., Fujita, S., Glynn, E.L., Drummond, M.J., Volpi, E. & Rasmussen, B.B. 2010. Resistance exercise increases leg muscle protein synthesis and mTOR signalling independent of sex. Acta Physiol (Oxf) 199, 71–81.
Este tema se incluye en la próxima webinar sobre Entrenamiento Concurrente
