Configuración de las Series en el Ejercicio de Fuerza: Fatiga Muscular y Efectos Cardiovasculares
Set Configuration in Resistance Exercise: Muscle Fatigue and Cardiovascular Effects
Dan Río-Rodríguez, Eliseo Iglesias-Soler y Miguel Fernández del Olmo
Artículo publicado en el journal Revista de Entrenamiento Deportivo, Volumen 31, Número 4 del año 2017.
Publicado 30 de agosto de 2016
Resumen
Palabras clave: fuerza, cortical, hemodinámica, series de ejercicios, fatiga
Abstract
Keywords: Strength, cortical, hemodynamic, set of exercises, fatigue
INTRODUCCIÓN
La modulación cardiovascular y su asociación con el ejercicio de fuerza han tenido un enfoque de investigación extensiva [1]. Las respuestas de la presión sanguínea (PS) y la frecuencia cardíaca (FC) al entrenamiento de la fuerza son creídas que son moduladas por mecanismos periféricos y mecanismos centrales [1,2]. El rol de estos mecanismos puede mediarse por los rasgos de la configuración del entrenamiento de la fuerza (es decir, el volumen, la intensidad, el número de repeticiones/serie, pausas entre las series), aunque esta relación no ha sido extensivamente estudiada. La configuración tradicional de las series (EFT) es el procedimiento más común dentro del entrenamiento de la fuerza y consiste en realizar cada repetición de una serie sin pausa hasta el fallo [3]. Esta configuración induce fatiga y molestia [4]. En suma, la PS y la FC suben proporcionalmente con las repeticiones sucesivas dentro de una serie [2], y la tasa a la cual la PS aumenta, está relacionada con la intensidad y la longitud de una serie [5].
Un nuevo método para la configuración de las series es la configuración de la pausa de intra-serie (PIS) que introduce pausas entre grupos pequeños o únicos de repeticiones (es decir, entrenamiento por conglomerados). Así, el esfuerzo percibido es reducido mientras el rendimiento es mantenido [4]. Este tipo de entrenamiento de la fuerza intermitente reduce la respuesta de la PS durante el ejercicio dinámico [6] y el ejercicio isométrico [7] comparado con la configuración del EFT. La modulación diferencial de la PS en respuesta a EFT y PIS puede ser debida a las diferencias en las proporciones de trabajo-pausa (es decir, esfuerzo vs tiempo de descanso) entre las configuraciones. Sin embargo, un estudio previo ha demostrado que la menor respuesta de la PS durante el PIS comparado con EFT, se mantuvo incluso cuando las relaciones de trabajo-pausa se igualaban para ambas configuraciones [8], indicando que otros factores sostienen estas diferencias. Nosotros propusimos que la PIS induce niveles más bajos de fatiga muscular, comparado con EFT, puesto que esta configuración está asociada con un rendimiento mecánico mejorado [9] y menos esfuerzo percibido [4,8,10]. Es más, la fatiga periférica y central pueden jugar roles diferentes en cada configuración. La fatiga periférica refleja un deterioro en, o distal a la unión neuromuscular, y puede evaluarse registrando la fuerza de contracción que es inducida por un estímulo nervioso periférico mientras el músculo está en reposo [11]. La fatiga central indica un fallo para activar a las neuronas motoras adecuadamente [12], y puede evaluarse registrando la fuerza evocada por un estímulo nervioso durante un esfuerzo voluntario máximo [13]. En suma, la fatiga muscular puede asociarse con cambios que son causadas por la estimulación magnética transcranial (EMT), en el potencial motor evocado (PME) [14], la inhibición intracortical corta (IICC) [14] y la facilitación intracortical (FIC) [15,16], aunque estos cambios pueden ser difíciles de interpretar [17].
No hay ningún estudio a la fecha que haya investigado la fatiga central y periférica inducida por las configuraciones del EFT y PIS, con una relación de trabajo-pausa igual, y su relación con los cambios cardiovasculares. Así, el objetivo de este estudio fue investigar las diferencias en las respuestas agudas neurofisiológicas, mecánicas y cardiovasculares de las configuraciones del EFT y PIS emparejadas para el volumen, intensidad y relación de trabajo-pausa. Esto nos permitirá comprobar la hipótesis de que los niveles de fatiga muscular inducidas por diferentes configuraciones del ejercicio de fuerza dan cuenta de las diferencias en su respuesta cardiovascular. Esto proveerá una visión más amplia de los mecanismos que subyacen la modulación cardiovascular en respuesta a los cambios en la configuración de las series de fuerza.
MATERIALES Y MÉTODOS
Sujetos
Once varones jóvenes participaron en este estudio (edad 21.0±2 años, altura 177.2±0.08 cm, peso 72.4±6.6 kg). Los sujetos se reclutaron del Instituto de Educación física y Deporte de la Coruña, España. Todos los sujetos eran físicamente activos y ninguno de ellos reportó deterioro neurológico, lesiones del miembro inferior y/o contraindicaciones a las EMT. El consentimiento informado por escrito se obtuvo de todos los sujetos después de una explicación completa de los procedimientos y riesgos implicados. Todos los procedimientos experimentales fueron aceptados por el comité de ética de la Universidad de La Coruña y confirmados por la Declaración de Helsinki.
Procedimiento experimental
Cada sujeto participó en cinco sesiones de familiarización y tres sesiones experimentales. El protocolo se describe en la Figura 1A. Las sesiones de familiarización fueron usadas para relacionar a los sujetos con las contracciones voluntarias máximas, los estímulos eléctricos y magnéticos y con la tasa de escala de esfuerzo percibido. La primera sesión experimental fue dirigida para calcular la contracción isométrica voluntaria máxima (MCV, maximal voluntary isometric contraction) durante un ejercicio de extensión de rodillas y el tiempo hasta el agotamiento (TTF, time to task failure) al 50% de la MCV. Las otras dos sesiones experimentales corresponden a dos sesiones de entrenamiento de la fuerza: con una configuración tradicional de las series (EFT) o con una configuración de pausa de intra-serie (PIS). El orden de las sesiones de EFT y PIS fue compensado, separadas por 1 semana y se llevaron a cabo en el mismo momento del día para cada sujeto. Cada sesión de entrenamiento empezaba con los registros hemodinámicos y las mediciones corticales (usando el estímulo magnético transcranial de la corteza motora) con el sujeto en reposo. Luego, después de un precalentamiento estandarizado, los sujetos realizaron las valoraciones dinámicas y neuromusculares (contracciones voluntarias máximas y el estímulo eléctrico, respectivamente). Los sujetos, entonces, empezaron el procedimiento de ejercicio (con configuración EFT o PIS) durante las cuales se registraron los parámetros cardiovasculares continuamente. Inmediatamente después del ejercicio, se registraron las valoraciones dinámicas y neuromusculares, y la tasa de esfuerzo percibido fue reportada por los sujetos. Diez minutos más tarde, se obtuvieron los registros corticales y cardiovasculares.
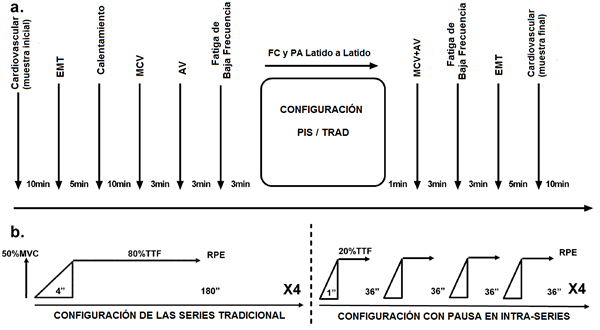
Figura 1. Esquema del protocolo experimental.
(a) Programación de las mediciones. (b) Protocolos del entrenamiento realizados en cada sesión. Cada protocolo (EFT/PIS) utilizó la misma intensidad, tiempo total de contracción muscular y de pausa.
Contracción máxima voluntaria
Los sujetos fueron sentados en una máquina de extensión de rodillas modificada (BF100, Biotech Bioiso, Brasil) unida a una célula de fuerza (sensibilidad: 2 mV/V y 0.0028 V/N; NL63-200, Digitimer S.A., Welwyn Garden City, Reino Unido) con las caderas flexionadas a 90° y la rodilla derecha flexionada a 90° y firmemente atada al brazo de palanca de la máquina. Para asegurar que los participantes sólo usaron los músculos extensores de la rodilla, un cuidado especial se tomó en el posicionamiento del brazo de palanca sobre el tobillo, y un cinturón fue usado para evitar el movimiento de la cadera y del tronco. Se les pidió a los participantes que realizaran una MCV "lo más veloz y fuerte posible" y mantenerla durante 4 segundos [18]. Nosotros seguimos las recomendaciones de Gandevia [12] para una medición de una MCV fiable: (i) la retroalimentación del rendimiento era determinada durante todas las contracciones voluntarias (imagen visual), (ii) un estímulo verbal estandarizado apropiado fue dado por los investigadores, (iii) se les permitió a los sujetos rechazar esfuerzos que ellos no consideraban 'máximo' e intentaban otra prueba después de 3 minutos.
Registros de EMG
Las señales electromiográficas (EMG) fueron registradas usando electrodos autoadhesivos Ag/AgCl bipolares de 10 mm de diámetro (F9079P, FIAB, Vicchio, Italia) en configuración bipolar del recto femoral (RF) y del bíceps femoral siguiendo las recomendaciones de SENIAM [19], con una distancia entre los electrodos de 25 mm y con el electrodo de referencia en la rótula. La posición de los electrodos fue marcada en la piel para que fuera usada en la sesión subsecuente. Los sitios de registro fueron afeitados, desgastados y limpiados con alcohol de isopropilo para obtener una impedancia baja (Z, 5kΩ). Las señales de la EMG fueron amplificadas y se filtraron con una banda de frecuencias de ancho de banda de 10 Hz a 1 kHz (ganancia = 1,000). Las señales de la EMG se digitalizaron simultáneamente con las señales del torque, usando una carta de adquisición a una tasa de muestreo de 5 kHz por canal (Digitimer D360, Welwyn Garden City, Reino Unido) y guardadas para un análisis más tarde en una computadora con una escritura Signal script.
La fuerza y las señales de la EMG eran sincronizadas usando un convertidor Power 1401 A-D y software Signal [Cambridge Electronics Design (CED), Cambridge, Reino Unido].
Estimulación eléctrica
Ondas M. La estimulación eléctrica fue usada para activar el nervio femoral. Un cátodo de sonda era presionado con la mano sobre el triángulo femoral de 3-5cm debajo del ligamento inguinal. El ánodo, un electrodo autoadhesivo de 130×80mm (Cefar-Compex Scandinavia AB, Suecia), se aplicó al pliegue del glúteo. Los pulsos de ondas al cuadrado con una amplitud de 1 ms a un voltaje máximo de 400 VS desde un estimulador de corriente continua (Digitimer DS7A, la Welwyn Jardín Ciudad, Reino Unido) fue librado al músculo de reposo. La intensidad óptima de estimulación para un único estímulo era determinada aumentando la intensidad hasta la amplitud de la contracción evocada que no mostraba más aumento (Mmáx). La intensidad usada para las técnicas de la estimulación subsecuentes era del 120% de la que un torque máximo evocado con Mmáx subsecuente del RF (140-240 MA).
Fatiga de baja frecuencia.
Dos estímulos eléctricos al 100-Hz (Db100) y 10-Hz (Db10) fueron dados 4 segundos separadamente sobre el nervio femoral dos segundos después de una MCV de los músculos extensores de la rodilla [20].
Interpolación de descarga.
La técnica de interpolación de descargas [13] se aplicó a los músculos extensores de la rodilla. Durante una MCV, un estímulo eléctrico supramáximo superpuesto fue librado al nervio femoral, seguido por un segundo estímulo eléctrico de 1.5 segundos después del final de la MCV.
Estimulación magnética transcranial (EMT) de la corteza motora
Los pulsos únicos de EMT de 1-ms de duración (Magstim BiStim 2002, The Magstim Company, Dyfed, Reino Unido) fueron aplicados vía una bobina cóncava de doble cono (diámetro: 110 mm; potencia máxima: 1.4 T). El asa de la bobina de la EMT se posicionó sobre el vértice de la cabeza y se sostuvo tangencial al cráneo en una orientación anterior-posterior. La bobina se posicionó por encima de la corteza motora izquierda y su orientación fue determinada localizando el potencial evocado motor más grande (MEP) en el RF derecho, con la respuesta motora más baja en los bíceps femorales. El sitio óptimo de estimulación era marcado con un marcador rojo indeleble para asegurar la reproductibilidad de las condiciones de la estimulación para cada sujeto a lo largo de las sesiones. El umbral motor de reposo (RMT) era determinado como la intensidad mínima del estímulo necesario para provocar un MEP en el RF de al menos 50μV en 3 de 5 pruebas consecutivas.
La inhibición intracortical de intervalo corto (IICC) y la facilitación intracortical (FIC) se registraron usando técnicas que se han descrito previamente [21,22]. Los estímulos magnéticos emparejados a los diferentes intervalos inter-estímulos fueron aplicados en el sitio óptimo del cuero cabelludo para evocar las respuestas en el RF derecho mientras el sujeto estaba en reposo. El test de estimulación (segundo) fue puesto a una intensidad suficiente para evocar una respuesta en el RF de aproximadamente 0.5-1 mV. El estímulo de acondicionamiento (primero) fue a una intensidad del 80% de la potencia estimuladora debajo del umbral motor de reposo para el músculo designado. El intervalo entre los estímulos de prueba y acondicionamiento era de 3 ms para la investigación de la IICC y de 15 ms para la investigación de la FIC. Los 'timing' inhibitorios, excitadores y de EMT sólo fueron incorporados en un único bloque de 45 estímulos. Por lo tanto, en el total hubo 15 pruebas para cada condición, y se aleatorizaron los órdenes de la presentación de las condiciones.
Registros cardiovasculares
Se registraron los parámetros cardiovasculares y autónomos usando un sistema de medición no invasivo Task Force Monitor (CNSystems Medizintechnik GmbH-Austria), con 4 electrodos para el registro electrocardiológico y dos dispositivos de pletismografía pneumática puestos en la primera falange de los dedos segundos y terceros de la mano izquierda. La medición de la presión distal era corregida regularmente por una medición oscilométrica tomada de la arteria braquial derecha. Los registros fueron controlados a una tasa de muestreo de 1000 Hz.
Tasa de Esfuerzo Percibido (RPE)
La tasa de esfuerzo percibido fue registrada usando una escala visual con ayudas verbales (escala Omni) [23]. Antes de cada protocolo de ejercicio, la definición estándar del esfuerzo percibido y las formas de empleo para el modo específico de la Escala OMNI, fueron leídas a los sujetos. La escala se puso delante de los sujetos debajo de la pantalla de retroalimentación durante la prueba de ejercicio.
SESIONES EXPERIMENTALES
Primera sesión experimental.
La MCV durante un ejercicio de extensión de rodillas isométrico y el TTF al 50% de MCV fueron registrados para cada sujeto. La MCV se realizó conforme con los modos de empleo descritos previamente. Cinco minutos después, el test de TTF fue realizado. Los sujetos fueron exigidos a ejercitarse continuamente a una fuerza del 50% de MCV el mayor tiempo posible. Se los alentaba verbalmente durante la duración del test. Se consideraba que el test era completado cuando los sujetos no eran capaces de lograr la fuerza requerida.
Sesiones de entrenamiento.
Cada sesión de entrenamiento empezó con un precalentamiento estandarizado que incluyó 5 minutos de pedaleo en un cicloergómetro (Monark 828E; Monark Exercise AB, Vansbro, Suecia) a una potencia equivalente de 60 W seguido por 5 contracciones isométricas submáximas de extensión de rodillas (2x50-2x70-1x90% de MCV). Después de ese precalentamiento, los sujetos realizaron una de las sesiones de entrenamiento.
La sesión de configuración EFT consistió en 4 series isométricas al 50% de MCV de los músculos extensores de rodillas. La duración de cada serie se ajustó al 80% del TTF para cada sujeto (obtenida en la primera sesión experimental). El intervalo de pausa entre las series era de 180 segundos.
La sesión de configuración de PIS consistió en 16 series al 50% de MCV isométrica de los músculos extensores de las rodillas. La duración de cada serie se ajustó al 20% del TTF para cada sujeto. El intervalo de pausa entre las series era de 36 segundos.
El tiempo total de contracción muscular y en reposo para cada sujeto era equivalente entre las sesiones de entrenamiento (es decir, un sujeto con un TTF de 60 segundos realizaba ambas sesiones de entrenamiento con un tiempo toal de contracción muscular de 192 segundos y un tiempo de pausa total de 540 segundos). A fin de igualar el tiempo de la contracción muscular, cada contracción empezaba con una curva progresiva de 4 segundos en EFT y 1 segundo en PIS. La Fig. 1B representa gráficamente ambas configuraciones de las series de entrenamiento.
DATA ANÁLISIS DE DATOS
Estimulación eléctrica.
La amplitud de la Mmáx evocada durante un único estímulo eléctrico supramáximo fue registrada. Las tasas máximas de desarrollo de la fuerza (ST-RFD) y la mitad del tiempo de relajación (ST-½RRT) de la única activación, fueron medidas usando la estimulación del nervio femoral. La tasa de desarrollo de la fuerza fue calculada como el valor máximo del primer momento derivativo de la curva de fuerza-tiempo durante una única activación. La tasa de relajación era calculada desde el torque pico hasta la mitad del torque pico. La activación voluntaria máxima fue cuantificada usando la técnica de interpolación de la activación [13]. Brevemente, se comparó la fuerza producida por una activación superpuesta librada durante la MCV con la fuerza producida por una única activación librada durante una relajación de ∼2 segundos después de la MCV:
Activación voluntaria (%) = [1 - (activación superpuesta/activación de reposo)] ×100.
El índice de fatiga de baja frecuencia (LFF) fue cuantificada como la proporción entre el torque producido con 10 Hz de estimulación y el producido con 100 Hz (10 Hz/100Hz).
EMT.
La amplitud pico-a-pico del MEP fue medido off-line. El MEP medido en el RF se normalizó a Mmáx [17]. Los valores de IICC y de FIC se expresaron como el porcentaje de la amplitud del MEP de la prueba incondicionado.
Variables cardiovasculares.
La presión sanguínea sistólica promedio (PSSprom), la presión sanguínea diastólica promedio (PSDprom), la presión arterial promedio (PAprom) y la frecuencia cardíaca promedio (FCprom) se registraron latido a latido y se promediaban al final de cada sesión de entrenamiento incluyendo las pausas. El producto de FC-Presión (PFCP) fue calculado como la frecuencia cardíaca multiplicada por la PAprom (FCxPAprom) como está descrito en [24]. El producto de la FC-Presión es un indicador de la carga de trabajo cardíaco y el requerimiento de oxígeno del corazón.
Los índices de variabilidad de la frecuencia cardíaca fueron analizados de acuerdo a la Task Force of the European Society of Cardiology y la North American Society of Pacing and Electrophysiology [25] y eran calculados durante los 5 minutos últimos de una ventana de 10 minuto antes y después del ejercicio. Las densidades de potencia de los intervalos de R-R promedio (RRI) en baja banda (LF, 0.04-0.15 Hz) y alta banda de frecuencia (HF,> 0.15-0.40 Hz) se analizaron con métodos autoregresivos de frecuencia de dominio [26]. Se identificaron latidos ectópicos ocasionales visualmente y se reemplazaron con RRI interpolados [27].
La sensibilidad barorefleja (BRS) fue determinada usando el método de secuencia como previamente fue descrita [28]. Los tiempos de series para RRI y PSS se examinaron para sucesiones en los que RRI y PSS aumentaban simultáneamente (BRS-arriba) o disminuían (BRS-abajo) para un mínimo de tres latidos consecutivos. El Task Force Software pone los valores del umbral a 1 mmHG en PSS y 6 ms en RRI [29]. La BRS se computó como la proporción RRI/PSS (ms·mmHg-1) durante el reposo inicial y el final del ejercicio.
Tasa de esfuerzo percibido (RPE).
Una percepción general del esfuerzo (RPE-total) y una percepción del esfuerzo percibido local (RPE-pierna) fueron reportado por los sujetos al final de cada serie usando la Escala OMNI [23,30]. Los valores reportados por los sujetos por cada configuración de serie a fin de obtener una RPE promedio para cada configuración del ejercicio de fuerza.
Análisis estadístico
Los análisis de variaciones (ANOVA) de mediciones repetidas con el tiempo (antes, durante y después del ejercicio) y la configuración de las series (EFT, PIS) como factores principales, fueron aplicados valores promedio y valores máximos de las variables cardiovasculares (FC, PSS, PSD, PAprom, FCxPAprom).
Los ANOVAs de medidas repetidas con el tiempo (antes vs después del ejercicio) y con la configuración de las series (EFT vs PIS) como factores principales, fueron realizados para las siguientes variables: PME, IICC, amplitud de la FIC, Potencia Total, LF, HF, BRS-arriba, BRS-abajo, MCV, Mmáx, AV, AU (activación única), ST-RFD, ST-½RRT, LFF. Los análisis Post-hoc se dirigieron usando la corrección de Bonferroni.
La distribución normal se verificó usando un test de Shapiro-Wilk de normalidad. Cuando la normalidad no podía asumirse, transformaciones logarítmicas eran completadas para ser requerido. El Student's t apareados fue usado para comparar la RPE entre las configuraciones de las series. Las correlaciones entre las variables fueron determinadas usando el momento del producto de Pearson o los coeficientes rho de Spearman como apropiados para explorar las asociaciones entre las variables cardiovasculares, mecánicas y neurofisiológicas. El análisis estadístico se dirigió con el software de SPSS versión 15.0 (SPSS, Chicago, IL). La significancia estadística estaba fija en P≤ 0.05.
RESULTADOS
Todos los sujetos completaron todas sesiones de familiarización y las sesiones experimentales. Ellos pudieron realizar las sesiones de entrenamiento y los tests como era requerido. Un sujeto se excluyó del análisis de parámetros corticales puesto que ningún PME pudo inducirse por estimulación de EMT. Los análisis para los parámetros restantes se realizaron con y sin este sujeto y ninguna diferencia en los resultados se encontró. Por lo tanto, este sujeto sólo se excluyó del análisis del PME. Ninguna diferencia significativa se encontró en los valores básicos entre las configuraciones de las series para todas las variables registradas (los valores P fueron de 0.188 a 0.854).
Contracciones máximas voluntarias
Los resultados de la MCV se observan en la Fig. 2A. Hubo una disminución significativa en la MCV en ambas configuraciones de las series (P≤0.001). La MCV post-ejercicio fue significativamente baja para la configuración EFT comparado con la configuración PIS (P = 0.019) indicando una disminución mayor en la MCV para EFT comparado con PIS (ver Tabla 1).
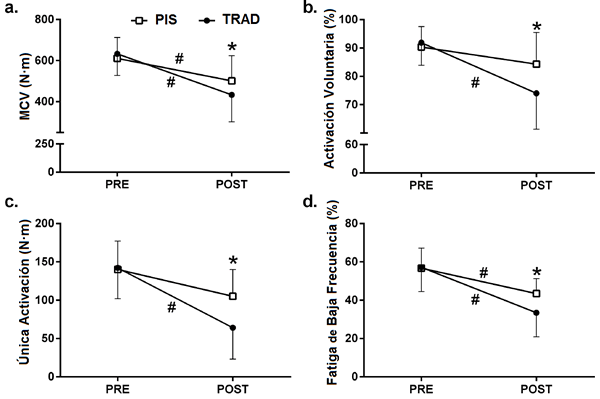
Figura 2.
Los cambios en la contracción voluntaria máxima (a), activación voluntaria (b), única activación (c), fatiga de baja frecuencia (d), después del rendimiento de una configuración de serie tradicional (círculos negros) y una configuración de pausa de intra-serie (cuadrados blancos). Los valores son mostrados en promedio y en SD.
* diferencias significativas entre las configuraciones de las series.
# diferencias significativas entre los valores PRE y valores POST.
Tabla 1. Los valores promedio, SD y P, de los efectos mecánicos, fatiga central y periférica de cada configuración de serie.
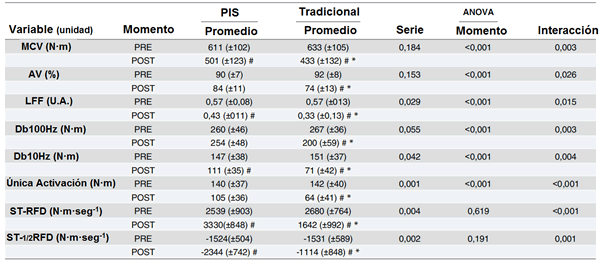
MCV, máxima contracción voluntaria; AV, activación voluntaria; LFF, índice de fatiga de baja frecuencia; Db100Hz, pulso eléctrico doble a 100Hz; Db10Hz, pulso eléctrico doble a 10Hz; Única activación, único pulso eléctrico; ST-RFD, tasa de desarrollo de la fuerza de una activación única; ST-½RRT, tasa de relajación de una única activación; PIS, configuración de pausa de intra-serie; Tradicional, configuración tradicional de las series.
* diferencias significativas entre las configuraciones de las series.
# diferencias significativas comparado con los valores de PRE.
Activación (contracción) única
Ambas configuraciones de las series llevaron a una reducción del torque de la activación única (Tabla 1). Sin embargo, esta reducción fue significativa en la configuración EFT (P <0.001), mientras la configuración PIS sólo mostró una tendencia para una reducción (P = 0.053). En suma, los valores de torque de activación única post-ejercicio estuvieron significativamente más bajos en la configuración tradicional comparado con la configuración PIS (P <0.001) (Fig. 2C). El análisis para el ST-RFD reveló que mientras la configuración tradicional de las series indujo una disminución significativa para el ST-RFD (P = 0.008), la configuración PIS llevó a un aumento de este parámetro (P = 0.016). Finalmente, el ST-½RRT significativamente sólo aumentó en la configuración PIS (P = 0.001) y estos valores post-ejercicio fueron significativamente superiores para la configuración PIS comparado con la configuración EFT (P <0.001).
El análisis de la onda M para el recto femoral (Fig. 3D) mostró un efecto significativo para el tiempo (F1,10 = 17.091, P = 0.002) pero ningún efecto principal para la configuración de las series (F1,10 = 0.234, P = 0.639), ni ninguna interacción de configuración de las series x tiempo (F1,10 = 0.020, P = 0.890) (Fig. 2D).
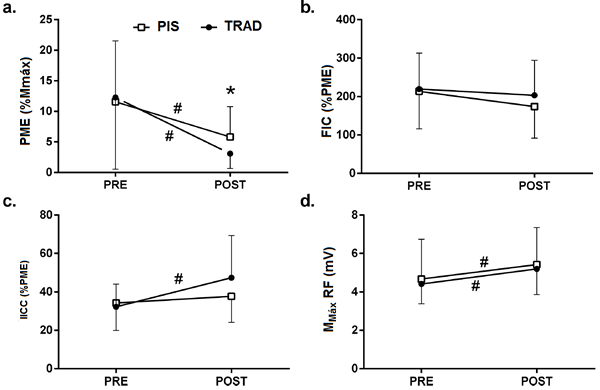
Figura 3.
Cambios en los potenciales evocados motores (a), facilitación intracortical (b), inhibición intracortical corta (c), onda máxima del recto femoral (d), después del rendimiento de la configuración de serie tradicional (círculos negros) y la configuración de pausa de intra-serie (cuadrados blancos). Los valores son mostrados en promedio y en SD.
* diferencias significativas entre las configuraciones de las series.
# dferencias significativas entre los valores PRE y valores POST.
Fatiga de baja frecuencia
El análisis de LFF reveló que la proporción de LFF disminuyó significativamente después de cada configuración de ejercicio (P <0.001 para las configuraciones EFT y PIS) (Tabla 1). En suma, la proporción de LFF post-ejercicio fue significativamente más baja en la configuración tradicional comparada con la configuración PIS (P = 0.003) (Fig. 2D). Mientras que resultados similares fueron encontrados para el componente Db10Hz de LFF, éste no fue el caso para el componente de alta frecuencia medido con Db100Hz. El Db10Hz disminuyó significativamente para ambas configuraciones de las series (P <0.001) y los valores post-ejercicio fueron significativamente más bajos en EFT comparado con PIS (P = 0.003). Sin embargo, los valores de Db100Hz significativamente sólo disminuyeron en la configuración EFT (P = 0.001) y esos valores post-ejercicio fueron significativamente más bajos para la configuración EFT comparada con la configuración PIS (P = 0.007).
Activación voluntaria
El análisis de la activación voluntaria mostró una reducción significativa de este parámetro en la configuración tradicional (P <0.001) pero no en la configuración PIS (Fig. 2B y Tabla 1).
Estimulación magnética transcranial
El análisis de la amplitud del PME normalizado con la onda-M (Fig. 3A) mostró una disminución en la amplitud del PME después del ejercicio para ambas configuraciones de las series (50% y 75% reducción para PIS y EFT, respectivamente). Esta reducción sólo fue significativamente para la configuración EFT (P = 0.031) aunque una tendencia a la significancia se encontró para la configuración PIS (P = 0.053). Las diferencias en las amplitudes del PME post-ejercicio entre las configuraciones de las series fueron estadísticamente significativas (P = 0.034). El análisis de valores de la IICC reveló valores post-ejercicio superiores para la configuración EFT comparado con los valores básicos (ΔEFT = 46%, P = 0.049) y PIS (ΔPIS = 8%, P = 0.516), indicando menos inhibición intracortical para la última configuración, aunque ninguna diferencia estadística se encontró entre los grupos después del ejercicio (P = 0.109). No hubo diferencias significativas en los valores de la FIC entre o después de las configuraciones de las series del ejercicio (Fig. 3B)).
Respuesta cardiovascular durante el ejercicio
El análisis para la FCprom mostró que los valores básicos de ambas configuraciones de las series tuvieron un aumento significativo durante el ejercicio (P ≤ 0.003) retornando a los valores básicos en PIS pero no en EFT después del ejercicio (P = 0.003). La configuración tradicional de las series llevo a valores de FC superiores durante y después del ejercicio comparado con PIS (P <0.001 y P = 0.001) (ver Tabla 2). La FCmáx ese mantuvo elevada durante y después del ejercicio (P ≤ 0.001 y P = 0.013, respectivamente). El análisis post-hoc mostró valores superiores para EFT durante (P 0.001) y después del ejercicio (P = 0.001) con respecto a la configuración PIS.
Tabla 2. Los valores promedio, SD y P, de la respuesta cardiovascular antes, durante y después del ejercicio.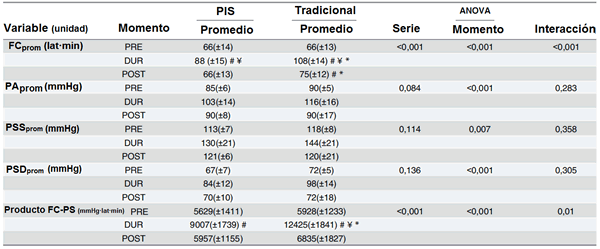
FCprom, frecuencia cardíaca promedio; PAprom, presión arterial promedio; PSSprom, presión sanguínea sistólica promedio; PSDprom; presión sanguínea diastólica promedio; Producto FC-presión, producto de la FC x presión arterial; PIS, configuración de pausa de intra-serie; Tradicional, configuración tradicional de las series.
* diferencias significativas entre las configuraciones de las series.
# diferencias significativas comparado a los valores de PRE.
¥ diferencias significativas comparado a lso valores de POST.
Para la PAprom, el análisis reveló valores superiores para la PA durante el ejercicio comparado con los valores básicos y después del ejercicio (P <0.001 y P = 0.003, respectivamente) y ninguna diferencia antes y después del ejercicio (P> 0.05). El análisis de la PAmáx mostró valores superiores para EFT durante el ejercicio (P = 0.001) comparado con PIS.
El análisis para el PSSprom reveló valores superiores de PSS superior durante el ejercicio comparado con los valores de inicio y después del ejercicio (P = 0.006 y P = 0.005, respectivamente) y ninguna diferencia antes y después del ejercicio (P> 0.05). La PSSmáx mostró valores superiores para EFT durante el ejercicio (P = 0.003) comparado con PIS.
El análisis de la PSDprom mostró valores superiores de la PSD durante el ejercicio comparado con los valores iniciales y después del ejercicio (P ≤ 0.001 y P = 0.002 respectivamente) y ninguna diferencia antes y después del ejercicio (P> 0.05). En suma, el EFT indujo valores superiores comparado con PIS (P = 0.048). El PSDmáx mostró valores superiores en EFT durante el ejercicio (P = 0.001) comparado con PIS.
El producto de la FC-presión aumentó durante el ejercicio comparado con los valores básicos (P <0.001) con diferencias significativas entre PIS y EFT (P <0.001). Se observaron valores significativamente superiores para EFT comparado con PIS durante el ejercicio (P = 0.001) y volviendo a los valores basales después del ejercicio (P = 0.063).
El componente espectral de alta frecuencia de la variabilidad de la frecuencia cardíaca sólo disminuyó significativamente en la configuración tradicional de las series (P = 0.013) y esos valores post-ejercicio fueron más bajos para la configuración EFT comparado con la configuración PIS (P = 0.023) (ver Tabla 3). El análisis para baja frecuencia reveló que los valores post-ejercicio de EFT tenían una tendencia a disminuir (P = 0.051). El valor post-ejercicio para EFT fue significativamente más bajo comparado con PIS (P = 0.012).
Tabla 3. Los valores promedio, SD y P, de la variabilidad de la frecuencia cardíaca y la sensibilidad barorefleja antes y después del ejercicio
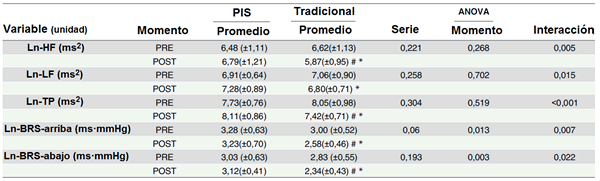
Ln-HF, logaritmo natural de banda del alta frecuencia; Ln-LF, logaritmo natural de banda de baja frecuencia; Ln-TP, logaritmo natural de potencia del espectro total; Ln-BRS-a, logaritmo natural de secuencias ascendentes de sensibilidad barorefleja; Ln-BRS-abajo, logaritmo natural de secuencias descendentes de sensibilidad barorefleja; PIS, configuración de pausa de intra-serie; Tradicional, configuración tradicional de las series.
* diferencias significativas entre las configuraciones de las series.
# diferencias significativas comparado a los valores de PRE.
La potencia total para EFT mostró una reducción significativa después del ejercicio (P = 0.019) mientras que para PIS no se mostró ninguna diferencia significativa (P = 0.066). Los valores de EFT fueron inferiores comparado con los valores de PIS (P = 0.002).
El análisis de la activación barorefleja (BRS-a) reveló una disminución significativa para la configuración EFT (P = 0.002) pero no para la configuración PIS. La BRS-arriba después de la configuración EFT fue significativamente superior compardo con PIS (P = 0.002). La inhibición barorefleja (BRS-baja) post-ejercicio fue significativamente más baja para la configuración tradicional de las series (P ≤ 0.001). Se encontraron diferencias entre las configuraciones de las series (P = 0.020) indicando una sensibilidad barorefleja empeoradal por la configuración EFT
Percepción del esfuerzo
La comparación de la RPE-total entre las configuraciones de las series reveló diferencias significativas (t = -4.1, P = 0.002). Cuando se les pidió a los sujetos que distingan las sensaciones periféricas (RPE-pierna), se encontraron diferencias significativas (t = -4.378, P = 0.001) entre las configuraciones de las series.
Correlaciones
El aumento en el producto de la FC-presión (PFCP), los valores de pre a durante el ejercicio, se correlacionó significativamente y negativamente con el cambio en la activación voluntaria post-ejercicio para la configuración EFT (r = -0.85, P <0.001). El aumento en el PAprom, los valores de pre a durante el ejercicio, mostraron una (r = -0.65, P = 0.03). En suma, la disminución en los valores de la IICC se correlacionó significativamente y negativamente con el cambio en la BRS-baja para la configuración EFT (r = -0.71, P = 0.014). No hubo ninguna correlación entre estas variables para la sesión de configuración PIS.
El valor de RPE-pierna en el entrenamiento tradicional tuvo una correlación negativa fuerte con el cambio en el índice de fatiga de baja frecuencia (r = -0.75, P = 0.008). La RPE-pierna también mostró una relación negativa fuerte con el cambio del pulso de doble de baja frecuencia, Db10 Hz (r = -0.75, P = 0.008). Finalmente, el cambio en el pulso de alta frecuencia evocado eléctrico (Db100 Hz) demostró una correlación positiva significativa con el componente espectral de baja frecuencia de la variabilidad de la FC (r = 0.65, P = 0.030).
DISCUSIÓN
El objetivo de este estudio fue explorar y comparar las respuestas agudas neurofisiológicas, mecánicas y hemodinámicas de configuraciones tradicionales y de la pausa de intra-serie con un igual volumen igual, intensidad y relaciones de trabajo-pausa. Nuestros resultados principales demuestran que la configuración PIS está asociada con los niveles más bajos de fatiga periférica y central, así como bajo estrés hemodinámico y cardiovascular, comparado con una configuración tradicional de las series. Es interesante observar que la fatiga central fue asociada con el estrés cardiovascular durante la configuración del ejercicio de fuerza tradicional pero no durante la configuración de pausa de intra-serie, indicando que los procesos de fatiga central están vinculados con la intensidad de las respuestas cardiovasculares. Por lo tanto, los resultados actuales indican que la configuración de las series tiene un rol clave determinando los niveles de fatiga y los efectos cardiovasculares que son inducidos por los ejercicios de fuerza.
Efectos de la configuración de la serie sobre la función muscular
La configuración de pausa de intra-serie produjo una pérdida de la MCV del 18%, mientras que la configuración EFT indujo un decremento mayor (32%). Estudios previos han demostrado que la configuración PIS está asociado con un rendimiento mecánico superior comparado con el de la configuración EFT [8,9]. Nuestros resultados extienden estos resultados y demuestran esto para los ejercicios isométricos también.
La serie tradicional pero no la configuración PIS llevó a la fatiga periférica, puesto que la tasa de desarrollo de la fuerza y la tasa de tiempo de relajación de las activaciones del torque evocados fueron empeoradas después de la configuración EFT mientras que la configuración PIS llevó a una mejora de estas variables. Estas respuestas opuestas a una activación única pueden ser explicadas por la coexistencia de mecanismos de fatiga y de potenciación que ocurren inmediatamente después del ejercicio [11,12,17,31]. Los aumentos de la amplitud de la onda-M que se observaron después de ambas configuraciones de las series indican que hay un efecto de potenciación post-activación. Sin embargo, nuestros resultados indican que sólo la configuración PIS, y no la configuración EFT, se benefició de este efecto de la potenciación. Es creíble que la configuración EFT llevó a una reducción en la actividad de Na+-K+ ATPasa [32] y dañó la liberación y consumo de Ca2+ del retículo sarcoplasmático [33], como resultado de los tiempos de contracción relativa más largas comparado con la configuración PIS.
Aunque, el tiempo total de la contracción muscular fue idéntico para ambas configuraciones, la configuración EFT se caracterizó por 4 períodos de contracciones más largas comparado con los 16 períodos de contracciones cortas en la configuración PIS. Los períodos de la contracción muscular más largos pueden tener un impacto mayor en el perfil metabólico del acople excitación-contracción [34]. Es más, ambas configuraciones de las series indujeron una fatiga de baja frecuencia, aunque esta fatiga fue más intensa después de EFT que después de PIS. Sin embargo, la naturaleza de estos cambios fue diferente para cada configuración. Mientras que la configuración de EFT indujo activaciones inferiores a 10 y 100 Hz, la configuración PIS sólo llevó a una reducción de la activación a 10 Hz. Así, el EFT indujo una pérdida proporcionalmente mayor de la fuerza a baja frecuencia de estimulación (10 Hz) comparado con la alta frecuencia de estimulación (100 Hz). La fatiga de baja frecuencia que resulta de los aumentos en el Ca2+ libre intracelular ([Ca2+i]) durante la fatiga y esas elevaciones en la concentración de [Ca2+i], activa procesos que llevan a un fallo del acople excitación-contracción (E-C) y la liberación de Ca2+ [35]. Es posible que el EFT indujo un gran fallo de la liberación del Ca2+ que podría afectar la forma de la curva de fuerza-Ca2+ para ambos tipos de frecuencias. En contraste, la configuración PIS puede afectar la parte empinada de la curva de fuerza-Ca2+ donde caídas moderadas en la liberación de Ca2+ produce una pérdida mayor de la tensión a bajas frecuencias [36]. En resumen, usando mediciones periféricas, el estudio actual demuestra que la configuración PIS está asociada con menos deterioro en las propiedades de la contracción muscular comparado con la configuración EFT.
Nuestros resultados de la activación voluntaria demuestran que EFT, pero no PIS, indujo un deterioro en el control neural voluntario en los músculos extensores de la rodilla, aunque las relaciones de trabajo-pausa estaban igualadas para ambas configuraciones. En suma, la configuración de EFT indujo una reducción significativa en la amplitud del PME (normalizado a onda-M), haciendo pensar en una menor excitabilidad córticoespinal después del EFT comparado con la configuración PIS. Es más, la reducción de la IICC indica que los mecanismos que actúan a nivel cortical pueden contribuir a la fatiga central que es inducida por la configuración EFT. Es probable que estos mecanismos involucren circuitos corticales GABAA, puesto que la IICC se relaciona a la actividad en los circuitos inhibitorios intracorticales que usan GABAA como neurotransmisores [21] y que intervienen en una estructura cortical en lugar de subcortical [21]. La reducción observada de la IICC puede reflejar mecanismos compensatorios en respuesta al deterioro en el control neural central [14,17]. A fin de mantener la fuerza designada, la plasticidad del cerebro induce una expansión de las áreas motoras reduciendo la actividad inhibitoria de interneuronas, aumentando así el control neural hacia los músculos [14].
La activación voluntaria para la configuración PIS disminuyó de 90% al 84%. Aunque esta disminución no fue significativa, es posible que la fatiga central jugó un rol menor en la disminución de la MCV, como fue indicado por la reducción de la amplitud del PME. En adición, la ausencia de cambios en la IICC después de la configuración PIS podría ser debida a una rápida recuperación del circuito de la IICC como resultado de un protocolo menos cansador. Esto es soportado por otros resultados que demuestran que los tiempos de recuperación de los valores de la IICC entre 5-10 minutos son asociados con contracciones isométricas fatigantes [14].
Los valores de FIC después de ambas configuraciones de las series permanecieron inalterados. Aunque, el efecto del ejercicio exhaustivo sobre la FIC no está claro, nuestros resultados apoyan resultados previos que indican que la fatiga muscular no afecta los circuitos glutamatérgicos corticales [14].
Finalmente, aunque deben interpretarse los cambios del PME con precaución [17], nuestros resultados del PME y de la activación voluntaria demuestran que la distribución entre el esfuerzo y el descanso durante una sesión de entrenamiento tiene un impacto diferente en el sistema nervioso central, con la configuración PIS teniendo un impacto inferior sobre los mecanismos centrales de la fatiga muscular comparado con la configuración EFT.
Fatiga muscular y respuesta cardiovascular
Durante el rendimiento de ambas configuraciones de las series, los valores promedio y máximo de los parámetros de la presión sanguínea (PAprom, PSS y PSD) aumentaron significativamente comparado con los valores de pre-ejercicio. Estos parámetros retornaron a los valores básicos 10 minutos después del ejercicio. Los valores máximos de estos parámetros durante el ejercicio fueron significativamente bajos para la configuración PIS comparado con la configuración EFT. En suma, la configuración PIS indujo valores menores de FCprom, de FCmáx y del PFCP comparado con el EFT. Estos resultados están conformes con un estudio previo usando contracciones dinámicas [8] y confirma que la configuración de pausa de intra-serie induce bajas respuestas cardiovasculares comparado con una configuración tradicional de las series.
Este aumento en la FC en la configuración tradicional es probablemente el resultado de una anulación parasimpática, como es indicada por la fuerte frecuencia alta (HF), la disminución de la densidad de potencia después del ejercicio, mientras que la banda de baja frecuencia (LF) demostró una disminución de la densidad de la potencia más moderada [37]. Estos cambios fueron acompañados por un deterioro del mecanismo baroreflejo durante la configuración EFT, haciendo pensar en un estrés cardiovascular superior para el EFT comparado con la configuración PIS. Las reducciones en HF y LF junto con un deterioro baroreflejo, han sido asociadas con el entrenamiento de la fuerza de alta intensidad [38]. Sin embargo, puesto que la intensidad para ambas configuraciones de las series fue idéntica (50% de la MCV), otros factores relacionados con la distribución del esfuerzo pueden explicar la modulación del producto de FC-presión diferencial observada.
Los períodos relativos de contracción muscular no sólo pueden explicar las diferencias en la fatiga neuromuscular sino también las respuestas cardiovasculares diferenciales entre las configuraciones. Los aumentos en el producto de FC-presión y PAprom en respuesta a la configuración EFT fueron asociados con una disminución en la activación voluntaria. Además, después del rendimiento de la configuración EFT, una disminución de la activación de HF se correlacionó con una disminución de LF. Esta modulación neuromuscular y cardiovascular inducida por la serie tradicional puede mediarse por mecanismos centrales y periféricos. Esto es soportado por el mayor esfuerzo percibido que fue reportado por los sujetos durante la serie tradicional comparado con la serie PIS. Estos resultados pueden relacionarse al control central que se envía a los músculos para mantener la fuerza durante los períodos de contracción muscular más largos relativos. Una relación directa entre la percepción del esfuerzo y el control central enviada a los músculos ha sido previamente reportado [39]. Es más, se ha indicado que el aumento en la presión sanguínea y la frecuencia cardíaca durante el tiempo al hacer la tarea al fallo de una contracción de fuerza baja son debido a la contribución del control central [1]. Nuestros resultados de la inhibición intracortical medida por el pulso del par de la EMT (IICC) apoya el rol del control central para la regulación cardiovascular. La reducción en la IICC después de la configuración EFT se correlacionó con una disminución en la sensibilidad de la respuesta barorefleja. Para nuestro mejor conocimiento, sólo otro estudio encontró una correlación significativa entre la IICC y la sensibilidad barorefleja [40]. Los autores postularon que la descarga baroreceptora mejoró la excitabilidad cortical debido a una mayor función noradrenérgica, dopaminérgica, y serotoninérgica dentro de la corteza motora, llevando a una disminución en los mecanismos de la IICC.
Los mecanismos periféricos también pueden tener un impacto en el esfuerzo percibido. Esto es apoyado por nuestro hallazgo de que la fatiga periférica (LFF y DB10Hz) está asociada con un esfuerzo percibido local superior (RPE-pierna). Nosotros indicamos que los períodos más largos de la contracción muscular pueden inducir períodos prolongados de flujo sanguíneo restringido y de isquemia muscular. La isquemia muscular activa la respuesta refleja cpmpresora del ejercicio vía estimulación mecánica y estimulación metabólica (es decir, aferents III/IV), llevando a un fallo del acople de excitación en las fibras musculares, afectando su contractibilidad [11,12,17]. En suma, los aferentes musculares III/IV pueden limitar los circuitos que generan la activación motora cortical [41] causando una estimulación subóptima de las motoneuronas. Las señales aferentes de la musculatura alcanzan centros superiores como los Núcleos del Tracto Solitarios (Nucleus Tractus Solitarii, NTS) que tienen un rol como centro de integración en la respuesta cardiovascular recibiendo información desde la musculatura, baroreceptores y el control central, modulando el tono vagal y la respuesta cardiovascular subsecuente [42].
Es importante destacar que las correlaciones descritas anteriores no se observaron para la configuración PIS. Esto puede ser debido al hecho de que la configuración PIS no produjo un nivel de fatiga suficiente para inducir una modulación en el control central, a diferencia de la configuración EFT.
A nuestro mejor conocimiento, éste es el primer estudio que encontró correlaciones entre las modulaciones neuromusculares y cardiovasculares en respuesta al entrenamiento de la fuerza, se necesitan estudios más extensos para entender la naturaleza de estas relaciones.
Limitaciones
A pesar de las fuertes correlaciones reportadas en este estudio entre la activación voluntaria y las respuestas cardiovasculares, nuestros resultados se limitan a un régimen de contracción isométrico. Hay evidencia de que las contracciones isométricas inducen mayor presión sanguínea comparado con las contracciones dinámicas [43]. Así, es de importancia determinar si las correlaciones observadas en el estudio actual se generalizan a las contracciones no-isométricas. Estudios previos que usan configuraciones PIS y EFT durante contracciones dinámicas [8] han reportado modulaciones en las respuestas cardiovasculares similares a las observadas en el estudio actual y así, es probable que la asociación entre la activación voluntaria y las respuestas cardiovasculares no esté limitada a las contracciones isométricas. Es más, es posible que el entrenamiento isométrico que usa intensidades superiores (mayor que el 50% de la MCV usado en el estudio actual) pueda inducir respuestas cardiovasculares más fuertes, específicamente en la configuración PIS.
Otra limitación se relaciona a las medidas de la EMT que se utilizaron. Las medidas de EMT no fueron obtenidas inmediatamente después de la realización del ejercicio, y se sabe que el PME y la IICC se recuperan rápidamente después del ejercicio [14]. Sin embargo, después de la configuración EFT, ambos estos parámetros (obtenidos 7 minutos post-ejercicio) permanecían significativamente bajos, haciendo pensar en un impacto más grande en los mecanismos centrales de fatiga muscular comparado con la configuración PIS.
Significancia
El estudio actual demuestra que la configuración de las series tiene un rol clave en la modulación de la respuesta cardiovascular y los efectos de fatiga en el entrenamiento de la fuerza. Una configuración PIS tiene una ventaja por encima de una configuración EFT puesto que los sujetos pueden completar la misma cantidad de trabajo en el mismo tiempo pero con bajo estrés cardiovascular, bajo deterioro neuromuscular y un esfuerzo percibido inferior comparado con una configuración tradicional de las series. Este hallazgo es de importancia para médicos y entrenadores que desean evitar una elevación innecesaria de la presión sanguínea y la frecuencia cardíaca en adultos sanos durante el rendimiento del ejercicio de fuerza. Una reciente revisión señaló la relevancia del uso del entrenamiento isométrico de la fuerza como tratamiento para las enfermedades cardiovasculares [43]. En suma, un reciente estudio ha reportado incrementos similares de la circunferencia del muslo después de entrenamientos con configuraciones de series tradicionales y de PIS [44]. Junto con nuestros resultados actuales, nosotros indicamos que los protocolos del entrenamiento, como la configuración PIS, producen una reducción del impacto cardiovascular del ejercicio, conservando el crecimiento muscular. Esto podría ser de relevancia para personas ancianas que padecen cronicidades asociadas con la vejez como la sarcopenia muscular y enfermedad cardiovascular (es decir, hipertensión, insuficiencia cardíaca). Sin embargo, más estudios deben dirigirse para explorar aún más las diferencias en las adaptaciones musculares y cardiovasculares entre la configuración de las series tradicional y PIS en el entrenamiento de sujetos ancianos y sujetos jóvenes.
CONCLUSIÓN
Nuestro estudio apoya la hipótesis de que hay una relación entre la fatiga central y las respuestas hemodinámicas, de tal forma que cuanto mayor es la fatiga central, más grande es la respuesta hemodinámica. Nuestros resultados muestran que esta relación es modulada por la configuración de las series. Una configuración de pausa de intra-serie está asociada con una menor fatiga central y periférica con una pérdida inferior subsecuente en los valores de fuerza máxima así como bajo estrés cardiovascular comparado con una configuración tradicional de las series con igual trabajo, pausa y proporción de trabajo-pausa. La respuesta hemodinámica mayor en la configuración tradicional de las series parece estar relacionada a la magnitud compresora de la respuesta refleja del ejercicio, la modulación barorefleja y el control central. Estos cambios están asociados con una activación voluntaria inferior, haciendo pensar en una relación entre la fatiga central y el estrés cardíaco. A nuestro conocimiento, éste es el primer estudio que comparó la fatiga central y periférica, en combinación con las medidas hemodinámicas y cardiovasculares de dos configuraciones de las series del ejercicio de la fuerza con proporciones de trabajo-pausa iguales. Los resultados proveen una mayor visión de los mecanismos fisiológicos de la configuración de las series subyacentes y su relevancia en el control de los efectos del ejercicio de la fuerza.
Referencias
1. Mitchell JH. (2013). Neural circulatory control during exercise: early insights. Exp Physiol. 2013;98: 867–78.
2. McCartney N. (1999). Acute responses to resistance training and safety. Med Sci Sports Exerc. 1999;31: 31–7.
3. Izquierdo M, Ibañez J, González-Badillo JJ, Häkkinen K, Ratamess N a, Kraemer WJ, et al. (2006). Differential effects of strength training leading to failure versus not to failure on hormonal responses, strength, and muscle power gains. J Appl Physiol. 2006;100: 1647–56.
4. Hardee JP, Lawrence MM, Utter AC, Triplett NT, Zwetsloot K a, McBride JM. (2012). Effect of inter-repetition rest on ratings of perceived exertion during multiple sets of the power clean. Eur J Appl Physiol. 2012;112: 3141–7.
5. Taylor AC, McCartney N, Kamath M V, Wiley RL. (2003). Isometric training lowers resting blood pressure and modulates autonomic control. Med Sci Sports Exerc. 2003;35: 251–6.
6. Baum K, Rüther T, Essfeld D. (2003). Reduction of blood pressure response during strength training through intermittent muscle relaxations. Int J Sports Med. 2003;24: 441–5.
7. Heffernan KS, Sosnoff JJ, Jae SY, Gates GJ, Fernhall B. (2008). Acute resistance exercise reduces heart rate complexity and increases QTc interval. Int J Sports Med. 2008;29: 289–93.
8. Iglesias-Soler E, Boullosa D a., Carballeira E, Sánchez-Otero T, Mayo X, Castro-Gacio X, et al. (2014). Effect of set configuration on hemodynamics and cardiac autonomic modulation after high-intensity squat exercise. Clin Physiol Funct Imaging. 2014;
9. Iglesias-Soler E, Carballeira E, Sánchez-Otero T, Mayo X, Jiménez A, Chapman ML. (2012). Acute effects of distribution of rest between repetitions. Int J Sports Med. 2012;33: 351–8.
10. Mayo X, Iglesias-Soler E, Fernández-Del-Olmo M. (1992). Effects of set configuration of resistance exercise on perceived exertion. Percept Mot Skills. 2014;119: 825–837.
11. Enoka RM, Stuart DG. Neurobiology of muscle fatigue. (1992). J Appl Physiol. 1992;72: 1631–48.
12. Gandevia SC. (2001). Spinal and supraspinal factors in human muscle fatigue. Physiol Rev. 2001;81: 1725–89.
13. Merton P. (1954). Voluntary strength and fatigue. J Physiol. 1954;123: 553–64. pmid:13152698
14. Maruyama A, Matsunaga K, Tanaka N, Rothwell JC. (2006). Muscle fatigue decreases short-interval intracortical inhibition after exhaustive intermittent tasks. Clin Neurophysiol. 2006;117: 864–70.
15. Tergau F, Geese R, Bauer a, Baur S, Paulus W, Reimers CD. (2000). Motor cortex fatigue in sports measured by transcranial magnetic double stimulation. Med Sci Sports Exerc. 2000;32: 1942–1948.
16. Bäumer T, Münchau a, Weiller C, Liepert J. (2002). Fatigue suppresses ipsilateral intracortical facilitation. Exp Brain Res. 2002;146: 467–73.
17. Gruet M, Temesi J, Rupp T, Levy P, Millet GY, Verges S. (2013). Stimulation of the motor cortex and corticospinal tract to assess human muscle fatigue. Neuroscience. IBRO; 2013;231: 384–99.
18. Aagaard P, Simonsen EB, Andersen JL, Magnusson P, Dyhre-Poulsen P. (2002). Increased rate of force development and neural drive of human skeletal muscle following resistance training. J Appl Physiol. 2002;93: 1318–26.
19. Hermens HJ, Freriks B, Disselhorst-Klug C, Rau G. (2000). Development of recommendations for SEMG sensors and sensor placement procedures. J Electromyogr Kinesiol. 2000;10: 361–74.
20. Millet GY, Tomazin K, Verges S, Vincent C, Bonnefoy R, Boisson R-C, et al. (2011). Neuromuscular consequences of an extreme mountain ultra-marathon. PLoS One. 2011;6: e17059.
21. Kujirai T, Caramia MD, Rothwell JC, Day BL, Thompson PD, Ferbert A, et al. (1993). Corticocortical inhibition in human motor cortex. J Physiol. 1993;471: 501–19.
22. Ridding MC, Rothwell JC. (1999). Afferent input and cortical organisation: A study with magnetic stimulation. Exp Brain Res. 1999;126: 536–544.
23. Lagally K, Robertson R. (2006). Construct validity of the OMNI resistance exercise scale. J Strength Cond Res. 2006;20: 252–256.
24. Keller-Ross ML, Pereira HM, Pruse J, Yoon T, Schlinder-Delap B, Nielson KA, et al. (2014). Stress-induced increase in muscle fatigability of young men and women is predicted by strength but not voluntary activation. J Appl Physiol. 2014; 767–778.
25. Task Force of the European Society of Cardiology; (1996). The North American Society of Pacing and Electrophysiology; Heart rate variability: standards of measurement, physiological interpretation and clinical use. Circulation. 1996;93: 1043–65.
26. Bianchi AM, Mainardi LT, Meloni C, Chierchiu S, Cerutti S. (1997). Continuous monitoring of the sympatho-vagal balance through spectral analysis. IEEE Eng Med Biol Mag. 1997;16: 64–73.
27. Buchheit M, Gindre C. (2006). Cardiac parasympathetic regulation: respective associations with cardiorespiratory fitness and training load. Am J Physiol Heart Circ Physiol. 2006;291: H451–8.
28. Kardos a., Watterich G, de Menezes R, Csanady M, Casadei B, Rudas L. (2001). Determinants of Spontaneous Baroreflex Sensitivity in a Healthy Working Population. Hypertension. 2001;37: 911–916.
29. La Rovere MT, Pinna GD, Raczak G. (2008). Baroreflex sensitivity: measurement and clinical implications. Ann Noninvasive Electrocardiol. 2008;13: 191–207.
30. Bolgar MR, Baker CE, Goss FL, Nagle E, Robertson RJ. (2010). Effect of exercise intensity on differentiated and undifferentiated ratings of perceived exertion during cycle and treadmill exercise in recreationally active and trained women. J Sports Sci Med. 2010;9: 557–63.
31. Morris MG, Dawes H, Howells K, Scott OM, Cramp M, Izadi H. (2012). Alterations in peripheral muscle contractile characteristics following high and low intensity bouts of exercise. Eur J Appl Physiol. 2012;112: 337–43.
32. Aughey RJ, Murphy KT, Clark S a, Garnham a P, Snow RJ, Cameron-Smith D, et al. (2007). Muscle Na+-K+-ATPase activity and isoform adaptations to intense interval exercise and training in well-trained athletes. J Appl Physiol. 2007;103: 39–47.
33. Leppik J a, Aughey RJ, Medved I, Fairweather I, Carey MF, McKenna MJ. (2004). Prolonged exercise to fatigue in humans impairs skeletal muscle Na+-K+-ATPase activity, sarcoplasmic reticulum Ca2+ release, and Ca2+ uptake. J Appl Physiol. 2004;97: 1414–23.
34. Schott J, McCully K, Rutherford OM. (1995). The role of metabolites in strength training. II. Short versus long isometric contractions. Eur J Appl Physiol Occup Physiol. 1995;71: 337–41.
35. Chin ER, Allen DG. (2006). The contribution of pH-dependent mechanisms to fatigue at different intensities in mammalian single muscle fibres. 2006; 831–840.
36. Westerblad H, Duty S, Allen DG. (1993). Intracellular calcium concentration during low-frequency fatigue in isolated single fibers of mouse skeletal muscle. J Appl Physiol. 1993;75: 382–8.
37. Stanley J, Peake JM, Buchheit M. (2013). Cardiac parasympathetic reactivation following exercise: implications for training prescription. Sports Med. 2013;43: 1259–77.
38. Niemelä TH, Kiviniemi AM, Hautala AJ, Salmi J a, Linnamo V, Tulppo MP. (2008). Recovery pattern of baroreflex sensitivity after exercise. Med Sci Sports Exerc. 2008;40: 864–70.
39. DeMorree HM, Klein C, Marcora SM. (2012). Perception of effort reflects central motor command during movement execution. Psychophysiology. 2012;49: 1242–53.
40. Buharin VE, Butler AJ, Shinohara M. (2014). Motor cortical dis-inhibition with baroreceptor unloading induced by orthostatic stress. J Neurophysiol. 2014;111: 2656–2664.
41. Taylor JL, Gandevia SC. (2008). A comparison of central aspects of fatigue in submaximal and maximal voluntary contractions. J Appl Physiol. 2008;104: 542–50.
42. Fisher JP, White MJ. (2004). Muscle afferent contributions to the cardiovascular response to isometric exercise. Exp Physiol. 2004;89: 639–46.
43. Millar PJ, McGowan CL, Cornelissen V a, Araujo CG, Swaine IL. (2014). Evidence for the role of isometric exercise training in reducing blood pressure: potential mechanisms and future directions. Sports Med. 2014;44: 345–56.
44. Iglesias-Soler E, Mayo X, Río-Rodríguez D, Carballeira E, Fariñas J, Fernández-del-Olmo M. (2015). Inter-Repetition Rest Training and Traditional Set Configuration Produce Similar Strength Gains Without Cortical Adaptations. J Sports Sci. 2015.