Consideraciones sobre la Ingesta de Carnitina y su Influencia en el Metabolismo del Tejido Adiposo
Fernando J Rodríguez Rodríguez1
Pontificia Universidad Católica de Valparaíso, Chile.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2006.
Publicado 17 de noviembre de 2006
Resumen
Palabras clave: carnitina, malonyl coa, acidos grasos, metabolismo, lipólisis
INTRODUCCION
Hoy en día se comercializan una gran cantidad de productos que dicen ayudar a conseguir una silueta perfecta o llegar a valores normopeso de individuos con sobrepeso u obesidad.
Dado el aumento del sedentarismo y de los factores de riesgo para la proliferación de enfermedades crónicas no trasmisibles, la población ha comenzado a preocuparse más de su salud, recurriendo a métodos no tradicionales para conseguirlo, como dietas mágicas y pastillas que puede hacer bajar hasta tres kilos en un mes.
Muchos han abusado del sustento científico para recetar de forma equivocada algunas sustancias que dicen beneficiar la salud o el rendimiento deportivo.
Hace algunos años la polémica la desató el uso de la creatina, que incluso algunos se esforzaron por convertirla en doping. Pero el trabajo de los científicos indico que sus efectos no eran validos sin entrenamiento deportivo, por lo tanto no se podían clasificar en ninguna de las categorías establecidas por el COI (Comité Olimpia Internacional).
El debate esta centrado ahora sobre la carnitina, la cual juega un papel fundamental en la entrada de ácidos grasos en la mitocondria para realizar la β-oxidación y así se sintetice ATP.
A continuación se presenta evidencia que muestra la influencia de la carnitina en la utilización de ácidos grasos como energía y las distintas características y condiciones que se deben dar para que la carnitina actúe de forma eficiente.
¿Que es la Carnitina?
Allá por 1905, dos investigadores rusos, Krimberg y Gulewitsch, descubrieron la importancia de una molécula a la que llamaron Carnitina por haber sido extraída de la carne de un animal. Su nombre formal es Beta-hidroxi-gamma-trimetilamonio (por su estructura química). Se forma en el hígado y en el riñón a partir de residuos del aminoácido lisina (6-N-trimetil-lisina) y una serie de reacciones que incluyen a la S-adenosil-metionina. Además, se requiere ácido ascórbico, niacina, piridoxina y hierro para su formación. Esta sustancia se absorbe en el intestino delgado y una vez que entra a la circulación se distribuye por todo nuestro organismo.
La levocarnitina (L-Carnitina) es la forma activa, a la que se conoce como una vitamina hidrosoluble y del complejo B, conocida también como vitamina B11 (Kanter & Williams, 1.995). Nuestro cuerpo la sintetiza de forma natural para que facilite el metabolismo de las grasas para poder así obtener energía. Este proceso de obtención de energía ocurre en el interior de la mitocondria celular (el lugar energético) mediante un proceso llamado "beta-oxidación".
Función de la Carnitina
No todos los ácidos grasos pueden cruzar esa membrana mitocondrial interna para ser oxidados dentro de la matriz.
Los ácidos grasos de cadenas cortas y medianas pueden entrar en la mitocondria fácilmente, pero los de cadena larga deben unirse a la L-carnitina para poder cruzar la membrana mitocondrial interna, por lo tanto es un “carrier” o transportador natural que favorecer el paso de los ácidos grasos al interior de la mitocondria.
L-Carnitina funciona como un complejo enzimático (carnitina palmitoiltransferasa I, y carnitina palmitoiltransferasa a II) que es responsable del transporte de una gran cadena de ácidos grasos a través de la membrana mitocrondial más profunda al citosol, dónde las enzimas oxidadas están activas (Pande et.al. 1980).
Los ácidos grasos llegan a la mitocondria en forma de acil-CoA. El proceso de "unir" el ácido graso al CoA lo realizan varias enzimas en distintas localizaciones; en citosol, en membrana plasmática y en membranas de retículo endoplásmico, peroxisomas, y mitocondria existen enzimas que sintetizan acil-CoA : ácido graso CoA ligasas (FACL ), y miembros de la familia SLC27 (familia 27 de transportadores de soluto).
Los acil-CoA no pueden atravesar la membrana mitocondrial interna. El radical acilo graso pasará esta membrana unido a la carnitina en forma de acil-O-carnitina. Por ello los radicales acilo graso son transferidos desde el CoA hasta la carnitina en el espacio intermembrana, en una reacción que origina la acil-carnitina. Esta reacción que es catalizada por el enzima carnitina palmitoiltransferasa I (CPT I).
El radical acilo graso atraviesa la membrana mitocondrial interna unido a carnitina en forma de acil-carnitina. Este paso es realizado mediante el antiportador de acil-carnitina/carnitina (CACT), que intercambia acil-carnitina que entra a la mitocondria por carnitina libre que sale de la matriz.
La última etapa es catalizada por el enzima carnitina palmitoiltransferasa II (CPT II), enzima de la matriz mitocondrial en dirección contraria a la realizada por carnitina palmitoiltransferasa I. La carnitina palmitoiltransferasa II cataliza la transferencia del radical acilo graso desde la acil-carnitina hasta el CoA para formarse en carnitina libre y acil-CoA.
El principal destino de los Acil-CoA en la matriz mitocondrial es su oxidación en el proceso de β-oxidación.
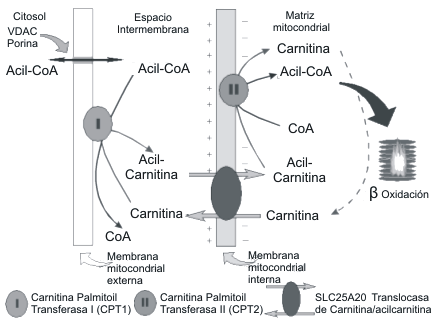
Figura 1. Se exponen los procesos que permiten el paso de los radicales
acilo graso hasta la matriz mitocondrial por medio de Carnitina palmitoil
Transferasa I; Carnitina palmitoil Transferasa II y Translocasa de carnitina/acilcarnitina.
(Extraído de Alfonso Martínez-Conde, Ph. D. & Pilar Mayor, Ph. D. Departamento
de Bioquímica y Biología Molecular. Facultad de Medicina de la Universidad
Complutense de Madrid.
Evidencia Científica
A continuación se presentan una serie de ejemplos y estudios significativos para mostrar de ejemplo a las conclusiones sobre el uso de la cantina.
En un estudio cruzado realizado por Decombaz et .al. (1993), a 9 personas se les dieron 3 gramos al día de L-Carnitina durante 7 días. Al final de los 7 días completaron un ejercicio en bicicleta de 20 minutos al 43% VO2 máximo. El cociente de respiración, el ritmo cardíaco, la evaluación del ejercicio percibido y varios parámetros sanguíneos, no indicaron influencia del suplemento de carnitina en la utilización del substrato. (Decombaz y cols. 1993)
Otto (1987) completó otro estudio doble ciego utilizando a 10 sujetos condicionados. Los participantes completaron 4 semanas tomando 500 mg de carnitina al día, justo antes de una actividad de 60 minutos. No hubo mejoras demostrables en la ventilación, VO2, FC, RQ. (Decombaz y cols. 1993)
En un estudio separado por Otto y cols. (1987), 10 personas participaron en un estudio doble ciego y se les asignó aleatoriamente 50 mg de carnitina por día, ó un placebo durante 28 días. En este caso los autores comprobaron sus efectos sobre el VO2 máximo y los niveles de ácidos grasos libres. No hubo cambios significativos en el VO2, ventilación, tolerancia anaeróbica, frecuencia cardiaca (FC)
Heinonen, Takala, Kvist (1992), investigaron el uso de L-carnitina en ratas por seis semanas, donde las ejercitaron hasta la fatiga en una prueba de natación, sin encontrar diferencias en las concentraciones musculares de L-carnitina en los grupos control, placebo y los que consumieron carnitina. (Heinonen y cols., 1992).
Fink (1994) estudiaron a 8 personas cerca de 14 días suplementados con carnitina para ver qué efecto tendría sobre una acumulación muscular de la misma durante ejercicios de alta intensidad. Los sujetos llevaron a cabo actividades de ciclismo a un nivel máximo de 115% VO2 máx. El suplemento de L-Carnitina no tuvo efecto en la sangre ni en su acumulación muscular durante un esfuerzo anaeróbico máximo.
Kasper et.al. (1994) evaluaron los efectos de la carnitina en la realización de ejercicios continuos. Siete corredores de fondo consumieron 4 gramos al día durante 2 semanas antes de la evaluación. No se encontró mejoras en la realización de la carrera durante 5 km y no hubo disminución del lactato en sangre ni del ritmo cardiaco (FC).
El conocido fisiólogo del ejercicio David Costill en 1994, suplementó a 8 ciclistas durante 14 días, pedaleando 20 min al 115% del VO2 máx. No se hallaron disminuciones en el lactato sanguíneo, ni aumentos de la concentración de L-carnitina en el músculo, solo aumentos en las concentraciones plasmáticas, sin tener aumentos en el rendimiento. (Barnett, Costill, 1994)
Gorostiaga y sus colegas (1998) examinaron a 10 sujetos cerca de 28 días con suplemento de carnitina y sus efectos en el cociente de respiración (RQ) durante el ejercicio. Este estudio no encontró un aumento significativo en O2, glicerol en sangre, ácidos libres de grasas y un pequeño cambio en el cociente de respiración (RQ) con el suplemento de carnitina. Los autores observaron que ningún dato era conclusivo y que eran necesarios estudios más completos para establecer cualquier declaración definitiva sobre la eficacia de la carnitina. (Decombaz y cols. 1993)
Mahmoud en 1998 encontró una disminución del tejido adiposo abdominal y de la frecuencia cardiaca, aplicando 50mg/kg, pero lo que no consideró fue que el experimento duró 4 semanas, por lo tanto pudieron haberse producido adaptaciones metabólicas y cardiovasculares que influyeron en el estudio. (Mahmoud y cols., 1998)
Un estudio reciente de Klaus, Wutzke, Lorenz (2004) encontraron diferencias significativas en la oxidación de grasa (15.8% v 19.3%) con 3 gr/dia por 10 días en adulto obesos (Klaus y cols. 2004), la observación a este estudio que es el único que ha encontrado buenos resultados, es que fue hecho en obesos, por lo cual la mejora en la oxidación de las grasa puede estar dado por otros factores, como metabolismo aumentado post ejercicio, dieta, más ejercicio, entre otros, por lo tanto la aplicabilidad falla en individuos con normopeso, sanos o deportistas.
Otra investigación del centro de estudios del músculo en Copenhague (Roepstorff y cols. 2004) demostró que el Malonyl CoA puede disminuir al consumir pocos carbohidratos dando origen así a la activación de la lipólisis por medio del mecanismo de transporte de carnitina. Esto debido a que el Malonyl CoA tiene la capacidad de inhibir la carnitina palmitoil transferasa, transportador de ácidos grasos dentro de la mitocondria, como se presenta en el ítem “función de la carnitina”.
Para A, B, y C: Rest: Reposo; A Eje y: Concentración Muscular de acetil-CoA (μmol/kg de peso seco); B Eje y: Concentración Muscular de Acetilcarnitina (μmol/kg de peso seco); C Eje y: Concentración Muscular de Carnitina (μmol/kg de peso seco).
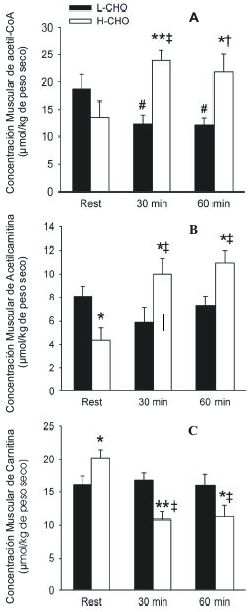
Figura 2. Diferencias entre el consumo alto y bajo de CHO en el músculo vasto
lateral con respecto a las concentraciones de Acetil-CoA, Acetil-carnitina y
carnitina. (Roepstorff cols. 2004). A: Concentración muscular de Acetyl-CoA; B: Concentración muscular de
Acetylcarnitina; C: Concentración muscular de carnitina.
CONCLUSIONES
Lo que ya sabemos de la carnitina es que es un elemento que actúa a nivel de la membrana mitocondrial y que ayuda a los transportadores a introducir Acil-CoA (ácido graso) a la matriz para que el mismo sea oxidado y así obtener energía. Considerando esto, resulta fácil concluir que una mayor cantidad de carnitina disponible ayudaría a movilizar mas “grasas”.
Pero existen otras consideraciones que han sido olvidadas, como por ejemplo el tipo de ejercicio que se realiza, la dieta asociada, entre otras.
La ingesta de carnitina no provoca cambios en los niveles de lactato, el VO2 máx., ni del rendimiento y solo se han encontrado leves aumentos de los niveles intramusculares y plasmáticos de la misma, pero que no provocan efectos en el amento de la oxidación de los ácidos grasos.
En los estudios que avalan el uso de la carnitina, tanto en humanos como en animales, y que aparecen con efectos en la oxidación de las grasas, es posible que ocurra por una adaptación metabólica al ejercicio, debido a que los diseños de investigación implican varios días de ejercicio y a bajas intensidades.
En los ejercicios de baja intensidad el metabolismo de las grasas puede aumentar por los bajos requerimientos de glucógeno muscular, de esta forma el organismo funciona ahorrando este sustrato.
En ejercicios de alta intensidad, se produce la hidrólisis del ATP a ADP y luego a AMP, activando a la enzima AMPK, este aumento incide a la vez estimulación del complejo transportador GLUT-4 produciendo mayor glucólisis, de esta forma la disponibilidad de glucógeno va a determinar la utilización de otros sustratos para la obtención de energía, como por ejemplo los ácidos grasos.
Ahora bien, la evidencia además muestra que el alto consumo de CHO va asociado a un aumento de los niveles de Malonil-CoA, sustancia que bloquea los transportadores de membrana mitocondrial, entrando de esta forma menor cantidad de ácidos grasos a la mitocondria independientemente de la cantidad de carnitina disponible.
Por tanto el Malonil-CoA puede regular el paso de ácidos grasos, dejando a un lado la importancia de la carnitina libre disponible y su uso como suplemento en beneficio de la utilización de ”grasa” como energía y el consecuente efecto en la disminución del tejido adiposo.
Finalmente los estudios realizados no son lo suficientemente concluyentes, ya que no son del todo aclaratorios, faltando mejorar los procesos metodológicos para la obtención de resultados, como por ejemplo poner atención en las cantidades de carnitina usadas, los días de ejecución del ejercicio, tipo de ejercicio, si los sujetos son deportistas o sedentarios, donde claramente los procesos metabólicos ocurren a diferentes velocidades y con adaptaciones especificas para cada condición, por lo cual se hace difícil determinar los efectos de la carnitina sobre el metabolismo de las grasas. (Williams, Melvin, 2007).
Referencias
1. Barnett C, Costill DL, Vukovich MD, Cole KJ, Goodpaster BH, Trappe SW, Fink WJ (1994). Effect of L-carnitine supplementation on muscle and blood carnitine content and lactate accumulation during high-intensity sprint cycling. Human Performance Laboratory, Ball State University, Muncie, IN 47306. Int J Sport Nutr Sep;4(3):280-8
2. Heinonen OJ, Takala J, Kvist MH (1992). Effect of carnitine loading on long-chain fatty acid oxidation, maximal exercise capacity, and nitrogen balance. Paavo Nurmi Center, University of Turku, Finland. Eur J Appl Physiol Occup Physiol. 65(1):13-7
3. Klaus D. Wutzke and Henrik Lorenz (2004). The Effect of L-Carnitine on Fat Oxidation, Protein Turnover, and Body Composition in Slightly Overweight Subjects. University of Rostock, Children's Hospital, Research Laboratory, Germany. Metabolism. Aug;53(8):1002-6
4. Decombaz J, Deriaz O, Acheson K, Gmuender B, Jequier E (1993). Effect of L-carnitine on submaximal exercise metabolism after depletion of muscle glycogen. Med Sci Sports Exerc. Jun;25(6):733-40
5. Roepstorff C, Halberg N, Hillig T, Saha A, Ruderman N, Wojtaszewski J, Richter E, Kiens B (2004). Malonyl CoA and carnitine and regulation of fat oxidation in human skeletal muscle during exercise. AJP Endo 288 133-142, 2005. First published Sep 21, 2004; doi 10.1152/ajpendo 00379
6. Achten, J., M. Gleeson, and A. E. Jeukendrup (2002). Determination of the exercise intensity that elicits maximal fat oxidation". Med. Sci. Sports Exerc., Vol. 34, No. 1, pp. 92-97
7. Williams, Melvin (2006). Nutrition for Fitness, Health and Sport. Ed. Mac Graw Hill Companies, Inc. Cap. 6 pag 174
8. Hawley J.A, Brouns F, Jeukendrup A (1998). Strategies to Enhance Fat Utilisation During Exercise . Sports Medicine, Volume 25, Number 4,pp. 241-257(17)
9. Kevin R. Short, Jonas Nygren, Maureen L. Bigelow and K. Sreekumaran Nair (2004). Effect of Short-Term Prednisone Use on Blood Flow, Muscle Protein Metabolism, and Function. Endocrinology Research Unit, Mayo Clinic School of Medicine, Rochester, Minnesota 55905
10. Kinam N. Heo, Xi Lin, In K. Han, and Jack Odle (2004). Medium Chain Fatty Acids but Not L Carnitine Accelerate the Kinetics of Triacylglycerol Utilization by Colostrum Deprived Newborn Pig. Department of Animal Science, North Carolina State University, Raleigh, NC 27695-7621,Seoul National University, Suweon 441-744, South Korea
11. MacMillan K, Norman (2004). Estrategias nutricionales para optimizar la oxidacion de grasa durante el ejercicio. Rev. chil. nutr., vol.31, no.3, p.283-286. ISSN 0717-7518.,dic
12. Souccar Thierry (2004). Guía de los nuevos estimulantes. Segunda Edición. Ed. Paidotribo. Barcelona
13. Wilmore J, Costill D (1998). Fisiología del esfuerzo y del deporte. Ed. Paidotribo. Barcelona