Contenido de Cadenas Musculares de Miosina Pesada en Relación a las Hormonas Gonadales y el Balance Anabólico - Catabólico en Hombres Entrenados y no Entrenados
M. Grandys, J. Majerczak, J. Karasinski y J. Zoladz
Artículo publicado en el journal PubliCE, Volumen 0 del año 2013.
Publicado 4 de marzo de 2013
Resumen
Palabras clave: interconversión de fibras, testosterona, cortisol, entrenamiento
INTRODUCCION
Las isoformas de cadena de miosina pesada (MHC) son las principales proteínas contráctiles del músculo esquelético que determinan sus propiedades funcionales como máxima y óptima velocidad de contracción (5), pico de potencia (17), velocidad de desarrollo de la fuerza (27), costo de la tensión (28) y eficiencia mecánica (43). A su vez la clasificación de fibras está basada en la distribución de las isoformas de MHC y las isoformas de las proteínas como respuesta al cambio en la transición de las fibras (39). En años recientes se ha realizado un gran progreso analizando las bases moleculares de las transformaciones del tipo de fibra muscular (3,44). Se ha demostrado que las señales dependientes del calcio que incluyen a CaNNFAT (calcineurin-nuclear factor of activated T cells) y el CaMK-HDAC-MEF-2 (calcium/calmodulin-dependent protein kinase-histone deacetylase-myocyte enhancer factor-2) juegan un rol clave en la remodelación de la fibra (6,35). Otras señales moleculares como la MAPK (mitogen- activated protein kinase) (45), la miostatina (29) o el FOXO1 (forkhead box O1 transcription factor) (54) pueden también estar involucrados. Obviamente, la operatividad de estas señales debe ser confirmada en humanos por que la mayoría ha sido demostrada en el modelo animal. Sin embargo, conociendo estos mecanismos celulares ayuda para relacionarlos con señales intra o extra muscular que pueden influenciar el cambio de tipo de fibra muscular.
Las hormonas gonadales han sido reconocidas como uno de los factores que contribuyen a la interconversión de fibras (39), pero poco se sabe sobre los efectos de las hormonas gonadales y el balance anabólico - catabólico en dicho proceso. Esto es de alguna forma sorprendente, por que se han reportado efectos significantes de la testosterona (T) sobre la composición fibrilar en animales ya en 1970 (22). Estos autores demostraron que el tratamiento postnatal con T en conejillos de india femeninos permite un cambio temporal de tipo de fibra (de tipo 1 a tipo 2) generando una similitud de con los resultados en conejillos masculinos. Esta influencia de la T en la diferenciación del tipo de fibras fue luego confirmada sobre los músculos diferenciados por sexo (33) y en otros músculos en experimentación con animales (31,41). En estudios con humanos el potencial de la influencia de la T sobre la composición del tipo de fibra basado en MHC ha sido raramente mencionado. Pette (40), por ejemplo, sugirió que las diferencias por sexo relacionadas con la concentración de isoformas de MHC (una mayor área ocupada por las fibras tipo 2A en hombres que en mujeres), lo cual fue también encontrado previamente por Staron et al. (46), puede ser dependiente de la T. En forma similar, Glenmark et al. (18) proponen que es posible una explicación del incremento observado en la proporción de fibras tipo 2 desde la adolescencia a la adultez en hombres, se produce como una consecuencia de la exposición a los andrógenos durante la maduración. También existe un artículo que correlacionó positivamente al entrenamiento con la T sérica y el porcentaje de fibras tipo 2a y 2x (47). Además en la actualidad se ha vuelto evidente que la actividad anabólica de T en el tejido muscular se ejerce no solo a través de los receptores de andrógenos clásicos sino que también los hacen rápidamente a través de su acción no genómica (12). Estos efectos rápidos son mediados a través de múltiples señales celulares (ejemplo: caminos dependiente Ca2+, cascada MAPK y PI3K-Akt), los cuales pueden también estar involucrados en la interconversión de fibras, donde el papel de la T no puede ser ignorado.
En otro sentido, el rol de la T elevada como un factor anabólico y de hipertrofia ha sido recientemente cuestionado (51) aunque este tema está siendo debatido (50,52). Sin embargo evidencia de que la T y el balance hormonal anabólico - catabólico pueden afectar la expresión de las isoformas de MHC en humanos no ha sido refutada o ni confirmanda. Como es bien conocido que atletas de diferentes deportes tienen variadas isoformas de MHC, nosotros hemos estudiado la composición de MHC y la concentración basal de T en 2 grupos de atletas con diferentes historias de entrenamiento y un grupo de hombres controles no entrenados. También examinamos la testosterona libre (f T), la testosterona biodisponible (bio-T) y los índices basales de T:C y fT:C en un grupo de sujetos no entrenados por que todas estas variables reflejan el balance hormonal anabólico - catabólico y posiblemente su influencia sobre la composición de las MHC.
METODOS
Descripción del problema
Todos los participantes se sometieron a una biopsia del vasto lateral y a análisis de sangre para analizar las concentraciones séricas basales de T. A su vez los sujetos realizaron un ejercicio incremental máximo en bicicleta para determinar el VO2 pico. Se realizaron análisis de sangre básicos como: hemoglobina, hematocrito, conteo de eritrocitos y leucocitos, sodio, potasio y albumina, para evaluar el estado de salud de los sujetos. Además en la mitad de los sujetos (n = 15, sujetos no entrenados) se midieron las globulinas ligadoras de hormonas sexuales (SHBG) y el C para calcular fT y bio-T y determinar el perfil basal de hormonas gonadales y su relación con las MHC y los índices (T:C - fT:C).
Los sujetos fueron familiarizados con todos los procedimientos antes de la evaluación y se les indicó que no realizaran ejercicio físico intenso y que no ingirieran alcohol o cafeína 48 horas antes del estudio. Los test de sangre fueron realizados luego de una noche de ayuno en horario matutino (7.30–8.00 AM), mientras que el test en bicicleta y la biopsia se realizaron 2 horas luego de una comida (1–4 PM). Cada test se realizó en días separados en el mismo orden (análisis de sangre, test máximo bicicleta y biopsia muscular) con al menos dos días de descanso entre ellos.
Sujetos
Todos los participantes fueron informados sobre el propósito del estudio y firmaron un consentimiento de procedimiento experimental que fue aprobado por el comité local de ética en acuerdo con la declaración de Helsinki. Un total de 30 hombres participaron del estudio. Ellos fueron asignados a 3 grupos divididos de acuerdo a su historia de entrenamiento: sujetos estudiantes no entrenados, pero físicamente activos U (n = 15); atletas moderadamente entrenados en resistencia E (n = 10); y atletas moderadamente entrenados en piques/fuerza S (n = 5).
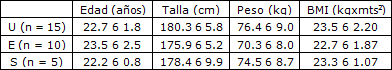
Tabla 1. Características antropométricas en sujetos no entrenados (U), entrenados en resistencia (E) y entrenados en piques/fuerza (S).*
*Los datos están en referenciados como media y desvío estándar.
Las características antropométricas básicas de los 3 grupos se presentan en la Tabla 1. El grupo E consistió en 6 corredores de media y larga distancia, 2 corredores de cross-country ski y 2 ciclistas, mientras que el grupo S fue compuesto por 3 saltadores (2 de largo y 1 de alto) y 2 karatecas. El grupo E tenía un promedio de 6.8 años de entrenamiento mientras que el grupo S tenía 4.8 años. Todos los atletas competían en sus deportes regularmente a nivel nacional o internacional. El estudio se realizó a fines del mes de marzo cuando los atletas habían terminado la fase de preparación general dedicada principalmente al aumento de la resistencia específica antes de comenzar la fase de competencia.
Test incremental
Se realizó un test máximo incremental en un cicloergometro (Ergoline, Ergoline GmbH, Bitz, Germany) para determinar el V̇O2pico. El test comenzó con 6 minutos sentado sobre el ergometro para tomar los datos cardiorrespiratorios de base seguido por un aumento gradual de la potencia de 30 W cada 3 minutos. El test finalizó cuando los sujetos no podían continuar pedaleando a una frecuencia de (60 rpm) o potencia establecida (55). Durante el test de midió contantemente el gas respiración por respiración para analizar las variables (Oxycon Champion Jaeger, Mijnhardt B.V., Bunnik the Netherlands). Antes de cada test se calibró el sensor de volumen de gas con una jeringa de volumen conocido y el analizador de gases fue calibrado con una mezcla de gases también conocidos como lo describe Zoladz et al. (56).
Biopsia muscular
Las biopsias musculares fueron obtenidas bajo anestesia local (1% lidocaína) del vasto lateral del cuádriceps aproximadamente 15 cm arriba de la rotula con una aguja de 2-mm de diámetro (pro-Mag I 2.2; MDTECH).
Las muestras fueron congeladas inmediatamente y guardadas en nitrógeno líquido para ser analizadas luego.
Electrophoresis por gel Sodio Dodecyl Sulfate Polyacrylamide
Las biopsias musculares (8–28 mg) fueron cortadas con un cortador ultrasónico sobre hielo (UP 50H Sonicator; Dr. Hielscher GmbH) con 150–200 ml de buffer que contenían 62.5 mM Tris [pH 6.8], 10% glycerol, 2.5% sodium dodecyl sulfate. Las muestras fueron centrifugadas y el supernadante fue analizado con Bicinchoninic Acid Protein Assay Reagent (Sigma) y albumina sérica bovina como procedimiento estándar. Para las muestras restantes se sumó una concentración de 2.5% 2-mercaptoethanol. De acuerdo a Carraro (8), la electroforesis de gel sodium dodecyl sulfate polyacrylamide para extraer miosina se realizó con 3% apilado y 6% en gel separados conteniendo 37.5% de glicerol a 60 V por 30 minutos seguidos de 180 V por 3 horas. Análisis densitométrico de bandas de proteínas fueron realizadas utilizando la cámara de video Fotodyne y el software Gel Pro Analyzer. Los datos de MHC fueron expresados en unidades de densidad óptica.
Análisis de sangre
Las muestras de sangre (15 ml) fueron obtenidas de la vena antecubital. Las muestras fueron tomadas en reposo entre las 7:30 y 8:00 AM luego de una noche sin ingesta. La sangre se colectó para analizar el sodio [Na+], el potasio [K+], la albumina (Alb), T y las SHBG en tubos limpios y almacenadas por 30 minutos a temperatura ambiente y luego centrifugadas a 4,000 rpm durante 5 minutos. El cortisol plasmático fue colectado en tubos con EDTA. Luego las muestras fueron centrifugadas a 3,000 rpm durante 10 minutos a 4° C. Ambas muestras (séricas y de plasma) fueron guardadas a -40° C hasta su análisis.
Análisis de sangre
La hemoglobina (Hb), el hematocrito (Hct), los glóbulos rojos (RBC) y los glóbulos blancos (WBC) fueron determinados utilizando el analizador hematológico automático 2120 (Siemens, Dublin, Ireland). Las concentraciones séricas de [Na+] y [K+] se midieron con un fotómetro Ciba Corning 480 (Ciba-Corning Diagnostics Ltd., Halstead, United Kingdom). Además para calcular fT y la albúmina sérica (Alb) fueron evaluados usando electroforesis de gel agarose (Paragon System; Beckman, Fullerton, CA, USA).
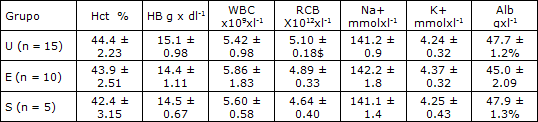
Tabla 2. Análisis de sangre, medidos para evaluar el status de salud en los 3 grupos.
*Datos como media y desvío estándar. Hct = hematocrito; Hb = hemoglobina; RBC = cantidad glóbulos rojos; WBC = cantidad glóbulos blancos; [Na+] = concentración de Sodio; [K+] = concentración de potasio; [Alb] = concentración de albumina; U = sujetos no entrenados; E = entrenados en resistencia; S = entrenados en piques/fuerza.
$ Significativamente mayor que grupo S (p<0.01).
% Significativamente mayor que grupo E (p<0.02).
Todas las mediciones hormonales fueron realizadas por duplicado y la T sérica y las SHBG fueron determinadas por luminiscencia electroquímica por inmunoensayo utilizando un analizador 2010 (Hitachi, Tokyo, Japan). El coeficiente de variación intra e inter medición para estos ensayos fue <4% y <8% respectivamente. La concentración plasmática de C fue medida utilizando luminiscencia electroquímica por inmunoensayo con un analizador ADVIA Centaur (Bayer Diagnostics, Leverkusen, Germany) y el coeficiente de variación intra e inter medición para estos ensayos fue 2.1% y 3.3% respectivamente. Además, fT fue calculado usando el método estándar de Vermeulen et al. (49) donde la concentración de T es corregida por los niveles de SHBG y la Alb como sigue: fT = ([T] 2 (N 3 [f T]))/(Kt), donde fT, T y SHBG son testosterona libre, testosterona total y globulinas ligadoras de hormonas sexuales, respectivamente.
N = KaCa + 1, donde Ka es la constante asociada a la albumina para T y Ca es la concentración de albumina mientras Kt es la constante de asociación de SHBG para T a 37° C.
Bio-T (frecuentemente llamada como no–SHBG-T) fue calculada como la suma de fT y aT (Alb-unida a la testosterona). Como la T unida a la albumina es la fracción no específica y como es una relación lineal con fT, se evaluó de la siguiente forma: aT = KaCa x fT.
Análisis estadístico
En este estudio los datos son presentados como media y desvío estándar y se tomó valor de p≤0.05 para considerar estadísticamente significativo. Comparaciones entre grupos fueron realizadas con el test de Kruskal- Wallis seguido de un test de Mann-Whitney U de dos colas si diferencias significativas eran encontradas. Además el tamaño del efecto (effect size) fue calculado con el test de Cohen’s para medir la magnitud de las diferencias entre los grupos independientemente del tamaño de la muestra. Valores para Cohen’s de 0.2, 0.5 y 0.8 son comúnmente usados para marcar efectos bajos, medios y altos.
Las correlaciones entre MHC-2 y el índice hormonal anabólico catabólico y entre MHC-2 y la capacidad aeróbica fueron evaluados usando el coeficiente de correlación de Spearman. Los análisis fueron realizados utilizando el software Statistica 8.0 (StatSoft, Inc., 2007, Tulsa, OK, USA
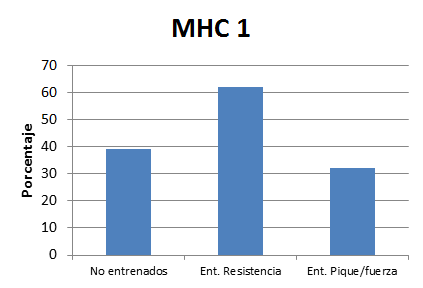
Figura 1.
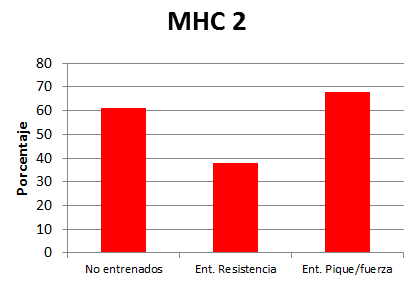
Figura 2.
Figura 1 y 2. Porcentaje de isoformas MHC en el vasto lateral de sujetos no entrenados (U), entrenados en resistencia (E) y entrenados en pique/fuerza (S). Las comparaciones intergrupo fueron realizadas utilizando el test de Mann-Whitney U- a dos colas para muestras no pareadas y el test de Cohen para las comparaciones.
RESULTADOS
Las características basales de los sujetos independientemente de su historia de entrenamiento, las características antropométricas básicas (Tabla 1) y los parámetros de test de sangre (Tabla 2) de los 3 grupos fueron similares. La única diferencia significativa se encontró en RBC que fue más alto en el grupo U que en S (Mann-Whitney, p<0.01, Cohen’s d = 1.87, 95% intervalo confianza [CI] 0.70–3.03) y en la concentración de Alb que fue más baja en el grupo E comparado con U (Mann-Whitney, p<0.02, Cohen’s d = 1.66, 95% CI 0.73–2.58) y el grupo S (Mann- Whitney, p<0.02, Cohen’s d = 1.53, 95% CI 0.32–2.73).
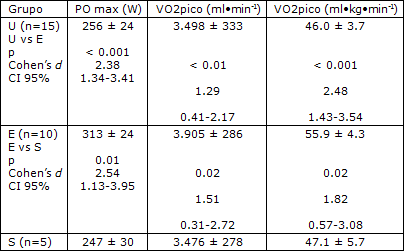
Tabla 3. Máxima potencia obtenida al V̇O2pico (POmax) y máximo consume de oxigeno (V̇O2pico) en los 3 grupos de sujetos.
Datos como media y desvío estándar. Las comparaciones intergrupo fueron realizadas utilizando el test de Mann-Whitney U- a dos colas para muestras no pareadas y el test de Cohen para las comparaciones. Sujetos no entrenados (U), entrenados en resistencia (E) y entrenados en pique/fuerza (S). CI = intervalo de confianza.
El contenido de isoformas de MHC y la aptitud física aeróbica fue diferente entre los 3 grupos (Kruskal-Wallis: H = 18.58, p<0.001, Figuras 1 y 2). Como se podía esperar el grupo E mostró la más baja proporción de MHC-2 y la más alta de MHC-1 (37.5 ± 13.80% y 62.5 ± 13.80%, respectivamente, para MHC-2 y MHC-1), mientras que el grupo S mostró la proporción más alta de de MHC-2 y la más baja de MHC-1 (69.4 ± 2.39% y 30.6 ± 2.39%, respectivamente, para MHC-2 y MHC-1; Figuras 1 y 2). Además, el V̇O2pico, expresado en términos absolutos y relativos y la potencia (POmax) muestran diferencias significativas entre los 3 grupos (Kruskal-Wallis: H = 9.77, p<0.01; H = 16.12, p<0.001; y H = 16.00, p<0.01 para el V̇O2pico en términos absolutos y relativos y la POmax, respectivamente).
Una comparación intergrupo mostró que el grupo E tiene valores más altos que los grupos S y U (Tabla 3). También se encontró un correlación significativa negativa entre MHC-2 y el V̇O2pico (Spearman r = 20.49, p<0.01) y MHC-2 con POmax (Spearman r = 20.69, p<0.01) para todos los sujetos (N = 30; todos los grupos juntos).
No hubo diferencias significativas en la concentración basal de T entre los 3 grupos 3 (18.84 ± 5.73 nmol•L-1, 18.60 ± 5.73 nmol•L-1 y 20.73 ± 4.06 nmol•L-1 para los grupos U, E y S, respectivamente; Kruskal- Wallis: H = 1.11, p<0.5). El contenido de MHC tipo 2 parece estar relacionado al balance hormonal anabólico catabólico por que se observa una correlación positiva de MHC-2 con el índice basal f T:C ratio (Spearman r = 0.63, p = 0.01) en el grupo de no entrenados U (Figure 3).
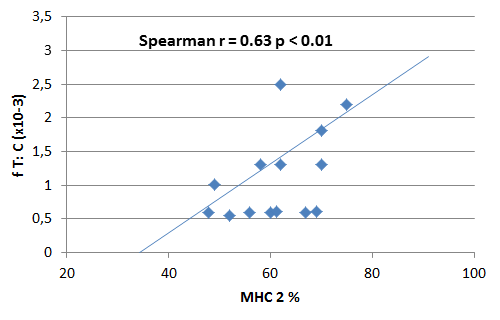
Figura 3. Hemos encontrado una correlación positive significativa entre MHC tipo 2 en el vasto lateral y el índice basal testosterona libre - Cortisol (fT:C).
DISCUSIÓN
En este estudio se ha demostrado que independientemente de la gran variedad de resultados en los contenidos de MHC entre los diferentes grupos, no hay diferencias entre ellos en relación a los valores basales de concentración de T (ver figura 1 y resultados). Estos resultados son consistentes con un estudio que hemos publicado recientemente (21) donde comparamos sprinters de elite (atletas con un nivel superior al de este estudio y con mayor número de evaluados n = 16) con sujetos no entrenados. Si bien la composición de MHC no fue determinada en ese artículo, es razonable asumir que velocistas con una marca personal en 100 metros de entre 10.17 a 10.71 segundos tengan una proporción mayor de MHC tipo 2 comparado con sujetos no entrenados (1). A pesar de esta esperada diferencia, se encontró que los sprinters de elite no tenían concentraciones de hormonas gonadales más altas que sujetos jóvenes no entrenados.
Por otro lado, los datos muestran que atletas entrenados y sujetos no entrenados difieren en términos de isoformas de MHC pero no en términos de concentración basal de T lo cual es un poco sorpresivo. Muchos reportes (4,7,37) han demostrado que T correlaciona con el rendimiento explosivo y con la velocidad (4,9). Esto es, rendimientos generales relacionados a un alto porcentaje de fibras rápidas tipo 2 (1,43). Tomando esto en consideración, uno puede esperar (en oposición a nuestros hallazgos) que un alto porcentaje de fibras tipo 2 está relacionado con concentraciones de T altas en hombres.
Estudios en animales parecen confirmar la relación entre la T y los tipos de isoformas de MHC (31,33,41). Tratamientos con T resultaron en un aumento de la expresión de las MHC tipo 2 tanto en animales intactos (41) como cuando se le extrajeron las gónadas (31). Además, la castración genera un descenso de la proporción de fibras tipo 2 en gemelos de rata (31), en una inhibición de la expresión de las isoformas de MHC tipo 2 en los músculos maseteros de conejo (14) y en los músculos temporales de conejillos de india (33).
Por otro lado, la influencia de los andrógenos sobre la expresión de MHC en el músculo esquelético (otros más que el dimorfismo sexual) en modelos animales también ha sido cuestionado (38) y Prezant et al. (41) sugieren que los resultados de los tratamientos con T dependen tanto del nivel de loa andrógenos basales y de la duración del tratamiento. En efecto, se debe aclarar que estos estudios con animales experimentales frecuentemente utilizan cambios suprafisiológicos para lograr modificaciones en la concentración de T (castración y/o suplementación con T en altas dosis), lo cual no ocurre en condiciones normales. En humanos, el impacto de los andrógenos sobre la expresión de MHC en la fibra muscular es aun más ambiguo por que los datos sobre este tema son muy escasos. Es cierto que, hay reportes que indican que la T influencia la síntesis de MHC en humanos (2), pero, para nuestro conocimiento, hay solo 2 estudios previos que reportan una correlación positiva entre la concentración sérica de T y el porcentaje de fibras tipo 2 en humanos (36,47). En el estudio de Mero et al. (36), esta relación fue presentada en atletas muy jóvenes (niños de 11–13 años). Edades cercanas a la pubertad pueden explicar estos resultados porque se ha mostrado que la proporción de fibras tipo 2 se incrementaron en hombres desde la adolescencia a la adultez (18,32). Una posible explicación para estos cambios aportada por Glenmark et al. (18) fue la exposición a los andrógenos durante la transición a la adultez. Teniendo en mente la conocida diferencia de secreción en la T [en la adultez, T puede ser un 50% más alta que en la adolescencia (23)], es muy tentador sospechar de la relación que tiene la proporción de las fibras tipo 2 en el músculo esquelético con la aumentada secreción de T.
A su vez, Staron et al. (47) mostraron que esta relación puede ser encontrada no solo en la adolescencia. Es sus estudios, un aumento de la concentración de T se correspondió con un aumentado porcentaje de fibras tipo 2 en la fase inicial de entrenamiento en hombres no entrenados. Los sujetos que pertenecían al grupo de entrenados en nuestro estudio tenían una historia previa de entrenamiento regular (5 años de experiencia) y este hecho puede explicar la falta de asociación entre la concentración de T y la composición de MHC. Conociendo los efectos que genera la T sobre el músculo esquelético vía genómica y no genómica (12), uno puede asumir que la T basal tiene un débil efecto genómico en la transición de las fibras musculares pero en situación de aumento de la secreción o disponibilidad (tratamiento, maduración o fase inicial del entrenamiento) podría influenciar a la diferenciación en el músculo esquelético a través de caminos no genómicos y señales especificas.
Se ha demostrado recientemente que T activa la cascada de MAPK (26), que estimula la liberación intracelular de calcium release and Ca2+-dependent pathways (15) y que afecta los factores reguladores claves para la diferenciación muscular porque la miostatina (30), el factor insulínico de crecimiento 1 (16) y el factor de transcripción FOXO1 (42), los cuales pueden influenciar la transición de tipos de fibras musculares esqueléticas. Como algunas de estas señales fueron relaciones con la transición de fibras rápidas a lentas y otras de lentas a rápidas y que el panorama de interconversión de fibras todavía no está del todo claro, la contribución de la T al incremento de MHC-2 no puede ser confirmada o excluida en este punto. Sin embargo, los hallazgos en este estudio sugieren que la MHC pueden estar relacionadas con el balance hormonal basal de anabolismo-catabolismo. Esto se debe a que el índice f T:C (en vez de solo la concentración basal de T) tiene una correlación significativa con el contenido de MH C-2 en el grupo U (Figure 3). También esto puede ser cierto que para el mencionado incremento en las fibras de tipo 2 en la adolescencia (36) y durante la primera fase de entrenamiento de fuerza (47). En el último estudio, un aumento de la concentración de T fue acompañada de un descenso en la concentración de C y esto indicaría un aumento del índice T:C y f T:C ratio. Se podría esperar que el índice f T:C esta elevado durante la adolescencia como un indicador de una actividad anabólica incrementada (13). La importancia del balance anabólico - catabólico para la diferenciación del musculo esquelético también fue determinada a nivel molecular (42,53). Estos estudios encontraron el T inhibe la respuesta de los glucocorticoides que inducen respuesta catabólicas (es decir, disminución en la actividad de la p38 MAPK y del camino PI3K/Akt/mTOR) y demostró efectos opuestos de T y C en las acciones celulares. Sin embargo, estos resultados indican que las relaciones entre en contenido de MHC y el balance hormonal anabólico - catabólico hormonal son difíciles de comparar con otros estudios porque no hay casi literatura concerniente a este tema. Se ha notado sin embargo que, este aumento en el perfil hormonal anabólico (expresado como un alto nivel basal de los índices T:C y f T:C) correlaciona con un alto rendimiento de fuerza muscular y/o velocidad (11,25), el cual a su vez se relaciona a menudo con un alto porcentaje de fibras musculares tipo 2 (10,19,34). Estos hallazgos en conjunto con nuestros resultados, sugieren que un perfil hormonal anabólico elevado se corresponde con un alto porcentaje de contenido de MHC-2. También estamos advertidos de las limitaciones de este estudio. La limitación principal surge de la medición única de T en los dos grupos de atletas. Sin embargo en la muestra físicamente inactiva una única medición puede ser confiable como un marcador promedio anual (48), es bien conocido que la concentración de T durante el entrenamiento cambia en relación a tipo de cargas [para discusión de este punto ver (20,21)]. Además, el entrenamiento aeróbico intenso también puede inducir hipogonadismo (24), pero en este estudio, no hubo signo de condiciones hipogonadales en los atletas a juzgar por los niveles basales de T que se observaron. Sin embargo es posible que la falta de diferencia entre los niveles basales de T entre los sujetos entrenados y no entrenados provenga desde el periodo de 4 meses de entrenamiento duro de los grupos E y S. Simultáneamente, las alteraciones de corto tiempo en los niveles de T también influenciarían la relación entre la T y el contenido de MHC-2 presentado en este estudio.
Aplicaciones prácticas
En conclusión, hemos demostrado una relación positiva entre MHC-2 en el musculo vasto lateral y el índice basal de fT:C en sujeto no entrenados; por lo tanto se puede inferir que un mejor perfil hormonal anabólico caracteriza individuos con un alto contenido de fibras tipo 2. Además no encontramos diferencias en la concentración basal de T entre sujetos no entrenados, entrenados en Resistencia y entrenados en piques/fuerza. Esto indica que la concentración basal de T por sí sola no puede ser considerada como un índice de adaptación al entrenamiento. Nosotros postulamos un índice mas valorativo de adaptación al ejercicio que puede ser el perfil anabólico – catabólico, el cual en vista de nuestras observaciones puede también ser tomado como un mecanismo que determina el contenido de MHC en el musculo esquelético.
Agradecimientos
Este estudio fue apoyado con fondos de la Escuela Universitaria de Educación Física (Krakow, Poland) por el estatuto de investigación en 2008 para el Departamento de fisiología y bioquímica. Este estudio fue realizado en el laboratorio de fisiología muscular, Polonia.
Referencias
1. Andersen, JL, Schjerling, P, and Saltin, B (2000). Muscle, genes and athletic performance. Sci Am 283: 48–55
2. Balagopal, P, Rooyackers, OE, Adey, DB, Ades, PA, and Nair, KS (1997). Effects of aging on in vivo synthesis of skeletal muscle myosin heavy-chain and sarcoplasmic protein in humans. Am J Physiol 273: E790–E800
3. Bassel-Duby, R and Olson, EN (2006). Signaling pathways in skeletal muscle remodeling. Annu Rev Biochem 75: 19–37
4. Bosco, C, Tihanyi, J, and Viru, A (1996). Relationships between field fitness test and basal serum testosterone and cortisol levels in soccer players. Clin Physiol 16: 317–322
5. Bottinelli, R, Canepari, M, Pellegrino, MA, and Reggiani, C (1996). Force velocity properties of human skeletal muscle fibres: Myosin heavy chain isoform and temperature dependence. J Physiol 495: 573–586
6. Calabria, E, Ciciliot, S, Moretti, I, Garcia, M, Picard, A, Dyar, KA, Pallafacchina, G, Tothova, J, Schiaffino, S, and Murgia, M (2009). NFAT isoforms control activity-dependent muscle fiber type specification. Proc Natl Acad Sci U S A 106: 13335–13340
7. Cardinale, M and Stone, MH (2006). Is testosterone influencing explosive performance? . J Strength Cond Res 20: 103–107
8. Carraro, U and Catani, C (1983). A sensitive SDS-PAGE method separating myosin heavy chain isoforms of rat skeletal muscles reveals the heterogeneous nature of the embryonic myosin. Biochem Biophys Res Commun 116: 793–802
9. Crewther, BT, Cook, CJ, Gaviglio, CM, Kilduff, LP, and Drawer, S (2012). Baseline strength can influence the ability of salivary free testosterone to predict squat and sprinting performance. J Strength Cond Res 26: 261–268
10. Dawson, B, Fitzsimons, M, Green, S, Goodman, C, Carey, M, and Cole, K (1998). Changes in performance, muscle metabolites, enzymes and fibre types after short sprint training. Eur J Appl Physiol Occup Physiol 78: 163–169
11. Deschenes, MR, Kraemer, WJ, Bush, JA, Doughty, TA, Kim, D, Mullen, KM, and Ramsey, K (1998). Biorhythmic influences on functional capacity of human muscle and physiological responses. Med Sci Sports Exerc 30: 1399–1407
12. Dubois, V, Laurent, M, Boonen, S, Vanderschueren, D, and Claessens, F (2012). Androgens and skeletal muscle: Cellular and molecular action mechanisms underlying the anabolic actions. Cell Mol Life Sci 10: 1651–1667
13. Ducharme, JR, Forest, MG, De Peretti, E, Sempe, M, Collu, R, and Bertrand, J (1976). Plasma adrenal and gonadal sex steroids in human pubertal development. J Clin Endocrinol Metab 42: 468–476
14. Eason, JM, Schwartz, G, Shirley, KA, and English, AW (2000). Investigation of sexual dimorphism in the rabbit masseter muscle showing different effects of androgen deprivation in adult and young adult animals. Arch Oral Biol 45: 683–690
15. Estrada, M, Espinosa, A, Muller, M, and Jaimovich, E (2003). Testosterone stimulates intracellular calcium release and mitogen-activated protein kinases via a G protein-coupled receptor in skeletal muscle cells. Endocrinology 144: 3586–3597
16. Ferrando, AA, Sheffield-Moore, M, Yeckel, CW, Gilkison, C, Jiang, J, Achacosa, A, Lieberman, SA, Tipton, K, Wolfe, RR, and Urban, RJ (2002). Testosterone administration to older men improves muscle function: Molecular and physiological mechanisms. Am J Physiol Endocrinol Metab 282: E601–607
17. Gilliver, SF, Degens, H, Rittweger, J, Sargeant, AJ, and Jones, DA (2009). Variation in the determinants of power of chemically skinned human muscle fibres. Exp Physiol 94: 1070–1078
18. Glenmark, B, Hedberg, G, and Jansson, E (1992). Changes in muscle fibre type from adolescence to adulthood in women and men. Acta Physiol Scand 146: 251–259
19. Glenmark, B, Hedberg, G, Kaijser, L, and Jansson, E (1994). Muscle strength from adolescence to adulthood—relationship to muscle fibre types. Eur J Appl Physiol Occup Physiol 68: 9–19
20. Grandys, M, Majerczak, J, Duda, K, Zapart-Bukowska, J, Kulpa, J, and Zoladz, JA (2009). Endurance training of moderate intensity increases testosterone concentration in young, healthy men. Int J Sports Med 30: 489–495
21. Grandys, M, Majerczak, J, Zapart-Bukowska, J, Kulpa, J, and Zoladz, JA (2011). Gonadal hormone status in highly trained sprinters and in untrained men. J Strength Cond Res 25: 1079–1084
22. Gutmann, E, Hanzlikova, V, and Lojda, Z (1970). Effect of androgens on histochemical fibre type. Differentiation in the temporal muscle of the guinea pig. Histochemie 24: 287–291
23. Guyton, AC and Hall, JE (2006). Textbook of Medical Physiology. Philadelphia, PA: Elsevier Saunders
24. Hackney, AC (2008). Effects of endurance exercise on the reproductive system of men: The "exercise-hypogonadal male condition". J Endocrinol Invest 31: 932–938
25. Ha¨kkinen, K, Pakarinen, A, Alen, M, and Komi, PV (1985). Serum hormones during prolonged training of neuromuscular performance. Eur J Appl Physiol Occup Physiol 53: 287–293
26. Hamdi, MM and Mutungi, G (2010). Dihydrotestosterone activates the MAPK pathway and modulates maximum isometric force through the EGF receptor in isolated intact mouse skeletal muscle fibres. J Physiol 588: 511–525
27. Harridge, SD, Bottinelli, R, Canepari, M, Pellegrino, M, Reggiani, C, Esbjornsson, M, Balsom, PD, and Saltin, B (1998). Sprint training, in vitro and in vivo muscle function, and myosin heavy chain expression. J Appl Physiol 84: 442–449
28. He, ZH, Bottinelli, R, Pellegrino, MA, Ferenczi, MA, and Reggiani, C (2000). ATP consumption and efficiency of human single muscle fibers with different myosin isoform composition. Biophys J. 79: 945–961
29. Hennebry, A, Berry, C, Siriett, V, O’Callaghan, P, Chau, L, Watson, T, Sharma, M, and Kambadur, R (2009). Myostatin regulates fiber type composition of skeletal muscle by regulating MEF2 and MyoD gene expression. Am J Physiol Cell Physiol 296: C525–534
30. Kovacheva, EL, Hikim, AP, Shen, R, Sinha, I, and Sinha-Hikim, I (2010). Testosterone supplementation reverses sarcopenia in aging through regulation of myostatin, c-Jun NH2-terminal kinase, Notch, and Akt signaling pathways. Endocrinology 151: 628–638
31. Krotkiewski, M, Kral, JG, and Karlsson, J (1980). Effects of castration and testosterone substitution on body composition and muscle metabolism in rats. Acta Physiol Scand 109: 233–237
32. Lexell, J, Sjostrom, M, Nordlund, AS, and Taylor, CC (1992). Growth and development of human muscle: A quantitative morphological study of whole vastus lateralis from childhood to adult age. Muscle Nerve 15: 404–409
33. Lyons, GE, Kelly, AM, and Rubinstein, NA (1986). Testosterone-induced changes in contractile protein isoforms in the sexually dimorphic temporalis muscle of the guinea pig. J Biol Chem 261: 13278–13284
34. Mannion, AF, Jakeman, PM, and Willan, PL (1995). Skeletal muscle buffer value, fibre type distribution and high intensity exercise performance in man. Exp Physiol 80: 89–101
35. McKinsey, TA, Zhang, CL, Lu, J, and Olson, EN (2000). Signal-dependent nuclear export of a histone deacetylase regulates muscle differentiation. Nature 408: 106–111
36. Mero, A, Jaakkola, L, and Komi, PV (1991). Relationships between muscle fibre characteristics and physical performance capacity in trained athletic boys. J Sports Sci 9: 161–171
37. Mero, A, Kauhanen, H, Peltola, E, Vuorimaa, T, and Komi, PV (1990). Physiological performance capacity in different prepubescent athletic groups. J Sports Med Phys Fitness 30: 57–66
38. Noirez, P and Ferry, A (2000). Effect of anabolic/androgenic steroids on myosin heavy chain expression in hindlimb muscles of male rats. Eur J Appl Physiol 81: 155–158
39. Pette, D and Staron, RS (1997). Mammalian skeletal muscle fiber type transitions. Int Rev Cytol 170: 143–223
40. Pette, D and Staron, RS (2001). Transitions of muscle fiber phenotypic profiles. Histochem Cell Biol 115: 359–372
41. Prezant, DJ, Karwa, ML, Kim, HH, Maggiore, D, Chung, V, and Valentine, DE (1997). Short- and long-term effects of testosterone on diaphragm in castrated and normal male rats. J Appl Physiol 82: 134–143
42. Qin, W, Pan, J, Wu, Y, Bauman, WA, and Cardozo, C (2010). Protection against dexamethasone-induced muscle atrophy is related tobmodulation by testosterone of FOXO1 and PGC-1alpha. Biochem Biophys Res Commun 403: 473–478
43. Sargeant, AJ and de Haan, A (2006). Human muscle fatigue: The significance of muscle fibre type variability studied using a microdissection approach. J Physiol Pharmacol 57(Suppl. 10): 5–16
44. Schiaffino, S (2010). Fibre types in skeletal muscle: A personal account. Acta Physiol (Oxf) 199: 451–463
45. Shi, H, Scheffler, JM, Pleitner, JM, Zeng, C, Park, S, Hannon, KM, Grant, AL, and Gerrard, DE (2008). Modulation of skeletal muscle fiber type by mitogen-activated protein kinase signaling. FASEB J 22: 2990–3000
46. Staron, RS, Hagerman, FC, Hikida, RS, Murray, TF, Hostler, DP, Crill, MT, Ragg, KE, and Toma, K (2000). Fiber type composition of the vastus lateralis muscle of young men and women. J Histochem Cytochem 48: 623–629
47. Staron, RS, Karapondo, DL, Kraemer, WJ, Fry, AC, Gordon, SE, Falkel, JE, Hagerman, FC, and Hikida, RS (1994). Skeletal muscle adaptations during early phase of heavy-resistance training in men and women. J Appl Physiol 76: 1247–1255
48. Vermeulen, A and Verdonck, G (1992). Representativeness of a single point plasma testosterone level for the long term hormonal milieu in men. J Clin Endocrinol Metab 74: 939–942
49. Vermeulen, A, Verdonck, L, and Kaufman, JM (1999). A critical evaluation of simple methods for the estimation of free testosterone in serum. J Clin Endocrinol Metab 84: 3666–3672
50. Vingren, JL, Kraemer, WJ, Ratamess, NA, Anderson, JM, Volek, JS, and Maresh, CM (2010). Testosterone physiology in resistance exercise and training: The up-stream regulatory elements. Sports Med 40: 1037– 1053
51. West, DW, Burd, NA, Tang, JE, Moore, DR, Staples, AW, Holwerda, AM, Baker, SK, and Phillips, SM (2009). Elevations in ostensibly anabolic hormones with resistance exercise enhance neither training-induced muscle hypertrophy nor strength of the elbow flexors. J Appl Physiol 108: 60–67
52. West, DWand Phillips, SM (2010). Anabolic processes in human skeletal muscle: Restoring the identities of growth hormone and testosterone. Phys Sportsmed 38: 97–104
53. Wu, Y, Zhao, W, Zhao, J, Zhang, Y, Qin, W, Pan, J, Bauman, WA, Blitzer, RD, and Cardozo, C (2010). REDD1 is a major target of testosterone action in preventing dexamethasone-induced muscle loss. Endocrinology 151: 1050–1059
54. Yuan, Y, Shi, XE, Liu, YG, and Yang, GS (2011). FoxO1 regulates muscle fiber-type specification and inhibits calcineurin signaling during C2C12 myoblast differentiation. Mol Cell Biochem 348: 77–87
55. Zoladz, JA, Duda, K, and Majerczak, J (1998). Oxygen uptake does not increase linearly at high power outputs during incremental exercise test in humans. Eur J Appl Physiol Occup Physiol 77: 445–451
56. Zoladz, JA, Rademaker, AC, and Sargeant, AJ (1995). Non-linear relationship between O2 uptake and power output at high intensities of exercise in humans. J Physiol 488: 211–217