Control Autonómico de la Frecuencia Cardíaca
Publicado 26 de marzo de 2015, 3:21
No es ninguna novedad que la principal causa de muerte a nivel mundial esté liderada por los eventos cardiovasculares (p. ej., enfermedades coronarias); y en la actualidad un sinnúmero de investigaciones sugieren que una gran parte de los problemas de ésta índole están relativamente asociados con procesos inflamatorios. Sin embargo, el profesional del ejercicio parece estar preocupado por otras cuestiones más que por algo tan insignificante como prevenir eventos cardiovasculares. En este contexto, es aparente que algo está ocurriendo y da la impresión que es más importante el debate acerca de si media sentadilla o sentadilla completa, o de si funcional o no funcional, o de si intermitente vs. no intermitente; que el debate acerca de mecanismos de control y valoración que pueden permitir la comprensión de una variable de tan simple medición como lo es la frecuencia cardíaca. Por lo tanto, para aquellos menos experimentados en estas cuestiones, la idea de este blog es hacer una pequeña y muy breve introducción al control autonómico de la frecuencia cardíaca.
El incremento en la frecuencia cardíaca (FC) que se produce entre el reposo y el ejercicio máximo dinámico depende del equilibrio entre las influencias de las ramas parasimpática y simpática del sistema nervioso autonómico (SNA). En una de las primeras investigaciones sobre el control autonómico de la FC se examinaron cinco sujetos que realizaron ejercicio dinámico en posición supina hasta alcanzar el VO2max. Además se implementaron tres condiciones; bloqueo completo de los receptores β adrenérgicos del corazón mediante propranolol, control, y bloqueo autonómico combinado completo del corazón (i.e., FC intrínseca) (Robinson et al., 1966). Los resultados provistos por el estudio de Robinson et al. (1996) fueron reinterpretados y simplificados para sugerir que los incrementos en la FC entre el reposo y cargas de trabajo “ligeras” eran principalmente el resultado de la reducción en la actividad nerviosa parasimpática; posteriormente denominado “retiro parasimpático o retiro vagal” (Rowell, 1993). Además, se indicó que los subsiguientes incrementos en la FC por encima de los 100 latidos/min y hasta la FCmax, relacionados con el incremento de la carga (momento en el cual se produce la liberación de norepinefrina en el plasma), resultaban del incremento en la actividad nerviosa simpática. Desafortunadamente, esta interpretación de los mecanismos involucrados en el incremento de la FC inducido por el ejercicio resultaron en la aceptación generalizada de que los incrementos en la FC que se producen desde el reposo hasta una carga de ejercicio que provoque una FC de 100 latidos/min resultaban exclusivamente del retiro parasimpático y que los incrementos en la FC por encima de los 100 latidos/min resultaban del incremento en la actividad nerviosa simpática.
Sin embargo, recientes investigaciones acerca del control autonómico de la FC y de la presión arterial durante el ejercicio dinámico en perros (O'Leary et al., 1997) y en humanos (Ogoh et al., 2005) han cuestionado si (i) si el retiro de la actividad parasimpática o vagal se reduce durante transición desde el reposo al ejercicio y continúa reduciéndose hasta que tiene un efecto insignificante sobre los incrementos adicionales en la FC, aproximadamente a los 100 latidos/min (Matsukawa, 2012); (ii) si el antagonismo recíproco puede explicar los cambios en el equilibrio simpato-vagal que resultan en el incremento de la FC asociado con la carga de ejercicio, y (iii) si el reflejo presor del ejercicio y los barorreflejos arteriales y cardiopulmonares que controlan la presión arterial desempeñan un rol en restablecer el punto operativo del reflejo presor de la FC a un punto de reducida sensibilidad (Fadel and Raven, 2012, Fisher, 2014).
A lo largo de los años, un gran número de investigaciones en animales y humanos han establecido la involucración de tres mecanismos autonómicos (tal como ya se ha mencionado) en la regulación de la presión sanguínea (Raven, 2012): el comando central, el reflejo presor del ejercicio y el barorreflejo arterial. En este contexto, diversos estudios han mostrado que la activación del comando central y el reflejo presor, relacionada con la carga de ejercicio, proveniente tanto de señales centrales como periféricas resulta en respuestas cardiorrespiratorias eferentes (Fadel and Raven, 2012, Mitchell, 1990, Raven et al., 2006, Rowell, 1993, Shepherd, 1981). Durante el progresivo incremento en la carga de ejercicio, desde el inicio del ejercicio hasta el máximo, las respuestas hemodinámicas están directamente relacionadas con la carga de trabajo y con el índice de percepción del esfuerzo (RPE) del individuo (Williamson, 2010).
Como se ha mencionado previamente, por muchos años el simple concepto de retiro vagal fue propuesto como el mecanismo por el cual la FC se incrementa desde el inicio del ejercicio hasta los 100 latidos/min; luego de lo cual, la FC se incrementa principalmente debido a la influencia simpática. La nueva información resultante de diversos estudios indica que existe un equilibrio efectivo entre el control simpático y parasimpático de la FC con el progresivo incremento en la carga de trabajo desde el reposo hasta el ejercicio máximo. Además, parece que la estimulación parasimpática de la FC es necesaria para el control reflejo, mientras que la actividad simpática es requerida para establecer el estado estable de la FC relacionado con la carga de trabajo. En contraste con el simple concepto de retiro vagal al inicio del ejercicio, se ha propuesto que la FC se incrementa desde el inicio del ejercicio y se incrementa con la carga de trabajo en relación con un mecanismo regulatorio de la presión arterial. El mecanismo regulatorio de la presión arterial requiere que el comando central reinicie el punto operativo de la presión arterial para permitir incrementos concurrentes en la presión arterial y la frecuencia cardíaca y así permitir el incremento del gasto cardíaco (Q) (Williamson, 2010). Esto es, al inicio del ejercicio el acto inmediato de reiniciar el punto operativo de referencia de la presión arterial resulta en una retroalimentación negativa desde los barorreceptores arteriales, indicando que la presión operativa del reflejo es muy baja, lo cual inicia una rápida respuesta de retiro vagal para mantener la frecuencia cardíaca (DiCarlo and Bishop, 1992). Adicionalmente, al inicio del ejercicio, el incremento en el retorno venoso con debido a la activación de los músculos, incrementa el volumen sanguíneo en la aurícula derecha resultando en el estiramiento de los receptores auriculares tipo A y B (Paintal, 1973) que es transmitido a través de fibras aferentes del nervio vago y esto incrementa la FC; un reflejo denominado “Reflejo Bainbridge”. Al mismo tiempo, el lento incremento en la actividad neural simpática progresivamente inhibe la influencia parasimpática (Ogoh et al., 2005) y el incremento en la actividad simpática se vuelve el mayor estímulo para el incremento de la FC. A medida que se incrementa la carga de trabajo, el incremento en la actividad neural simpática (Savard et al., 1989) excita directamente las células del marcapasos cardíaco y progresivamente inhibe la modulación parasimpática de la FC hasta que se alcanza la carga máxima de trabajo. Por lo tanto, en la transición desde el reposo al progresivo incremento en la carga de ejercicio, diversos análisis indican que la influencia dinámica del equilibrio simpato-vagal sobre la FC progresa hacia una dominancia simpato-dominante, pero no antes de que el incremento inicial en la dominancia parasimpática resulte en la inhibición de los barorreceptores cardiopulmonares. Interesantemente, los resultados del estudio llevado a cabo por Takahashi et al. (2004) proveen respaldo adicional al equilibrio activo simpato-vagal al inicio del ejercicio. Estos autores observaron que el ejercicio voluntario estático en sujetos tetrapléjicos, quienes carecen de control simpatoadrenal supraespinal pero mantienen intacto el control vagal, no induce incrementos en la FC similares a los observados durante el ejercicio estático en sujetos saludables. Por lo tanto, si el retiro vagal fuera el mecanismo principal por el cual se incrementara la FC al inicio del ejercicio, el incremento en la FC al comienzo del ejercicio estático en sujetos tetrapléjicos sería el mismo que en los individuos normales. El hecho de que la respuesta de la FC en los individuos tetrapléjicos fuera menor que la registrada en los individuos saludables indica que el incremento en la actividad simpática y la presencia del equilibrio simpato-vagal son factores requeridos para la respuesta fisiológica de la FC en sujetos saludables (Takahashi et al., 2004).
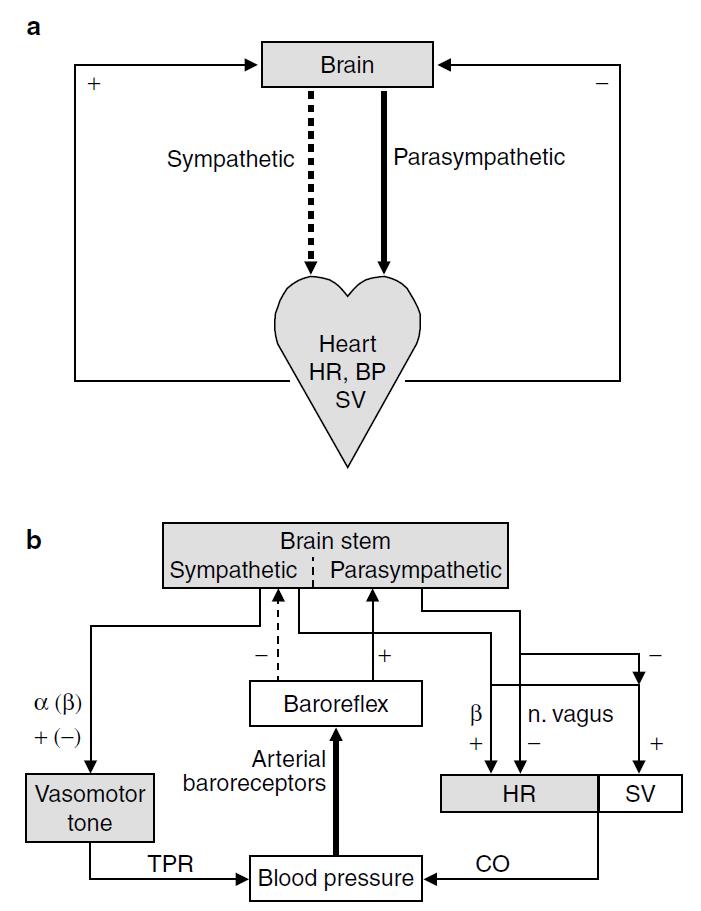
Figura 1. (a) Esquema ultra simplificado que ilustra la
influencia de la actividad nerviosa simpática (incremento en la FC) y
parasimpática (reducción de la FC) en el modelo de equilibrio simpato-vagal.
(b) Un modelo más elaborado de los mecanismos de control de la frecuencia
cardíaca, la presión sanguínea y de los mecanismos de retroalimentación
barorrefleja. Esto ilustra las acciones independientes de los sistemas
simpático y parasimpático. Su acción puede valorarse a través de la medición de
la variabilidad de la frecuencia cardíaca. La actividad parasimpática es
responsable de la bradicardia que acompaña la estimulación de los
barorreceptores y la taquicardia que acompaña la desactivación de los
barorreceptores. BP = Presión sanguínea; CO = Gasto Cardíaco, HR = Frecuencia
Cardíaca; N. Vagus = Nervio Vago; SV = Volumen Sistólico; TPR = Resistencia
Periférica Total
En resumen, los modelos más recientes sobre el control autonómico de la FC indican un rol reflejo del sistema parasimpático y el rol del sistema simpático en el establecimiento del estado estable. La investigación apunta a un sistema de control que no posee un claro umbral de encendido/apagado, sino que representa un continuo control de equilibrio simpato-vagal. Además, es importante señalar que equilibrio simpato-vagal no significa que ambas ramas tienen la misma influencia, sino que este equilibrio representa el interjuego entre las dos ramas para la modulación de la FC a corto y largo plazo. Asimismo, se debe recordar que la activación parasimpática es de corta duración, mientras que el sistema simpático puede ser activado tónicamente y tiene la capacidad de atenuar la influencia del sistema parasimpático.
Algunas cuestiones como esta y mucho más en el próximo Curso de Entrenador Personal
REFERENCIAS
Paintal, A. S. 1973. Vagal sensory receptors and their reflex effects. Physiol Rev, 53, 159-227 .
Raven, P. B. 2012. Neural control of the circulation: exercise. Exp Physiol, 97, 10-3 .
Rowell, L. B. 1993. Arterial baroreflexes, central command, and muscle chemoreflexes: a synthesis. In: ROWELL, L. B. (ed.) Human Cardiovascular Control. New York: Oxford University Press.
