Control glucolítico a través de la Fosfofructoquinasa (PFK-1)
Publicado 31 de mayo de 2013, 22:01
Autor: Raúl Herrero
Control glucolítico a través de la Fosfofructoquinasa (PFK-1)
Continuando con el desarrollo del control de la glucólisis durante el ejercicio, en este blog abordaremos la tercera reacción de este proceso que está catalizada por la fosfofructoquinasa-1 (PFK-1). La PFK-1 es una molécula compleja (ver figura 1).
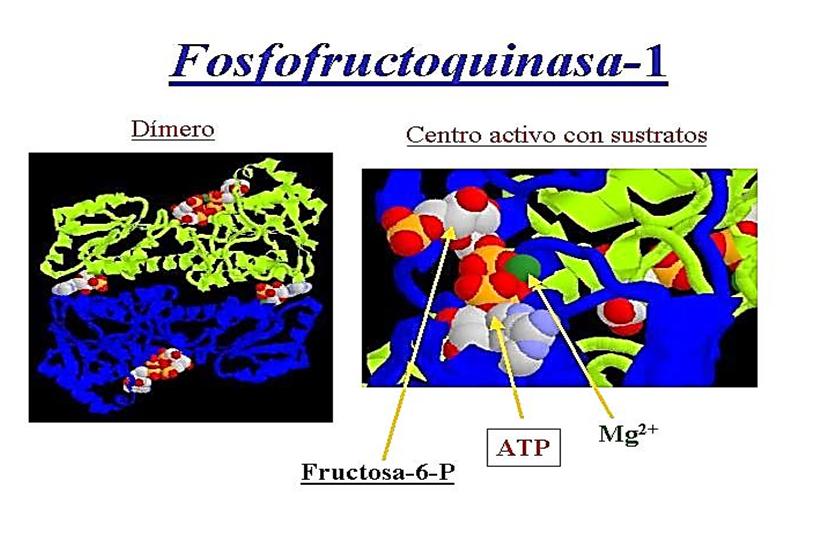
Figura 1
Esta regulación es muy técnica y requiere de explicaciones detalladas desde el punto de vista de la cinética bioquímica. El sitio de control controlado por la fosfofructoquinasa -1 (PFK-1) es el segundo paso de control importante en este proceso y es un paso determinante ya que esta enzima controla el flujo de los hidratos de carbono (HC) a través de la glucólisis en el músculo. En este paso de cataliza una reacción irreversible fructosa 6 fosfato (F-6P) a fructosa 1-6 di fosfato (F-1,6DP). Ver figura 2.
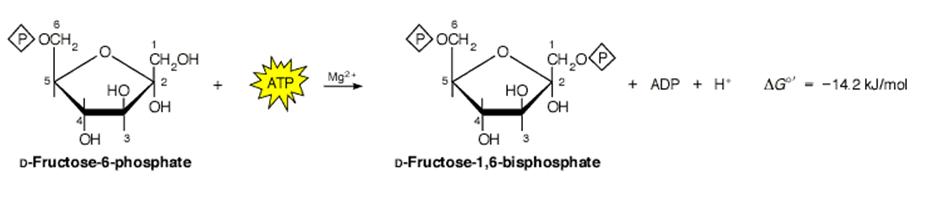
Figura 2
Los sustratos de esta enzima son la F-6P y el ATP mientras que el producto es la F-1,6DP y el ADP.
Esta enzima tiene una regulación muy estricta y compleja:
Los inhibidores de la PFK-1 son el ATP y el Citrato que es un metabolito intermedio del ciclo aeróbico mientras que los activadores que se encargan de revertir dicha inhibición causada por el ATP son el ADP, AMP y la fructosa 2-6 difosfato (F-2,6DP). Este último es un potente activador de la PFK-1 pero en el hígado.
Si se observa con atención se verá que el ATP es sustrato he inhibidos de la PFK lo cual resulta raro ¿no?
Ahora bien veamos como ocurre esto: la PFK existe en dos estados conformacionales; uno llamado “R” y otro llamado “T” y ambos están en equilibrio entre sí. Cada subunidad de la PFK tiene dos sitios de unión para el ATP: un sitio ATP inhibidor y un sitio ATP sustrato.
El sitio ATP sustrato liga el ATP en ambos estados conformacionales en igual forma, pero el sitio ATP inhibidor liga casi exclusivamente en estado T. El otro sustrato (F 6P) se liga al estado R, pero cuando la concentración de ATP es alta y se une al estado T, desplaza el equilibrio hacia dicho estado disminuyendo el estado R por lo que disminuye la afinidad de la PFK por lo tanto disminuye la velocidad de la glucólisis y por lo tanto la potencia de movimiento.
Si una persona se encuentra generando energía en forma aeróbica submáxima y de pronto aumenta la intensidad del ejercicio (aumenta los requerimientos de ATP instantáneos), la célula se verá obligada a recurrir a la vía glucolítica y lo hace fácilmente ya que la caída momentánea de concentración de ATP produce un aumento de la concentración de ADP y AMP y estos son activadores de la PFK-1 lo cual aumenta inmediatamente el flujo glucolítico (no debemos olvidar que la demanda metabólica la produce la intensidad del ejercicio).
El AMP se liga al estado R de la PFK aumentando la afinidad por la F-6P y aumentando el flujo glucolítico. La producción de AMP esta favorecida por la enzima adenilatokinasa (AK) que cataliza la siguiente reacción (ver figura 3).
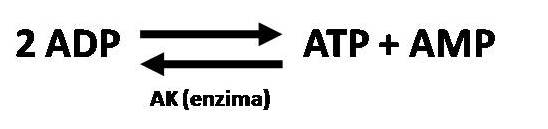
Figura 3
Así que una disminución de la concentración de ATP produce un aumento de la concentración del ADP y cada 2 ADP la AK regenera un ATP y da como resultado un AMP aumentando de esta manera la cantidad de activador de la PFK.
El otro activador muy importante de la PFK es la F-2,6DP que no es un intermediario metabólico de la glucólisis. La concentración de F-2,6DP depende de su síntesis y degradación que a su vez está regulada por dos enzimas la (PFK-2) y la fructosa difosfatasa 2 (FDP-2). Estas dos enzimas son controladas por fosforilación enzimática y por otros controladores hormonales. Si bien este activador parecía ser mucho más importante en el hígado que en el músculo actualmente se ha conocido la existencia de isoformas de la F2-6DP en el musculo cardíaco y esquelético.
Es importante dejar en claro lo que ocurre en el músculo: lo que nosotros analizamos es como varía el flujo metabólico a través de la glucólisis, por lo tanto si las demandas de ATP son bajas es porque las concentraciones de ATP son altas y no estamos haciendo trabajo físico importante. Por ende el flujo metabólico por la glucólisis es bajo, aunque no necesariamente nulo (glucólisis lenta).
Cuando la se hacen contracciones rápidas y/o fuertes, la concentración de ATP cae instantáneamente y aumenta concentración de AMP, lo que aumenta las demandas de ATP y el metabolismo debe reponer rápidamente este ATP a casi la misma velocidad que se consume por esto aumenta inmediatamente el flujo glucolítico (ver figura 4).
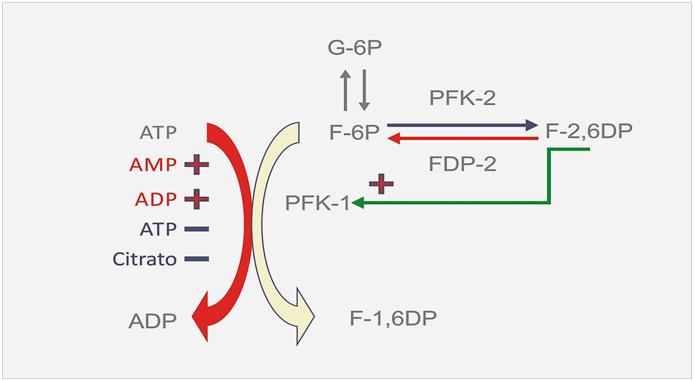
Figura 4
Por último, otra molécula que disminuye el flujo glucolítico (no inhibe) por acción sobre la PFK es el citrato que es un metabolito intermedio del ciclo de Krebs (metabolismo aeróbico). Cuando el citrato sube le informa a la célula que se ha alcanzado un buen nivel de producción aeróbica de ATP, entonces comienza a inhibir la PFK-1 y reduce el flujo de los HC proveniente de la glucólisis. Cabe acotar que en el hígado las regulaciones son algo diferentes y si serán publicadas más adelante.
Como conclusión podemos decir que conocer los aspectos teóricos de los mecanismos de inhibición y activación de la cinética enzimática es importante para la planificación deportiva ya que de ellos dependen los resultados de los procesos de entrenamiento.