Daño Muscular Inducido por Maratón del Mar Muerto y Eficacia a Corto Plazo de Suplemento Oral de Vitamina E
Mo’ath Bataineh1, Ali Al-Nawaiseh1, Akef Taifour1 y Lawrence Judge2
1Laboratorio de Rendimiento Humano, Departamento de Rehabilitación Deportiva, Universidad Hashemite, Zarqa, Jordania
2Escuela de kinesiología, Facultad de Salud, Universidad Estatal de Ball, Muncie, Indiana, EEUU.
Artículo publicado en el journal PubliCE del año 2017.
Publicado 14 de noviembre de 2017
Resumen
Palabras clave: Vitaminas Antioxidantes, Maratón del Mar Muerto, Running en Descenso, Daño Muscular Inducido por el Ejercicio
INTRODUCCIÓN
El running recreativo o competitivo es una de las actividades físicas más beneficiosas y populares para mejorar el bienestar (25,44,45). En Jordania, la Maratón del Mar Muerto (42,2 km) y la Ultra Maratón (50 km) se han corrido anualmente desde 1993. La pista de carrera en sí es interesante fisiológicamente, ya que tiene aproximadamente 21 km de carrera en descenso.
Los corredores consideran que muchos maratones son difíciles específicamente debido al componente de descenso o declive de su recorrido. Ejemplos de tales recorridos incluyen la maratón de St. George (declive total: 768 m), la maratón de Tucson (declive total: 671 m), la maratón del recorrido de Bizz Johnson (declive total: 335 m), maratón de SteamTown (declive total: 291 m), la maratón de Whistle-stop (declive total: 155 m), la maratón de Boston (declive total: 137 m) y la maratón internacional de California (declive total: 104 m). En comparación, el declive total de la Maratón del Mar Muerto y la Ultra Maratón es 1318 y 1368 m, respectivamente. La parte descendente de la maratón comienza después del 1° y el 9° km, y las altitudes de la línea de salida son aproximadamente 900 y 950 m sobre el nivel del mar en la maratón y la Ultra Maratón, respectivamente. Ambos eventos comparten la misma línea de meta a una altitud de 418 m bajo el nivel del mar, es decir, por qué "Correr hasta el punto más bajo de la Tierra" es el slogan del evento.
La incapacidad de caminar durante días después de tales eventos es probablemente un resultado del daño muscular inducido por el ejercicio (DMIE), que es típicamente más evidente después de un ejercicio de alta intensidad. Sin embargo, una fuerte evidencia apoya el efecto específicamente del componente excéntrico de la contracción muscular como la principal causa de daño muscular (31). El DMIE contribuye a la fatiga y al dolor muscular debido a la pérdida de contenido muscular en el torrente sanguíneo que es permitida por la interrupción física de la membrana muscular. Este proceso desencadena una cascada de inflamación e induce la irritación de las terminaciones nerviosas (17,31). Además, la maratón en sí misma produce importantes desafíos fisiológicos, como los recursos energéticos agotados (31,36), la deshidratación, la hiponatremia (12), la hipertermia, las termorregulaciones (11,40), el estrés oxidativo (16,29), la resistencia transitoria a la insulina (20), y la depresión del sistema inmune (14). En la Maratón del Mar Muerto, el camino de descenso empinado, el cambio de altitud y el aumento de temperatura y humedad a medida que avanza la carrera añaden un estrés adicional a los desafíos presentados por la maratón de running.
El running de descenso tiene un gran componente de contracción excéntrica resultante de la absorción del peso corporal en cada paso al aterrizar en un pie desde un punto de partida más alto. Con pasos más largos, en los empinados caminos de descenso, los corredores quitan más distancia durante la fase de vuelo y esto aumenta el impacto del aterrizaje en cada pie, lo que aumenta el componente excéntrico de la carrera que aumenta la magnitud del DMIE de los corredores (40). Además, debido a que la distancia de la carrera es extensa y el sistema oxidativo de los corredores es la principal fuente de energía durante la carrera, se espera que los subproductos de oxidación puedan contribuir a un daño muscular adicional (16). Dado que la Maratón del Mar Muerto dura alrededor de 3 horas de carrera que es en su mayoría un recorrido de carrera de descenso, asumimos que correr en este evento induciría más daño muscular que otros tipos de contracciones excéntricas comúnmente reportados en la bibliografía.
Se usan frecuentemente marcadores de sangre u orina para evaluar el DMIE. En particular, los niveles de creatina kinasa (CK) en la sangre son buenos indicadores del daño del músculo esquelético cuando se miden en las isoformas de CKm, y generalmente alcanzan su pico en el torrente sanguíneo 24 a 48 horas post-ejercicio (6,21,43). Los eventos aeróbicos de larga distancia están significativamente relacionados con el aumento del estrés oxidativo que también puede inducir daño muscular (43).
Varios investigadores han sugerido a la suplementación con vitamina E como una estrategia preventiva para reducir el daño del estrés oxidativo que se asocia con eventos aeróbicos sub-máximos de larga distancia (5,16,18,39). Sin embargo, dado que la suplementación a largo plazo con vitamina E parece reducir las adaptaciones al entrenamiento, debe evitarse esta suplementación para minimizar los efectos negativos (30). Curiosamente, con respecto a esto, sólo unos pocos estudios han informado un papel eficaz para la vitamina E en la atenuación de la lesión muscular asociada con las contracciones excéntricas y el estrés oxidativo, debido a su capacidad antioxidante para limpiar los radicales libres y estabilizar el sarcolema (4,23,37,38).
La Maratón del Mar Muerto todavía no se ha estudiado con respecto a sus condiciones extremas de carrera. Por lo tanto, decidimos llevar a cabo el presente estudio con dos objetivos principales en mente: (a) cuantificar la magnitud del daño muscular inducido por el ejercicio después de la Maratón del Mar Muerto; y (b) examinar los posibles efectos preventivos de la vitamina E antioxidante en los marcadores de daño muscular inducidos por las contracciones excéntricas y el estrés oxidativo asociado con el running de la Maratón del Mar Muerto.
MÉTODOS
Sujetos
Catorce corredores masculinos competitivos (Tabla 1) que voluntariamente participaron en la Maratón del Mar Muerto fueron reclutados de boca en boca para ser los sujetos en este estudio. Después de informar a los sujetos sobre los riesgos y beneficios del estudio, firmaron un consentimiento informado aprobado por el IRB. El proceso de reclutamiento se dividió en dos etapas.
Tabla 1. Datos Descriptivos de los Sujetos
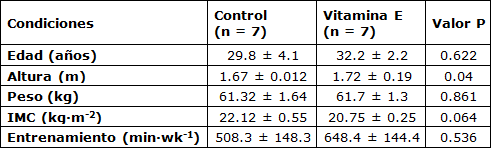
En la Etapa 1, sólo 27 de los 77 participantes registrados cumplieron con los criterios de inclusión iniciales de nuestro estudio (es decir, varones de 20 a 39 años, más de 5 años de experiencia en running de distancia competitivo, previa participación en maratones locales y/o internacionales y que no hayan ingerido ningún tipo de suplementos). Veintidós corredores inicialmente acordaron participar en el estudio actual.
En la Etapa 2, se excluyeron a 8 corredores por no cumplir con el estándar de inclusión de esta etapa, que exigía que los corredores no hubieran practicado en la pista de carrera en los últimos 30 días y que los niveles de CK pre-carrera fueran normales. Los sujetos fueron divididos aleatoriamente e igualmente en dos grupos (es decir, Suplemento Vitamina E y Control). Todos los sujetos alcanzaron la línea de meta y no requirieron atención médica durante o después del evento. Se obtuvieron muestras de sangre 24 horas después de la finalización de la carrera en un laboratorio de un hospital privado local y se procesaron para su análisis posterior. El procedimiento experimental cumplió con la Declaración de Helsinki.
Procedimientos
Análisis Alimentario
Los sujetos mantuvieron su comportamiento alimentario regular y no recibieron ningún consejo nutricional del equipo de investigación. Para fines de análisis alimentario, los sujetos recibieron capacitación de un nutricionista sobre cómo llenar y mantener registros detallados de alimentos durante la duración del estudio de 2 semanas. Los registros de alimentos se recogieron y analizaron utilizando NUTRITIONEST PRO (Axxya Systems, Stafford, TX, EEUU.), y se obtuvo información sobre la ingesta de nutrientes esenciales para cada sujeto. Además, se registraron estrategias nutricionales y consideraciones nutricionales especiales para todos los sujetos.
Suplementación de Vitamina E
Los sujetos fueron asignados aleatoriamente a dos grupos. El grupo Vitamina E suplementó durante 5 días con geles blandos de Vitamina E (400 IU·d-1 α-Tocoferol), que se obtuvieron comercialmente. El grupo Vitamina E comenzó la ingesta de vitamina E 3 días antes del evento, continuó en la mañana de la carrera, y terminó a la mañana siguiente. El grupo Control no recibió ningún tratamiento (es decir, vitamina E), y no era consciente de que el segundo grupo estaba consumiendo vitamina E.
Evaluación de Creatina Kinasa
Nosotros determinamos (y lo apoya la investigación) que los niveles de CK post-evento alcanzan un máximo de 24 horas post-ejercicio (21,31,43). El muestreo de sangre se realizó en un hospital local siguiendo un procedimiento estandarizado. Se extrajo una muestra de sangre (5 ml) de la vena antecubital del brazo derecho en un tubo vacutainor con gel separador. Las muestras se centrifugaron durante 15 min a 2500 rev·min-1 seguido de la separación del suero en un tubo Eppendorf. Los valores de CK se midieron enzimáticamente utilizando el sistema ARCHITECT C8000 (Abbott Diagnostics, Abbott Park, IL, EEUU.).
Análisis Estadísticos
La normalidad de los datos se evaluó mediante el test de Shapiro-Wilk. El test de normalidad verificó que los datos estaban distribuidos normalmente (P>0,05). Los resultados se expresan como media ± desviación estándar (DE). El efecto principal fue detectado usando un ANOVA bidireccional con prueba de medida repetida (Tratamiento y Tiempo). Se realizó una comparación cruzada de grupos utilizando un t-test independiente y t-tests apareados para pre-comparaciones y post-comparaciones dentro del mismo grupo, ambas seguidas por ajuste de Bonferroni para comparaciones múltiples cuando era apropiado. Las relaciones entre las variables del estudio medidas se evaluaron mediante las correlaciones producto-momento de Pearson (r). Todos los análisis estadísticos se realizaron utilizando el paquete estadístico IBM SPSS statistics 20. Hemos establecido el nivel alfa en 0,05 y aceptado la significación cuando P <0,05.
RESULTADOS
Rendimiento
Todos los sujetos cruzaron la línea de meta dentro de su tiempo de rendimiento esperado. La velocidad de carrera durante el evento varió de 12,24 km·h-1 a 19,13 km·h-1, y el tiempo total para terminar el evento varió de 131,7 min a 245,0 min (Figura 1). No hubo diferencias significativas en la velocidad media de carrera (Control: 16,11 ± 3,8 km·h-1 vs. Vitamina E: 16,16 ± 2,6 km·h-1) (Figura 1a) ni en el tiempo para terminar (Control: 168,1 ± 63,9 min vs Vitamina E: 166,3 + 43,9 min) (Figura 1b).
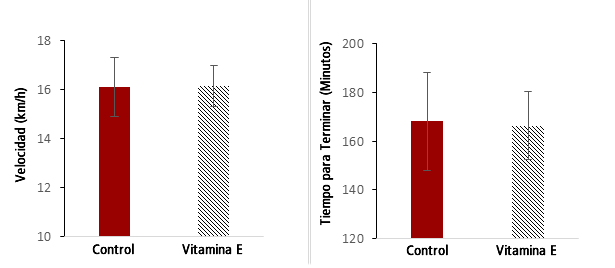
Figura 1. Paso de Carrera y Tiempo para Terminar para el Maratón del Mar Muerto Según el Grupo.
El peso corporal de los sujetos se redujo significativamente (P = 0,000) del principio al final en 3,5 ± 0,54 kg (5,81%), aunque todos los sujetos siguieron su protocolo regular de consumo de líquidos durante el evento (1 a 1,5 L·h-1), y había suficientes estaciones de agua uniformemente distribuidas cada 2,5 km a lo largo del recorrido de la carrera. Las diferencias entre grupos en la pérdida de peso fueron significativas (Control: 5,8 ± 0,9% vs Vitamina E: 6,34 ± 0,3%, P = 0,001), lo que indica una mayor tasa de sudor en el grupo de suplementación con vitamina E (Figura 2).
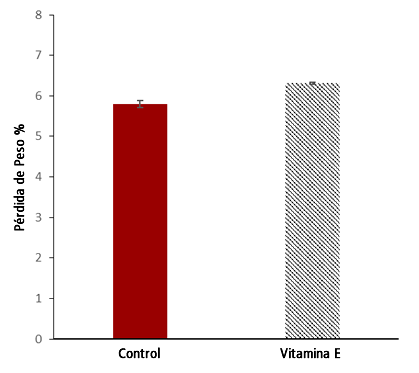
Figura 2. Porcentaje de pérdida de peso durante Maratón del Mar Muerto.Ingesta Energética
La ingesta de energía durante la semana anterior al evento fue similar entre todos los sujetos (control: 3154,5 ± 174,5 kcal·d-1 vs. Vitamina E: 3250,7 ± 186,8 kcal·d-1). Además, las contribuciones porcentuales de carbohidratos (casi 60%), grasas (casi 25%) y proteínas (casi 15%) no fueron significativamente diferentes entre los dos grupos. El consumo de vitamina E en la dieta también fue similar en ambos grupos (casi 30 IU·d-1). La ingesta energética en el día pre-carrera se redujo significativamente (P = 0,000) en un ~39% en comparación con los días anteriores, cuando no hubo diferencias significativas entre los grupos (Tabla 2). Las disminuciones en la ingesta energética en el día pre-carrera se distribuyeron uniformemente entre los nutrientes que producen energía.
Tabla 2. Cambios Medidos en la Ingesta Energética durante el Período de Estudio.
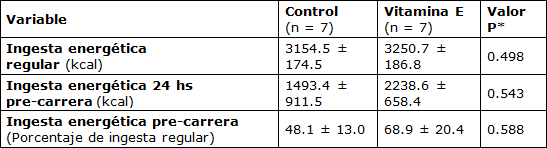
* Valor P para comparación entre grupos.
Daño Muscular
Todos los sujetos en los grupos de control y de suplemento estaban dentro del rango normal de CK antes de la carrera. Sólo después del evento los sujetos superaron el punto de corte normal superior para los niveles de CK en suero (170 U·L-1), variando de 927 a 8501 U·L-1 24 horas después del evento. No se encontró correlación significativa entre los niveles séricos de CK y la velocidad de carrera (r = 0,49; P = 0,15), la edad (r = 0,36; P = 0,31), la ingesta de energía regular (r = 0,69; P = 0,20) la ingesta de energía pre-carrera (r = 0,65; P = 0,24) ni el tiempo de entrenamiento semanal (r = 0,006; P = 0,99). Los niveles séricos de CK post-24 hs fueron significativamente elevados en ambos grupos (Vitamina E: 5337,3 ± 1058,4 U·L-1; Control: 5351,6 ± 1331,9 U·L-1) en comparación con los niveles pre-24 hs = 0,000). Sin embargo, la suplementación con Vitamina E no atenuó los valores de CK en suero después del evento en comparación con el grupo control (P = 0,98) (Figura 3).
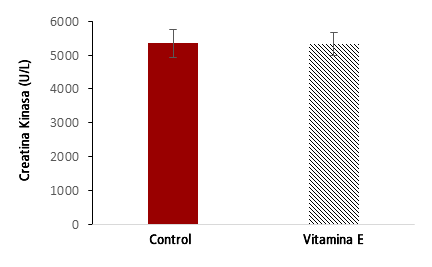
Figura 3. Creatina Kinasa (U·L-1) Post-24 hrs de la Maratón del Mar Muerto.
La fatiga percibida (valores IEP) fue similar en ambos grupos, ya sea evaluada al final de la carrera (mediana = 20) o después de 24 horas (mediana = 18) (P≥0,05).
DISCUSIÓN
A nuestro conocimiento esta es la primera investigación informada sobre la magnitud del daño muscular inducido por la Maratón del Mar Muerto. El propósito de este estudio fue determinar la magnitud de los daños musculares resultantes de correr una maratón de descenso y la eficacia de la suplementación con vitamina E en la prevención del daño muscular. El principal hallazgo del presente estudio fue un descubrimiento de un aumento de 20 a 30 veces en la [CK] sérica, que se considera el valor más alto informado en la bibliografía (Tabla 3).
Tabla 3. Magnitud del Marcador de DMIE (CK) Post-Maratón y las Contracciones Musculares Excéntricas
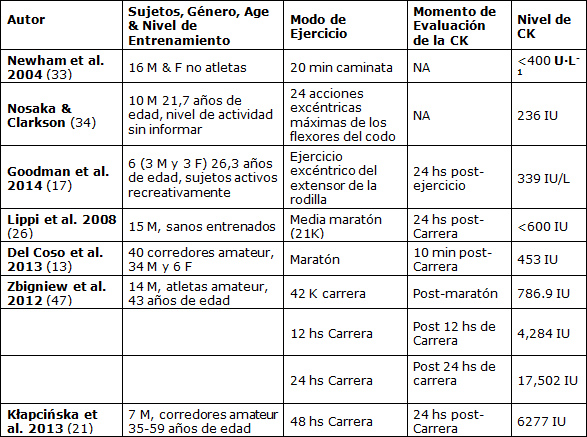
Nuestros resultados no pueden especificar si la pérdida de contenido muscular se debió o no específicamente al componente excéntrico de las contracciones musculares en el running de descenso o al estrés oxidativo causado por el ejercicio aeróbico largo (19). Sin embargo, se midieron los valores de CK séricos en los sujetos que realizaban el evento de 21 km, que se corrió en una pista de carrera plana a una altitud entre ~300 a 370 m bajo el nivel del mar, y se revelaron aunque más bajos que los valores de los maratonistas, pero más altos que lo habitual (resultados no mostrados en este estudio), lo que sugiere un mayor estrés oxidativo coincidiendo con condiciones de carrera hiperbáricas por debajo del nivel del mar. Además, no hay estudios previos que hayan informado un aumento similar en los niveles de CK con una carrera de maratón de distancia. (Tabla 3).
Efecto del Componente Descendente
La magnitud de los valores de CK en el presente estudio no se ha informado en ningún otro evento de maratón o en ninguna carrera de 24 horas o más (43). Por lo tanto, es probable que los hallazgos actuales se atribuyan al componente de descenso en lugar de a la distancia de la carrera. La inclinación de la primera mitad del recorrido de la carrera y la forma excéntrica de contracción mientras se corre en tales condiciones dio como resultado la transferencia de energía mecánica a energía térmica (8,10,40). La temperatura muscular también aumentó, causando una mayor tasa de reacciones dentro de los músculos con un aumento en la pérdida de agua para la termorregulación. Además, el aumento de la oxidación energética en el entorno competitivo impone mayores demandas de oxígeno, lo que al acoplarse con un volumen plasmático reducido crea una situación similar a ejercitarse bajo intensidades mucho más altas (8,13), induciendo así un daño muscular superior al esperado.
Contribución Hiperbárica
En la segunda mitad de la maratón, el recorrido de la carrera cambió dramáticamente. Esta sección del recorrido se caracteriza por un recorrido casi plano bajo presión barométrica aumentada (800 mmHg) a una altitud de 350 a 400 m bajo el nivel del mar. Esta disminución de la altitud a lo largo de la carrera estuvo acompañada por un aumento de la presión barométrica de 763 mmHg a 800 mmHg cerca de la línea de meta. El aumento de la presión barométrica atenúa el flujo sanguíneo, aumenta la PO2, obstaculiza la cinética de O2 y desafía la termorregulación de los corredores debido al aumento de calor y humedad en el área del valle de Jordania en comparación con el clima de las montañas (7,22,26,27,32). Además, se supone que la toxicidad del oxígeno causada por el aumento de la PO2 (que alcanza los 168 mmHg en nuestro caso) incrementa el estrés oxidativo que conduce a más daño muscular.
Deshidratación
El componente excéntrico de correr en descenso y la absorción de choque de los músculos son bien conocidos para generar cantidades anormales de calor que conducen a la tasa de sudoración elevada de los corredores y la deshidratación en un intento de mantener la homeostasis y evitar la hipertermia (10). Se sabe que la deshidratación deteriora la capacidad de estabilizar la temperatura central, lo que da como resultado una hipertermia, que resulta en un Dolor Muscular de Inicio Tardío (DMIT) y un mayor dolor percibido hasta 48 horas después del ejercicio (10). De hecho, nuestros resultados revelaron deshidratación aumentada (> 5% de pérdida de peso), lo que podría explicar la magnitud del daño muscular evidente a través de los altos valores observados de CK y el alto IEP, tanto inmediato como 24 horas post-carrera.
Ingesta Energética
Por temor a problemas gastrointestinales y fatiga, la mayoría de los corredores de distancia no cumplen con los requerimientos de energía o la nutrición adecuada en el día anterior a la competición (29,35). Por lo tanto, los sujetos en este estudio también redujeron su consumo de energía y nutrientes durante las 24 horas que precedieron a la carrera. Teniendo en cuenta que los sujetos no recibieron ningún asesoramiento científico sobre la cantidad y el tipo de alimento que debían ingerir del equipo de investigación, podría explicar parcialmente la reducción de la ingesta el día antes de la carrera. Además, el pequeño tamaño de la muestra, que fue una limitación importante en el presente estudio, también explica la falta de significatividad al comparar la ingesta de energía y otras energías que producen diferencias de nutrientes.
Suplementación
Contrariamente a los efectos preventivos anticipados de la suplementación con vitamina E (α-tocoferol) en la reducción del DMIE, los resultados de nuestro estudio plantean dudas sobre la eficacia de la vitamina E como un agente útil contra el daño muscular inducido por la carrera en descenso. Aunque no se midieron los niveles plasmáticos de α-Tocoferol en este estudio, se ha establecido que la suplementación con vitamina E (α-tocoferol) durante cinco días fue suficiente para duplicar sus niveles en el plasma (46). Por lo tanto, estamos sugiriendo que niveles bajos de vitamina E en plasma no afectaron nuestros resultados. Además, varios estudios han fracasado en informar algún efecto beneficioso de una mayor Vitamina E plasmática sobre la alteración del estado de reducción-oxidación de la sangre y el músculo, así como sobre los daños musculares resultantes de los ejercicios de contracción muscular excéntrica o de carreras a larga distancia (30,41,42). Muchos estudios sugieren que los sujetos deben tener hipovitaminosis E para detectar un efecto de la suplementación (3,42); sin embargo, ninguno de nuestros sujetos presentó hipovitaminosis al ingreso al estudio, según lo determinó el análisis alimentario de sus registros de alimentos.
CONCLUSIONES
La magnitud del daño muscular inducido por la Maratón del Mar Muerto es muy superior a cualquier otro daño muscular informado post-maratón. Es impulsado por las condiciones extremas de carrera (recorrido de la carrera y factores ambientales), exponiendo así a los participantes del evento a una gran carga de salud. Aunque la bibliografía sugiere la suplementación de vitamina E como un potencial agente ergogénico y preventivo contra el DMIE excéntrico, nuestros resultados no apoyan estas afirmaciones en el caso de la Maratón del Mar Muerto. Estudios futuros son necesarios para probar la eficacia de las estrategias para atenuar el DMIE de la Maratón del Mar Muerto.
AGRADECIMIENTOS
Agradecemos a los equipos de running de las fuerzas armadas y nacionales de Jordania por participar en este estudio. También agradecemos a The Specialty Hospital Laboratory/Amman y a su personal por su amable colaboración en la recolección y análisis de las muestras de sangre.
Dirección de correo: Ali M. Al-Nawaiseh, PhD, Department of Sport rehabilitation, The Hashemite University, Zarqa, Jordan 11196, Email: nawaiseh_a@yahoo.com
Referencias
1. Asp S, Rohde T, Richter EA. (1997). Impaired muscle glycogen resynthesis after a marathon is not caused by decreased muscle GLUT-4 content. J Appl Physiol. 1997;83(5): 1482-1485.
2. Assumpcao CDO, Lima LCR, Oliveira FBD, Greco CC, Denadai BS. (2013). Exercise-induced muscle damage and running economy in humans. Sci World J. 2013;1-11. doi.org/ 10.1155/2013/189149
3. Avery NG, Kaiser JL, Sharman MJ, Scheett TE, Barnes DM, Gomez AL, Volek JS. (2003). Effects of vitamin E supplementation on recovery from repeated bouts of resistance exercise. J Strength Cond Res. 2003;17(4):801-809.
4. Bloomer RJ. (2007). The role of nutritional supplements in the prevention and treatment of resistance exercise-induced skeletal muscle injury. Sports Med. 2007;37(6):519-532.
5. Bryant RJ, Ryder J, Martino P, Kim J, Craig BW. (2003). Effects of vitamin E and C supplementation either alone or in combination on exercise-induced lipid peroxidation in trained cyclists. J Strength Cond Res. 2003;17(4):792-800.
6. Cases N, Aguilo A, Tauler P, Sureda A, Llompart I, Pons A, Tur JA. (2005). Differential response of plasma and immune cell's vitamin E levels to physical activity and antioxidant vitamin supplementation. Eur J Clin Nutri. 2005;59(6):781-788.
7. Casey DP, Joyner MJ, Claus PL, Curry TB. (2011). Hyperbaric hyperoxia reduces exercising forearm blood flow in humans. Am J Physiol Heart Circ Physiol. 2011;300(5):H1892-H1897.
8. Cheuvront SN, Haymes EM. (2001). Thermoregulation and marathon running. Sports Med. 2001;31(10):743-762
9. Clarkson PM, Kearns AK, Rouzier P, Rubin RLC, Thompson PD. (2006). Serum creatine kinase levels and renal function measures in exertional muscle damage. Med Sci Sports Exerc. 2006;38(4):623.
10. Cleary MA, Sweeney LA, Kendrick ZV, Sitler MR. (2005). Dehydration and symptoms of delayed-onset muscle soreness in hyperthermic males. J Athl Train. 2005;40(4):288.
11. Corona BT, Rouviere C, Hamilton SL, Ingalls CP. (2008). Eccentric contractions do not induce rhabdomyolysis in malignant hyperthermia susceptible mice. J Appl Physiol. 2008; 105(5):1542-1553.
12. Davis DP, Videen JS, Marino A, Vilke GM, Dunford JV, Van Camp SP, Maharam LG. (2010). Exercise-associated hyponatremia in marathon runners: A two-year experience. J Emerg Med. 2010;21(1):47-57.
13. Del Coso J, Fernández D, Abián-Vicen J, Salinero JJ, González-Millán C, Areces F, Pérez-González B. (2013). Running pace decrease during a marathon is positively related to blood markers of muscle damage. PloS One. 2013;8(2):e57602.
14. Ekblom B, Ekblom Ö, Malm C. (2006). Infectious episodes before and after a marathon race. Scand J Med Sci Sports. 2006;16(4):287-293.
15. Eston R, Byrne C, Twist C. (2003). Muscle function after exercise-induced muscle damage: Considerations for athletic performance in children and adults. J Exerc Sci Fit. 2003; 1(2):85-96.
16. Gomez-Cabrera MC, Martínez A, Santangelo G, Pallardó FV, Sastre J, Vina J. (2006). Oxidative stress in marathon runners: Interest of antioxidant supplementation. British J Nutri. 2006;96(S1):S31-S33.
17. Goodman CA, Bennie JA, Leikis MJ, McKenna MJ. (2014). Unaccustomed eccentric contractions impair plasma K+ regulation in the absence of changes in muscle Na+, K+-ATPase content. PloS One. 2014;9(6):e101039.
18. Kabasakalis A, Kyparos A, Tsalis G, Loupos D, Pavlidou A, Kouretas D. (2011). Blood oxidative stress markers after ultramarathon swimming. J Strength Cond Res. 2011; 25(3):805-811.
19. Kanda K, Sugama K, Sakuma J, Kawakami Y, Suzuki K. (2014). Evaluation of serum leaking enzymes and investigation into new biomarkers for exercise-induced muscle damage. Exerc Immunol Rev. 2014;20:39-54.
20. Kirwan JP, Hickner RC, Yarasheski KE, Kohrt WM, Wiethop BV, Holloszy JO. (1992). Eccentric exercise induces transient insulin resistance in healthy individuals. J Appl Physiol. 1992;72(6):2197-202.
21. Kłapcińska B, Waśkiewicz Z, Chrapusta SJ, Sadowska-Krępa E, Czuba M, Langfort J. (2013). Metabolic responses to a 48-h ultra-marathon run in middle-aged male amateur runners. Eur J Appl Physiol. 2013;113(11):2781-2793.
22. Kramer MR, Godfrey S. (1996). Dead Sea: Natural oxygen enrichment at low altitude. Israel J Med Sci. 1996;32:S20-23.
23. Kyparos A, Nikolaidis MG, Dipla K, Zafeiridis A, Paschalis V, Vrabas IS. (2012). Low-frequency fatigue as an indicator of eccentric exercise-induced muscle injury: The role of Vitamin E. Hindawi Publishing Corporation. 2012;9(17). doi:10.1155/2012/62835 2.
24. Kyparos A, Sotiriadou S, Mougios V, Cheva A, Barbanis S, Karkavelas G, Matziari C. (2011). Effect of 5-day vitamin E supplementation on muscle injury after downhill running in rats. Eur J Appl Physiol. 2011;111(10):2557-2569.
25. Lieberman DE, Dennis MB. (2007). The evolution of marathon running-capabilities in humans. Sports Med. 2007;37(4-5):288-290.
26. Lippi G, Schena F, Salvagno GL, Montagnana M, Gelati M, Tarperi C, Guidi GC. (2008). Acute variation of biochemical markers of muscle damage following a 21-km, half-marathon run. Scand J Clin Lab Invest. 2008;68(7):667-672.
27. Liu JH, Zhou ZH, Ou MH, Xie MH, Wang K, Shi YQ. (2005). The effect of "living high and training low" on serum CK, LDH and ALT of rowing athletes. Chin J Appl Physiol. 2005;21(3):349-352.
28. Machefer G, Groussard C, Vincent S, Zouhal H, Faure H, Cillard J, Gratas-Delamarche A. (2007). Multivitamin-mineral supplementation prevents lipid peroxidation during “the Marathon des Sables”. J Am Coll Nutr. 2007;26(2):111-120.
29. Machefer G, Groussard C, Zouhal H, Vincent S, Youssef H, Faure H, Gratas-Delamarche, A. (2007). Nutritional and plasmatic antioxidant vitamins status of ultra-endurance athletes. J Am Coll Nutr. 2007;26(4):311-316.
30. Mastaloudis A, Traber MG, Carstensen K, Widrick JJ. (2006). Antioxidants did not prevent muscle damage in response to an ultramarathon run. Med Sci Sports Exerc. 2006; 38(1):72-80.
31. McArdle WD, Katch FI, Katch VL. (2010). Exercise Physiology: Nutrition, Energy, and Human Performance. (4th Edition). Philadelphia, PA: Lippincott Williams & Wilkins, 2010.
32. Moses SW. (2012). Health effects of Dead Sea climatotherapy on patients with heart and lung diseases. Med Hydrol Balneol: Envir Aspects. 2012;66:119.
33. Newham DJ, Jones DA, Edwards RHT. (1983). Large delayed plasma creatine kinase changes after stepping exercise. Muscle & Nerve. 1983;6(5):380-385.
34. Nosaka K, Clarkson PM. (1996). Variability in serum creatine kinase response after eccentric exercise of the elbow flexors. Int J Sports Med. 1996;17(2):120-127.
35. Pfeiffer B, Stellingwerff T, Hodgson AB, Randell R, Pottgen K., Res, P, Jeukendrup AE. (2012). Nutritional intake and gastrointestinal problems during competitive endurance events. Med Sci Sports Exerc. 2012;44(2):344-351.
36. Rapoport BI. (2010). Metabolic factors limiting performance in marathon runners. PLoS Computational Biology. 2010;6(10):e1000960.
37. Sacheck JM, Blumberg JB. (2001). Role of vitamin E and oxidative stress in exercise. Nutrition. 2001;17(10):809-814.
38. Shafat P, Butler RL, Jensen Donnelly AE. (2004). Effects of dietary supplementation with vitamins C and E on muscle function during and after eccentric contractions in humans. Eur J Appl Physiol. 2004;93(1-2):196-202.
39. Sureda A, Ferrer MD, Mestre A, Tur JA, Pons A. (2013). Prevention of neutrophil protein oxidation with vitamins C and E diet supplementation without affecting the adaptive response to exercise. Int J Sport Nutr. 2013;23(1):31-39.
40. Takeno Y, Kamijo YI, Nose H. (2001). Thermoregulatory and aerobic changes after endurance training in a hypobaric hypoxic and warm environment. J Appl Physiol. 2001;91 (4):1520-1528.
41. Theodorou AA, Nikolaidis MG, Paschalis V, Koutsias S., Panayiotou G, Fatouros IG, Jamurtas AZ. (2011). No effect of antioxidant supplementation on muscle performance and blood redox status adaptations to eccentric training. Am J Clin Nutr. 2011;93(6):1373-1383.
42. Warren JA, Jenkins RR, Packer L, Witt EH, Armstrong RB. (1992). Elevated muscle vitamin E does not attenuate eccentric exercise-induced muscle injury. J Appl Physiol. 1992; 72(6):2168-2175.
43. Waśkiewicz Z, Kłapcińska B, Sadowska-Krępa E, Czuba M, Kempa K, Kimsa E, Gerasimuk D. (2012). Acute metabolic responses to a 24-h ultra-marathon race in male amateur runners. Eur J Appl Physiol. 2012;112(5):1679-1688.
44. Williams PT. (2013). Effects of running and walking on osteoarthritis and hip replacement risk. Med Sci Sports Exerc. 2013;45(7):1292-1297.
45. Williams PT. (2013). Non-exchangeability of running vs. other exercise in their association with adiposity, and its implications for public health recommendations. PloS one. 2013;7 (7):e36360.
46. You T, Goldfarb AH, Bloomer RJ, Nguyen L, Sha X, McKenzie MJ. (2005). Oxidative stress response in normal and antioxidant supplemented rats to a downhill run: Changes in blood and skeletal muscles. Can J Appl Physiol. 2005;30(6):677-689.
47. Zbigniew W, Barbara K, Ewa SK, Milosz C, Katarzyna K, Elżbieta K, Dagmara G. (2012). Acute metabolic responses to a 24-h ultra-marathon race in male amateur runners. Eur J Appl Physiol. 2012;112 (5):1679-1688.