Efectos de la Hiperoxia sobre el Consumo Máximo de Oxígeno, el Equilibrio Ácido-Base Sanguíneo y las Limitaciones en la Tolerancia al Ejercicio
Robert A Robergs2 y Todd A Astorino1
1Exercise Science Program, Salisbury University, Salisbury, MD 21801, Estados Unidos.
2Center for Exercise and Applied Human Physiology, Exercise Physiology Program, the University of New Mexico, Albuquerque, NM, 87131-1258.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2003.
Publicado 26 de mayo de 2004
Resumen
Palabras clave: VO2 máx., limitación central, SaO2, respiración de O2, lactato
INTRODUCCION
La hiperoxia es definida como un incremento en la concentración de oxígeno (O2) inspirado. La hiperoxia puede ser administrada por la vía de la reinfusión sanguínea de (1, 2), la respiración de aire enriquecido con oxígeno [fracción de oxígeno inspirado (FlO2)>(0.2093)] (3-7), y por exposición hiperbárica [presión parcial arterial de oxígeno (PaO2)~500 Torr.] (8). Durante las dos últimas décadas, la hiperoxia ha sido ampliamente utilizada por los investigadores para examinar las limitaciones del máximo consumo de oxígeno (VO2 máx.), de manera tal que es necesario resumir estos hallazgos. Además, se han completado muchas investigaciones adicionales desde la más reciente revisión sobre hiperoxia y tolerancia al ejercicio (4), por lo cual está garantizada una revisión más completa y más actual acerca de los efectos del incremento del contenido de O2 sobre la tolerancia al ejercicio, la función cardiovascular y el equilibrio ácido/base. Los criterios de búsqueda para esta revisión incluyeron todos los estudios en los cuales sujetos saludables hallan completado ejercicio progresivo hasta el agotamiento bajo condiciones de hiperoxia.
EFECTOS DE LA HIPEROXIA SOBRE LA TOLERANCIA AL EJERCICIO
Rápidamente después del descubrimiento del O2, se determinaron sus efectos sobre la capacidad de ejercicio. Reportes anecdóticos (9-10) sugirieron que la respiración de O2 puro incrementaba la tolerancia al ejercicio, pero deficiencias en el diseño de la investigación y en el equipamiento de los laboratorios minimizaron la validez de esos datos. Durante los siguientes 30 años, la investigación con diseños experimentales y métodos mejorados respaldaron esos hallazgos mostrando que la hiperoxia mejoraba la tolerancia independientemente del modo de ejercicio. Sin embargo, no podrían eliminarse los efectos psicológicos de respirar un gas hiperóxico, como una causa de la mejora del rendimiento, ya que no se empleaban grupos controles, pruebas aleatorias y los sujetos no utilizaban mascaras. Uno de los primeros estudios bien controlados (11) que investigo los cambios en la tolerancia al ejercicio con la hiperoxia requirió que los sujetos completaran ejercicios en cinta hasta el agotamiento en una habitación con cuatro fracciones diferentes de gas hiperóxico (40, 60, 80, y 100% de O2). Los resultados son presentados en la Figura 1.

Figura 1. Incrementos en la tolerancia al ejercicio con el incremento de la
FlO2. Adaptado de Wilson y Welch (11).
El tiempo de carrera hasta el agotamiento se incremento en forma casi lineal desde el 40 al 100% de O2. Es interesante observar que en comparación al 80% de O2, el tiempo de carrera todavía se incrementó al 100% de O2, contrariamente a reportes anteriores (12), en donde la tolerancia al ejercicio realizaba una meseta con una FlO2 mayor de 0.66. Posteriores trabajos han mostrado que en comparación con la normoxia, la administración aguda de hiperoxia aumentaba la capacidad de ejercicio durante la carrera en cinta (13-15), cicloergometría submáxima (16-18), y durante el ejercicio máximo de remo (Tabla 1) (6-7). La magnitud del beneficio sobre el rendimiento varia, sin embargo, con la especificidad de la variable medida en el estudio, y parece que la carga de trabajo pico se incrementa a un menor grado que el tiempo hasta el agotamiento durante el ejercicio máximo o supra máximo. Estos datos sugieren que la hiperoxia incrementa la capacidad de completar ejercicios submáximos y/o ejercicios de alta intensidad.
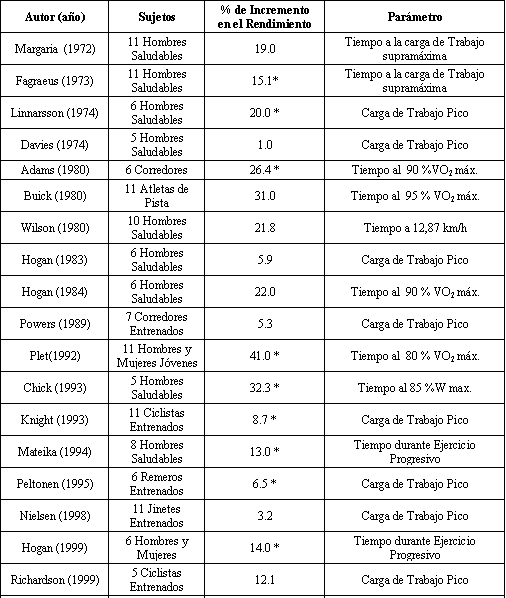
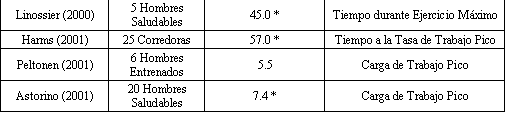
Tabla 1. Efectos de
la hiperoxia sobre el rendimiento en el ejercicio. * p<0.05.
EFECTOS DE LA HIPEROXIA SOBRE EL VO2 MÁX.
Una explicación inicial de la mejora del rendimiento con la hiperoxia es un mayor VO2 máx. mediado por una mejora en el transporte de oxígeno. La ecuación de Fick propone que cualquier incremento observado en el VO2 máx. es atribuido en parte a la función central cardiovascular (gasto cardiaco) y/o a la extracción de O2 (diferencia arterio-venosa de O2). Por ejemplo, un cálculo simple enfatiza que el cambio esperado en el VO2 máx. para un incremento en el transporte de O2 mediado por la hiperoxia se debe a un incremento en el contenido arterial de oxígeno (CaO2). Utilizando valores previamente reportados del gasto cardiaco (Q) y de la diferencia arterio-venosa de O2 (a-v O2∆), en normoxia y al 100% de O2 (5), el VO2 máx. debería incrementarse aproximadamente en un 11% (4547.5 ml/min vs. 4102.6 ml/min) en hiperoxia. La Tabla 2 muestra la magnitud del incremento en el VO2 máx. en respuesta a varios niveles de hiperoxia administrados en investigaciones previas. Datos recientes de nuestro laboratorio (19) revelaron que la media para el VO2 máx. es un 12% mayor con un 25% de O2 (4.34 ± 0.75 l/min) versus la condición de normoxia (3.87 ± 0.58 l/min) en hombres jóvenes moderadamente entrenados. Este incremento es comparable a los datos reportados en investigaciones previas (7, 14, 17, 20) que utilizaron sujetos similares. De este modo, ¿qué factores son responsables del incremento en el VO2 máx. con la hiperoxia?.
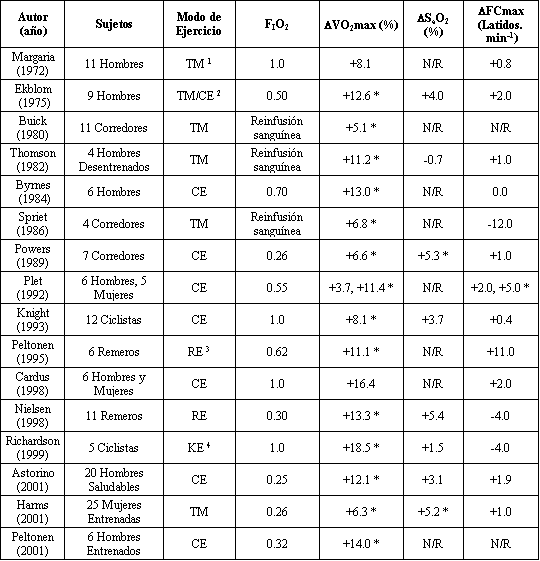
Tabla 2. Cambios en el VO2 máx., SaO2 máximo, y la
frecuencia cardiaca máxima reportados con hiperoxia. 1 = cintaergómetro, 2 =
cicloergómetro, 3 = romoergómetro, 4 = extensiones de rodilla a una pierna, N/R
= no reportado, * = incremento significativo (p<0.05) en el VO2 máx.,
SaO2, FC con respecto a la condición de normoxia.
Primero, un transporte de O2 mejorado (mediado por un incremento en el Q y/o en la CaO2) podría explicar los incrementos en el VO2 máx. coincidentes con la hiperoxia. En respuesta a la reinfusión de 2 U de sangre que provocaron un 11.2% de incremento en el VO2 máx. (2), la CaO2 fue significativamente mayor (21.9±1.2 ml/dl vs 19.7±0.7 ml/dl), mientras que el Q fue similar excepto cuando se alcanzó el VO2 máx. En otro estudio, el transporte de O2 cuando se alcanzó el VO2 máx., fue un 11% mayor con el 100% de O2 (4.18±0.23 l/min) en comparación con el aire del ambiente (3.77 ± 00.2 l/min), debido a un incremento en la CaO2 sin cambios en el Q en las piernas (5). El incremento casi lineal en el VO2 máx. en respuesta al transporte de O2 incrementado con la hiperoxia en estudios previos se muestra en las Figuras 2 A-C.
Figura 2. Correlación entre el VO2 máx. y el transporte de O2
en investigaciones previas; (a) en respuesta a la reinfusión de sangre (1), (b)
durante remoergometría en normoxia y al 30% de O2 (7); (c) durante
una cicloergometría en normoxia y al 100% de O2 (5), y (d) durante
extensiones de rodillas a una pierna en normoxia y al 100% de O2 (32)
El incremento en la CaO2 mediado por la hiperoxia se debe a un marcado incremento en la SaO2 (3, 7, 19) y en menor extensión, a la concentración de hemoglobina ([Hb]) (1, 14). De hecho, los datos de los investigadores pioneros Powers y cols. (1) demostraron que la hiperoxia aguda (26.2 % de O2) elimina la aparición de hipoxemia arterial en corredores altamente entrenados, lo que resulta en un VO2 máx. significativamente mayor en comparación con el ejercicio con el aire del ambiente (74.7±1.2 vs. 70.1±1.9 ml/kg/min). Corredores entrenados que no tuvieron una desaturación (una marcada disminución del la SaO2) durante VO2 máx., mostraron un incremento en el mismo mientras respiraban mezclas de gas hiperóxico. Consecuentemente, es evidente que la hiperoxia mejora el VO2 máx. debido a un incremento en el transporte de oxígeno al músculo activo.
¿Le permite este incremento en el transporte de O2 impulsado por la hiperoxia superar las limitaciones centrales del VO2 máx. al atleta?. La aseveración de que la función cardiovascular central regula el VO2 máx. no es nueva, ya que esta teoría fue introducida originalmente en una investigación clásica por parte del laboratorio de A. V. Hill (21, 22). Durante esta investigación, los sujetos corrieron sobre una pista de 85 m a varias velocidades durante tres minutos mientras el intercambio de gases se obtuvo cada 30 s con bolsas de Douglas. Hill y sus colegas concluyeron que una velocidad de carrera de 16 km/h y un VO2 máx. igual a 4 l/min representaba el máximo rendimiento atlético en el hombre. Para explicar la nivelación en el consumo de oxígeno a esas altas velocidades de carrera, Hill comento (p. 156)...”al correr, el requerimiento de oxígeno se incrementa continuamente a medida que la velocidad también lo hace, alcanzando valores enormes con las velocidades mas altas: El consumo de oxígeno real, sin embargo, alcanza un máximo mas allá del cual ningún esfuerzo puede superarlo. El consumo de oxígeno puede alcanzar su máximo y permanecer constante y que no puede alcanzar valores más altos debido a las limitaciones de los sistemas circulatorio y respiratorio”.
Esta breve sinopsis de los datos recolectados hace casi 80 años representa la interpretación inicial de la meseta del VO2 en el VO2 máx., que representa la limitación central del mismo. Es decir, en el VO2 máx., la interpretación es que el transporte de oxígeno al músculo activo es inadecuado para cubrir la siempre creciente demanda de oxígeno. Las investigaciones subsiguientes (23-25) que examinaron el VO2 en respuesta al ejercicio progresivo fraccionado corroboraron el paradigma desarrollado por Hill acerca de que el transporte de O2 limita el VO2 máx. Dos décadas más tarde, en respuesta a un 43% de hombres que exhibían una meseta en el VO2 durante el VO2 máx., Cumming y Borysyk (26) comentaron (p. 20) que... “Hasta cierto punto, estos (criterios para la confirmación de la incidencia del VO2 máx.) son todos indicadores de que el sistema de transporte de oxígeno esta completamente cargado y el ejercicio es incrementalmente llevado a cabo anaeróbicamente”. De manera similar, Shepard (27) señaló (p. 759)...”Durante el ejercicio en cinta, el esfuerzo máximo se ve impedido por una falla en la circulación central”. Además, se reportó que en hombres que se ejercitaban hasta el agotamiento, el VO2 máx. y el transporte de O2 eran marcadamente atenuados al respirar una mezcla de gas al 12% y al 15% de O2 en comparación con la normoxia (28). Consecuentemente, es aparente que el transporte de O2 a los músculos en contracción limita parcialmente el VO2 máx., y que el incremento en el transporte de O2 a través de la hiperoxia promueve incrementos en el VO2 máx. y en la tolerancia al ejercicio.
LIMITACIONES PERIFÉRICAS DEL VO2 MÁX.
Las limitaciones del VO2 máx. también existen en la periferia, dentro del músculo esquelético. Saltin y cols. (29) utilizaron un protocolo de pedaleo a una pierna para examinar las adaptaciones centrales y periféricas a cuatro semanas de diferentes tipos de entrenamientos. Los resultados demostraron que en respuesta al entrenamiento de velocidad y de resistencia, la pierna entrenada mostraba incrementos significativos en el VO2 máx., y disminuciones significativas en el lactato sanguíneo y la frecuencia cardiaca a tasas de trabajo submáximas, en comparación con la pierna desentrenada. Los autores concluyeron que los factores periféricos desempeñan un rol importante en la limitación al rendimiento en el ejercicio, tal como lo hace la función cardiovascular central. Se considera también que la acumulación substancial de lactato durante el ejercicio progresivo esta asociada con el comienzo del agotamiento. Los reportes realizados por el laboratorio de Welch (11) afirmaban que el aumento del rendimiento con la hiperoxia puede deberse a una anaerobiosis disminuida y a un incremento subsiguiente del metabolismo oxidativo. Una producción de dióxido de carbono aumentada (VCO2) puede representar una mayor producción de ATP por la vía oxidativa, aunque pocos estudios (7, 30) han demostrado incrementos significativos en la VCO2 en la condición de hiperoxia. De esta manera, es necesario examinar los cambios en la VCO2, la ventilación, y el lactato sanguíneo, reportados en investigaciones previas.
Las diferencias en la VCO2, la ventilación y el lactato sanguíneo de los estudios previos que compararon la tolerancia al ejercicio en normoxia e hiperoxia se muestran en la Tabla 3. Datos recientes (7) revelaron una VCO2 significativamente mayor durante el VO2 máx. con el 30% de O2, en remeros entrenados que completaron una remoergometría progresiva, aunque este modo particular de ejercicio puede explicar este hallazgo. Además la VCO2 fue mayor durante una cicloergometría submáxima con el 55% de O2 (30), aunque este resultado se observó solo en diez sujetos. Los datos de nuestro laboratorio en 20 hombres saludables (19) demostraron que no hubo diferencias entre la VCO2 máxima y submáxima cuando se inspiraron gases con fracciones de oxígeno en un rango de 25-35%, aunque la VCO2 fue mayor (p<0.05) al VO2 máx. con la hiperoxia. Esto tiene sentido, ya que una mayor producción de potencia con la hiperoxia (19, 31-33) fomentaría una mayor VCO2 durante el VO2 máx. Se ha reportado que una hiperoxia mayor del 60% de O2 anula la actividad de los quimioreceptores periféricos (11), y de esta manera disminuye la respuesta ventilatoria. Sin embargo, la mayoría de las investigaciones previas (3, 5, 14, 19) reportaron ventilaciones similares durante el VO2 máx. tanto en las condiciones de hiperoxia como de normoxia. Si la ventilación máxima es similar, la producción de CO2 no metabólico también puede ser similar, derivando en la ausencia de cambios en la VCO2 durante el VO2 máx. en la condición de hiperoxia.
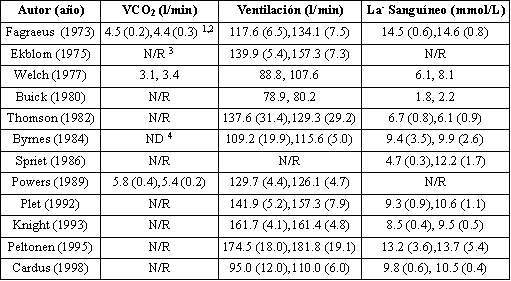
Tabla 3. Alteraciones en la VCO2 máxima, la ventilación y el
lactato sanguíneo durante las condiciones de hiperoxia y normoxia.
LIMITANTES DEL SISTEMA NERVIOSO CENTRAL AL VO2 MÁX.
Investigaciones previas demostraron alteraciones en la liberación de catecolaminas con la manipulación de la FlO2. Se ha identificado a la activación simpática aumentada como un mecanismo para incrementar la FC y el flujo sanguíneo a una tasa de trabajo en hipoxia aguda (34). Se ha mostrado una reducción significativa en los niveles de norepinefrina y epinefrina después de 10 y 15 min de ejercicio, en respuesta a una cicloergometría submáxima con el aire de la habitación y con el 100% de O2 (35). Sin embargo, durante una cicloergometría prolongada al 67% del VO2 máx. (36), no se observaron diferencias en la concentración de catecolaminas (p>0.05) cuando se realizó el ejercicio con el aire de la habitación y con el 60% de O2, llevando a los autores a concluir que los cambios en la función metabólica o cardiorrespiratoria eran independientes de las catecolaminas. Consecuentemente, es improbable que la actividad simpática altere la tolerancia al ejercicio en hiperoxia. También es posible que un mejor reclutamiento de unidades motoras pueda explicar el incremento en la tolerancia al ejercicio con la hiperoxia aguda. En un estudio reciente (34) sometió a seis hombres saludables a ejercicios con el antebrazo y una cicloergometría hasta el agotamiento a nivel del mar y luego de un mes de aclimatación a la altura (5050 m). Durante las pruebas en la altura, antes del agotamiento se les administro a los sujetos una mezcla de gas al 100% de O2, lo que resultó en 3 min adicionales de ejercicio. Durante todas las pruebas, se colocaron electrodos en el vasto lateral derecho para registrar datos electromiográficos (EMG). Los resultados mostraron que la EMG integrada se incrementó durante los 3 minutos adicionales de ejercicio mientras se respiraba el gas al 100% de O2, sugiriendo un mayor reclutamiento de fibras inactivas. Sin embargo, estos datos fueron obtenidos en solo seis sujetos, por lo que los datos de la influencia adicional de la hipoxia crónica sobre el reclutamiento de unidades motoras son especulativos. Mateika y cols. (37) reportaron que durante un ejercicio progresivo en cinta llevado a cabo por hombres saludables no se hallaron diferencias en la raíz cuadrada media del voltaje de la EMG en hipoxia, normoxia, e hiperoxia (66% O2). Sería interesante adquirir datos de la EMG de un mayor número ciclistas, entrenados durante ejercicio progresivo en normoxia e hiperoxia para determinar si el reclutamiento de unidades motoras es, en efecto, mayor bajo condiciones de una PO2 incrementada. Esto podría permitirles a los investigadores identificar otra limitación posible a la tolerancia al ejercicio.
EFECTOS DE LA HIPEROXIA SOBRE EL METABOLISMO OXIDATIVO
Las investigaciones pasadas en relación a la VCO2 y la ventilación (VE) no revelaron si el metabolismo oxidativo es aumentado con la hiperoxia aguda. Uno de los primeros trabajos (38) indicó que la depleción de glucógeno es similar durante el ejercicio máximo tanto en normobaria como en hiperbaria, un hallazgo respaldado por una tasa similar de glucogenolisis en normoxia y con el 60% de O2. Sin embargo, el hecho de que no halla cambios en la degradación de glucógeno con la hiperoxia solo infiere que el metabolismo aeróbico es similar bajo condiciones de altas PO2 inspiradas. Una investigación elocuente realizada in situ en músculos de perros (40) demostró cambios en el estado de los potenciales redox mitocondriales tanto en normoxia como al 100% de O2. En reposo, el cociente NAD+/NADH citoplasmático estimado a partir del cociente Lactato/Piruvato, estaba en un estado más oxidado, mientras que, durante estimulación eléctrica no se observaron diferencias entre la normoxia y la hiperoxia. Además, el potencial redox mitocondrial, estimado a partir de las actividades de las enzimas del sistema de la glutamato dehidrogenasa, no fue diferente tanto en reposo como durante la estimulación. El hallazgo de un potencial redox mas oxidado en la hiperoxia sugiere una mayor tasa glucolítica durante el inicio del ejercicio. Esto podría no solo fomentar una mayor producción de piruvato y como resultado un mayor flujo hacia el ciclo del ácido cítrico, sino que también podría proveer de NADH adicionales para la cadena de transporte de electrones. En contraste, los trabajos en humanos que realizaron ejercicio máximo, tanto con el aire de la habitación como con el 60% de O2 (41) revelaron una mejora en el mantenimiento de las concentraciones de ATP, ADP y del NADH en relación a la normoxia. Esto también estuvo asociado a una acumulación reducida de IMP, lactato, creatina, y glucosa-6-fosfato en relación con la normoxia. Esta reducción en la perturbación de la homeostasis celular podría promover una menor acidosis con la hiperoxia, derivando en un mejor mantenimiento de la función contráctil y de esta manera mejorar la tolerancia al ejercicio. Sin embargo, estos hallazgos están basados en datos musculares de solo cinco sujetos, por lo que estos resultados deberían ser aceptados con precaución. Por último, parece que el metabolismo celular es regulado por el O2, y son necesarias investigaciones adicionales con una mayor poder estadístico para mejorar la investigación con respecto a si la hiperoxia aumenta el metabolismo oxidativo.
EFECTOS DE LA HIPEROXIA SOBRE LA RESPUESTA DEL LACTATO SANGUÍNEO
Hasta la fecha, solo dos estudios (1, 17) han demostrado una concentración significativamente menor del lactato sanguíneo durante el VO2 máx. con la hiperoxia. El primero (1) involucró la administración de hiperoxia a través de la reinfusión gradual de 3 U de sangre, mientras que el estudio de Plet y cols. (17) sometió a un grupo de sujetos a una cicloergometría en normoxia y con el 55% de O2. Sin embargo, estos estudios solo utilizaron cuatro y cinco sujetos, por lo que estos datos son especulativos. De hecho, estos estudios están en desacuerdo con datos previos que no reportaron diferencias en la máxima concentración de lactato sanguíneo en hiperoxia (Tabla 3). Una investigación previa (31) no solo indicó concentraciones similares de lactato arterial durante el VO2 máx. en normoxia (9.5±5 mmol/l) y con el 100% de O2 (8.5±0.4 mmol/l), sino que también documentó una liberación de lactato similar, calculada por medio del flujo venoso femoral y la diferencia arterio-venosa, en normoxia (23.7±4.2 mmol/min) e hiperoxia (20.1±3.3 mmol/min). En músculos aislados de perros (42), la producción de lactato fue similar en normoxia (480.0±110.0 μmol/g) y con el 100% de O2 (390.0±60.0 μmol/g). Los datos de nuestro laboratorio (19) en 20 hombres revelaron que la máxima concentración de lactato sanguíneo obtenida de la vena dorsal de la mano no es diferente a una FlO2 igual a 0.25 en relación con la normoxia (Tabla 3). Sin embargo, se muestra una tendencia (p>0.05) de una mayor concentración de lactato sanguíneo con el 30 y el 35% de O2, lo cual puede ser explicado por una significativamente mayor producción de potencia con la hiperoxia (347.7±57.6 y 349.2±62.8 Watts, respectivamente) versus normoxia (325.7±50.8 Watts). Esto tiene sentido, ya que la tasa de producción de ATP a partir de la glucólisis debe acelerarse al final del ejercicio progresivo para cubrir la demanda continuamente creciente de ATP. Esto puede ser debido a un mayor reclutamiento de unidades motoras rápidas glucolíticas (Tipo IIa y IIb) a producciones de potencia casi máximas. Los resultados de mitocondrias aisladas de músculos de perros (43) también demostraron una acumulación de lactato en músculos completamente oxigenados refutando la afirmación acerca de que el lactato no se produce en presencia de O2. Para explicar el mecanismo por el cual la hiperoxia altera la respuesta del lactato durante el ejercicio progresivo, se debe dirigir las investigaciones futuras hacia la observación de la tasa de clearance o “lavado” de lactato y las actividades de la lactato dehidrogenasa y la piruvato dehidrogenasa en hiperoxia.
EFECTOS DE LA HIPEROXIA SOBRE EL EQUILIBRIO ACIDO/BÁSICO SANGUÍNEO
¿Representa la falta de diferencias en la ventilación, VCO2, pH, y lactato, el mantenimiento del equilibrio ácido/básico bajo condiciones de una PO2 incrementada en hiperoxia?. Las investigaciones que hayan examinado el equilibrio ácido/básico en las condiciones de normoxia e hiperoxia son algo escasas (7, 16, 31, 42). Un primer trabajo (20) reveló valores similares de pH arterial máximo en normoxia (7.23±0.02) y con un 60% de O2 (7.22±0.01) en respuesta al ejercicio máximo en cinta. Similarmente se demostró que no había diferencias en el pH máximo en remeros de elite (7), ciclistas entrenados (31), y hombres activos y saludables (19). Sin embargo, en respuesta a una cicloergometría máxima con el 55% de O2, el pH venoso arterializado (7.39±0.02) fue significativamente mayor en comparación con la condición de normoxia (7.35±0.01). Interesantemente, en el músculo gastronecmio de caninos que realizaban ejercicio hasta la fatiga (42), la concentración arterial de iones hidrogeno ([H+]a) fue significativamente mayor al 100% de O2 (49.0 ± 10.0 nmol/l) que en la condición de normoxia (42.0 ± 2.0 nmol/l). Los datos de nuestro laboratorio (19) utilizando una cicloergometría progresiva y el muestreo simultáneo de la vena dorsal de la mano indicaron que el pH máximo no es diferente (p>0.05) en normoxia que con una FlO2 inspirada igual a 0.25, 0.30 y 0.35 (Figura 3). Consecuentemente, a pesar de una mayor producción máxima de potencia en hiperoxia, el pH sanguíneo durante el VO2 máx. es similar al que ser produce en condiciones de normoxia.
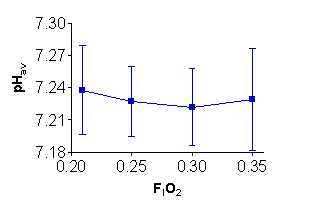
Figura 3. Cambios en la disminución del pH máximo con el incremento en la
FlO2. Adaptado de Astorino (19).
Así ¿sugiere la falta de diferencias en el pH máximo con la hiperoxia, que se mantiene el amortiguamiento de protones con la misma?. Los datos de un estudio reciente en nuestro laboratorio no revelaron diferencias en la concentración máxima de bicarbonato venoso arterializado ([HCO3-]) durante el VO2 máx. en hiperoxia. Similarmente, una investigación reciente (7) reportó [HCO3-] durante VO2 máx. comparables tanto como en las condiciones de normoxia (15.0±1.0 mM) como con un 30% de O2 (16.0±0.0 mM) en remeros entrenados. En hombres entrenados (16), la [HCO3-] fue similar al 91% del VO2 máx., en normoxia y con el 60% de O2, aunque se observaron diferencias significativas entre la hiperoxia y la hipoxia. La hemoglobina sirve también como un potente amortiguador de protones en el músculo esquelético. En respuesta a la reinfusión de sangre, la concentración arterial de hemoglobina ([Hb]) es significativamente mayor en comparación con la concentración pre infusión (1, 14), aunque ningún estudio hasta la fecha, que halla administrado fracciones de gases hiperóxicos, demostró un efecto similar. Por ello, es probable que la hiperoxia aguda no afecte el equilibrio ácido/básico sanguíneo, siendo otros los parámetros responsables de la mejora de la tolerancia al ejercicio.
EFECTOS DE LA HIPEROXIA SOBRE LA PRESIÓN PARCIAL DE OXÍGENO
El incremento de la presión parcial arterial de oxígeno (PaO2) es el resultado común de la hiperoxia aguda. Se han observado incrementos en la PaO2 con hiperoxia en remeros entrenados (7), ciclistas de elite (5, 32), corredores de elite (3), hombres saludables (17, 20) y en músculos de perros (42). En veinte hombres activos que realizaban ejercicio en forma recreacional, la PO2 arterializada tomada en la vena dorsal de la mano fue significativamente mayor con el 25, 30 y 35% de O2 en comparación con la normoxia (19). Estos datos se muestran en la Figura 4a. En contraste, la PaO2 no es aumentada en respuesta a la reinfusión de sangre (1, 14). Por ello, ¿Elimina el aumento en la PO2 mediado por la hiperoxia las limitaciones periféricas al VO2 máx.?. La ley de difusión de Fick afirma que el consumo de oxígeno es igual al producto de una conductancia de difusión generalizada (DO2) y a la diferencia en la presión parcial entre los eritrocitos (PCAPO2) y las mitocondrias musculares (PMTO2). De esta manera, es evidente que existe una relación directa entre la PO2 y el VO2 máx., y cuando se producen alteraciones en la PO2 a través de la hiperoxia se produce un cambio mensurable en el VO2 máx.
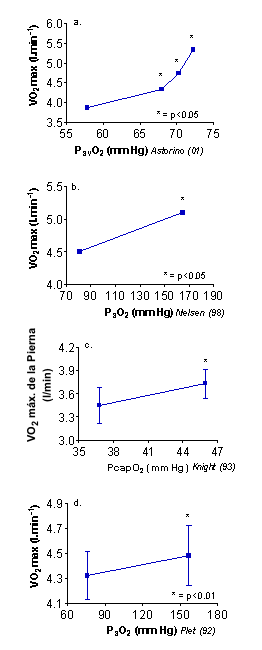
Figuras 4. A-D. Correlaciones entre el VO2 máx. y la PO2
reportadas previamente en la literatura científica. Un convincente trabajo del
laboratorio de Wagner (32) que utilizo extensiones máximas de rodilla a una
pierna demostró un VO2 del cuadriceps significativamente mayor con el
100% de O2 (1.28±0.2 L/min) en comparación con la normoxia (1.08±0.2
L/min), lo cual puede ser explicado por un incremento significativo en la PCAPO2
y una PO2 asociada a la mioglobina (PMBO2). La DO2
fue similar en hiperoxia (34.8±6.7 mmHg) y en normoxia (38.1±8.5 mmHg). Las
Figuras 4b-4d muestran una correlación lineal entre los valores previamente
reportados para el VO2 máx. y el cociente PaO2/ PCAPO2
tanto en normoxia como en hiperoxia. Sobre todo, estos datos sugieren que en
hiperoxia, un mayor gradiente de difusión de O2 desde el capilar
hacia la mitocondria muscular mejora el VO2 máx.
EFECTOS DE LA HIPEROXIA SOBRE LOS FOSFATOS DE ALTA ENERGÍA
Otros factores periféricos involucrados en la regulación de la tolerancia al ejercicio incluyen la fosfocreatina (PCr) y el fosfato inorgánico (Pi). Se cree que la fatiga producida por el ejercicio de alta intensidad y de corta duración se debe a la depleción de PCr y a un incremento en el Pi, que desmejoran el aparato contráctil (44). Concomitantemente con la depleción de PCr hay una marcada perturbación celular como resultado de la acumulación de lactato, la degradación de glucógeno, y la inminente acidosis metabólica, que deriva en la finalización de la actividad. Un primer trabajo (38) demostró una tendencia hacia una mayor depleción de PCr durante el ejercicio submáximo en normobaria versus hiperbaria; sin embargo, no se observaron diferencias durante el trabajo máximo. Una investigación mas reciente (45) que utilizó un modelo de ejercicio que consistía en flexiones plantares submáximas reveló que la [PCr] muscular se mantiene mejor con el 100% de O2 en comparación con la normoxia y la hipoxia. Esto sugiere una menor tasa de degradación de PCr en respuesta a un incrementó de la PO2. A partir de datos de biopsias musculares en cinco hombres activos y saludables (41) se reportó una menor disminución en la [PCr] en respuesta a una cicloergometría submáxima con el 60% de O2 (48 mmol/kg de peso seco) versus normoxia (71 mmol/kg de peso seco). Además, el ∆Pi fue menor en hiperoxia (41.6±11.3 mmol/kg dm) en comparación con la normoxia (62.5±2.4 mmol/kg de peso seco) a la vez que la [ATP] se preservó en la condición de hiperoxia (22.9±0.6 a 21.7±1.2 mmol/kg de peso seco) en comparación con una disminución significativa (p<0.05) en la condición de normoxia (22.9±0.5 a 19.7±0.8 mmol/kg de peso seco). Tomados todos juntos, estos datos sugieren que la hidrólisis de PCr puede ser atenuada con la hiperoxia aguda, lo que resulta en un menor disturbio metabólico y de esta manera en una mejora en la tolerancia al ejercicio.
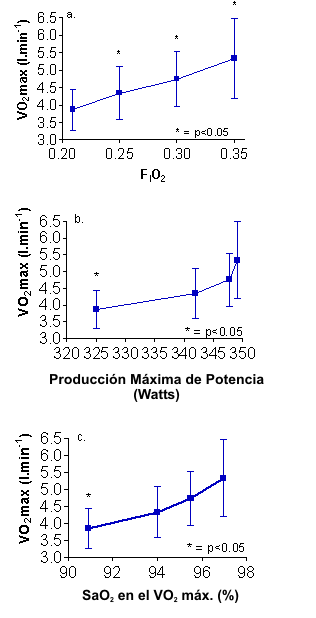
Figuras 5. Cambios en a) el VO2 máx. en respuesta a hiperoxia
gradual; y VO2 máx. versus cambio en b) producción de potencia y c)
SaO2 en respuesta a hiperoxia gradual.
PRECISIÓN DEL LOS DATOS SOBRE EL INTERCAMBIO DE GASES EN HIPEROXIA
Investigaciones previas (46, 47) cuestionaron la suposición de que el nitrógeno es fisiológicamente inerte en hiperoxia, derivando en valores erróneos para el VO2. Para investigar esto, Welch y Pedersen (48) compararon estimaciones del VO2 realizadas con bolsas de Douglas con aquellas realizadas por medio de la ecuación de Fick y con una tercera ecuación (VO2= VI – VE – VCO2), en normoxia y con el 60% de O2. Los resultados mostraron que en comparación con la normoxia, el método de las bolsas de Douglas sobreestimaba el VO2 en hiperoxia, mientras que la introducción de una cámara mezcladora no mostraba diferencias en el VO2 o en la VCO2 entre los métodos. Los autores también recomendaron que se tomaran precauciones específicas, incluyendo 10 min de equilibración de la mezcla de gas hiperoxico en combinación con ejercicio suave, para asegurar que el intercambio neto de nitrógeno sea cero. En nuestro laboratorio, se siguieron estos lineamientos durante una investigación diseñada para investigar la magnitud de incremento en el VO2 máx. en respuesta a 25, 30 y 35% de O2. Nuestros datos (19) están presentados en las Figuras 5a-5c. En comparación con la normoxia, el VO2 máx. fue 12, 22 y 38% mayor con la hiperoxia gradual. Sin embargo, la tasa de cambio en el VO2 durante el ejercicio progresivo con el 30 y 35% de O2 (~ 64 ml O2/Watt/min) fue marcadamente mayor que el valor aceptado de 9-11 ml/O2/Watt/min. Nuestros datos que muestran una sobreestimación del VO2 máx. con el 30 y 35% de O2, son presentados en las Figuras 5b y 5c, indicando un incremento relativamente menor tanto en la producción máxima de potencia y en la SaO2, mostraron un incremento dramático en el VO2 máx. con la hiperoxia. Durante todas las evaluaciones, los analizadores de gases mostraron un valor de desviación igual a cero después de cada prueba, los datos de intercambio de gases fueron consistentemente similares después de la calibración con el 35% de O2 en relación con la calibración realizada con el aire de la habitación. Sin embargo, una fuente de error no identificada derivo en esta sobreestimación del VO2 máx. con el 30 y 35% de O2. Nuestra recomendación es que la calorimetría indirecta por intercambio de gases puede no ser precisa para estimar el VO2 en hiperoxia, y deberían utilizarse el gasto cardiaco y los valores de diferencia arterio-venosa para determinar el consumo de oxígeno en hiperoxia.
Conclusión
La hiperoxia ha sido ampliamente utilizada para examinar los cambios en el rendimiento durante el ejercicio, la capacidad cardiorrespiratoria máxima, y el equilibrio ácido/básico sanguíneo. Es ahora aparente que la hiperoxia mejora la tolerancia al ejercicio parcialmente por medio de la eliminación las limitaciones centrales y periféricas, a través del incremento en la CaO2 y de esta manera en el transporte de O2 y en la PaO2. Sin embargo, aún debe esclarecerse si el VO2 máx. en hiperoxia esta limitado por el sistema nervioso central. Además se ha mostrado que la hiperoxia promueve una mayor provisión de ATP por la vía oxidativa durante el ejercicio máximo, aunque son necesarias investigaciones adicionales para aclarar este aspecto. Además, es posible que la hidrólisis de PCr durante el transito metabólico sea atenuado con la hiperoxia, derivando en un menor disturbio celular al comienzo del ejercicio. Los investigadores deberían tomar especiales precauciones para confirmar la precisión de los datos del intercambio de gases en hiperoxia. Por ultimo, la hiperoxia aguda no altera la ventilación máxima, el pH, [HCO3-], o la VCO2, de manera tal que el incremento en el VO2 máx. y en la tolerancia al ejercicio con la hiperoxia tiene que deberse a otros factores distintos del mejoramiento del equilibrio ácido/básico.
Agradecimientos
Estoy en deuda con mi equipo de investigación en la Universidad de New Mexico (Erik Faria, Stacy Smoyer, Lance Dalleck, Chantal Vella, and Roberto Landwehr) por su aplicación, ayuda y esfuerzo durante la recolección de los datos. También quiero agradecer al Dr. David James y al Dr. Mark Eichinger del Health Sciences Center de la Universidad de New Mexico por su ayuda con la recolección de gases sanguíneos, y las consultas con respecto a los datos. Por último, quisiera agradecer al Dr. Robert Andrew Robergs por servir definitivamente como un modelo a seguir de lo que debería ser un científico, un mentor, un maestro y un académico.
El apoyo para esta investigación fue provisto por una beca del Research, Product, and Travel, así como también por otra beca de la Graduate and Professional Student Association de la Universidad de New Mexico.
Dirección para Correspondencia
Todd A. Astorino, Ph.D., Director, Exercise Science Program, Salisbury University, 1101 Camden Ave, Maggs PAC 224, Salisbury, MD 21801. Teléfono: (410) 677-5342; Fax: (410) 543-6434; correo electrónico: taastorino@salisbury.edu
Referencias
1. Spriet L, Gledhill N, Froese A, Wilkes D (1986). Effect of graded erythrocythemia on cardiovascular and metabolic responses to exercise. J Appl Physiol;61(5):1942-8
2. Thomson J, Stone J, Ginsburg A, Hammett P (1982). O2 transport during exercise following blood reinfusion. J Appl Physiol;53(5):1213-
3. Powers S, Lawler J, Dempsey J, Dodd S, Landry G (1989). Effects of incomplete pulmonary gas exchange on VO2max. J Appl Physiol; 66(6):2491-5
4. Welch H (1982). Hyperoxia and human performance: a brief review. Med Sci Sports Exerc;14:253-62
5. Knight D, Schaffartzik W, Poole D, Hogan M, BeBout D, Wagner P (1993). Effects of hyperoxia on maximal leg O2 supply and utilization in men. J Appl Physiol;75(6):2586-94
6. Peltonen J, Rantamaki J, Niitymaki S, Sweins K, Viitasolo J, Rusko H (1995). Effects of oxygen fraction in inspired air on rowing performance. Med Sci Sports Exerc;27(4):573-
7. Nielsen H, Madsen P, Svendsen L, Roach R, Secher N (1998). The influence of PaO2, pH, and SaO2 on maximal oxygen uptake. Acta Physiol Scand; 164:89-97
8. Fagraeus L, Hesser C, Linnarsson D (1974). Cardiorespiratory responses to graded exercise at increased ambient air pressures. Acta Physiol Scand; 91:259-74
9. Douglas C, Haldane J (1910). The effects of previous forced breathing and oxygen inhalation on the distress caused by muscular work. J Physiol (London); 39: i-iv
10. Hill L, Flack M (1910). The influence of oxygen inhalations on muscular work. J Physiol (London);40:347-72
11. Wilson G, Welch H (1975). Effects of hyperoxic gas mixtures on exercise tolerance in man. Med Sci Sports; 7:48-52
12. Bannister R, Cunningham D (1954). The effects on the respiration and performance during exercise of adding oxygen to the inspired air. J Physiol (London);125:118-37
13. Wilson B, Welch H, Liles J (1980). Effects of hyperoxic gas mixtures on energy metabolism during prolonged work. J Appl Physiol;39(2):267-71
14. Buick F, Gledhill N, Froese AB, Myers E (1980). Effect of induced erythrocythemia on aerobic work capacity. J Appl Physiol;48:636-42
15. Margaria R, Camporesi E, Aghemo P, Sassi G (1972). The effect of O2 breathing on maximal aerobic power. Pfleugers Arch;336:225-35
16. Adams RP, Welch HG (1980). Oxygen uptake, acid-base status, and performance with varied inspired oxygen fractions. J Appl Physiol;49:863-8
17. Plet J, Pedersen P, Jensen F, Hansen J (1992). Increased working capacity with hyperoxia in humans. Eur J Appl Physiol;65:171-
18. Chick T, Stark D, Murata G (1993). Hyperoxic training increases work capacity after maximal training at moderate altitude. Chest;104:1759-62
19. Astorino T (2001). Effect of graded hyperoxia on VO2max and acid-base balance during exercise testing to volitional fatigue. [dissertation]. Albuquerque: University of New Mexico
20. Ekblom B, Huot R, Stein EM, Thorstensson A (1975). Effect of changes in arterial oxygen content on circulation and physical performance. J Appl Physiol 1975; 39:71-5
21. Hill AV, Lupton H (1923). Muscular exercise, lactic acid, and the supply and utilization of oxygen. Q J Med;16:135-71
22. Hill AV, Long C, Lupton H (1924). Muscular exercise, lactic acid, and the supply and utilization of oxygen. Part IV. Methods of studying the respiratory gas exchanges in man, during rapid alterations produced by muscular exercise, and while breathing various gas mixtures. Proc Res Soc London [Biology];97:84-96
23. Taylor H, Buskirk E, Henschel A (1955). Maximal oxygen intake as an objective measure of cardiorespiratory performance. J Appl Physiol;8:73-80
24. Mitchell J, Blomqvist, G (1971). Maximal oxygen uptake. N Engl J Med;284:1018-22
25. Wyndham C, Strydom N, Maritz J, Morrison J, Peter J, Potgieter Z (1959). Maximal oxygen intake and maximum heart rate during strenuous work. J Appl Physiol;14: 927-36
26. Cumming G, Borysyk L (1972). Criteria for maximal oxygen uptake in men over 40 in a population survey. Med Sci Sports;4:18-2
27. Shephard R (1984). Tests of maximal oxygen intake, a critical review. Sports Med;1:99-124
28. Roca J, Hogan M, Story S, BeBout D, Haab P, Gonzalez R et al (1989). Evidence for tissue diffusion limitation of VO2max in normal humans. J Appl Physiol;67(1):291-9
29. Saltin B, Nazar K, Costill D, Stein E, Jansson E, Essen B et al (1976). The nature of the training response; peripheral and central adaptations to one-legged exercise. Acta Physiol Scand; 96:289-305
30. Prieur F, Busso T, Castells J, Bonnefoy R, Benoit H, Geyssant A et al (1998). Validity of oxygen uptake measurements during exercise under moderate hyperoxia. Med Sci Sports Exerc;30(6):958-62
31. Knight D, Poole D, Hogan M, BeBout D, Wagner P (1996). Effect of inspired oxygen concentration on leg lactate release during incremental exercise. J Appl Physiol;81(1):246-51
32. Richardson R, Leigh J, Wagner P, Noyszewski E (1999). Cellular PO2 as a determinant of maximal mitochondrial O2 consumption in trained human skeletal muscle. J Appl Physiol; 87(1): 325-31
33. Hogan MC, Cox RH, Welch HG (1983). Lactate accumulation during incremental exercise with various inspired oxygen fractions. J Appl Physiol;55(4):1134-
34. Kayser B, Narici M, Binzoni T, Grassi B, Cerretelli P (1994). Fatigue and exhaustion in chronic hypobaric hypoxia: influence of exercising muscle mass. J Appl Physiol;76:634-4
35. Hesse B, Kanstrup I, Christensen N, Ingemann-Hansen T, Hansen J, Halkjaer J et al (1981). Reduced norepinephrine response to dynamic exercise in human subjects during O2 breathing. J Appl Physiol;51:176-8
36. Howley E, Cox R, Welch H, Adams R (1983). Effect of hyperoxia on metabolic and catecholamine responses to prolonged exercise. J Appl Physiol;54:59-63
37. Mateika J, Duffin J (1994). The ventilation, lactate, and electromyographic thresholds during incremental exercise tests in normoxia, hypoxia, and hyperoxia. Eur J Appl Physiol;69:110-8
38. Linnarsson D, Karlsson J, Fagraeus L, Saltin B (1974). Muscle metabolites and oxygen deficit with exercise in hypoxia and hyperoxia. J Appl Physiol;36:399-402
39. Graham T, Pedersen P, Saltin B (1987). Muscle and blood ammonia and lactate responses to prolonged exercise with hyperoxia. J Appl Physiol;63(4):1457-6
40. Wolfe B, Graham T, Barclay J (1987). Hyperoxia, mitochondrial redox state, and lactate metabolism of in situ canine muscle. Amer J Physiol;253(22):C263-8
41. Linossier M-T, Dormois D, Arsac L, Denis C, Gay J, Geyssant A et al (2000). Effect of hyperoxia on aerobic and anaerobic performances and muscle metabolism during maximal cycling exercise. Acta Physiol Scand;168:403-11
42. Hogan MC, Welch, HG (1986). Effect of altered arterial oxygen tensions on muscle metabolism in dog skeletal muscle during fatiguing work. Amer J Phys;251(20):C216-22
43. Connett R, Honig C, Gayeski T (1984). Lactate accumulation in fully aerobic, working, dog gracilis muscle. Amer J Phys;246:H120-8
44. MacLaren D, Gibson H, Pary-Billings M (1989). A review of metabolic and physiological factors in fatigue. Exerc Sports Sci Rev; 17:229-36
45. Haseler L, Richardson R, Videen J, Hogan J (1998). Phosphocreatine hydrolysis during submaximal exercise: the effect of FIO2. J Appl Physiol; 85(4):1457-6
46. Cissik J, Johnson R, Rokosch D (1972). Production of gaseous nitrogen in human steady-state conditions. J Appl Physiol;32(2):155-
47. Wilmore J, Costill D (1975). Adequacy of the Haldane transformation in the computation of exercise VO2 in man. J Appl Physiol;35(1):85-9
48. Welch H, Pedersen P (1981). Measurement of metabolic rate during hyperoxia. J Appl Physiol;51:725-3
49. Harms C, McClaran S, Nickele G, Pegelow D, Nelson W, Dempsey J (2000). Effect of exercise-induced arterial O2 desaturation on VO2max in women. Med Sci Sports Exerc;32:1101-8
50. Peltonen J, Tikkanen H, Rusko H (2001). Cardiorespiratory responses to exercise in acute hypoxia, hyperoxia, and normoxia. Eur J Appl Physiol;85:82-8