Efectos de la Ingestión de Glicerol sobre el Balance de los Fluidos y la Hemodinámica Cardiovascular en Varones durante la Hipoxia Hipobárica
Robert A Robergs2, Derek W Marks6, Julia C Orri1, Donna W Lockner3, David S James4, Ann L Gibson5, Erik Faria2, Heidi Weingart7 y Lanza Dalleck8
1University of San Francisco, Department of Exercise and Sport Science, San Francisco, CA, Estados Unidos.
2University of New Mexico, Exercise Physiology Laboratories, Albuquerque, NM, Estados Unidos.
3University of New Mexico, Nutrition Program, Albuquerque, NM, Estados Unidos.
4Four Corners Pulmonary and Critical Care Medicine, Durango, CO, Estados Unidos.
5Barry University, Department of Sport and Exercise Sciences, Miami Shores, FL, Estados Unidos.
6Saint Mary’s College of California, Department of Kinesiology, Moraga, CA, Estados Unidos.
7Santa Fe Community College, Department of Fitness Education, Santa Fe, NM, Estados Unidos.
8University of Wisconsin-Eau Claire, Department of Kinesiology, Eau Claire, WI, Estados Unidos.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2007.
Publicado 11 de junio de 2008
Resumen
Palabras clave: gasto cardíaco, <i>clearance </i> de agua libre, <i>clearance </i> osmolar, hiperhidratación, diuresis
INTRODUCCION
Los desafíos que implican las actividades realizadas en alturas elevadas, tales como escalar y esquiar presentan situaciones tanto de recompensa como de riesgo para las personas no preparadas. La exposición aguda a la altura provoca pérdida del agua corporal total (1) y del volumen plasmático (PV) (2), y se acompaña por incrementos post-ejercicio en la gravedad específica de la orina (3). Se han informado aumentos del doble en el volumen de orina después de la exposición a 5000 metros (4), mientras que durante ascensiones a 4500 metros se han encontrado aumentos de cuatro veces en la producción de orina y disminuciones en el volumen de fluidos, tanto en los miembro inferiores como en los antebrazos (5). Además, se han observado reducciones de 17% en el volumen sistólico (SV) y en el gasto cardíaco (Q) durante la realización de ejercicio a 3100 metros (6) y 5300 metros (7).
La función cardiovascular y el rendimiento dependen de una hidratación adecuada (8). Se ha observado que el volumen plasmático se incrementa luego de la ingestión de glicerol y de agua adicional (9). Se ha demostrado que los aumentos en PV reducen la carga cardiovascular disminuyendo la frecuencia cardíaca media (HR) en la recuperación y en el ejercicio (10, 11). Después de la ingestión, se ha comprobado que el glicerol es absorbido rápidamente por el intestino, causando aumentos en la osmolaridad sérica (12), plasmática (13, 14), y del contenido de agua corporal total (TBW) (15). Se observó que tres horas después de la ingestión de glicerol, el TBW aumentaba 500 ml en comparación con la administración de agua sola, con menor producción de orina en reposo (16). La notable propiedad de hiperhidratación del glicerol se hace posible gracias a su capacidad para ser distribuida dentro de las células del riñón, produciendo una mayor reabsorción de agua. Esto no es posible con una solución de carbohidratos (15).
En la actualidad no se conoce ningún estudio publicado que haya investigado la influencia del glicerol en el equilibrio de los fluidos y en los parámetros cardiovasculares en altura, a pesar de que se ha demostrado que la ingestión de carbohidratos en altura mejora el rendimiento cuando se compara con un placebo (17). Hay evidencia que permite sugerir que un protocolo de investigación basado en la ingesta de glicerol mejoraría la hidratación y atenuaría la disminución del PV que se experimenta en la altura (15). Por consiguiente, el propósito de este estudio consistió en determinar los efectos de la ingestión de glicerol sobre el equilibrio de los fluidos y la hemodinámica cardiovascular durante la hipoxia hipobárica. Planteamos la hipótesis que sostiene que la ingestión de glicerol produciría un clearance de agua libre (CH2O) significativamente menor así como valores más altos de clearance osmolar (COSM) en comparación con la ingestión de carbohidratos. Adicionalmente, planteamos la hipótesis que sostiene que la ingestión de glicerol produciría SV y Q significativamente mayores, así como también una menor HR y un menor cambio del volumen plasmático (ΔPV), en comparación con la solución que solo contenía carbohidratos.
METODOS
Sujetos
Doce sujetos de sexo masculino participaron voluntariamente en este estudio. El grupo de sujetos estaba formado por 6 ciclistas de competición, 2 corredores de ultra maratón, 1 maratonista de élite, y 3 atletas recreacionales. Los sujetos debían haber residido en Albuquerque, NM (5120 pies; 1524 metros de altura) durante los últimos 6 meses. Además, se solicitó una estadía continua de 4 semanas, sin exposición a alturas superiores a los 3000 metros dentro de los 3 días del estudio. En la Tabla 1 se presentan los valores medios de las características correspondientes a los participantes. Los procedimientos experimentales fueron aceptados por el Consejo de Revisión Institucional del Campus Principal (IRB) y el Comité de Revisión de Investigaciones con Seres Humanos (HRRC) en la Escuela Medicina de la Universidad de Nuevo México. Todos los sujetos presentaron el consentimiento informado por escrito.
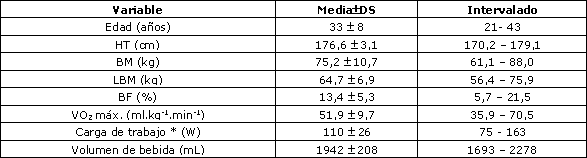
Tabla 1. Datos descriptivos de los sujetos. HT: masa corporal; BM: masa corporal; LBM: masa corporal magra; BF: porcentaje de grasa corporal obtenido mediante hidrodensitometría. *=carga de trabajo para las cuatro pruebas. El volumen de bebida fue el mismo para las cuatro pruebas.
Protocolo
El nivel de hidratación se valoró en reposo y durante el ejercicio en las cuatro condiciones siguientes: Prueba A: ingestión de una bebida que contenía 6% de carbohidratos/electrolitros (CHO) a 1524 m; Prueba B: ingestión de una bebida con 5% de glicerol + CHO (GLY) a 1524 m; Prueba C: ingestión de una bebida con CHO a 3659 m; y Prueba D: ingestión de una bebida con GLY a 3659 m. Las 4 pruebas tuvieron lugar en una Cámara Hiper/Hipobárica (cámara de altura) en la Universidad de Nuevo México. En la Tabla 2 se muestra un resumen del registro de aplicación del protocolo.
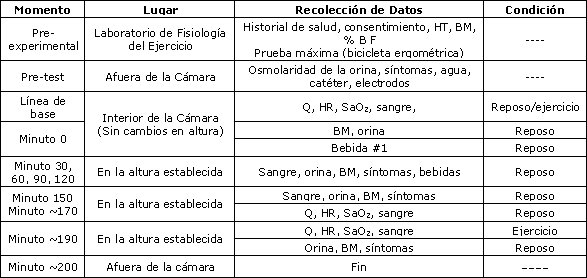
Tabla 2. Registro de aplicación del protocolo. HT=talla, BM=masa corporal, Q=gasto cardíaco, SaO2=Saturación arterial de oxígeno.
Determinaciones Iniciales (línea de base): Pre-test
La masa corporal magra (LBM) se obtuvo a través de pesaje hidrostático con un volumen residual medido. Para la conversión de densidad corporal a % de grasa corporal (BF) se usaron fórmulas específicas para la población (18). Se realizó una prueba de ciclismo para determinar la producción de potencia máxima en una bicicleta ergométrica (Lode BV, Groningen, Holland) utilizando un protocolo en rampa con una carga inicial de 50 W durante 2 min y aumentos de 25 W en cada minuto subsiguiente hasta que el sujeto no pudiera continuar pedaleando con una cadencia de 40 rpm. El umbral ventilatorio (VT) fue definido como la intensidad de ejercicio dónde el aumento de la ventilación minuto (VE) daba como resultado una relación no lineal entre VE/VO2 y VE/VCO2 (19). Sobre la base de la disminución lineal del VO2 máx. de ~9% cada 1000 m, (19), se calculó una disminución de aproximadamente 18% para el VO2 máx. a 3659 m (12000 pies). Suponiendo la misma disminución en el umbral ventilatorio, se estimó que el VT a 3659 m representaría aproximadamente el 82% del VT a 1524 m en las pruebas piloto. Para que los sujetos realizaran la prueba de ciclismo en estado estable a 3659 metros, fue seleccionado el valor correspondiente al 50% del VT de los 1524 m como la carga de trabajo para el componente de ejercicio de cada prueba.
Se exigió que todos los participantes consumieran 40 mL de agua por kilogramo de masa corporal (BM) durante los 2 días anteriores a las pruebas. También, se les solicitó que no ingirieran cafeína u otros diuréticos en las 48 hrs previas a cada prueba para asegurar una hidratación adecuada. También se les solicitó que en las 24 hrs previas a la prueba se abstuvieran de realizar ejercicio intenso y prolongado (>60 min). Además, debían llegar a la cámara de altura luego de un ayuno de 8 hrs, a excepción de la ingestión de agua y de 2 latas de bebida de desayuno comercialmente disponible 2 hrs antes de la prueba (472 ml, 720 cal, 94 g CHO).
Recolección de Datos en la Cámara de Altura
Antes de la recolección de los datos, se determinaron la temperatura y humedad en la cámara Hiper/Hipobárico con un psicrómetro giratorio de bulbo húmedo (Mercury C°, Bacharach Inc., Pittsburgh, PA). La temperatura media en la cámara de altura durante la prueba fue de (22,8±3,2) °C y la humedad relativa fue de (38,4±11,5) %.
En el momento en que los sujetos llegaron a la cámara de altura, proporcionaron una muestra de orina para verificar los niveles iniciales de hidratación adecuados. A continuación se insertó un catéter de teflón en la vena del antecubital, para obtener una muestra inicial de sangre en reposo que fue inmediatamente centrifugada (Marathon 21K/BR, Fischer Scientific, Pittsburgh, PA). La concentración de hemoglobina (Hb) fue determinada por triplicado usando el método de la methemoglobina (Spectronic 401, Milton Roy, Rochester, NY). El hematocrito (Hct) fue determinado por cuadruplicado por microcentrifugación (International Micro-Capillary centrifuge, Model MB, Needham Hts., MA) y se realizó una corrección para atrapamiento plasmático multiplicando el valor por 0,96 (20). La osmolaridad del plasma fue determinada mediante un osmómetro (Advanced Instruments, Model 3D3, Norwood, MA). El DPV fue determinado según el método de Dill y Costill (20). El COSM fue calculado utilizando el método descripto por Freund et al. (16), mientras que el CH2O fue calculado mediante la siguiente fórmula: CH2O=tasa de flujo de orina - COSM. La osmolaridad plasmática y de la orina fueron determinadas a través del método del punto de congelación (21) utilizando un osmómetro (Advanced Instruments, Model 3D3, Norwood).
Medición de los Parámetros Cardiovasculares
El volumen sistólico (mL) fue calculado dividiendo Q por HR. Los valores de HR por minuto fueron calculados contando el número de ondas R en la pantalla de la computadora durante 10 s y multiplicando dicho número por 6. La frecuencia cardíaca también se determinó por el ECG integrado al sistema del software Rayfield (Rayfield Equipment, Waitsfield, VT).
Durante la preparación para la determinación de Q los sujetos fueron conectados mediante una boquilla a una válvula de combinación Hans Rudolph de 3 y 2 vías (Kansas City, MO.). Los sujetos, a quienes se les colocó previamente un broche nasal, respiraron el aire de la habitación y los gases expirados fueron recolectados durante 4 min. El aire inspirado fue determinado mediante un flujómetro de baja resistencia (Rayfield Equipment, Waitsfield, VT) mientras que el aire expirado fue conducido hacia una cámara mezcladora y posteriormente a un analizador de gases (Erich Jaeger, Germany) para la determinación de FEO2 y FECO2.
Una bolsa de 7 litros (Hans Rudolph, Kansas City, MO) fue vaciada y llenada con las siguientes concentraciones de CO2 certificadas médicamente (equilibradas con O2): valor inicial y reposo a 1524 m=10,0%; valor inicial y ejercicio a 1524 m=13,5%; reposo a 3659 m=13,5%; ejercicio a 3659 m=15,0%. Luego de que se alcanzó el estado estable, (aprox. 4 minutos) el sujeto fue desconectado en el final de la espiración cerrando la válvula de 2 vías durante 6-10 segundos de reinhalación de CO2. Un técnico controló que la tasa de frecuencia respiratoria de los sujetos fuera de 30-40 respiraciones/min. Luego de que se estableció un equilibrio entre la concentración de CO2 de la bolsa, los alveolos, y los capilares pulmonares, se abrió la válvula de 2 vías y el sujeto respiró el aire de la habitación nuevamente. Después de que el VCO2 y la tasa de intercambio respiratoria retornaron a los valores pre-reinhalación (aprox. 9 minutos), la maniobra fue repetida para asegurar la confiabilidad de los datos. En el caso en que no se alcanzara un plateau en la PCO2 dentro de los 6-10 s, se realizaba una tercera maniobra de reinhalación. Continuamente se llevó un registro de la frecuencia cardíaca (Hellige Servomed, Germany), y el porcentaje de saturación de oxígeno de la Hb (Poet Criticare Systems, Inc, Ohio) a través de la integración con el sistema de software Rayfield (Rayfield Equipment, Waitsfield, VT).
El gasto cardíaco fue calculado aplicando la ecuación cardiovascular de Fick (22):
Q (L.min-1 ) = VCO2 (mL.min-1) / [(CvCO2 - CaCO2) (mL CO2. L sangre-1)], dónde CvCO2 = contenido de CO2 de la sangre venosa mixta y CaCO2 = contenido de CO2 de la sangre arterial. El CaCO2 fue calculado a partir de una serie de ecuaciones (22,23) después de obtener los valores promedio máximos de CO2 al final de la espiración a partir de 5 - 10 respiraciones normales. El % CO2 al final de la espiración fue calculado por una ecuación de regresión a partir de valores conocidos de CO2. El CvCO2 fue determinado luego de la identificar un plateau en CO2 durante el procedimiento de reinhalación y de realizar los cálculos posteriores de la PCO2 de la sangre venosa mixta (PvCO2) (22, 23). Cuando el SaO2 fue <95% se realizó un cálculo de corrección para la diferencia entre el contenido de CO2 venoso mixto y el CO2 arterial (CvCO2 - CaCO2) (23).
Inmediatamente después de la última maniobra de reinhalación, los sujetos comenzaron a pedalear con una carga de trabajo equivalente al 50% de su VT a 1524 m. La misma carga de trabajo absoluta se utilizó en ambas condiciones de altitud. El procedimiento de reinhalación de CO2 se realizó por duplicado de la misma manera que se describió anteriormente. La serie de ejercicio fue suficiente para permitir la realización de 2 maniobras de reinhalación de CO2 precedidas por la estabilización del VCO2 (~15-30 min). Se tomó una muestra de sangre al inicio del ejercicio entre las maniobras de reinhalación.
Después de la determinación de Q, se quitó la boquilla, los sujetos descendieron de la bicicleta y se determinó el volumen de orina y la BM de los sujetos desnudos. Se obtuvieron el volumen de orina, plasma y osmolaridad de orina para calcular COSM y CH2O. Luego de realizar las mediciones anteriores, se realizó un cambio de presión barométrica equivalente a no mas de 300 m/min (~ 7 min) para alcanzar la presión barométrica asignada para la prueba a 3659 m. La presión barométrica fue confirmada por un barómetro portátil (Fisher Scientific, #02-406). Con el objetivo de que el estudio fuera realizado en la condición de ciego durante la prueba a 1524 m, el operador de la cámara levantó y bajó la presión para simular un cambio a 2000 m (~ 7 min) antes de retornar a los 1524 m.
Ingestión de Glicerol
Durante el cambio de presión barométrico, los sujetos consumieron la primera bebida (tiempo 0). Durante la prueba GLY consumieron la bebida ProHydrator (InterNutria Inc., Framingham, MA) como una solución al 5% en una mezcla en polvo de CHO/electrolitos diluida al 50% (Gatorade Co, Chicago, IL) más agua. Cada sujeto consumió 30 mL/kg LBM de la solución en 5 volúmenes iguales de una botella a los 0, 30, 60, 90, y 120 minutos. La bebida de CHO consistió solamente en 30 mL/kg de LBM de la bebida de carbohidratos/electrolitos. Cada 30 minutos se tomaron muestras de sangre, y se registraron el volumen de orina, y la BM del sujeto desnudo, y a continuación se ingería la bebida. Luego de que se repitieron todas las mediciones iniciales a los 150 min, la presión barométrica fue restituida al valor de 630 mm Hg.
Análisis Estadísticos
El tamaño de la muestra fue calculado para todas las variables dependientes (DV) a partir de estudios previos que justificaron el uso de 12 sujetos. La potencia estimada fue 0,8 (Statistica v6.0). Se realizaron 3 ANOVA para mediciones repetidas por separado para las variables cardiovasculares y renales (SPSS v 8.0 y Statistica v6.0). Para todas las variables, los tres factores repetidos fueron altura (1524 m, 3659 m) clase de bebida (CHO, GLY), y condición (tiempo). Las cuatro variables cardiovasculares dependientes (DV) fueron Q, HR, DPV y SV a los minutos 0 y 150. Los datos de ejercicio no fueron incluidos debido a que los sujetos presentaron tiempos de ejercicio variables. Para las variables renales, se establecieron 5 niveles del factor condición: 30, 60, 90, 120, y 150 min en reposo. Las 2 variables renales dependientes (DV) fueron COSM (osmolaridad plasmática) y CH2O. Para todas las DV se realizaron análisis de la varianza para establecer si existieron diferencias significativas en el nivel de hidratación inicial entre las pruebas. La significancia estadística fue fijada en p<0,05. Los datos se presentan como media±DS.
RESULTADOS
Todos los sujetos cumplieron con todos los aspectos del protocolo. No se encontraron diferencias significativas entre los sujetos en los valores iniciales de osmolaridad de la orina, osmolaridad plasmática, Hct, Hb, Q, HR, y SV, lo que revela niveles de hidratación intra-sujeto consistentes para las 4 condiciones experimentales.
Variables Cardiovasculares
No se encontraron efectos principales o interacciones significativas en Q, HR, DPV, y SV (p> 0,05) (Tablas 3-6). Se observó un efecto principal significativo de la altura sobre HR (p <0,05).

Tabla 3.Valores medios de HR (lat./min) para los grupos CHO y GLY durante las condiciones de reposo y ejercicio a 1524 m y 3659 m.

Tabla 4. Valores medios de Q (L/min) para los grupos CHO y GLY durante las condiciones de reposo y ejercicio a 1524 m y 3659 m.

Tabla 5. Valores medios de DPV (%) para los grupos CHO y GLY durante las condiciones de reposo y ejercicio a 1524 m y 3659 m.

Tabla 6. Valores medios de SV (ml) para los grupos CHO y GLY durante las condiciones de reposo y ejercicio a 1524 m y 3659 m.
Variables renales
Los resultados de CH2O y de COSM fueron agruparon según la altura. Se encontró una interacción significativa entre tiempo y bebida para CH2O (p<0,05). El CH2O fue significativamente menor en la condición GLY que en el grupo CHO a los 90, 120, y 150 min (p<0,05) (Figura 1). También se encontró una interacción significativa entre tiempo y bebida para COSM. El COSM fue significativamente mayor en la condición GLY que en la condición CHO en los minutos 60, 90, 120, y 150 (p <0,05) (Figura 2).
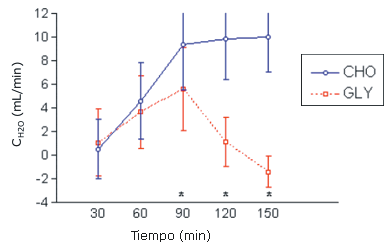
Figura 1. Resultados de los valores medios de CH2O en los grupos CHO y GLY en reposo obtenidos a partir de las mediciones realizadas en 12 sujetos. *=presenta diferencias significativas con respecto a CHO. CH2O=clearance de agua libre; CHO: bebida con 6% de carbohidratos/electrolitos; GLY=bebida que contiene glicerol al 5%.
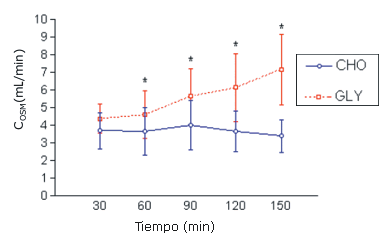
Figura 2. Resultados de los valores medios de COSM en los grupos CHO y GLY en reposo obtenidos a partir de las mediciones realizadas en 12 sujetos. *=presenta diferencias significativas con respecto a CHO. COSM= clearance osmolar; CHO: bebida con 6 % de carbohidrato/electrolito; GLY: bebida que contiene Glicerol al 5%.
La ingestión de glicerol provocó un mayor nivel de retención de fluidos de forma consistente (volumen total de bebida ingerida - volumen total de orina) que el observado en el grupo que ingirió la bebida de carbohidratos/electrolitos. Específicamente, se encontraron diferencias significativas entre las pruebas A (1524 m + CHO) y B (1524 m + GLY), C (CHO + 3659 m) y D (GLY + 3659 m), A y D, así como entre B y C (p<0,05) (Figura 3).
Se encontraron diferencias significativas en la variación de la masa corporal (DBM) entre las pruebas A y D, B y C, así como también entre C y D (p <0,05) (Figura 4).
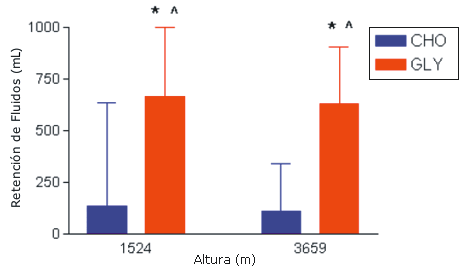
Figura 3. Resultados de la retención de fluidos media obtenida a los 150 minutos a partir de las determinaciones realizadas en los 12 sujetos en los grupos CHO y GLY. *=presenta diferencias significativas con respecto al valor obtenido en 1524 m + CHO; ^=presenta diferencias significativas con respecto al valor obtenido en 3659 m + CHO. Retención de fluidos=volumen total de líquido ingerido - volumen total de orina.
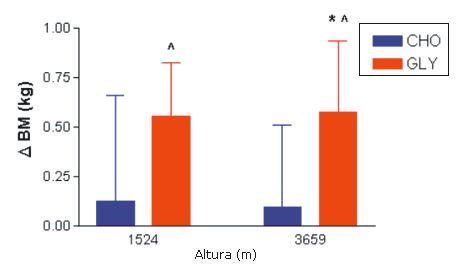
Figura 4.Resultados de la variación de masa corporal media obtenida a los 150 minutos a partir de las determinaciones realizadas en los 12 sujetos en los grupos CHO y GLY. *=presenta diferencias significativas con el valor obtenido en 1524 m + CHO; ^=presenta diferencias significativas con el valor obtenido en 3659 m + CHO. DBM=variación de la masa corporal expresada en kg.
DISCUSION
Para nuestro conocimiento, éste es el primer estudio realizado para evaluar la efectividad de la ingestión de glicerol para compensar la deshidratación que es experimentada frente a la exposición aguda a altura. La ingestión de glicerol produce de manera consistente una mayor retención de fluidos y un aumento correspondiente en la masa corporal en comparación con la ingestión de CHO. Durante la prueba a 3659 m con la ingestión de CHO, 7 de los 12 sujetos presentaron una menor BM a las 2,5 hrs. Los mayores valores de variación de peso corporal y de retención de fluidos establecidos luego de la ingestión de GLY sugieren que se produjo un efecto de hiperhidratación, en comparación con los valores obtenidos por la ingestión únicamente de CHO.
No se encontró ningún efecto significativo del GLY en DPV. Riedesel et al. (21) tampoco encontraron cambios significativos en PV (por Hct y Hb) a pesar de observar una hiperhidratación con 430 ml de glicerol luego de 3 hrs (aumento en la osmolaridad plasmática y disminución en el volumen de orina). Tanto Gleeson et al. (13) como Murray et al. (14) demostraron un mejor mantenimiento del PV durante el ejercicio luego de la ingestión de glicerol, en comparación con la ingestión de agua o de CHO a pesar del poco volumen total de líquido ingerido en cada estudio (Gleeson=400 ml; Murray=647 ml). En el presente estudio, nuestros participantes consumieron un volumen de bebida promedio de 1942 ml (1693ml a 2278 ml) que se asemeja a la cantidad administrada en el estudio de Lyons et al. (24) (2045 ml), en el cual observaron un efecto de hiperhidratación. El glicerol se distribuye uniformemente en todos los compartimentos líquidos del cuerpo (15). El plasma es el menor componente del volumen de fluido extracelular, alcanzando sólo el 7,6 % del TBW (25). De esta manera, si en nuestro estudio, el exceso de fluido retenido durante las pruebas donde se administró GLY fuera distribuido equitativamente en todo el TBW, cualquier aumento en PV parecería pequeño en relación con los compartimientos más grandes del TBW (16) y así no contribuiría con cambios cardiovasculares significativos (26).
Las diferencias significativas en COSM entre GLY y CHO sugieren que se produce un gradiente osmótico con posterior reabsorción de agua. Freund (16) informó una tasa de retención de 60% para el glicerol y el agua luego de 3 horas de la ingestión de glicerol, acompañada por una disminución significativa en CH2O. El factor de definición en el proceso de la hiperhidratación es la acción osmótica del glicerol (21) y la reabsorción pasiva del glicerol en los tubulos proximales y distales del riñón. De hecho, la tasa de reabsorción es casi 100% cuando la concentración plasmática es <10 mg/dL (16). Este mecanismo no se manifiesta de la misma manera cuando se trata de soluciones de carbohidratos/electrolitos o agua (15) y podría beneficiar potencialmente al volumen de la sangre y al PV (16), a través del aumento en los volúmenes de los fluidos intersticiales e intracelulares (24,27). Scheett et al. (26) informaron una recuperación del PV significativamente mayor con la ingestión de glicerol durante la rehidratación, en comparación con la ingestión exclusivamente de agua. Ellos sugirieron que el glicerol podría aumentar el PV, mientras que el agua podría ser restringida al espacio extravascular.
Es importante señalar que tanto el entrenamiento de resistencia como la aclimatación al calor pueden causar a menudo una expansión del PV (25). En el presente estudio, la edad promedio de los sujetos era de 32 años y el VO2 máx. de 51,85 mL.kg-1.min-1, lo que representa un nivel elevado de aptitud cardiorespiratoria. Además, la mayoría de los datos para este estudio fueron recolectados durante los meses de verano donde la temperatura máxima promedio era superior a los 90° F. Es posible que el PV de nuestros sujetos haya aumentado antes y durante el estudio, limitando así cualquier expansión adicional del PV a través de la hiperhidratación inducida por el glicerol. El hecho de que no observamos cambios significativos en el SV también podría atribuirse a que gracias al entrenamiento se logró alcanzar un nivel óptimo de expansión del PV. En hombres desentrenados fueron observados incrementos del 11% en el SV del ejercicio luego de una expansión del PV de 400 mL y de la sangre (14%), utilizando una solución de dextran (28). Cuando el protocolo se repitió en el grupo que realizó entrenamiento, la expansión del volumen sanguíneo de 400 mL, produjo incrementos mínimos en el SV. Además, el aumento del SV en el grupo desentrenado no aumentó por dosis adicionales de dextran (28).
Las diferencias en los valores de HR luego de la ingestión de glicerol que nosotros observamos y que no fueron estadísticamente significativas coincidieron con los resultados de estudios anteriores, aunque Montner et al. (10,29) y Anderson et al. (11) observaron valores de HR significativamente menores durante el ejercicio luego de la ingestión del glicerol. Freund et al. (16) observaron aumentos del TBW de aproximadamente 500 mL luego de la ingestión de glicerol sin la correspondiente reducción en la HR durante el reposo. Lyons et al. (24) informaron una disminución que no fue estadísticamente significativa en HR a pesar de observar volúmenes de orina reducidos cuando el glicerol se consumió 2,5 hrs antes de realizar ejercicios en calor. Murray et al. (14) observaron aumentos de PV durante el ejercicio luego de la ingestión de glicerol, también con una respuesta atenuada de HR que no fue estadísticamente significativa. En un estudio realizado por Latzka et al. (30) en el cual los sujetos consumieron glicerol + agua (volumen total=29,1 mL/kg LBM) en un período de 30 min, encontraron que los valores de la HR del ejercicio eran similares a los encontrados luego de la ingestión de agua sola.
Nosotros tampoco encontramos diferencias estadísticamente significativas en el gasto cardíaco. Aunque el método de reinhalación de CO2 que nosotros usamos (22) está altamente correlacionado con el método directo de Fick (r=0,94) en reposo en poblaciones normales (31), durante el ejercicio incremental la variabilidad aumenta, lo cual da como resultado una sobreestimación del gasto cardíaco (32). Por consiguiente, se sugiere que el método de Collier (18) sea utilizado en reposo y durante la realización de ejercicio submáximo (32). También es posible que este método carezca de la sensibilidad necesaria para detectar cambios pequeños en Q, o que la bebida de glicerol al 5% esté muy diluida para producir cambios significativos sobre HR y Q.
Contraindicaciones del Glicerol y Seguridad
A pesar de que la ingestión glicerol y la exposición aguda a la altura aumentan las probabilidades de sufrir dolores de cabeza (33), nosotros probamos que la solución al 5% era segura en nuestro grupo de atletas masculinos saludables. La ingestión de glicerol no produjo síntomas de dolor de cabeza o náuseas en nuestros 3 participantes amateurs o en los 9 atletas de competición cuyas edades estaban comprendidas entre los 21 y 43 años. No se encontraron estudios referentes a la ingestión de glicerol en individuos saludables de mayor edad. Por lo tanto, los atletas de edad avanzada y aquellos que no son atletas deberían consultar previamente a su médico acerca de la ingestión de glicerol. Se ha observado que la hiperhidratación con glicerol ha sido bien tolerada en mujeres que realizan ejercicios tanto en condiciones ambientales de elevada temperatura (42°C) (24), como en condiciones de temperatura moderada (24°C) (10).
Los niveles incrementados de hiperhidratación y glucosa que se producen luego de la ingestión de glicerol están contraindicados en los individuos que poseen insuficiencia renal, dolores de cabeza migrañosos, hipertensión, desórdenes hepáticos, así como también en mujeres embarazadas (15). Además, se ha comprobado que la ingestión de glicerol aumenta el glicerol sérico en los diabéticos (34), y por consiguiente, no se recomienda para los las personas que sufren diabetes tipo 1 o 2. La ingestión de glicerol tampoco es recomendable para los pacientes con diálisis peritoneal, debido a la relación que hay entre ECFv, inflamación, y mortalidad (35).
Conclusiones
El resultado más destacable e importante de este estudio fue que se encontró un CH2O significativamente menor durante la ingestión de glicerol en comparación con el CH2O determinado luego de la ingestión de CHO. Pensamos que la anti-diuresis inducida por el glicerol produjo el aumento en la masa corporal y la retención de líquidos observada a los 150 min. Los resultados confirman que el GLY es superior a los CHO en la reducción del CH2O durante la hipoxia hipobárica en atletas masculinos saludables entrenados y amateurs.
Referencias
1. Krzywicki, HJ, Consolazio, CF, Johnson, HL, Nielsen, J., WC and Barnhart, RA (1971). Water metabolism in humans during acute high-altitude exposure (4,300 m). J Appl Physiol 30:806-809
2. Sawka, MN, Convertino, VA, Eichner, ER, Schnieder, SM and Young, AJ (2000). Blood volume: importance and adaptations to exercise training, environmental stresses, and trauma/sickness. Med Sci Sports Exerc 32:332-348
3. Rozier, LH (1998). The hydration status of backpackers at high altitude. Int J Circumpolar Health 57:742-745
4. Zaccaria, M, Rocco, S, Noventa, D, Varnier, M and Opocher, G (1998). Sodium regulating hormones at high altitude: basal and post-exercise levels. J Clin Endocrinol Metab 83:570-574
5. Schirlo, C, Bub, A, Reize, C, Buhrer, A, Kohl, J, Koller and EA (1997). Volume changes in the forearm and lower limbs during 2 h of acute hypobaric hypoxia in nonacclimatized subjects. Eur J Appl Physiol 75:124-131
6. Alexander, JK, Hartley, LH, Modelski and M, Grover, RF (1967). Reduction of stroke volume during exercise in man following ascent to 3,100 m altitude. J Appl Physiol 23:849-858
7. von Duvillard, SP, Braun, WA, Markofski, M, Beneke, R and Leithauser, R (2004). Fluids and hydration in prolonged endurance performance. Nutrition 20:651-656
8. Jimenez, C, Melin, B, Koulmann, N, Allevard, AM, Launay, JC and Savourey, G (1999). Plasma volume changes during and after acute variations of body hydration level in humans. Eur J Appl Physiol 80:1-8
9. Montner, P, Stark, DM, Riedesel, ML, Murata, G, Robergs, R, Timms, M, Chick and TW (1996). Pre-exercise glycerol hydration improves cycling endurance time. Int J Sports Med 17: 27-33
10. Anderson, MJ, Cotter, JD, Garnham, AP, Casley, DJ and Febbraio, MA (2001). Effect of glycerol-induced hyperhydration on thermoregulation and metabolism during exercise in heat. Int J Sport Nutr Exerc Metab 11:315-33
11. Sommer, S, Nau, R, Wieland, E and Prange, HW (1993). Pharmacokinetics of glycerol administered orally in healthy volunteers. Arzneim-Forsch/Drug Res 43:744-747
12. Gleeson, M, Maughan, RJ and Greenhaff, PL (1986). Comparison of the effects of pre-exercise feeding of glucose, glycerol and placebo on endurance and fuel homeostasis in man. Eur J Appl Physiol 55:645-653
13. Murray, R, Eddy, DE, Paul, GL, Seifert, JG and Halaby, GA (1991). Physiological responses to glycerol ingestion during exercise. J Appl Physiol 71:144-149
14. Robergs, RA and Griffin, SE (1998). Glycerol: Biochemistry, pharmacokinetics, and clinical and practical applications. Sports Med 26:145-167
15. Freund, BJ, Montain, SJ, Young, AJ, Sawka, MN, DeLuca, JP and Pandolf, KB (1995). Glycerol hyperhydration: Hormonal, renal, and vascular responses. J Appl Physiol 79:2069-2077
16. Fulco, CS, Kambis, KW, Friedlander, AL, Rock, PB, Muza, SR and Cymerman, A (2005). Carbohydrate supplementation improves time-trial cycle performance during energy deficit at 4,300-m altitude. J Appl Physiol 99:867-876
17. Heyward, VH (1998). Advanced Fitness Assessment & Exercise Prescription. 3rd ed. Champaign, IL: Human Kinetics
18. Robergs, RA and Roberts, SO (1997). Exercise Physiology: Exercise, Performance, and Clinical Applications. St. Louis, MO: Mosby-Year Book Inc
19. Dill, DB and Costill, DL (1974). Calculation of percentage changes in volumes of blood, plasma, and red cells in dehydraton. J Appl Physiol 37:247-248
20. Riedesel, ML, Allen, DY, Peake, GT and Al-Qattan, K (1987). Hyperhydration with glycerol solutions. J Appl Physiol 63:2262-2268
21. Bassett, DR and Fitton, TR (1995). Gas mixing apparatus for determining cardiac output by CO2 rebreathing. Med Sci Sports Exerc 27:1698-1702
22. Jones, N L (1988). Clinical Exercise Testing. 3rd ed. Philadelphia, PA: W.B. Saunders Co
23. Lyons, TP, Riedesel, ML, Meuli, LE and Chick, TW (1990). Effects of glycerol-induced hyperhydration prior to exercise in the heat on sweating and core temperature. Med Sci Sports Exerc 22:477-483
24. Sawka, MN and Coyle, EF (1999). Influence of body water and blood volume on thermoregulation and exercise performance in the heat. In: Exercise and sport science reviews, JO Holloszy, Editor. Philadelphia: Lippincott Williams & Williams, p. 167-218
25. Scheett, TP, Webster, MJ and Wagoner KD (2001). Effectiveness of glycerol as a rehydrating agent. Int J Sport Nutr Exerc Metab 11:63-71
26. Seifert, JG, Luetkemejer, MJ, Schrage, W and Coles, M (1995). The effects of glycerol ingestion on fluid compartment volumes, physiological function, and cycling performance. Med Sci Sports Exerc 27:S19
27. Hopper, MK, Coggan, AR and Coyle, EF (1988). Exercise stroke volume relative to plasma-volume expansion. J Appl Physiol 64: 404-408
28. Montner, P, Zou, Y, Robergs, RA, Murata, G, Stark, D, Quinn, C, Chick, Wood, S, Lium, D and Greene, ER (1999). Glycerol hyperhydration alters cardiovascular and renal function. J Exerc Physiol Online 2:1-10
29. Latzka, WA, Sawka, MN, Montain, SJ, Skrinar, GS, Fielding, RA, Matott, RP and Pandolf, KB (1998). Hyperhydration: tolerance and cardiovascular effects during uncompensable exercise-heat stress. J Appl Physiol 84:1858-1964
30. Muiesan, G, Sorbini, CA, Solinas, E, Grassi, V, Casucci, G and Petz, E (1968). Comparison of CO2-rebreathing and direct fick methods for determining cardiac input. J Appl Physiol 24:424-429
31. Vanhees, L, Defoor, J, Schepers, D, Brusselle, S, Reybrouk, T and Fagard, R (2000). Comparison of cardiac output measured by two automated methods of CO2 rebreathing. Med Sci Sports Exerc 32:1028-1034
32. Klocke, DL, Decker, WW and Stepanek, J (1998). Altitude-related illneses. Mayo Clin Proc 73:988-993
33. Pelkonen, R, Nikkila, EA and Kekki, M (1967). Metabolism of glycerol in diabetes mellitus. Diabetologia 3:1-8
34. Avila-Diaz, M, Ventura, MD, Valle, D, Vicente-Martinez, M, Garcia-Gonzalez, Z, Cisneros, A, Furlong, MD, Gomez, AM, Prado-Uribe, MD, Amato, D and Paniagua, R (2006). Inflammation and extracellular volume expansion are related to sodium and water removal in patients on peritoneal dialysis. Perit Dial Int