Efectos de la Suplementación con Creatina en Suero sobre los Niveles Musculares de Creatina y Fosfágenos
Richard B Kreider1, Darryn S Willoughby2, Mike Greenwood1, Mark A Tarnopolsky3, G. Parise3 y E. Payne3
1Exercise & Sport Nutrition Laboratory, Center for Exercise, Nutrition and Preventive Health Research Department of Health, Human Performance & Recreation, Baylor University.
2Exercise Biochemistry and Molecular Biology Lab, Department of Kinesiology, Texas Christian University.
3Departments of Medical Sciences, Kinesiology, and Medicine (Division of Neurology), McMaster University, Canada.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2003.
Publicado 4 de agosto de 2004
Resumen
Palabras clave: retención de creatina, creatina líquida, monohidrato de creatina
INTRODUCCION
Numerosos estudios han indicado que la suplementación oral con monohidrato de creatina (e.g., 20 gramos/día durante 5 días) incrementa el contenido muscular de creatina y la PC de manera característica en un 15-40% (1-9). El incremento en la creatina y la PC muscular le permite al individuo incrementar la producción de trabajo durante el ejercicio de alta intensidad derivando en mayores ganancias de fuerza y de masa muscular durante el entrenamiento (10-23). El valor del potencial ergogénico de la suplementación con creatina está supeditado a la efectividad del protocolo de suplementación para incrementar las reservas musculares de creatina y PC (5, 9, 24-27). Las dos vías más aceptadas para determinar el efecto de la suplementación con creatina sobre las concentraciones musculares de creatina y PC es la obtención de biopsias o la realización de mediciones por medio de espectroscopia de resonancia magnética (ERM) antes y después de la suplementación (2-6, 28). La medición diaria de la excreción urinaria de creatina durante la carga con creatina ha sido también utilizada para estimar la retención de creatina corporal total (5, 29).
La marca Muscle Marketing USA (Valencia, CA) ha afirmado que la Creatina en Suero ATP AvantageTM (CS) es una forma estable de creatina líquida que provee el equivalente a 2.5 gramos de monohidrato de creatina por porción (5 ml). También afirmaron que la CS es transportada más eficientemente al músculo que el monohidrato de creatina debido a que es supuestamente suministrada en un “Complejo Creatina Fosfato” que está diseñado para ser absorbido en la mucosa y con ello evitar los procesos digestivos, que según sostienen, reduce marcadamente la biodisponibilidad de la creatina al músculo.
Como resultado, la compañía afirma que la CS constituye una manera más eficiente de incrementar las reservas musculares de creatina en comparación con el monohidrato de creatina. Estas afirmaciones han sido criticadas porque:
- Cuando se lo coloca en solución y dependiendo de la temperatura y acidez del fluido, el monohidrato de creatina es típicamente convertido a creatinina después de varias horas a varios días;
- Estudios previos indican que el monohidrato de creatina ingerido oralmente no se degrada significativamente en creatinina durante el proceso digestivo normal;
- No hay datos publicados disponibles que respalden la supuesta eficacia de la suplementación con CS sobre los niveles musculares de creatina;
- Los intentos de verificar el supuesto contenido de creatina en la CS han mostrado cantidades insignificantes de creatina y altos niveles de creatinina sugiriendo inestabilidad (30); y
- Estudios previos no han mostrado efectos de la suplementación con CS sobre los niveles sanguíneos de creatina luego de la ingestión oral (31).
Independientemente del tema de la absorción y de la conversión de creatina en creatinina, la evaluación definitiva de la eficacia de la CS sobre las reservas musculares de creatina constituye la realización de mediciones pre y post suplementación de los niveles musculares de creatina y PC. Con respecto a esto, si la CS constituye una forma efectiva de creatina, la CS debería incrementar significativamente la CrL, la PC, y/o la CrT en comparación al placebo. Adicionalmente, si la CS es más eficientemente absorbida que el MC, una dosis baja de CS debería producir incrementos similares en las reservas musculares de creatina que altas dosis de MC. Por otro lado, si la CS no es una forma efectiva de creatina, no tendrá efectos sobre las reservas musculares de creatina tanto con dosis altas como con dosis bajas. El propósito de este estudio fue determinar si la suplementación con CS afecta el contenido muscular de ATP, CrL, PC o CrT en comparación con la suplementación con monohidrato de creatina.
METODOS
Diseño del Estudio
Este estudio fue realizado como un ensayo clínico doble ciego con control con placebo para valorar los efectos de la ingesta de dosis bajas y altas de CS sobre el contenido muscular de ATP, CrL, PC o CrT en comparación con el MC como control de referencia. La variable independiente fue la suplementación con CS. El control estándar fue el MC. La variables dependientes principales incluyeron las concentraciones musculares de ATP, CrL, PC o CrT.
Sujetos
Cuarenta (40) sujetos varones de entre 18 y 30 años de edad participaron en este estudio. Los sujetos reportaron no tener historia de suplementación con creatina y no eran vegetarianos. Se les informó a los sujetos sobre los requerimientos del estudio y firmaron informes de consentimiento en cumplimiento con las Directivas sobre Sujetos Humanos de la Texas Christian University (TCU) y del Colegio Americano de Medicina del Deporte. A modo de descripción los sujetos tenían 21±2.5 años, 182±6 cm de talla, y pesaban 83±13 kg.
Ingreso y Sesión de Familiarización
Los sujetos que expresaron interés en participar en este estudio fueron entrevistados para determinar si estaban calificados para participar en el estudio. Los sujetos que creímos cumplían con los criterios de elegibilidad fueron invitados a asistir a una sesión de ingreso/familiarización. Durante esta sesión, los sujetos firmaron un Informe de Consentimiento y completaron planillas de historia personal y médico. Los sujetos que cumplían con los criterios de elegibilidad fueron entonces familiarizados con los procedimientos experimentales a través de una explicación verbal y escrita sobre el diseño del estudio.
Procedimiento de Suplementación y Realización del Ciego
Un farmacéutico con 23 años de experiencia en la investigación y en la fabricación de productos nutricionales compró 48 botellas de Creatina en Suero ATP AdvantageTM de MMUSA a través de su sitio web (www.creatine.com). Luego de recibir las muestras de CS (ATP AdvantageTM Cratine Serum – Lot #10517) el farmacéutico preparó un placebo que igualaba a la CS en color y sabor. Se vació el contenido de las 24 botellas de CS y se reemplazó el contenido de estas botellas con una cantidad igual de placebo. Las 24 botellas de placebo y las 24 botellas de CS fueron divididas en cuatro grupos (dos grupos de 8 y dos grupos de 16) para su rotulación y codificación. El farmacéutico preparó sobres sellados con los códigos de los cuatro grupos. Luego envió las botellas a la TCU para la realización del doble ciego antes del inicio del estudio.
Pre SuplementaciónEvaluaciones Iniciales
Los sujetos registraron todas sus ingestas de alimentos en una planilla de registros dietarios durante cuatro días (4-d) antes la evaluación pre suplementación y durante 3 días durante el protocolo de suplementación, con el propósito de confirmar que estaban manteniendo su dieta normal durante el estudio y que no eran vegetarianos. Para las evaluaciones iniciales los sujetos se presentaron en el Laboratorio de Bioquímica del Ejercicio en la TCU o en el Laboratorio de Nutrición del Ejercicio y el Deporte en la Universidad de Baylor. Una vez que los sujetos se reportaron en el laboratorio, fueron pesados y se los preparó para la realización de los procedimientos de biopsia muscular. Las biopsias percutáneas musculares (50-70 mg) se extrajeron en el punto medio entre la rótula y el trocánter mayor del fémur de la porción media del músculo vasto lateral derecho utilizando procedimientos estándar a una profundidad de entre 1 y 2 cm (14). Luego de la biopsia la aguja era retirada, y las muestras de tejido muscular eran colocadas en un recipiente para especímenes, congeladas en nitrógeno líquido, y guardadas a -80 ºC para los subsiguientes análisis bioquímicos siguiendo procedimientos estándar (14, 32, 33). Según lo sugerido por Soderland y Hultman (34), hubo aproximadamente un minuto de demora entre la excisión de la biopsia y el congelamiento de las muestras de tejido.
Protocolo de Suplementación
Luego de la extracción de las muestras de biopsias musculares, los sujetos fueron agrupados en base a la masa corporal y la edad y distribuidos aleatoriamente en uno de cinco grupos. Después de esto los sujetos recibieron los suplementos que contenían ya sea CS, placebo con el mismo sabor y color que la CS colocada en las botellas de CS o monohidrato de creatina en polvo, con las siguientes dosis:
- 5 ml de CS una vez por día durante cinco días proveyendo supuestamente el equivalente a 2.5 gramos/día de monohidrato de creatina (BD-CS)
- 5ml de placebo saborizado una vez por día durante 5 días (BD-P)
- 5 ml de CS ingerida 8 veces por día durante cinco días proveyendo supuestamente el equivalente a 20 gramos/día de monohidrato de creatina (DA-CS)
- 5 ml de placebo saborizado ingerido 8 veces por día durante 5 días proveyendo el equivalente a 20 gramos/día de creatina (DA-P), o,
- 5 gramos de monohidrato de creatina en polvo (Creapure™, BioActives GmbH, Freising, Germany) mezclada con 390,194 g de fluido 4 veces por día durante cinco días (i.e., 20 gramos/día) (MC).
Estas dosis permitieron la valoración de los efectos de la ingesta de CS con la dosis efectiva descrita en la etiqueta (i.e., 1 porción por día que provee supuestamente del equivalente a 2.5 gramos/día de monohidrato de creatina) como así también con una dosis 8 veces mayor a la supuesta dosis efectiva, lo cual teóricamente proveería del equivalente a 20 gramos/día de monohidrato de creatina. Se les instruyó a los sujetos ingerir los 5 ml de suero en la forma que se describe más abajo y de acuerdo a las instrucciones descriptas en la etiqueta de la CS:
“La porción única de 5 ml (una cucharada de te) de ATP ADVANTAGE™ CREATINE SERUM™ puede tomarse apretando 5 veces el gotero directamente bajo la lengua. Cada gota equivale a 1 ml; o si usted prefiere la dosis de ATP ADVANTAGE™ CREATINE SERUM™ puede mezclarse con agua. Ambos métodos son efectivos debido a que ATP ADVANTAGE™ CREATINE SERUM™ es absorbida directamente en el músculo. Usted esta listo para comenzar a ejercitarse.”
Evaluaciones Post Suplementación
Los sujetos ingirieron las dosis de suplementos descritas anteriormente durante 5 días e ingirieron una dosis final de suplementos dos horas antes de que se le realizaran las biopsias musculares post suplementación. Para las biopsias post suplementación, se intentó extraer el tejido aproximadamente de la misma ubicación por medio de la utilización de la cicatriz de la biopsia previa, marcas de profundidad en la aguja, y por medio de una sucesiva incisión que fue hecha a aproximadamente 0.5 cm de la anterior desde la parte medial hacia la lateral, de acuerdo a los procedimientos estándar (14). Los procedimientos para la obtención y el congelamiento de las biopsias musculares fueron idénticos a los realizados en las evaluaciones iniciales. Los sujetos devolvieron las botellas vacías o los paquetes a los investigadores para verificar el cumplimiento en la toma de los suplementos.
Análisis de los Tejidos
Las muestras fueron numeradas, codificadas, y enviadas a un laboratorio independiente con una extensa experiencia en la realización de análisis de ATP, PC, y creatina para pruebas doble ciego (6-8, 21, 22, 35, 36). El laboratorio que realizo los análisis no fue informado sobre el diseño o el propósito del estudio hasta que los análisis se hubieran realizado, chequeados, y enviado al sitio de coordinación del estudio. Las concentraciones musculares de ATP, creatina libre, y PC fueron analizadas utilizando procedimientos estándar descritos en detalle previamente (6,7, 21). Las muestras fueron pulverizadas utilizando dos pares de pinzas en una cámara climatizada a 4ºC, con una humedad relativa del 15% al 30% para prevenir la rehidratación de las muestras musculares. Se inspeccionó cada muestra para hallar sangre superficial y retirarla raspando cuidadosamente el músculo. La muestra fue triturada entre las pinzas y repetidamente refregada para pulverizar al músculo y conseguir un polvo fino. Se realizaron periódicas inspecciones para asegurar que todo el tejido conectivo visible fuese removido. Esto se cumplió fácilmente ya que el tejido conectivo se “pega” a las pinzas y se remueve durante el proceso de pulverización. Para la extracción con ácido perclórico se pesaron 5 a 10 mg de polvo en un tubo de polietileno de 1.5 ml.
Los metabolitos musculares se extrajeron utilizando 0.5 M de ácido perclórico el cual contenía 1 mM de EDTA, a una tasa de 800 μl cada 10 mg de polvo, fueron mantenidos durante 5 minutos en hielo mientras se los agitaba periódicamente. Luego de esto las muestras fueron centrifugadas durante 5 minutos a 7000 revoluciones/minuto y neutralizadas utilizando 2 M de KHCO3, durante 5 minutos mientras se los agitaba periódicamente. Luego de un centrifugado final de 15 minutos a 7000 revoluciones/minuto, el sobrenadante fue guardado en un tubo de polietileno de 1.5 ml a -50 ºC. Los subsiguientes análisis de metabolitos fueron realizados utilizando una modificación de los métodos previamente descriptos (33).
El trifosfato de adenosina y la PCr fueron analizados en la presencia de 50 mL de un amortiguador Tris, pH 7.4; 1 mM de clorhidrato de magnesio, 0.5 mL de ditiotreitol, 100 μM de glucosa, 50 μM de NADP+, 350 U/ml de glucosa-6-fosfato dehidrogenasa. Los ensayos fueron realizados en tubos de ensayo de 13 x 75 mm utilizando 10 μL de muestra a 1 ml de reactivo. La solución reactante fue agitada y estudiada utilizando un fluorímetro (Shimadzu RFMini 150, Japan) con una longitud de onda de excitación de 360 nm y una longitud de onda de emisión de 460 nm.
Veinticinco ml de hexoquinasa (280 U/ml) se añadieron a 1 ml del reactivo y luego fueron estailizados. Para los análisis de ATP, se añadieron 25 μl de la solución de la hexoquinasa, el tubo fue nuevamente agitado e incubado en una habitación oscura a temperatura ambiente durante 30 minutos, las muestras fueron nuevamente estudiadas en el fluorímetro. Se añadieron 2 mg de CK (25 U/mg) y 2 ng de ADP a 1 ml de reactivo y se estabilizó la solución utilizando 10 ml con el 10 % de albúmina bovina en suero. Para la determinación de la PCr, se añadieron 20 μL de la solución CK/ADP a los tubos, se los agitó y se los incubo en una habitación oscura a temperatura ambiente durante 60 minutos. Las muestras fueron nuevamente estudiadas. Todos los resultados están expresados en mmol/kg peso seco.
El análisis de la Cr en los extractos fue realizado en presencia de 50 mM de amortiguador imidazol, pH 7.4; 5 mM de clorhidrato de magnesio, 30 mM de clorhidrato de potasio, 25 μM de fosfoenolpiruvato, 200μM de ATP, 45μM de NADH, 1250 U/ml de lactato dehidrogenasa, 2000 U/ml de piruvato dehidrogenasa. Se añadieron 5 mg de CK (25 U/mg) a 1 ml del amortiguador y se lo estabilizó usando 10% de albúmina bobina en suero. El análisis fue realizado en tubos de ensayo de 13 x 75 mm utilizando 10 μL de muestra a 1 ml de reactivo. Luego de la adición de la muestra al reactivo, la solución reactante fue agitada e incubada en una habitación oscura a temperatura ambiente durante 15 minutos, y estudiada en el fluorímetro como se mencionó anteriormente. La solución buffer de creatínquinasa (25 μL) fue añadida a la muestra, agitada e incubada en una habitación oscura a temperatura ambiente durante 30 minutos, las muestras fueron entonces nuevamente estudiadas. Todos los ensayos se realizaron por duplicado (ATP y creatina libre) o cuadruplicado (PC) para verificar la consistencia de los resultados. El coeficiente de variación intra ensayo para el ATP y la PCr fue de 4.0 % y de 5.4 %, respectivamente. De manera similar, el coeficiente de variación intra ensayo para la Cr fue 6.4%. Los análisis de correlación con los ensayos repetidos revelaron una alta confiabilidad (r=0.99).
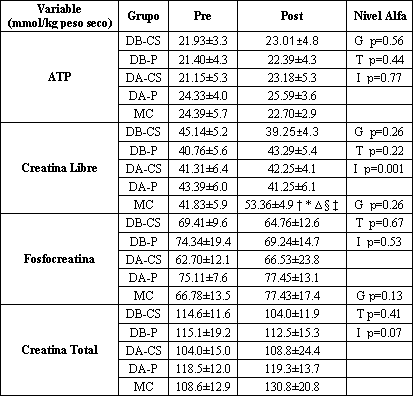
Tabla 1. Concentraciones de los fosfágenos musculares observadas antes y
después de la suplementación en los cinco grupos. Los datos son presentados como
medias±desviaciones estándar. Grupo dosis baja de creatina en suero (BD-CS);
grupo dosis baja de placebo (BD-P); grupo dosis alta de creatina en suero (DA-CS),
grupo dosis alta de placebo (DA-P); grupo monohidrato de creatina (MC). G =nivel
alfa para el grupo; T = nivel alfa para el tiempo, I =nivel alfa para grupo x
tiempo.† representa diferencia con respecto a los valores iniciales a un nivel
de significancia de p<0.05; * representa diferencia con respecto al grupo DB-CS
a un nivel de significancia de p<0.05; ∆ representa diferencia con respecto al
grupo DB-P a un nivel de significancia de p<0.05; § representa diferencia con
respecto al grupo DA-CS a un nivel de significancia de p<0.05; ‡ representa
diferencia con respecto al grupo DA-P a un nivel de significancia de p<0.05.
Análisis Estadísticos
Los datos fueron examinados bajo condiciones de ciego para identificar cualquier valor atípico que excediera ±2 desviaciones estándar de la media grupal para el ATP, CrL y PC. Por medio de esta examinación en ciego se determinaron un total de 3 valores atípicos para la PC los cuales fueron reemplazados por el valor medio grupal tal como se describió previamente (6, 7, 21). El contenido total de creatina muscular se calculó como las suma del contenido de CrL y PC. Los datos fueron analizados mediante el análisis de varianza para mediciones repetidas (ANOVA) utilizando el programa SPSS para Windows versión 11.0 (SPSS Inc., Chicago, IL). Los valores delta (valores post-pre) fueron calculados para cada variable y analizados con el análisis de varianza ANOVA de una vía. Los datos fueron considerados significativamente diferentes cuando la probabilidad de error fue ≤0.05. Cuando se observaron niveles alfa significativos se emplearon procedimientos post hoc de la mínima diferencia significativa (LSD). Los datos son presentados como medias±desvío estándar.
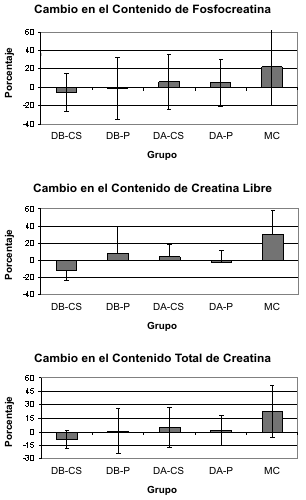
Figura 1. Porcentaje de cambio en la fosfocreatina (panel superior
izquierdo), en la creatina libre muscular (panel superior derecho), y en la
creatina total (panel inferior) luego de la suplementación para los grupos dosis
baja de creatina en suero (DB-CS), dosis baja de placebo (DB-P); dosis alta de
creatina en suero (DA-CS); dosis alta de placebo (DA-P) y monohidrato de
creatina (MC). * representa diferencia significativa a un nivel α igual a p<0.05
entre el grupo MC y los grupos DB-CS, DB-P, DA-CS, y DA-P. † representa
diferencia significativa a un nivel α igual p<0.05 entre el grupo MC y los
grupos DB-CS y DB-P.
RESULTADOS
No se observaron diferencias significativas entre los grupos en la edad, altura o peso corporal. La Tabla 1 presenta los contenidos pre y post intervención para el ATP, la CrL, la PC y la CrT mientras que la Figura 1 muestra el porcentaje de cambio observado para los grupos dosis baja de creatina en suero (DB-CS), dosis baja de placebo (DB-P); dosis alta de creatina en suero (DA-CS); dosis alta de placebo (DA-P) y monohidrato de creatina (MC). No se observaron diferencias significativas entre los grupos en las concentraciones de ATP (p=0.77). Se observó un interacción significativa grupo x tiempo entre los grupos en el contenido muscular de CrL (p=0.001). Los análisis post hoc revelaron que los sujetos que ingirieron monohidrato de creatina (MC) tuvieron un incremento significativo en el contenido de CrL mientras que no se observaron efectos sobre el contenido muscular de CrL en los grupos con bajas y altas dosis de placebo líquido y suplementación con CS. El incremento en el contenido de CrL en respuesta a la suplementación con MC fue significativamente mayor que en los grupos DB-CS; DB-P, DA-CS, DA-P. Los cambios en el porcentaje de CrL muscular fueron significativamente mayores en el grupo MC (DB-CS 21.3±11.3; DB-P –8.6±24.7, DA-CS 3.8±14.7; DA-P -2.7±14.1; MC 30.8±27.7 %; p=0.001). No se observaron diferencias significativas entre los grupos en las concentraciones de PC (p=0.53). Los grupos que se suplementaron con dosis bajas y altas de CS no tuvieron efectos significativos sobre el contenido muscular de ATP, CrL, PC o CrT.
DISCUSION
Aproximadamente el 95% de la creatina existente en el cuerpo está almacenada en el músculo. Cerca de dos tercios de esta creatina está almacenada como PC, mientras que el tercio restante está almacenada como creatina libre (3, 5, 27, 28, 37-39). La valoración del contenido muscular de creatina y de PC por medio de biopsia muscular o por espectroscopia de resonancia magnética (ERM) son los medios más aceptados para determinar la eficacia de la retención de creatina (3, 5, 27, 28, 37-39). Diversos estudios han hallado consistentemente que la suplementación con monohidrato de creatina incrementa el contenido muscular de creatina y PC en un 15-40% con poco o ningún efecto sobre la concentración muscular de ATP (3, 5, 27, 28, 37-39). En el presente estudio, la suplementación con monohidrato de creatina (20 gramos/día durante 5 días) resulto en un incremento del 30.8 % en el contenido de creatina libre, un incremento del 22.0 % en el contenido de PC y un incremento del 22.6 % en el contenido muscular total de creatina. Estos hallazgos son consistentes con muchos estudios que han reportado que la suplementación con monohidrato de creatina incrementa la disponibilidad de creatina y/o de los fosfágenos musculares.
La marca MMUSA ha comercializado la CS como una forma de creatina más efectiva que el monohidrato de creatina en polvo. De acuerdo con el material de comercialización, el argumento es que al proveer de un “Complejo de Fosfato de Creatina” en forma líquida se permite el transporte de la creatina a través de la mucosa evitando de esta manera el proceso digestivo normal. MMUSA afirma que este método de transporte de creatina es diez veces más eficiente, en el transporte de creatina hacia el músculo, que el MC en polvo debido a que, según lo que esta marca sostiene, el 90% del monohidrato de creatina ingerido oralmente es convertido a creatinina y/o no es absorbido por el músculo. Por ello, MMUSA afirma que con la CS no es necesario seguir los procedimientos tradicionales de la carga de creatina.
Los resultados del presente estudio no respaldan las afirmaciones comerciales de MMUSA. Con respecto a esto, mientras la suplementación con MC produjo incrementos significativos en el contenido muscular de creatina, la suplementación con dosis bajas de CS (i.e., la cantidad recomendada en la etiqueta, que supuestamente proveía del equivalente a 2.5 gramos/día de monohidrato de creatina) y la suplementación con dosis altas de CS (i.e., 8 veces la cantidad recomendada en la etiqueta, que supuestamente proveía el equivalente a 20 gramos/día de monohidrato de creatina) no tuvieron efectos significativos sobre el contenido muscular de ATP, CrL, PC o CrT. Además, las ganancias observadas en la CrL y en la CrT luego de la suplementación con MC fueron significativamente mayores que las observadas con la suplementación con CS a bajas y altas dosis. Estos hallazgos indican que la CS es una forma de creatina completamente inefectiva para promover la retención de creatina y que el MC es significativamente mejor que la CS para promover la retención de creatina. Los presentes hallazgos también respaldan estudios previos que reportaron que el contenido de creatina en la CS es poco o ninguno y que la ingestión oral de CS no tiene efecto sobre los niveles sanguíneos de creatina por lo cual no podría promover la retención de creatina (30, 31).
Está bien establecido que el valor ergogénico de la suplementación con creatina está sujeto a la habilidad de incrementar significativamente las reservas musculares de creatina y de PC. No existe ningún mecanismo fisiológico conocido por el cual la suplementación con creatina podría provocar un efecto ergogénico sin incrementar significativamente la disponibilidad muscular de creatina y/o PC (3, 5, 27, 28, 37-39). Los estudios en donde los protocolos de suplementación fallaron en incrementar significativamente las reservas musculares de creatina y PC han reportado que la suplementación con creatina no tiene valor ergogénico (3, 5, 27, 28, 37-39). Además, otros estudios han reportado que la magnitud de la retención de creatina en el músculo esta positivamente correlacionada con el beneficio ergogénico (5, 9, 24-28). El presente estudio indica que la suplementación con bajas y altas dosis de CS no tiene efectos sobre los niveles musculares de creatina. De esta manera, no hay bases fisiológicas para afirmar que la CS mejora la capacidad de rendimiento en el ejercicio, mejora las adaptaciones al entrenamiento, y/o es una forma superior de creatina que el monohidrato de creatina.
Conclusión
Hemos evaluado cuidadosamente los supuestos efectos de la suplementación con CS sobre el contenido muscular de ATP, CrL, PC y CrT. Este estudio provee de una respuesta definitiva a si la CS es una forma efectiva de creatina y/o si es más efectiva que el MC en incrementar el contenido muscular de creatina. Estos hallazgos indican que la suplementación con MC es efectiva para incrementar el contenido muscular de creatina y que es significativamente mejor que la suplementación con bajas y altas dosis de CS.
Por lo tanto nuestra opinión es que:
- No hay bases científicas para respaldar la afirmación de que la CS es una forma efectiva de creatina;
- No hay evidencia científica que indique que la CS es una forma más eficiente de creatina que el MC para promover la retención muscular de creatina; y
- Dado que no hay evidencia acerca de que la CS afecte las reservas musculares de creatina, la suplementación con CS no tendría por lo tanto, ningún valor ergogénico.
Estos hallazgos sugieren que la afirmación de que la CS es una forma efectiva de creatina y/o más efectiva que el monohidrato de creatina para incrementar el contenido muscular de creatina y de fosfágenos parece ser falsa.
Agradecimientos
Quisiéramos agradecer a los sujetos que participaron en este estudio. Este estudio fue respaldado por Degussa BioActives GmbH, Freising, Alemania como parte de un acuerdo independiente de consulta con el Dr. Kreider y por subsidios provistos por la TCU y por la Universidad de McMaster. Los investigadores involucrados en este estudio recolectaron, analizaron e interpretaron los datos independientemente y no tuvieron ningún interés financiero en las consecuencias de los resultados reportados. La presentación de los resultados en este estudio no constituye un respaldo de los investigadores o de las instituciones para las que ellos trabajan a los suplementos investigados.
Dirección para correspondencia
Richard B. Kreider, Ph.D., Exercise & Sport Nutrition Laboratory, Center for Exercise, Nutrition and Preventive Health Research, Department of Health, Human Performance & Recreation, Baylor University, PO Box 97313, Waco, TX 76798-7313; Teléfono: (254) 710-3526; Fax: (254) 710-3527; correo electrónico: Richard_Kreider@baylor.edu
Referencias
1. Harris, R.C., Soderlund, K., and Hultman, E (1992). Elevation of creatine in resting and exercised muscle of normal subjects by creatine supplementation. Clin Sci (Colch), 83(3), 367
2. Greenhaff, P.L., et al (1993). Influence of oral creatine supplementation of muscle torque during repeated bouts of maximal voluntary exercise in man. Clin Sci (Colch), 84(5), 565
3. Balsom, P.D., Soderlund, K., and Ekblom, B (1994). Creatine in humans with special reference to creatine supplementation. Sports Med, 18(4), 268
4. Green, A.L., et al (1996). Carbohydrate ingestion augments skeletal muscle creatine accumulation during creatine supplementation in humans. Am J Physiol, 271(5 Pt 1), E821
5. Hultman, E., et al (1996). Muscle creatine loading in men. J Appl Physiol, 81(1), 232
6. Tarnopolsky, M.A. and Parise, G (1999). Direct measurement of high-energy phosphate compounds in patients with neuromuscular disease. Muscle Nerve, 22(9), 1228
7. Parise, G., et al (2001). Effects of acute creatine monohydrate supplementation on leucine kinetics and mixed-muscle protein synthesis. J Appl Physiol, 91(3), 1041
8. Tarnopolsky, M.A., et al (2001). Creatine transporter and mitochondrial creatine kinase protein content in myopathies. Muscle Nerve, 24(5), 682
9. Greenhaff, P.L., et al (1994). Effect of oral creatine supplementation on skeletal muscle phosphocreatine resynthesis. Am J Physiol, 266(5 Pt 1), E725
10. Volek, J.S., et al (1999). Performance and muscle fiber adaptations to creatine supplementation and heavy resistance training. Med Sci Sports Exerc, 31(8), 1147
11. Stone, M.H., et al (1999). Effects of in-season (5 weeks) creatine and pyruvate supplementation on anaerobic performance and body composition in American football players. Int J Sport Nutr, 9(2), 146
12. Kreider, R.B., et al (1998). Effects of creatine supplementation on body composition, strength, and sprint performance. Med Sci Sports Exerc, 30(1), 73
13. Volek, J.S., et al (1997). Creatine supplementation enhances muscular performance during high- intensity resistance exercise. J Am Diet Assoc, 97(7), 765
14. Willoughby, D.S. and Rosene, J (2001). Effects of oral creatine and resistance training on myosin heavy chain expression. Med Sci Sports Exerc, 33(10), 1674
15. Skare, O.C., Skadberg, and Wisnes, A.R (2001). Creatine supplementation improves sprint performance in male sprinters. Scand J Med Sci Sports, 11(2), 96
16. Preen, D., et al (2001). Effect of creatine loading on long-term sprint exercise performance and metabolism. . Med Sci Sports Exerc, 33(5), 814
17. Urbanski, R.L., Vincent, W.J., and Yaspelkis, B.B (1999). 3rd, Creatine supplementation differentially affects maximal isometric strength and time to fatigue in large and small muscle groups. Int J Sport Nutr, 9(2), 136
18. Peyrebrune, M.C., et al (1998). The effects of oral creatine supplementation on performance in single and repeated sprint swimming. J Sports Sci, 16(3), 271
19. Jones, A.M., Atter, T., and George, K.P (1998). Oral creatine supplementation improves multiple sprint performance in elite ice-hockey players. Med Sci Sports Exerc, 30(5), S140
20. Jowko, E., et al (2001). Creatine and beta-hydroxy-beta-methylbutyrate (HMB) additively increase lean body mass and muscle strength during a weight-training program. Nutrition, 17(7-8), 558
21. Tarnopolsky, M.A. and MacLennan, D.P (2000). Creatine monohydrate supplementation enhances high-intensity exercise performance in males and females. Int J Sport Nutr Exerc Metab, 10(4), 452
22. Tarnopolsky, M.A., Roy, B.D., and MacDonald, J.R (1997). A randomized, controlled trial of creatine monohydrate in patients with mitochondrial cytopathies. Muscle Nerve, 20(12), 1502
23. Tarnopolsky, M.A., et al (2001). Creatine-dextrose and protein-dextrose induce similar strength gains during training. Med Sci Sports Exerc, 33(12), 2044
24. Greenhaff, P.L (1996). Creatine supplementation: recent developments. Br J Sports Med, 30(4), 276
25. Greenhaff, P., Casey, A., and Green, A.L (1996). Creatine supplementation revisited: An update. Insider, 4(3), 1
26. Greenhaff, P., et al (1993). The influence of oral creatine supplementation on muscle phosphocreatine resynthesis following intenst contraction in man. J Physiol, 467, 75P
27. Greenhaff, P.L (2001). Muscle creatine loading in humans: Procedures and functional and metabolic effects. In 6th Internationl Conference on Guanidino Compounds in Biology and MedicineCincinatti, OH
28. Williams, M.H., Kreider, R., and Branch, J.D (1999). Creatine: The power supplement Champaign. IL: Human Kinetics Publishers, 252
29. Kreider, R., et al (2001). Effects of creatine loading on hydration, whole body creatine retention, and urinary creatinine excretion. J Str Cond Res, 15(10), 395
30. Dash, A.K. and Sawhney, A (2002). A simple LC method with UV detection for the analysis of creatine and creatinine and its application to several creatine formulations. J Pharm Biomed Anal, 29(5), 939
31. Almada, A., Harris, R.C., and Harris, D.B (2001). Ingestion of creatine serum has no effect on plasma creatine. FASEB J, 15, LB61
32. Soderlund, K. and Hultman, E (1986). Effects of delayed freezing on content of phosphagens in human skeletal mucle biopsy samples. J Appl Physiol, 61, 832
33. Soderlund, K. and Hultman, E (1986). Effects of delayed freezing on content of phosphagens in human skeletal muscle biopsy sample. J Appl Physiol, 61(3), 832
34. Tarnopolsky, M. and Martin, J (1999). Creatine monohydrate increases strength in patients with neuromuscular disease. Neurology, 52(4), 854
35. Tarnopolsky, M., et al (2003). Acute and moderate-term creatine monohydrate supplementation does not affect creatine transporter mRNA or protein content in either young or elderly humans. Mol Cell Biochem, 244(1-2), 159
36. Greenhaff, P (1997). The nutritional biochemistry of creatin. Nutri Biochem, 11, 610
37. Kraemer, W.J. and Volek, J.S (1999). Creatine supplementation. Its role in human performance. Clin Sports Med, 18(3), 651
38. Kreider, R.B (1999). Creatine Supplementation in Exercise and Sport., in Energy-Yielding Macronutrients and Energy Metabolism in Sports Nutrition. Driskell, J. and Wolinsky, I., Editors. CRC Press LLC: Boca Raton, FL. p. 213