Efectos de la Suplementación con L-Canitina L-Tartrato sobre las Respuestas Hormonales al Entrenamiento de Sobrecarga y la Recuperación
Keijo Häkkinen4, William J Kraemer1, Robert U Newton2, Jeff S Volek1, Nicholas A Ratamess1, Ana L Gómez1, Martín R Rubin1, Duncan N French1, Matthew J Sharman1 y Bruce W Craig3
1Human Performance Laboratory, Department of Kinesiology, The University of Connecticut, Storrs, CT 06269, Estados Unidos.
2Exercise and Sport Science, Edith Cowan University, Joondalup, Western Australia, 6027 Australia.
3Human Performance Laboratory, Ball State University, Muncie, Indiana 47306.
4Department of Biology of Physical Activity, University of Jyväskilä, Finland and Research Unit for Sport and Physical Fitness, Jyväskilä, Finland.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2003.
Publicado 27 de diciembre de 2006
Resumen
Palabras clave: estrés hipóxico, hormona del crecimiento, daño muscular, testosterona, factores de crecimiento, prot
INTRODUCCION
La carnitina endógena es un componente necesario para la oxidación de las grasas en las células. Específicamente, la carnitina actúa como sistema transportador al nivel de la mitocondria facilitando el transporte de los ácidos grasos a través de la matriz mitocondrial para su metabolismo y producción de energía por la beta-oxidación. A partir del conocimiento del rol de la carnitina en la oxidación de las grasas, desde principios y hasta mediados de la década de los 90’ se ha examinado extensivamente la suplementación dietaria con L-carnitina, un nutriente de las características de los aminoácidos, en el contexto del ejercicio como una herramienta potencial para incrementar el transporte de ácidos grasos hacia la mitocondria, para mejorar de esta manera la utilización de grasas durante el ejercicio (2, 4, 5, 12, 16, 28). Desafortunadamente, a pesar de la lógica en la teoría para su utilización, la suplementación con carnitina probó ser inefectiva para mejorar el rendimiento deportivo y para incrementar la oxidación de ácidos grasos durante el ejercicio, principalmente debido al hecho de que la suplementación con carnitina en la dieta no ha probado incrementar el contenido de carnitina en los músculos esqueléticos de los humanos (28), en comparación con las ratas (1).
Investigaciones más recientes acerca de la suplementación con L-carnitina L-tartrato (LCLT), llevadas a cabo en el contexto del ejercicio se han concentrado en una hipótesis diferente al rol previamente examinado de la L-carnitina en el metabolismo graso (27). En un reciente trabajo realizado en nuestro laboratorio se examinó el rol de la L-carnitina como un mecanismo potencial de protección para atenuar el daño tisular inducido por los radicales libres producidos en hipoxia durante el ejercicio y en la posterior recuperación (27). La L-carnitina, al acumularse en las células endoteliales de los capilares, puede incrementar el transporte de oxígeno hacia los músculos activos a través de un efecto vasodilatador sobre los capilares, reduciendo así la hipoxia muscular local observada normalmente durante la realización de ejercicios de alta intensidad y la subsiguiente cascada de eventos que derivan en la formación de radicales libres y en la ruptura y daño tisular inducido químicamente. Además, el flujo sanguíneo hacia otros tejidos importantes y hacia diversas glándulas corporales puede incrementarse y proveer mecanismos adicionales más allá del flujo circulatorio hacia los músculos para mejorar los procesos de recuperación (e.g., células de la glándula pituitaria, hígado y testículos, todas las cuales tienen complejos sistemas capilares que proporcionan oxígeno y otros nutrientes a estas glándulas endócrinas y proporcionan una ruta para el transporte hormonal hacia la circulación). En general, los resultados de nuestro estudio anterior proporcionan los primeros datos que respaldan esta hipótesis (27). En este estudio hallamos un efecto favorable de la suplementación con LCLT sobre la regulación del flujo sanguíneo endotelial durante y luego de la realización del ejercicio de sentadillas a una intensidad moderada, lo cual estuvo evidenciado por una menor acumulación de marcadores de la degradación de purinas, de formación de radicales libres, de daño tisular y de inflamación muscular. Además, Giamberardino et al. (9) también indicaron que la suplementación con L-carnitina (3 g por día durante 3 semanas) atenuó el comienzo retrasado de la inflamación muscular inducida por el ejercicio y la acumulación de creatinquinasa luego de la realización de esfuerzos excéntricos llevados a cabo con el cuadriceps, aunque este estudio probablemente se concentró más en el impacto de la suplementación con L-carnitina, debido a que se indujeron altos niveles de daño muscular con el cual no habría un flujo sanguíneo óptimo. De esta manera, la suplementación con LCTC podría ser beneficiosa para el proceso de recuperación luego del estrés provocado por el ejercicio, sin embargo, se requieren más investigaciones para dilucidar los mecanismos potenciales mediadores de este proceso (7, 27).
Los eventos bioquímicos que se desencadenan como consecuencia de la realización de ejercicios son numerosos y complejos e incluyen el catabolismo de las purinas, la generación de especies oxigenadas reactivas, y la ruptura de las membranas celulares y del citoesqueleto (26, 27). Para promover la recuperación luego de series individuales de ejercicio, se requieren de condiciones óptimas. La recuperación implica el funcionamiento coordinado de varios procesos fisiológicos que se encuentran fuertemente influenciados por la disponibilidad y las acciones de hormonas específicas (6, 10, 13-15). De particular importancia para la recuperación luego de haberse producido el daño muscular inducido por el ejercicio y para la regeneración de las estructuras celulares son las hormonas anabólicas y los factores de crecimiento, incluyendo la testosterona, la hormona del crecimiento (GH) y los factores de crecimiento tipo insulínico I (IGF-1) (6, 16-20). Las interacciones entre estas hormonas y sus receptores al nivel de las células musculares durante la fase de recuperación posterior al ejercicio tienen el efecto de estimular la reparación y promover el remodelamiento estructural a través del proceso de síntesis proteica (14, 15, 20). El incremento en el recambio o turnover proteico favorece la reparación y el crecimiento del tejido muscular dañado y es regulado en forma aguda por las interacciones homeostáticas de estas hormonas anabólicas. Claramente, el ejercicio vigoroso provoca la ruptura o el daño de la estructura de las fibras musculares, las cuales durante la recuperación, deben pasar por el proceso de remodelación. Por lo tanto sería razonable considerar un vínculo entre las concentraciones circulantes de las hormonas anabólicas y el incremento en la tasa de síntesis proteica, lo cual deriva en una mejora en la regeneración y en la recuperación muscular.
La importancia de las hormonas anabólicas durante el proceso de recuperación ha sido destacado por MacDougal et al. (20), quienes observaron una elevación en la síntesis de proteínas en músculos entrenados hasta 36 horas después de la finalización de ejercicios de sobrecarga. Muchos estudios han mostrado que las concentraciones circulantes de las hormonas anabólicas se incrementan agudamente luego de la realización de ejercicios de sobrecarga (16-19). Además, los estudios que han utilizado dosis suprafisiológicas de testosterona han documentado sus efectos anabólicos sobre el tejido muscular (3, 15). Aunque las investigaciones previas han indicado que la L-carnitina puede proporcionar un mecanismo protector durante el ejercicio y promover la recuperación luego del mismo (7, 27), ningún estudio ha examinado los efectos de la suplementación con L-carnitina sobre las hormonas anabólicas y los factores de crecimiento luego de la realización de ejercicios de sobrecarga. Por lo tanto, aún se desconoce si la mejora en el nivel de recuperación reportado en los estudios previos (7, 9, 27) es consecuencia de los cambios en las concentraciones circulantes de las hormonas anabólicas y su capacidad para incrementar la reparación y regeneración de los tejidos celulares. Por lo tanto, el propósito de este estudio fue examinar la influencia de la suplementación con LCLT sobre la respuesta de las hormonas anabólicas al ejercicio agudo de sobrecarga.
METODOS
Enfoque Experimental del Problema
Con este estudio quisimos ampliar nuestra comprensión acerca de los beneficios de la recuperación y los posibles mecanismos relacionados con la suplementación con LCLT y sobre los factores hormonales que median dicha reparación anabólica y que no han sido aun esclarecidos. Este estudio fue llevado a cabo utilizando un diseño experimental transversal, balanceado, controlado con placebo, que examinó los efectos de la suplementación con LCLT sobre los marcadores de la respuesta de las hormonas anabólicas luego de la realización del ejercicio de sentadilla en forma concéntrica – excéntrica. Los sujetos fueron agrupados para obtener los valores clínicos previos a la evaluación respecto de los antecedentes de actividad física, patrones nutricionales y tamaño corporal y luego fueron aleatoriamente asignados a un grupo LCLT o a un grupo placebo utilizando un diseño doble ciego. Luego de 3 semanas de suplementación (2 g de LCLT por día), se obtuvieron muestras sanguíneas en ayunas, recolectadas en horas de la mañana, en 6 días consecutivos (D1-D6). Durante el día D2, los sujetos completaron un protocolo de ejercicio que implicaba la realización de sentadillas en forma concéntrica – excéntrica (5 series de 15-20 repeticiones). El mismo día en que se llevó a cabo el protocolo de ejercicio se obtuvieron muestras sanguíneas a los minutos 0, 15, 30, 120 y 180 post ejercicio. Luego de un período de lavado de 1 semana, los sujetos consumieron el otro suplemento durante un período de 3 semanas, y se repitió el mismo protocolo experimental utilizando exactamente los mismos procedimientos.
Sujetos
Este estudio amplió nuestro trabajo previo al utilizar los mismos 10 hombres saludables entrenados en la fuerza de forma recreacional, con valores medios ± DE para la edad, 23.7±2.3 años, peso, 78.7±8.5 kg y talla 1799.2±4.6 cm, los cuales sirvieron como sujetos. Se requirió que todos los sujetos estuvieran llevando a cabo un programa para el entrenamiento de la fuerza que incluyera el ejercicio de sentadillas desde al menos 1 año antes del comienzo del estudio, para excluir a aquellos individuos que pudieran experimentar un alto grado de daño muscular en los cuadriceps en respuesta a la realización del ejercicio de sentadillas por primera vez. Los sujetos continuaron normalmente con su entrenamiento con excepción del período comprendido entre D1 y D6 durante el cual no se les permitió entrenar. Todos los sujetos fueron informados acerca del propósito y de los posibles riesgos de esta investigación antes de que firmaran un documento de consentimiento escrito aprobado por el comité de revisión. Un nutricionista registrado monitoreó a los potenciales sujetos para determinar comportamientos nutricionales o la utilización de suplementos que pudieran causar confusión en los resultados. Se utilizaron registros dietarios y de actividad física para estandarizar los comportamientos en cada condición experimental para eliminar potenciales influencias de confusión tanto nutricionales como de comportamiento.
Protocolo de Suplementación
A los sujetos se les proporcionaron cápsulas de L-CARNIPURE LCLT (Lonza, Fair Lawn, NJ) que contenían 736 mg de LCLT (500 mg de L-carnitina y 236 mg de L-tartrato) o un placebo de apariencia similar (celulosa en polvo) con instrucciones escritas para que se consumieran 2 cápsulas con el desayuno y el almuerzo para alcanzar una dosis total de 2 g de L-carnitina por día. La suplementación comenzó 3 semanas antes de que se llevara a cabo el protocolo de ejercicio y continúo durante la recuperación. Esta dosis de carnitina fue elegida para maximizar la concentración plasmática sin exceder el umbral renal (11, 25). Las concentraciones sanguíneas actuaron como marcadores internos de la adherencia al protocolo de suplementación. Esta dosis ha mostrado ser segura (24).
Protocolo de Ejercicio
El protocolo de ejercicio consistente en la realización de sentadillas fue llevado a cabo en un equipo Plyometric Power System (PPS, Lismore, Australia) el cual fue descrito detalladamente en un estudio previo (29). En forma breve, el PPS permite solo el movimiento vertical de la barra. Los rodamientos lineares acoplados en cada extremo de la barra permiten que esta se deslice hacia arriba y hacia abajo sobre dos ejes de acero con un mínimo de fricción. Una semana antes de que comenzara el protocolo de suplementación cada sujeto fue evaluado para determinar la fuerza en una repetición máxima (1RM) en el ejercicio de sentadillas, utilizando los procedimientos estándar de nuestro laboratorio (17). Para determinar que intensidad de ejercicio provocaría ruptura del tejido muscular pero no daño severo y de esta manera maximizar el potencial de la LCLT para reducir las respuestas bioquímicas mediadas por hipoxia al estrés de ejercicio, se llevaron a cabo estudios pilotos en los cuales se utilizaron diferentes cargas de ejercicio e imágenes de resonancia magnética nuclear (MRI). El protocolo de ejercicio fue llevado a cabo en D2 en horas de la tarde, 3 horas después del almuerzo (lo cual fue reproducido por cada sujeto durante los dos días de ejercicio) y 3 horas después de la última dosis de carnitina. Luego de una entrada en calor estandarizada (5 minutos de ciclismo), los sujetos realizaron 5 series de 15-20 repeticiones del ejercicio de sentadilla con una carga igual al 50% de la 1RM determinada previamente. Se permitió un período de recuperación de 2 minutos entre cada serie. La carga se redujo si se realizaban < de 15 repeticiones.
Ruptura del Tejido Muscular
La valoración directa de la ruptura del tejido muscular y su reparación fue evaluada utilizando imágenes transversales de MRI y el tiempo de relajación spin-spin de los músculos del muslo antes del test de ejercicio y a los 1 y 4 días post ejercicio utilizando los métodos previamente descritos en detalle por Dudley et al (8). El mismo investigador realizó todas las mediciones con un coeficiente de confiabilidad r=0.99. Las imágenes fueron recolectadas utilizando un imán de MRI abierto de 0.3 Tesla (AIRIS II, Hitachi Medical Systems America, Twinsburg, OH) y las áreas fueron medidas utilizando el programa para Macintosh desarrollado en el Instituto Nacional de Salud (NIH), NIH Image 1.55b 20, una computadora MacIntosh Quadra 800 (Apple Computer, Inc., Cupertino, CA), y un escáner (ArtixScan 1100, Microtek Laboratories, Inc., Redondo Beach, CA). El INH Image 1.55b 20 utiliza píxeles de luz para determinar el área del músculo esquelético en donde se produjo el daño tisular.
Recolección de las Muestras de Sangre
Las muestras de sangre fueron obtenidas en 6 días consecutivos a la misma hora de la mañana y luego de que los sujetos ayunaran 12 horas durante la noche y que se abstuvieran de consumir alcohol o realizar ejercicios vigorosos. La última dosis de carnitina fue consumida durante el almuerzo el día previo a cada extracción de sangre (~ 18-20 horas antes). Los sujetos se reportaron al laboratorio entre las 7:00 y las 9:00 AM y se mantuvieron en reposo durante 10 min en posición de decúbito supino, luego de lo cual se obtuvieron ~30 mL de sangre extraídos de la vena antecubital utilizando una aguja calibre 20 y tubos Vacutainer. En los días en que se realizó ejercicio, se les insertó a los sujetos un catéter flexible en la vena del antebrazo, el cual se mantuvo patente mediante un goteo constante de solución salina (60 ml/h). Para evitar la dilución de las muestras de sangre, previamente a la recolección de las mismas se extrajeron 3 mL de sangre los cuales fueron descartados, y subsiguientemente se extrajeron los ~ 30 mL que fueron colocados en 2 tubos de 10 mL con un activador de la coagulación y en 1 tubo de 10 mL con EDTA. Dentro de los 15 min de haber extraído la muestra, la sangre fue centrifugada (1200 g durante 15 minutos a 10 ºC) y el suero/plasma resultante fue dividido en alícuotas y almacenado a -80 ºC. Durante el período de recuperación de 3 horas posterior al ejercicio los sujetos se mantuvieron en reposo en posición de sentados.
Análisis Bioquímicos
La concentración circulante en plasma de GH inmunoreactiva fue medida utilizando el ensayo inmunoradiométrico de Nichols (IRMA) (Nichols Institute Diagnostics, San Juan Capistrano, CA). Este ensayo comercialmente disponible utiliza dos anticuerpos monoclonales de alta afinidad y especificidad para la GH. Cada anticuerpo detecta un epitope diferente de la molécula de GH. Uno de los anticuerpos es marcado con 125I para la detección y el otro se acopla con la biotina. La sensibilidad de este ensayo es de 0.04 dn/mL. La varianza intra ensayo fue menor al 5%.
La concentración plasmática de GH inmunofuncional fue determinada con un análisis que utiliza un ensayo tipo sándwich amplificado en 2 etapas el cual requiere un anticuerpo monoclonal anti-GH y una proteína recombinante biotinilada fijadora de GH (GHBP) que se une, respectivamente, a los sitios 1 y 2 de del receptor de la GH presentes en todas las moléculas “biológicamente activas” de la GH (Diagnostics Systems Laboratories, Inc. [DSL], Webster, TX). Las muestras de plasma fueron incubadas secuencialmente (con pasos de lavado intermedios) con (a) un anticuerpo anti-GH inmovilizado, (b) una GHBP biotinilada seguido de estreptavidina marcada con peroxidasa de rábano y finalmente (c) con tetrametilbenzidina. Luego de la adición de una solución ácida paralizante, se determinó el turnover enzimático mediante mediciones de absorbancia a dos longitudes de onda de 450 y 630 nm. La absorbancia es directamente proporcional a la concentración de GH “intacta” biológicamente activa que posee ambos sitios de unión. La sensibilidad de este ensayo, cuando se utilizó el método de B0 ± 2 DE fue de 0.20 ng/mL. Las varianzas intra-ensayo para concentraciones bajas, moderadas y altas de GH fueron menores al 9%.
La concentración total de IGF-1 sérico fue determinada por medio del ensayo IRMA (DSL) de 2 sitios. Este ensayo incluye una extracción simple en etanol en el cual el IGF-1 es separado de su proteina fijadora en la muestra de suero, un paso considerado esencial para una precisa medición de la concentración de IGF-1. Este es un ensayo tipo sándwich no competitivo en el cual el analito es encerrado entre dos anticuerpos, 1 inmovilizado a la pared del tubo y el otro marcado con un radioisótopo de 125I para la detección. La sensibilidad de este ensayo es de 0.03 ng/mL. Las varianzas intra-ensayo fueron menores al 5%.
La medición de la IGFBP-3 circulante fue llevada a cabo utilizando el ensayo IRMA (DSL) de 2 sitios en tubo recubierto. Este es un ensayo no competitivo en el cual el analito a ser medido es encerrado entre dos anticuerpos. El primero es inmovilizado en el interior de la pared del tubo y el otro marcado con un radioisótopo para la detección. La sensibilidad de este ensayo es de 0.5 ng/mL. Las varianzas intra-ensayo fueron menores al 5%.
La testosterona total en suero fue analizada en duplicado utilizando la técnica de radioinmunoensayo 125I de fase sólida con una sensibilidad de 0.278 nmol/L (DSL). Las varianzas intra-ensayo fueron menores al 5%.
Análisis Estadísticos
Para evaluar los cambios en el tiempo y las diferencias entre las condiciones L-carnitina y placebo se utilizó el análisis de varianza (ANOVA) de dos vías para mediciones repetidas. Para determinar el área bajo las curvas de valores se llevó a cabo el análisis trapezoidal en los puntos del tiempo en que se realizó la recolección de los datos. Antes de llevar a cabo los análisis ANOVA se realizaron test de distribución normal (test de chi-cuadrado de Kolmogorov-Smirnov) y de homogeneidad de la varianza (test de Levene). Las comparaciones post hoc se llevaron a cabo utilizando el test de Fisher de la menor diferencia significativa (LSD) o el test de Tukey, según fuera apropiado. Se determinó que la potencia estadística fue >0.80 para todas las mediciones respecto del tamaño de la muestra utilizado y con un nivel alfa de 0.05 (nQuery Advisor software, Statistical Solutions, Saugus, MA). La significancia estadística fue establecida a p≤0.05.
RESULTADOS
Tanto la GH inmunoreactiva (Figura 1) como la GH inmunofuncional (Figura 2) mostraron una respuesta idéntica con incrementos significativos por encima del valor de reposo a los 0, 15 y 30 post ejercicio. La magnitud de la concentración de la GH inmunoreactiva fue mayor que la de la GH inmunofuncional. No se observaron diferencias entre las condiciones LCLT y placebo.
Las respuestas de la IGF-1 al protocolo de ejercicio (Figura 3) no mostraron cambios significativos inducidos por el ejercicio o diferencias entre las condiciones de tratamiento con placebo o LCLT.
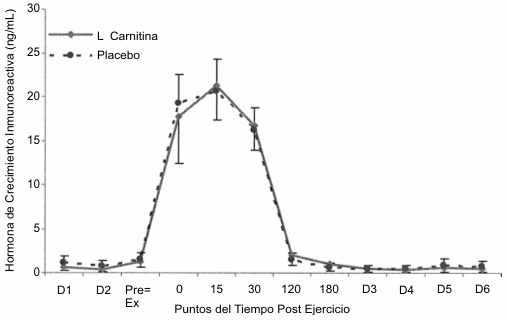
Figura 1. Respuesta de la hormona de crecimiento inmunoreactiva al
protocolo de ejercicio consistente en la realización de sentadillas. Se
observaron incrementos significativos (p<0.05) por encima del nivel de reposo a
los 0, 15 y 30 min post ejercicio y no se observaron diferencias entre la
condición placebo (línea punteada) y la condición L-carnitina L-tartrato (línea
sólida).
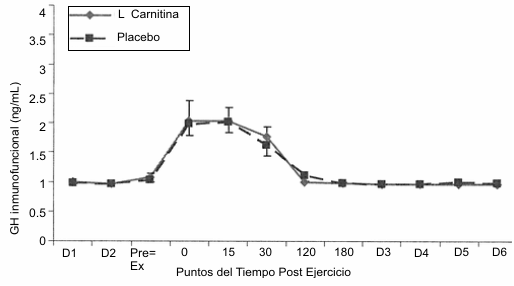
Figura 2. Respuesta de la hormona de crecimiento inmunofuncional al
protocolo de ejercicio consistente en la realización de sentadillas. Se
observaron incrementos significativos (p<0.05) por encima del nivel de reposo a
los 0, 15 y 30 min post ejercicio y no se observaron diferencias entre la
condición placebo (línea punteada) y la condición L-carnitina L-tartrato (línea
sólida).
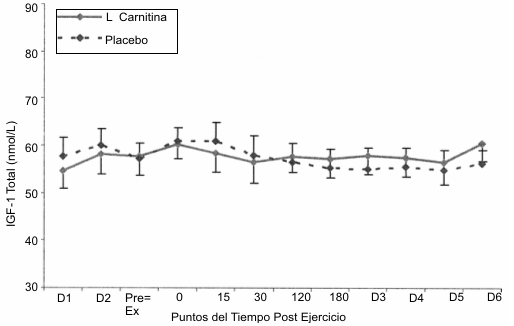
Figura 3. Respuesta del factor de crecimiento tipo insulínico 1 al
protocolo de ejercicio consistente en la realización de sentadillas. No se
observaron incrementos significativos (p>0.05) con el ejercicio y no se
observaron diferencias entre la condición placebo (línea punteada) y la
condición L-carnitina L-tartrato (línea sólida).
Las respuestas de la IGFBP-3 al protocolo de ejercicio (Figura 4) mostraron un incremento significativo por encima del valor de reposo al minuto 0 post ejercicio. Se observaron diferencias significativas entre las condiciones de tratamiento con placebo y LCLT en los días D1 y D2 como así también en los minutos 30, 120 y 180 posteriores a la finalización del protocolo de ejercicio, mostrando el grupo tratado con LCLT una mayor concentración de proteína fijadora. Además, el grupo tratado con LCLT demostró un área bajo la curva de concentración significativamente mayor que la del grupo tratado con placebo.
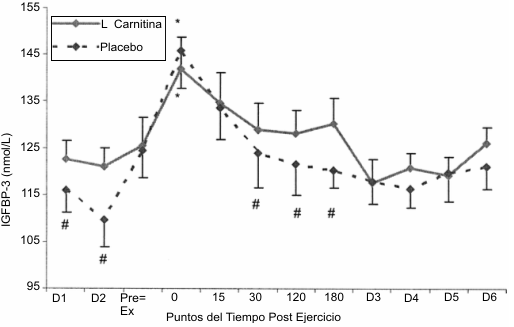
Figura 4. Respuesta de la proteína fijadora 3 del factor de crecimiento
tipo insulínico al protocolo de ejercicio consistente en la realización de
sentadillas. Se observaron incrementos significativos (p>0.05) por encima del
valor de reposo al minuto 0 postejercicio y se observaron diferencias entre la
condición placebo (línea punteada) y la condición L-carnitina L-tartrato (línea
sólida) en los días D1 y D2 y a los 30, 120 y 180 min post ejercicio.
Las respuestas de la testosterona al protocolo de ejercicio (Figura 5) mostraron incrementos significativos por encima de los valores de reposo a los 15 min post ejercicio. No se observaron diferencias entre las condiciones de tratamiento con LCLT y placebo.
Utilizando imágenes de MRI de secciones transversales del muslo medio en reposo como punto de comparación con los cambios post ejercicio para determinar los efectos del estrés inducido por el ejercicio de sobrecarga, se valoró el porcentaje de ruptura del tejido muscular en los días D3 y D6, obteniéndose valores del 23 ± 8 y 16 ± 5% para el grupo LCLT y del 39 ± 5 y 29 ± 6% para el grupo placebo, respectivamente. El porcentaje de ruptura del tejido muscular fue significativamente mayor en la condición de tratamiento con placebo. El delta de daño muscular entre los días D3 y D6 fue significativamente menor en la condición de tratamiento con LCLT.
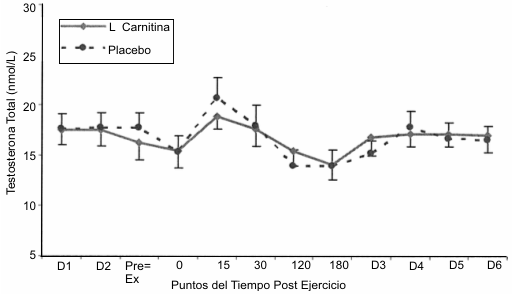
Figura 5. Respuesta de la testosterona al protocolo de ejercicio
consistente en la realización de sentadillas. Se observaron incrementos
significativos (p<0.05) por encima del nivel de reposo a los 15 min post
ejercicio y no se observaron diferencias significativas entre la condición
placebo (línea punteada) y la condición L-carnitina L-tartrato (línea sólida).
DISCUSION
La acumulación de LCLT en las células endoteliales capilares parece haber incrementado el transporte de oxígeno hacia los músculos activos mediante un efecto vasodilatador sobre los capilares, resultando en una reducción local de la hipoxia muscular característicamente observada durante el ejercicio. Esto parece haber reducido la magnitud del daño, evitado la formación de radicales libres y la ruptura del tejido muscular inducida químicamente (27). Un hallazgo importante realizado en esta investigación fue que la suplementación con LCLT redujo significativamente la proporción de daño muscular en un 7-10% del área, permitiendo que un mayor número de receptores celulares estabilizados estuvieran disponibles para realizar uniones de interacción y señales celulares para el incremento de la síntesis proteica o para provocar efectos anticatabólicos a nivel de los receptores. Este hallazgo puede proveer pistas claves respecto de los mecanismos de acción y los patrones de respuesta de las hormonas anabólicas circulantes. De esta manera, una mayor proporción de tejido no dañado pudo haber preservado su capacidad para realizar interacciones hormonales con el tejido muscular lo cual ayudaría a explicar la reducida progresión del daño tisular inducido químicamente que ocurrió entre los días D3 y D6 en el grupo tratado con LCLT y en comparación con la condición placebo.
Descubierto en 1957, la evolución de los estudios acerca del sistema de los IGF-1 ha mostrado que estos son una interfase hormonal importante para la dinámica metabólica, mitogénica y anabólica de las células en respuesta al estrés inducido por el ejercicio (23). Con la utilización de un período de suplementación con LCLT de 3 semanas, se observaron incrementos en la IGFP-3 en los días D1 y D2 y desde el minuto 30 al minuto 180 durante el período de recuperación luego de la realización del protocolo agudo de ejercicios. Concomitantemente no se observaron incrementos o efectos suplementarios con la concentración de IGF-1. La interpretación de estos hallazgos debe ser examinada al unísono debido a las íntimas interrelaciones de su función cibernética.
La IGFBP-3 es la proteína fijadora de IGF predominante en el suero de los adultos y más del 75% de la IGF-1 circula en un complejo ternario de 150 kD comprendido por la IGF-1, la IGFBP-3 y una subunidad de ácido lábil. Pequeñas proporciones de IGF-1 se encuentran unidas a proteínas fijadoras de menor peso molecular o en forma libre. Al parecer la IGFBP-3 es independiente de la regulación de la GH e inhibe la acción de los IGF-1 implicando que la IGFBP-3 puede modular la unión de los IGF-1 a sus receptores y por lo tanto afectar y titular las acciones biológicas. Esto esencialmente permite el secuestro de los IGF-1 desde sus receptores celulares cuando se produce el incremento en la proteína fijadora. Es el complejo libre y no ternario el que tiene un tamaño molecular aceptable como para pasar a través de las fenestraciones capilares y hacia el fluido extracelular para interactuar con la membrana celular para ejercer sus efectos. La IGFBP-3 puede incrementar y extender la vida media del complejo IGF-1/IGFBP-3 en 1-2 horas antes de que se produzca la degradación del complejo ternario. Por lo tanto, esta proteína fijadora ayuda a proveer un mecanismo para prolongar el período de tiempo en el cual la concentración de IGF-1 puede ser biológicamente dosificada para mejorar el ambiente celular de interacción con los IGF-1 libres. Este podría ser uno de los mecanismos hormonales que provea una interacción trófica más óptima y que influencie positivamente el metabolismo de las proteínas y mejore la reparación del tejido muscular. De esta manera, aunque no se observaron cambios en la concentración de IGF-1, la suplementación con LCLT aparentemente mejora la viabilidad, la vida media y la cinética biocompartimental de los IGF-1. Dichos hallazgos muestran que la suplementación con LCLT afecta el particionamiento del sistema de los IGF-1 de una manera tal que puede mejorar las interacciones celulares.
La falta de un incremento inducido por el ejercicio en las concentraciones de IGF-1 en respuesta al estrés agudo provocado por ele ejercicio puede también estar relacionada con que los sujetos que participaron en el presente estudios tenían un alto nivel de acondicionamiento. Esto esta respaldado por los hallazgos que han mostrado que el entrenamiento de sobrecarga tiene la capacidad de provocar el incremento en la concentración de IGF-1 (21). En estudios previos llevados a cabo por nuestro laboratorio, no hemos observado cambios o hemos observado incrementos en la respuesta a un protocolo de ejercicios de sobrecarga. Aunque pueden proponerse muchos factores relacionados con la composición del estrés provocado por el ejercicio como posibles razones de la falta de cambio con el ejercicio agudo, una observación importante es el hecho de que las concentraciones iniciales de IGF-1 pueden ser el factor más importante relacionado con el potencial para observar un incremento en la circulación inducido por el ejercicio (16, 18, 19). Una alta concentración inicial puede inhibir la capacidad de estimular un incremento adicional en la concentración de IGF-1 con el estrés inducido por el ejercicio debido a mecanismos de retroalimentación negativa o al menos enmascarar los pequeños cambios que pueden ocurrir en la pequeña ventana biológica de la máxima concentración endógena posible con el estrés inducido por el ejercicio. Las concentraciones halladas en el presente estudio fueron similares a las halladas en nuestros estudios previos en los cuales no se observaron incrementos en respuesta al estrés inducido por el ejercicio agudo de sobrecarga (16, 19) y fueron mucho mayores que los incrementos reportados en otras investigaciones previas (17, 18).
En el presente estudio no se observaron cambios en las concentraciones de GH inmunoreactiva o de GH inmunofuncional en respuesta a la suplementación con LCLT. Aunque solo unos pocos estudios han examinado las respuestas de la GH inmunofuncional concomitantemente con las respuestas de la GH inmunoreactiva al ejercicio de sobrecarga, se observó un esperado incremento con el estrés provocado por el ejercicio agudo de sobrecarga y la menor magnitud de las concentraciones de GH inmunofuncional en relación con las de la GH inmunoreactiva fueron consistentes con los hallazgos reportados por nuestro equipo de investigación (13, 22). El incremento en la concentración de GH es importante para las acciones somatogénicas y metabólicas que siguen al ejercicio de sobrecarga y se piensa que es uno de los factores principales que influencia las acciones anabólicas incluyendo la influencia sobre el sistema de los IGF-1 y sobre la testosterona. El ensayo inmunofuncional utilizado en esta investigación fue diseñado en base a que este ensayo detecta solo aquellas moléculas intactas que poseen ambos sitios 1 y 2, los cuales son requeridos para inducir la señal de transducción. A la inversa, el ensayo IRMA Nichols utilizado para determinar la concentración de GH inmunoreactiva utiliza anticuerpos monoclonales que interactúan con los epitopes de especificidad no conocida.
Interesantemente, las concentraciones de GH inmunofuncional fueron casi 10 veces menores en respuesta a este protocolo específico de ejercicios de sobrecarga, en comparación con nuestro trabajo previo en donde se utilizaron 10RM con una intensidad del 75% de 1RM. Esto podría respaldar la importancia de la carga para provocar señales hormonales anabólicas. Sin embargo, como hemos teorizado previamente, la importancia biológica de las otras variantes de la GH que no son capaces de dimerizar los receptores no puede ser desechada, ya que estas formas pueden tener un importante papel inhibitorio y modulador en la regulación de los eventos celulares (22). La reproducibilidad de la huella hormonal de la GH así como también de las otras hormonas analizadas en este estudio nuevamente muestra que se puede examinar las hormonas circulantes con una gran sensibilidad (19). Las concentraciones molares de las variantes hormonales de la GH tuvieron una mayor proporción de área no dañada de tejido muscular para interactuar durante la condición LCLT, derivando potencialmente en un mayor efecto anabólico (6). Esto puede ser un factor vital para las interacciones tanto de la biológicamente potente GH inmunofuncional como de la potencialmente potente GH inmunoreactiva con el tejido muscular. La manera en que los conjuntos de dichos monómeros de GH medidos mediante otros bioensayos (13) (i.e., isoformas de mayor peso molecular) responden a la suplementación con LCLT es una perspectiva faltante en el presente estudio respecto de la función pituitaria y la respuesta al ejercicio.
A diferencia de la interfase entre las hormonales peptídicas y el núcleo miocelular en los músculos esqueléticos la testosterona como hormona esteroide tiene una interacción más directa con los elementos regulatorios del ADN. Tanto en el tratamiento con LCLT como en el tratamiento con placebo se observó un incremento en la concentración sérica de testosterona en respuesta al estrés provocado por el ejercicio a los 15 min post ejercicio, demostrando al igual que la GH inmunofuncional, una reducción en la magnitud de la respuesta causada probablemente por la carga utilizada en el protocolo de ejercicio (16, 17, 19). No se observó un efecto absoluto de la suplementación con LCLT, pero nuevamente, más tejido muscular no dañado estuvo disponible para la interacción hormonal durante la condición LCLT. La importancia de este hecho recae en el mayor número de receptores que se encuentran estabilizados lo cual deriva en una mayor trascripción y en definitiva en una mayor síntesis proteica (15). De esta manera, la importancia de optimizar la interfase tisular para la interacción hormonal puede desempeñar un papel importante en la optimización de los patrones de recuperación del tejido muscular como tal como se demostrara con la suplementación con LCLT en el presente estudio y en nuestro estudio previo.
En resumen, las hormonas anabólicas estudiadas en el presente trabajo mostraron una impresionante reproducibilidad durante el transcurso de la investigación. La suplementación con LCLT ha mostrado previamente reducir el estrés hipóxico y el daño químico relacionado con el ejercicio y además ha reducido el nivel de inflamación probablemente por el menor daño tisular. Las concentraciones de IGFBP-3 fueron las que sufrieron los cambios más dramáticos en su patrón de respuesta a la suplementación con LCLT con nuestros propios voluntarios actuando como sus propios controles. El resultado neto parece ser una mayor preservación de la concentración de IGF-1 durante la recuperación así como también en los días posteriores al ejercicio. El patrón temporal respecto del incremento en la concentración de IGFBP-3 con la suplementación con LCLT y luego de la realización de ejercicios sigue siendo especulativo y requiere de mayor investigación. Cada una de las hormonas parece beneficiarse de la reducción en el daño tisular lo que permite que un mayor número de receptores intactos y viables estén disponibles para la interacción tanto directa (hormonas esteroides) como indirecta (hormonas peptídicas) con los elementos regulatorios del ADN relacionados con la síntesis proteica.
Aplicaciones Prácticas
La suplementación con LCLT ha demostrado reducir la cantidad de daño en el tejido muscular probablemente mediando una reducción en el daño hipóxico producido por los radicales libres que resultan en el daño químico característico observado días después de los eventos mecánicos asociados con el ejercicio de sobrecarga.
Parece haber una mejora en los mecanismos hormonales debido a la mayor viabilidad de los receptores para interactuar exitosamente con las señales hormonales anabólicas. Las concentraciones utilizadas en el presente estudio han mostrado ser seguras y estos datos proporcionan un respaldo adicional respecto de los efectos positivos de la LCLT como suplemento para la recuperación del estrés hipóxico inducido por el ejercicio.
Agradecimientos
Quisiéramos agradecer al dedicado grupo de sujetos que hicieron que este trabajo fuera posible y al staff del laboratorio por su ayuda con este proyecto. Este estudio fue apoyado en parte por una subvención otorgada por Lonza Inc., Fair Lawn, NJ.
Dirección para el Envío de Correspondencia
William J. Kraemer, Ph.D., correo electrónico: kraemer@uconnvm.uconn.edu
Referencias
1. Bacurau, R.F., F. Navarro, R.A. Bassit, M.O. Meneguello, R.V. Santos, A.L. Almeida, and L.F. Costa Rosa (2003). Does exercise training interfere with the effects of L-carnitine supplementation?. Nutrition. 19:337341
2. Barnett, C., D.L. Costill, M.D. Vukovich, K.J. Cole, B.H. Goodpaster, S.W. Trappe, and W.J. Fink (1994). Effect of L-carnitine supplementation on muscle and blood carnitine content and lactate accumulation during high-intensity sprint cycling. Int. J. Sport Nutr. 4:280288
3. Bhasin, S., T.W. Storer, N. Berman, C. Callegari, B. Clevenger, J. Phillips, T.J. Bunnell, R. Tricker, A. Shirazi, and R. Casaburi (1996). The effects of supraphysiologic doses of testosterone on muscle size and strength in normal men. N. Engl. J. Med. 335:17
4. Brass, E.P (2000). Supplemental carnitine and exercise. Am. J. Clin. Nutr. 72:618S623S
5. Brass, E.P., and W.R. Hiatt (1994). Carnitine metabolism during exercise. Life Sci. 54:13831393
6. Crist, D.M., G.T. Peake, R.B. Loftfield, J.C. Kraner, and P.A. Egan (1991). Supplemental growth hormone alters body composition, muscle protein metabolism and serum lipids in fit adults: Characterization of dose-dependent and response-recovery effects. Mech. Ageing Dev. 58:191205
7. Corbucci, G.G., G. Montanari, G. Mancinelli, and S. D'Iddio (1990). Metabolic effects induced by L-carnitine and propionyl-L-carnitine in human hypoxic muscle tissue damage during exercise. Int. J. Clin. Pharmacol. Res. 10:197202
8. Dudley, G.A., J. Czerkawski, A. Meinrod, G. Gillis, A. Baldwin, and M. Scarpone (1997). Efficacy of naproxen sodium for exercise-induced dysfunction muscle injury and soreness. Clin. J. Sport Med. 7:310
9. Giamberardino, M.A., L. Dragani, R. Valente, F. Di Lisa, R. Saggini, and L. Vecchiet (1996). Effects of prolonged L-carnitine administration on delayed muscle pain and CK release after eccentric effort. Int. J. Sports Med. 17:320324
10. Harper, P., C.E. Elwin, and G. Cederblad (1988). Pharmacokinetics of bolus intravenous and oral doses of L-carnitine in healthy subjects. Eur. J. Clin. Pharmacol. 35:6975
11. Heinonen, O.J (1996). Carnitine and physical exercise. Sports Med. 22:109132
12. Hymer, W.C., W.J. Kraemer, B.C. Nindl, J.O. Marx, D.E. Benson, J.R. Welsch, S.A. Mazzetti, J.S. Volek, and D.R. Deaver (2001). Characteristics of circulating growth hormone in women after acute heavy resistance exercise. Am. J. Physiol. Endocrinol. Metab. 281:E878887
13. Jones, J.I., and D.R. Clemmons (1995). Insulin-like growth factors and their binding proteins: Biological actions. Endocr. Rev. 16:334
14. Kadi, F (2000). Adaptation of human skeletal muscle to training and anabolic steroids. Acta Physiol. Scand. Suppl. 646:152
15. Kraemer, W.J., B.A. Aguilera, M. Terada, R.U. Newton, J.M. Lynch, G. Rosendaal, J.M.M. McBride, S.E. Gordon, and K. Hakkinen (1995). Responses of IGF-I to endogenous increases in growth hormone after heavy resistance exercise. J. Appl. Physiol. 79:13101315
16. Kraemer, W.J., S.E. Gordon, S.J. Fleck, L.J. Marchitelli, R. Mello, J.E. Dziados, K. Friedl, E. Harman, C. Maresh, and A.C. Fry (1991). Endogenous anabolic hormonal and growth factor responses to heavy resistance exercise in males and females. Int. J. Sports Med. 12:228235
17. Kraemer, W.J., L. Marchitelli, S.E. Gordon, E. Harman, J.E. Dziados, R. Mello, P. Frykman, D. McCurry, and S.J. Fleck (1990). Hormonal and growth factor responses to heavy resistance exercise protocols. J. Appl. Physiol. 69:14421450
18. Kraemer, W.J., J.S. Volek, J.A. Bush, M. Putukian, and W.J. Sebastianelli (1998). Hormonal responses to consecutive days of heavy-resistance exercise with or without nutritional supplementation. J. Appl. Physiol. 85:15441555
19. MacDougall, J.D., M.J. Gibala, M.A. Tarnopolsky, J.R. MacDonald, S.A. Interisano, and K.E. Yarasheski (1995). The time course for elevated muscle protein synthesis following heavy resistance exercise. Can. J. Appl. Physiol. 20:480486
20. Nindl, B.C., W.J. Kraemer, and W.C. Hymer (2000). Immunofunctional vs. immunoreactive growth hormone responses after resistance exercise in men and women. Growth Hormone IGF Res. 10:99103
21. Reiter, E.O., and R.G. Rosenfeld (1998). Normal and aberrant growth. In: Williams Textbook of Endocrinology (9th ed.). J.D. Wilson, D.W. Foster, H.M. Kronenberg, and P.R. Larson, eds. Philadelphia: W.B. Saunders Company, pp. 14271508
22. Rubin, M.R., J.S. Volek, A.L. Gomez, N.A. Ratamess, D.N. French, M.J. Sharman, and W.J. Kraemer (2001). Safety measures of L-carnitine L-tartrate supplementation in healthy men. J. Strength Cond. Res. 15:486490
23. Serge, G., E. Bianchi, M. Corsi, S. D'Iddio, O. Ghirardi, and F. Maccari (1988). Plasma and urine pharmacokinetics of free and short-chain carnitine after administration of carnitine in man. Drug Res. 38:18301834
24. Soop, M., O. Bjorkman, G. Cederblad, L. Hagenfeldt, and J. Wahren (1988). Influence of carnitine supplementation on muscle substrate and carnitine metabolism during exercise. J. Appl. Physiol. 64:23942399