Efectos del Dolor Muscular de Aparición Tardía sobre Respuestas Fisiológicas Seleccionadas en la Carrera Submáxima
Kristen E Scott1, Ralph Rozenek1, Hill A Crussemeyer1 y Michael G Lacourse1
Department of Kinesiology and Physical Education, California State University, Long Beach, Long Beach, California 90840, Estados Unidos.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2003.
Publicado 10 de agosto de 2005
Resumen
Palabras clave: dolor muscular de aparición tardía, escala de esfuerzo percibido, consumo de oxígeno, carrera en cin
INTRODUCCION
El dolor muscular de aparición tardía (DOMS) está definido como el dolor del músculo esquelético que ocurre luego de una actividad o ejercicio al que no se está acostumbrado (3). El inicio del dolor comienza de manera característica 12-24 horas después de la actividad, hace un pico 24-72 horas después y luego subsiste hasta que desaparece de 3-7 días después del ejercicio (3, 28). Frecuentemente los individuos que experimentan DOMS reportan dureza muscular, sensibilidad, pérdida de fuerza y tumefacción en los músculos asociados (9).
Varias teorías han intentado explicar los mecanismos del DOMS (4, 6, 11, 22, 24). Aunque los músculos implicados muestran evidencia de daño agudo de las fibras y la membrana muscular y reacciones inflamatorias (2, 20, 25, 30, 42), ninguna de estas respuestas comparten un período de tiempo o intensidad común con el dolor. Así, el estímulo exacto que produce el DOMS permanece poco claro (29). Sin embargo, parece que el trabajo excéntrico es más probablemente la causa del DOMS que el trabajo concéntrico o isométrico (9) y que la intensidad de la actividad juega un rol significativo en el desarrollo del DOMS sin tener en cuenta el tipo de contracción (14).
Ejercitarse mientras se experimenta DOMS es un acontecimiento común, aunque existe poca información con respecto a sus efectos mientras se realiza actividades de resistencia típicas. En los pocos estudios que han sido realizados parece haber alguna variabilidad en las respuestas cardiopulmonares y metabólicas reportadas en el ejercicio durante el DOMS. Hamill, et al. (19) no reportaron diferencias en el costo metabólico entre pruebas de carrera en cinta rodante submáxima en condiciones de dolor y de control. Un resultado similar fue observado por VanHeest, et al. (45), quienes encontraron poca diferencia en la economía de carrera entre un grupo placebo y otros dos grupos que tomaban o un agente antiinflamatorio solo o en combinación con un analgésico luego de la inducción de DOMS. Por otro lado, Gleeson, et al. (17) encontraron que el DOMS resultó en un mayor estrés de ejercicio relativo durante una ergometría submáxima en bicicleta ergométrica, como fue indicado por la mayor concentración de lactato sanguíneo, índice de intercambio respiratorio, frecuencia cardiaca, y escala de esfuerzo percibido. Sin embargo, el consumo de oxígeno no fue afectado. Más recientemente, Gleeson, et al. (16) examinaron el efecto del DOMS durante un protocolo máximo incremental en bicicleta ergométrica y encontraron que las concentraciones de lactato sanguíneo fueron mayores cuando los sujetos estaban experimentando DOMS.
Muchos atletas de resistencia, como los corredores, incorporan al entrenamiento de sobrecarga en sus programas generales de entrenamiento, y hay cierta evidencia que muestra que el mismo puede beneficiar el rendimiento de resistencia (33). Sin embargo, cuando el ejercicio de sobrecarga es adicionado a un programa, estos atletas pueden experimentar DOMS como resultado de no estar acostumbrados a la actividad de alta intensidad. Debido a la relativa falta de información con respecto a la realización de carrera mientras se experimenta DOMS, nuestro interés se centró en ver que efecto tendría el DOMS inducido por el entrenamiento de sobrecarga sobre las respuestas agudas a este modo de actividad de resistencia. La información obtenida a partir de este tipo de experimento puede afectar la forma en que los individuos entrenan y puede proporcionar ideas acerca del diseño de programas de ejercicio. De este modo, el propósito de este estudio fue comparar respuestas fisiológicas seleccionadas de los sujetos durante una carrera submáxima en cinta ergométrica de 30 minutos, antes y después de una sesión de ejercicio diseñada para inducir DOMS.
METODOS
Aproximación Experimental al Problema
Para dilucidar el interrogante de si el DOMS afecta las respuestas fisiológicas en la carrera submáxima en cinta rodante, sujetos varones y mujeres completaron dos sesiones de ejercicio submáximo de 30 minutos a una velocidad de carrera individualizada que resultó en una concentración de lactato sanguíneo (bLa) de 2.5mmol.L-1. Luego de la primera sesión de ejercicio, los sujetos realizaron una serie de ejercicios de sobrecarga diseñada para inducir DOMS en las extremidades inferiores. Veinticuatro a 30 horas después de la sesión de entrenamiento de sobrecarga, los sujetos completaron una sesión de ejercicio idéntica a la primera. La frecuencia cardiaca (FC), el consumo de oxígeno (VO2), el índice de intercambio respiratorio (RER), bLa, y el índice de esfuerzo percibido (RPE) fueron registrados a intervalos regulares durante ambas sesiones. Los valores para todas las mediciones fueron comparados para determinar si había diferencias en las respuestas entre las dos sesiones de ejercicio.
Sujetos
Inicialmente fueron evaluados dieciséis sujetos físicamente activos (8 varones y 8 mujeres) de entre 18 y 37 años de edad (X±DS=26.2±5.3 años), que corrían por lo menos 3 veces a la semana como parte de un programa de ejercicio regular. Un varón y 4 mujeres no fueron incluidos en los análisis finales, debido a dolor insuficiente o a problemas con la realización del protocolo de ejercicio. Así, 7 varones (X±DS=27.4±5.6 años) y 4 mujeres (X±DS=28.0±6.3 años) fueron incluidos en el análisis finales de los datos (Tabla 1). Todos los sujetos firmaron un consentimiento informado antes de la participación, y un comité de revisión institucional universitario para la protección de sujetos humanos aprobó todos los procedimientos. A los sujetos se les pidió que cumplieran las siguientes instrucciones antes de realizar todas las sesiones de evaluación: (a) abstenerse de ingesta de alcohol y de actividad física intensa por 24 horas; (b) evitar la ingesta de comida por al menos 2-3 horas; (c) permanecer bien hidratados; y (d) abstenerse del uso de cualquier tipo de medicación para el dolor (e.g., aspirina, ibuprofeno) o cualquier modalidad (e.g., hielo, masaje) que alivie el dolor o la sensación de dolor entre las sesiones de ejercicio.
Procedimientos de Laboratorio
Para determinar el ritmo de carrera apropiado para las sesiones de ejercicio submáximo subsiguientes, fue usado un protocolo en cinta rodante modificado de Astrand (27) hasta la fatiga volitiva. Durante las evaluaciones, fueron medidos el VO2, el RER, y la FC cada minuto. El equipo de análisis de gases (analizador de CO2, modelo 17630, modelo de analizador 17620; Vista System con software de análisis Turbo Fit; VacuMed, Ventura, CA) fue calibrado de acuerdo a especificaciones del fabricante antes de cada evaluación. El principal criterio usado para determinar el máximo consumo de oxígeno (VO2máx.) fue la observación de una meseta para el consumo de oxígeno. El segundo criterio implicó un RER mayor a 1.15, el logro de la frecuencia cardiaca máxima y/o una bLa que excediera 8.0mmol.L-1. Para la recolección de los datos de FC fue usado un monitor de la frecuencia cardiaca Polar Accurex II (Polar Electro, Oy, Finlandia).
Los sujetos reportaron su RPE usando la escala de Borg 6-20 (7). Cada sujeto estaba familiarizado con la escala antes de la evaluación. El RPE fue registrado una vez durante cada etapa de la evaluación máxima de ejercicio. Las concentraciones de lactato sanguíneo fueron analizadas con un analizador STAT glucosa/lactato (modelo 2300, Yellow Springs Instrument Co., Inc.; Yellow Springs, OH). El instrumento fue mantenido y calibrado de acuerdo a las instrucciones del fabricante. Las muestras sanguíneas fueron recolectadas usando el método del pinchazo en el dedo. La yema del dedo fue pinchada con una aguja estéril y descartable, y la muestra fue recolectada en una pipeta microcapilar de 100μl que contenía heparina.
La sangre fue inmediatamente transferida a un tubo de microcentrifugación que contenía anticuagulante (heparina, Li+/NaF), mezclada, y almacenada en un baño de hielo hasta los análisis. Cada muestra fue analizada en duplicado y en los análisis estadísticos fueron usados los promedios intra-análisis de las concentraciones de lactato.
Por lo menos una semana después de la determinación del VO2máx., todos los sujetos realizaron un ejercicio submáximo de resistencia en una cinta rodante durante 30 minutos a un ritmo que resultó en una bLa de aproximadamente 2.5mmol.L-1 durante el test máximo (T1). Este valor fue seleccionado debido a que correspondía a una intensidad de ejercicio que los sujetos pudieron mantener durante el período de tiempo prescrito y está por debajo de lo que es considerado el umbral del lactato.
Dentro de 3 horas después de la primera carrera de 30 minutos, cada sujeto realizó una serie de ejercicios submáximos para inducir dolor muscular. Fueron usados los siguientes ejercicios: sentadilla con barra, estocadas con carga, subidas y bajadas a un step con carga y peso muerto con piernas extendidas. Para el ejercicio de sentadilla, cada participante realizó una entrada en calor de 10 repeticiones con solamente la barra (20kg) y luego procedieron a realizar una serie de 10 repeticiones con el 50% de la masa corporal (BM), una serie de 10 repeticiones con el 75% de la masa corporal, y 2 series adicionales de 10 repeticiones de estocadas alternativas, mientras se sostenían mancuernas. La masa total de las mancuernas fue el 20-30% de la BM para las mujeres y 20-50% para los hombres. Las estocadas fueron seguidas por 3 series de 10 subidas y bajadas a cajones de madera (35cm), usando las mismas masas que las usadas durante las estocadas. El ejercicio final que fue utilizado fue el peso muerto con piernas rígidas. Los sujetos hicieron 3 series de 10 repeticiones usando una barra de 20kg. Las mujeres adicionaron 2.5-40kg, dependiendo de la fuerza del individuo, y los hombres adicionaron 10-85kg. A través de todo el protocolo de sobrecarga, los sujetos fueron monitoreados para que realizaran los ejercicios correctamente y en el rango de movimiento correcto y fueron asistidos cuando fue necesario. El descanso entre las series fue de 1 a 2 minutos, y a los sujetos se les permitió hacer estiramientos estáticos entre las series.
En este estudio fue desarrollado un inventario de dolor en base a una escala análoga visual (VAS). Ha sido demostrado que el VAS es confiable y válido en una investigación previa (36). Los sujetos valoraron el dolor en una línea de 75mm que decía “ningún dolor” en un extremo de la escala y “el peor dolor que podría tener” en el otro extremo. La valoración del dolor fue hecha para cada uno de los siguientes músculos y grupos musculares: cuadriceps, isquiotibiales, y glúteos. Además, a los sujetos se les pidió que valoraran su sensación general de dolor.
Los sujetos valoraron su dolor para cada uno de los sitios en reposo antes de la sesión de ejercicio de sobrecarga como medición inicial. Veinte, 24, 36 y 60 horas después de la sesión de ejercicio de sobrecarga, los sujetos valoraron el grado de dolor en cada sitio y el dolor total tanto en reposo y mientras hacían movimientos que imitaban los ejercicios usados en el protocolo de inducción de DOMS. De treinta y cuatro a 30 horas luego de la actividad de sobrecarga, los sujetos realizaron un protocolo de ejercicio idéntico a la primera carrera de 30 minutos, y fueron tomados los mismos registros (T2). Para asegurar que los sujetos estuvieran suficientemente doloridos en T2, solo fueron evaluados aquellos sujetos que reportaron niveles de dolor de al menos 50% del máximo dolor total máximo percibido 24-30 horas después del ejercicio para inducir dolor.
Análisis Estadísticos
Todos los datos fueron analizados usando el SPSS versión para PC (Statistical Package for Social Sciences, Chicago, IL). Fue usado un análisis de varianza para mediciones repetidas dentro de los sujetos 2 x 6 (ANOVA) para el VO2, FC, RER, y bLa. Para el RPE, fue usado un diseño experimental ANOVA de mediciones repetidas dentro de los sujetos 2 x 5. Cuando fueron observadas diferencias significativas, fue conducido un test ANOVA de un solo factor entre T1 y T2 en cada medición de tiempo para determinar donde ocurrieron las diferencias. La significancia estadística fue establecida a un nivel p≤0.05.
RESULTADOS
No fueron observadas diferencias significativas entre los sexos para ninguna de las variables, por lo que todos los sujetos fueron analizados como un solo grupo. El dolor fue seguido durante un período de 60 horas después de la inducción. El dolor hizo un pico para todos los grupos musculares entre 24 y 36 horas (Figura 1).
Como se observa en la Figura 2, la FC se incrementó significativamente desde el reposo hasta el minuto 6 y continuó incrementándose gradualmente a través de todo el descanso del período de ejercicio. La respuesta de la FC durante T2 fue significativamente mayor, en comparación con T1 en los minutos 6 y 12. Más allá del minuto 12, no hubo diferencias significativas entre las dos pruebas.
El VO2 se incrementó significativamente desde el descanso hasta el minuto 6 en ambos grupos y luego del minuto seis continuó incrementándose gradualmente a través de toda la carrera de 30 minutos. Sin embargo, no hubo diferencias significativas entre T1 y T2 (Figura 2b).
La Figura 2c muestra una disminución total significativa en el RER desde el reposo hasta el minuto 30, comenzando con un incremento pequeño desde el reposo hasta el minuto seis. No fueron observadas diferencias significativas entre T1 y T2 en ningún punto de tiempo. Las concentraciones de lactato sanguíneo se incrementaron significativamente desde el reposo hasta el minuto 6 en ambas pruebas. Sin embargo, no fueron observadas diferencias significativas entre las pruebas en ningún punto de tiempo (Figura 2d).
El RPE se incrementó significativamente a través de toda la carrera de 30 minutos en ambos grupos (Figura 3). Hubo una diferencia significativa entre las pruebas para T1, con valores de RPE significativamente más altos durante T2 para cada período de registro.
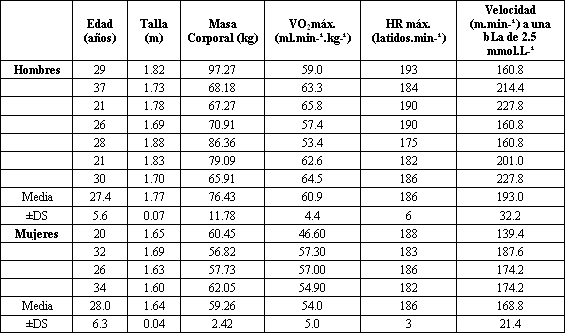
Tabla 1. Características físicas de los sujetos.
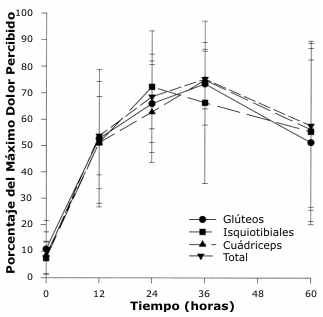
Figura 1. Relación entre el porcentaje del máximo dolor percibido y el tiempo.
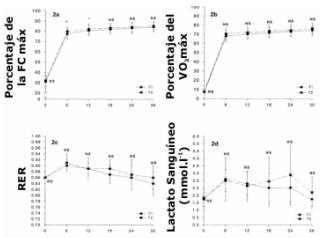
Figura 2. 2a) Relación entre el porcentaje de la frecuencia cardiaca máxima (%
FC máx.) y el tiempo de ejercicio (tiempo); 2b) Relación entre el porcentaje del
máximo consumo de oxígeno (% VO2máx.) y el tiempo de ejercicio
(tiempo); 2c) Relación entre el índice de intercambio respiratorio (RER) y el
tiempo de ejercicio (tiempo); y 2d) Relación entre la concentración de lactato
sanguíneo (lactato sanguíneo) y el tiempo. T1=prueba pre-DOMS. T2=prueba durante
el DOMS. El asterisco (*) indica diferencias significativas (p<0.05) entre las
pruebas. NS=sin diferencias significativas entre las pruebas.
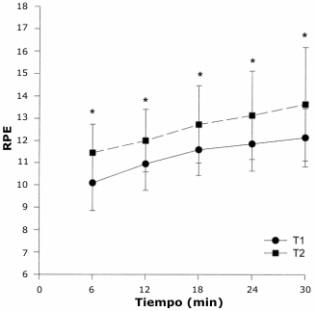
Figura 3. Relación entre el índice de esfuerzo percibido (RPE) y el tiempo de
ejercicio (tiempo). T1=prueba pre-DOMS. T2=prueba durante el DOMS. Un asterisco
(*) significa diferencias significativas (p<0.05) entre pruebas. NS=diferencia
no significativa entre pruebas.
DISCUSION
Se pensaba que el daño de la masa muscular y el dolor, asociados con el DOMS podrían posiblemente afectar el consumo de oxígeno durante el ejercicio submáximo, ya sea, alterando la eficiencia mecánica o la eficiencia metabólica. En base a los presentes resultados, el consumo de oxígeno submáximo no parece ser afectado. Los resultados coinciden con 2 estudios previos que encontraron que el DOMS tiene poco efecto sobre el VO2 mientras se realiza 15 minutos de carrera (19) o bicicleta (17) al 80% del VO2máx. Cuando se analizan juntos, estos datos sugieren que el DOMS no afecta la eficiencia metabólica como se midió por medio del VO2 durante los esfuerzos submáximos en la carrera o el ciclismo. Diferentes posibles explicaciones pueden dar cuenta de la falta de efecto observada en el VO2: (a) el daño muscular extensivo fue insuficiente para producir cambios mecánicos o fisiológicos que pudieran alterar el VO2; (b) las fibras musculares no dañadas pueden haber sido reclutadas a partir del pool de fibras disponibles y fueron capaces de compensar a cualquiera de las fibras dañadas; y (c) los ejercicios de sobrecarga usados para inducir DOMS no fueron suficientes para afectar las respuestas de la actividad de carrera.
Las concentraciones de lactato sanguíneo y el RER no fueron significativamente diferentes entre las dos pruebas en ninguno de los períodos de tiempo. Las velocidades de carrera fueron determinadas por medio de una concentración de bLa de 2.5mmol.L-1, siendo esta intensidad de aproximadamente el 67% del VO2máx. Esta intensidad de ejercicio esta debajo de lo que muchos consideran ser el umbral anaeróbico (8). En contraste, Gleeson et al. (17) encontraron una bLa elevada mientras se experimentaba DOMS. En su estudio, el ejercicio submáximo fue realizado al 80% del VO2máx. o justo debajo de lo que ellos consideraron que era el “umbral anaeróbico”. Generalmente se cree que las fibras musculares tipo I son las primeras en ser reclutadas a intensidades por debajo del umbral anaeróbico, pero a intensidades más altas las fibras tipo II son reclutadas (1, 18). A la intensidad y duración usadas en el presente estudio, las fibras musculares tipo I serían las que más probablemente fueron reclutadas. Investigaciones previas han mostrado que las fibras tipo II pueden ser más susceptibles al daño a partir de la actividad excéntrica, en comparación con las fibras tipo I (5, 23). Las fibras tipo I pueden no haber sido afectadas; así manteniendo los patrones de reclutamiento y la función metabólica normales. Sin embargo, a intensidades de ejercicio más altas en las cuales es necesaria una mayor producción de fuerza, puede haber una mayor dependencia sobre las fibras tipo II no dañadas lo que conduce a elevaciones en la bLa (16, 17). Ha sido sugerido que los patrones de utilización de combustible pueden ser adaptables y pueden ser alterados para compensar cualquier incremento en la economía de carrera como resultado de los ajustes mecánicos mientras se experimenta DOMS (19). La falta de un efecto sobre la bLa y el RER indica que los patrones de utilización de combustible no fueron alterados, al menos bajo las presentes condiciones experimentales.
El DOMS parece tener su mayor efecto sobre la percepción del esfuerzo. El efecto significativo del DOMS en el RPE indica que, a pesar de la faltad de cambios significativos en las mediciones fisiológicas y metabólicas seleccionadas, los individuos percibieron que ejercitarse mientras se experimentaba DOMS era más difícil. Ha sido sugerido que el esfuerzo percibido es el mejor indicador del grado de estrés físico, debido a que el mismo integra signos, percepciones, y experiencias en una “configuración de agotamiento percibido” (7). Los sistemas que modulan la percepción del dolor están estrechamente asociados con la función cardiovascular que controlan (37). Los factores locales que se originan desde la piel, los músculos y las articulaciones, así como los factores metabólicos centrales relacionados a las sensaciones de los órganos de la circulación y la respiración pueden contribuir a la percepción del esfuerzo (13, 34). Robertson (38) reportó que la señal sensorial principal del RPE proviene de los factores locales, y los factores centrales pueden modificar la señal local en proporción a la demanda cardiopulmonar. La molestia reportada en el inventario de dolor es evidencia de dolor muscular local, y de disminución de la capacidad de producir fuerza (3, 10, 28, 30). Estos factores locales podrían ser los que causaron que los sujetos reporten una mayor percepción del esfuerzo durante T2. Slauber (41) sugirió que, durante el DOMS y el daño muscular asociado, el sistema nervioso central puede evocar una estrategia de control alternativa que distribuye la producción de fuerza en un mayor número de fibras musculares. El uso de un mayor número de fibras musculares pude ser percibido como un incremento en el esfuerzo y resultar en una elevación del RPE. Es también posible que la función neuromuscular fuera modificada por medio de los receptores aferentes localizados en los músculos esqueléticos y los tendones, que pueden haber estado dañados como resultado del DOMS (40). Otra posible explicación para el mayor RPE observado durante T2, es que los sujetos podrían haber tenido una mayor probabilidad de sobreestimar la producción de fuerza mientras se experimentaba dolor muscular.
Ha sido demostrado que la actividad física proporciona cierto alivio para el DOMS (2, 11). Al inicio del ejercicio, la respuesta promedio de la FC durante T2 estuvo elevada, en comparación con la respuesta en T1, pero la misma fue afectada solo durante los primeros 12 minutos de ejercicio. De este modo es posible que al ritmo que los sujetos estaban corriendo, los primeros 12 minutos sirvieron como un período extendido de entrada en calor, tiempo después del cual los sujetos experimentaron algún alivio de su rigidez y dolor muscular.
Un número de estudios ha encontrado una alta correlación entre la FC y el RPE (12, 15, 35, 39). Sin embargo, existe un cuerpo de evidencia substancial que refuta la relación directa entre las dos variables (13, 21, 26, 31, 32). Los resultados del presente estudio indicarían que el DOMS altera la relación entre la FC y el RPE. Con respecto a la bLa, diferentes estudios han sugerido el uso del RPE como medio de estimación del umbral del lactato y la bLa (43, 44). La elevación del RPE durante T2 en ausencia de cambios en la bLa indicaría que durante el DOMS el RPE puede no reflejar exactamente la bLa, como ha sido previamente reportado.
Aplicaciones Prácticas
Cuando los atletas entrenados en resistencia adicionan entrenamiento de la fuerza a sus programas de entrenamiento, probablemente pueden experimentar DOMS como resultado de la actividad no familiar y de la alta intensidad. Los hallazgos de este estudio sugieren que aunque las personas que están experimentando dolor muscular pueden percibir un mayor esfuerzo cuando corren a un ritmo submáximo, en comparación a cuando corren y no están doloridas, las respuestas fisiológicas medidas no parecen ser diferentes. Sin embargo, el peligro de lesión o sobreentrenamiento no debería ser pasado por alto. Cuando un individuo experimenta DOMS y percibe que el esfuerzo es más intenso que lo usual, sería apropiado un entrenamiento de baja intensidad.
Con respecto a los programas de entrenamiento que utilizan el RPE para determinar la intensidad de entrenamiento, el DOMS parece afectar la percepción del esfuerzo relativo a las respuestas fisiológicas medidas asociadas, de modo que los cambios en el RPE pueden no reflejar exactamente la FC o la bLa. Los individuos que entrenan usando mediciones de FC o bLa para propósitos de entrenamiento deberían hacer los ajustes apropiados en sus intensidades de entrenamiento si están experimentando DOMS.
Referencias
1. Abernathy, P.J., R. Thayer, and A.W. Taylor (1990). Acute and chronic responses of skeletal muscle to endurance and sprint training. Sports Med. 10: 365389
2. Abraham, W.M (1977). Factors in delayed muscle soreness. Med. Sci. Sports. 9: 1120
3. Armstrong, R.B (1984). Mechanisms of exercise-induced delayed onset muscular soreness: A brief review. Med. Sci. Sports Exerc. 16: 529538
4. Asmussen, E (1956). Observations on experimental muscular soreness. Acta Rheum. Scand. 2:109116
5. Asp, S., J.R. Daugaard, S. Kristiansen, B. Kiensand, and E.A. Richter (1998). Exercise metabolism in human skeletal muscle exposed to prior exercise. J. Physiol. (Lond.). 509:305313
6. Barlas, P., D.M. Walsh, G.D. Baxter, and J.M. Allen (2000). Delayed onset muscle soreness: Effect of an ischaemic block upon mechanical allodynia in humans. Pain. 87:221225
7. Borg, G.A.V (1982). Psychophysical bases of perceived exertion. Med. Sci. Sports Exerc. 14:377381
8. Bourdon, P (2000). Blood lactate transition thresholds: Concepts and controversies. In: Physiological Tests for Elite AthletesAustralian Sports Commission. J. Gore, ed. Champaign, IL: Human Kinetics. pp. 5065
9. Clarkson, P.M., and D.J. Newham (1995). Associations between muscle soreness, damage, and fatigue. Adv. Exp. Med. Biol. 384:45769
10. Davies, C.T.M., and M.J. White (1981). Muscle weakness following eccentric work in man. Pflugers Arch. Eur. J. Physiol. 392:168171
11. Devries, H.A (1966). Quantitative electromyographic investigation of the spasm theory of muscle pain. Am. J. Phys. Med. 45:119134
12. Edwards, R.H.T., A. Melcher, C.M. Hesser, O. Wigertz, and L.G. Ekelund (1972). Physiological correlates of perceived exertion in continuous and intermittent exercise with the same average power output. Eur. J. Clin. Invest. 2:108114
13. Ekblom, B., and A.N. Goldbarg (1971). The influence of training and other factors on the subjective rating of perceived exertion. Acta Physiol. Scand. 83:399406
14. Fitzgerald, G.K., J.M. Rothstein, T.P. Mayhew, and R.L. Lamb (1991). Exercise-induced muscle soreness after concentric and eccentric isokinetic contractions. Phys. Ther. 71:505513
15. Gamberale, B (1972). Perceived exertion, heart rate, oxygen uptake, and blood lactate in different work operations. Ergonomics. 15:323332
16. Gleeson, M., A.K. Blannin, N.P. Walsh, C.N.E. Field, and J.C. Pritchard (1998). Effect of exercise-induced muscle damage on the blood lactate response to incremental exercise in humans. Eur. J. Appl. Physiol. 77:292295
17. Gleeson, M., A.K. Blannin, B. Zhu, S. Brooks, and R. Cave (1995). Cardiorespiratory, hormonal, and haematological responses to submaximal cycling performed 2 days after eccentric or concentric exercise bouts. J. Sports Sci. 13:471479
18. Gollnick, P.D., K. Piehl, and B. Saltin (1974). Selective glycogen depletion pattern in human muscle fibres after exercise of varying intensity and at varying pedaling rates. J. Physiol. 241:4557
19. Hamill, J., P.S. Freedson, P.M. Clarkson, and B. Braun (1991). Muscle soreness during running: Biomechanical and physiological considerations. Int. J. Sports Biomech. 7:125137
20. Hamlin, M.J., and B.M. Quigley (2001). Quadriceps concentric and eccentric exercise 2: Differences in muscle strength, fatigue, and EMG activity in eccentrically exercised sore and non-sore muscles. J. Sci. Med. Sport. 4:105115
21. Henriksson, J., H.G. Knuttgen, and F. Bonde-Peterson (1972). Perceived exertion during exercise with concentric and eccentric muscle contractions. Ergonomics. 15:537544
22. Hough, T (1902). Ergographic studies in muscular soreness. Am. J. Physiol. 7:7692
23. Jones, D.A., D.J. Newham, J.M. Round, and S.E. Tolfree (1986). Experimental human muscle damage: Morphological changes in relation to other indices of damage. J. Phyisol. (Lond.). 375:435448
24. Komi, P.V., and E.R. Buskirk (1972). The effect of eccentric and concentric muscle activity on tension and electrical activity of human muscle. Ergonomics. 15:417434
25. MacIntyre, D.L., S. Sorichter, J. Mair, A. Berg, and D.C. McKenzie (2001). Markers of inflammation and myofibrillar proteins following eccentric exercise in humans. Eur. J. Appl. Physiol. 84:180186
26. Martin, D.T., and M.B. Anderson (2000). Heart rate-perceived exertion relationship during training and taper. J. Sports Med. Phys. Fitness. 40:201208
27. McArdle, W.D., F.I. Katch, and V.L. Katch (1996). Exercise Physiology: Energy, Nutrition, and Human Performance (4th ed). Baltimore: Williams & Wilkins. p. 202
28. Miles, M.P., and P.M. Clarkson (1994). Exercise-induced muscle pain, soreness, and cramps. J. Sports Med. Phys. Fitness. 34:203216
29. Newham, D.J (1988). The consequences of eccentric contractions and their relationship to delayed onset muscle pain. Eur. J. Appl. Physiol. 57:353359
30. Newham, D.J., K.R. Mills, B.M. Quigley, and R.H.T. Edwards (1983). Pain and fatigue after concentric and eccentric muscle contractions. Clin. Sci. 64:5562
31. Noble, B., K. Metz, K. Pandolf, C. Bell, E. Cafarelli, and W. Sime (1973). Perceived exertion during walking and runningII. Med. Sci. Sports. 5:116120
32. O'Connor, P.J., W.P. Morgan, and J.S. Raglin (1991). Psychobiologic effects of 3 d of increased training in female and male swimmers. Med. Sci. Sports Exerc. 23:10551061
33. Paavolainen, L., K. Hakkinen, I. Hamalainen, A. Nummela, and H. Rusko (1999). Explosive-strength training improves 5-km running time by improving running economy and muscle power. J. Appl. Physiol. 86:15271533
34. Pandolf, K.B (1982). Differentiated ratings of perceived exertion during physical exercise. Med. Sci. Sports Exerc. 14:397405
35. Perry, S.R., T.J. Housh, G.O. Johnson, K.T. Ebersole, A.J. Bull, T.K. Evetovich, and D.B. Smith (2001). Mechanomyography, electromyography, heart rate, and ratings of perceived exertion during incremental cycle ergometry. J. Sports Med. Phys. Fitness. 41:183188
36. Price, D.D., P.A. McGrath, A. Rafii, and B. Buckingham (1983). The validation of visual analogue scales as ratio scale measures for chronic and experimental pain. Pain. 17:4556
37. Randich, A., and W. Maixner (1984). Interactions between cardiovascular and pain regulatory systems. Neurosci. Biobehav. Rev. 8:343367
38. Robertson, R.J (1982). Central signals of perceived exertion during dynamic exercise. Med. Sci. Sports Exerc. 14:390396
39. Sargeant, A.J., and C.T.M. Davies (1973). Perceived exertion during rhythmic exercise involving different muscle masses. J. Hum. Ergonomics. 2:311
40. Saxton, J.M., P.M. Clarkson, R. James, M. Miles, M. Westerfer, S. Clark, and A.E. Donnelly (1995). Neuromuscular dysfunction following eccentric exercise. Med. Sci. Sports Exerc. 27:11851193
41. Stauber, W.T (1989). Eccentric action of muscles: Physiology, injury, and adaptation. Exerc. Sport Sci. Rev. 17:157185
42. Stauber, W.T., P.M. Clarkson, V.K. Fritz, and W.J. Evans (1990). Extracellular matrix disruption and pain after eccentric muscle action. J. Appl. Physiol. 69:868874
43. Steed, J., G.A. Gaesser, and A. Weltman (1994). Rating of perceived exertion and blood lactate concentration during submaximal running. Med. Sci. Sports Exerc. 26:797803
44. Stoudemire, N.M., L. Wideman, K.A. Pass, C.L. McGinness, G.A. Gaesser, and A. Weltman (1996). The validity of regulating blood lactate concentration during running by ratings of perceived exertion. Med. Sci. Sports Exerc. 28:490495
45. Vanheest, J.L., J. Stoppani, T.P. Scheett, V. Collins, M. Roti, J. Anderson, G.J. Allen, J. Hoffman, W.J. Kraemer, and C.M. Maresh (2002). Effects of ibuprofen and Vicoprofen on physical performance after exercise-induced muscle damage. J. Sports Rehabil. 11:224234