Efectos del Ejercicio sobre el Metabolismo de las Proteínas
Laboratorio de Investigación en Fisiología Aplicada Escuelas de Ciencias Biomédicas y Ejercicio, Recreación, & Deporte Universidad Estatal de Kent, Kent, OH, USA.
Artículo publicado en el journal PubliCE, Volumen 0 del año 1997.
Publicado 2 de junio de 2008
Resumen
Palabras clave: oxidación de aminoácidos, proteínas, necesidades de proteínas, ejercicio
INTRODUCCION
Durante al menos 150 años los científicos han estudiado el uso de los combustibles en distintos tipos de ejercicio físico. Durante este tiempo, hubo bastante debate con relación a la importancia de las proteínas para los individuos que realizan ejercicios físicos en forma regular. En realidad, desde la mitad del siglo XIX, el entendimiento del rol de las proteínas en el metabolismo del ejercicio ha cambiado dramáticamente varias veces. Hacia mediados de ese siglo se pensaba que las proteínas eran el combustible principal para la contracción muscular (von Liebig, 1842) y, consecuentemente, es entendible que los deportistas de entonces consumieran grandes cantidades de proteínas. Sin embargo, distintos estudios llevados a cabo durante la última mitad del siglo XIX, y primer cuarto del siglo XX (revisados en Cathcart, 1925), revelaron que las proteínas cumplían un papel mucho más pequeño en términos de combustible para el ejercicio (contribuyendo < 10 % del gasto energético durante la actividad). Como resultado, al menos en la comunidad científica, la idea con respecto a la importancia de las proteínas para el metabolismo energético se revirtió totalmente (cambiando de contribuyente principal a no tener virtualmente ninguna contribución). En base a estos datos, se creyó que el ejercicio no aumentaba la necesidad de proteínas alimentarias. No se sabe por qué la contribución de proteínas fue considerada poco importante, pero probablemente fue una hiper-reacción a la nueva información (que era bastante diferente del punto de vista a la que prevalecía hasta ese momento), o quizás simplemente una idea de que la cantidad de proteínas consumida normalmente era suficiente para cubrir esta necesidad. En cualquier caso, fue tan dominante la idea de que las necesidades de proteínas alimentarias no estaban afectadas por el ejercicio físico, que la gran mayoría de los trabajos metabólicos, a lo largo de los primeros tres cuartos del siglo XX, se concentró en los carbohidratos y las grasas y, como resultado, ignoraron casi totalmente el rol de las proteínas (Astrand & Rodahl, 1977).
Comenzando en los años 70’, primero esporádicamente (Felig &Wahren, 1971; Poortmans, 1975; Haralambie & Berg, 1976; Dohm et al., 1977; Lemon & Mullin, 1980; Lemon & Nagle, 1981; White & Brooks, 1981; Lemon et al., 1982), y luego más regularmente (para revisión, ver Lemon 1997), comenzaron a aparecer estudios que sugerían que las ingestas de proteínas, en cantidades que exceden las recomendaciones para personas sedentarias, podrían ser beneficiosas para aquellos que realizaban ejercicios intensos en forma regular. Sin embargo, el tema de los efectos del ejercicio sobre los requerimientos de proteínas es extremadamente complejo, y aún no existe un consenso absoluto (Lemon, 1987; Butterfield, 1991; Lemon, 1991; Evans, 1993; Rennie et al., 1994; Millward et al., 1994; Lemon, 1996). Además, este tema se ha complicado por el hecho de que las recomendaciones alimentarias para las proteínas en distintos países, no tratan adecuadamente este tema ya que están basadas principalmente en estudios con sujetos sedentarios. Por otro lado, algunas recomendaciones no se han actualizado. Por ejemplo, no sólo las recomendaciones actuales en los Estados Unidos fueron publicadas hace muchos años, sino que además no tienen ni una sola referencia sobre este tema después de 1977 (Comité de Alimentos & Nutrición de los EEUU, 1989). Muchos estudios han examinado los efectos del ejercicio sobre los requerimientos alimentarios de proteínas. Es interesante observar que durante todo este período de tiempo, independientemente de la opinión científica, muchos deportistas (especialmente aquellos comprometidos en actividades de fuerza y potencia), han consumido en forma rutinaria grandes cantidades de proteínas (300-775 % de la RDA o Reccomended Dietary Allowance; o sea, margenes dietarios máximos recomendables) (Steen, 1991; Kleiner et al., 1994).
Teniendo en cuenta esta perspectiva, el presente artículo hace una revisión de algunos de los resultados experimentales más recientes, pone de relieve varios cuestionamientos metodológicos que podrían comprometer algunos de los datos, examina la poca información existente sobre si la suplementación con proteínas mejora o no el rendimiento deportivo, y considera distintos posibles mecanismos responsables, con el fin de poder entender de qué manera el ejercicio físico afecta los requerimientos de proteínas.
SIMPLIFICACION DEL MECANISMO DE LAS PROTEINAS
En la Figura 1 se muestra brevemente, cómo el organismo metaboliza las proteínas. A pesar de que el “pool” de aminoácidos libres contiene solamente un porcentaje muy pequeño de los aminoácidos del cuerpo (la gran mayoría está en las proteínas de los tejidos), en la Figura 1, por el tamaño y la ubicación central de la esfera, se indica el rol importante de los aminoácidos libres en el organismo (a través del cual todos deben pasar). Fisiológicamente, hay sólo tres caminos por los cuales los aminoácidos pueden entrar en el “pool” libre (a través de las proteínas alimentarias durante la digestión, por la ruptura de proteínas en los tejidos, o como aminoácidos no indispensables (no esenciales) formados en el cuerpo a partir de NH3 y una fuente de carbono; números 1, 2, y 3, respectivamente, en la Figura 1). Por supuesto, algunos aminoácidos consumidos nunca llegan a ser absorbidos (se pierden con la materia fecal), y en el laboratorio es posible un cuarto método (a través de la infusión de aminoácidos). Cuando se estudian los aminoácidos indispensables (esenciales), la ruta 3 es eliminada ya que estos aminoácidos no pueden ser formados en el cuerpo.
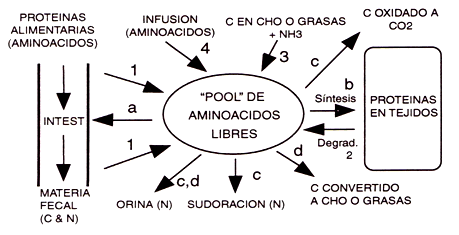
Figura 1. Esquema simplificado del metabolismo de las proteínas. La entrada de aminoácidos en el “pool” libre se muestra con números, y la salida de los mismos, con letras. Las mediciones del balance nitrogenado involucran la cuantificación de la diferencia entre toda la ingesta y excreción de nitrógeno, mientras que la medición del “turnover” de proteínas permite la estimación de los procesos involucrados, es decir la síntesis y la degradación total de proteínas corporales totales (adaptado de Lemon et al, 1995)
Una vez en el “pool” libre, también existen cuatro vías por las cuales los aminoácidos pueden metabolizarse (reabsorción en el intestino, incorporación en forma de proteínas en los tejidos, oxidación [nitrógeno eliminado por la orina o sudoración; el carbono por la respiración], o incorporarse en carbohidratos o grasas como reservorio de energía [el nitrógeno amino es eliminado por la orina]: letras A, B, C, y D, respectivamente en la Figura 1). Durante el ejercicio, las rutas A (debido a la redistribución sanguínea) y D (debido al estímulo catabólico) no son consideradas importantes. Con el tiempo, luego de la infusión constante o de la ingesta reiterada de un aminoácido “marcado” representativo (indicador o trazador isotópico) se puede obtener un equilibrio isotópico; por ejemplo, la entrada al “pool” libre iguala a la salida, y se puede medir el movimiento del aminoácido “marcado” a través del sistema (“turnover”, o flujo). Esto sólo requiere una mínima invasión porque los valores en los tejidos (enriquecidos) se pueden estimar a partir de muestras en sangre [modelo de “pool” recíproco (Matthews et al., 1982; Horber et al., 1989)] o en orina (la presunción es que el enriquecimiento urinario es representativo del producto final de la ruptura de proteínas). Combinando estos datos con la ingesta alimentaria (y la tasa de infusión, si es aplicable), y/ o con mediciones de la oxidación (requiere muestras de la respiración), es posible estimar las tasas totales de degradación de proteínas (“turnover” [o flujo] - ingesta + infusión = degradación), o las tasas de síntesis de proteínas totales del cuerpo (i.e., pérdida no oxidativa) (turnover - oxidación o excreción urinaria = síntesis) (Picou & Talyor-Roberts, 1969). Tradicionalmente, el nivel total de nitrógeno del cuerpo se ha evaluado por una técnica conocida como balance de nitrógeno. Esta comprende la medición de comidas duplicadas a aquellas consumidas por los sujetos experimentales, con el fin de cuantificar de manera precisa la ingesta de nitrógeno (el consumo de proteínas es estimado suponiendo que el contenido promedio de nitrógeno del alimento es del 16 % (i.e., multiplicando la ingesta de nitrógeno por 6.25), todas las rutas de excreción del nitrógeno (normalmente sólo se miden la orina y la materia fecal, y las pérdidas misceláneas, incluyendo pérdidas estimadas a través de la piel), y luego calculando la diferencia entre las dos. La estimación de las pérdidas misceláneas de nitrógeno normalmente es adecuada, ya que en individuos sedentarios son pequeñas, bastante consistentes, y extremadamente difíciles de medir completamente. Sin embargo, con el ejercicio, la eliminación de nitrógeno por la piel a través de la sudoración debería ser cuantificada, ya que puede ser sustancial (Consolzio et al., 1963; Lemon & Mullin, 1980). Cuando la ingesta de nitrógeno excede el total excretado, el sujeto está en balance positivo de nitrógeno (el balance negativo se da cuando la excreción excede el consumo). Esta última situación no puede prolongarse durante mucho tiempo sin efectos adversos ya que, al contrario de los carbohidratos y las grasas, el organismo no contiene una reserva energética de proteínas (todas las proteínas corporales tienen un rol estructural o funcional) y, consecuentemente, esto lleva a pérdidas de componentes corporales esenciales. Aunque la descripción de balances positivos/negativos son un lugar común en la literatura, es recomendable el uso del término estatus o estado, en sustitución y para evitar los términos de balance positivo o negativo.
El balance de nitrógeno es una técnica clásica que ha sido utilizada en la gran mayoría de los estudios, considerados por Comités de Expertos en distintos países, para la determinación de los márgenes alimenticios recomendados para las proteínas, MAR o RDA (Comité de Alimentos & Nutrición de los EEUU, 1989). Sin embargo, debería entenderse que este método tiene un número de limitaciones (es inconveniente para los sujetos, da mucho trabajo a los investigadores, tiende a sobreestimar el nitrógeno que es realmente retenido, por lo general sobreestima la ingesta y subestima la excreción), y debido a su naturaleza de «caja negra», no puede aportar información específica acerca de las distintas partes componentes del metabolismo de las proteínas (Lemon et al., 1992; Fuller & Garlick, 1994). Además, el estatus (balance) de nitrógeno está afectado por el balance energético (Munro, 1951), lo cual puede confundir los datos, especialmente en estudios en donde ésto no fue siempre bien controlado. Frecuentemente, existen distintas variables que pueden confundir los resultados, incluyendo: inadecuado tiempo de adaptación al cambio de dietas experimentales (Scrimshaw et al., 1972), cambios inducidos por el ejercicio en el transcurso del tiempo y/o importancia relativa de los distintos caminos de excreción de nitrógeno (Austin et al., 1921; Lemon & Mullin, 1980; Dolan et al., 1987), problemas técnicos que hacen difícil la recolección completa de la excreción de nitrógeno (Lutwak & Burton, 1964; Bingham & Cummings, 1983; Lemon et al., 1986; Dolny & Lemon, 1988), y el uso inapropiado de la regresión lineal para estimar la necesidad proteica, tanto con dietas que sean muy ricas como muy pobres en proteínas, por ejemplo, cuando la respuesta es curvilínea (Rennie et al., 1994). Como resultado, se debe examinar la literatura de manera muy crítica.
Más recientemente, los investigadores han utilizado la técnica de trazadores metabólicos, donde se pueden investigar las partes componentes de la “caja negra” del metabolismo de las proteínas (Waterlow, 1995). Como se mencionó anteriormente, esto significa que uno puede estimar las tasas totales de síntesis de proteínas del cuerpo, si se miden las tasas de oxidación o de excreción urinaria; y las tasas de degradación total de proteínas corporales, si se miden las tasas de infusión/dietarias. A pesar de que esta técnica tiene un gran futuro para ayudar a dilucidar cómo el ejercicio afecta el metabolismo de las proteínas, también tiene varias limitaciones, incluyendo el costo, es un método invasivo, y la validez de varias de sus presunciones (Young et al., 1989; Wolfe, 1992; Garlick et al., 1994; Rennie et al., 1994; Tessari et al., 1996). A pesar de que técnicamente es más difícil, la síntesis de proteínas musculares, que representa cerca del 25-30 % de la síntesis proteica total, también se puede medir cuantificando con enriquecimiento isotópico en muestras musculares obtenidas através de biopsias (Nair et al., 1988; Chesley et al., 1992; Biolo et al., 1995; MacDougall et al., 1995).
Evidencia de que las Necesidades de Proteínas Aumentan con el Ejercicio
En los últimos años, se han comenzado a acumular una variedad de datos experimentales que sugieren que el ejercicio tiene efectos dramáticos sobre el metabolismo de las proteínas. Por ejemplo, varios investigadores han medido las pérdidas en el músculo de roedores (Varrik et al., 1992), y/o los niveles de proteínas hepáticas (Dohm et al., 1978; Kasperek et al., 1980) luego del ejercicio, especialmente con ejercicios prolongados de resistencia (Figura 2). Consistente con estas observaciones, nosotros hemos encontrado un aumento del 114 % en el contenido de N en urea en el músculo activo (107.4 a 229.7 µg/gr de peso corporal) de roedores, inmediatamente después de una hora de carrera a 25 m/min (datos no publicados). Además, se han documentado mayores tasas de degradación de proteínas (Kasperek & Snider, 1989) y un daño muscular significativo (Newman et al., 1983; Armstrong et al., 1983; Friden et al., 1988; Evans & Cannon, 1991; Kuipers, 1994) en varias especies de mamíferos (incluyendo seres humanos), especialmente cuando el ejercicio tiene un (componente excéntrico significativo.
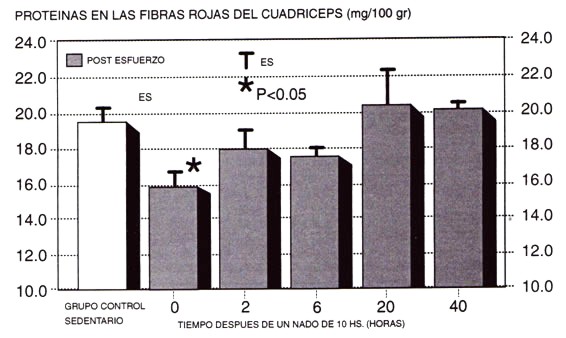
Figura 2. Efecto de un ejercicio prolongado de resistencia (10 horas de natación con roedores) sobre la concentración de proteínas en las fibras rojas de los cuádriceps. Observar la disminución inmediatamente después de la serie de ejercicio (adaptado de Varrik et al., 1992).
Las proteasas lisosómicas, por ejemplo las catepsinas, han sido involucradas en esta respuesta catabólica al ejercicio (Seene & Vira, 1982; Tapscott et al., 1982; Sahumen et al., 1983; Salminen & Vihko, 1984), pero algunos creen (Kasperek & Snider, 1989) que no cumplen un papel importante. Recientemente, se ha sugerido (Belcastro et al., 1996) que las proteasas no lisosómicas, quizás una proteasa neutra activada con calcio (calpaína), estimulada por un mayor calcio intracelular inducido por el ejercicio, podría ser responsable principal del daño inicial que ocurre inmediatamente después del ejercicio. La evidencia de esto proviene no sólo de la observación que las isoenzimas de la calpaína aumentan 22-30 % con el ejercicio (Belcastro, 1993), sino también porque el patrón de daño miofibrilar inducido por el ejercicio es similar al inducido por la calpaína (Goll et al., 1992). La actividad de la proteasa lisosómica podría jugar un papel más importante en el daño muscular que se observa varios días después del ejercicio (Evans & Gannon, 1991; MacIntyre et al., 1995). Se desconoce si el aumento en la ingesta de proteínas puede reducir este daño, o acelerar los procesos posteriores de reparación.
Juntos, el gran flujo de los aminoácidos alanina (Felig & Wahren, 1971) y glutamina (Ruderman & Berger, 1974) desde el músculo activo, así como la acumulación/excreción frecuentemente observada de los productos residuales del metabolismo de las proteínas, la urea (Refsum & Stromme, 1974; Haralambie & Berg, 1976; Lemon & Mullin, 1980; Dohm et al., 1982) y amonio (Czarnowski & Gorski, 1991; Graham & MacLean, 1992; Graham et al., 1995), aportaron una fuerte evidencia indirecta que se producen incrementos significativos en el metabolismo de los aminoácidos de cadena ramificada (AACR) con el ejercicio de resistencia (Figura 3). Además, esto ha sido confirmado utilizando mediciones directas de la oxidación (Figura 4) por distintas investigaciones independientes (White & Brooks, 1981; Lemon et al., 1982; Hagg et al., 1982; Babij et al., 1983; Meredith et al., 1989; Phillips et al., 1993). Probablemente, este hecho es el resultado de la activación, dependiente de la intensidad del ejercicio, de la enzima limitante (oxoácido-dehidrogenasa de cadena ramificada) en el camino de oxidación de los AACR (Kasperek & Snider, 1987). Aparentemente, esta respuesta es directamente proporcional a la disponibilidad de AACR (Knapik et al., 1991; Layman et al., 1994), e inversamente proporcional a la disponibilidad de glucógeno (Lemon & Mullin, 1980; Wagenmakers et al., 1991), a pesar de que otros factores también podrían ser importantes (Jackman et al., 1997). Esto sugiere que las proteínas y los carbohidratos en la alimentación, antes del ejercicio, y el tiempo transcurrido desde la comida previa, son probablemente determinantes importantes de la oxidación de AACR en el ejercicio.
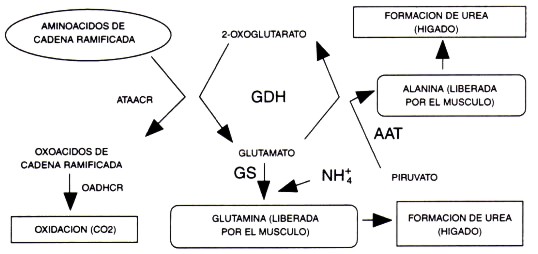
Figura 3. Gráfico del metabolismo de los aminoácidos de cadena ramificada (AACR) mostrando la producción de alanina y glutamina en el músculo, así como la formación de urea en el hígado. ATAACR = amino transferasa de aminoácidos de cadena ramificada; OADHCR = oxoácido-dehidrogenasa de cadena ramificada, GDH = glutamatodehidrogenasa, GS = glutamina-sintetasa, AAT = alanina amino-transferasa, NH3 = amonio, CO2 = dióxido de carbono.
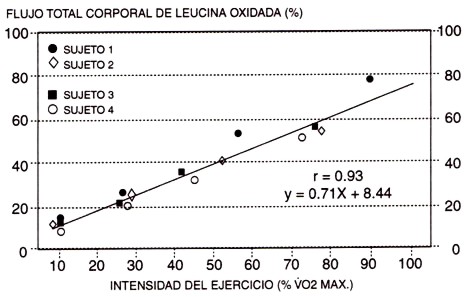
Figura 4. Efecto de la intensidad del ejercicio de resistencia (% VO2máx) sobre la oxidación de uno de los aminoácidos de cadena ramificada (leucina), en seres humanos. Observar el aumento lineal en la oxidación ante el incremento en la intensidad del ejercicio (adaptado de Babij et al., 1983).
La magnitud de este aumento en la oxidación de AACR podría ser importante en relación a los requerimientos diarios de AACR, ya que una sola serie de ejercicios moderados (2 hs al 55 % del VO2máx) puede producir una tasa de oxidación equivalente a casi el 90 % del requerimiento diario para, al menos uno de los AACR (Evans et al., 1983). Además, es posible que esta tasa de oxidación pudiera ser aún mayor en individuos entrenados en resistencia, ya que al menos dos estudios en roedores mostraron que el entrenamiento de resistencia provoca mayores aumentos en la oxidación de AACR, tanto en reposo como durante el ejercicio (Dohm et al., 1977; Henderson et al., 1985). Con el ejercicio de resistencia, este incremento es proporcional a la intensidad del mismo (Babij et al., 1983), pero el ejercicio de fuerza parece no afectar la oxidación de los AACR (Figura 5), a pesar de su naturaleza extremadamente intensa (Tarnopolsky et al., 1991). Esto se debe probablemente al hecho de que la actividad de fuerza es tan intensa, que una gran parte de la energía necesaria debe ser derivada a través del metabolismo anaeróbico; por ejemplo, fosfágenos y glucógeno muscular acumulados, más que a través de vías metabólicas oxidativas. También existen datos interesantes a partir de elegantes experimentos sobre el estátus (balance) de nitrógeno, que sugieren que los requerimientos alimentarios de proteínas aumentan con el ejercicio, tanto de resistencia como de fuerza. Los datos de Gontzea et al (1974) sugieren que las necesidades proteicas son mayores con un programa de ejercicio aeróbico (Figura 6), pero un trabajo posterior realizado por el mismo grupo (Gontzea et al., 1975) indica que esto podría ser cierto, sólo transitoriamente durante unas pocas primeras semanas de un programa de resistencia (Figura 7). Sin embargo, los datos en esta segunda investigación podrían haberse confundidos por un efecto del entrenamiento físico, ya que el estímulo del ejercicio permaneció constante durante el período de 3 semanas, durante los cuales fue evaluado el estatus de nitrógeno. En otras palabras, el aumento en la capacidad de resistencia (VO2máx), experimentado a medida que progresaba el estudio en estos sujetos previamente desentrenados, podría significar que la misma serie absoluta de ejercicio representaba una intensidad relativa de ejercicio menor, y quizás como resultado, un mejor estatus de nitrógeno. Para examinar esta posibilidad, decidimos repetir la investigación inicial de Gontzea et al. (1974) con algunos cambios menores, pero significativos. Primero, estudiamos un grupo de corredores de resistencia experimentados (> 5 años de entrenamiento, 94 ± 21 km/sem, VO2máx = 71 ± 5 mL/kg/min), y segundo, utilizamos una serie de ejercicio que era similar a su carga diaria de entrenamiento. Observamos un balance nitrogenado negativo en los corredores entrenados, cuando consumieron 0.9 gr de proteínas/ kg/d, y un balance nitrogenado positivo cuando la ingesta fue de 1.5 gr/kg/d (Friedman & Lemon, 1989). El hecho que estos corredores entrenados respondieran de manera similar que los sujetos desentrenados, que no estaban acostumbrados a un estímulo físico en el estudio de Gontzea et al. (1974), indica que el balance nitrogenado negativo en los corredores de resistencia que consumieron 0.9 gr de proteínas/kg/d refleja una dieta inadecuada en proteínas, más que una respuesta transitoria a la iniciación de un programa de ejercicios.
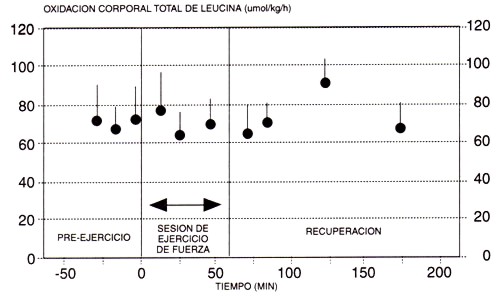
Figura 5. Efecto de un ejercicio intenso de resistencia sobre la oxidación de leucina en seres humanos. Observar que a pesar de la naturaleza intensa de la sesión de entrenamiento, hay poco efecto sobre la oxidación de leucina, ya sea durante el ejercicio o durante las 2 hs. de recuperación (adaptado de Tamopolsky et al., 1991).
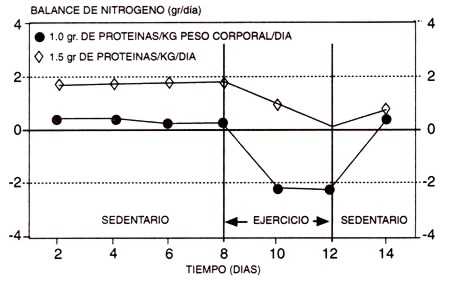
Figura 6. Efecto de una serie aguda de ejercicios de resistencia sobre el balance de nitrógeno mientras se consumen distintas cantidades de proteínas (1.5 vs. 1.0 gr de proteínas/kg/d). Observar que el patrón general del balance de nitrógeno con el ejercicio es similar con ambas ingestas de proteínas, y que con el consumo más bajo (125% de la ingesta recomendada para proteínas) el balance de nitrógeno se vuelve negativo con el programa de ejercicios, sugiriendo que esta cantidad de proteínas, que puede ser adecuada para el individuo sedentario, es inadecuada para el ejercicio (adaptado de Gontzea et al., 1974).
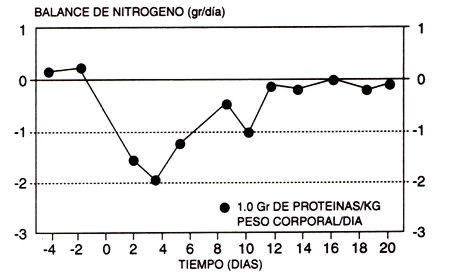
Figura 7. Efecto de la adaptación a un programa de ejercicios sobre el balance de nitrógeno, mientras se consume 1.0 gr de proteínas/kg/d (125 % de la ingesta proteica recomendada). Observar que el balance de nitrógeno parece recuperarse a través de varias semanas con el mismo estímulo de ejercicio. Estos datos significan que esta ingesta de proteínas, a pesar de ser inadecuada durante los primeros días del programa de resistencia, se vuelve adecuada en unas pocas semanas como resultado de una adaptación. Sin embargo, esta mejoría aparente en el balance de nitrógeno también podría ser producto de un artificio por una disminución en el estímulo de ejercicio, debido a una mayor capacidad de resistencia a lo largo de las semanas de entrenamiento (adaptado de Gontzea et al., 1975).
En otro estudio, Tarnopolsky et al. (1988), utilizando distintas ingestas proteicas (1.0-2.7 gr/kg/d) y la técnica del balance de nitrógeno, no sólo observó un mayor requerimiento de proteínas en los deportistas de resistencia estudiados, concordando con los otros estudios mencionados anteriormente, sino también en un grupo que entrenaba la fuerza (ver discusión de los estudios de fuerza más adelante - Figura 8). Normalmente, los procedimientos de regresión; por ejemplo, ingesta proteica que produce balance de nitrógeno + un margen seguro (dos veces el desvío estándar de la muestra de los sujetos) para cubrir las necesidades del 97.5 % de la población de interés (Comité de Alimentos & Nutrición, 1989), son utilizados con esta clase de datos para determinar un margen alimentario recomendado (RDA). En este estudio, los investigadores utilizaron este procedimiento, pero sólo usaron 1 DS para arribar a las ingestas recomendadas de 1.6 gr para deportistas de resistencia, y 1.2 gr/kg/d para los que entrenan la fuerza (167 y 112 % de la RDA actual, respectivamente). Se utilizó este método conservador ya que querían minimizar cualquier sobreestimación que pudiera resultar de la extrapolación de ingestas tan elevadas como 2.7 gr/kg/d, a aquellas requeridas para el balance de nitrógeno. Finalmente, la inclusión del grupo sedentario en este estudio es importante, ya que cualquier error metodológico sería similar a través de los tres grupos y, por lo tanto, las diferencias en la ingesta, necesaria para producir un balance de nitrógeno (0.73, 0.82, y 1.37 gr/kg/d para los grupos sedentario, de fuerza, y de resistencia, respectivamente), deberían reflejar las diferencias reales en el requerimiento alimentario de proteínas de estos grupos.
Poco después, Meredith et al. (1989) utilizaron tanto la técnica del balance de nitrógeno como mediciones del “turnover” de proteínas (dosis orales de glicina - 15N cada 3 hs. durante 60 hs.) para evaluar los requerimientos alimentarios de proteínas en hombres jóvenes (26.8 ± 1.2 años) y de mediana edad (52.0 ± 1.9 años) entrenados en resistencia (> 11 años de entrenamiento). Estos datos del balance de nitrógeno indican que las necesidades de proteínas fueron mayores, de manera similar en los dos grupos de edad (37 %), en relación a los datos de un estudio publicado previamente por el mismo laboratorio con individuos sedentarios. Cuando estos datos fueron utilizados para calcular un margen alimenticio recomendado en base a procedimientos de regresión (como se describió anteriormente; excepto que aquí se agregó dos veces el DE de la muestra, porque las ingestas proteicas utilizadas fueron cercanas al requerimiento; i.e., 0.61, 0.91 y 1.21 gr de proteínas/ kg/d), el valor obtenido fue de 1.26 gr de proteínas/ kg/d (157 % de la RDA actual en los Estados Unidos). Además, se observó un mayor respaldo para la ventaja de un consumo más elevado de proteínas en los datos del “turnover” de las mismas, lo cual mostró que la tasa de síntesis proteica fue mayor en ambos grupos de edad cuando consumieron 1.21 gr vs. 0.61 gr.
Los datos posteriores de Phillips et al. (1993), quienes hallaron un balance negativo de nitrógeno en corredores de en resistencia (> 5 años de experiencia de entrenamiento, 43-50 km/sem, VO2máx = 66-68 mL/kg/min), adaptados a una ingesta proteica de 0.80-0.94 gr/kg/d, brindan un mayor respaldo a la idea de que las necesidades de proteína son elevadas en los deportistas de resistencia. Además, en este estudio se observó un balance negativo mayor en los varones que en las mujeres y esta diferencia fue confirmada por las mayores tasas de oxidación de leucina (Figura 9) en los hombres, tanto en reposo como durante el ejercicio (Phillips et al., 1993). Aparentemente, esta diferencia entre sexos está relacionada con la reducción de glucógeno y/o el mejor uso de las grasas en las mujeres, quizás como resultado de respuestas hormonales diferentes (Tarnopolsky et al., 1995).
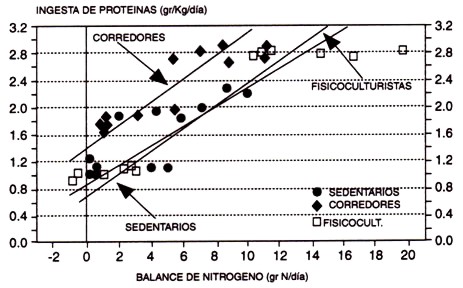
Figura 8. Estimación de los requerimientos alimentarios (ingesta de proteínas necesaria para producir un balance de nitrógeno) en deportistas de resistencia, en deportistas de fuerza, y en hombres sedentarios. Observar que ambos grupos de atletas tienen requerimientos mayores (intercepción de curvas de "y”) que los hombres sedentarios (adaptado de Tamopolsky et al., 1988).
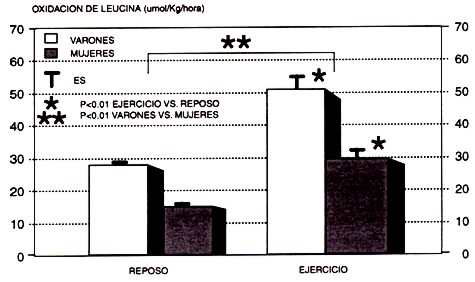
Figura 9. Efecto del sexo sobre la oxidación de la leucina, tanto en reposo como durante una serie de ejercicio de resistencia, en seres humanos. Observar que el ejercicio aumenta la oxidación de leucina y que tanto en reposo como durante el ejercicio, la tasado oxidación fue mayor en los varones (adaptado de Phillips et al., 1993).
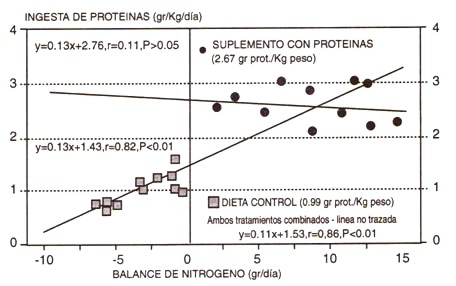
Figura 10. Requerimientos alimentarios estimados (consumo de proteínas necesario para producir un balance de nitrógeno) en fisicoculturistas principiantes varones. Observar que cuando se consumieron 0.99 gr de proteínas/kg/d (125 % de la ingesta recomendada para proteínas), todos los sujetos tuvieron un balance nitrogenado negativo (cuadrados), y una fuerte relación lineal entre la ingesta de proteínas y el balance de nitrógeno (r = 0.82, p<0.01). Usando estos datos, el requerimiento proteico estimado para las proteínas (intercepción de “y”) desde 1.43gr/kg/d. Normalmente, las recomendaciones para las proteínas son iguales a este valor, más un “buffer” de seguridad igual a 2 DE del promedio de la muestra (para tener en cuenta la variabilidad en la población con relación a la muestra estudiada). Aquí, la recomendación sería de 1.63 gr/kg/d (204 % de la recomendación actual). La relación lineal entre la ingesta de proteínas y el balance nitrogenado se pierde con el alto consumo proteico estudiado (2.67 gr/kg/d, círculos), y el balance de nitrógeno fue altamente positivo, indicando que esta ingesta excedía las necesidades de proteínas.
Al menos dos grupos (Lemon et al., 1992; Tarnopolsky et al., 1992) han observado necesidades aún mayores de proteínas en deportistas que entrenan la fuerza (Figura 10), y en base a los datos del balance de nitrógeno, han recomendado ingestas de 1.7 y 1.8 gr/kg/d, respectivamente. Además, Fern et al. (1991) observaron un mayor aumento de peso, en 4 semanas de entrenamiento, en fisicoculturistas que consumieron 3.3 gr vs. 1.3 gr de proteínas/kg/d. Este documento es fascinante ya que apoya la vieja (pero pobremente documentada) creencia de los deportistas que entrenan la fuerza, de que grandes cantidades de proteínas (y el balance nitrogenado resultante altamente positivo) en combinación con el estímulo anabólico del ejercicio de sobrecarga, podría estimular el desarrollo muscular (Lemon, 1991). Sin embargo, la oxidación de aminoácidos también aumentó un 150 % en este estudio, sugiriendo que la ingesta óptima fue probablemente excedida. Posteriormente, Tarnopolsky et al. (1992) observaron un aumento en la síntesis total de proteínas (Figura 11), cuando los atletas que entrenaban la fuerza incrementaron su consumo de 0.9 gr a 1.4 gr/kg/d. Es interesante notar que no hubo un incremento adicional cuando consumieron una dieta que contenía 2.4 gr/kg/d. Además, la oxidación de aminoácidos aumentó con 1.4 gr y 2.4 gr/kg/d en el grupo sedentario, pero con los deportistas de sobrecarga, sólo con la dieta que contenía 2.4 gr. Esto sugiere que con una ingesta de 1.4 gr, los aminoácidos consumidos en exceso de las necesidades, fueron removidos del organismo a través de la oxidación en los sujetos sedentarios, pero utilizados para soportar e incrementar la tasa de síntesis de proteínas en el grupo de fuerza. Obviamente, con el tiempo esto debería llevar a aumentos en el peso muscular y, potencialmente, en la fuerza. Estos resultados confirman los datos de Fern et al. (1991) (que evidenciaron que el aumento de proteínas en la dieta, en combinación con el ejercicio de sobrecarga, mejora el desarrollo muscular, más que con el estímulo de entrenamiento por sí solo), e indican además que 2.4 gr de proteínas es una cantidad excesiva. Estos datos, y los datos sobre el balance de nitrógeno (Lemon et al., 1992; Tarnopolsky et al., 1992) indican que las ingestas óptimas de proteínas para deportistas varones que entrenan la fuerza, están cercanas a 1.4 gr a 1.8 gr/kg/d (175-225 % de las recomendaciones actuales). Finalmente, debería entenderse que todos estos estudios se llevaron a cabo con deportistas que no consumían ninguna sustancia anabólica. Aunque no recomendable debido a los potenciales efectos secundarios adversos, es posible que el efecto relativo al desarrollo muscular observado con ingestas de 1.4 gr -1.8 gr de proteínas pudiera extenderse a consumos más elevados, si se combinan con manipulaciones farmacológicas conocidas de aumentar la masa muscular (Bhasin et al., 1996). Si es así, esto podría explicar por qué las creencias de los atletas acerca de los beneficios de dietas muy ricas en proteínas difieren de los datos científicos.
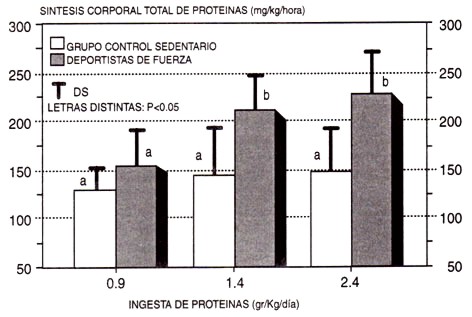
Figura 11. Síntesis total de proteínas en varones sedentarios vs varones entrenados en sobrecarga que consumieron 0.9, 1.4, o 2.4 gr de proteínas/kg/d (112,175, y 300 % de los valores actuales recomendados). Observar que la tasa de síntesis de proteínas aumentó en los deportistas cuando fueron del 112 al 175 %, indicando que este último porcentaje podría facilitar el desarrollo de la masa muscular y de la fuerza. Sin embargo, no hubo un aumento adicional cuando la ingesta se incrementó al 300 %, sugiriendo que la misma excedía el consumo óptimo de proteínas. Notar también que es necesario el entrenamiento de sobrecarga para aumentar la tasa de síntesis proteica además de las proteínas alimentarias, ya que no se observaron aumentos en los varones sedentarios.
Campbell et al. (1995) estudiaron el “turnover” de proteínas y el balance de nitrógeno, en hombres y mujeres de edad (56-80 años) que consumían ya sea 1.62 gr o 0.8 gr de proteínas/kg/d, mientras participaban en un programa de 12 semanas de entrenamiento con sobrecarga. Ellos observaron un balance negativo, y una tendencia a disminuir el total de proteínas corporales más la masa mineral (-3.5 %) con la dieta pobre en proteínas. Por el contrario, los sujetos que consumieron la dieta rica en proteínas tuvieron una mayor tasa de síntesis, y las proteínas más la masa mineral fueron mayores (+1.9 %). Estos datos concuerdan con los resultados observados en sujetos más jóvenes (discutido anteriormente), y sugieren además que las dietas ricas en proteínas son beneficiosas para individuos mayores que entrenan la fuerza. Esto es especialmente importante, ya que debido a los aparentes beneficios del entrenamiento de sobrecarga en las personas mayores (Fiatarone et al., 1990; Fiatarone et al., 1994), muchos adultos están agregando este tipo de ejercicios a su programa de entrenamiento.
Hay otros datos que apoyan la idea de que los individuos físicamente activos necesitan más proteínas (Consolazio et al., 1963; Celejowa & Homa, 1970; Consolazio et al., 1975; Laritcheva et al., 1978; Marable et al., 1979; Dragan et al., 1985; Meredith et al., 1992), y junto con los recientes resultados del balance de nitrógeno y el “turnover” de proteínas es difícil negar que las ingestas por encima de las recomendaciones actuales (0.8 gr/kg/d, en la mayoría de los países) son beneficiosas para aquellos individuos que realizan actividad física. Aparentemente, el consumo óptimo en deportistas que entrenan la fuerza podría estar cerca de 1.7-1.8 gr/kg/d, y para los deportistas de resistencia un poco menos (1.2-1.4 gr). Sin embargo, se debería recordar que estos datos han sido recogidos principalmente en varones. Los pocos datos disponibles en deportistas de resistencia mujeres sugieren que las necesidades de proteínas podrían ser algo menores, pero esto no está bien documentado. Además, casi no existen datos en fisicoculturistas mujeres. Consecuentemente, estos estudios sobre el balance de nitrógeno necesitan repetirse con mujeres para confirmar las aparentes diferencias entre sexos, con el ejercicio de resistencia, y establecer las recomendaciones para la ingesta de proteínas en deportistas mujeres que entrenan la fuerza.
Actualmente, al margen de los reclamos anecdóticos fenomenales en contrarío, hay poca evidencia confiable que indique que las ingestas proteicas elevadas (> 1.3-1.4 gr/kg/d) mejoren el rendimiento muscular (Dragan et al., 1985; Brouns et al., 1989; Vukovich et al., 1992; Fry et al., 1993). Además, nosotros no hemos observado un mejor rendimiento en carreras de resistencia, con suplementos de proteínas, en roedores que llevaron a cabo un programa de entrenamiento de resistencia (Cortright et al., 1993), ni pudimos documentar una mayor fuerza muscular, o desarrollo de la masa, en deportistas de fuerza suplementados con proteínas (2.6 gr/kg/d), a pesar del mejor balance de nitrógeno (Lemon et al., 1992). Además, nuestros estudios con diferentes tipos de proteínas (soja, caseína) y entrenamiento de sobrecarga, no revelaron ninguna ventaja obvia en la performance con ningún tipo de proteína (Appicelli et al., 1995). Sin embargo, nuestros estudios sólo han investigado la respuesta inicial (4-8 semanas) al entrenamiento, y es posible que se pudiera observar alguna ventaja en períodos más prolongados. Dados los fantásticos reclamos y los obvios potenciales beneficios económicos en el campo deportivo, es sorprendente que esta área haya recibido tan poca atención entre la comunidad científica.
¿Son Saludables estas Recomendaciones Moderadamente Elevadas de Proteínas?
Muchos creen que las dietas con alto contenido de proteínas son peligrosas, pero es difícil de documentar algún efecto adverso, excepto en pacientes con patologías en la función renal (Brenneret al., 1982). Claramente, un elevado contenido de proteínas en la alimentación aumenta el trabajo de los ríñones debido a la carga adicional de nitrógeno que debe ser eliminada, pero esto no parece ser un problema para las personas sanas. Además, no se han observado efectos adversos severos en roedores que consumieron dietas extremadamente altas en proteínas (80 % de la ingesta calórica), durante más de la mitad de su vida (Zaragoza et al., 1987). Estos datos son particularmente interesantes no sólo por su naturaleza longitudinal, sino también debido a que esta dieta representa al menos 3 veces el porcentaje observado en las dietas con mayor contenido de proteína en los deportistas. Finalmente, la falta de reportes que señalen problemas renales en levantadores de pesas y fisicoculturistas de mediana edad, un porcentaje significativo de los cuales han consumido dietas ricas en proteínas de manera regular, durante 20-30 años o más, sugiere que probablemente se han sobreestimado los peligros de las dietas proteicas elevadas en individuos sanos.
De manera similar, probablemente se haya sobreestimado la asociación entre las dietas ricas en proteínas y la aterogénesis. Por ejemplo, aparentemente la relación positiva (muy bien documentada), entre las proteínas animales y el colesterol plasmático observado en los animales, no se aplica a los seres humanos (West & Beynen, 1985) y, como resultado, la relación entre grasas en la dieta y grasas en sangre es mucho más leve de lo que se creía (McNamara et al., 1987; Clifton & Nestel, 1996). Además, aún si estas relaciones fueran importantes en individuos sedentarios, el destino de las grasas ingeridas podría ser sustancialmente diferente en individuos físicamente activos (son utilizadas como combustible en lugar de ser almacenadas en las paredes de los vasos sanguíneos o en el tejido adiposo) (Muoio et al., 1994; Leddy et al., 1997).
En un momento parecía que las dietas ricas en proteínas provocaban una pérdida obligatoria de calcio por la orina (Allen et al., 1979) y, de ser así, esto podía ser problemático, especialmente en las mujeres, debido a la posibilidad de acelerar el desarrollo de la osteoporosis. Sin embargo, esto parece ser un problema sólo con los suplementos de proteínas purificadas, porque el contenido de fosfato del alimento con proteínas aparentemente niega esta pérdida acelerada de calcio (Flynn, 1985).
Sin embargo, existen al menos dos áreas problemáticas con las dietas ricas en proteínas. En primer lugar, la mayor excreción de agua asociada con la pérdida de nitrógeno a través de los riñones podría ser perjudicial para los individuos físicamente activos (especialmente los deportistas de resistencia) debido a sus mayores pérdidas de líquidos a través de la sudoración. La deshidratación resultante podría afectar de manera adversa el rendimiento deportivo (Armstrong et al., 1985), y si es bastante seria, hasta amenazar la salud (Adolph, 1947: Bauman, 1995). Por esta razón, es muy importante que la rehidratación sea adecuada en aquellos atletas que ingieren dietas ricas en proteínas. La mejor manera de hacerlo a controlando regularmente los cambios en el peso corporal. Los cambios agudos súbitos en deportistas que consumen dietas con alto contenido de proteínas indican que es necesaria una rehidratación adicional. En segundo lugar, la ingesta de mega-dosis de aminoácidos individuales (lo cual sólo se ha vuelto posible en los últimos años por el amplio desarrollo comercial de suplementos con aminoácidos individuales) podría ser potencialmente perjudicial. Los beneficios ergogénicos de estos suplementos se promueven con mucho éxito, debido al intenso deseo de los atletas de llegar al triunfo deportivo. A pesar de que muchos de los efectos teóricos suenan convincentes (especialmente para los que no son científicos), se han documentado muy pocos de estos efectos, no obstante una considerable cantidad de investigaciones (Brodan et al., 1974; Kasai et al., 1978; Isidori et al., 1981; Maughan & Sadler, 1983; Segura & Ventura, 1988; Wessen et al., 1988; Bucci et al., 1990; Blomstrandet al., 1991; Kreider et al., 1992; Fogelholm et al., 1993; Lambert et al., 1993; Newsholme & Parry-Billings, 1994; Bigardet al., 1996; Kreider et al., 1996; Suminski et al., 1997), y existen posibles complicaciones sustanciales (Harper et al., 1970; Benevenga & Steele, 1984; Yokogoshi et al., 1987; Tenman & Hainline, 1991). Como resultado, se recomienda evitar estos suplementos hasta que se pruebe su seguridad así como sus beneficios ergogénicos.
¿Es necesaria la suplementación con proteínas?
Para la gran mayoría de individuos físicamente activos, probablemente no es necesaria la suplementación con proteínas, ya que las cantidades requeridas (1.2-1.8 gr/kg/d) se pueden obtener a través de una dieta normal (que supone una ingesta calórica adecuada). Por ejemplo, un individuo sedentario que consume cerca de 10.500 kJ/d (2.500 kcal) de los cuales el 10 % son proteínas, estaría ingiriendo cerca de 65 gr diarios de proteínas. Suponiendo un peso de 70 kg, esto, significaría casi 0.9 gr/kg/d, o cerca del 112 % de la RDA actual en la mayoría de los países. Si esta persona comenzara un programa de ejercicios y, consecuentemente, duplicara su ingesta calórica a 21.000 kJ (5.000 kcal) manteniendo el 10 % de consumo de proteínas, la ingesta proteica resultante también sería el doble (1.8 gr/kg/d). Esto sería suficiente para cubrir las mayores necesidades que se mencionan en todos los estudios referidos en esta revisión. Además, a pesar del énfasis de los carbohidratos en la dieta de la mayoría de los deportistas, mantener una ingesta proteica del 10 % (2.100 kJ) no debería causar ningún problema porque, si la ingesta de grasas fuera del 30 % (6.300 kJ), le quedarían 12.600 kJ para consumir, es decir cerca de 750gr de carbohidratos (10.7 gr/kg). Esta cantidad de carbohidratos ciertamente es más que suficiente para cualquier programa de carga de carbohidratos.
La ingesta inadecuada de proteínas en individuos activos es más probable que ocurra en aquellos que tienen alguna condición pre-existente, que interactúa con el efecto del ejercicio para aumentar la cantidad de proteínas necesarias. Por ejemplo, durante períodos de crecimiento rápido, (adolescentes, niños, mujeres embarazadas, etc.), en situaciones en donde la ingesta calórica total es inadecuada (personas que hacen dieta, aquellos que realizan actividades con restricciones en el peso corporal, etc.), o en los que no consumen una dieta variada (adolescentes, vegetarianos, ancianos). Algunos deportistas consumen ingestas calóricas insuficientes debido a que no alcanzan la cantidad absoluta de alimentos y líquidos necesarios para mantener el balance calórico y de fluidos. En algunas situaciones, podría ser beneficioso el uso de fórmulas de reposición de alimentos líquidos.
Si se sospecha de una ingesta alimentaria inadecuada, lo mejor es realizar un análisis de la dieta (normalmente a través de una encuesta de 3-7 días procesada por programas comerciales) para verificar que en verdad existe un problema. Desafortunadamente, en los seres humanos libres, estos análisis pueden llegar a ser bastante inadecuados, no sólo porque al sujeto se le dan a veces instrucciones muy vagas (él/ella podría modificar la dieta con el fin de complacer al investigador), sino también debido a los equipos inadecuados para cuantificar de manera precisa la porción (deben usarse balanzas para cuantificar cantidades), o simplemente olvidando registrar todos los alimentos consumidos. Además, 3 días podrían no ser representativos de la dieta real, especialmente si no se incluyen los días de fin de semana (la ingesta de alimentos podría diferir sustancialmente entre los días de semana y de fin de semana), y las encuestas de 7 días no siempre son mejores porque si los sujetos no están bastante motivados podrían aburrirse en el proceso y, consecuentemente, no brindar reportes precisos. Por todas estas razones, se debe tener un cuidado extremo en la interpretación de esta clase de información.
Suponiendo que se han tomado todos los recaudos necesarios para obtener una información precisa de la dieta del individuo y se observó una ingesta proteica insuficiente, normalmente se puede corregir este problema con algunos ajustes menores en la selección de alimentos. Esto significa que, a pesar del hecho de que la participación regular en un programa de ejercicios (ya sea de fuerza o de resistencia), aparentemente aumenta los requerimientos de proteínas, los suplementos (considerablemente más caros que los alimentos ricos en proteínas) raramente son necesarios. Además, si se determina que no es posible consumir una suficiente cantidad de proteínas con los alimentos y se toma la decisión de utilizar suplementos, uno de los mejores métodos y más efectivo en cuanto al costo, sería fortificar la alimentación con proteínas de alta calidad y bajo costo, como leche descremada en polvo. Finalmente, existe un respaldo aún menor para la práctica comúnmente utilizada de la suplementación con aminoácidos individuales. Hasta tanto sea claro que grandes dosis de uno o algunos aminoácidos individuales sean tanto beneficiosos como seguros, esta última estrategia está definitivamente contraindicada.
Referencias
1. Allen, L.H., Oddoye, E.A. & Margen, S (1979). Protein induced hypercalciuria: a longer term study. American Journal of Clinical Nutrition 32:741-749
2. Armstrong R.B., Ogilivie, R.W. & Schwane, J.A (1983). Eccentric exercise-induced injury in rat skeletal muscle. Journal of Applied Physiology 54:80-93
3. Astrand, P.O. & Rodahl, K (1977). Textbook of Work Physiology. McGraw-Hill, New York
4. Austin, J.H., Stillman, E. & Van Slyke (1921). Factors governing the excretion of urea. Journal of Biological Chemistry 46:91-112
5. Babij, P., Matthews, S.M. &Rennie, M.J (1983). Changes in blood ammonia lactate and amino acids in relation to workload during bicycle ergometer exercise in man. European Journal of Applied Physiology 50:405-411
6. Belcastro, A.N (1993). Skeletal muscle calcium-activated neutral protease (calpain) with exercise. Journal of Applied Physiology 74:1381-1386
7. Belcastro, A.N., Albisser, T.A. & Littlejohn, B (1996). Role of calcium-activated neutral protease (calpain) with diet and exercise. Canadian Journal of Applied Physiology 21:328-346
8. Benevenga, N.J. & Steele, R.D (1984). Adverse effects of excessive consumption of amino acids. Annual Review of Nutrition 4:157-181
9. Bhasin, S., Storer.T.W., Berman, N., Callegari, C., Clevenger, B., Phillips, J. Bunnell, T.J., Tricker, R., Shirazi, A. & Casaburi, R (1996). The effects of supraphysiologic doses of testosterone on muscle size and strength in normal men. New England Journal of Medicine 335:1-7
10. Bigard, A.X., Laviet, P., Ullmann, L., Legrand, H.,Douce, P. & Guezennec, C.Y (1996). Branched-chain amino acid supplementation during recreated prolonged skiing exercises at altitude. International Journal of Sports Nutrition 6:295-306
11. Bingham, S. & Cummings, J.H (1983). The use of 4-aminobenzoic acid as a marker to valídate completeness of 24th uriñe collections in man. Clinical Science 64:629-635
12. Biolo, G., Maggi, S.P., Williams, B.D., Tipton, K.D. & Wolfe, R.R (1995). Increased rates of muscle protein turnover and amino acid transport after resistance exercise en humans. American Journal of Physiology, 268:E514-E520
13. Blomstrand, E., Hackmen, P., Kebob, B. & Newsholme, E.A (1991). Administration of branched-chain amino acids during prolonged exercise effects on performance and on plasma concentration of some amino acids. European Journal of Applied Physiology 63:83-88
14. Brenner, B.M., Meter, T.W. & Hosteler, D (1982). Protein intake and the progressive nature of kidney disease, the role of hemodynamically mediated glomerular sclerosis in aging, renal ablation, and intrinsic renal disease. New England Journal of Medicine 307:652-657
15. Brodan, V., Kuhn, E., Pechar, J., Placer, Z. & Slabochova, Z (1974). Effects of sodium glutamine infusion on ammonia formation during intense physical exercise. Nutritionn Reports International 9:223-232
16. Brouns, F., Saris, W.H.M., Beckers, E., Adlercreutz, H., van der Vusse, G.J., Keizer, H.A., Kuipers, H., Menheere, P., Wangenmakers, A.J. & len Hoor, F (1989). Metabolic changes induced by sustained exhaustive cycling and diet manipulation. International Journal of Sports Medicine 10 (Suppl. 1):S49-S62
17. Bucci, L.R., Hickson, J.F., Pivarnik, J.M. Wolinsky, I., McMahon, J.S. & Turner, S.D (1990). Ornitine ingestión and growth hormone release in bodybuilders. Nutrition Research 10:239-245
18. Butterfield, G.E (1991). Aminoacids and high protein diets. In M. William & D. Lamb (eds.). Perspectives in Exercise Science and sports Medicine. Vol. 4. Ergogenics-The Enhancemenc of Exercise and Sport Performance, pp. 87-122. Benchmark Press, Indianapolis
19. Campbell, W.W., Crim, M.C., Young, V.R., Joseph, L.J. & Evans, W.J (1995). Effects of resistance training and dietary protein intake on protein metabolism in older adults. American Journal of Physiology 268:E1143-E1153
20. Cathcart, E.P (1925). Influence of muscle work on protein metabolism. Physiological Reviews 5:225-243
21. Chesley, A., MacDougall, J.D., Tarnopolsky, MA., Atkinson, S. A. & Smith, K (1992). Changes in human protein synthesis following resistance exercise. Journal of Applied Physiology 73:1383-1388
22. Celejowa, I. & Homa, M (1970). Food intake, nitrogen and energy balance in Polish weightlifters during a training camp. Nutrition and Metabolism 12, 259-274
23. Clifton, P.M. & Nestel, P.J (1996). Effect of dietary cholesterol on postprandial lipoproteins in three phenotypic groups. American Journal of Clinical Nutrition 64:361-367
24. Consolazio, C.F., Johnson, H.L., Nelson, R.A., Dramise, J.G. &Skala, J.H (1975). Protein metabolism during intensive physical training in the young adult. American Journal of Clinical Nutrition 28:29-35
25. Consolazio, C.F., Nelson, R.A., Matcush, L.O., Harding, R.S. & Canham, J.E (1963). Nitrogen excretion in sweat and its relation to nitrogen balance experiments. Journal of Nutrition 79:399-406
26. Cortright, R.N., Rogers, M.E. & Lemon, P.W.R (1993). Does protein intake during endurance training affect growct, nitrogen balance, or exercise performance?. Canadian Journal of Applied Physiology 18:403P
27. Czarnowski, D. & Gorski, J (1991). Sweat ammonia excretion during submaximal cycling exercise. Journal of Applied Physiology 70, 371-374
28. Dohm, G.L., Puente, F.R., Smith, C.P. & Edge, A (1978). Changes in tissue protein levels as a result of exercise. Life Science 23:845-850
29. Dohm, G.L., William, R.T., Kasperek, G.J. & van Rij, A.M (1982). Increased urea and Nt-methylhistidine by rats and humans after a bout of exercise. Journal of Applied Physiology 52:27-33
30. Dohm, G.L., Hecker, A.L., Brown, W.E., Klain, G.J., Puente, F.R., Askew, E.W. & Beecher, G.R (1977). Adaptation of protein metabolism to endurance training. Biochemical Journal 164:705-708
31. Dolan, P.L., Hackney, A.C. & Lemon, P.W.R (1987). Improved exercise protein utilization estimates by forced hydration. Medicine and Science in Sports and Exercise 19:S33
32. Dolny, D.G. & Lemon, P.W.R (1988). Effect of ambient temperature on protein breakdown during prolonged exercise. Journal of Applied Physiology 64:550-555
33. Dragan, G.I., Vasiliu, A. & Georgescu, E (1985). Effect of increased supply of protein on elite weightlifters. In T.E. Galeslooc & B.J. Tinbergen (eds.). Milk Proteins 84, pp 99-103, Pudoc. Wageningen
34. Evans, W.J (1993). Exercise and protein metabolism. In A.P. Simopoulos & K.N. Pavlou (eds.). Nutrition and Fitness for Athletes. World Review of Nutrition and Dietetics, pp 21-33, Karger, Basel
35. Evans, W. J. &Cannon, J.G (1991). The metabolic effects of exercise-induced muscle damage. In J.O. Holloszy (ed.). Exercise and Sport Science Reviews, Vol 19, pp 99-125. William & Wilkins, Baltimore
36. Evans, W.C., Fisher, E.C., Hoerr, R.A. & Young, V.R (1983). Protein metabolism and endurance exercise. Physician and Sportsmedicine 11:63-72
37. Felig, P. & Wahren, J (1971). Amino acid metabolism in exercising man. Journal of Clinical Investigation 50:2703-2714
38. Fern, E.B., Bielinski, R.N. & Schultz, Y (1991). Effects of exaggerated amino acid and protein supply in man. Experientia 47:168-172
39. Fiacarone, M.A., Marks, E.C., Ryan, N.D. Meredith, C.N., Lipstiz, L.A. & Evans, W.J (1990). High intensity strength training in nonagenarians. Effects on skeletal muscle. Journal of the American Medical Association 263:3029-3034
40. Fiatarone, M. A., O'Neill, E.F., Ryan, N.D., Clements, K.M., Solares, G.R., Nelson, M.E., Roberts, S.B., Kehayias, J.J., Lipstiz, L.A. & Evans, W.J (1994). Exercise training and nutritional supplementation for physical frailly in very elderly people. New England Journal of Medicine 330:1769-1775
41. Fogelholm, G.M., Naveri, H.K., Kiilavuori, K.T.K. & Harkonen, M.H.K (1993). Low dose amino acid supplementation: No effects on serum growth hormone and insulin in male weightlifters. International Journal of Sport Nutrition 3:290-297
42. Friden, J., Sfakianos, P.N., Hargens, A.R. & Akeson, W.H (1988). Residual swelling after repetitive eccentric contractions. Journal of Orthopedic Research 6:493-498
43. Friedman, J.E. & Lemon, P.W.R (1989). Effect of chronic endurance exercise on retention of dietary protein. International Journal of Sports Medicine 10:118-123
44. Fry, A.C., Kraemer, W.J., Seone, M.H., Warren, B.J., Kearney, J.T., Maresh, C.M., Wesserman, C.A. & Fleck, S.J (1993). Endocrine and performance responses to high volume training and amino acid supplementation in elite junior weightlifters. International Journal of Sport Nutrition 3:306-322
45. Fuller, M.F. & Garlick, P.J (1994). Human amino acid requirements: Can the controversy be resolved?. Annual Review of Nutrition 14:217-241
46. Garlick, P.J., McNurlan, M.A., Essen, P. & Wernerman, J (1994). Measurement of tissue protein synthesis races in vivo: Critical analysis of contrasting methods. American Journal of Physiology 266:E287-E297
47. Goll, D.E., Thompson, V.F., Talyor, R.G. & Zalewska, T (1992). Is calpain activity regulated by membranes and autolysis or by calcium and capastatin?. Bioessays 14:549-556
48. Gontzea, I., Sutzescu, P. & Durnitrache, S (1974). The influence of muscular activity on the nitrogen balance and on the need of man for proteins. Nutrition Reports Internationall 10:35-43
49. Gontzea, E., Sutzescu, P. & Dumitrache, S (1975). The influence of adaptation of physical effort on nitrogen balance in man. Nutrition Reports International 11:231-234
50. Graham, T.E. & MacLean, D.A (1992). Ammonia and amino acid metabolism in human skeletal muscle during exercise. Canadian Journal of Physiology and Pharmacology 70:132-141
51. Graham, T.E., Turcotte, L.P., Kiens, B. & Richter, E.A (1995). Training and muscle ammonia amino acid metabolism in humans during prolonged exercise. Journal of Applied Physiology 78:725-735
52. Hagg, S.A., Morse, E.L. & Adibi, S.A (1982). Effect of exercise on rates of oxidation, turnover, and plasma clearance of leucine in human subjects. American Journal of Physiology 242:E407-E41
53. Haralambie, G. & Berg, A (1976). Serum urea and amino nitrogen changes with exercise duration. European Journal of Applied Physiology 36:39-48
54. Harper, A.E., Benevenga, N.J. & Wohleuter, R.M (1970). Effects of ingestion of disproportional amounts of aminoacids. Physiological Reviews 50:428-557
55. Henderson, S.A., Black, A.L., Brooks, G.A (1985). Leucine turnover in trained rats during exercise. American Journal of Physiology 249, E137-E144
56. Horber, F.F., Harber-Feyder, C.M., Krayer, S., Schwenk, W.F. & Haymond, M.W (1989). Plasma reciprocal pool specific activity predicts that of intracellular free leucine for protein synthesis. American Journal of Physiology 257:E385-E399
57. Isidori, A., Lo Monaco, A. & Cappa, M (1981). A study of growth hormone release in man after oral administration of amino acids. Current Medical Research Opinion 7:475-481
58. Jackman, M.L., Gibala, M.J., Hultman, E., & Graham, T.E (1997). Nutritional status affects branched-chain oxoacid dehydrogenase activity during exercise in humans. American Journal of Physiology 272:E233-E238
59. Kasai, K., Kobayashi, M. & Shimoda, S (1978). Stimulatory effect of glycine on human growth hormone secretion. Metabolism 27:201-208
60. Kasperek, G.J., Dohm, G.L., Tapscolt, E.B. & Powell, T (1980). Effect of exercise on liver protein loss and lysosomal enzyme levels in fed and fasted rats. Proceedings of the Society of Biological Medicine, 164:430-434
61. Kasperek, G.J. & Snider, R.D (1987). Effect of exercise intensity and starvation on the activation of branched-chain keto acid dehydrogenase by exercise. American Journal of Physiology 252:E33-E37
62. Kleiner, S.M., Bazzarre, T.L. & Ainsworth, B.E (1994). Nutritional status of nationally ranked elite bodybuilders. International Journal of Sport Nutrition 4:54-69
63. Knapik, J., Meredith, C, Jones, B., Fielding, R., Young, V. & Evans, W (1991). Leucine metabolism during fasting and exercise. Journal of Applied Physiology 70:43-47
64. Kreider, R.B., Klesges, R., Harmon, K., Grindstaff, P., Ramsey, L., Bullen, D., Wood, L., Li, Y. & Almada, A (1996). Effect of ingesting supplements designed to promote lean tissue accretion on body composition during resistance training. International Journal of Sports Nutrition 6:234-246
65. Kreider, R.B., Miller, G.W., Mitchell, M., Cortes, C.W., Miriel, V., Somma, C.T., Sechrist, S.S. & Hill, D (1992). Effects of amino acid supplementation on ultraendurance triathlon performance. In: A. Marino, M. Rivera & R. Segura (eds.). Proceedings First World Congress on Sports Nutrition, pp. 490-536. Enero, Barcelona
66. Kuipers, H (1994). Exercise-induced muscle damage. International Journal of Sports Medicine 15, 132-135
67. Lamben, M.I., Hefer, J.A., Millar, R.P. & Macfarlane, P.W (1993). Failure of commercial oral amino acid supplements to increase serum growth hormone concentrations in male body-builders. International Journal of Sport Nutrition 3:298-305
68. Laritcheva, K.A., Yalavaya, N.I., Shubin, V.I. & Smomov, P.V (1978). Study of energy expenditure and protein needs of top weight lifters. In J. Parizkova & V. A. Rogozkin (eds.). Nutrition Physical Fitness & Health, pp 155-163. University Park Press, Baltimore
69. Layman, D.K., Paul, G.L. & Olken, M.H (1994). Amino acid metabolism during exercise. . In I. Wolinsky & J.F. Hickson (eds.). Nutrition in Exercise and Sport, 2nd edn, pp 123-137. CRC Press, Boca Raton
70. Leddy, J., Horvath, P., Rowland, J. & Pendergast, D (1997). Effect of a high or low fat diet on cardiovascular risk factors in male and female runners. Medicine and Science in Sports and Exercise 29:17-25
71. Lemon, P.W.R (1987). Protein and exercise: Update 1987. Medicine and Science in Sports and Exercise 19 (No 5, supplement): S179-S190
72. Lemon, P.W.R (1991). Protein and amino acid needs of the strength athlete. International Journal of Sports Nutrition 1:127-145
73. Lemon, P.W.R (1996). Is increased dietary protein necessary or beneficial for individuals with a physically active lifestyle?. Nutrition Reviews 54 (4, part II): S169-S175
74. Lemon, P.W.R (1997). Dietary protein requirements in athletes. Nutritional Biochemistry, in press
75. Lemon, P.W.R. & Mullin, J.P (1980). Effect of initial muscle glycogen levels on protein catabolism during exercise. Journal of Applied Physiology 48:624-629
76. Lemon, P.W.R. & Nagle, F.J (1981). Effect of exercise on protein and amino acid metabolism. Medicine and Science in Sports and Exercise 13:141-149
77. Lemon, P.W.R., Yarasheski, K.E. & Dolny, D.G (1986). Validity/reliability of sweat analysis by whole body washdown vs regional collections. Journal of Applied Physiology 61:1967-1971
78. Lemon, P.W.R., Nagle, F.J., Mullin, J.P. & Benevenga, N.J (1982). In vivo leucine oxidation at rest and during two intensities of exercise. Journal of Applied Physiology 53:947-954
79. Lemon, P.W.R., Tarnopolsky, M.A., MacDougall, J.D. & Atkinson, S.A (1992). Protein requirements and muscle mass/strength changes during intensive training in novice body builders. Journal of Applied Physiology 73:767-775
80. MacDougall, J.D., Gibala, M.J., Tarnopolsky, M.A., MacDonald, J.R., Interisano, & Yarasheski, K.E (1995). The lime course of elevated muscle protein synthesis following heavy resistance exercise. Canadian Journal of Applied Physiology 20:480-486
81. Maclntyre, D.L., Reid, W.D. & Mackenzie, D.C (1995). Delayed muscle soreness: The inflammatory response to muscle injury and its clinical implications. Sports Medicine 20:24-40
82. Marable, N.L., Hickson, J.F., Korslund, M.K., Herbert, W.G., Desjardins, R.F. & Thyre, F.W (1979). Urinary nitrogen excretion as influenced by a muscle-building exercise program and protein intake variation. Nutritional Reports International 19:795-805
83. Mallhews, D.E., Schwarz, H.P., Yang, R.D., Motil, K.J. & Young, V.R (1982). Relationship of plasma leucine and alpha-ketoisocaproate during L (1-13C) leucine infusion in man: a method for measuring human intracellular tracer enrichment. Metabolism 31:1105-1112
84. Maughan, R.J. & Sadler, D.J.M (1983). The effect of oral administration of salts of aspartic acid on the metabolic response to prolonged exhausting exercise in man. International Journal of Sports Medicine 4:119-123
85. Meredith, C.N., Frontera, W.R., O'Reilly, K.P. & Evans, W.J (1992). Body composition in elderly men: effect of dietary modification during strength training. Journal of the American Geriatrics Society 40:155-162
86. Meredith, C.N., Zackin, M.J., Frontera, W.R. & Evans, W.J (1989). Dietary protein requirements and protein metabolism in endurance-trained men. Journal of Applied Physiology 66:2850-2856
87. Millward, D.J., Bowtell, J.L., Pacy, P. & Rennie, M.J (1994). Physical activity, protein metabolism and protein requirements. Proceedings of the Nutrition Society 53:223-240
88. Munro, H.N (1963). Carbohydrate and fat as factors in protein utilization and metabolism. Physiological Reviews 31:449-488
89. Muoio, D.M., Leddy, J.J., Horvath, P.J., Awad, A.B. & Pendergast, D.R (1994). Effect of dietary fat on metabolic adjustments to maximal VO2 and endurance in runners. Medicine and Science in Sports and Exercise 26:81-88
90. Nair, K.S., Halliday, D. & Griggs, R.C (1988). Leucine incorporation into mixed skeletal muscle protein in humans. American Journal of Physiology 254:E208-E213
91. Newman, D.J., McPhail, G., Mills, K.R. & Edwards, R.H.T (1983). Ultrastructural changes after concentric and eccentric contractions of human muscle. Journal of Neurological Sciences 61:109-122
92. Newsholme, E.A. & Parry-Billings, M (1994). Effects of exercise on the immune system. In C. Bouchard, R.J., Shephard & T. Stephens (eds.) Physical Activity, Fitness, and Health, pp. 451-455. Human Kinetics, Champaign
93. Phillips, S.M., Atkinson, S.A., Tarnopolsky, M.A. & MacDougall, J.D (1993). Gender differences in leucine kinetics and nitrogen balance in endurance athletes. Journal of Applied Physiology 75:2134-2141
94. Piccu, D. & Talyor-Roberts, T (1969). The measurement of total protein synthesis and catabolism and nitrogen turnover in infants in different nutritional states and receiving different amounts of dietary protein. Clinical Science London 36:283-301
95. Poortmans, J.R (1975). Effect of long lasting physical exercise and training on protein metabolism. In H.H. Howald & J.R. Poortmans (eds.). Metabolic adaptations to Prolonged Physical Exercise, pp. 212-228. Birkhauser, Baset
96. Refsum, H.E. & Stromme, S.B (1974). Urea and creatinine production and excretion in urine during and following prolonged heavy exercise. Scandinavian Journal of Clinical Laboratory Investigation 33:247-254
97. Rennie, M.J., Smith, K. & Walt, P.W (1994). Measurement of human protein synthesis. An optimal approach. American Journal of Physiology 266:E298-E307
98. Rennie,M.J.,Bowtell, J.L.&Millward,D.J (1994). Physical activity and protein metabolism. In C. Bouchard, R.J. Shephard & T. Stephens (eds.). Physical Activity, Fitness and Health, pp. 432-450, Human Kinetics, Champaign
99. Ruderman, N.B. & Berger, M (1974). The formation of glutamine and alanine in skeletal muscle. Journal of Biological Chemistry 249:5500-5506
100. Salminen, A. & Vibko, V (1984). Autophagic response to strenuous exercise in mouse skeletal muscle fibers. Virchows Archives (Cell Pathology) 45:97-106
101. Salminen, A., Komulainen, J., Ahomaki, E., Kainulainen, H., Takala, T. & Vihko, V (1983). Effect of endurance training on alkaline protease activities in rat skeletal muscles. Acta Physiologica Scandinavica 119:261-265
102. Seene, T. & Viru, A (1982). The catabolic effect of glucocortícoids on different types of skeletal muscle fibers and its dependence upon muscle activity and interaction with anabolic steroids. Journal of Steroid Biochemistry 16:349-352
103. Segura, R. & Ventura, J (1988). Effect of L-tryptophan supplementation on exercise performance. International Journal of Sports Medicine 9:301-305
104. Scrimshaw, N.S., Hussein, M. A., Murray, E., Rand, W.M. & Young, V.R (1972). Protein requirements of man. Variations in obligatory and fecal nitrogen losses in young men. Journal of Nutrition 102:1595-1604
105. Steen, S.N (1991). Precontest strategies of a male bodybuilder. International Journal of Sports Nutrition 1:69-78
106. Suminski, R.R., Robertson, R.J., Goss, F.L., Arslanian, S., Kang, J., Dasilva, S., Utter, A.C. & Metz, K.F (1997). Acute effect of amino acid ingestion and resistance exercise on plasma growth hormone concentration in young men. Journal of Sport Nutrition 7:48-60
107. Tapscott, E.B., Kasperek, G.J. & Dohm, G.L (1982). Effect of training on muscle protein turnover in male and female rats. Biochemical Medicine 27:254-259
108. Tarnopolsky, M.A., MacDougall, J.D. & Atkinson, S.A (1988). Influence of protein intake and training status on nitrogen balance and lean body mass. Journal of Applied Physiology 64:187-193
109. Tarnopolsky, M.A., Atkinson, S.A., MacDougall, J.D., Chesley, A., Phillips, S. & Schwarcz, H. (1992). Evaluation of protein requirements for trained strength athletes. Journal of Applied Physiology 73:1986-1995
110. Tarnopolsky, M. A., Atkinson, S. A., MacDougall, J.D., Senor, B.B., Lemon, P.W.R. & Schwarcz, H (1991). Whole body leucine metabolism during and after resistance exercise in fed humans. Medicine and Science in Sports and Exercise 23:326-333
111. Tenman, A.J. & Hainline, B (1991). Eosinophilia-myalgia syndrome. Physician and Sportsmedicine 19(2):81-86
112. Tessari, P., Parazzoni, R., Zanetti, M., Veltore, M., Normand, S., Bruttomessio, D. & Beaufrere, B (1996). Protein degradation and synthesis measured with múltiple amino acid tracers in vivo. American Journal of Physiology 271:E733-E741
113. U.S. Food & Nutrition Board (1989). Recommended Dietary Allowances. National Academy Press, Washington
114. Varrik, E., Viru, A., Oopik, V. & Viru, M (1992). Exercise induced catabolic responses in various muscle fibers. Canadian Journal of Sport Sciences 17:125-128
115. vonLiebig, J (1992). Animal Chemistry or Organic Chemistry in its Application to Physiology. International Journal of Sport Nutrition 2:307-316
116. Wagenmakers, A.J.M., Beckers, E.J., Brouns, F., Kuipers, H., Soeters, P.B., vander Vusse, G.J. & Saris, W.H.M (1991). Carbohydrate supplementation, glycogen depletion, and aminoacid metabolism during exercise. American Journal of Physiology 260:E883-E890
117. Waterlow, J.C (1995). Whole-body protein turnover in humans - past, present, and future. Annual Review of Nutrition 15, 57-92
118. Wessen, M, McNaughton, L., Davies, P. & Tristram, S (1988). Effects of oral administration of aspartic acid salts on the endurance capacity of trained athletes. Research Quarterly in Exercise and Sport 59:234-239
119. West, C.E. & Beynen, A.C (1985). Milk protein in contrast to plant protein: effects on plasma cholesterol. In: T.E. Galesloot & B.J. Tinbergen (eds.). Milk Proteins 84, pp. 80-87, Pudoc, Wageningen
120. White, T.P. & Brooks, G.A (1981). [U-14C] glucose, -alanine, -leucine oxidation in rats at rest and during two intensities of running. American Journal of Physiology 240:E155-E165
121. Wolfe, R.R (1992). Radioactive and Stable Isotope Tracers in Biomedicine: Principles and Practice of Kinetic Analysis. Wiley-Liss, New York
122. Yokogoshi, H., Iwata, T., Ishida, K. & Yoshida, A (1987). Effect of amino acid supplementation to low protein diet on brain and plasma levels of tryptophan and brain 5-hydroxyinodoles in rats. Journal of Nutrition 117:42-47
123. Young, V.R., Bier, D.M. & Pellet, P.L (1989). A theoretical basis for increasing current estimates of the amino acid requirements in adult man with experimental support. American Journal of Clinical Nutrition 50:80-92