Efectos del Ejercicio sobre las Hormonas Leptina y Ghrelina Acilada en Varones Entrenados
Serife Ozen1, Gul Sonmez2, Bekir Yuktasir1, Hasan Yalcin1, Guler Bugdayci3 y Mark Willems4
1School of Physical Education and Sports, Abant Izzet Baysal University, Bolu,Tuquía.
2Department of Health Sciences, Lehman College, Bronx, New York, Estados Unidos.
3Department of Biochemistry, Medicine Faculty, Abant Izzet Baysal University, Bolu, Turquía.
4Faculty of Sport, Education and Social Sciences, University of Chichester, Reino Unido.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2010.
Publicado 21 de junio de 2010
Resumen
Palabras clave: balance energético, ingesta de alimentos, ejercicio aeróbico, cinta rodante, intensidad moderada
INTRODUCCION
Los recientes estudios en endocrinología y metabolismo indican que los adipocitos funcionan como un tejido endocrino que produce diferentes substancias endocrinas importantes. Específicamente, los adipocitos liberan leptina, una proteína que, según los informes recibidos, disminuye la ingesta de alimentos, aumenta el gasto energético y preserva al tejido adiposo (51). Además de leptina, se ha demostrado que los adipocitos liberan un péptido relativamente nuevo, conocido como ghrelina (12, 26) y que la administración exógena de ghrelina, induce la liberación de la hormona de crecimiento (GH), estimula la ingesta de alimentos, aumenta el peso corporal (34, 42, 43, 45, 49,) y disminuye el metabolismo de los lípidos (42, 43). También se ha demostrado que durante el ayuno el nivel de leptina disminuye mientras que el de ghrelina aumenta (10, 37). Por consiguiente, tanto la leptina como la ghrelina están relacionadas con la regulación del balance energético. Esto ha provocado un creciente interés con respecto al estudio de los efectos del ejercicio sobre la ghrelina y leptina. Estudiar los efectos de estos péptidos puede aclarar cómo el ejercicio mejora la salud, dado que se ha demostrado que el entrenamiento físico mejora el estado de salud de individuos obesos y se asocia con la reducción del peso corporal (21, 29, 50).
Hasta la fecha, los estudios publicados sobre ejercicios agudos submáximos y máximos han presentado resultados contradictorios. Los estudios han informado aumentos (7, 23, 30), disminuciones (40, 44) o ningún cambio (6, 11, 15, 24, 27, 31, 36, 52) en las concentraciones totales de ghrelina como resultado del ejercicio. En todos estos estudios, se investigó el efecto del ejercicio sobre la concentración total de ghrelina.
La ghrelina en la circulación toma dos formas, ghrelina acilada y ghrelina desacilada (30); pero, sólo la ghrelina acilada tiene un grupo n-octanoil. Este grupo es necesario para que la ghrelina se una al receptor de secretagogos de la hormona de crecimiento (GHSR) para ingresar en el hipotálamo y en la glándula pituitaria y así afectar la ingesta de alimentos (26). Por consiguiente, podemos concluir que la acetilación de la ghrelina es esencial para la regulación del apetito. Actualmente, se conoce muy poco sobre la influencia del ejercicio agudo de intensidad moderada sobre la concentración de ghrelina acilada.
Hay algunos estudios que se centraron en los efectos del ejercicio sobre la ghrelina acilada (activa) (4, 5, 20, 25, 30, 32, 33). Dos estudios investigaron los efectos crónicos del ejercicio (25,33) y observaron que un programa de ejercicios de largo plazo no alteró la ghrelina acilada. Otros tres estudios (4, 15, 32) analizaron los efectos agudos de ejercicios de intensidad relativamente alta. Broom y colegas (4,5) observaron que 60 minutos de ejercicio al 70-72% del VO2 máx. se asociaban con una disminución en la concentración de ghrelina acilada. El otro estudio también informó una disminución en la concentración de ghrelina acilada en 8 varones obesos luego de un test de ejercicios incrementales en bicicleta ergométrica realizados hasta el agotamiento (4). A diferencia de lo observado en éste estudio, Mackelvie y colegas (30) observaron que ejercicios aeróbicos (65% de la frecuencia cardíaca máxima de reserva) realizados durante una hora durante 5 días consecutivos, aumentaron los niveles de ghrelina acilada en varones adolescentes con sobrepeso y peso normal.
Los resultados de estos pocos estudios sobre la ghrelina acilada son contradictorios y se necesitan estudios adicionales en el área. Las posibles causas de los resultados contradictorios pueden estar vinculadas a diferencias metodológicas provenientes de la selección de participantes y la intensidad, duración, frecuencia y tipo de ejercicio.
La intensidad del ejercicio en estudios previos era igual o superior al 70% de VO2 máx. lo que exigiría que los carbohidratos sean la fuente principal de energía sólo con una pequeña contribución de las grasas (4, 5, 32). Sin embargo la evidencia demuestra que hay una correlación entre la ghrelina y la selección del sustrato (3,47). La ghrelina favorece la adipogenesis in vivo (41) y perjudica la lipólisis en los adipocitos in vitro (8) mientras que la administración de ghrelina periférica y central aumenta la tasa respiratoria, lo que indicaría una menor utilización oxidativa de los lípidos en todo el cuerpo (42).
No hay ningún estudio en la literatura que haya investigado los efectos del ejercicio agudo de baja intensidad (<60% del VO2 máx.) y con lípidos como fuente principal de energía, sobre los niveles de ghrelina acilada y leptina plasmáticas. Por consiguiente, el objetivo de este estudio fue investigar el efecto del ejercicio agudo de intensidad moderada sobre los niveles de leptina y de ghrelina acilada.
METODOS
Sujetos
Siete varones no fumadores entrenados, de entre 18 y 21 años de edad, participaron voluntariamente en el estudio. Los sujetos no tenían antecedentes de ningún tratamiento médico reciente, ni de alguna enfermedad endocrina, no realizaban ninguna dieta de disminución o aumento de peso durante el transcurso del estudio, no habían tenido ninguna restricción dietaria en los últimos seis meses, ningún registro de diabetes u obesidad en el historial familiar, ningún problema gástrico o digestivo y ninguna enfermedad cardiovascular conocida. Realizaban ejercicio por lo menos tres veces por semana y tenían un historial de, por lo menos, cinco años de práctica de ejercicio regular. Los sujetos dieron su consentimiento informado después de que se les informaran los riesgos de participar en el estudio. El presente estudio fue aprobado por el Comité de Etica del Laboratorio de Investigaciones Médicas de la Escuela Universitaria de Medicina Abant Izzet Baysal, Bolu, Turquía y por el Comité de Revisión Institucional de la Universidad de Lehman, de la Ciudad de Nueva York, EE.UU.
Procedimientos
Determinaciones Preliminares
Mediciones Antropométricas
La altura se midió con un estadiómetro Holtain de pared fijo, con una precisión de 0,1 cm. La masa corporal se midió con una balanza de brazos cuya apreciación era de 0,01 kg. El espesor de los pliegues cutáneos se determinó en cuatro sitios (tríceps, bíceps, sub-escapular y supra-ilíaco) en el lado derecho del cuerpo mediante calibres (Skinfold Caliper Baseline MM, Fabrication Enterprise Incorporated, New York, Estados Unidos). La densidad corporal se determinó a través de una fórmula que abarcaba cuatro sitios y luego se estimó el porcentaje de grasa corporal usando la ecuación de Siri (38). El perímetro de cintura y de cadera fueron medidos con una apreciación del orden de 0,5 pulgadas (1,27 cm) usando una cinta de medición Novel Products Figure Finder Tape (Novel Products Inc., Rockton, Illinois). El perímetro de la cintura se midió en la zona más angosta delimitada entre la décima costilla y la cresta ilíaca; el perímetro de la cadera se determinó en el nivel de protrusión máxima de los músculos glúteos. Las medidas fueron obtenidas por duplicado. Si las dos diferían en más de 1 pulgada (2,54 centímetros), se realizaba una tercera medición. Luego se utilizó el promedio de las dos mediciones. Se determinó de manera apropiada la relación cintura:cadera (39).
Test VO2 máx.
El consumo de oxígeno máximo se determinó a través de un protocolo incremental de Bruce con etapas de 3 min utilizando un analizador de gases Cortex II Metalyser (Corteza Biophysik, Leipzig, Alemania). Antes de comenzar el test, el analizador fue calibrado con gases de concentración conocida siguiendo las recomendaciones del fabricante. Se consideraba que el consumo de oxígeno máximo había sido alcanzado cuando se cumplían los siguientes criterios: (1) la frecuencia cardíaca se encontraba dentro de un intervalo de ±10 latidos.min-1 de la frecuencia cardíaca máxima para la edad; (2) la tasa de intercambio respiratorio (RER) ≥ 1,15; y (3) se observaba un plateau en el consumo de oxígeno.
Pruebas Experimentales
Se analizaron dos condiciones (ejercicio o control) siguiendo un diseño experimental aleatorizado, contrabalanceado. El tiempo transcurrido entre las dos pruebas fue por lo menos de 1 semana. Para cada prueba, los participantes acudieron al laboratorio a las 9:00 luego de una ayuno como mínimo toda la noche de 10 horas (sin consumir ningún alimento o bebida excepto agua). En la condición de ejercicio, los sujetos corrieron a 50% VO2 máx. con una RER (VCO2/VO2) entre 0,7-0,8 durante 60 minutos.
Durante el ejercicio, los sujetos respiraron a través de una máscara facial. Las variables de intercambio respiratorio de gases fueron medidas a lo largo del test, respiración por respiración, y los datos fueron almacenados en intervalos de 10 segundos. El consumo de oxígeno (VO2) y la producción de anhídrido carbónico (VCO2) fueron medidos continuamente utilizando un analizador Cortex II Metalyser (Cortex Biophysik, Leipzig, Alemania). La tasa de intercambio respiratorio media (RER) fue calculada a partir de las mediciones realizadas. El gasto de energía bruto durante el ejercicio fue calculado mediante la ecuación de Weir (46). La oxidación de grasas y carbohidratos fue determinada indirectamente, a través del monitoreo de la tasa de intercambio respiratorio (RER). La velocidad de la cinta rodante iba siendo ajustada cada pocos minutos para mantener la velocidad al 50% del VO2 máx. según los resultados preliminares del test .
Muestreo y Análisis de la Sangre
Cuarenta y cinco minutos antes de realizar los ejercicios, se insertó una cánula en la vena del antebrazo de los participantes y luego se les permitió descansar. Diez minutos antes del ejercicio, se recolectó la primera muestra de sangre en ambos grupos. La segunda muestra de sangre se recolectó inmediatamente después del ejercicio y después de 60 minutos, en la condición control. Las muestras de sangre para la determinación de la hormona ghrelina, fueron recolectadas en tubos fríos que contenían Na2 EDTA (1,25 mg.mL-1) y aprotinina (500 U mL-1) (Phoenix pharmaceuticals, Burlingame, Estados Unidos). Para las determinaciones de leptina, fueron colocados 3 mL de sangre en tubos con tapa roja.
Inmediatamente después de la recolección de las muestras de sangre, los tubos para la determinación de ghrelina fueron centrifugados a 1500 g durante 15 minutos a 4°C. Las muestras del plasma obtenidas fueron mezcladas con 1 mol.L-1 de HCl (ácido clorhídrico) en una proporción 1/10 y fueron guardadas a -70°C. Los tubos con tapa roja fueron centrifugados después de la coagulación y posteriormente las muestras de suero fueron guardadas a -70°C, hasta el día en que se realizó la determinación de la hormona. La ghrelina acilada se evaluó en el plasma (Sceti, Tokio, Japón) y la leptina en el suero (DRG, Marburg, Alemania) con el método ELISA (Sandwich).
Control de la Dieta y del Ejercicio
Durante 2 días antes de las pruebas, se solicitó a los participantes que realizaran su actividad física regular. Debían pesar y registrar toda la comida y bebida consumida durante las 48 horas inmediatamente antes de la primera prueba y reproducir esta ingesta durante las 48 horas previas a la segunda prueba. Se solicitó a los participantes abstenerse de consumir alcohol durante éstos períodos de prueba. El ingesta de la dieta fue analizada utilizando el software de www.mydietanalysis.com.
Análisis Estadísticos
Los datos no presentaban distribución normal, las varianzas no eran homogéneas y N era inferior a 30, por lo tanto utilizamos el test no paramétrico de Wilcoxon. Se determinó la media y desviación estándar de los datos (±DS). Las diferencias entre los valores pre-test y post-test de las condiciones, ejercicio y control, fueron analizadas con el test de Wilcoxon. El nivel de significancia fue fijado en p<0,05. Los resultados fueron analizados con el software estadístico SPSS 15,0, (SPSS Inc., Chicago, IL, Estados Unidos).
RESULTADOS
Las características físicas de los sujetos (Media ±DS) fueron las siguientes: edad: 19,42±0,97 años, talla: 1,75±0,05 m, masa corporal: 70,6±4,0 kg, índice de masa corporal (BMI): 23,04±0,54 kg.m-2, perímetro de la cintura: 79,28±3,54 cm, relación cintura/cadera: 0,87± 0,05, grasa corporal: 19,91±0,01%, consumo de oxígeno máximo: 63,14±6,09 mL.kg-1.min-1. Las características de los sujetos se presentan en la Tabla 1.
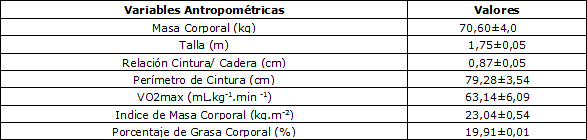
Tabla 1. Características físicas de los participantes. Los valores se presentan como Media±DS (n=7).
Respuestas Obtenidas luego de la Carrera en Cinta Rodante
El consumo de oxígeno máximo porcentual medio, producido durante el ejercicio fue 50,12±1,13%. El 50% del VO2 máx. medio fue 32,30±5,45 mL.kg-1.min-1 y la tasa de intercambio respiratorio media fue 0,76±0,05. El gasto energético bruto durante el ejercicio fue 686,14±55,36 kcal donde 83±2% de la energía provenía de las grasas y 17±2% provenía de los carbohidratos. La frecuencia cardíaca media durante el ejercicio fue 143,18±3,30 latidos/min.
Análisis Nutricional
Los sujetos consumieron 9445,71±1261,73 kcal y 8901,42±1057,00 kcal en 48 horas en los grupos ejercicio y control, respectivamente. No se observaron diferencias significativas entre los grupos (p=0,091)
Ghrelina Acilada y Leptina
El análisis estadístico de datos reveló que hay diferencias estadísticamente significativas entre los valores observados en las concentraciones de leptina (p=0,02) y de ghrelina (p=0,02) antes del test (pre-test) y los observados después del test (post-test) en el grupo que realizó ejercicios. Por otro lado en el grupo control, no se observaron diferencias estadísticas en las concentraciones de leptina (p=0,12) ni en las de ghrelina (p=0,73) pre- test vs. post-test, (Tabla 2).
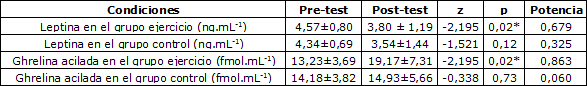
Tabla 2. Efecto del ejercicio en cinta rodante realizado a una intensidad del 50% del VO2 máx. durante 60 min, sobre los niveles de leptina en suero y de ghrelina en el plasma, entre las determinaciones pre- y post-test.* Se observan diferencias significativas entre las determinaciones pre-y post-test (p<0,05). Los valores se presentan como Media±DS (n=7).
En la condición de ejercicio, 1 hora de ejercicio de intensidad moderada produjo un aumento significativo del 45% en la concentración plasmática de ghrelina acilada (13,23±3,69 a 19,17±7,31 fmol.mL-1) y una disminución significativa del 17% en la concentración de leptina en el suero (4,57± 0,80 a 3,80±1,19 ng.mL-1); de manera contraria no se observaron diferencias significativas pre- vs. post-test en la concentración plasmática de ghrelina (14,18±3,82 fmol.mL-1 y 14,93±5,66 fmol/ml) y de leptina en el suero (4,34±0,69 ng.mL-1 y 3,54±1,44 ng.mL-1) en la condición control.
El análisis estadístico de los datos, también mostró que la diferencia entre la media pre- vs. post-test de la concentración de ghrelina acilada, era significativamente diferente entre los grupos, ejercicio y control (p=0,01), mientras que la diferencia de la media de la concentración pre- vs. post-test, de leptina no era significativamente diferente (p=0,61) entre los grupos ejercicio y control (Tabla 3).
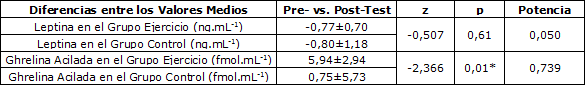
Tabla 3. Efecto del ejercicio en cinta rodante realizado a una intensidad del 50% del VO2 máx. durante 60 min, sobre los niveles de leptina en suero y de ghrelina en el plasma entre los grupos.* Se observan diferencias significativas en las determinaciones entre los grupos (p<0,05). Los valores se presentan como Media±DS (n=7).
DISCUSION
Este estudio evaluó los niveles de ghrelina acilada y de leptina inmediatamente después de la realización de un ejercicio agudo de intensidad moderada de larga duración (VO2 máx. inferior a 60%) en varones entrenados. El hallazgo principal del presente trabajo fue un aumento significativo en los niveles de ghrelina acilada y una disminución en los de leptina, inmediatamente después del ejercicio. El resultado observado, un aumento en la concentración de ghrelina acilada después del ejercicio, sólo concuerda con los resultados de uno de los estudios anteriores (30) que demostró que 5 días consecutivos de ejercicio aeróbico aumentaron la concentración de ghrelina acilada. Si bien este resultado no coincide con lo encontrado en otros estudios (4, 5, 32), estos estudios emplearon protocolos de ejercicio diferentes.
En los estudios anteriores, la duración de los ejercicios fue menor y/o la intensidad de los mismos mayor.
El presente estudio investigó los efectos del ejercicio moderado sobre los niveles de ghrelina acilada después de un ejercicio, durante el cual se utilizó como fuente de energía principal a las grasas (RER = 0,76) en comparación con otros estudios (4, 5, 32) donde se usaron los carbohidratos como fuente de energía (RER=0,89 - 0,94). El aumento en RER sugiere un cambio en la oxidación de las grasas hacia la oxidación de carbohidratos. Nitsche et al. (35) informaron que en niños obesos y adolescentes, después de 10 días de restricción calórica y ejercicio, el BMI disminuyó, mientras que la RER y los niveles de ghrelina aumentaron; y además observaron una correlación entre los dos (35). Esto demuestra que la ghrelina acilada es un indicador sensible del cambio de oxidación de sustratos. La deficiencia energética inducida por el ejercicio agudo de intensidad moderada aumenta la ghrelina acilada. Este cambio puede actuar como un estimulante metabólico, desempeñando un papel fundamental en la compensación de la deficiencia energética, aumentando el apetito y la ingesta de alimentos (9).
Es posible que el aumento en los niveles de ghrelina acilada después del ejercicio pueda ser un intento de disminuir la utilización de lípidos, dado que la infusión central de ghrelina inhibe la oxidación de lípidos y aumenta la lipogénesis, la entrada de triglicéridos a las células grasas blancas (37) y la utilización de carbohidratos (47).
Diferentes estudios proporcionaron evidencia que afirma (7, 23, 30) que los mayores niveles de ghrelina total luego de los ejercicios de intensidad moderada, estarían vinculados con el uso de las grasas como fuente de energía principal. Cuando se comparó una dieta de elevado contenido graso con una dieta de bajo contenido graso, la dieta baja en grasas disminuyó los niveles de ácidos grasos libres y aumentó el nivel de ghrelina de un modo más significativo, que una dieta rica en grasas durante y después del ejercicio de intensidad moderada (7).
Otros estudios han demostrado que la infusión intravenosa de ácidos grasos libres suprime rápidamente la ghrelina total a una tasa del 22% (18, 19). El rol fisiológico de los ácidos grasos libres en la supresión de la ghrelina total no ha sido establecido con claridad. Posiblemente puede explicarse por el hecho que los niveles crecientes de lípidos y ácidos grasos libres en circulación, podrían enviar al sistema nervioso central la señal que indica que hay abundancia de alimentos y no hay necesidad de ingerir más comida. Por otra parte, podría haber factores adicionales asociados con la circulación de ácidos grasos libres como resultado del ejercicio. La supresión de la ghrelina podría estar relacionada con la cascada de eventos (es decir, catecolominas, lipasa sensible a hormonas, AMPc, hormona de crecimiento, glucagón) que liberan ácidos grasos libres del tejido adiposo durante el ejercicio. Esto también debería ser investigado en estudios futuros.
También, en el estudio actual, el ejercicio produjo una disminución de leptina en el suero después de los ejercicios en la condición ejercicio comparada con la condición control. La mayoría de los estudios actuales que evaluaron los efectos del ejercicio sobre los niveles de leptina coinciden con éste resultado (13, 14, 22). Los trabajos cuyos resultados coinciden con los resultados del presente estudio fueron realizados en atletas, mientras que el estudio que presenta resultados contrarios (28) fue realizado con individuos obesos.
La ghrelina también esta regulada negativamente por la leptina. Se ha demostrado que luego de la administración de leptina, la concentración de ghrelina disminuye y el gasto energético aumenta (2, 37). Por lo tanto, cuando el nivel de leptina disminuye después de ejercicios de intensidad moderada de larga duración, el efecto supresor sobre la ghrelina también podría disminuir.
El ejercicio de intensidad moderada de larga duración (VO2 máx. inferior a 60%) ha sido postulado como una modalidad de ejercicio para disminuir la grasa corporal (16). Los resultados del estudio actual, ponen en duda el uso del ejercicio de intensidad moderada de larga duración como una metodología de ejercicio para disminuir la grasa corporal. Los resultados del presente estudio demostraron que este tipo de ejercicio puede producir una disminución en los niveles de leptina y un aumento en los de ghrelina. Se ha demostrado que el aumento en los niveles de ghrelina acilada y la disminución en los niveles de leptina aumentan el apetito y la ingesta de alimentos (1, 17, 35, 48). Por lo tanto, el ejercicio de intensidad moderada de larga duración (VO2 máx. inferior al 60%) podría estimular la ingesta de energía después del ejercicio y haciendo más difícil el control del peso. También deberían realizarse otros estudios controlados para entender los efectos de este tipo de ejercicio sobre la ghrelina acilada y la leptina en persona obesas, con sobrepeso y sedentarias.
El presente estudio posee varias limitaciones. Primero; no se realizaron mediciones de ácidos grasos libres, para comprender mejor la relación entre la utilización de grasas y la secreción de ghrelina.
Segundo, no se midió la ingesta de alimentos ni se obtuvieron las puntuaciones en una escala de apetito de los sujetos después del ejercicio. Tercero, las determinaciones efectuadas en la sangre no fueron repetidas luego de un cierto tiempo después del ejercicio (1-3 horas) para determinar si los cambios se mantenían. Cuarto, en el procedimiento se usaron como mínimo 10 horas de ayuno, porque esta es la duración del ayuno, que ha sido informada en la literatura (4-6). Sin embargo, no se informó si los sujetos tenían un ayuno más prolongado, y se desconoce cómo esto podría haber afectado los niveles de ghrelina y leptina.
Conclusión
En conclusión, este estudio demostró que la deficiencia energética inducida por el ejercicio agudo de intensidad moderada (VO2 máx. inferior a 60%) disminuye el nivel de leptina, mientras aumenta el de ghrelina acilada. Este resultado cuestiona el rol de este tipo de ejercicio en el control del peso. Es necesario realizar investigaciones más detalladas para determinar la importancia de este resultado. Tales investigaciones podrían tener implicancias importantes con respecto al rol de los ejercicios agudos de intensidad moderada y larga duración sobre el manejo del peso.
Agradecimientos
Este estudio fue financiado por el premio George Shuster Fellowship Award de la Universidad de Lehman, de la Ciudad de Nueva York, Bronx, NY, EE.UU. Los autores agradecen las instituciones que colaboraron y apoyaron esta investigación.
Referencias
1. Akther A., Khan K. H., Begum M., Parveen S., Kaiser M. S., Chowdhury A. Z (2009). Leptin: a mysterious hormone; its physiology and pathophysiology. Mymensingh Med J; 18: S140-144
2. Asakawa A., Inui A., Kaga T., Yuzuriha H., Nagata T., Ueno N., Makino S., Fujimiya M., Niijima A., Fujino M. A., Kasuga M (2001). Ghrelin is an appetite-stimulatory signal from stomach with structural resemblance to motilin. Gastroenterol 120:337-45
3. Barazzoni R., Bosutti A., Stebel M., Cattin M. R., Roder E., Visintin L., Cattin L., Biolo G., Zanetti M., Guarnieri G (2005). Ghrelin regulates mitochondrial-lipid metabolism gene expression and tissue fat distribution favoring triglyceride deposition in liver but not skeletal muscle. Am J Physiol Endocrinol Metab 288:228-E235
4. Broom D. R., Batterham R. L., King J. A., Stensel D. J (2009). Influence of resistance and aerobic exercise on hunger, circulating levels of acylated ghrelin, and peptide YY in healthy males. Am J Physiol 296:R29-35
5. Broom D. R., Stensel D. J., Bishop N. C., Burns S. F., Miyashita M (2007). Exercise-induced suppression of acylated ghrelin in humans. J Appl Physiol 102:2165-71
6. Burns S. F., Broom D. R., Miyashita M., Mundy C., Stensel D. J (2007). A single session of treadmill running has no effect on plasma total ghrelin concentrations. J Sports Sci Med 25:635-642
7. Choi K., Roh S. G., Hong Y. H., Shrestha Y. B., Hishikawa D., Chen C., Kojima M., Kangawa K. and Sasaki S (2003). The role of ghrelin and growth hormone secretagogues receptor on rat adipogenesis. Endocrinol 144:754-759
8. Cummings D. E (2006). Ghrelin and the short- and long-term regulation of appetite and body weight. Physiol Behav 89:71-84
9. Cummings D. E., Purnell J. Q., Frayo R. S., Schmidova K., Wisse B. E., Weigle D. S (2001). A preprandial rise in plasma ghrelin levels suggests a role in meal initiation in humans. Diabetes 50:1714-9
10. Date Y., Kojima M., Hosoda H., Sawaguchi A., Mondal M. S., Suganuma T., Matsukura S., Kangawa K., Nakazato M (2000). Ghrelin, a novel growth hormone-releasing acylated peptide, is synthesised in a distinct endocrine cell type in gastrointestinal tract of rats and humans. Endocrinol 141:42554261
11. Desgorces F. D., Chennaoui M., Drogou C., Guezennec C. Y., Gomez-Merino D (2008). Relationships between leptin levels and carbohydrate intake during rowing training. J Sports Med Phys Fitness 48:83-89
12. Desgorces F. D., Chennaoui M., Gomez-Merino D., Drogou C., Guezennec C. Y (2004). Leptin response to acute prolonged exercise after training in rowers. Eur J Appl Physiol 92:609-611
13. Erdmann J., Tahbaz R., Lippl F., Wagenpfeil S., Schusdziarra V (2007). Plasma ghrelin levels during exercise - Effects of intensity and duration. Regulatory Peptides 143:127-135
14. Foricher J. M., Ville N., Gratas-Delamarche A., Delamarche P (2003). Effects of submaximal intensity cycle ergometry for one hour on substrate utilisation in trained prepubertal boys versus trained adults. J Sports Med Phys Fitness ;43:36-43
15. Gormsen L. C., Gjedsted J., Gjedde S., Vestergaard E. T., Christiansen J. S., Jorgensen O. T., Nielsen S., Moller N (2006). Free fatty acids decrease circulating ghrelin concentrations in humans. J Endocrinol 154:667673
16. Hagobian T. A., Sharoff C. G., Stephens B. R., Wade G. N., Silva J. E., Chipkin S. R., Braun B (2009). Effects of exercise on energy-regulating hormones and appetite in men and women. Am J Physiol 296:R233-42
17. Johnson N. A., Sachinwalla T., Walton D. W., Smith K., Armstrong A., Thompson M. W., George J (2009). Aerobic exercise training reduces hepatic and visceral lipids in obese individuals without weight loss. Hepatol Jun 15. Epub ahead of print doi: 10.1002/hep.23129
18. Jurimae J., Jurimae T (2004). Plasma leptin responses to prolonged sculling in female rowers. J Sports Med Phys Fitness 44:104-109
19. Kim H. J., Lee S., Kim T. W., Kim H. H., Jeon T. Y., Yoon Y. S., Oh S. W., Kwak H., Lee J. G (2008). Effects of exercise-induced weight loss on acylated and unacylated ghrelin in overweight children. Clin Endocrinol 68:416-422
20. Kojima M., Hosoda H., Date Y., Nakazato M., Matsuo H., Kangawa K (1999). Ghrelin is a growth-hormone-releasing acylated peptide from stomach. Nature 402:656660
21. Kraemer R. R., Durand R. J., Acevedo E. O., Johnson L. G., Kraemer G. R., Hebert E. P., Castracane V. D (2004). Rigorous running increases growth hormone and insulin-like growth factor-I without altering ghrelin. Exp Biol Med 229:240246.
22. Kyriazis G. A., Caplan J. D., Lowndes J., Carpenter R. L., Dennis K. E., Sivo S. A., Angelopoulos T. J (2007). Moderate exercise-induced energy expenditure does not alter leptin levels in sedentary obese men. Clin J Sports Med 17:49-51
23. Levinger I., Goodman C., Hare D. L., Jerums G., Morris T., Selig S (2009). Psychological Responses to Acute Resistance Exercise in Men and Women Who Are Obese. J Strength Cond Res 23:1548-52
24. Mackelvie Kerry JGraydon S. Meneilly, Dariush Elahi, Alfred C. K. Wong, Susan I. Barr and Jean-Pierre Chanoine (2007). Regulation of Appetite in Lean and Obese Adolescents after Exercise: Role of Acylated and Desacyl Ghrelin. J Clin Endocrinol Metab 92:648-654
25. Martins C., Morgan L. M., Bloom S. R., Robertson M. D (2007). Effects of exercise on gut peptides, energy intake and appetite. J Endocrinol 193:251-258
26. Marzullo P., Salvadori A., Brunani A., Verti B., Walker G. E., Fanari P., Tovaglieri I., Medici C. D., Savia G., Liuzzi A. (2008). Acylated ghrelin decreases during acute exercise in the lean and obese state. Clin Endocrinol 69:970-1
27. Mirzaei B., Irandoust K., Rahmani-Nia F., Mohebbi H., Hassan-Nia S (2009). Unacylated Ghrelin levels increase after aerobic exercise program in obese women. Braz J Biomotricity 3:11-20
28. Nakazato M., Murakami N., Date Y., Kojima M., Matsuo H., Kangawa K., Matsukura S (2001). A role for ghrelin in the central regulation of feeding. Nature 409:194198
29. Nitsche H., Nitsche M., Sudi K., Tschop M., Zotter H., Weinhand G., Froehlich-Reiterer E., Gallisti S., Pirker M., Borkenstein M (2007). Ghrelin an indicator for fat oxidation in obese children and adolescents during a weight reduction program. J Pediatr Endocrinol Metab 20:719-23
30. Schmidt A., Maier C., Schaller G., Nowotny P., Bayerle-Eder M., Buranyi B., Luger A., Wolzt M (2004). Acute exercise has no effect on ghrelin plasma concentrations. Horm Metab Res 36:174-177
31. Shintani M., Ogawa Y., Ebihara K (2001). Ghrelin, an endogenous growth hormone secretagogue is a novel orexigenic peptide that antagonizes leptin action through the activation of hypothalamic neuropeptide Y/Y1 receptor pathway. Diabetes 50:227-232
32. Siri W. E (1961). Body composition from fluid spaces and density: analysis of methods. In Henschel, A (ed). Techniques for Measuring Body Composition. Natl Acad Sci National Res 223244
33. Slattery M. L., Schumacher M. C., Lanier A. P., Edwards S., Edwards R., Murtaugh M. A., Sandidge J., Day G. E., Kaufman D., Kanekar S., Tom-Orme L., Henderson J. A (2007). A Prospective Cohort of American Indian and Alaska Native People: Study Design, Methods, and Implementation. Am J Epidemiol 166:606615.
34. Stock S., Leichner P., Wong A. C., Ghatei M. A., Kieffer T. J., Bloom S. R., Chanoine J. P (2005). Ghrelin, PYY, GIP and hunger responses to a mixed meal in anorexic, obese and control female adolescents. J Clin Endocrinol Metab 90:21612168
35. Thompson N. M., Gill D. A., Davies R., Loveridge N., Houston P. A., Robinson I. C. and Wells T (2004). Ghrelin and des-octanoyl ghrelin promote adipogenesis directly in vivo by a mechanism independent of the type 1a growth hormone secretagogue receptor. Endocrinol 145:234-242
36. Vestergaard E. T., Dall R., Lange K. H., Kjaer M., Christiansen J. S., Jorgensen J. O (2007). The ghrelin response to exercise before and after growth hormone administration. J Clin Endocrinol Metab 92:297-303
37. Vriese De C., Delporte C (2008). Ghrelin: A new peptide regulating growth hormone release and food intake. Int J Biochem Cell Biol 40:1420-4
38. Weir J. B. de V (1949). New Methods for Calculating Metabolic Rate with Special Reference to Protein Metabolism. J Physiol 109:1-9
39. Wortley K. E., Anderson K. D., Garcia K., Murray J. D., Malinova L., Liu R., Moncrieffe M., Thabet K., Cox H., Yancopoulos G. D., Wiegand S. I., Sleeman M. W (2004). Genetic deletion of ghrelin does not decrease food intake but influences metabolic fuel preference. Natl Acad of Sci USA;101:8227-32
40. Wren A. M., Seal L. J., Cohen M. A., Brynes A. E., Frost G. S., Murphy K. G., Dhillo W. S., Ghatei M. A., Bloom S. R (2001). Ghrelin enhances appetite and increases food intake in humans. J Clin Endocrinol & Metab 86:59925995
41. Wren A. M., Small C. J., Ward H. L., Murphy K. G., Dakin C. L., Taheri S., Kennedy A. R., Roberts G. H., Morgan D. G., Ghatei M. A., Bloom S. R (2000). The novel hypothalamic peptide ghrelin stimulates food intake and growth hormone secretion. Endocrinol 141;43254328
42. Yackobovitch-Gavan M., Nagelberg N., Phillip M., Ashkenazi-Hoffnung L., Hershkovitz E., Shalitin S (2009). The influence of diet and/or exercise and parental compliance on health-related quality of life in obese children. Nutr Res 29:397-404
43. Zhang Y., Proenca R., Maffei M. et al (1994). Positional cloning of the mouse obese gene and its human homologue. Nature;372:425-432
44. Zoladz J. A., Konturek S. J., Duda K., Majerczak J., Sliwowski Z., Grandys M. and Bielanski W (2005). Effect of moderate incremental exercise, performed in fed and fasted state on cardiorespiratory variables and leptin and ghrelin concentrations in young healthy men. J Physiol Pharmacol 56:63-85