Efectos del Momento de Suplementación con Glucosa sobre el Metabolismo Proteico después del Entrenamiento de la Fuerza
Duncan Mac Dougall1, Mark A Tarnopolsky1,2, J. Fowles1 y K. E Yarasheski3
1Department of Kinesiology, McMaster University, Hamilton, Ontario, Canada L8S 4K1.
3Metabolism Division, Washington University School of Medicine, St. Louis, Missouri.
Artículo publicado en el journal PubliCE, Volumen 0 del año 1997.
Publicado 29 de septiembre de 2003
Resumen
Palabras clave: síntesis proteica muscular, degradación proteica, 3 metilhistidina, nitrógeno de la urea, insulina
INTRODUCCIÓN
El crecimiento muscular en humanos adultos se produce a partir de la hipertrofia de las fibras musculares (11). La hipertrofia es el resultado de un incremento del balance proteico muscular neto [i.e., velocidad fraccional de síntesis de proteínas musculares (FSR) – velocidad de degradación de proteínas musculares (MPD)]. En humanos, tanto la FSR (4, 6, 30) como la MPD (4) pueden ser estimuladas por medio del ejercicio de fuerza de alta intensidad. También es conocido que el transporte de aminoácidos está incrementado después del ejercicio de fuerza (83). Favorecer la comprensión de los factores que influencian el balance proteico neto puede permitir maximizar la FSR y minimizar la MPD, incrementando de esta manera la tasa y la cantidad de hipertrofia muscular.
Las investigaciones en el área del entrenamiento de la fuerza y sus efectos sobre la FSR y la MPD es limitada. Recientes trabajos de laboratorios independientes han demostrado que la FSR esta elevada después de una serie de entrenamiento de fuerza en humanos (4, 6). Sin embargo, después del ejercicio de fuerza en estado de ayuno el balance proteico neto, aunque más positivo, siguió siendo negativo (4). Se ha demostrado además que en el estado alimentado, los individuos entrenados en fuerza en comparación con individuos sedentarios poseen un balance proteico neto positivo en todo el cuerpo, una mayor tasa de síntesis proteica en el cuerpo entero (WBPS) y un elevado flujo de aminoácidos (23). Estas inconsistencias pueden relacionarse con la disponibilidad de aminoácidos y el estado de energía durante el estado hiper-insulinémico (2).
Aparentemente cuando la insulina es combinada con el incremento en la liberación de aminoácidos, la FSR y la WBPS permanecen incrementadas (2). La importancia de la insulina suprimiendo o atenuando el incremento en la MPD luego del ejercicio puede ser de particular importancia en el período posterior a la ejercitación (4).
Los estudios hasta la fecha no han señalado la interacción potencial del ejercicio de fuerza y la insulina/estado nutricional sobre el turnover de la leucina/balance proteico. Debido a que la insulina puede causar una disminución en la MPD, y un posible incremento en la FSR, y es sabido que el ejercicio de fuerza incrementa la FSR, es posible que la insulina pueda disminuir la MPD e incrementar simultáneamente la FSR después del ejercicio de fuerza. Si esto último ocurre en combinación con el incremento en la FSR debido al ejercicio (4, 6), el balance proteico neto puede ser aún más positivo, resultando de esta manera en un mayor crecimiento neto de las proteínas miofibrilares. El consumo de un suplemento de carbohidratos (CHO) es un método simple para incrementar las concentraciones de insulina luego del ejercicio (9, 32).
Nosotros hipotetizamos que un suplemento de CHO consumido inmediatamente después del ejercicio puede resultar en: 1) una disminución en la excreción urinaria de 3-metilhistidina (3-MH) (un marcador de la MPD), 2) un incremento en la tasa de incorporación de leucina [13C] muscular (un marcador de la FSR), y 3) una disminución en la excreción urinaria de nitrógeno de la urea (balance proteico neto positivo).
MÉTODOS
Sujetos
Ocho hombres jóvenes (edad 20-25 años) y saludables que participaron de programas de entrenamiento de la fuerza durante por lo menos 1 año antes de la investigación (> 2 veces/semana) formaron parte del presente trabajo (Tabla 1). Antes de obtener el informe de consentimiento se les explicó a cada uno de los voluntarios los procedimientos experimentales y los posibles riesgos y beneficios de participar en el estudio. El estudio fue aprobado por el Comité de Ética Humana de la Universidad de MacMaster.
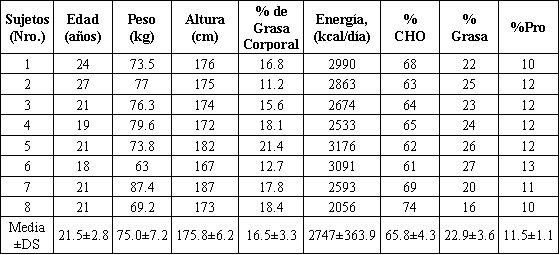
Tabla 1. Datos descriptivos de los sujetos. CHO: carbohidratos; Pro:
proteínas.
Diseño
Cada sujeto participó en un diseño doble ciego aleatorio controlado con placebo, que incluyó luego del ejercicio, un tratamiento de suplementación con CHO y otro con placebo (Nutrasweet; Pl). Los sujetos realizaron dos ejercicios de extensión de rodilla unilateral de manera que los músculos de la pierna que no se ejercitó sirvieron como control [pierna de ejercicio (Ex) y pierna de reposo (Con)]. Una semana antes de los dos tratamientos, se determinó la fuerza máxima de los sujetos en una repetición máxima (1RM) para los ejercicios de extensión de rodilla y press de pierna, y también se determinó la densidad corporal a través de pesaje hidrostático. Además, los sujetos completaron registros dietéticos durante 4 días, que fueron analizados con un software de análisis nutricional (Nutritionist III, First Data Bank, San Bruno, CA). A partir de este análisis se creó una dieta para cada sujeto. Las dietas fueron isoenergéticas, poseían igual cantidad de nitrógeno, no contenían carne, y fueron controladas durante los tres días previos a cada tratamiento. En el día del tratamiento, se suministró a los sujetos el alimento empaquetado que fue consumido en tres comidas. Para el tratamiento de CHO, los sujetos recibieron la bebida (1g/kg glucosa) inmediatamente y 1 h después de la serie de ejercicio mientras que consumieron el Pl (Nutrasweet) con el desayuno. En el tratamiento Pl, los sujetos consumieron una bebida (2g/kg de glucosa) con su desayuno y el placebo luego del ejercicio en los mismos momentos en que se consumieron los CHO. El consumo diario de energía y nitrógeno fue el mismo para ambos tratamientos.
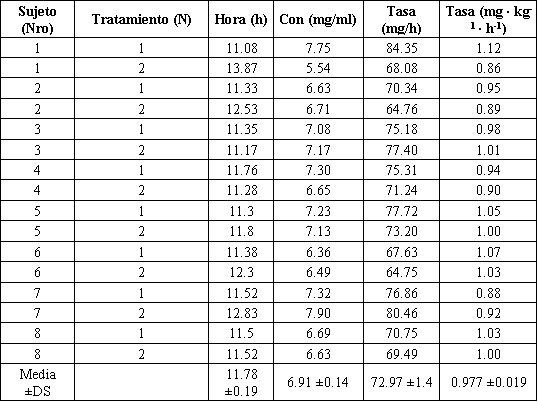
Tabla 2. Datos de infusión. Con: concentración.
Los sujetos se abstuvieron de realizar cualquier ejercicio de fuerza con las piernas 3 días antes de cada tratamiento y de cualquier tipo de actividad física durante los dos días previos a cada tratamiento. En el día de tratamiento los sujetos consumieron los alimentos a las 07:00/11:00/14:00 horas y se reportaron al laboratorio a las 17:00 horas (t =-120 min). Se insertó un catéter calibre 20 dentro de una vena ante-cubital para la infusión de un marcador, como fue descrito por Tarnopolsky et al. (23, 24). Se colocó un segundo catéter en una vena contralateral del dorso de la mano para obtener muestras de sangre “arterializada” (hot box a 65±5 °C) (16). Para determinar la FSR de las proteínas musculares mixtas se usó una (0.972 ±0.03 mg/kg) infusión principal constante (0.977 ±0.02 mg x kg-1 x h-1) de leucina L-[l-13C] (Masstrace, Somerville, MA) como se describió previamente (6, 3, 30). La leucina L-[l-13C] pasó a través de un filtro antibacterial (0.2 µm; Arodisc) inmediatamente antes de la infusión. A las ~18:30 (t =-30min), los sujetos realizaron el entrenamiento de fuerza prescripto [4 series de press de pierna y extensión de rodilla unilateral, al 85% de una repetición máxima (RM), 8-10 repeticiones]. Los 90 minutos entre el comienzo de la infusión y el inicio del ejercicio transcurrieron para asegurar la llegada a una meseta isotópica (23). Inmediatamente después del ejercicio (~19:00; t=0), se tomó una muestra de sangre y una muestra de músculo del músculo vasto lateral de cada pierna (post-Ex0, post-Con0) por medio de una biopsia de succión con aguja (Stille) de Bergström modificada, y se consumió la bebida con glucosa (1g/kg) o Nutrasweet. Las muestras de sangre (4 ml) fueron recolectadas cada 15 minutos durante la hora siguiente e inmediatamente centrifugadas y almacenadas a –50 °C. A las ~20:30 (t=+1 h) se administró una segunda bebida con CHO (1g/kg) o placebo. Las muestras de sangre fueron nuevamente recolectadas cada 15 minutos por la siguiente 1,5 h y nuevamente a las ~04:00, 04:30, y 05:00 de la mañana siguiente. Las últimas muestras de biopsias fueron tomadas a las ~05:00 horas (post-Ex10, post-Con10; ~10-h de terminado el ejercicio). Para la determinación de 3-MH, y nitrógeno de la urea los sujetos recolectaron todas las muestras de orina excretadas durante un período de 24-h (~12 pre-Ex, ~12 h post-Ex). La recolección de la orina comenzó en la mañana (06:00) del tratamiento (sin recolectar la primera orina) y continuó hasta el final de la mañana siguiente (06:00). Durante el período de recolección las dietas fueron isoenergéticas y contuvieron la misma cantidad de nitrógeno. Los sujetos no salieron del laboratorio hasta que fue recolectada la última muestra de orina.
Análisis
Se removieron los tejidos conectivo y graso visibles de las muestras de músculo, el cual fue posteriormente enfriado en nitrógeno líquido y mantenido a –70 °C. El aumento de L-[l-13C] en las proteína musculares mixtas fue determinado usando espectrometría de masa índice cromatografía gaseosa/combustión/isótopos (GC/C/IRMS) como fue descrito por Yarasheski et al. (29). La sangre fue analizada para glucosa plasmática [kit 315, coeficiente de variación (CV)= 3.9%, Sigma Diagnostics, St. Louis MO] y concentración de insulina (radioinmunoensayo, CV =2.9%, Diagnostic Products, Los Angeles, CA). Se preparó plasma α-[13C] del ácido cetoisocrapoico (α-KIC) como el derivado trimetilsilil-quinoxalinol. Su aumento isotópico se determinó con el uso de espectrometría de masa/cromatografía de gases de ionización de impacto electrónico (GC/MS), por medio de monitorización de iones seleccionados de una relación masa/carga de 233/232. Se determinó la excreción urinaria de nitrógeno de la urea y la excreción de creatinina a partir de una alícuota de la recolección de orina de 24-h, usando métodos colorimétricos como fue descripto por Tarnopolsky et al. (23) (kits 640 y 555, CV =4.7 y <1%, respectivamente, Sigma Diagnostics). Se determinó la concentración de 3-MH mediante un analizador de aminoácidos automático y fue normalizado para la excreción urinaria de creatinina de 24 h (Beckman Instruments, Palo Alto, CA).
Cálculos
La FSR muscular fue calculada de acuerdo a la siguiente ecuación:
FSR = (Lem x 100)/(Kep x t)
dónde la FSR de proteínas musculares es medida en porcentaje por hora, t es el tiempo (en h) entre las muestras de músculo, tomadas de la misma pierna, Lem es el incremento en la abundancia de 13C en la leucina de las proteínas musculares mixtas obtenida entre las muestras musculares sacadas de cada pierna, y Kep es el aumento plasmático medio de α-[13C] KIC de las muestras de sangre para t= 2.5, ~10, y ~10.5 h (corregidas por la abundancia natural de α-[13C] KIC en la muestra sanguínea t =0-h). Se calculó el flujo de leucina (Q) usando el modelo de pool recíproco (8), en la meseta isotópica
Q = i [(Ei/Ep)-1]
dónde i=tasa de infusión de leucina L-[l-13C](µmol x kg-1 x h-1), Ei es la aumento de la leucina infundida, Ep es el aumento del α-[13C] KIC plasmático (porcentaje de exceso atómico), y el término “-1” corrige por la contribución del isótopo infundido a Q. La tasa de degradación proteica de todo el cuerpo (WBPD) fue estimada a partir de Q, basándose en la ecuación:
Q=B + I
dónde B es la tasa de aparición de leucina endógena, e I es la ingesta dietaria de leucina. Debido a que los sujetos no tuvieron ingesta dietaria de leucina durante la infusión, I=0; así B =Q.
Análisis Estadísticos
Los datos musculares y sanguíneos se analizaron usando mediciones repetidas de análisis de varianza (tiempo x tratamiento; GB-STAT version 5.30, Dynamic Microsystem). Cuándo ocurría una interacción significativa, se utilizaba el análisis post hoc Tukey para localizar las diferencias apareadas. El área bajo la curva (insulina, glucosa) fue calculada con un software desarrollado para el estudio. Los orina y los datos del área bajo la curva fueron analizados usando un test-t apareado. Una diferencia de P<0.05 fue seleccionada como indicativa de significancia estadística. Los valores están expresados como medias ±DS.
RESULTADOS
No hubo diferencias significativas en las concentraciones de insulina plasmática al comienzo (t= -1.5 h) y al final de la infusión (t= ~10; CV= 2.9%). Las diferencias plasmáticas de insulina fueron significativamente mayores para la condición de CHO comparada con Pl en los tiempos +0.5-, +0.75-, +1.25-, +1.5-, +1.75-, t +2.0 (P <0.01) (Fig. 1). El área bajo la curva de insulina durante las primeras 2.5 h fue ~4 veces mayor para la condición de CHO comparado con Pl [65.2 ± 12.1 µIU • h-1 • ml-1 para CHO y 15.2 ± 2.1 µIU • h-1 • ml-1 para Pl (P < 0.01)] (Fig. 2).
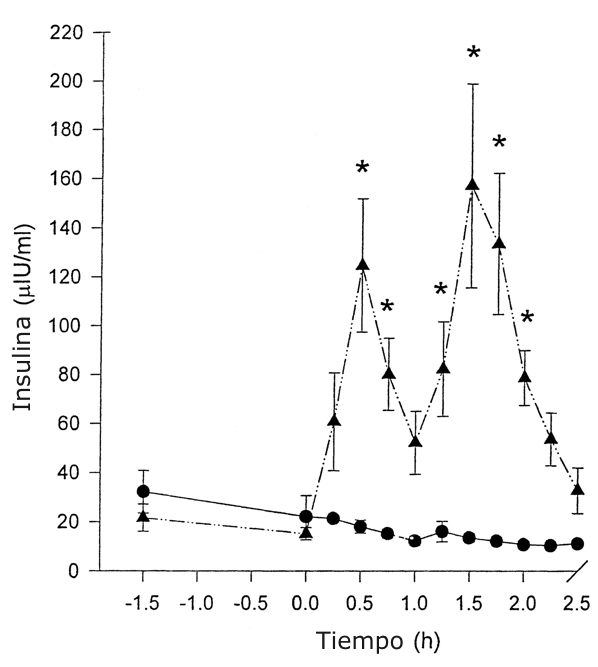
Figura 1. Valores de insulina plasmática para las suplementaciones con
carbohidratos (CHO; ▲) y placebo (Pl; ●) con respecto al tiempo. Los valores
están presentados como medias ±DS; n=8. * P<0.01 entre las dos condiciones.
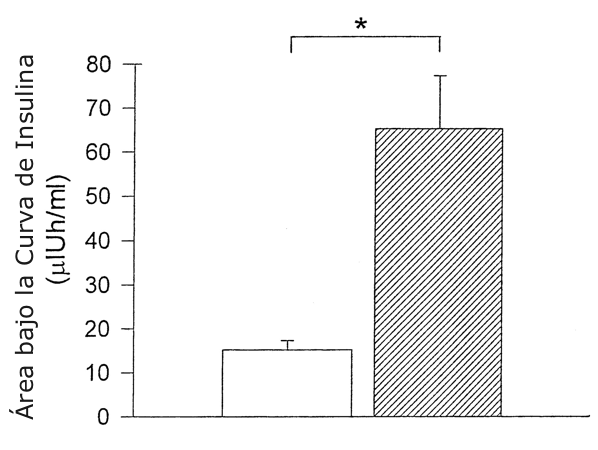
Figura 2. Área bajo la curva de insulina para CHO (barra sombreada) y Pl
(barra blanca). Los valores están presentados como medias ±DS por las primeras
2.5 h después del ejercicio; n =8. *P <0.01 entre las dos condiciones.
Las concentraciones de glucosa plasmática no fueron significativamente diferentes entre CHO y Pl antes del comienzo (t =-1.5h) y al final de la infusión del isótopo (Figura 3). Al completar el ejercicio, los niveles plasmáticos de glucosa fueron mayores que los valores de reposo para las condiciones de CHO y Pl [6.26±0.40 a 6.73±0.54 mmol/l para CHO y 5.70±0.55 a 6.50±0.25 mmol/l para Pl (P<0.05)]. La concentración de glucosa plasmática fue también significativamente mayor (P<0.01) en +0.5 y 0.75 h en la condición CHO en comparación con Pl. El área bajo la curva para la glucosa en las primeras 2.5 h fue significativamente mayor en la condición CHO en comparación con Pl (P<0.01; CHO=7.21±0.43 mmol x h-1 x l-1 y Pl = 5.88 ± 0.16 mmol x h-1 x l-1) (Figura 4).
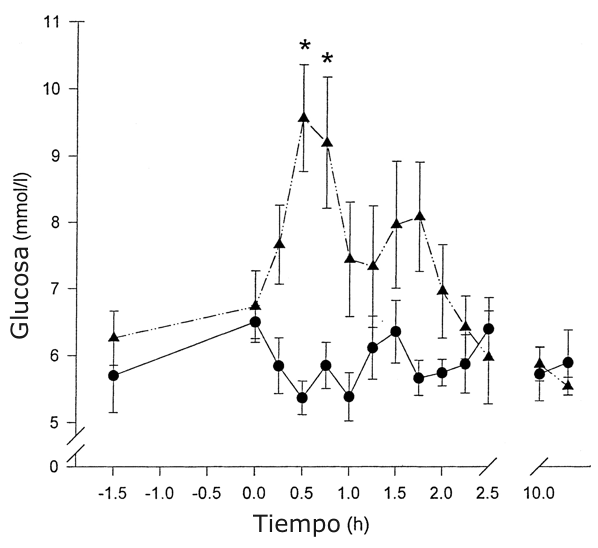
Figura 3. Valores de glucosa plasmática para CHO (▲) y Pl (●) con
respecto al tiempo. Los valores están presentados como media ±DS; n =8. *P <0.05
entre las dos condiciones.
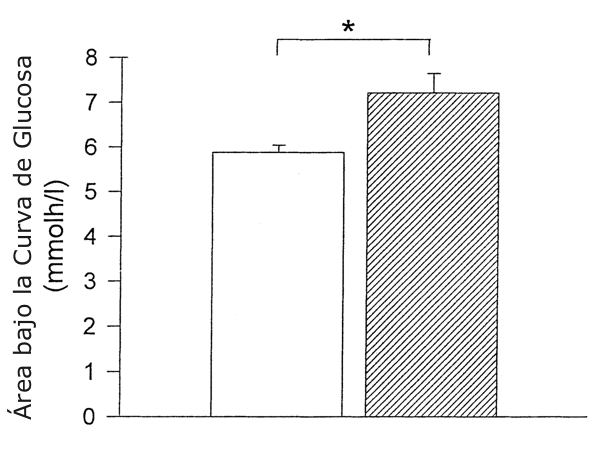
Figura 4. Área bajo la curva de glucosa para CHO (barra sombreada) y Pl
(barra blanca). Los valores están presentados como medias ±DS para las primeras
2.5 horas después del ejercicio; n= 8. *P <0.01 entre las dos condiciones.
La excreción urinaria de creatinina durante veinticuatro horas no fue significativamente diferente en las dos condiciones (n=7; 1.76±0.15 g/24 h para CHO y 1.70±0.09 g/24 h para Pl). Debido a que estos valores no fueron significativamente diferentes, el resto de los resultados urinarios fueron expresados relativos a los valores de creatinina. La excreción de 3-MH fue significativamente menor para la condición de CHO vs. Pl (P<0.05; n=7; 110.43±3.62 y 120.14±5.82 µmol/g de creatinina, respectivamente) (Figura 5A). Se observó una diferencia similar para el nitrógeno de la urinaria (P<0.05; n=7; CHO=8.60±0.66 g/g creatinina y Pl = 12.28 ± 1.84 g/g creatinina) (Figura 5B).
El aumento del α-[13C] KIC plasmático en cada una de las muestras es mostrado en la Figura 6 (n=7). El equilibrio isotópico fue alcanzado por todos los sujetos [CV=<10%, inclinación=no significativa (NS)] y mantenido por la duración de la infusión, como fue esperado según datos de trabajo previos (24).
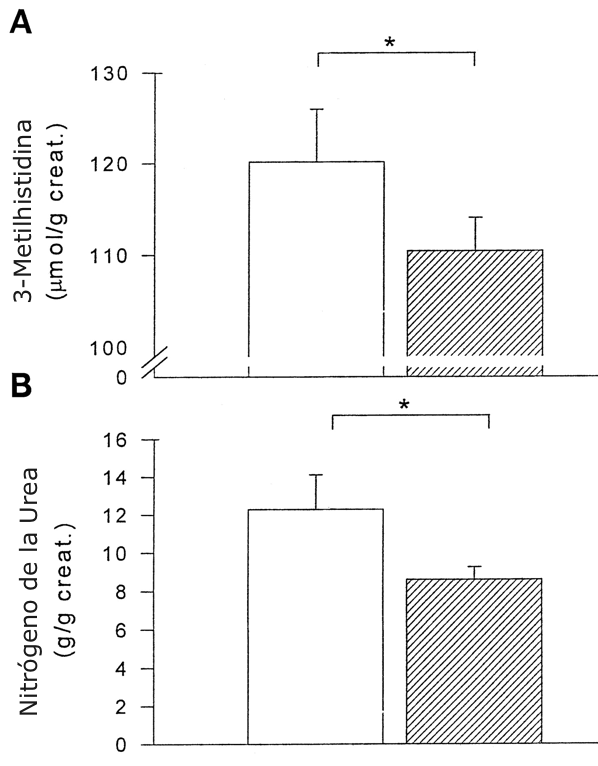
Figura 5. Resultados de orina (24 h). A: 3-metil histidina para Pl (barra
blanca) y CHO (barra sombreada). B: nitrógeno de la urea urinaria para Pl y CHO.
Los valores están presentados como medias ±DS; n=8; creat, Creatinina. *P <0.01
entre las dos condiciones.
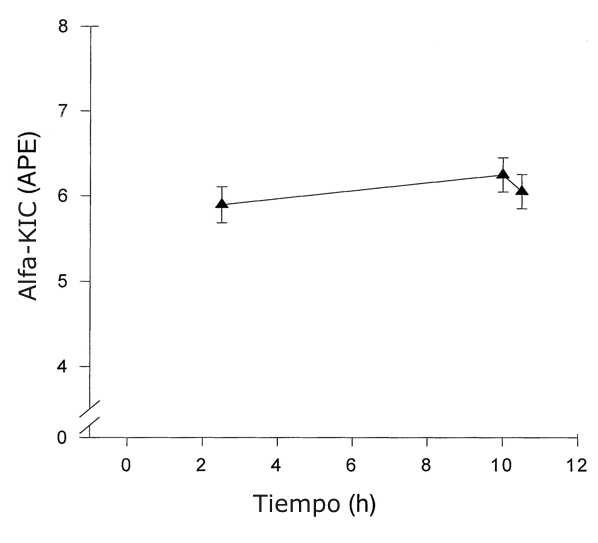
Figura 6. Aumento del ácido cetoisocrapoico plamático (α-KIC) a lo largo
del tiempo. Los valores están presentados como medias ±DS; n =6. APE, % de
exceso atómico.
En comparación con el músculo de la pierna control, la FSR en el músculo vasto lateral que se ejercitó estuvo elevada en un 36.1% en la condición de CHO y 6.3% en la condición Pl (NS; n=6) (Figura 7).
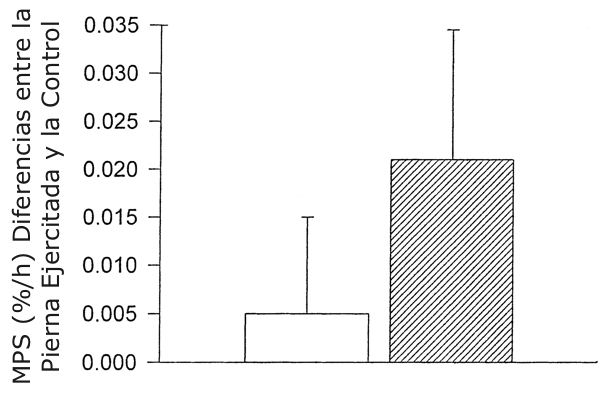
Figura 7. Tasa de síntesis proteica muscular (MPS; diferencia entre la
pierna ejercitada y la pierna control) para Pl (barra blanca) y CHO (barra
sombreada). Los valores están presentados como medias ±DS; n=8.
No se observaron diferencias significativas en el flujo de leucina del cuerpo entero entre las dos condiciones (n=7; 115.37±5.65 µmol x kg-1 x h-1 para CHO y 113.07±4.05 µmol x kg-1 • x h-1 para Pl).
DISCUSIÓN
El propósito de esta investigación fue determinar los efectos del tiempo de suplementación con glucosa cuándo la misma es suministrada inmediatamente después del ejercicio de fuerza sobre las variables FSR, MPD, WBPD, y excreción de urea urinaria. Un suplemento de glucosa de 1 g/kg (inmediatamente y +1h después del ejercicio) resultó en un incremento significativo en la glucosa plasmática y en las concentraciones de insulina como fue descrito por otros investigadores (9, 32). Esto estuvo asociado tanto con una menor excreción urinaria de 3-MH, como con una menor excreción de nitrógeno de la urea, sin diferencias entre la FSR del vasto lateral o en la WBPD. El efecto neto fue anabólico y puede resultar en un balance proteico muscular neto más positivo.
La mayoría de los trabajos en el área de la insulina y sus efectos sobre el turnover o recambio proteico ha incluido el uso de insulina e infusiones de glucosa (3, 13, 14, 17). El presente estudio es el primer reporte en humanos acerca de la influencia de la suplementación oral con glucosa sobre el metabolismo proteico y posee implicancias prácticas para atletas y personas que realizan ejercicio terapéutico. Los efectos positivos de la suplementación sobre el metabolismo de las proteínas fueron logrados mediante una simple redistribución del tiempo en el cual los sujetos realizan su ingesta calórica habitual.
La administración de una bebida con CHO produjo una caída significativa en la excreción urinaria de 3-MH durante el día del estudio. Nosotros interpretamos esto como una reducción en la MPD. Este hallazgo es avalado por algunos (13, 18), pero no por todos (3, 14) los estudios previos que analizaron los efectos de una elevada concentración de insulina sobre la MPD. Una ventaja del método de la excreción urinaria de 3-MH durante 24 h, sobre la técnica de balance arteriovenoso, es el período de tiempo en el que ocurre la determinación. La mayor duración de la recolección del método de excreción urinaria es una ventaja para la medición de MPD durante un período de recuperación completo, luego del ejercicio y así es provechoso en la determinación del impacto de una intervención sobre WBPD. Otros también han considerado a la 3-MH como un factor indicativo de la MPD (5, 27, 31).
Las objeciones a la validez respecto a la excreción de 3-MH como un indicador de MPD se relaciona principalmente a la contribución de fuentes no musculares (piel, esplánica, dietaria) al pool de 3-MH (20). Otras fuentes de error en la determinación del uso de 3-MH son las carencias de controles dietarios y la falla para considerar las diferencias interindividuales en la proporción de las contribuciones no miofibrilares/miofibrilares de la excreción urinaria total de 3-MH (10, 20, 27). En el presente estudio, los sujetos realizaron una dieta controlada sin contenido de carne durante los tres días previos a cada tratamiento y una dieta pre-empaquetada sin carne en el día de cada tratamiento (10). Además, nosotros usamos un diseño de mediciones repetidas cruzadas y, así, la variación interindividual en la contribución del músculo esquelético vs. las proteínas que no pertenecen al músculo esquelético, a la 3-MH urinaria debería ser constante.
Se ha demostrado en humanos con infecciones, que la contribución de las fuentes esplénicas al pool de 3-MH es relativamente pequeña durante largos períodos de catabolismo (21, 22). Por otro lado, en humanos que permanecen en reposo durante períodos de hiperinsulinemia e hiperaminoacidemia hay aparentemente una reducción en la ruptura de proteínas no miofibrilares (14). Sin embargo después del ejercicio, cuando hay un incremento en la ruptura de proteínas (4), no se sabe como la insulina atenúa este proceso en las proteínas miofibrilares.
En síntesis, la provisión de un suplemento de glucosa inmediatamente después del ejercicio disminuye la excreción de 3-MH. Sin la medición de las diferencias arteriovenosas, la fuente de esta reducción no puede ser comprobada con certeza.
La caída en la excreción de 3-MH estuvo acompañada por una disminución significativa en la excreción del nitrógeno de la urea, lo que sugiere una reducción en la transaminación y desaminación oxidativa de aminoácidos, debido a que la excreción urinaria de urea esta determinada por la concentración de urea en el plasma y por la tasa de filtración glomerular (7). Nosotros asumimos que la tasa de filtración glomerular para cada sujeto fue similar entre tratamientos debido a que la energía dietaria, proteínas, ingesta de fluidos, y ejercicio fue idéntica para cada condición. Además, no hubo diferencias en la excreción de creatinina, y la urea y la 3-MH fueron expresadas relativas a ésta. Así, asumiendo que la pérdida por materia fecal y por sudor no difirió entre ambos tratamientos (19, 25), el balance nitrogenado de todo el cuerpo debió ser más positivo para la condición CHO.
No se observaron diferencias en WBPD entre ambas condiciones. Aparentemente el tratamiento con CHO no proveyó una reducción suficiente en la MPD para influenciar a la WBPD. Sin embargo, la FSR contribuyó ~25% a la WBPS (15), y uno podría estimar que sólo el ~7% de la masa muscular total estuvo activa durante el ejercicio. Así, los cambios en la MPD pueden haber contribuido demasiado poco como para influenciar a la WBPD, debido a un efecto de dilución. Un protocolo similar con el uso de un ejercicio que estimule al cuerpo entero (vs. una sola pierna) podría demostrar un efecto de la MPD sobre la WBPD. Alternativamente, la degradación proteica en el tejido no muscular (i.e., esplánico) pudo haber cambiado en una dirección opuesta y atenuado la influencia de la MPD sobre la WBPD (28).
Además, las mediciones WBPD fueron tomadas a partir del α-[13C] KIC recolectado inmediatamente después del ejercicio y próximo a la terminación de la infusión (t =+10h; estado de ayuno). Es probable que para el tratamiento de CHO haya habido una reducción en la WBPD durante el período de hiperinsulinemia después del ejercicio (~2h) y para el tratamiento Pl después del desayuno (2 g/kg CHO) (14). Las mediciones de WBPD se deberían haber tomado durante las ~3h posteriores a éstos momentos para determinar si la WBPD fue más sensible al efecto de la insulina en el período posterior al ejercicio. Los datos de 3-MH y la reducción en la excreción de urea sugirieron que éste pudo haber sido el caso.
Nosotros encontramos que las tasas de FSR permanecieron sin cambios en respuesta a la ingesta de CHO. Se observó una tendencia en la que la condición CHO produjo un incremento estadísticamente no significativo en la FSR del 36% entre la pierna que realizó el ejercicio y la pierna que permaneció en reposo (Figura 7). Un efecto positivo de la insulina en la FSR fue descrito por otros investigadores (3, 17). Un factor que pudo haber atenuado el incremento en la FSR fue el hecho de que la suplementación con glucosa causó probablemente una caída en la disponibilidad de aminoácidos plasmáticos debido al incremento en la insulina. Ha sido demostrado que el efecto positivo de la insulina sobre la FSR es observado predominantemente con una hiperaminoacidemia concomitante (2, 3, 17). Otro factor que pudo haber atenuado una respuesta positiva de la suplementación con glucosa luego del ejercicio fue el hecho que la insulina estuvo sólo incrementada significativamente durante ~2 h después de la suplementación, mientras que el tiempo de medición fue de 10h. Estudios futuros debería usar métodos que puedan determinar la FSR durante un período de ~4 h (3, 4).
Un error imprevisto de muestreo llevó a una caída en el tamaño de la muestra para el análisis de la FSR (n=6). Por ello, un error de tipo II puede también explicar el fracaso de un incremento significativo. Además, el estímulo brindado por el ejercicio pudo no haber sido suficiente para estimular un incremento en la FSR del vasto lateral. Nosotros hemos reportado previamente un incremento en la FSR después del entrenamiento usando un mayor volumen de entrenamiento en un músculo fusiforme (bíceps braquial) (6). Debido a que el vasto lateral es un músculo peniforme que contribuye tanto a la estabilización como a la extensión de la rodilla, la fuerza/unidad de área pudo haber sido menor que en nuestros estudios previos en los que usamos el bíceps braquial. Un estudio en nadadoras tampoco encontró efecto del entrenamiento de fuerza sobre la FSR, usando un músculo que es difícil de activar por completo (deltoides posterior) (26). Este mismo grupo, sin embargo, encontró un incremento en la FSR del vasto lateral usando un volumen e intensidad de ejercicio casi idéntico (4). Debería destacarse, sin embargo, que los sujetos del último estudio eran desentrenados (4), y es posible que esto pueda explicar parcialmente la discrepancia en los resultados. Una tercera posibilidad es que nuestras mediciones de FSR durante un período de 10 h inmediatamente después del ejercicio, no hayan incluido los momentos en los cuales la FSR es máxima. Nosotros sabemos de estudios previos que la FSR fue máxima ~24 h después del ejercicio (12).
En resumen, nuestros resultados indicaron que el consumo de un suplemento de 1g/kg de CHO inmediatamente y 1 h después de terminar un entrenamiento de fuerza disminuye significativamente la ruptura de proteínas miofibrilares y la excreción urinaria de nitrógeno de la urea, e incrementa levemente la FSR, resultando en un balance proteico más positivo. Esto sugiere que el consumo de un suplemento de glucosa después del ejercicio de fuerza incrementa la concentración de insulina y por ello puede incrementar el balance proteico muscular.
Agradecimientos
Los autores agradecen al Dr. E.V. Youglai y Marty Gibala por su ayuda y su soporte técnico.
Notas al Pie
Este estudio fue financiado por un Subsidio de Investigación Aplicada al Deporte de Canadá, por el Consejo de Investigación en Ciencias Naturales e Ingeniería de Canadá, y por la División de Recursos para la Investigación Subsidio RR-00954.
Dirección para correspondencia y pedido de reimpresiones: M. A. Tarnopolsky, Dept. of Neurology and Physical Medicine and Rehabilitation, Rm 201B, Ivor Wynne Centre, McMaster Univ., Hamilton, Ontario, Canada L8S 4K1.
Referencias
1. Balon, T. W., A. Zorzano, J. L. Treadway, M. N. Goodman, and N. B. Ruderman (1990). Effect of insulin on protein synthesis and degradation in skeletal muscle after exercise. Am. J. Physiol. 258 (Endocrinol. Metab. 21): E92-E97
2. Bennet, W. M., A. A. Connacher, C. M. Scrimgeour, R. T. Jung, and M. J. Rennie (1990). Euglycemic hyperinsulinemia augments amino acid uptake by human leg tissue during hyperaminoacidemia. Am. J. Physiol. 259 (Endocrinol. Metab. 22): E185-E194
3. Biolo, G., R. Y. D. Flemming, and R. R. Wolfe (1995). Physiologic hyperinsulinemia stimulates protein synthesis and enhances transport of selected amino acids in human skeletal muscle. J. Clin. Invest. 95: 811-819
4. Biolo, G., S. P. Maggi, B. D. Williams, K. D. Tipton, and R. R. Wolfe (1995). Increased rates of muscle protein turnover and amino acid transport after resistance exercise in humans. Am. J. Physiol. 268 (Endocrinol. Metab. 31): E514-E520
5. Carraro, F., C. S. Stuart, W. H. Hartl, J. Rosenblatt, and R. R. Wolf (1990). Effect of exercise and recovery on muscle protein synthesis in human subjects. Am. J. Physiol. 259 (Endocrinol. Metab. 22): E470-E476
6. Chesley, A., J. D. MacDougall, M. A. Tarnopolsky, S. A. Atkinson, and K. Smith (1992). Changes in human muscle protein synthesis after resistance exercise. J. Appl. Physiol. 73: 1383-1388
7. Guyton, A. C., and J. E. Hall (1996). Textbook of Medical Physiology. Philadelphia, PA: Saunders
8. Horber, F. F., C. M. Harber-Feyder, S. Krayer, W. F. Schwenk, and M. W. Hamond (1989). Plasma reciprocal pool specific activity predicts that of intracellular free leucine for protein synthesis. Am. J. Physiol. 257 (Endocrinol. Metab. 20): E385-E399
9. Ivy, J. L., A. L. Katz, C. L. Cutler, W. M. Sherman, and E. F. Coyle (1988). Muscle glycogen synthesis after exercise: effect of time of carbohydrate ingestion. J. Appl. Physiol. 64: 1480-1485
10. Lukaski, H. C., J. Mendez, E. R. Buskirk, and S. H. Cohn (1981). Relationship between endogenous 3-methylhistidine excretion and body composition. Am. J. Physiol. 240 (Endocrinol. Metab. 3): E302-E307
11. MacDougall, J. D (1992). Hypertrophy or hyperplasia. In: Strength and Power in Sport, edited by P. V. Komi. Boston, MA: Blackwell, p. 230-238
12. MacDougall, J. D., M. J. Gibala, M. A. Tarnopolsky, J. R. MacDonald, S. A. Interisano, and K. E. Yarasheski (1995). The time course for elevated muscle protein synthesis following heavy resistance exercise. Can. J. Appl. Physiol. 20: 480-486
13. McNurlan, M. A., P. Essen, A. Thorell, A. G. Calder, S. E. Anderson, O. Ljungqvist, A. Sandgren, I. Grant, I. Tjader, P. E. Ballmer, J. Wernerman, and P. J. Garlick (1994). Response of protein synthesis in human skeletal muscle to insulin: an investigation with L-[2H5] phenylalanine. Am. J. Physiol. 267 (Endocrinol. Metab. 30): E102-E108
14. Moller-Loswick, A. C., H. Zachrisson, A. Hyltander, U. Korner, D. E. Matthews, and K. Lundholm (1994). Insulin selectively attenuates breakdown of nonmyofibrillar proteins in peripheral tissues of normal men. Am. J. Physiol. 266 (Endocrinol. Metab. 29): E645-E652
15. Nair, K. S., D. Halliday, and R. C. Griggs (1988). Leucine incorporation into mixed skeletal muscle protein in humans. Am. J. Physiol. 254 (Endocrinol. Metab. 17): E208-E213
16. Nauck, M. A., H. Lieb, E. G. Siegel, P. D. Niedmann, and W. Creutzfeldt (1992). Critical evaluation of the "heated-hand-technique" for obtaining "arterialized" venous blood: incomplete arterialization and alterations in glucagon responses. Clin. Physiol. 12: 537-552
17. Newman, E., M. J. Heslin, R. F. Wolf, P. W. T. Pisters, and M. F. Brennan (1994). The effect of systemic hyperinsulinemia with concomitant amino acid infusion on skeletal muscle protein turnover in the human forearm. Metabolism 43: 70-78
18. Pacy, P. J., K. S. Nair, C. Ford, and D. Halliday (1989). Failure of insulin to stimulate fractional muscle protein synthesis in type-I diabetic patients. Diabetes 38: 618-624
19. Phillips, S. M., S. A. Atkinson, M. A. Tarnopolsky, and J. D. MacDougall (1993). Gender differences in leucine kinetics and nitrogen balance in endurance athletes. J. Appl. Physiol. 75: 2134-2141
20. Rennie, M. J., and D. J. Millward (1983). 3-Methylhistidine excretion and the urinary 3-methylhistidine/creatinine ratio are poor indicators of skeletal muscle protein breakdown. Clin. Sci. (Lond.) 65: 217-225
21. Tarnopolsky, M. A., S. A. Atkinson, J. D. MacDougall, A. Chesley, S. Phillips, and H. P. Schwarcz (1992). Evaluation of protein requirements for trained strength athletes. J. Appl. Physiol. 73: 1986-1995
22. Tarnopolsky, M. A., S. A. Atkinson, J. D. MacDougall, B. B. Senor, P. W. R. Lemon, and H. Schwarcz (1991). Whole body leucine metabolism during and after resistance exercise in fed humans. Med. Sci. Sports Exercise 23: 326-333
23. Tarnopolsky, M. A., J. D. MacDougall, and S. A. Atkinson (1988). Influence of protein intake and training status on nitrogen balance and lean body mass. J. Appl. Physiol. 64: 187-193
24. Tipton, K. D., A. A. Ferrando, B. D. Williams, and R. R. Wolfe (1996). Muscle protein metabolism in female swimmers during recovery from swim and resistance training. J. Appl. Physiol. 81: 2034-2038
25. Virgili, F., G. Maiani, H. Zahoor, D. Ciarapica, A. Raguzzini, and A. Ferro-Luzzi (1994). Relationship between fat-free mass and urinary excretion of creatinine and 3-methylhistidine in adult humans. J. Appl. Physiol. 76: 1946-1950
26. Williams, B. D., R. R. Wolfe, D. Bracy, and D. H. Wasserman (1996). Gut proteolysis provides essential amino acids during exercise. Am. J. Physiol. 270 (Endocrinol. Metab. 33): E85-E90
27. Yarasheski, K. E., K. Smith, M. J. Rennie, and D. M. Bier (1992). Measurement of muscle protein fractional synthetic rate by capillary gas chromatography/combustion isotope ratio mass spectrometry. Biol. Mass Spectr. 21: 486-490
28. Yarasheski, K. E., J. J. Zachwieja, and D. M. Bier (1993). Acute effect of resistance exercise on muscle protein synthesis rate in young and elderly men and women. Am. J. Physiol. 265 (Endocrinol. Metab. 28): E210-E214
29. Young, V. R., and H. N. Munro (1978). 3-Methylhistidine and muscle protein turnover: an overview. Federation Proc. 37: 2291-2300
30. Zawadzki, K. M., B. B. Yaspelkis, and J. L. Ivy (1992). Carbohydrate complex increases the rate of muscle glycogen storage after exercise. J. Appl. Physiol. 72: 1854-1859