El Dispositivo Marc Pro<sup>TM</sup> es un Nuevo Cambio de Paradigma en el Acondicionamiento, la Recuperación y el Rendimiento Muscular: Incremento en la Microcirculación Dependiente de la Inducción de Oxido Nítrico (ON) Acoplado con Mecanismos de Angiogénesis
Wayne L Westcott2, Nicholas DiNubile1, Gary Reinl3, Anish Bajaj4, Eric R Braverman4,5, Margaret A Madigan6, John Giordano7 y Kenneth Blum4,6,7
1Department of Orthopedic Surgery. Hospital of the University of Pennsylvania Philadelphia.
2Department of Exercise Science. Quincy College, Quincy, MA.
3Nautilus. Inc. Independence, Virginia.
4Executive Health. Path Research Foundation NY.
5Department of Neurosurgery. Weill Cornel College of Medicine, New York.
6Department of Personalized Medicine. LifeGen, Inc., San Diego, CA.
7Department of Clinical Pain. G & G Holistic Addiction Treatment, North Miami Beach, FL.
8Department of Psychiatry. University of Florida, College of Medicine, Gainesville, FL.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2011.
Publicado 26 de abril de 2012
Resumen
Palabras clave: Diámetros Microvasculares, rendimiento muscular, dolor muscular de aparición demorada
INTRODUCCIÓN
El uso de estimuladores musculares eléctricos para mejorar el acondicionamiento, el rendimiento y la recuperación muscular es muy conocido (5,8,9,11). Se ha demostrado que la estimulación eléctrica mediante el dispositivo Marc Pro™ (MPDS) acelera la recuperación muscular luego de ejercicios fuertes (16). La MPDS ha sido aprobada por la Administración de Drogas y Alimentos de los Estados Unidos (FDA) por su capacidad de mejorar el acondicionamiento y el rendimiento muscular y recibió una patente americana (Aviso de Concesión). Este trabajo es un comentario de seguimiento del trabajo mas reciente sobre MPDS publicado en esta revista en el cual se observó una recuperación del dolor muscular de aparición tardía (DOMS) (16). Específicamente, nosotros informamos que la MPDS mejoró significativamente la recuperación muscular y la resistencia muscular de ejercicios concéntricos y excéntricos combinados en deportistas recreacionales saludables. Catorce sujetos (que no padecían dolor antes de comenzar el estudio) realizaron actividades de entrenamiento con sobrecarga (ejercicios de extensión de piernas con énfasis en la fase excéntrica) para producir DOMS en los cuádriceps. Todos los participantes recibieron 1 hora de MPDS en la pierna derecha sólo después de la sesión de ejercicios. Un día después, la valoración del dolor muscular de aparición tardía reveló una incomodidad significativamente menor en la pierna derecha (MPDS) que en la pierna izquierda (no recibió la estimulación MPDS) en todos los sujetos y en los no respondientes, respectivamente (P <0.008; P <0.002). El número de repeticiones de fuerza realizados con la pierna derecha (con MPDS) fue significativamente mayor que el número de repeticiones realizadas con la pierna izquierda (sin MPDS) en todos los sujetos y en los no respondientes respectivamente (P <0.03; P <0.008). En el segundo experimento, 13 sujetos (no padecían ningún dolor antes de comenzar el estudio) utilizaron una caminata con cierta dificultad hacia arriba y hacia abajo para producir DOMS en los cuádriceps. Luego de la caminata, se realizó MPDS en la pierna derecha de los sujetos durante 60 min mientras que la pierna izquierda no recibió ninguna aplicación de MPDS. El dolor que se informó fue significativamente menor en la pierna derecha (con MPDS) que en la pierna izquierda (sin MPD) en todos los participantes y en los respondientes, respectivamente (P <0.0008; P <0.0002). Por consiguiente estamos obligados a presentar información específica que ayudará a explicar el mecanismo conocido y propuesto de acción (MOA) de MPDS.
Superación del Dolor Muscular de Aparición Tardía (DOMS)
El proceso para superar el DOMS involucra muchos factores, entre los que se incluyen, aunque no se limitan, a: (a) carga de los huesos, tejido fibroso y muscular; (b) aumento en el flujo de sangre dependiente del óxido nítrico (ON); (c) aumento en la formación de nuevos vasos sanguíneos o angiogénesis; (d) aumento en el clearance de proteínas en los sitios fatigados; (e) aumento en la absorción de lactato celular y (f) aumento en la biogénesis mitocondrial (Figura 1).
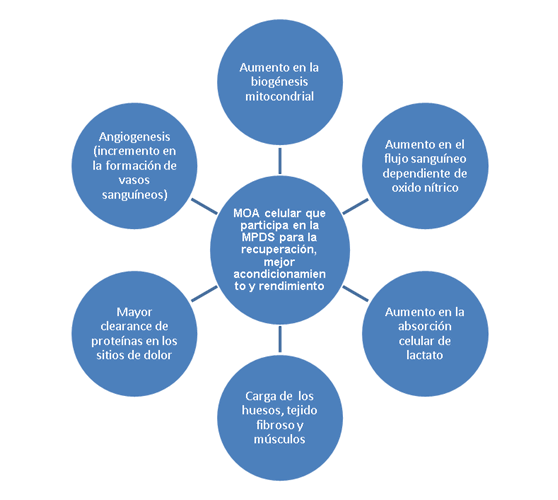
Figura 1. Factores involucrados en el proceso de superación del dolor muscular de aparición tardía (DOMS). MOA= Mecanismo conocido y propuesto de acción; MPDS=Estimulación eléctrica mediante el dispositivo Marc Pro™
En una revisión detallada (17), se sugirieron varios mecanismos que estarían involucrados en el proceso de resistencia y recuperación muscular. Notablemente, en el estudio de Hellsten et al. (3) el movimiento pasivo aumentó cuatro veces (P <0.05) el nivel de RNAm de la oxido nítrico sintasa (eNOS) por encima de los niveles observados en reposo. Es más, los resultados demuestran que una sesión de movimientos pasivos de piernas que aumenta el flujo de sangre y produce un estiramiento pasivo, aumenta las concentraciones intersticiales del factor de crecimiento del endotelio vascular (VEGF), el efecto proliferativo del fluido intersticial y los niveles de RNAm de la oxido nítrico sintasa (eNOS) en el tejido muscular. Los autores propusieron que el aumento en el flujo de sangre y el estiramiento pasivo son estimulantes fisiológicos positivos de factores asociados con el crecimiento capilar en el músculo humano.
En este comentario, nosotros también proponemos que MPDS permite superar el DOMS debido a sus propiedades innatas únicas asociadas con una mayor microcirculación dependiente del ON y de la angiogénesis. Es importante destacar que un estudio realizado por Tedeger et al. (15) sobre el DOMS demostró que las concentraciones de ON eran menores en la pierna con DOMS que en la pierna control, particularmente durante las primeras 4 hs de microdiálisis. Los aumentos crónicos en la actividad contráctil del músculo esquelético, como los producidos por el ejercicio de resistencia, producen adaptaciones fisiológicas y bioquímicas en el músculo esquelético, entre las que se incluyen la biogénesis de mitocondrias, angiogénesis y transformación del tipo de fibra (4,7). Estos cambios adaptativos son la base para una mejora en el rendimiento físico.
Además, el ejercicio de resistencia estimula la expresión del coactivador 1-alfa del receptor gamma activado por proliferadores de peroxisomas (PGC-1 alpha) en el músculo esquelético y la expresión forzada de PGC-1alpha cambia el metabolismo muscular y la capacidad de realizar ejercicios en los ratones (1). El PGC-1alpha desempeña un papel funcional en la biogénesis mitocondrial y angiogénesis inducidas por el ejercicio de resistencia, pero no en la transformación del fibra-tipo IIb-a-IIa en el músculo esquelético de ratones, y la mejora en la morfología mitocondrial y en la defensa antioxidante en respuesta al ejercicio de resistencia puede ocurrir independientemente de la función de PGC-1alpha (11).
Recientemente se han investigado de manera sistemática, los mecanismos fisiológicos del efecto de MPDS en los estudios con animales (12,14). Se ha sugerido que los efectos fisiológicos de la MPDS se deben a varias propiedades específicas de las variantes de MPDS que producen mejoras en la circulación de los tejidos. Estas nuevas propiedades de MPDS luego de la estimulación produjeron un aumento agudo y de largo plazo, en la microcirculación del musculo estriado de ratas que dependía del ON (12). Más aún, la actividad de recuperación muscular luego de MPDS repetidos de larga duración en la pata trasera de ratas es evidente debido a la inducción sistémica significativa de la formación de nuevos vasos sanguíneos o angiogénesis (14).
El MPDS es una modalidad de estímulo eléctrico que se sabe que reduce el DOMS luego de ejercicio extenuante. El MOA de esta modalidad puede estar relacionado con un aumento en la perfusión al músculo, con el potencial de reducir la extravasación de fluidos y minimizar la congestión (10). Los resultados sugieren que el aumento que el fluido extracelular puede responder en parte del aumento en músculo T2 observado durante el ejercicio.
Los Mecanismos Hemodinámicos y Microvasculares de la Estimulación Muscular con MDP dependen del Óxido Nítrico
El objetivo de varios estudios realizados con animales en los Departamentos de Investigación Ortopédica, Fisiología y Farmacología del Colegio Universitario de Medicina de Wake Forest, fue evaluar de manera directa las respuestas microvasculares al MPDS del músculo estriado. Además, también se evaluó el efecto de la estimulación repetida a lo largo de un período de 3 semanas en el flujo de sangre de los miembros posteriores. Nuestro laboratorio planteó la hipótesis que el estímulo eléctrico agudo del músculo estriado produciría vasodilatación arteriolar y que la estimulación eléctrica repetida produciría una mayor capacidad de perfusión en el músculo tratado.
Para abordar estos interrogantes Smith y colegas (12-14) realizaron estudios con ratas en los cuales estudiaron, en 57 ratas de sexo masculino, la microvasculatura con microscopía intravital y estimulación eléctrica. Las ratas fueron anestesiadas y se preparó el músculo cremáster para la video microscopía. Para la estimulación eléctrica del tejido se usaron electrodos de platino. Se midió una arteriola por rata antes, durante y después de la estimulación eléctrica del músculo cremáster hasta por 2,5 hrs. El músculo cremáster se estimuló con 1 Hz o 2 Hz durante períodos de 30 a 60 min. Las ratas del grupo control (n = 15) no fueron sometidas a estimulación eléctrica durante las evaluaciones microscópicas intravitales (Figura 2). El MPDS tanto en 1 como en 2 Hz produjo una vasodilatación arteriolar significativa (Figura 2). Las arteriolas de los animales del grupo control no expuestos a estimulación eléctrica no presentaron ningún cambio en el diámetro.
El papel del ON en la respuesta microvascular a la MPDS se evaluó bloqueando la vía del ON utilizando L-nitroarginina metil éster (L-NAME), aplicado de manera tópica en una concentración de 10-5 Molar en el cremáster antes del estímulo eléctrico con 2 Hz (n = 10 ratas). Se midieron las respuestas arteriolares máximas a MPDS y se compararon con los diámetros previos al estímulo. Los diámetros microvasculares no cambiaron con la MPDS luego del bloqueo del ON (84,1 ± 4,5 µm antes de la estimulación vs. 84,7 ± 4,1 µm después de la estimulación), lo que demuestra que el posible MOA está relacionado con la activación del ON dentro de los vasos sanguíneos (Figura 3)
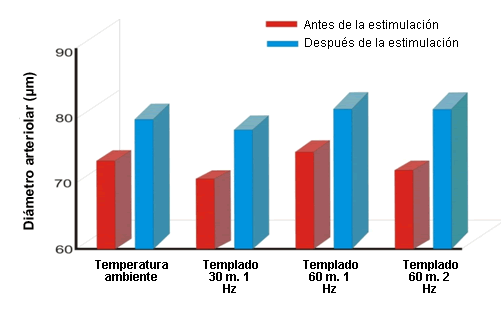
Figura 2. Diámetros microvasculares antes y después del estímulo eléctrico durante 30 o 60 min con estimulo de 1 o 2 Hz P <0,05 (pre vs post) (12,13).
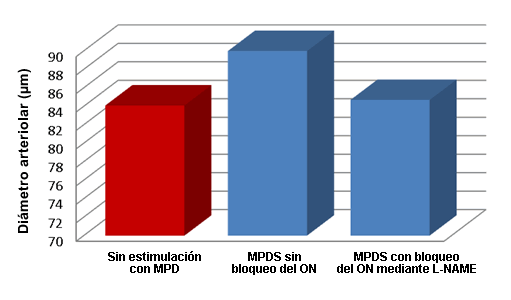
Figura 3. Efecto de la L-NAME sobre la dilatación arteriolar inducida por estimulación con el dispositivo Marc ProTM, en el cual se observa un bloqueo del efecto inducido por la MPDS y por lo tanto no se produce un incremento en el diámetro arteriolar por encima de los valores observados al inicio (12,13).
La significativa dilatación arteriolar inducida por la MPDS sugiere que esta modalidad de tratamiento está asociada con aumentos significativos en la perfusión del músculo estriado. Debido a la ley de Poiseuille, los aumentos observados en el diámetro arteriolar se traducen en aumentos en el flujo de sangre a través de los vasos individuales de 26% a 62%. Por consiguiente, la MPDS del músculo estriado mediante parámetros de estimulación clínica produce una respuesta fisiológica caracterizada por la dilatación arteriolar microvascular. Además, no se observa dilatación arteriolar luego de diferentes MPDS en presencia de L-NAME, un inhibidor de la síntesis de ON, lo que sugiere que la respuesta microvascular al MPDS está, en parte, regulada por el ON.
Flujo sanguíneo
Por otra parte se estudió el flujo de sangre de las patas en 10 ratas de sexo masculino (Figura 4). Se asignaron los animales a un grupo acondicionado mediante el estímulo (Grupo Acondicionado) o a un grupo con estímulo simulado (Grupo No Acondicionado) (n = 5/grupo). El grupo Acondicionado fue tratado diariamente con un estímulo eléctrico de 2 Hz durante 1 hr en la pata izquierda (lunes-viernes) durante 3 semanas. El grupo No Acondicionado fue tratado con un dispositivo falso de MPD durante un período similar. El miembro contralateral en ambos grupos fue utilizado como control. Después de 3 semanas, las ratas fueron anestesiadas con isoflurano y se midió el flujo de sangre de la arteria iliaca mediante flujometría ultrasónica de tiempo de tránsito antes, durante y después de HWDS agudo en cada pata trasera durante 5 min. Se analizaron las diferencias entre los flujos sanguíneos de las patas traseras de los grupos Acondicionado y No Acondicionado en comparación con el lado control. La MPDS de las patas traseras del grupo Acondicionado produjo un aumento promedio de 247% en el flujo de sangre de la pata por encima de las condiciones de reposo con 5 min de estimulación (Figura 4). La pata control aumentó el flujo de sangre en un 200% con 5 min de estímulo. Los animales del grupo No Acondicionado no presentaron diferencias entre las patas (pierna con estimulación simulada vs pierna control) (13,14).
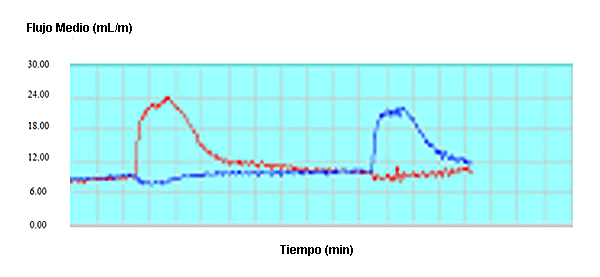
Figura 4. Imagen del flujo sanguíneo luego de la MPDS de larga duración obtenida mediante flujometría antes, durante y después de MPDS agudo en cada para durante 5 minutos (12,13)
En la imagen de flujo de sangre, la línea recta indica el flujo de sangre en reposo. Tan pronto como se produce el estímulo en la pata acondicionada se produce un aumento notable inmediato en el flujo de sangre, que alcanza un máximo de 247% por encima del estado de reposo. Después de MPDS se produce una caída asintótica y vuelve a los niveles iniciales de reposo. Cuando se estimuló con MPDS la pata contralateral no acondicionada se obtuvo un patrón de flujo sanguíneo similar pero menos robusto que alcanzó un nivel máximo de 200% por encima nivel de flujo sanguíneo de la pata trasera. Esta diferencia de 25% fue significativa (Figura 5). Se plantea la hipótesis que la diferencia entre la pata control y la pata posterior acondicionada se debe a una reserva vascular o angiogénesis. Este aumento rápido en el flujo de sangre sugiere que la selección de MPDS como una modalidad de primera línea debe producir un aumento inmediato al comienzo del proceso de recuperación. Se sugiere que este aumento rápido observado en el flujo de sangre es sumamente importante en lo que se refiere a impactar en el retorno rápido al campo de juego.
Inducción de Angiogénesis por MPDS
El análisis posterior (12), de la pata posterior acondicionada con respecto a la producción de nuevos vasos reveló, mediante tinción con bromouridina, un aumento demostrable en los nuevos vasos sanguíneos lo que demuestra la existencia de angiogénesis (Figura 6). Así, la diferencia entre la respuesta con respecto al flujo sanguíneo de la pata posterior acondicionada y la no acondicionada, se debía en parte a la angiogénesis inducida por MPDS. Los cambios en el flujo de sangre de la pata que se producen junto con la MPDS corroboraron los hallazgos microvasculares, lo que demuestra un aumento significativo en el flujo sanguíneo de la pata junto con MPDS. Además, la exposición diaria repetitiva a MPDS durante 3 semanas produjo un incremento 25% mayor en el flujo de sangre en la pata acondicionada con MPDS en comparación con la pata contralateral control no acondicionada. Este aumento en el flujo de sangre en la pata acondicionada sugiere una mayor reserva vascular disponible para aumentar la perfusión en las patas expuestas a MPDS repetidas. De hecho, el aumento de la reserva se debe, en parte, a la angiogénesis producida por MPDS crónica importante para recuperación muscular y para un mayor rendimiento.
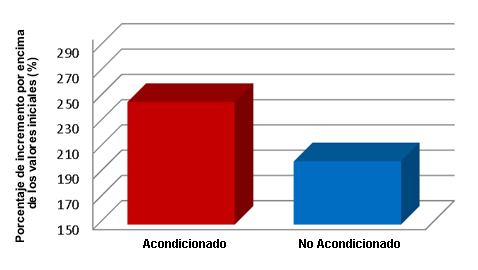
Figura 5. Flujo sanguíneo en los miembros posteriores acondicionados con MPDS versus los miembros posteriores utilizados como control en respuesta a la estimulación eléctrica en comparación con los valores iniciales previos a la estimulación (P<0.05); P<0,05 comparado con los valores iniciales N = 5 ratas (13,14).
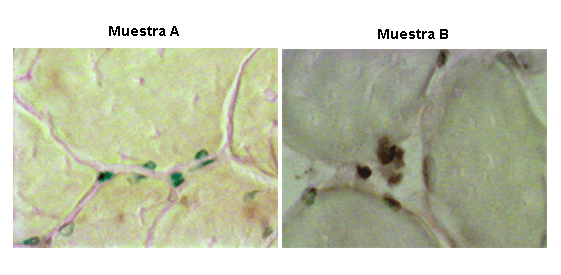
Figura 6. La muestra A refleja lo que ocurre en una pata que experimentó una estimulación simulada. Los vasos preexistentes se observan teñidos de verde. Los nuevos vasos se observan teñidos de color marrón. La muestra B refleja lo que ocurre en una pata con MPDS. Los vasos nuevos se observan teñidos de color marrón. También se observan vasos preexistentes (verdes). Imágenes proporcionadas por el Departamento de Investigación Ortopédica, Fisiología y Farmacología, Colegio Universitario de Medicina de Wake Forest, Winston-Salem, Carolina del Norte (12,13).
Publicaciones recientes apoyan la relación de la producción y/o función del ON y el factor de crecimiento del endotelio vascular (VEGF). Tal como se estableció previamente en los resultados de Hellsten et al. (3) que demuestran que una sesión de movimiento de piernas pasivo, que incrementaba el flujo de sangre y provocaba estiramiento pasivo, aumentaba las concentraciones intersticiales de VEGF, el efecto proliferativo del fluido intersticial y el contenido de RNAm de eNOS en el tejido muscular. Los autores propusieron que el mayor flujo de sangre y el estiramiento pasivo son estimulantes fisiológicos positivos de factores asociados con el crecimiento capilar en el músculo humano.
RESUMEN Y PERSPECTIVAS FUTURAS
El conocimiento de las propiedades innatas importantes de MPDS nos da el impulso para utilizar MPDS para mejorar el rendimiento físico. Elaboramos este comentario para que quienes estén interesados en el potencial de este nuevo dispositivo, conozcan los beneficios potenciales de la MPDS.
El músculo esquelético presenta una plasticidad extraordinaria en respuesta a cambios en las demandas funcionales. Los aumentos crónicos de la actividad contráctil del músculo esquelético, como los producidos por los ejercicios de resistencia, producen una variedad de adaptaciones fisiológicas y bioquímicas en el músculo esquelético, entre las que se incluyen la biogénesis mitocondrial, angiogénesis, y transformaciones del tipo de fibra. Estos cambios adaptativos son la base para la mejora en el rendimiento físico. Nosotros proponemos que las propiedades innatas de las diferentes MPDS pueden mejorar el rendimiento y la recuperación muscular potencialmente debido a la producción de ON, a la biogénesis mitocondrial, angiogénesis y transformación del tipo de fibra. Es más, PGC-1alpha desempeña un papel funcional en la biogénesis mitocondrial y en la angiogénesis inducidas por el ejercicio de resistencia, pero no en la transformación del tipo de fibra en el músculo esquelético de ratones. Dado que PGC-1alpha es necesario para las adaptaciones completas del músculo esquelético inducidas por el ejercicio de resistencia, nosotros continuaremos nuestra investigación evaluando la posible producción de PGC-1alpha luego de MPDS (9).
El MPD no está diseñado como un dispositivo de curación, sino como un método para acondicionar los músculos saludables, reducir el dolor muscular de aparición tardía (DOMS), aumentar la recuperación, la fuerza y el rendimiento muscular después de un ejercicio activo. Es necesario realizar investigaciones adicionales para confirmar este nuevo mecanismo conocido y propuesto (MOA) de la MPDS.
Dirección de contacto: Kenneth Blum, PhD, Department of Psychiatry, University of Florida, College of Medicine and Mcknight Brain Institute, Gainesville, Florida, USA Email: drd2gene@aol.com
Referencias
1. Geng T, Li P, Okutsu M, Yin X, Kwek J, Zhang M, Yan Z (2010). PGC-1alpha plays a functional role in exercise-induced mitochondrial biogenesis and angiogenesis but not fiber-type transformation in mouse skeletal muscle. Am J Physiol Cell Physiol ; 298(3):C572-579
2. Hainaut K, Duchateau J (1992). Neuromuscular electrical stimulation and voluntary exercise. Sports Med; 4(2):100-11
3. Hellsten Y, Rufener N, Nielsen JJ, Høier B, Krustrup P, Bangsbo J (2008). Passive leg movement enhances interstitial VEGF protein, endothelial cell proliferation, and eNOS mRNA content in human skeletal muscle. Am J Physiol Regul Integr Comp Physiol; 294(3):R975-82
4. Jornayvaz Fr, Shulman GI (2010). Regulation of mitochondrial biogenesis. Essays Biochem; 47:69-84
5. Kemmler W, Schliffka R, Mayhew JL, von Stengel S (2010). Effects of whole-body electromyostimulation on resting metabolic rate, body composition, and maximum strength in postmenopausal women: The training and electrostimulation trial. J Strength Cond Res; 24(7):1880-1887
6. Lake DA (1992). Neuromuscular electrical stimulation. An overview and its application in the treatment of sports injuries. Sports Med; 13(5):320-336
7. Lira VA, Benton CR, Yan Z, Bonen A (2011). PGC-1alpha regulation by exercise training and its influences on muscle function and insulin sensitivity. Am J Physiol Endocrinol Metab; 299(2):E145-156
8. Parker MG, Bennett MJ, Hieb MA, Hollar AC, Roe AA (2003). Strength response in human femoris muscle during 2 neuromuscular electrical stimulation programs. J Orthop Sports Phys Ther; 33(12):719-726
9. Peng X, Wang J, Lassance-Soares RM, Najafi AH, Sood S, Aghili N, Alderman LO, Panza JA, Faber JE, Wang S, Epstein SE, Burnett MS (2011). Gender differences affect blood flow recovery in a mouse model of hindlimb ischemia. Am J Physiol Heart Circ Physiol; 300(6):H2027-34. Epub 2011 Mar 1
10. Ploutz-Snyder LL, Nyren S, Cooper TG, Potchen EJ, Meyer RA (1997). Different effects of exercise and edema on T2 relaxation in skeletal muscle. Magn Reson Med; 37(5):676-682
11. Pogozelski AR, Geng T, Li P, Yin X, Lira VA, Zhang M, Chi JT, Yan Z (2009). p38gamma mitogen-activated protein kinase is a key regulator in skeletal muscle metabolic adaptation in mice. PLoS One; 4(11):e7934
12. Smith TL, Blum K, Callahan MF, DiNubile NA, Chen TJ, Waite RL (2009). H-Wave induces arteriolar vasodilation in rat striated muscle via nitric oxide-mediated mechanisms. J Orthop Res; 1248-1251
13. Smith TL, Blum K, Waite RL, Heaney WJ, Callahan M (2007). The microvascular and hemodynamic mechanisms for the therapeutic actions of H-Wave muscle stimulation. Abstract presented at: 6th Combined Meeting of the Orthopaedic Research Societies, 21 October, Honolulu, Hawaii. Abstract #83
14. Smith Tl, Callahan MF, Blum K, DiNubile N, Chen TJH, Waite RL (2011). H-wave effects on blood flow and angiogenesis in longitudinal studies in rats. J Surg Ortho Adv (in Press)
15. Tegeder L, Zimmermann J, Meller ST, Geisslinger G (2002). Release of analgesic substances in human experimental muscle pain. Inflamm Res; 51(8):393-402
16. Westcott WL, Chen T, Neric, FB, DiNubile N, Bowirrat A, Madigan M, Downs BW, Giordano J. Morse S, Chen A, Bajaj A, Kerner M, Braverman E, Reinl G, Blakemore M, Whitehead S, Sacks L, Blum K (2011). The Marc ProTM device improves muscle performance and recovery from concentric and eccentric exercise induced muscle fatigue in humans: A pilot study. JEPonline; 14(2):55-67
17. Yan Z, Okutsu M, Akhtar YN, Lira VA (2011). Regulation of exercise-induced fiber type transformation, mitochondrial biogenesis, and angiogenesis in skeletal muscle. J Appl Physiol 2011; 110(1):264-274