El Ejercicio induce a las Proteínas Lipoproteín Lipasa y GLUT- 4 en el Músculo independientemente de la Señalización por medio de los Receptores Adrenérgicos
Jeffrey S Greiwe1, John O Holloszy1 y Clay F Semenkovich1
Departments of Medicine and Cell Biology and Physiology, Washington University School of Medicine, St. Louis, Missouri 63110.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2000.
Publicado 6 de octubre de 2003
Resumen
Palabras clave: catecolaminas, metabolismo de lípidos, transporte de glucosa, β-bloqueante, α-bloqueante
INTRODUCCIÓN
Los carbohidratos y los ácidos grasos son la fuente principal de combustible utilizada durante el ejercicio y durante la recuperación del ejercicio. La lipoproteín lipasa (LPL), el factor limitante de velocidad para el metabolismo de las lipoproteínas ricas en triacilglicéridos, y los GLUT-4, los mayores transportadores de glucosa del músculo esquelético, son críticos para la adquisición de ácidos grasos y glucosa durante y después del ejercicio. La captación de sustratos después del ejercicio repleta las fuentes de energía en preparación para la serie siguiente de ejercicio y provee combustible para la reparación muscular y otras funciones de recuperación (15).
El ejercicio depleta los fosfatos de alta energía en el músculo e incrementa la concentración de AMP, causando la activación de la proteín quinasa activada por AMP (AMPK). La activación de la AMPK media probablemente la translocación de los GLUT-4 en el sarcolema en el ejercicio (9, 20). El ejercicio también incrementa los niveles de ARNm y proteínas de ambos, los GLUT-4 y la LPL en el músculo esquelético dentro de las 18 h posteriores a una serie de ejercicio (29, 31, 32). Los eventos de señalización que conducen al aumento de la expresión (probablemente por medio de la activación de la transcripción) de los genes de GLUT-4 y LPL no han sido todavía identificados. Las catecolaminas se incrementan en función de la intensidad de ejercicio (6) e interactúan con los receptores de superficie celular unidos a las proteínas G. Las catecolaminas y el ejercicio son conocidos por incrementar las concentraciones intracelulares de AMPc, una molécula de señalización implicada en la expresión de la LPL en el músculo cardiaco y esquelético (3-5, 27).
Aunque las catecolaminas estimulan la expresión de LPL en el músculo en reposo (3-5, 27), no esta claro si el incremento de las catecolaminas observado en el ejercicio contribuye a la inducción del ejercicio de la LPL. Tampoco se sabe si las catecolaminas incrementan la expresión de los GLUT-4. En este artículo científico, nosotros establecemos específicamente la cuestión de si el incremento en las proteínas LPL y GLUT-4 en el músculo esquelético después del ejercicio, es causado por la estimulación de los receptores adrenérgicos durante el ejercicio. Para responder esta pregunta, nosotros medimos el contenido de las proteínas GLUT-4 y LPL en el músculo esquelético después de una sola serie de ejercicio realizada en presencia y ausencia de bloqueo de los receptores adrenérgicos.
MATERIALES Y MÉTODOS
Sujetos
Los sujetos eran individuos sanos, activos, pero desentrenados, y realizaban actividades físicas recreacionales de manera regular. La composición corporal fue estimada a partir de pesaje hidrostático. El estudio fue aprobado por el Comité de Estudios en Humanos de la Universidad de Washington. Fue obtenido un informe de consentimiento de cada uno de los sujetos.
Consumo de Oxígeno
Fue realizada una evaluación continua en ciclo ergómetro por cada individuo para determinar el pico de consumo de oxígeno (VO2 pico). El protocolo consistió de pedalear a 100, 150 y 200 W durante 3 min por intensidad de entrenamiento, seguido de incrementos de 25 W cada min hasta el agotamiento. Fue usado un sistema automático on-line para recolectar y analizar el aire espirado a través de toda la evaluación (Max-1, Picio-Dyne Instrument, Farmingdale, NY). Cada sujeto alcanzó al menos dos de los siguientes criterios durante el protocolo de VO2: plateau en el consumo de oxígeno con un incremento de la tasa de trabajo, frecuencias cardiacas dentro de 10 lat/min de la frecuencia cardiaca máxima predicha para la edad, y un índice de intercambio respiratorio mayor a 1.11.
Pruebas de Ejercicio
Dos pruebas de ejercicio, una con y otra sin bloqueo de los receptores adrenérgicos, fueron completadas dentro de un período de 7 a 12 días. El orden de las pruebas fue establecido al azar. Los sujetos no realizaron ejercicio el día anterior a cada prueba.
El bloqueo de los receptores adrenérgicos fue conseguido con el α-bloqueante no selectivo fenoxibenzamina (Dibenzyline, SmithKline Beecham Pharmaceuticals) y el β-bloqueante no selectivo propanolol (Inderal, Ayerest Laboratories). La fenoxibenzamina es una medicación oral. No fue posible obtener fentolamina, un α-bloqueante intravenoso, para este estudio. Al tiempo de estos experimentos, el uso de fentolamina en los Estados Unidos estaba limitado a urgencias médicas, debido a problemas de manufacturación. Como fue previamente descrito (36), el bloqueo α- con fenoxibenzamina fue iniciado 3 días antes de la prueba de ejercicio a una dosis de 10 mg por boca, cuatro veces por día (día 1). La dosis fue progresivamente incrementada a 20 mg cuatro veces por día (día 2) y a 30 mg cuatro veces por día (día 3), y luego los sujetos ingirieron 40 mg 1,5 h antes de la prueba de ejercicio en el día 4. Para el β-bloqueante (24) los sujetos recibieron una infusión intravenosa continua (143 μg/kg) de propanolol, empezando 30 min antes de la prueba de ejercicio. Al comienzo del ejercicio, la dosis fue disminuida a 1,4 μg.kg−¹.min−¹, y la infusión de propanolol continuo a esta tasa hasta 15 min antes de la finalización del ejercicio.
Una cada día, una muestra de sangre fue obtenida en la mañana posterior a un ayuno de 12 h. Fue realizada una biopsia muscular del vasto lateral. 45 minutos más tarde, los sujetos se ejercitaron por 1 h en un cicloergómetro frenado eléctricamente al 65 % del VO2 pico. El consumo de oxígeno fue medido a intervalos de 15 min durante la prueba de ejercicio, y la potencia fue ajustada para mantener ≈ el 65% del VO2 pico. Después de la prueba de ejercicio, los sujetos descansaron en una cama por las siguientes 22 h en el Centro de Investigaciones Clínicas Generales de la Universidad de Washington. Fueron obtenidas periódicamente muestras de sangre a partir de un catéter, y las biopsias musculares fueron realizadas 8 y 22 h después del ejercicio. Las dietas durante el protocolo fueron estandarizadas e idénticas para las dos pruebas.
Biopsias Musculares
Las biopsias fueron realizadas como fue previamente descrito (31). Después de la biopsia inicial, fue usada la pierna contralateral para la segunda biopsia. La tercera biopsia fue realizada en una región 3 cm distal al sitio de la biopsia inicial. Las biopsias de la segunda prueba fueron realizadas en la misma secuencia que la primera prueba en un sitio 3 cm distal de las biopsias iniciales. Las muestras musculares fueron inmediatamente limpiadas con solución salina, desprovistas de cualquier grasa visible, secadas y congeladas con nitrógeno líquido. Las muestras fueron luego almacenadas a -80 ºC para los análisis subsecuentes. Las muestras musculares de todos los puntos de tiempo fueron analizadas para el contenido de proteínas LPL y GLUT-4 por medio de Western blotting como fue previamente descrito (30, 31). Las proteínas unidas a los anticuerpos fueron visualizadas por medio del uso de quimioluminiscencia aumentada (Amersham/Pharmacia Biotech). Las bandas de proteínas fueron cuantificadas por densitometría. Los datos están expresados por contenido de proteínas. Como fue previamente demostrado (32) el ejercicio agudo no tiene ningún efecto detectable sobre la proteína de control miosina cuando es usado este análisis.
Muestras y Análisis de Sangre
Un catéter de polietileno fue insertado dentro de una vena antecubital en la mañana anterior de la biopsia inicial y fue mantenido abierto con una solución salina. Las muestras sanguíneas fueron obtenidas de los sujetos antes de las biopsias iniciales, inmediatamente antes del ejercicio, a los 30 min de ejercicio, y justo antes de la finalización del ejercicio. Además, las muestras sanguíneas fueron obtenidas cada 30 min por las primeras 2,5 h después del ejercicio y luego cada 1 h por las siguientes 6 h. Las muestras estuvieron sujetas a centrifugación (15 min a 2000 g) y el sobrenadando fue recolectado y almacenado a -80 ºC hasta los análisis subsecuentes. Las muestras fueron analizadas para insulina (25), catacolaminas (23), leptina (23), glucosa (Sigma Chemical, St. Louis, MO), y ácidos grasos no esterificados (Waco Chemicals, Dallas TX). Los niveles de lípidos y lipoproteínas fueron medidos después de un ayuno de 12 h, de acuerdo con el programa de estandarización de lípidos del Centro de Control de Enfermedades.
Análisis Estadísticos
El contenido de proteínas musculares LPL y GLUT-4, así como las muestras de plasma fueron analizados usando análisis de varianza a dos vías de mediciones repetidas. Cuando el análisis de varianza revelaba diferencias significativas era realizado un test post hoc Tukey.
RESULTADOS
Las características de los sujetos son presentadas en la Tabla 1. Las intensidades de ejercicio no fueron significativamente diferentes durante las dos pruebas (Tabla 2). Las frecuencias cardiacas fueron significativamente más bajas durante el ejercicio para la prueba con bloqueo en comparación con la prueba control (Tabla 2). Las concentraciones plasmáticas de epinefrina (Figura 1A) y norepinefrina (Figura 1B) fueron significativamente más altas durante el ejercicio para la prueba con bloqueo en comparación con la prueba control, un resultado esperado, porque el bloqueo de receptores interfiere con el clearence normal de las catecolaminas. Las frecuencias cardiacas más bajas y los niveles más altos de catecolaminas durante la prueba con bloqueo indican que el bloqueo de los receptores adrenérgicos fue exitoso.
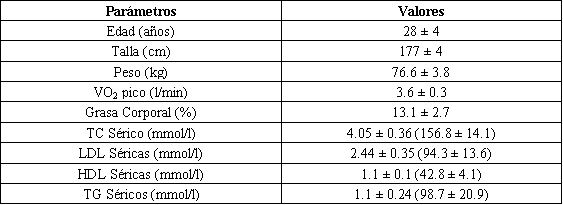
Tabla 1. Características de los sujetos. Los valores son presentados como medias
±DS; los valores en paréntesis están en mg/dl. VO2 pico: pico de consumo de
oxígeno; TC: colesterol total; LDL: lipoproteínas de baja densidad; HDL:
lipoproteínas de alta densidad; TG: triacilglicéridos. Los niveles de lípidos y
lipoproteínas fueron analizados en muestras obtenidas después de un ayuno de 12
h.
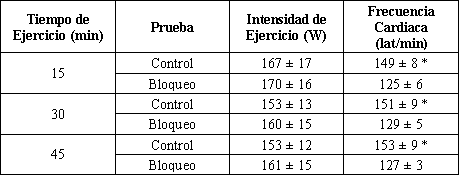
Tabla 2. Datos de trabajo y frecuencia cardiaca para cada prueba de ejercicio.
Los valores son presentados como medias ±DS. * Diferencia significativa (por
medio del uso de test t apareados) en la frecuencia cardiaca en comparación con
la prueba con bloqueo al mismo tiempo de ejercicio, P<0.05.
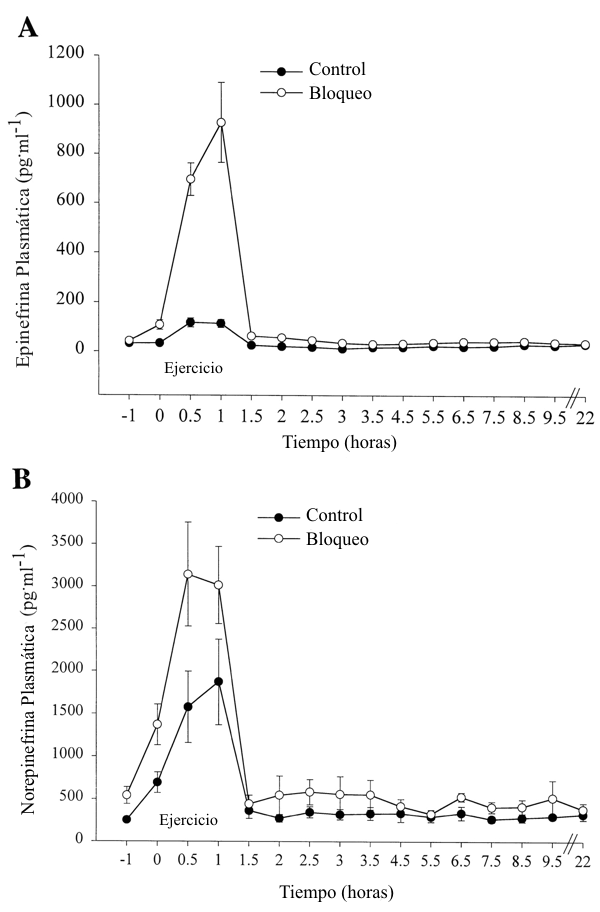
Figura 1. Concentraciones plasmáticas de epinefrina (A) y norepinefrina (B)
durante series de ejercicio para las pruebas control y con bloqueo (bloqueo de
los receptores adrenérgicos por medio del uso de fenoxibenzamina y propanolol).
Fue obtenida una muestra en reposo (-1 h) y luego los sujetos se ejercitaron
durante 60 min al 65% del VO2 pico (0-1 h). Después del ejercicio, los sujetos
descansaron en una cama por 22 h. Después del ejercicio fueron obtenidas
muestras de sangre a intervalos de 30 min por 3,5 h (1-4,5 h) y luego cada 60
min por 5 h adicionales (4,5-9,5 h). También fue obtenida una muestra a las 22 h
postejercicio. Fue encontrada una interacción significativa entre las pruebas
control y con bloqueo (P<0.01).
Contenido de las proteínas LPL musculares
Fueron realizadas biopsias de músculo esquelético antes y 8 y 22 h después de la serie de ejercicio para ambas pruebas. El músculo fue analizado para el contenido de las proteínas LPL y GLUT-4. Las cantidades absolutas de LPL y GLUT-4 del tejido muscular fueron variables entre los individuos. De este modo, las señales de LPL y GLUT-4 para cada individuo fueron comparadas con las señales en la muestra pre-ejercicio para cada prueba, y los datos fueron analizados pro medio de análisis de varianza de mediciones repetidas para focalizarse en las diferencias asociadas con la intervención y no en las diferencias entre los individuos. Como fue mostrado en la Figura 2, izquierda, las proteínas LPL en la prueba control estuvieron incrementadas 8 h después del ejercicio en la prueba control. 22 h después del ejercicio en la prueba control, las proteínas LPL estuvieron incrementadas en un 170±100 % (P<0.05). El mismo patrón fue observado en la prueba con bloqueo (Figura 2, derecha). A las 22 h post-ejercicio, el contenido de proteínas LPL fue un 240±110 % mayor que en la condición inicial (P<0.05) aunque el ejercicio fue realizado en el marco de ambos, bloqueo α- y β- adrenérgico.
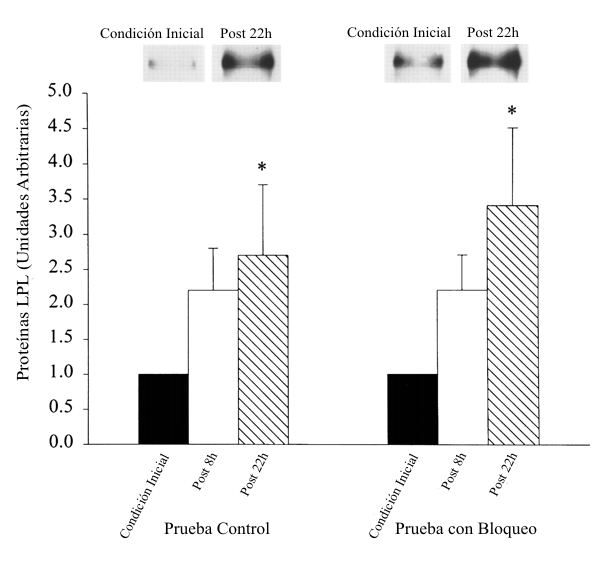
Figura 2. Contenido del músculo esquelético de la proteína lipoproteín lipasa (LPL)
antes del ejercicio (condición inicial) y 8 h (post 8 h) y 22 h (post 22 h)
después del ejercicio para las pruebas control y con bloqueo (bloqueo de los
receptores adrenérgicos por medio del uso de fenoxibenzamina y propanolol). Las
muestras fueron obtenidas del músculo vasto lateral y fueron analizadas para la
proteína LPL por medio de Western blotting cuantitativo. Para cada individuo,
fueron comparadas las señales a las 8 y 22 h después del ejercicio con las
muestras de la condición inicial y fueron analizadas con análisis de varianza de
mediciones repetidas. Debido a que las barras de error reflejan las varianzas
para las diferencias entre las muestras de las 8 y 22 h y la condición inicial,
no existieron errores en la condición inicial. Los verdaderos datos de la
densitometría de la condición inicial fueron 0.72±0.29 unidades arbitrarias para
la prueba control y 0.42±0.17 unidades arbitrarias para la prueba con bloqueo.
Figuras, gráficos representativos para la prueba control (izquierda) y para la
prueba con bloqueo (derecha). *Diferencias significativas (P<0.05) en la
comparación de las muestras de cada prueba en la condición inicial y 22 h
post-ejercicio para cada prueba.
Contenido de proteínas GLUT-4 musculares
El contenido de proteínas GLUT-4 también estuvo elevado después de las series de ejercicio en ambas pruebas, control y con bloqueo (Figura 3). El contenido de proteínas GLUT-4 estaba todavía elevado 8 h después del ejercicio en cada prueba. A 22 h post-ejercicio, el contenido de proteínas GLUT-4 se incremento en un 51±16 % (P<0.05) en la prueba control y un 32±6 % (P<0.05) en la prueba con bloqueo en comparación con la condición inicial.

Figura 3. Contenido de proteínas GLUT-4 del músculo esquelético antes del
ejercicio y 8 y 22 h después del ejercicio para las prueba control y con bloqueo
(bloqueo de los receptores adrenérgicos por medio del uso de fenoxibenzamina y
propanolol). Las muestras fueron obtenidas a partir del músculo vasto lateral y
fueron analizadas para las proteínas GLUT-4 por medio de Western blotting. Para
cada individuo, fueron comparadas las señales a 8 y 22 h después del ejercicio
con las muestras de la condición inicial y analizadas con análisis de varianza
de mediciones repetidas. Debido a que la barras de error reflejan las varianzas
de las diferencias entre las muestras de las 8 y 22 h y las muestras de la
condición inicial, no se presentaron errores en la condición inicial. Los
verdaderos datos de la densitometría de la condición inicial fueron 1.89±0.39
unidades arbitrarias para la prueba control y 1.65±0.34 unidades arbitrarias
para la prueba con bloqueo. Figuras, gráficos representativos para la prueba
control (izquierda) y para la prueba con bloqueo (derecha). *Diferencias
significativas (P<0.05) en la comparación de las muestras de cada prueba en la
condición inicial y 22 h post-ejercicio para cada prueba.
Para la LPL y los GLUT-4 en ambas pruebas, fue encontrado un importante efecto significativo del tiempo por medio del análisis de varianza a dos vías de mediciones repetidas. Estos resultados sugieren que, al menos bajo las condiciones de este experimento, el curso de tiempo de inducción de estas proteínas en el músculo esquelético humano es similar y no es afectado por el bloqueo de los receptores adrenérgicos.
La insulina y la glucosa afectan la expresión de LPL y GLUT-4. El bloqueo de los receptores adrenérgicos estuvo asociado con menores niveles de insulina en los puntos de tiempo de 0 h (P=0.04), 0.5 h (P=0.05), y 1 h (P=0.02), justo antes y durante el ejercicio (Figura 4 A). Sin embargo no hubo diferencias significativas en otros puntos de tiempo y no hubo diferencias significativas en ningún punto de tiempo para las concentraciones de glucosa (Figura 4 B).
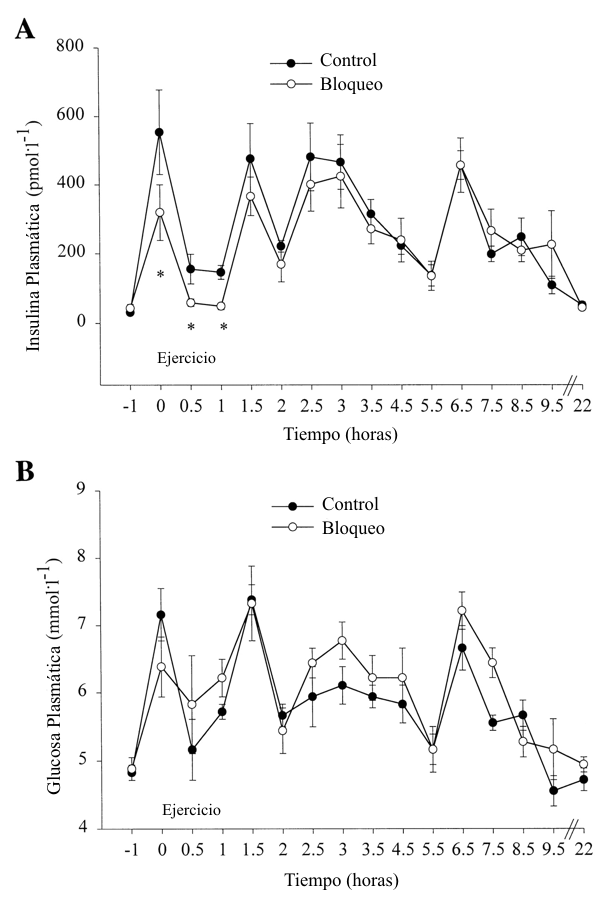
Figura 4. Concentraciones plasmáticas de insulina (A) y glucosa (B) durante las
pruebas control y con bloqueo. *P<0.05 en comparación con las pruebas control en
el mismo punto de tiempo.
Los ácidos grasos no esterificados circulantes tendieron a incrementarse con el ejercicio, debido a que las catecolaminas promovieron la actividad de la lipasa sensible a las hormonas en el tejido adiposo. Hubo una tendencia a una menor concentración de los ácidos grasos durante el ejercicio en la prueba con bloqueo (datos no mostrados), pero estas diferencias no fueron significativas. No hubo diferencias en los niveles circulantes de leptina entre las pruebas (datos no mostrados).
DISCUSIÓN
Nuestros resultados confirman que una sola serie de ejercicio incrementa el contenido de las proteínas LPL del músculo esquelético (32). Varios estudios anteriores reportaron la inducción de las proteínas GLUT-4 después de 7-10 días de ejercicios de resistencia (2, 7). Es conocido que una sola serie prolongada de ejercicio incrementa la expresión de los GLUT-4 del músculo esquelético en ratas (29). Para el mejor de nuestros conocimientos, los presentes resultados representan los datos iniciales mostrando que una sola serie de ejercicio también incrementa a las proteínas GLUT-4 en el músculo esquelético de los humanos.
Los presentes resultados también proveen ideas acerca de los mecanismos subyacentes a la inducción de estas dos proteínas que son críticas para el normal metabolismo de la glucosa y los lípidos. Las catecolaminas se incrementan en función de la intensidad de ejercicio (6), e interactúan con los receptores adrenérgicos de la superficie de las células unidos a las proteínas G para afectar numerosas rutas metabólicas. El bloqueo de los receptores adrenérgicos por medio del uso de fenoxibenzamina (un α-bloqueante no específico) y propanolol (un β-bloqueante no específico) durante el ejercicio no previno la inducción de las proteínas LPL y GLUT-4 en el músculo esquelético humano. Estos resultados sugieren que, aún en la ausencia de estimulación por parte de las catecolaminas, el músculo esquelético puede activar vías de señalización que producen una respuesta coordinada para asegurar la adquisición de combustible.
Al menos para la LPL, varias líneas de evidencia sugieren que las catecolaminas están involucradas en la respuesta al ejercicio. Las catecolaminas incrementan los niveles de AMPc, los niveles de AMPc se incrementan en función al ejercicio o en respuesta a concentraciones elevadas de catecolaminas plasmáticas (17, 21), y un elemento de respuesta al AMPc está presente en el promotor de la LPL humano (16). Las tasas de excreción urinaria de catecolaminas explican > del 80 % de la variabilidad en la actividad de la LPL del músculo esquelético humano (22). La infusión de ya sea epinefrina o isoproterenol incrementa la expresión de la LPL del músculo esquelético en humanos y roedores (3, 4, 27). Las catecolaminas también incrementan la actividad de la LPL en el músculo cardíaco de las ratas (5).
Los presentes resultados sugieren que la señalización inducida por la interacción entre las catecolaminas y los receptores adrenérgicos no es requerida para el incremento inducido por el ejercicio en el contenido de las proteínas LPL. Un estudio anterior realizado en humanos concluyó que la actividad contráctil local es responsable del incremento de la actividad de la LPL en el músculo (14), pero el mismo no excluyó a los posibles efectos locales de las catecolaminas liberadas de los nervios que inervan a los músculos que se ejercitan. Usando un bloqueo sistémico de los receptores adrenérgicos, nuestros datos también muestran que las catecolaminas liberadas localmente como consecuencia de la actividad contráctil no juegan un rol crítico en la inducción de la LPL. En conjunto con un estudio realizado en ratas (8), los datos disponibles indican que la contracción muscular por si misma induce a la LPL. El mediador de este efecto es desconocido, aunque el AMPc es un candidato atractivo. Los niveles de AMPc son elevados durante el ejercicio aún con bloqueo β (17, 18).
Los estudios sobre los efectos de las catecolaminas sobre los GLUT-4 son menos consistentes. La infusión en un corto transcurso de tiempo de epinefrina en ratas después de la extirpación quirúrgica de la médula adrenal disminuye la transcripción de GLUT-4 (13), sugiriendo que las catecolaminas disminuyen la expresión de los GLUT-4. Las ratas sujetas a bloqueo β durante 6 semanas de entrenamiento no mostraron incrementos en los GLUT-4 musculares, sugiriendo que las catecolaminas son necesarias para el incremento en los GLUT-4 inducido por el ejercicio (19). Los presentes resultados no apoyan esta interpretación. Una posible explicación para esta aparente discrepancia es el hecho que el estudio hecho con ratas midió los GLUT-4 ≥ 48 h después del ejercicio, un punto de tiempo en el cual serían revertidos los cambios adaptativos en los GLUT-4 (12).
El contenido de proteínas LPL usualmente refleja la actividad enzimática de la LPL en el músculo esquelético (31, 35). Bajo la mayoría de las circunstancias, el contenido de las proteínas GLUT-4 refleja la capacidad del músculo esquelético de llevar a cabo el transporte de glucosa (10, 29, 30). Los niveles de proteínas para la LPL y GLUT-4, en el presente estudio, son probablemente elevados debido a los niveles incrementados de mensajes. Estudios anteriores de nuestro laboratorio usando humanos demostraron que un incremento en el ARNm de la LPL del músculo esquelético precede a un incremento en la proteína LPL después del ejercicio (32). Estudios anteriores de nuestro laboratorio usando roedores demostraron que el ejercicio induce al ARNm de los GLUT-4 y a la proteína GLUT-4 (29). Otros han demostrado un incremento en la transcripción de los GLUT-4 con el ejercicio (26). De este modo, es probable que el ejercicio active una ruta de señalización transcripcional independientemente de los receptores adrenérgicos para incrementar las proteínas LPL y GLUT-4. Un asunto crítico es la naturaleza de la ruta de señalización que modula la activación de la transcripción por medio del ejercicio.
La AMPK, activada por la depleción de energía en el músculo, es probable que este involucrada en la inducción de genes que responden al ejercicio. Una evidencia creciente implica a esta quinasa en la translocación de los GLUT-4 (9, 20), y datos recientes indican que la AMPK induce la expresión de los GLUT-4 y la hexoquinasa (11). Sin embargo, los mediadores corriente abajo de la AMPK son desconocidos. La vía de las proteín quinasas activadas por mitógenos puede estar involucrada. La contracción muscular es un potente activador de esta vía metabólica (1). Las proteín quinasas activadas por mitógenos pueden ser responsables del incremento de la transcripción de los genes inmediatos en el músculo esquelético después del ejercicio (34).
La señalización por el receptor insulínico también puede estar involucrada en las respuestas al ejercicio. La contracción del músculo esquelético tiene notables efectos metabólicos en la ausencia de insulina (28). De manera consistente con este concepto, el ejercicio incrementa el transporte de glucosa en el músculo esquelético de ratas sin receptores insulínicos musculares específicos (37). Sin embargo, la insulina potencia el efecto del ejercicio en estos ratones sin receptores insulínicos en el músculo esquelético, sugiriendo que quizás receptores insulínicos en lugares distintos de los miocitos o que la interacción de la insulina con otros receptores, pueden afectar las respuestas al ejercicio. En el presente estudio, el bloqueo de los receptores adrenérgicos estuvo asociado con menores niveles plasmáticos de insulina durante el ejercicio (Figura 4 A). La señalización por medio de los receptores adrenérgicos tiene efectos complejos sobre la secreción y acción de la insulina (38). Debido a que fueron observados menores niveles de insulina sin diferencias en la glucosa plasmática (Figura 4 B), el bloqueo de los receptores adrenérgicos puede aumentar modestamente la señalización de la insulina durante el ejercicio, al menos bajo las condiciones de este experimento.
En conclusión, una sola serie de ejercicio incrementa el contenido de las proteínas LPL y GLUT-4 del músculo esquelético humano en el marco de ambos, bloqueo α- y β- adrenérgico. La contracción muscular en si misma, actuando quizás en respuesta a la depleción de las reservas de fosfatos de alta energía, parece mediar la adquisición de combustible en el músculo.
Agradecimientos: Apreciamos el compromiso de los sujetos de nuestro estudio.
Nota: Este trabajo fue apoyado por el National Institute of Health (NIH), Becas AG-14658, HL-58427, y DK-53198; por el Washington University General Clinical Research Center (MO1 RR-00036); por el Washington University Diabetes Research and Training Center (DK-20579). J. S. Greiwe fue apoyado por el NIH Institutional National Research Service Award AG-0078.
Dirección para pedido de reimpresiones y otras correspondencias: C. F. Semenkovich, Washington Univ. School of Medicine, 660 S. Euclid Ave., Box 8046, St. Louis, MO 63110 (E-mail semenkov@im.wustl.edu).
Referencias
1. Aronson, D, Violan MA, Dufresne SD, Zangen D, Fielding RA, and Goodyear LJ (1997). Exercise stimulates the mitogen-activated protein kinase pathway in human skeletal muscle. J Clin Invest 99: 1251-1257
2. Cox, JH, Cortright RN, Dohm GL, and Houmard JA (1999). Effect of aging on response to exercise training in humans: skeletal muscle GLUT-4 and insulin sensitivity. J Appl Physiol 86: 2019-2025
3. Deshaies, Y, Geloen A, Paulin A, Marette A, and Bukowiecki LJ (1993). Tissue-specific alterations in lipoprotein lipase activity in the rat after chronic infusion of isoproterenol. Horm Metab Res 25: 13-16
4. Eckel, RH, Jensen DR, Schlaepfer IR, and Yost TJ (1996). Tissue-specific regulation of lipoprotein lipase by isoproterenol in normal-weight humans. Am J Physiol Regulatory Integrative Comp Physiol 271: R1280-R1286
5. Friedman, G, Chajek-Shaul T, Stein O, Noe L, Etienne J, and Stein Y (1986). β-Adrenergic stimulation enhances translocation, processing and synthesis of lipoprotein lipase in rat heart cells. Biochim Biophys Acta 877: 112-120
6. Greiwe, JS, Hickner RC, Shah SD, Cryer PE, and Holloszy JO (1999). Norepinephrine response to exercise at the same relative intensity before and after endurance exercise training. J Appl Physiol 86: 531-535
7. Gulve, EA, and Spina RJ (1995). Effects of 7-10 days of cycle ergometer exercise on skeletal muscle GLUT-4 protein content. J Appl Physiol 79: 1562-1566
8. Hamilton, MT, Etienne J, McClure WC, Pavey BS, and Holloway AK (1998). Role of local contractile activity and muscle fiber type on LPL regulation during exercise. Am J Physiol Endocrinol Metab 275: E1016-E1022
9. Hayashi, T, Hirshman MF, Kurth EJ, Winder WW, and Goodyear LJ (1998). Evidence for 5 AMP-activated protein kinase mediation of the effect of muscle contraction on glucose transport. Diabetes 47: 1369-1373
10. Holloszy, JO, and Hansen PA (1996). Regulation of glucose transport into skeletal muscle. Rev Physiol Biochem Pharmacol 128: 99-193
11. Holmes, BF, Kurth-Kraczek EJ, and Winder WW (1999). Chronic activation of 5-AMP-activated protein kinase increases GLUT-4, hexokinase, and glycogen in muscle. J Appl Physiol 87: 1990-1995
12. Host, HH, Hansen PA, Nolte LA, Chen MM, and Holloszy JO (1998). Rapid reversal of adaptive increases in muscle GLUT-4 and glucose transport capacity after training cessation. J Appl Physiol 84: 798-802
13. Jones, JP, and Dohm GL (1997). Regulation of glucose transporter GLUT-4 and hexokinase II gene transcription by insulin and epinephrine. Am J Physiol Endocrinol Metab 273: E682-E687
14. Kiens, B, Lithell H, Mikines KJ, and Richter EA (1989). Effects of insulin and exercise on muscle lipoprotein lipase activity in man and its relation to insulin action. J Clin Invest 84: 1124-1129
15. Kiens, B, and Richter EA (1998). Utilization of skeletal muscle triacylglycerol during postexercise recovery in humans. Am J Physiol Endocrinol Metab 275: E332-E337
16. Kirchgessner, TG, Chuat J-C, Heinzmann C, Etienne J, Guilhot S, Svenson K, Ameis D, Pilon C, D'Auriol L, Andalibi A, Schotz MC, Galibert F, and Lusis AJ (1989). Organization of the human lipoprotein lipase gene and evolution of the lipase gene family. Proc Natl Acad Sci USA 86: 9647-9651
17. Kraus, WE, Bernard TS, and Williams RS (1989). Interactions between sustained contractile activity and β-adrenergic receptors in regulation of gene expression in skeletal muscles. Am J Physiol Cell Physiol 256: C506-C514
18. Kraus, WE, Longabaugh JP, and Liggett SB (1992). Electrical pacing induces adenylyl cyclase in skeletal muscle independent of the β-adrenergic receptor. Am J Physiol Endocrinol Metab 263: E226-E230
19. Kuo, C-H, Ding Z, and Ivy JL (1996). Interaction of exercise training and clenbuterol on GLUT-4 protein in muscle of obese Zucker rats. Am J Physiol Endocrinol Metab 271: E847-E854
20. Kurth-Kraczek, EJ, Hirshman MF, Goodyear LJ, and Winder WW (1998). 5 AMP-activated protein kinase activation causes GLUT-4 translocation in skeletal muscle. Diabetes 48: 1667-1671
21. Lee, AD, Hansen PA, Schluter J, Gulve EA, Gao J, and Holloszy JO (1997). Effects of epinephrine on insulin-stimulated glucose uptake and GLUT-4 phosphorylation in muscle. Am J Physiol Cell Physiol 273: C1082-C1087
22. Ma, Z, Gingerich RL, Santiago JV, Klein S, Smith CH, and Landt M (1996). Analysis of human plasma leptin by radioimmunoassay. Clin Chem 42: 942-946
23. Marker, JC, Hirsch IB, Smith LJ, Parvin CA, Holloszy JO, and Cryer PE (1991). Catecholamines in prevention of hypoglycemia during exercise in humans. Am J Physiol Endocrinol Metab 260: E705-E712
24. Morgan, DR, and Lazarow A (1963). Immunoassay of insulin: two antibody system. Diabetes 12: 115-126
25. Neufer, PD, and Dohm GL (1993). Exercise induces a transient increase in transcription of the GLUT-4 gene in skeletal muscle. Am J Physiol Cell Physiol 265: C1597-C1603
26. Pedersen, SB, Bak JF, Holck P, Schmitz O, and Richelsen B (1999). Epinephrine stimulates human muscle lipoprotein lipase activity in vivo. Metabolism 48: 461-464
27. Ploug, T, Galbo H, and Richter EA (1984). Increased muscle glucose uptake during contractions: no need for insulin. Am J Physiol Endocrinol Metab 247: E726-E731
28. Ren, JM, Semenkovich CF, Gulve EA, Gao J, and Holloszy JO (1994). Exercise induces rapid increases in GLUT-4 expression, transport capacity, and insulin-stimulated glycogen storage in muscle. J Biol Chem 269: 14396-14401
29. Ren, JM, Semenkovich CF, and Holloszy JO (1993). Adaptation of muscle to creatine depletion: effect on GLUT-4 glucose transporter expression. Am J Physiol Cell Physiol 264: C146-C150
30. Seip, RL, Angelopoulos TJ, and Semenkovich CF (1995). Exercise induces human lipoprotein lipase gene expression in skeletal muscle but not adipose tissue. Am J Physiol Endocrinol Metab 268: E229-E236
31. Seip, RL, Mair K, Cole TG, and Semenkovich CF (1997). Induction of human skeletal muscle lipoprotein lipase gene expression by short-term exercise is transient. Am J Physiol Endocrinol Metab 272: E255-E261
32. Shah, SD, Clutter WE, and Cryer PE (1985). External and internal standards in the single isotope derivative (radioenzymatic) assay of plasma norepinephrine and epinephrine in normal humans and persons with diabetes mellitus or chronic renal failure. J Lab Clin Med 106: 624-629
33. Sherwood, DJ, Dufresne SD, Markuns JF, Cheatham B, Moller DE, Aronson D, and Goodyear LJ (1999). Differential regulation of MAP kinase, p70S6K, and Akt by contraction and insulin in rat skeletal muscle. Am J Physiol Endocrinol Metab 276: E870-E878
34. Simsolo, RB, Ong JM, and Kern PA (1993). The regulation of adipose tissue and muscle lipoprotein lipase in runners by detraining. J Clin Invest 92: 2124-2130
35. Sundin, T, Dahlstrom A, Norlen L, and Svedmyr N (1977). The sympathetic innervation and adrenoreceptor function of the human lower urinary tract in the normal state and after parasympathetic denervation. Invest Urol 14: 322-328
36. Wojtaszewski, JFP, Higaki Y, Hirshman MF, Michael MD, Dufresne SD, Kahn CR, and Goodyear LJ (1999). Exercise modulates postreceptor insulin signaling and glucose transport in muscle-specific insulin receptor knockout mice. J Clin Invest 104: 1257-1264
37. Young, JB, and Landsberg L (1998). Catecholamines and the adrenal medulla. In: Williams Textbook of Endocrinology (9th ed.). Philadelphia, PA: Saunders, p. 665-728