El Entrenamiento de Esprint de Alta Intensidad Reduce la Peroxidación de los Lípidos en el Músculo Esquelético con Predominio de Fibras de Contracción Rápida
Perry Cunningham1, Marca Geary1, Richard Harper1, Angela Pendleton1 y Shawn Stover1
Department of Biology and Environmental Science, Davis & Elkins College, Elkins, West Virginia, Estados Unidos.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2006.
Publicado 4 de junio de 2008
Resumen
Palabras clave: ejercicio anaeróbico, estrés oxidativo, malondialdehído
INTRODUCCION
Como consecuencia del metabolismo celular normal se produce la generación de especies reactivas tales como el oxígeno singlete, radical superóxido, y el radical hidroxilo (1). El daño relacionado al oxígeno reactivo incluye ruptura en la hebra de ADN y cambios de una sola base (2), oxidación de las cadenas laterales de los aminoácidos y fragmentación de polipéptidos (3), y la degradación de ácidos grasos poliinsaturados y fosfolípidos a través de la peroxidación de los lípidos (4). La degradación del oxígeno reactivo del cuerpo se lleva a cabo por el sistema endógeno de defensa antioxidante que comprende la actividad de enzimas como la superóxido dismutasa (SOD), glutatión peroxidasa (GPx), y glutatión reductasa (GR), junto con antioxidantes exógenos consumidos a través de la dieta (1). El estrés oxidativo puede ser definido como una condición en que la producción celular de oxígeno reactivo excede la capacidad fisiológica del cuerpo para inactivar las especies reactivas (4).
Las especies reactivas de oxígeno tienen vidas medias muy cortas, que van de 2 a 20 μs para el oxígeno singlete (5), aproximadamente 30 ms para el radical superóxido (6), y 10-9 s para el radical hidroxilo (7). Sin embargo, se ha estimado que las especies reactivas se originan a una velocidad aproximada de 1011 por célula por día. Por lo tanto, los organismos aeróbicos siempre están sujetos al estrés oxidativo (8). Además, las especies reactivas pueden comenzar reacciones de oxidación en cadena. Por ejemplo, el radical hidroxilo reaccionará ligando o sustrayendo el hidrógeno de las moléculas blanco. En cualquier caso se originan nuevas especies reactivas. Esta reacción en cadena podría conducir a la peroxidación lipídica. El blanco de las especies reactivas de oxígeno son los dobles enlaces carbono-carbono de los ácidos grasos poliinsaturados muy abundantes en las membranas celulares. El enlace doble en el carbono hace que la unión entre el carbono y el hidrógeno sea relativamente débil, lo que permite que las especies reactivas disocien fácilmente el hidrógeno. La remoción del hidrógeno deja al carbono con un electrón desapareado, originando así una nueva especie reactiva (2). La rápida peroxidación de los lípidos rompe la organización de la membrana, afectando su fluidez y permeabilidad (9), y puede ser una fuente de aldehídos citotóxicos (10).
El aumento en el consumo de oxígeno durante el ejercicio aeróbico es acompañado por un aumento de las especies reactivas del oxígeno. El ejercicio aeróbico agudo genera oxígeno reactivo creando una perturbación en el transporte de electrones que provoca una excesiva producción de radicales superóxido (4). Sin embargo, el entrenamiento de resistencia a largo plazo reduce eficientemente el daño asociado al aumento en el consumo de oxígeno reforzando las defensas antioxidantes del cuerpo. Ha sido demostrado que en respuesta al entrenamiento de resistencia aumentan las actividades de las enzimas GPx (11), GR (11), y SOD (12).
El ejercicio anaeróbico agudo puede causar una mayor oxidación de lípidos. En las ratas, un solo esprint de un minuto a un ritmo de 45 m/min eleva los hidroperóxidos lipídicos y las sustancias reactivas al ácido tiobarbiturico (TBARS) en el músculo esquelético, lo que indica una peroxidación de lípidos significativa (13). En ratones, esprints de 15-30 s a un ritmo de 35 m/min aumenta significativamente las TBARS en el músculo esquelético y en el hígado (14). En seres humanos, seis esprints de 150 m (15), o un circuito de ejercicio de resistencia submáxima (16), aumentan los niveles plasmáticos del marcador de peroxidación de lípidos, malondialdehído (MDA).
Mientras que las respuestas al entrenamiento de resistencia han sido documentadas relativamente bien, los efectos de los métodos de entrenamiento que acentúan el uso de los músculos glucolítico con predominio de fibras contracción rápida no han recibido tanta atención. Estudios previos indican que la actividad de GPx y GR aumenta significativamente luego del entrenamiento de esprint (17) y que el entrenamiento de resistencia regular puede ayudar en la prevención de la peroxidación de los lípidos durante el ejercicio (16). En el presente estudio evaluamos las siguientes hipótesis; 1) el ejercicio agudo de alta intensidad puede provocar estrés oxidativo, y 2) el daño oxidativo de los tejidos, inducido por el ejercicio puede ser reducido por medio del entrenamiento de alta intensidad a largo plazo. Si el ejercicio agudo de alta intensidad, puede inducir la peroxidación de lípidos en el músculo esquelético con predominio de fibras de contracción rápida, entonces se observarán niveles elevados de MDA en el músculo extensor largo de los dedos (EDL) luego de la realización de una sola sesión de esprint de alta intensidad. Además, si el entrenamiento de alta intensidad puede reducir los efectos perjudiciales del estrés oxidativo, entonces la concentración de MDA debería ser menor en el EDL luego de entrenamiento de esprint de alta intensidad de larga duración.
METODOS
Animales
Este estudio fue aprobado por el Comité Institucional de Uso y Cuidado Animal de la Universidad Davis & Elkins. Treinta ratones ICR masculinos albinos (CD-1®) (Harlan, Indianapolis, EN), que tenían entre 5-7 semanas de vida al comienzo del estudio, fueron enjaulados de a uno o de a dos por jaula y colocados en un cuarto mantenido entre 18-24°C y con ciclos de 12 horas de luz - 12 horas de oscuridad. Todos los ratones disponían de acceso libre al agua y a la comida (dieta fortificada para ratas y ratones, Kaytee Products, Inc., Chilton, WI).
Ejercicio Agudo
Los ratones experimentales desentrenados (n=8) realizaron seis esprints consecutivos de 30 s en una cinta caminadora para roedores a un ritmo de 30 m/min (15° pendiente), con un intervalo de recuperación de 1 min entre cada esprint. Los ratones del grupo control (n=5) no realizaron ningún ejercicio. Se utilizó de manera moderada una rejilla electrificada (0,2 mA) en la parte posterior de la cinta caminadora como motivación para correr. Todos los procedimientos de ejercitación fueron realizados entre las 9:00 am y las 12:00 pm.
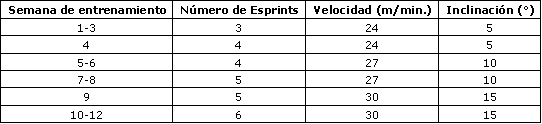
Tabla 1.Programa de entrenamiento de los ratones.
Ejercicios de Entrenamiento
Los ratones experimentales (n=9) participaron en un programa de entrenamiento de alta intensidad que consistió en correr en una cinta dos días por semana durante 12 semanas. Cada sesión estuvo compuesta por tres a seis esprints de 30 s a un ritmo de 24-30 m/min (5-15° pendiente; Tabla 1), con un intervalo de recuperación de 1 min entre cada esprint. Los ratones del grupo control (n=8) no realizaron el proceso de entrenamiento. Al final del período de entrenamiento, los ratones entrenados y los controles realizaron seis esprints consecutivos de 30 s en una cinta caminadora para roedores a un ritmo de 30 m/min (15° pendiente), con un intervalo de recuperación de 1 min entre cada esprint. Una rejilla electrificada (0,2 mA) colocada en la parte posterior de la cinta se usó moderadadamente como motivación para correr. Todos los procedimientos de ejercitación fueron realizados entre las 9:00 am y la 12:00 pm
Determinación de la Peroxidación de los Lípidos
Los ratones fueron sacrificados por dislocación cervical. El sacrificio de animales que realizaron el ejercicio fue realizado inmediatamente después del último intervalo de recuperación de 1 min. Se extrajeron los músculos soleo y EDL de los miembros posteriores, fueron enjuagados con agua destilada fría, homogeneizados en buffer Tris-HCl (pH 7,4) 20 mM y se les colocó N-metil-2-fenilindol (R1) a 45°C. El R1 se combina con el MDA generando un cromóforo estable con absorbancia máxima a 586 nm (Colorimetric Assay for Lipid Peroxidation Biomedical Research, Oxford, MI). Para descontar la absorbancia base, se prepararon los correspondientes controles negativos que contenían el buffer Tris-HCl en lugar del tejido homogeneizado. Las muestras experimentales y los controles fueron analizados espectrofotométricamente a 586 nm. Las concentraciones de MDA fueron calculadas a partir de los valores de absorbancia aplicando la siguiente fórmula: [MDA] = ([A586 - b]/a) x df dónde [MDA] es la concentración de MDA en la muestra en mM, A586 es la absorbancia neta de la muestra a 586 nm, a es la pendiente de la curva patrón de MDA (los estándares de MDA fueron incluidos en el kit de ensayo), b es la ordenada al origen de la curva estándar, y df es el factor de dilución de la muestra.
Análisis Estadísticos
Para determinar la variabilidad de las medias entre los grupos se utilizó un análisis de la varianza de una vía (ANOVA). Para realizar las comparaciones específicas de grupo en el ANOVA de una vía, se utilizaron test t de dos muestras. Todos los test t fueron de dos colas, y el nivel alfa fijado fue igual a p<0,05 para que las diferencias fueran consideradas estadísticamente significativas. Los datos fueron expresados como media±desviación estándar.
RESULTADOS
Ejercicio Agudo
Luego de la realización del ejercicio agudo, la concentración de MDA en el soleo con predominio de fibras de contracción lenta no fue significativamente diferente a la del grupo control que no realizó ejercicio. Sin embargo, el ejercicio agudo produjo un aumento significativo de la concentración de MDA en el EDL con predominio de fibras de contracción rápida (17,276 mM±1,86 mM), en comparación con el grupo control (11,638 mM±3,16 mM; Figura 1).
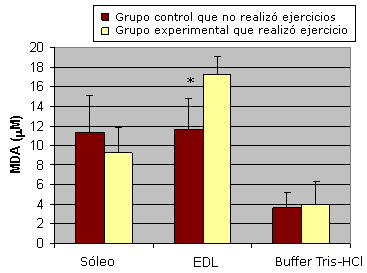
Figura 1. Resultados que muestran los efectos del ejercicio agudo. Los valores se presentan como media±desviación estándar; * Significativamente diferente respecto del grupo que realizó "Ejercicio Agudo" (p<0,05); las muestras que contenían buffer de homogeneización solo se analizaron para descontar la absorbancia no específica.
Ejercicios de Entrenamiento
Luego del régimen de entrenamiento, la concentración de MDA en el soleo no fue significativamente diferente respecto del grupo control que no realizó entrenamiento. Sin embargo, la concentración de MDA en el EDL se redujo significativamente en los ratones entrenados (14,257 mM±4,12 mM), en comparación con la concentración encontrada en el grupo control no entrenado (17,641mM±1,60 mM; Figura 2).
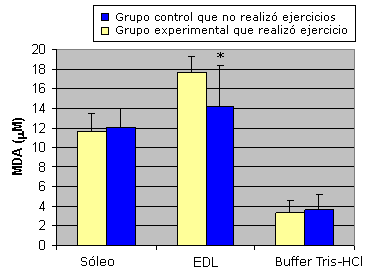
Figura 2. Resultados que muestran los efectos de entrenamiento. Los valores se presentan como media±desviación estándar; * Significativamente diferente respecto del grupo que realizó "Ejercicio Agudo" (p <0,05); las muestras que contenían buffer de homogeneización solo se analizaron para descontar la absorbancia no específica.
DISCUSION
La magnitud del daño oxidativo en el tejido depende del equilibrio entre los radicales de oxígeno generados y la defensa antioxidante del tejido. La SOD descompone el radical superóxido para formar peróxido de hidrógeno (H2O2). A continuación, el H2O2 es transformado en agua por la acción de enzimas como la catalasa de los peroxisomas (CAT) o la GPx del citoplasma (18). El glutatión reducido (GSH) desempeña un papel importante en la defensa celular contra el estrés oxidativo, secuestrando las especies reactivas de oxígeno, actuando directamente o funcionando como sustrato para la GPx (19). La conversión de GSH a GSSG, la forma oxidada de la molécula, es catalizada por la GPx durante la detoxificación reductiva del H2O2 (20). El GSH se regenera a partir del GSSG por la actividad de la GR (21). Aunque algunas células epiteliales tienen la capacidad de captar el GSH intacto (22), la mayoría de las células realizan síntesis de novo para mantener las reservas celulares. El GSH es sintetizado a través de un proceso de dos pasos que involucra las enzimas, g-glutamato-cisteína ligasa (GCL) y la glutatión sintetasa (GS). La GCL cataliza la reacción intracelular que da como resultado la unión de un residuo de cisteína que contiene un grupo sulfidrilo con un residuo de glutamato. La actividad de la GS consiste en agregar un residuo de glicina para completar el tripeptido (19). Generalmente, el oxígeno reactivo es rápidamente degradado por los mecanismos defensivos. Sólo se observan efectos tóxicos de estrés oxidativo cuando la tasa de formación de oxígeno reactivo excede la tasa de degradación.
Está ampliamente aceptado que el aumento del oxígeno reactivo asociado con el ejercicio aeróbico se debe principalmente a un aumento en el transporte de electrones en la mitocondria y a la posterior liberación de radicales superóxido (4). Sin embargo, el mecanismo por el cual el ejercicio anaeróbico agudo produce estrés oxidativo no ha sido establecido con claridad. Se ha sugerido que el aumento en el oxígeno reactivo producido por el ejercicio de sobrecarga puede ser el resultado de una lesión mecánica de las fibras musculares, lo que produce proteólisis, inflamación, y un desequilibrio en la homeostasis del calcio (4, 23). Por otra parte, se ha demostrado que la potencia glucolítica alcanza un máximo al inicio del ejercicio de alta intensidad y es seguida por una síntesis significativa de ATP mitocondrial (24, 25). Además de la contribución del metabolismo aeróbico, y la consiguiente perturbación en el transporte de electrones, el aumento del oxígeno reactivo generado por ejercicios de esprint también puede ser afectada por la isquemia/reperfusión. El consumo de oxígeno repentino luego de un esprint puede producir la reacción de los intermediarios metabólicos acumulados para generar niveles elevados de radicales de oxígeno (4, 23).
Los resultados del presente estudio sugieren que el entrenamiento de esprint de alta intensidad tiene un efecto beneficioso. La peroxidación lipídica, como lo indica la concentración de MDA, disminuye significativamente en el músculo con predominio de fibras de contracción rápida EDL, después de 12 semanas de entrenamiento. No está claro cual es el mecanismo involucrado en la reducción de la peroxidación. El mecanismo responsable podría ser la regulación en alza (upregulation) de la actividad de la GPx. Debido a la sensibilidad de la enzima GPx frente a los niveles intracelulares de oxígeno reactivo y a su papel en la destrucción de los productos finales de la oxidación (incluyendo los peróxidos lipídicos), ésta podría ser considerada como la enzima antioxidante más importante para la supervivencia celular (26). Un aumento en el GSH también podría contribuir a la adaptación al entrenamiento demostrada en el presente estudio. Se ha observado que el entrenamiento de resistencia aumenta el contenido de GSH en los músculos de los miembros posteriores de perros (27) y ratas (12). El entrenamiento de esprint de alta intensidad podría producir un efecto similar. Es importante recalcar que un aumento en el GSH podría reflejar un aumento en la actividad de GCL, la enzima que limita la velocidad de síntesis de GSH. Finalmente, es posible que el efecto beneficioso se deba a una mayor capacidad para realizar fosforilación oxidativa. Estudios previos han confirmado una mayor masa mitocondrial en respuesta a condiciones de estrés oxidativo (28, 29). Cada uno de estos mecanismos debe ser estudiado en detalle.
El proceso de envejecimiento conduce a un incremento en la producción de oxígeno reactivo por parte de las mitocondrias que paulatinamente van tornándose menos eficientes para realizar el transporte de electrones dentro de las células, quienes a su vez se vuelven menos eficientes para expresar las enzimas antioxidantes (30, 31). Por consiguiente, el estrés oxidativo está implicado en muchos desórdenes fisiológicos asociados al envejecimiento. Por ejemplo, en la actualidad la oxidación de lipoproteínas de baja densidad (LDL) en los vasos sanguíneos se considera un factor principal en el desarrollo de la arteriosclerosis (32), y el cerebro de pacientes que presentan la enfermedad de Alzheimer posee concentraciones elevadas de MDA y una disminución en la actividad de la enzima catalasa (33). Los músculos que han sido sometidos a entrenamiento de resistencia tienen mayores niveles de actividad de las enzimas antioxidantes y un mayor contenido de GSH, lo que permite una remoción más eficaz de las especies reactivas de oxígeno (11, 12, 27). Por consiguiente, el entrenamiento de resistencia reduce el impacto del estrés oxidativo asociado a la edad. Luego de realizar un régimen de entrenamiento de resistencia, los músculos soleos de ratas de edad avanzada mostraron concentraciones menores de MDA, en relación a los controles sedentarios (34). El entrenamiento de esprint también podría proporcionar protección frente al daño oxidativo tisular asociado a la edad. Sin embargo, es necesario realizar estudios adicionales para determinar si los efectos beneficiosos se limitan a los músculos con predominio de fibras de contracción rápida.
Conclusiones
En síntesis, los resultados del presente estudio son consistentes con los resultados de trabajos anteriores donde se observó un aumento en la peroxidación de lípidos en respuesta al ejercicio agudo de alta intensidad, (13, 14, 15, 16). Además, los resultados indican que el entrenamiento de alta intensidad a largo plazo, podría reducir eficazmente el impacto del estrés oxidativo evitando la peroxidación de lípidos excesiva.
En lo que a la salud humana se refiere, los beneficios del entrenamiento de resistencia son ampliamente conocidos, pero el impacto positivo del entrenamiento anaeróbico de alta intensidad podría ser subestimado. Por ejemplo, Burgomaster et al. (35) demostraron recientemente que el entrenamiento intervalado de esprint intensivo podría aumentar el potencial oxidativo del músculo y verdaderamente duplicar la capacidad de resistencia. Los resultados del presente estudio indican que, además de su potencial para aumentar el rendimiento, el entrenamiento de esprint de alta intensidad podría también proporcionar un mecanismo eficiente en el tiempo para disminuir o reducir los efectos del estrés oxidativo.
Dirección para Envío de Correspondencia
Shawn Stover, Ph.D., Department of Biology and Environmental Science, Davis & Elkins College, 100 Campus Drive, Elkins, WV 26241. Phone: (304) 637-1275; correo electrónico: stovers@davisandelkins.edu.
Referencias
1. Sen CK, Packer L, Hanninen O, editors (1994). Exercise and Oxygen Toxicity. Amsterdam: Elsevier Science
2. Halliwell B, Guttheridge JMC (1989). Free Radicals in Biology and Medicine (2nd edition). New York: Clarendon Press, Oxford University Press
3. Levine RL, Stadtman ER (2001). Oxidative modification of proteins during aging. Exp Gerentol 36: 1495-1502
4. Bloomer RJ, Goldfarb AH (2004). Anaerobic exercise and oxidative stress a review. Can J Appl Physiol 29(3):245-263
5. Kearns D (1979). Solvent and solvent isotope effects on the lifetime of singlet oxygen. In: Wasserman HH, Murray RW, editors. Singlet Oxygen. New York: Academic Press, 115-137
6. Sawyer D (1991). Oxygen Chemistry. New York: Oxford University Press
7. Sies H (1993). Strategies of antioxidant defense. Eur J Biochem 215:213-219
8. Fridovich I, Freeman B (1986). Antioxidant defenses in the lung. Ann Rev Physiol 48:693-702
9. Grinna L (1977). Age-related changes in the lipids of the microsomal and mitochondrial membranes of rat liver and kidney. Mech Age Dev 6:197-205
10. Esterbauer H, Schau R, Zollner H (1991). Chemistry and biochemistry of 4-hydroxynonenal, malondialdehyde and related aldehydes. Free Radic Biol Med 11:81-128
11. Venditt P, Di Meo S (1997). Effect of training on antioxidant capacity, tissue damage, and endurance of adult male rats. Int J Sports Med 18:497-502
12. Leeuwenburgh C, Hollander J, Leichtweis S, Fiebig R, Gore M, Ji LL (1997). Adaptations of glutathione antioxidant system to endurance training are tissue and muscle fiber specific. Am J Physiol 272: R363-R369
13. Alessio HM, Goldfarb AH, Cutler RG (1988). MDA content increases in fast- and slow-twitch skeletal muscle with intensity of exercise in a rat. Am J Physiol 255:C874-C877
14. Kayatekin BM, Gonenc S, Acikgoz O, Uysal N, Dayi A (2002). Effects of sprint exercise on oxidative stress in skeletal muscle and liver. Eur J Appl Physiol 87:141-144
15. Marzatico F, Pansarasa O, Bertorelli L, Somenzini L, Della Valle G (1997). Blood free radical antioxidant enzymes and lipid peroxides following long-distance and lactacidemic performances in highly trained aerobic and sprint athletes. J Sports Med Phys Fitness 37:235-239
16. Ramel A, Wagner K, Elmadfa I (2004). Plasma antioxidants and lipid oxidation after submaximal resistance exercise in men. Eur J Nutr 43(1):2-6
17. Atalay M, Seene T, Hanninen O, Sen CK (1996). Skeletal muscle and heart antioxidant defenses in response to sprint training. Acta Physiol Scanda 158:129-134
18. Ramos KS, Chacon E, Acosta D (1996). Toxic responses of the heart and vascular systems. In: Klaasen CD, editor. Casarett and Doulls Toxicology: The Basic Science of Poisons. New York: McGraw-Hill, 492-493
19. Griffith OW (1999). Biologic and pharmacologic regulation of mammalian glutathione synthesis. Free Radic Biol Med 27:922-935
20. Meister A (1983). Selective modification of glutathione metabolism. Science 220: 472-477
21. Schultz GE, Schirmer RH, Sachsenheimer W, Pai EF (1978). The structure of the flavoenzyme glutathione reductase. Nature 273:120-124
22. Hagen TM, Aw TY, Jones DP (1988). Glutathione uptake and protection against oxidative injury in isolated kidney cells. Kidney Int 34:74-81
23. Jackson MJ (2000). Exercise and oxygen radical production by muscle. In: Sen CK, Packer L, Hanninen O, editors. Handbook of Oxidants and Antioxidants in Exercise. Amsterdam: Elsevier Science, 57-68
24. Smith JC, Hill DW (1991). Contribution of energy systems during a Wingate power test. Br J Sports Med 25(4):196-199
25. Nioka S, Moser D, Lech G, Evengelisti M, Verde T, Chance B, Kuno S (1998). Muscle deoxygenation in aerobic and anaerobic exercise. Adv Exp Med Biol 454:63-70
26. Remacle J, Lambert D, Raes M, Pigeolet E, Michiels C, Toussaint O (1992). Importance of various antioxidant enzymes for cell stability. Biochem J 286:41-46
27. Kretzschmar M, Muller D (1993). Aging, training, and exercise: a review of effects of plasma glutathione and lipid peroxidation. Sports Med 15:196-209
28. Lee H, Yin P, Lu C, Chi C, Wei Y (2000). Increase of mitochondria and mitochondrial DNA in response to oxidative stress in human cells. Biochem J 348:425-432
29. Lee H, Yin P, Chi C, Wei Y (2002). Increase in mitochondrial mass in human fibroblasts under oxidative stress and during replicative cell senescence. J Biomed Sci 9(6):517-526
30. Orr WC, Sohal RS (1994). Extension of life-span by overexpression of superoxide dismutase and catalase in Drosophila melanogaster. Science 263:1128-1139
31. Ames BN, Shigenaga MK, Hagen TM (1993). Oxidants, antioxidants, and degenerative diseases of aging. Proc Nat Acad Sci USA 90:7915-7922
32. McCance KL, Heuther SE (2002). Pathophysiology (4th edition). St. Louis: Mosby
33. Volicer L, Crino PB (1990). Involvement of free radicals in dementia of the Alzheimer type: a hypothesis. Neurobiol Aging 11:567-574
34. Leewenburgh CR, Fiebig R, Chandwaney R, Ji LL (1994). Aging and exercise training in skeletal muscle: response of glutathione and antioxidant enzyme systems. Am J Physiol 267:R439-R445
35. Burgomaster KA, Hughes SC, Heigenhauser GJF, Bradwell SN, Gibala MJ (2005). Six sessions of sprint interval training increases muscle oxidative potential and cycle endurance capacity in humans. J Appl Physiol 98:1985-1990