El Músculo Esquelético: ¿Amo o Esclavo del Sistema Cardiovascular?
Russel S Richardson1, Craig A Harms2, Bruno Grassi3 y Russell T Hepple3
1Department of Medicine, University of California, San Diego, La Jolla, CA.
2Department of Kinesiology, Kansas State University, Manhatten, KS.
3Instituto di Tecnologie Biomedicine Avanzatè, National, National Research Council, Milan, Italia.
Artículo publicado en el journal PubliCE, Volumen 0 del año 1999.
Publicado 5 de mayo de 2004
Resumen
Palabras clave: cinética de intercambio de gases, distribución del flujo sanguíneo, ácido láctico, PO2 intracelular,
Aunque se conocen numerosos sistemas fisiológicos y muchas interacciones durante el ejercicio, aún quizás la interacción más significativa se da entre el sistema cadiorrespiratorio y el músculo esquelético, los cuales determinan el aporte y la demanda de O2 (Figura 1). Al comienzo del ejercicio, la respuesta integrada de los sistemas pulmonar, cardiovascular, y muscular caracteriza la cinética del VO2 máx. Esta respuesta cinética es altamente sensible al entrenamiento aeróbico (31) y puede ser medida en la boca o a través de un músculo (10). Sin embargo, el rol que cada sistema juega para determinar la cinética del VO2 máx. continua siendo sujeto de considerable debate (4, 18). Más allá de este período transicional, nosotros nos enfrentamos a la cuestión de la distribución del flujo sanguíneo, el cual es la distribución apropiada de un gasto cardiaco finito entre órganos esenciales como el cerebro, corazón, e intestinos (48), y los músculos esqueléticos metabolicamente muy activos, implicados en el ejercicio (32). ¿Que área de demanda toma prioridad a medida que se incrementan los requerimientos metabólicos y que se llega cerca de los límites del gasto cardiaco (11)?. La introducción de modelos aislados de músculo esquelético (2, 51) ha aclarado esta cuestión de perfusión del músculo esquelético bajo condiciones de gasto cardiaco máximo versus una pequeña masa muscular donde los componentes centrales son menos puestos a prueba, permitiendo que sea alcanzado un mayor nivel de perfusión de músculo esquelético (41, 47). Adicionalmente, estos modelos de músculo esquelético han probado ser fructíferos en otra área de estudio que ha sido muy investigada: los determinantes de la tasa metabólica máxima (VO2 máx.), específicamente si el VO2 máx. es regulado por el aporte de O2 o por la demanda del mismo (35, 43). Finalmente, el estudio de la relación entre el sistema cardiovascular y el músculo esquelético puede constituir un enfoque poderoso para dilucidar la interacción entre estos dos sistemas. Puede ser experimentalmente demostrado que la conductancia de O2 máx. desde la sangre hasta la célula muscular juega un rol importante para determinar el VO2 máx. (37, 52), lo que es sugestivo de un rol pasivo jugado por el músculo mismo. Sin embargo, cuando es expuesto a un estímulo de ejercicio repetido, el músculo esquelético toma entonces un rol muy activo y demuestra una plasticidad remarcable (17) que afecta positivamente la capacidad de ejercicio (16). Así, ahora de nuevo la cuestión de quien es el amo y quien es el esclavo en la relación entre el sistema cardiovascular y el músculo esquelético está abierta a debate.
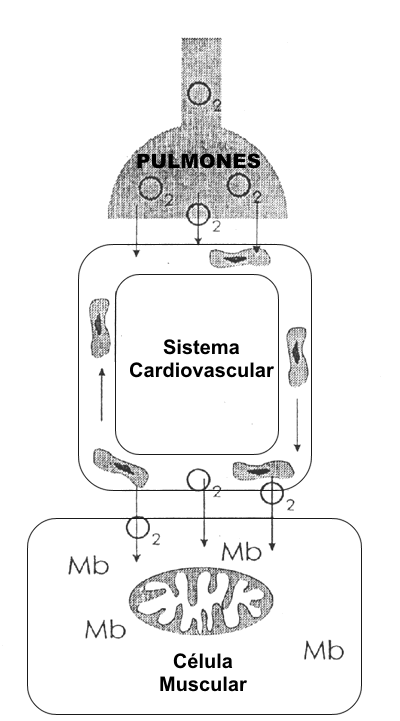
Figura 1. Interacción entre el sistema cardiorrespiratorio y el músculo
esquelético, los cuales determinan el aporte y demanda de O2.
Perfusión Muscular: ¿Determinada por la Demanda Muscular o por el Aporte Cardiovascular?
La mayor demanda para el gasto cardiaco durante el ejercicio viene dada por el músculo esquelético, ya que cerca del 85% de todo el flujo sanguíneo es direccionado a las piernas que trabajan durante la ergometría de ciclismo máxima (20, 32). Varias investigaciones han examinado como diferentes grupos de músculos esqueléticos compiten por el gasto cardiaco durante el ejercicio y si existe un fenómeno de “robo”. Aunque Secher et al. (50) observaron una disminución en el flujo sanguíneo a las piernas cuando fue adicionado un ejercicio de brazos a un ejercicio en un cicloergómetro con las piernas, investigaciones más recientes no han podido corroborar estos hallazgos (36, 44, 49). Sin embargo, la mayoría de los datos sugieren que ocurre algún grado de vasoconstricción en las piernas o un intento de vasoconstricción, que es determinado por la liberación de norepinefrina, cuando el ejercicio de brazos es adicionado al ejercicio de las piernas (44, 49). Recientemente, han sido conducidos una serie de experimentos para determinar si un grupo diferente de músculos esqueléticos, aquellos asociados con la respiración, influencian el gasto cardiaco y su distribución durante el ejercicio máximo (11-13, 56). Estos reportes han demostrado que los músculos respiratorios demandan una porción significativa del gasto cardiaco, principalmente a través del volumen de eyección y del VO2 total, aproximando 14-16 % del total (12). Adicionalmente fue mostrado que durante el ejercicio intenso, esta demanda metabólica de los músculos respiratorios afecta la distribución del gasto cardiaco entre los músculos respiratorios y las piernas de modo que la conductancia vascular de las piernas y el flujo sanguíneo se incrementan con las descarga de los músculos respiratorios y disminuye con la carga (11). El rendimiento durante el ejercicio puede también ser afectado por el trabajo de la respiración durante el ejercicio intenso, debido a la redistribución del flujo sanguíneo entre la pared del pecho y los músculos locomotores (56). De este modo, parece que, en contraste al ejercicio de los brazos versus el de las piernas, el trabajo de los músculos respiratorios, normalmente en contra durante el ejercicio máximo, influencia significativamente el gasto cardiaco y su distribución.
VO2 máx.: ¿Gobernado por el Aporte o la Demanda de Oxígeno?
Ha sido actualmente demostrado que un incremento en el transporte de O2 puede incrementar el VO2 máx. (1, 3, 5, 21, 30, 34, 38, 43, 55) lo cual sugiere que existe una limitación en el aporte de O2. Ya que el ejercicio del cuadriceps aislado del humano no alcanza los límites superiores del gasto cardiaco, este paradigma de ejercicio ha revelado previamente una reserva metabólica del músculo esquelético y resulta en el VO2 más alto específico para la masa muscular y tasas de trabajo registradas en el hombre (37, 41, 46). Esta observación es en si misma es evidencia de una limitación del aporte de O2 al VO2 máx. del músculo. En un estudio reciente de extensores de la rodilla en humanos, el VO2 máx. se incrementó con un transporte elevado de O2 (hiperoxia), demostrando que en condiciones normóxicas aún en el cuadriceps aislado altamente prefundido, el VO2 máx. del músculo no es limitado por la tasa metabólica de las mitocondrias, pero más bien por el aporte de O2 (35).
Aunque está claro que en muchas situaciones un incremento en el transporte de O2 puede incrementar el VO2 máx., también ha sido demostrado que este no es el único determinante; de hecho, la interacción entre los componentes convectivos y difusivos del transporte de O2 pueden finalmente establecer la tasa metabólica máxima (52). En el preparado de de gastrocnemio canino aislado, la infusión del modificador alostérico de hemoglobina RSR13 (Allos Therapeutics, Denver, CO) incrementó significativamente la P50, y a un transporte arterial de O2 constante, resultó en un incrementó en la extracción de O2 y un incremento consecuente en el VO2 máx. muscular (43). Esto indicó, en primera instancia, que el transporte de O2 del músculo gastrocnemio canino está normalmente limitado, aún cuando el animal esta respirando 100 % de O2. Además, el incremento del VO2 máx. fue proporcional al incremento de la PO2 venosa. Tomándolos juntos, estos hallazgos apoyan el concepto acerca de que la difusión del O2 entre las células rojas y las mitocondrias juega un rol en la determinación del VO2 máx.
Por largo tiempo ha existido la insinuación acerca de que la producción de lactato con el trabajo muscular progresivamente intenso es evidencia de una oxigenación intramuscular inadecuada (15). Ya que por las mismas, el término “umbral anaeróbico” ha sido usado para describir el punto en el cual el lactato comienza a acumularse en la sangre, pensándose que indica un transporte de O2 inadecuado para la demanda metabólica (54). La espectroscopia por resonancia magnética, utilizando mioglobina como una sonda endógena de la PO2 intracelular (29, 53), en combinación con el modelo de cuadriceps humano aislado (38) ha revelado que en condiciones de ejercicio hipóxicas y normóxicas, el flujo neto de lactato muscular es independiente de la PO2. El primero se incrementa mientras que el segundo (PO2) permanece constante durante el ejercicio progresivo incremental (39). Sin embargo, en la hipoxia, la PO2 es sistemáticamente disminuida en comparación con la normoxia, mientras que los cambios en el pH intracelular y el flujo de lactato están acelerados. Mientras que las últimas observaciones indican que no puede ser descartado un rol de la PO2 intracelular como moduladora del metabolismo, los niveles arteriales de epinefrina están relacionados de cerca al flujo de lactato muscular tanto en la normoxia como en la hipoxia y así pueden ser un estímulo principal para el incremento observado en el flujo de lactato muscular durante el ejercicio intenso y progresivo y para el flujo de lactato elevado en la hipoxia. Nosotros postularíamos que es la PO2 sistémica y no la intracelular la que incrementa la respuesta de las catecolaminas en la hipoxia y es de este modo responsable del correspondientemente alto flujo neto de lactato (39).
Recientemente, ha surgido evidencia que apoya la importancia de la PO2 intracelular en la determinación del VO2 máx. del músculo esquelético (38). Los estudios de la PO2 intracelular en el músculo esquelético entrenado con una variación de FIO2 sugieren que en la hiperoxia hay un aumento esperado en la PO2 intracelular (debido a un incremento en la PO2 media capilar), pero esta disponibilidad elevada de O2 esta entonces en exceso con respecto a la capacidad mitocondrial (40). Indicando que la PO2 intracelular es un determinante del VO2 máx. en cada FIO2 (12, 21, y 100 % de O2), pero en el último caso, el incremento en la PO2 intracelular resultó en una disminución del retorno con respecto a un incremento del VO2 máx. Estas observaciones son consistentes con el metabolismo celular que se está moviendo hacia una transición entre el aporte y la demanda de O2 como un determinante del VO2 máx. Parece que el incremento posterior en la PO2 intracelular, más allá de aquel registrado en la hiperoxia, pude tener menores efectos sobre el VO2 máx. hasta que sea alcanzada una meseta y el VO2 máx. no varíe con la PO2 intracelular. A partir de este punto, la PO2 intracelular pude no ser más un determinante del VO2 máx. del músculo esquelético. Esta relación hiperbólica, quizás frenada desde el origen, entre la tensión intracelular de O2 y la respiración celular es similar a los datos previamente presentados por Wilson et al. (57) en los cuales fue demostrado que la tasa metabólica de células de riñón aisladas eran dependientes del aporte de O2 debajo de cierta disponibilidad de O2. De nuevo, estos datos de PO2 asociados a la mioglobina encajan con la dependencia de transporte del VO2 máx. en el músculo esquelético humano entrenado sano (35, 37).
Cinética del VO2: ¿Establecida por el Flujo Sanguíneo o por el Metabolismo Muscular?
En el paso de transición desde el reposo hasta el ejercicio, o desde una carga de trabajo baja a una alta, la captación de O2 (VO2) se retrasa detrás del incremento de la producción de potencia, siguiendo un transcurso de tiempo llamado cinética del VO2. Los mecanismos que determinan esta respuesta cinética han sido materia de considerable debate entre aquellos que consideran a la misma principalmente relacionada a la tasa de ajuste del transporte de O2 a los músculos en ejercicio y aquellos que apoyan el concepto acerca de que la cinética del VO2 es principalmente establecida por una inercia del metabolismo oxidativo intramuscular. En años recientes, experimentos tanto en humanos en ejercicio (9, 10) como en preparados de músculo gastrocnemio de perro in situ aislado (7, 8) han proporcionado evidencia a favor de la hipótesis de “inercia metabólica”.
Específicamente, la transición desde el pedaleo sin carga hasta el pedaleo con carga (abajo del “umbral anaeróbico”) fue estudiada en humanos. El flujo sanguíneo a uno de los miembros en ejercicio fue determinado continuamente por una técnica de termodilución de infusión constante modificada, y el VO2 fue determinado en la pierna cada ≈ 5 s por medio del principio de Fick. El flujo sanguíneo a la pierna aumentó rápidamente con el cambio en la intensidad de trabajo, mientras que la diferencia de concentración arteriovenosa de O2 en el miembro no se incrementó durante los primeros 10-15 s de transición (10). Durante este tipo de transición metabólica, de este modo, la cinética de utilización de O2 se retrasó detrás de la cinética de transporte de volumen de oxígeno al músculo.
Las personas con transplante de corazón presentan una cinética del VO2 más lenta en comparación con los controles sanos. Esta cinética de VO2 más lenta puede ser atribuida a un ajuste más lento de la frecuencia cardiaca, gasto cardiaco y transporte de O2 a los músculos. En un grupo de pacientes con transplante de corazón la realización de un ejercicio “entrada en calor” antes de una transición desde el reposo hasta 50 W, resultó en un ajuste ligeramente más rápido del gasto cardiaco y condiciones más favorables tanto como el transporte de O2 a los músculos en ejercicio, pero no aceleró la cinética del VO2 (9). Nuevamente, esto fue indicativo de un retraso en la captación de O2 originado en el músculo en si mismo.
Por medio de la utilización de un preparado de gastrocnemio de perro in situ aislado, fue estudiada la transición metabólica desde el reposo hasta las contracciones tetánicas estimuladas eléctricamente correspondientes a ≈ 70 % del VO2 máx. (7). El retraso en el ajuste del transporte de O2 convectivo a los músculos fue completamente eliminado por medio de la perfusión del músculo con una bomba, en reposo y durante las contracciones, a un nivel constante de flujo sanguíneo, correspondiente a un valor en estado estable, obtenido durante las contracciones en las pruebas preliminares con el ajuste espontáneo del flujo sanguíneo muscular (perfusión muscular por la arteria femoral contralateral). Fue infundida adenosina intraarterialmente para prevenir cualquier vasoconstricción asociada con el flujo sanguíneo muscular elevado. La eliminación en el retraso en el transporte convectivo de O2 no afecto la cinética del VO2 muscular, la cual no fue diferente de aquella observada en las condiciones de control (7).
Finalmente, otro estudio fue conducido en el preparado de gastrocnemio de perro in situ aislado, durante la misma transición metabólica descrita arriba. La difusión periférica de O2 fue mejorada haciendo que los perros respiraran una mezcla de gases hiperóxica y por medio de la administración de RSR 13 (Allos Therapeutics), que desplaza hacia la derecha la curva de disociación de la hemoglobina. La PO2 capilar media (PcapO2) fue estimada por integración numérica. La respiración hiperóxica y la RSR 13 incrementaron significativamente la PcapO2 (i.e., la fuerza que conduce la difusión periférica de O2) en reposo y durante las contracciones, pero no afectaron la cinética del VO2 muscular (8). Tomados en consideración, los resultados de este estudio y los previos indicaron que, en este modelo experimental, ni el transporte de O2 convectivo ni difusivo a los músculos afecto la cinética de VO2 muscular, apoyando la hipótesis acerca de que este último es establecido por una inercia del metabolismo oxidativo muscular. Estas conclusiones coinciden con observaciones obtenidas por otros autores que investigaron en humanos durante transiciones graduales a cargas de trabajo menores que el “umbral anaeróbico” (6, 24). Debería ser destacado, sin embargo, que estos autores indicaron que durante las transiciones graduales a cargas de trabajo mayores al “umbral anaeróbico” la cinética de transporte de O2 a los músculos parece ser un factor crítico para determinar la cinética del VO2.
Plasticidad del Músculo Esquelético: ¿Adaptación Microcirculatoria a la Demanda Metabólica?
La cuestión de si el músculo esquelético es amo o esclavo del sistema cardiovascular depende del marco de referencia. Aunque las manipulaciones agudas el transporte de O2 convectivo claramente demuestran que el aporte de O2 establece el límite superior de la tasa respiratoria mitocondrial (42), las comparaciones entre especies (23) y el estudio de la adaptación a condiciones crónicas como el entrenamiento físico muestran que la capilarización (14, 19) y el desarrollo mitocondrial (28, 45) son componentes clave de la respuesta adaptativa en el VO2 máx. sistémico. Además, las adaptaciones en la capacidad estructural para el metabolismo aeróbico en el músculo esquelético son cuidadosamente reguladas (e.g., cuidadoso equilibrio del aporte capilar y el contenido mitocondrial) (26, 33) y son mantenidas en proporción a la capacidad aeróbica de todo el organismo (17).
El estudio de la variación adaptativa en la estructura del músculo esquelético dentro y entre especies ha revelado características de diseño que son uniformes por todos los músculos de una demanda metabólica muy variable. Una de estas características es que el tamaño de la superficie de contacto capilar-fibra, en vez de la distancia de difusión, está más cercanamente relacionado a la capacidad estructural para el flujo de O2 dentro de las fibras musculares (27). Estudios recientes también han mostrado que con la adaptación al entrenamiento (33), electroestimulación (26), e hipóxia crónica (25) el tamaño de la superficie de contacto capilar-fibra está equiparada al volumen mitocondrial/largo de la fibra. Estas observaciones sugieren que otra característica regulada de diseño en el músculo esquelético, está equiparando la capacidad de flujo de O2 a la demanda metabólica de las fibras (33).
Los cambios en la capilarización y en el contenido fibrilar de mitocondrias son partes importantes de la respuesta adaptativa al entrenamiento físico. En humanos ancianos, tanto el entrenamiento de fuerza de alta intensidad como el entrenamiento aeróbico incrementan el tamaño de la superficie de contacto capilar-fibra (14). Además, el cambio en el VO2 máx. está relacionado a los cambios en el tamaño de la superficie de contacto capilar-fibra en vez de a la densidad capilar, sugiriendo que un incremento en la capacidad estructural para el flujo de O2 es una característica importante de la adaptación en el VO2 máx. con ambos modos de entrenamiento en esta población (14).
Similarmente, la capacidad de la cadena de transporte de electrones mitocondrial (ETC) parece ser importante para el VO2 máx. muscular. El envenenamiento del complejo III (NADH-citocromo e reductasa) de la ETC resulta en una reducción en el O2 muscular pico (27) y reduce el VO2 muscular pico a los niveles pre-entrenamiento en el músculo del miembro trasero de ratas entrenadas (45). Es notable que esto ocurre aún cuando el metabolismo muscular, el flujo sanguíneo, y el transporte convectivo de O2 son marcadamente menores que durante el ejercicio máximo in vivo (22).
En conclusión, parece haber una paradoja entre el bien conocido incremento del VO2 máx. que ocurre con el incremento del transporte de O2 y las alteraciones proporcionales en el VO2 máx. que acompañan las manipulaciones en la capacidad oxidativa mitocondrial a un transporte de O2 submáximo y una demanda metabólica submáxima. Esto, junto con la observación acerca de que la adaptación en la capacidad estructural del músculo esquelético para el flujo de O2 (e.g., incremento de la capilarización y el contenido mitocondrial de fibras) ocurre como respuesta a las alteraciones en la demanda metabólica a través del entrenamiento físico y la hipóxia crónica, apoya un rol independiente del músculo esquelético en la determinación del VO2 máx. sistémico.
Conclusión
Esta claro que tanto a un nivel funcional y estructural la respuesta del sistema cardiovascular y el músculo esquelético están vinculadas de cerca. En este trabajo nosotros establecimos la cuestión acerca de cual de estos sistemas es dominante y cual está más sometido al otro. Aunque ofrecimos una idea acerca de esta cuestión, quizás la observación más sorprendente es que una sola respuesta no sería apropiada ya que el rol de cada sistema parece ser altamente dependiente de una multitud de factores que juntos crean el escenario de investigación. Un cambio en una de estas variables, por ejemplo, el ejercicio agudo que se vuelve crónico, va a alterar marcadamente la relación entre el sistema cardiovascular y el músculo esquelético y cambia la respuesta a la pregunta de control.
El apoyo económico para la realización del estudio fue proporcionado por NIH 17731, RR02305, y HL-15469, y el Dr. Richardson y el Dr. Harás fueron apoyados por Becas Parker Francis de Investigación Pulmonar.
Dirección para correspondencia
Russel S. Richardson, Ph.D, Department of Medicine, University of California, San Diego, La Jolla, CA 90293-0623. Correo electrónico: rrichardson@ucsd.edu
Referencias
1. ADAMS, R. P, and H. G. WELCH (1980). Oxigen uptake, acid base status, and performance with varied inspired oxygen fractions. J. Appl. Physiol. 49:863-868
2. ANDERSEN, P, and B. SALTIN (1985). Maximal perfusion of skeletal muscle in man. J. Physiol. 366:233-249
3. BARCLAY, J. K. and W. N. STAINSBY (1975). The role of blood flow in limiting maximal metabolic rate in muscle. Med. Sci. Sport. 7:116-119
4. CERRETELLI, P, D. W. RENNIE, and D. R. PENDERGAST (1980). Kinetics of metabolic transients during exercise. In: Exercise Bioenergetics and Gas Exchange, P. Cerretelli, and B. J. Whipp (Eds.). Amsterdam: Elsevier, pp. 187-209
5. DUAHAYLONGSOD, F. G, J. A. GRIEBEL, D. S. BACON, W. G. HOLFE and C. A. PIANTADOSI (1993). Effects of muscle contraction on cytochrome a, a3 redox state. J. Appl. Physiol. 75:790-797
6. GERBINO, A, S. A. WARD and B. J. WHIPP (1996). Effects of prior exercise on pulmonary gas exchange kinetics during high-intensity exercise in humans. J. Appl. Physiol. 80:99-107
7. GRASSI, B, L. B. GLADDEN, M. SAMAJA, C. M. STARY and M. C. HOGAN (1998). Faster adjustment of O2 delivery does not affect VO2 on kinetics in isolated in situ canine muscle. J. Appl. Physiol. 85
8. GRASSI, B, L. B. GLADDEN, C. M. STARY, P. D. WAGNER and M. C. HOGAN (1998). Peripheral O2 diffusiondoes not affect VO2 on-kinetics in isolated in situ canine muscle. J. Appl. Physiol. 85
9. GRASSI, B, C. MARCONI, M. MEYER, M. RIEU and P. CERRETELLI (1997). Gas exchange and cardiovascular kinetics upon different exercise protocols in heart transplant recipients. J. Appl. Physiol. 82:1952-1962
10. GRASSI, B, D. C. POOLE, R. S. RICHARDSON, D. R. KNIGHT, B. K. ERICKSON and P. D. WAGNER (1996). Muscle O2 uptake kinetics in humans: implications for metabolic control. J. Appl. Physiol. 80:988998
11. HARMS, C. A, M. A. BABCOCK, S. R. MCCLARAN, et al (1997). Respiratory muscle work compromises leg blood flow during maximal exercise. J. Appl. Physiol. 82:1573-1583
12. HARMS, C. A, M. A. BABCOCK, S. R. MCCLAREN, et al (1998). Effect of respiratory muscle work on cardiac output and its distribution during maximal exercise. J. Appl. Physiol. 85:609-618
13. HARMS, C. A, T. WETTER, C. ST. CROIX, D. F. PEGELOW and J. A. DEMPSEY (1998). Increased power output at VO2max with respiratory muscle unloading. Med. Sci. Sports. Exerc. 30:S41
14. HEPPLE, R. T, S. L. M. MACKINNON, J. M. GOODMAN, S. G. THOMAS, and M. J. PLYLEY (1997). Resistance and aerobic training in older men: effects on VO2 peak and the capillary supply to skeletal muscle. J. Appl. Physiol. 82:1305-1310
15. HILL, A. V, C. N. H. LONG and H. LUPTON (1924). Muscular exercise lactic acid and the supply and utilization of oxygen. Part IV: the oxygen debt at the end of exercise. Proc. R. Soc. (Lond.) Series B 97:127-137
16. HOPPELER, H, H. HOWALD, K. COLEY, et al (1985). Endurance training in humans: aerobic capacity and structure of skeletal elements. J. Exp. Biol. 115: 355-364
17. HOPPELER, H. and S. L. LINDSTEDT (1985). Melleability of skeletal muscle in overcoming limitations: structural elements. J. Exp. Biol. 115:355-364
18. HUGHSON, R. L, J. K. SHOEMAKER, M. E. TSCHAKOVSKY and J. M. KOWALCHUCK (1996). Dependence of muscle VO2 on blood flow dynamics at the onset of forearm exercise. J. Appl. Physiol. 81:1619-1626
19. INGJER, F (1996). Maximal aerobic power related to capillary supply in the quadriceps femoris muscle in man. Acta Physiol. Scand. 81:1619-1626
20. KNIGHT, D. R, D. C. POOLE, W. SCHAFFARTZIK, et al (1992). Relationship between body and leg VO2 during maximal cycle ergometry. J. Appl. Physiol. 73:1114-1121
21. KNIGHT, D. R, W. SCHAFFARTZIK, D. C. POOLE, M. C. HOGAN, D. E. BEBOUT and P. D. WAGNER (1993). Hyperoxia increases leg maximal oxygen uptake. J. Appl. Physiol. 75:2586-2594
22. LAUGHLIN, M. H and R. B. ARMSTRONG (1982). Muscular blood flow distribution patterns as a function of running speed in rats. Am J. Physiol. 243:H296-H306
23. LINDSTEDT, S. L, D. J. WELLS, J. H. JONES, H. HOPPELER and H. A. THRONSON, Jr (1988). Limitations to aerobic performance in mammals: interaction of structure and demand. Int. J. Sports Med. 9:210-217
24. MCDONALD, M, P. K. PEDERSEN and R. L. HUGHSON (1997). Acceleration of VO2 kinetics in heavy submaximal exercise in hyperoxia and prior high-intensity exercise. J. Appl. Physiol. 83:1381-1325
25. MATHIEU-COSTELLO, O, P. J. AGEY, L. WU, J. M. SZEWCZAK and R. E. MCMILLEN (1998). Increased fiber capillarization in flight muscle of finch at altitude. Respir. Physiol. 111:189-199
26. MATHIEU-COSTELLO, O, P. J. AGEY, L. WU, J. HANG and T. H. ADAIR (1996). Capillary-to-fiber surface ratio in rat fast-twitch hindlimb muscles after chronic electrical stimulation. J. Appl. Physiol. 80:904-909
27. MATHIEU-COSTELLO, O, R. K. SAUREZ and P. W. HOWCHACHKA (1992). Capillary-to-fiber geometry and mitochondrial density in hummingbird flight muscle. Respir. Physiol. 89:113-132
28. MCALLISTER, R. M. and R. L. TERJUNG (1990). Acute inhibition of respiratory capacity of muscle reduce peak oxygen consumption. Am. J. Physiol. 259:C889-C896
29. NOYSZEWSKI, E. A, E. L CHEN, R. REDDY, Z. WANG and J. S. LEIGH (1997). A simplified sequence for observing deoxymyoglobin signals in vivo: myoglobin excitation with dynamic unexcitation and saturation of water and fat. Magn. Reson. Med. 38:788-792
30. PELTONEN, J. E, J RANTAMAKI, S. P. NITTITYMAKI, K. SWEINS, J. T. VIITASALO and H. K. RUSKO (1995). Effects of oxygen fraction in inspired airo n rowing performance. Med. Sci. Sports. Exerc. 27:573-579
31. PHILLIPS, S. M, H. J. GREEN, M. J. MACDONALD and R. L. HUGHSON (1995). Progressive effect of endurance training on VO2 kinetcs at the onset of submaximal exercise. J. Appl. Physiol. 79:1914-1920
32. POOLE, D. C, G. A. GESSER, M. C. HOGAN, D. R. KNIGHT and P. D. WAGNER (1992). Pulmonary and leg VO2 during submaximal exercise: implications for muscular efficiency. J. Appl. Physiol. 72:805-810
33. POOLE, D. C, and O. MATHIEU-COSTELLO (1996). Relationship between fiber capillarization and mitochondrial volume density in control and trained rat soleus and plantaris muscle. Microcirculation 3:175-186
34. POWERS, S. K, J. LAWLWR, J. A. DEMPSEY, S. DODD and LANDRY (1989). Effects of incomplete pulmonary gas exchange on VO2max. J. Appl. Physiol. 66:2491-2495
35. RICHARDSON, R. S, B. GRASSI, T. P. GAVIN, L. J. HASELER, K. TAGORE, J. ROCA and P. D. WAGNER (1999). Evidence of supply dependent VO2max in the exercise-trained human quadriceps. J. Appl. Physiol. 86:1048-1053
36. RICHARDSON, R. S, B. KENNEDY, D. R. KNIGHT and P. D. WAGNER (1995). High muscle blood flows are not attenuated by recruitment of additional muscle mass. Am J. Physiol. 269:H1545-H1552
37. RICHARDSON, R. S, D. R. KNIGHT, D. C. POOLE, et al (1995). Determinants of maximal exercise VO2 during single leg knee extensor exercise in humans. Am. J. Physiol. 268: H1453-H1461
38. RICHARDSON, R. S, E. A. NOYSZESKI, K. F. KENDRICK, J. S. LEIGH and P. D. WAGNER (1995). Myoglobin O2 desaturation during exercise: evidence of limited O2 transport. J. Clin. Invest. 96: 1916-1926
39. RICHARDSON, R. S, E. A. NOYSZEWSKI, J. S. LEIGH and P. D. WAGNER (1998). Lactate efflux from exercising human skeletal muscle: role of intracellular PO2. J. Appl. Physiol. 85:627-634
40. RICHARDSON, R. S, E. A. NOYSZEWSKI, J. S. LEIGH, and P. D. WAGNER (1999). Cellular P O2 as a determinant of maximal mitochondrial O2 consumption in trained human skeletal muscle. J. Appl. Physiol. 87:325-331
41. RICHARDSON, R. S, D. C. POOLE, D. R. KNIGHT, et al (1993). High muscle blood flow in man: is maximal O2 extraction compromised?. J. Appl. Physiol. 75:1911-1916
42. RICHARDSON, R. S. and B. SALTIN (1998). Human muscle blood flow and metabolism studied in the isolated quadriceps muscle. Med. Sci. Sports. Exerc. 30:28-33
43. RICHARDSON, R. S, K. TAGORE, L. HASELER, M. JORDAN and P. D. WAGNER (1998). Increased VO2max with right shifted Hb O2 dissociation curve at a constant O2 delivery in dog muscle in situ. J. Appl. Physiol. 84:995-1002
44. RICHTER, E. A, B. KIENS, M. HARGREAVES and M. KAEJER (1992). Effect of arm cranking on leg blood flow and noradrenaline spillover during leg exercise in man. Acta Physiol. Scand. 144:9-14
45. ROBINSON, D. M, R. W. OGILIVIE, P. C. TULLSON and R. L. TERJUNG (1994). Increased peca oxygen consumption of trained muscle requires increased eletron flux capacity. J. Appl. Physiol. 77:1941-1952
46. ROWELL, L. B, B. SALTIN, B. KIENS and N. J. CHRISTENSEN (1986). Is peak quadriceps blood flow in humans even higher during exercise with hypoxemia?. Am. J. Physiol. 251:H1038-H1044
47. SALTIN, B (1985). Hemodynamic adaptions to exercise. Am. J. Cardiol. 55:42D-47D
48. SALTIN, B (1985). Hemodynamic adaptions to exercise. Am J. Cardiol. 55:42D-47D
49. SAVARD, G. K, E. A. RICHTER, S. STRANGE, B. KIENS, N. J. CHRISTENSEN, and B. SALTIN (1988). Norepinephrine spillover fromj skeletal muscle during exercise: role of muscle mass. Am. J. Physiol. 257:H1812-H1818
50. SECHER, N. H, J. P. CLAUSEN, K. KLAUSEN, I. NOER and J. TRAP-JENSEN (1977). Central and regional circulatory effects of adding arm exercise to leg exercise. Acta Physiol. Scand. 100:288-297
51. STAINSBY, W. N. and A. B. OTIS (1964). Blood Flow, blood oxygen tension, oxygen tension, oxygen uptake, and oxygen transport in skeletal muscle. Am. J. Physiol. 206:858-866
52. WAGNER, P. D (1992). Gas exchange and peripheral diffusion limitation. Med. Sci. Sports. Exerc. 24:54-58
53. WANG, Z, E. A. NOYSZEWSKI and J. S. LEIGH (1990). In vivo MRS measurement of deoxymyoglobin in human forearms. Magn. Reson. Med. 14:562-567
54. WASSERMAN, K. and M. B. MCILROY (1964). Detecting the Threshold of anaerobic metabolism in cardiac patients during exercise. Am. J. Cardiol. 14: 844-859
55. ELCH, H. G (1982). Hyperoxia and human performance: a brief review. Med. Sci. Sports. Exerc. 14:253-262
56. WETTER, T. J, C. A. HARMS, C. ST. CROIX, D. F. PEGLOW and J. A. DEMPSEY (1998). Effects of respiratory muscle loading and unloading on time to exhaustion during cycle ergometry. Med. Sci. Sports. Exerc. 30:S190
57. WILSON, D. F, M. ERECINSKA, C. DROWN and I. A. SILVER (1977). Effect of oxygen tension on cellular energetics. Am. J. Physiol. 233:C135-C140