El Polimorfismo K153R del Gen de la Miostatina como Gen Candidato en la Longevidad Extrema de Centenarias Españolas
MSTN K153R Polymorphism as Candidate Gene to Influence Extreme Longevity in Spanish Centenarian Women
Nuria Garatachea1,2, G. Rodríguez-Romo3, A. Santos-Lozano4, C. Santiago-Dorrego5, T. Yvert5, C. Fiuza-Luce2,5 y A. Lucia2,5
1Facultad de Ciencias de la Salud y del Deporte, Universidad de Zaragoza, Spain.
2Hospital Universitario 12 de Octubre, Research Institute (i+12), Madrid, Spain.
3INEF, Universidad Politécnica, Madrid, Spain.
4Department of Biomedical Science, University of León, León, Spain.
5Universidad Europea de Madrid, Spain.
Artículo publicado en el journal Kronos, Volumen 13, Número 2 del año 2014.
Publicado 30 de diciembre de 2014
Resumen
El gen de la miostatina (MSTN) es uno de los genes candidatos que podría influir en la longevidad extrema, debido a su papel en la modulación de masa muscular y sarcopenia, además de su papel en la inhibición de la principal vía de señalización de nutrientes relacionada con la longevidad, mTOR (del inglés, ‘mammalian target-of-rapamycin’). Comparamos la distribución alélica/genotípica de las variantes exónicas de la MSTN K153R (rs1805086), E164K (rs35781413), I225T y P198A, en centenarias (casos, n=132; rango edad: 100-107) y mujeres jóvenes (controles, n=167, < 50 años). La frecuencia de la variante alélica R y de los portadores de este la misma (genotipos KR o RR) fue significativamente superior en centenarias (6.8% y 12.1%) que en controles (1.5% y 3.8%) (p=0.0008 y p=0.0022 respectivamente). La razón de verosimilitud (‘odds ratio’, abreviado ‘OR’) de ser un centenaria si el sujeto tiene un alelo-R fue 4.47 (con un intervalo de confianza del 95% (CI): 1.59-12.54; p=0.004), comparado con el grupo control. Aunque son necesarias nuevas investigaciones, el alelo variante R del polimorfismo MSTN K153R podría ser uno de los contribuidores genéticos asociados con excepcional longevidad.
Palabras clave: genética, longevidad, sarcopenia
Abstract
Keywords: genetics, sarcopenia, longevity
INTRODUCCIÓN
El envejecimiento lleva inevitablemente asociados una serie de cambios en diferentes órganos y sistemas que determinan el nivel de capacidad física. La pérdida de masa muscular asociada con la edad está relacionada con una mayor riesgo de mortalidad (Metter, Talbot, Schrager, y Conwit, 2004); por tanto, los genes que están potencialmente asociados con el mantenimiento de la función muscular en la edad avanzada podría estar asociado no solo con el envejecimiento saludable sino también con un mejor riesgo de discapacidad, y también con una mayor longevidad. En este sentido, un gen candidato es la miostatina (MSTN o factor 8 de diferenciación del crecimiento, GDF8) (Huygens et al., 2004) .
La miostatina es un peptido secretado específicamente por el músculo esquelético que modula esencialmente la proliferación de mioblastos y por tanto la fuerza y la masa muscular (McPherron, Lawler, y Lee, 1997) . La pérdida o la inhibición de la miostatina resulta efectiva en la mejora de los síntomas de debilidad en varios modelos animales de daño muscular, atrofia y enfermedad (Lee y McPherron, 2001; Morrison et al., 2009; Murphy et al., 2010; Tsuchida, 2008; Wagner et al., 2008) . La inhibición de la miostatina, también puede tener consecuencias funcionales en humanos.
Los inhibidores de la miostatina, como el MYO-029, tienen un margen de seguridad adecuado y son capaces de mejorar las propiedades de fuerza muscular o la función contráctil muscular en algunos pacientes con distrofia muscular (Krivickas, Walsh, y Amato, 2009; Wagner et al., 2008) . De las variantes identificadas del gen de la MSTN en humanos, el polimorfismo Lys(K)153Arg(R) localizado en el exón 2 (rs1805086, sustitución 2379 A>G) podría ser un candidato que influyera en el fenotipo muscular (Ferrell et al., 1999) . En la reciente revisión de (Garatachea y Lucia, 2011) se identifica el polimorfismo MSTN K153R como un candidato para influir en los fenotipos musculares esqueléticos, incluso en las personas mayores.
Una de las más claras, y mejor estudiadas, mejoras en la longevidad es causada por la deprivación calórica y la regulación a la baja de la vía de señalización de ‘mTOR’ (del inglés, ‘mammalian target-of-rapamycin’). (Fontana, Partridge, y Longo, 2010; Kenyon, 2010) . La vía mTOR es una vía evolutivamente conservada de detección de nutrientes que ajusta el metabolismo y el crecimiento a la disponibilidad de aminoácidos, a factores de crecimiento, al estado de energía y al estrés (Fenton y Gout, 2011; Sengupta, Peterson, y Sabatini, 2010) . Algunos estudios han demostrado que la miostatina actúa como un regulador negativo de señalización directa de mTOR (Lipina, Kendall, McPherron, Taylor, y Hundal, 2010; Trendelenburg et al., 2009) , lo cual sugiere un posible papel de la inhibición de la miostatina en la longevidad. La supresión de la miostatina es de hecho beneficiosa para la densidad ósea, sensibilidad de insulina, y función cardíaca de ratones senescentes (Morissette et al., 2009) . La inhibición del receptor de la miostatina ActRIIB aumenta la supervivencia (el 17%) en ratones deficientes en miotubularina (Lawlor et al., 2011) . También una ampliación de la vida útil (+30%) fue observada después de terapia con folistatina (un antagonista natural de miostatina) en un modelo de ratón con atrofia muscular espinal (Rose, Mattis, Rindt, y Lorson, 2009) .
Gracias a los estudios de genotipado en centenarios se pueden identificar variantes genéticas asociadas con la longevidad (Martin, Bergman, y Barzilai, 2007) , ya que este grupo de población viven al menos 15-20 años más que la media en países industrializados.
El principal objetivo del estudio fue comparar las frecuencias alélicas y genotípicas del polimorfismo MSTN K153R entre centenarias (100-107 años) y mujeres jóvenes controles.
MÉTODO
El estudio ha sido desarrollado siguiendo las recomendaciones para los estudios de asociación genotipo-fenotipo publicada por el NCI-NHGRI Working Group on Replication in Association Studies (Chanock et al., 2007) .
Participantes
Cada participante firmó un consentimiento previo a la realización del estudio. El protocolo fue aprobado por el Comité Ético de nuestra institución y estuvo en concordancia con la Declaración de Helsinki para la Investigación con Humanos de 1974 (última modificación en el año 2008).
Todas las participantes eran caucasianas (españolas) y descendientes de al menos 3 generaciones de caucasianos. La mayoría (~90%) de ellas vivió la mayor parte de sus vidas y nacieron en las mismas áreas de España (Meseta Castellana, ~600m de altitud).
Jóvenes adultos (controles). Los criterios de inclusión de este grupo fueron (i) ser mujer, (ii) tener ≤50 años de edad, (iii) no poseer ninguna enfermedad diagnosticada y (iv) no tener conocimiento de antecedentes familiares de alta longevidad (90+ años). Finalmente participaron en el estudio 167 mujeres (edad media: 34,4 ± 7.8 años).
Centenarias (casos). Participaron en el estudio 144 centenarias (de una edad comprendida entre 100 y 107 años, edad media: 101.7 ± 1.8 años) que vivían en residencias de ancianos del área central de España (Meseta Castellana).
Genotipado
El genotipado se realizó exclusivamente para fines investigadores. Los investigadores encargados de realizar el genotipado desconocían la identidad de los sujetos ya que las muestras de saliva solamente tenían un código de barras cuya identidad únicamente conocía un investigador que no estaba implicado en el genotipado. En todos los participantes se extrajo DNA genómico de muestras de saliva. Utilizamos el protocolo clásico de extracción de DNA fenol-cloroformo con precipitación alcohólica. El DNA genómico fue resuspendido en 50µl milli-Q H2O y almacenado a -20ºC.
En todas las muestras (casos y controles), las secuencias correspondientes a las variantes E164K, I225T, K153R y P198A fueron amplificadas durante el 2013 por la reacción en cadena de la polimerasa (PCR) en el Laboratorio de Genética de la Universidad Europea de Madrid. Los primers utilizados fueron 5’-GAAAACCCAAATGTTGCTTC-3´ y 5´-TGTCTAGCTTATGAGCTTAGGG-3´. Las condiciones de la PCR fueron: desnaturalización inicial a 95ºC 10 minutos; 35 ciclos a 95ºC 1 minuto, 52ºC 45 s, 72ºC 1 minuto y una extensión final a 72ºC 5 minutos.
Los productos resultantes de la PCR fueron genotipados por la extensión de la base (Gonzalez-Freire et al., 2010). Los primers utilizados para E164K, I225T K153R, y P198A fueron 5´-CAAACACTGTTGTAGGAGTCT-3´, 5´-CTGAATCCAACTTAGGCA-3´, 5´-TTTAATACAATACAATAAAGTAGTAA-3´, y 5´-TTTTTTTTATCTCTGAAACTTGACATGAAC-3´ respectivamente. Las condiciones para la extensión de la base de la PCR fueron: 96ºC 10 s; 25 ciclos a 50ºC 5 s y 60ºC 30 s. Los productos resultantes de la PCR fueron detectados en ABI PRISM (Applied Biosystems, Foster City, CA).
Para asegurar un apropiado control interno, utilizamos un control positivo y negativo para cada análisis el cual fue previamente genotipado por medio del mismo método y de acuerdo a las recomendaciones para los estudiós de asociación genotipo-fenotipo (Chanock et al., 2007) . Todos los análisis los realizaron dos experimentados investigadores de forma independiente y desconociendo la identidad del sujeto de la muestra.
Análisis estadístico
El equilibrio Hardy-Weinberg se evaluó mediante el test chi-cuadrado (χ2). Se compararon las frecuencias genotípicas/alélicas entre los dos grupos (centenarias y controles) mediantes el χ2 test con un α de 0.05. Utilizamos la regresión logística binaria para analizar la relación entre genotipos/alelos y longevidad extrema. Todos los análisis estadísticos se realizaron con el paquete estadístico PASW (v. 18.0 for WINDOWS, Chicago), excepto la potencia estadística que fue calculada con el software StatMate, version 2.0 (GraphPad, San Diego, CA, USA).
RESULTADOS
No hubo errores en la recogida de muestras, en la adquisición de ADN o en el proceso de genotipado, excepto para 14 centenarias en las que el ADN necesario para la evaluación genotípica fue insuficiente.
Las distribuciones genotípicas del polimorfismo MSTN K153R estaban en equilibrio Hardy-Weinberg tanto en el grupo control (p=0.844) como en el grupo de centenarias (p=0.057). Las Figuras 1 y 2 muestran las frecuencias alélicas y genotípicas, respectivamente, del polimorfismo MSTN K153R en los dos grupos de estudio. La frecuencia del alelo variante R y de portadores del alelo-R (genotipos RR o KR) fue significativamente más alta en centenarias (6.8% y 12.1%) que en controles (1.5% y 3.8%), p=0.0008 y p=0.0022 respectivamente
La OR de ser centenaria si el sujeto tenía al menos un alelo-R fue de 4.47 (intervalo de confianza al 95% (CI): 1.59–12.54, p=0.004), comparado con el grupo control.
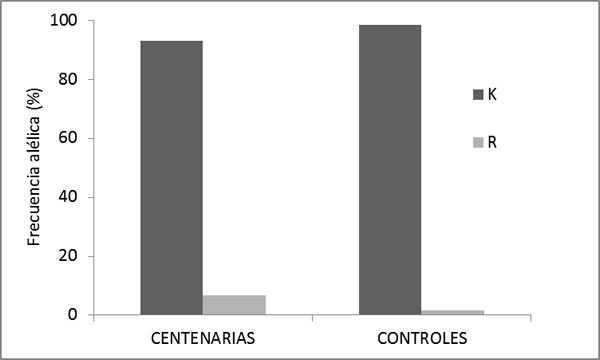
Figura 1. Frecuencias alélicas (%) del polimorfismo MSTN K153R en grupo de centenarias y controles.
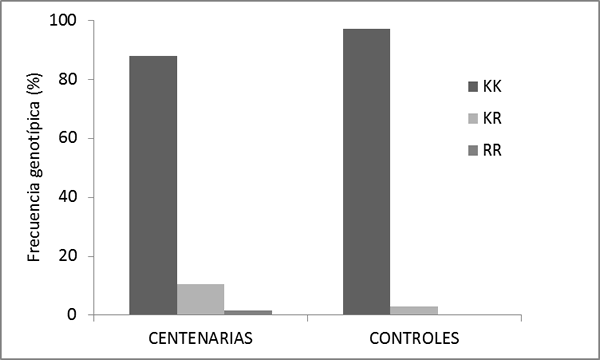
Figura 2. Frecuencias genotípicas (%) del polimorfismo MSTN K153R en grupo de centenarias y controles.
DISCUSIÓN
Nuestro principal hallazgo fue que la variante del alelo del polimorfismo MSTN K153R está asociado con una longevidad excepcional en la cohorte española estudiada, con una proporción significativamente más alta de este alelo en el grupo de centenarias (casos) comparada con sus controles. A pesar de la complejidad del proceso de envejecimiento y del hecho de que una longevidad excepcional es probablemente un rasgo poligénico con numerosos genes ejerciendo un efecto acumulativo o una interacción compleja, algunas mutaciones genéticas (como podría ser la que estudiamos aquí) puede ser suficientes per se para retrasar la aparición de fenotipos relacionados con la edad en multitud de organismos (Bjedov y Partridge, 2011). Hay una razón fundamental para sugerir que la inhibición de la miostatina, o alternativamente mutaciones en el gen MSTN afecten a su producto genético, pudiendo contribuir en una longevidad excepcional. Aunque son necesarias más investigaciones, los potenciales efectos biológicos de la variación K153R, como por ejemplo en los fenotipos musculares, pueden ser debidos a la potencial alteración que causa en el gen MSTN (Ferrell et al., 1999) . De hecho, la sustitución de aminoácido Lys(K)153Arg(R) afecta al péptido activo maduro de la proteína miostatina, y podría influir procesando su propéptido o en su afinidad para unirse con el supuesto receptor endógeno de la miostatina, ActRIIB (Jiang et al., 2004; Lee et al., 2005) .
En efecto, la miostatina es un péptido secretado específicamente en el musculo esquelético que esencialmente modula la proliferación de mioblastos y por tanto la masa/fuerza muscular (McPherron et al., 1997) . Varios ensayos preclínicos utilizando la pérdida o inhibición de miostatina han demostrado su eficacia para mejorar los síntomas de debilidad en varios modelos de lesiones, atrofia y enfermedad en animales (Lee y McPherron, 2001; Morrison et al., 2009; Murphy et al., 2010; Tsuchida, 2008; Wagner et al., 2008) . En humanos, los inhibidores de miostatina, tales como el MYO-029, tienen un adecuado y seguro margen y son capaces de mejorar la función/masa muscular o las propiedades contráctiles musculares en algunos pacientes con distrofia muscular (Krivickas et al., 2009; Wagner et al., 2008) .
Variantes del gen MSTN se asocian con fenotipos de hipertrofia muscular en diferentes especies de mamíferos (McPherron et al., 1997; McPherron y Lee, 1997). La expresión de la miostatina podría contribuir a la pérdida de masa muscular, tal como se sugiere en estudios con modelos animales (ratones inmovilizados) (Carlson, Booth, y Gordon, 1999) y humanos, por ejemplo en personas infectadas con el virus VIH (Gonzalez-Cadavid et al., 1998) , pacientes terminales (Constantin, McCullough, Mahajan, y Greenhaff, 2011) o caquexia (Dasarathy, Dodig, Muc, Kalhan, y McCullough, 2004) . Un estudio mostró como la miostatina sérica aumenta con la edad, sugiriendo una asociación entre miostatina y sarcopenia asociada al envejecimiento (Yarasheski, Bhasin, Sinha-Hikim, Pak-Loduca, y Gonzalez-Cadavid, 2002). Sin embargo, otros trabajos mostraron que la expresión de la miostatina no incrementa (Kawada, Tachi, y Ishii, 2001), y que incluso puede disminuir (Baumann, Ibebunjo, Grasser, y Paralkar, 2003) en el envejecimiento inducido por sarcopenia en humanos y roedores, cuestionando así su participación en la pérdida de masa muscular durante el envejecimiento. De hecho, el alelo-R no se asocia necesariamente con una mejor masa/función muscular en personas mayores caucásicas (edades >80 años) (ver la revisión de (Garatachea y Lucia, 2011). Ser portador de un alelo-R no parece ejercer mayor influencia en los fenotipos musculares de nonagenarios (Gonzalez-Freire et al., 2010) mientras que, sorprendentemente, los únicos dos caucásicos mayores con genotipo RR reportados hasta la fecha (una mujer española de 96 años de edad y una persona italiana con una edad superior a 80 años) parecían tener menor fuerza muscular que sus coetáneos (Corsi, Ferrucci, Gozzini, Tanini, y Brandi, 2002; Gonzalez-Freire et al., 2010) . En todo caso, dada la baja frecuencia del alelo-R, se necesitan nuevas investigaciones con muestras más grandes de población para dilucidar claramente su influencia en el fenotipo muscular y la sarcopenia en personas de edad muy avanzada.
Creemos que otra buena razón que explicaría un cierto efecto beneficioso del alelo variante R en la longevidad se basa en el rol como inhibidor que la miostatina juega en la vía de señalización mTOR. De hecho, los dos factores que más parecen contribuir a la longevidad en humanos son la restricción calórica y la regulación a la baja de la vía se señalización mTOR (Fontana et al., 2010; Kenyon, 2010) . Varios estudios han demostrado que el efecto de la miostatina como regulador negativo de la vía de señalización mTOR es coherente con su efecto inhibitorio sobre la síntesis de proteínas (Lipina et al., 2010; Trendelenburg et al., 2009) , y más específicamente sobre la traducción proteica en el músculo esquelético (Trendelenburg et al., 2009) .
En resumen, la variante en el alelo-R del polimorfismo MSTN K153R fue significativamente más frecuente en centenarias que en el grupo control. Aunque son necesarios más trabajos de investigación, esta variación genética podría ser uno de los contribuyentes genéticos asociados con una longevidad excepcional. Curiosamente, esta variante, cuya importancia se puso de manifiesto sobre todo en el mundo del deporte, podría ser un candidato a explicar muchos fenotipos de salud y de longevidad, mostrando las potenciales implicaciones que la investigación en genética del deporte, pueden tener en el campo de la medicina y la salud.
APORTACIONES DIDÁCTICAS
El hecho de que la variante en el alelo-R del polimorfismo MSTN K153R sea significativamente más frecuente en centenarias que en el grupo control tiene importantes aportaciones didácticas. A pesar de las limitaciones propias de la investigación, el estudio puede utilizarse como ejemplo didáctico de cómo la genética, además de otros factores, puede influir sobre la longevidad humana. Además también sirve de ejemplo de como un gen como la miostatina tradicionalmente asociado a los deportes de fuerza-potencia también tiene importante efectos sobre la salud y longevidad.
AGRADECIMIENTOS
Financiado por la Cátedra Real Madrid (2012 04RM).
Referencias
1. Baumann, A. P., Ibebunjo, C., Grasser, W. A., & Paralkar, V. M. (2003). Myostatin expression in age and denervation-induced skeletal muscle atrophy. Journal of musculoskeletal & neuronal interactions, 3(1), 8-16.
2. Bjedov, I., & Partridge, L. (2011). A longer and healthier life with TOR down-regulation: genetics and drugs. Biochemical Society transactions, 39(2), 460-465. doi: 10.1042/BST0390460
3. Carlson, C. J., Booth, F. W., & Gordon, S. E. (1999). Skeletal muscle myostatin mRNA expression is fiber-type specific and increases during hindlimb unloading. The American journal of physiology, 277(2 Pt 2), R601-606.
4. Constantin, D., McCullough, J., Mahajan, R. P., & Greenhaff, P. L. (2011). Novel events in the molecular regulation of muscle mass in critically ill patients. The Journal of physiology, 589(Pt 15), 3883-3895. doi: 10.1113/jphysiol.2011.206193
5. Corsi, A. M., Ferrucci, L., Gozzini, A., Tanini, A., & Brandi, M. L. (2002). Myostatin polymorphisms and age-related sarcopenia in the Italian population. J Am Geriatr Soc, 50(8), 1463. doi: jgs50376 [pii]
6. Chanock, S. J., Manolio, T., Boehnke, M., Boerwinkle, E., Hunter, D. J., Thomas, G., . . . Collins, F. S. (2007). Replicating genotype-phenotype associations. Nature, 447(7145), 655-660. doi: 447655a [pii] 10.1038/447655a
7. Dasarathy, S., Dodig, M., Muc, S. M., Kalhan, S. C., & McCullough, A. J. (2004). Skeletal muscle atrophy is associated with an increased expression of myostatin and impaired satellite cell function in the portacaval anastamosis rat. American journal of physiology. Gastrointestinal and liver physiology, 287(6), G1124-1130. doi: 10.1152/ajpgi.00202.2004
8. Fenton, T. R., & Gout, I. T. (2011). Functions and regulation of the 70kDa ribosomal S6 kinases. The international journal of biochemistry & cell biology, 43(1), 47-59. doi: 10.1016/j.biocel.2010.09.018
9. Ferrell, R. E., Conte, V., Lawrence, E. C., Roth, S. M., Hagberg, J. M., & Hurley, B. F. (1999). Frequent sequence variation in the human myostatin (GDF8) gene as a marker for analysis of muscle-related phenotypes. Genomics, 62(2), 203-207. doi: 10.1006/geno.1999.5984 S0888-7543(99)95984-0 [pii]
10. Fontana, L., Partridge, L., & Longo, V. D. (2010). Extending healthy life span--from yeast to humans. Science, 328(5976), 321-326. doi: 10.1126/science.1172539
11. Garatachea, N., & Lucia, A. (2011). Genes and the ageing muscle: a review on genetic association studies. Age (Dordr). doi: 10.1007/s11357-011-9327-0
12. Gonzalez-Cadavid, N. F., Taylor, W. E., Yarasheski, K., Sinha-Hikim, I., Ma, K., Ezzat, S., Bhasin, S. (1998). Organization of the human myostatin gene and expression in healthy men and HIV-infected men with muscle wasting. Proceedings of the National Academy of Sciences of the United States of America, 95(25), 14938-14943.
13. Gonzalez-Freire, M., Rodriguez-Romo, G., Santiago, C., Bustamante-Ara, N., Yvert, T., Gomez-Gallego, F., . . . Lucia, A. (2010). The K153R variant in the myostatin gene and sarcopenia at the end of the human lifespan. Age (Dordr), 32(3), 405-409. doi: 10.1007/s11357-010-9139-7
14. Huygens, W., Thomis, M. A., Peeters, M. W., Aerssens, J., Janssen, R., Vlietinck, R. F., & Beunen, G. (2004). Linkage of myostatin pathway genes with knee strength in humans. Physiol Genomics, 17(3), 264-270. doi: 10.1152/physiolgenomics.00224.2003 00224.2003 [pii]
15. Jiang, M. S., Liang, L. F., Wang, S., Ratovitski, T., Holmstrom, J., Barker, C., & Stotish, R. (2004). Characterization and identification of the inhibitory domain of GDF-8 propeptide. Biochem Biophys Res Commun, 315(3), 525-531. doi: 10.1016/j.bbrc.2004.01.085 S0006291X04001391 [pii]
16. Kawada, S., Tachi, C., & Ishii, N. (2001). Content and localization of myostatin in mouse skeletal muscles during aging, mechanical unloading and reloading. Journal of muscle research and cell motility, 22(8), 627-633.
17. Kenyon, C. J. (2010). The genetics of ageing. Nature, 464(7288), 504-512. doi: 10.1038/nature08980
18. Krivickas, L. S., Walsh, R., & Amato, A. A. (2009). Single muscle fiber contractile properties in adults with muscular dystrophy treated with MYO-029. Muscle Nerve, 39(1), 3-9. doi: 10.1002/mus.21200
19. Lawlor, M. W., Read, B. P., Edelstein, R., Yang, N., Pierson, C. R., Stein, M. J., . . . Beggs, A. H. (2011). Inhibition of activin receptor type IIB increases strength and lifespan in myotubularin-deficient mice. The American journal of pathology, 178(2), 784-793. doi: 10.1016/j.ajpath.2010.10.035
20. Lee, S. J., & McPherron, A. C. (2001). Regulation of myostatin activity and muscle growth. Proc Natl Acad Sci U S A, 98(16), 9306-9311. doi: 10.1073/pnas.151270098 151270098 [pii]
21. Lee, S. J., Reed, L. A., Davies, M. V., Girgenrath, S., Goad, M. E., Tomkinson, K. N., . . . Wolfman, N. M. (2005). Regulation of muscle growth by multiple ligands signaling through activin type II receptors. Proceedings of the National Academy of Sciences of the United States of America, 102(50), 18117-18122. doi: 10.1073/pnas.0505996102
22. Lipina, C., Kendall, H., McPherron, A. C., Taylor, P. M., & Hundal, H. S. (2010). Mechanisms involved in the enhancement of mammalian target of rapamycin signalling and hypertrophy in skeletal muscle of myostatin-deficient mice. FEBS letters, 584(11), 2403-2408. doi: 10.1016/j.febslet.2010.04.039
23. Martin, G. M., Bergman, A., & Barzilai, N. (2007). Genetic determinants of human health span and life span: progress and new opportunities. PLoS genetics, 3(7), e125. doi: 10.1371/journal.pgen.0030125
24. McPherron, A. C., Lawler, A. M., & Lee, S. J. (1997). Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily member. Nature, 387(6628), 83-90. doi: 10.1038/387083a0
25. McPherron, A. C., & Lee, S. J. (1997). Double muscling in cattle due to mutations in the myostatin gene. Proc Natl Acad Sci U S A, 94(23), 12457-12461.
26. Metter, E. J., Talbot, L. A., Schrager, M., & Conwit, R. A. (2004). Arm-cranking muscle power and arm isometric muscle strength are independent predictors of all-cause mortality in men. Journal of applied physiology, 96(2), 814-821. doi: 10.1152/japplphysiol.00370.2003
27. Morissette, M. R., Stricker, J. C., Rosenberg, M. A., Buranasombati, C., Levitan, E. B., Mittleman, M. A., & Rosenzweig, A. (2009). Effects of myostatin deletion in aging mice. Aging cell, 8(5), 573-583. doi: 10.1111/j.1474-9726.2009.00508.x
28. Morrison, B. M., Lachey, J. L., Warsing, L. C., Ting, B. L., Pullen, A. E., Underwood, K. W., . . . Wagner, K. R. (2009). A soluble activin type IIB receptor improves function in a mouse model of amyotrophic lateral sclerosis. Experimental neurology, 217(2), 258-268. doi: 10.1016/j.expneurol.2009.02.017
29. Murphy, K. T., Ryall, J. G., Snell, S. M., Nair, L., Koopman, R., Krasney, P. A., . . . Lynch, G. S. (2010). Antibody-directed myostatin inhibition improves diaphragm pathology in young but not adult dystrophic mdx mice. The American journal of pathology, 176(5), 2425-2434. doi: 10.2353/ajpath.2010.090932
30. Rose, F. F., Jr., Mattis, V. B., Rindt, H., & Lorson, C. L. (2009). Delivery of recombinant follistatin lessens disease severity in a mouse model of spinal muscular atrophy. Human molecular genetics, 18(6), 997-1005. doi: 10.1093/hmg/ddn426
31. Sengupta, S., Peterson, T. R., & Sabatini, D. M. (2010). Regulation of the mTOR complex 1 pathway by nutrients, growth factors, and stress. Molecular cell, 40(2), 310-322. doi: 10.1016/j.molcel.2010.09.026
32. Trendelenburg, A. U., Meyer, A., Rohner, D., Boyle, J., Hatakeyama, S., & Glass, D. J. (2009). Myostatin reduces Akt/TORC1/p70S6K signaling, inhibiting myoblast differentiation and myotube size. American journal of physiology. Cell physiology, 296(6), C1258-1270. doi: 10.1152/ajpcell.00105.2009
33. Tsuchida, K. (2008). Myostatin inhibition by a follistatin-derived peptide ameliorates the pathophysiology of muscular dystrophy model mice. Acta myologica : myopathies and cardiomyopathies : official journal of the Mediterranean Society of Myology / edited by the Gaetano Conte Academy for the study of striated muscle diseases, 27, 14-18.
34. Wagner, K. R., Fleckenstein, J. L., Amato, A. A., Barohn, R. J., Bushby, K., Escolar, D. M., Mendell, J. R. (2008). A phase I/IItrial of MYO-029 in adult subjects with muscular dystrophy. Ann Neurol, 63(5), 561-571. doi: 10.1002/ana.21338
35. Yarasheski, K. E., Bhasin, S., Sinha-Hikim, I., Pak-Loduca, J., & Gonzalez-Cadavid, N. F. (2002). Serum myostatin-immunoreactive protein is increased in 60-92 year old women and men with muscle wasting. J Nutr Health Aging, 6(5), 343-348.