Estrategias Nutricionales y Función Inmunológica
Mark S Kovacs3, Thomas W Buford2, Stephen J Rossi1, Jim McMillan1 y Elizabeth Marshall4
1Health and Human Performance Laboratory, Georgia Southern University, Statesboro, Georgia.
2Aging and Geriatric Research, College of Medicine, University of Florida, Gainesville, Florida.
3Player Development, United States Tennis Association, Boca Raton, Florida.
4Nutritional Feats Nutrition Consulting, Statesboro, Georgia.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2010.
Publicado 17 de marzo de 2011
Resumen
Palabras clave: citoquinas, sobreentrenamiento, hormesis, URTI
INTRODUCCION
En el ámbito deportivo, tanto atletas como entrenadores se esfuerzan continuamente por encontrar los regímenes de acondicionamiento óptimos para asegurar el máximo rendimiento. Utilizando la teoría de sobrecarga progresiva, los entrenadores crean programas de entrenamiento para sobrecargar a los atletas con la esperanza de que la adaptación resulte en ganancias en la potencia aeróbica y anaeróbica. La sobrecarga progresiva utiliza la teoría de adaptación general de Selye (44), proporcionando la base del entrenamiento.
La identificación del estrés positivo y negativo es crucial para el éxito del programa de acondicionamiento, el primero mejora y el último disminuye las adaptaciones positivas del entrenamiento. Desafortunadamente, llegar hasta el límite continuamente durante el entrenamiento en un intento por lograr mayores ganancias puede dar como resultado una sobrecarga excesiva, a menudo conocida como síndrome de sobreentrenamiento (OTS). El OTS se produce durante períodos de entrenamiento intenso y promueve la fatiga y el estancamiento, tanto de manera fisiológica como psicológica (12, 47).
De diversas maneras, el efecto del ejercicio sobre el sistema inmunológico presenta efectos horméticos, que se han definido mediante una relación dosis-dependiente en la que una dosis baja de una sustancia es estimulante y una dosis alta es inhibitoria (16). Se ha reportado que el ejercicio moderado produce un entorno anti-inflamatorio y, por lo tanto, disminuye el riesgo de sufrir una infección (16, 35, 37, 41, 49). Por el contrario, el ejercicio intenso puede incrementar las respuestas inflamatorias y el riesgo de sufrir una infección (24, 36, 52). Nieman (23) ha descrito a esta relación como una curva en forma de “J”, en la que el riesgo de infección del tracto respiratorio superior (URTI) puede reducirse a un nivel por debajo del de una persona sedentaria, pero es muy probable que el riesgo aumente con el ejercicio excesivo de intensidad elevada (Figura 1). Si el ejercicio intenso continúa por un período extenso, un atleta puede desarrollar OTS, una designación clínica que puede dar como resultado alteraciones fisiológicas, psicológicas, bioquímicas e inmunológicas, incluyendo un cambio persistente en el humor, disminución del rendimiento y una mayor susceptibilidad a sufrir una infección (12, 47).
La respuesta del sistema inmunológico al ejercicio no puede examinarse de manera aislada. Diversos factores (Figura 2), incluyendo el estrés, las lesiones, la exposición al entorno y el estado nutricional, se han asociado a la depresión inmunológica (14). Un riesgo de lesión mayor como resultado de la depresión inmunológica puede ser al mismo tiempo un riesgo de entrenamiento reducido y rendimiento disminuido en la competencia. Debido a la importancia de una salud adecuada durante el entrenamiento y la competencia, puede resultar beneficioso que los atletas y los entrenadores tengan al menos un conocimiento superficial del sistema inmunológico y los desafíos que el sistema enfrenta durante el entrenamiento y la competencia. El objetivo de este artículo es analizar las posibles estrategias nutricionales a fin de prevenir la disfunción inmunológica y los síntomas del OTS.
LA FUNCION INMUNOLOGICA Y EL OTS
El sistema inmunológico humano es un sistema complejo que consiste de 2 subsistemas principales: las defensas innatas (también conocidas como de tipo no específico) y las defensas adaptativas (también conocidas como de tipo específico). El sistema inmunológico innato se refiere a aquellos procesos inmunológicos que están presentes en el nacimiento y no necesitan un mayor desarrollo ante el encuentro de una sustancia externa. La respuesta inflamatoria o “inflamación” es un componente clave para el adecuado funcionamiento de la inmunidad innata (3). Puede describirse a la inflamación como la acumulación de fluidos acompañada de hinchazón, enrojecimiento y dolor, producidos por células inmunológicas activadas como los macrófagos, las citoquinas, las quimioquinas y otras proteínas que tienen influencia sobre la respuesta inmunológica innata (54).
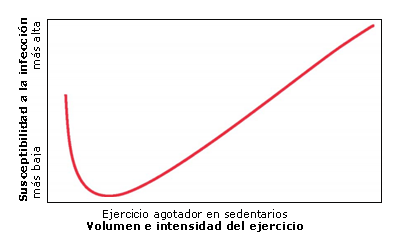
Figura 1. Curva en forma de ‘‘J’’ de inmunidad del ejercicio (adaptado de Nieman (23)).
El proceso inflamatorio con frecuencia se produce tras un ejercicio agotador, en especial del ejercicio que produce un daño muscular significativo. Por lo tanto, el sistema inmunológico y la inflamación están vinculados de manera intricada. Es importante que entrenadores y atletas comprendan este vínculo para organizar de manera sistemática el entrenamiento e implementar estrategias de recuperación exitosas para ayudar a mejorar el rendimiento y limitar la aparición de enfermedades y lesiones inducidas por el entrenamiento.
Al parecer existe un vínculo entre el sistema inmunológico, el cerebro y el músculo esquelético que si no se comprende y se monitorea adecuadamente, puede provocar una reducción del rendimiento, una posible depresión psicológica y una mayor susceptibilidad a la enfermedad. El vínculo puede estar en las citoquinas, dado que el OTS a menudo está acompañado por concentraciones incrementadas de citoquinas circulantes (45). Las citoquinas son moléculas de señalización que cumplen una función importante en la regulación de la respuesta inmunológica. Además de su función como mensajeros químicos en la función inmunológica, las citoquinas también cumplen una función en la homeostasis de la glucosa, el metabolismo de los lípidos y la función cerebral (35). Asimismo, las citoquinas están ligadas al daño muscular y, en parte, están reguladas por el estrés oxidativo. Se ha demostrado que las citoquinas, en especial la interleuquina (IL)-6, se producen no sólo en el tejido adiposo y el músculo esquelético (35), sino también en el tejido peri-tendinoso (19) y el cerebro (32).
Dado que las citoquinas pueden acceder al cerebro a través de varios caminos (35, 47), se ha propuesto que pueden ser capaces de producir disminuciones físicas, psicológicas e inmunológicas asociadas con el OTS (47). También es posible que las citoquinas sean horméticas por naturaleza. Quizás, algunos niveles de citoquinas pro-inflamatorias y anti-inflamatorias sean necesarios para la adecuada regeneración muscular después del ejercicio, no obstante los niveles muy elevados dan como resultado los síntomas del OTS.
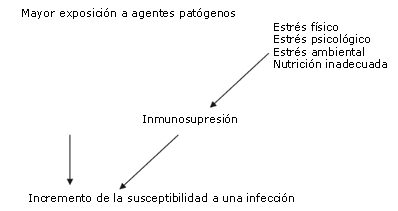
Figura 2. Factores que contribuyen a la incidencia de infección en los atletas (adaptado de Gleeson (14)).
En general, durante e inmediatamente después de un ejercicio agotador se liberan las citoquinas pro-inflamatorias, tales como el factor de necrosis tumoral alfa, la IL-1b, y la IL-6 “en respuesta a la inflamación” seguidas de las citoquinas reguladoras o anti-inflamatorias (e.g., IL-4, IL-10 y IL-1ra) (33). Normalmente, la homeostasis se mantiene mientras que los niveles de citoquinas pro-inflamatorias se compensen con el nivel de citoquinas anti-inflamatorias; sin embargo, si los niveles de citoquinas pro-inflamatorias son desmedidos, puede existir un riesgo de sufrir una infección posterior al ejercicio (33).
NUTRICION Y FUNCION INMUNOLOGICA
Las deficiencias nutricionales de ciertos macro- y micro-nutrientes pueden cumplir una función importante en la disfunción inmunológica de los atletas. Las deficiencias nutricionales a menudo se producen en los deportes en los que se cree que la masa corporal es un factor inhibitorio para el rendimiento, en deportes de resistencia exhaustivos u otras actividades que requieran muchas horas de entrenamiento por día. Los atletas deberían apuntar a mantener una hidratación adecuada y consumir una dieta balanceada que proporcione los nutrientes y la energía adecuados para incrementar el rendimiento y prevenir la disfunción inmunológica. El consumo inadecuado de macro-nutrientes puede tener un efecto prejudicial sobre la función inmunológica. La deficiencia proteica, por ejemplo, también puede tener efectos profundos sobre el sistema inmunológico funcionando en susceptibilidad a la infección (6).
Al encontrar una infección, la demanda de sustratos del cuerpo aumenta hasta dar cuenta de la mayor necesidad de sintetizar células y moléculas tales como los anticuerpos. No obstante, la información correspondiente a la suplementación con proteínas en los atletas sin deficiencias es limitada y no existen datos que sugieran que la proteína dietaria pueda actuar como un agente mejorador de la inmunidad en estos atletas. En estudios realizados en animales, la proteína en exceso (60% o mayor) puede afectar la función inmunológica óptima (4). Además de los efectos de la deficiencia proteica, el bajo consumo de proteína animal está asociado con niveles bajos de hierro, zinc y vitamina B12. Aunque es necesario para la función inmunológica óptima, el consumo excesivo de hierro y zinc de fuentes que no son alimentos tiene efectos negativos sobre el sistema inmunológico y sólo debería suplementarse bajo supervisión médica (4, 15).
CARBOHIDRATOS
Se han hecho esfuerzos exhaustivos para investigar la función de la nutrición sobre la depresión inmunológica. En la actualidad, la suplementación con carbohidratos (CHO) parece tener el mayor efecto sobre los indicadores de la inflamación, pero aún no se ha establecido una conexión directa con los índices de la infección. No obstante, un estudio ha sugerido que el uso de la suplementación con CHO antes, durante y después del ejercicio en los atletas de resistencia puede reducir el riesgo de infección, atenuando la reducción en los anticuerpos de la inmunoglobulina A salival (IgA) después del ejercicio intenso (28).
Al parecer los CHO mejoran muchos indicadores de la inflamación, la función inmunológica y el estrés oxidativo después del ejercicio. Principalmente, los estudios llevados a cabo han utilizado protocolos de entrenamiento de la resistencia. En estos se ha reportado que los CHO reducen la apoptosis de los linfocitos T (17), la leucocitosis (43), la ráfaga de actividad oxidativa de los neutrófilos y los monocitos (31) y el incremento de las citoquinas (18, 22, 26, 43, 48). Además, se ha reportado que la suplementación con CHO incrementa la concentración sanguínea de neutrófilos y monocitos (27). Por otra parte, en la literatura referente al entrenamiento con sobrecarga se ha reportado que la ingesta de CHO no ofrece protección respecto de la reducción en los niveles de IgA salival o el daño muscular provocado por 2 horas de entrenamiento con sobrecarga (20, 25) o 100 contracciones excéntricas de los cuádriceps (53). Es posible que la suplementación con CHO sea menos efectiva en el marco del entrenamiento con sobrecarga, dado que en general existe un menor grado de depleción del glucógeno que el observado durante el ejercicio aeróbico.
Se ha reportado que la disfunción inmunológica inducida por el ejercicio está principalmente relacionada con las hormonas del estrés, tales como el cortisol (13). Aunque se ha demostrado que los CHO atenúan el incremento del cortisol después del ejercicio (31, 43), se han reportado resultados contradictorios sobre si los niveles de cortisol están relacionados con las mejoras inmunológicas derivadas de los CHO (9, 17, 43). En este punto, la suplementación con CHO es aconsejable para la actividad aeróbica a fin de reducir los efectos inflamatorios del ejercicio y posiblemente disminuir el riesgo de una infección. Al parecer la suplementación con al menos una solución de CHO del 6% afecta de manera positiva la respuesta inflamatoria (31, 43) y es beneficiosa para la suplementación previa, durante y posterior al ejercicio para mantener el glucógeno muscular y los niveles de glucosa en sangre (9, 25, 31, 48). La ingesta de aproximadamente 4 mL/kg de una solución de CHO al 6% cada 15 minutos durante el ejercicio continuo de intensidad moderada parece ser un método válido para reducir la respuesta inflamatoria local posterior al ejercicio (31). En este momento, al parecer los CHO son la suplementación más efectiva para prevenir los compromisos inmunológicos.
GRASAS
En los últimos años, se han comenzado a investigar los efectos que los ácidos grasos pueden tener sobre la función inmunológica. Se ha determinado que el consumo de ácidos grasos poliinsaturados n-3 (PUFA), tales como el ácido icosapentaenoico (EPA) y el ácido docosahexaenoico (DHA), cumple una función importante en la función inmunológica óptima. El consumo adecuado del EPA y el DHA promueve la resolución de las respuestas inflamatorias en el cuerpo (7). Estos PUFA n-3 pueden disminuir la respuesta de la citoquina y la progesterona inflamatoria dentro del cuerpo (50). Es necesario que en el futuro se realicen investigaciones para determinar los efectos que el consumo de PUFA puede tener sobre el OTS.
ANTIOXIDANTES
La dificultad recae en analizar los efectos de la suplementación con antioxidantes en los atletas dado que se han utilizado innumerables combinaciones y dosis diferentes. Varios estudios han reportado resultados de suplementación con antioxidantes que no eran ni beneficiosas ni perjudiciales. Petersen et al. (38) reportaron que no hubo ningún efecto sobre los indicadores inflamatorios después de una agotadora carrera cuesta abajo tras 2 semanas de suplementación con 500 mg de vitamina C y 400 mg de vitamina E por día. Nieman et al. (30) y Palmer et al. (34) reportaron que la ingesta de 1,500 mg/día de vitamina C no actuó como contramedida para los incrementos de las citoquinas o la IgA salival.
Otras investigaciones han reportado un efecto beneficioso de la utilización de los suplementos antioxidantes. Phillips et al. (40) reportaron que una combinación de antioxidantes atenuó los incrementos en los indicadores de la inflamación. Además, Bryer y Goldfarb (5) reportaron que la suplementación con 3 g/día de vitamina C reducía el dolor muscular, el incremento de creatina quinasa y la oxidación de glutatión en sangre sin influenciar la pérdida de fuerza muscular después de 70 extensiones excéntricas de codo. Nieman et al. (29) reportaron que la suplementación con quercetina no alteró los indicadores inmunológicos medidos después de 3 días de ejercicio intenso, pero redujo de manera significativa las URTI. En este momento, no se recomienda ingerir grandes dosis de vitaminas dado que pueden actuar potencialmente de manera pro-inflamatoria para inducir a un mayor daño muscular y posiblemente bajar la función de las células inmunológicas. No obstante, dado que las deficiencias son perjudiciales, se recomienda que los atletas realicen una consulta con un nutricionista deportivo para determinar los niveles de antioxidantes no enzimáticos de su dieta y ajustar el consumo según corresponda. Se recomienda una dieta equilibrada que brinde amplios nutrientes antioxidantes al cuerpo.
Se han estudiado muchas otras suplementaciones con respecto a su efecto sobre el daño inmunológico, inflamatorio y muscular en respuesta al ejercicio. Las suplementaciones estudiadas incluyen al sulfato de dehidroepiandrosterona (39), la cafeína (51), los ácidos grasos n-3 (6), la N-acetil cisteína (24), la glutamina (8), la inmunoferona (10, 11), la L-cisteína (24) y el β-glucanode laavena (21). Hasta este momento, ninguna de ellas se ha estudiado de manera minuciosa para garantizar la suplementación, aunque algunas demuestran ser prometedoras. La inmunoferona es un compuesto polisacárido/proteico que es un inmuno-mejorador que puede adquirirse en el mercado. Se ha reportado que previene los incrementos de la respuesta de la creatina quinasa y la citoquina asociada con el ejercicio agotador (10, 11). Aunque se cree que es beneficiosa, se recomienda tener cautela hasta que una investigación futura defina los efectos de la reducción de la respuesta inflamatoria.
En conclusión, la nutrición adecuada es crucial para la correcta función inmunológica en los atletas, aunque hasta el momento, los suplementos recomendados que posiblemente mejoren esta función son limitados. En la actualidad, aún queda mucho por investigar con respecto a la función inmunológica de los atletas y las estrategias de nutrición apropiadas para prevenir la disfunción inmunológica y los síntomas del OTS.
APLICACIONES PRACTICAS
Las siguientes son recomendaciones generales para reducir al máximo los trastornos inmunológicos que pueden producirse con el ejercicio continuo de alta intensidad realizado durante el transcurso de una temporada competitiva.
- Concentrarse en mantener los niveles adecuados de hidratación, en especial durante los períodos de duro entrenamiento. Las mediciones simples del estado de hidratación incluyen la pérdida de peso corporal y el oscurecimiento del color de la orina después del ejercicio. Se recomienda que los atletas repongan cada libra de peso corporal perdido con 20-24 onzas de agua, y que el color de la orina sea amarillo claro (2, 46).
- Consumir las calorías diarias adecuadas para respaldar las exigencias energéticas del programa de entrenamiento en particular. La dieta debería consistir de una variedad de comidas, asegurándose de ingerir muchas frutas y verduras. Se pueden utilizar simples cálculos en base al género y el nivel de actividad para estimar las necesidades de energía (42).
- No siempre es mejor consumir más suplementos antioxidantes tales como vitaminas. La mejor manera de consumir vitaminas y minerales es dentro de la dieta. La suplementación individual con vitaminas y minerales debería hacerse bajo supervisión médica.
- Consumir las proteínas adecuadas. Los requerimientos diarios de proteínas sugeridos son en general de 1.2-2.0 g/kg del peso corporal para los atletas (1). La evidencia reciente sugiere que los atletas de fuerza/potencia consuman una mezcla de nutrientes después del entrenamiento de 2 partes de CHO y 1 parte de proteínas, los atletas de resistencia consuman una mezcla de 4:1 y los atletas de deportes de equipo, una mezcla de 3:1. La dosis de proteínas para esta mezcla debería ser de 0.25-0.50 g/kg del peso corporal. Esta mezcla de CHO-proteína después del entrenamiento debería consumirse cada 1-2 horas después del ejercicio durante 6 horas (55). Es posible que los vegetarianos, los atletas mayores y aquellos que transitan la pubertad necesiten una ingesta de proteínas un poco mayor.
- La ingesta de CHO debería ser de entre 6 y 10 g/kg de peso corporal por día, y se recomienda que aquellos atletas que participan regularmente en actividades muy intensas y de larga duración consuman una cantidad de CHO próxima a la recomendación de 10 g/kg. Sin embargo, la ingesta de CHO podría reducirse a 6 g/kg en aquellos atletas con menores necesidades totales de ingesta energética. Para aquellos atletas que consumen aproximadamente un 60% de su ingesta en forma de CHO, esta cantidad probablemente sea suficiente. Se recomienda el consumo de CHO antes del ejercicio en niveles tolerables para el sistema digestivo del atleta. En la actualidad, al parecer se puede suministrar una solución líquida de CHO del 6% cada 15 minutos durante la actividad de larga duración e intensidad moderada para ayudar a la recuperación y atenuar la respuesta inflamatoria local. La ingesta de CHO posterior al ejercicio debería realizarse rápidamente después del ejercicio para reducir la respuesta inflamatoria y aumentar al máximo la síntesis de glucógeno. Se ha demostrado que una ingesta de 1.5 g/kg del peso corporal de CHO inmediatamente después del ejercicio o 0.6-1.0 g/kg del peso corporal dentro de los primeros 30 minutos y otra vez cada 2 horas durante 6 horas aumenta al máximo la síntesis de glucógeno (1).
- Aproximadamente el 20-25% del consumo calórico total debería provenir de las grasas (1). Se recomienda el consumo de un mínimo de 2 porciones de pescado graso (8 oz) por semana. El salmón, la trucha, el mero, las sardinas, las anchoas y el arenque son buenas fuentes de PUFA n-3.
- En la actualidad, los suplementos no-macronutrientes, que muy probablemente ayudan al sistema inmunológico de un atleta, parecen ser los que derivan del grupo de los polifenólicos conocidos como flavonoides. Se ha demostrado que la quercetina, que se halla en alimentos tales como las manzanas y las cebollas, reducen la incidencia de las URTI. Los flavonoides hallados en el té y los productos de bayas también pueden ser beneficiosos.
- Otros productos muestran potencial, pero el mercado está saturado con productos que afirman mejorar la función del sistema inmunológico. Antes de hacer recomendaciones es necesario que se realicen más investigaciones sobre estos productos
Referencias
1. American College of Sports Medicine Position Stand (2009). Nutrition and athletic performance. Med Sci Sports Exerc 41: 709731
2. Armstrong LW, Maresh CM, Castellani JW, Bergeron MF, Kenefick RW, LaGasse KE, and Riebe D (1994). Urinary indices of hydration status. Int J Sport Nutr 4: 265279
3. Beg AA (2002). Endogenous ligands of toll-like receptors: Implications for regulating inflammatory and immune responses. Trends Immunol 23: 509512
4. Bishop NC, Blannin AK, Walsh NP, Robson PJ, and Gleeson M (1999). Nutritional aspects of immunosuppression in athletes. Sports Med 28: 151176
5. Bryer SC and Goldfarb AH (2006). Effect of high dose vitamin C supplementation on muscle soreness, damage, function, and oxidative stress to eccentric exercise. Int J Sport Nutr Exerc Metab 16: 270280
6. Calder PC (2006). Branched-chain amino acids and immunity. J Nutr 136: S288S293
7. Calder PC (2006). Polyunsaturated fatty acids, inflammation, and inflammatory diseases. Am J Clin Nutr 83: S1505S1519
8. Castell LM, Poortmans JR, Leclercq R, Brasseur M, Duchateau J, and Newsholme EA (1997). Some aspects of the acute phase response after a marathon race, and the effects of glutamine supplementation. Eur J Appl Physiol Occup Physiol 75: 4753
9. Chan MA, Koch AJ, Benedict SH, and Potteiger JA (2003). Influence of carbohydrate ingestion on cytokine responses following acute resistance exercise. Int J Sport Nutr Exerc Metab 13: 454465
10. Cordova A, Martin JF, Reyes E, and Alvarez-Mon M (2004). Protection against muscle damage in competitive sports players: The effect of the immunomodulator AM3. J Sports Sci 22: 827833
11. Cordova A, Monserrat J, Villa G, Reyes E, and Soto MA (2006). Effects of AM3 (inmunoferon) on increased serum concentrations of interleukin-6 and tumour necrosis factor receptors I and II in cyclists. J Sports Sci 24: 565573
12. Fry AC and Kraemer WJ (1997). Resistance exercise overtraining and overreaching. Neuroendocrine responses. Sports Med 23: 106129
13. Gleeson M (2006). Can nutrition limit exercise-induced immunodepression?. Nutr Rev 64: 119131
14. Gleeson M (2000). The scientific basis of practical strategies to maintain immunocompetence in elite athletes. Exerc Immunol Rev 6: 75101
15. Gleeson M, Lancaster GI, and Bishop NC (2001). Nutritional strategies to minimize exercise-induced immunosuppression in athletes. Can J Appl Physiol 26: S23S35
16. Gomez-Cabrera MC, Domenech E, Ji LL, and Vina J (2006). Exercise as an antioxidant: It up-regulates important enzymes for cell adaptations to exercise. Sci Sports 21: 8586, 89
17. Green KJ, Croaker SJ, and Rowbottom DG (2003). Carbohydrate supplementation and exercise-induced changes in T-lymphocyte function. J Appl Physiol 95: 12161223
18. Keller C, Keller P, Marshal S, and Pedersen BK (2003). IL-6 gene expression in human adipose tissue in response to exerciseeffect of carbohydrate ingestion. J Physiol 550: 927931
19. Langberg H, Bjorn C, Boushel R, Hellsten Y, and Kjaer M (2002). Exercise-induced increase in interstitial bradykinin and adenosine concentrations in skeletal muscle and peritendinous tissue in humans. J Physiol 542: 977983
20. McAnulty SR, McAnulty LS, Nieman DC, Morrow JD, Utter AC, and Dumke CL (2005). Effect of resistance exercise and carbohydrate ingestion on oxidative stress. Free Radic Res 39: 12191224
21. Murphy EA, Davis JM, Brown AS, Carmichael MD, Ghaffar A, and Mayer EP (2007). Oat beta-glucan effects on neutrophil respiratory burst activity following exercise. Med Sci Sports Exerc 39: 639644
22. Nehlsen-Cannarella SL, Fagoaga OR, Nieman DC, Henson DA, Butterworth DE, Schmitt RL, Bailey EM, Warren BJ, Utter A, and Davis JM (1997). Carbohydrate and the cytokine response to 2.5 h of running. J Appl Physiol 82: 16621667
23. Nieman DC (1994). Exercise, infection, and immunity. Int J Sports Med 15: S131S141
24. Nieman DC and Bishop NC (2006). Nutritional strategies to counter stress to the immune system in athletes, with special reference to football. J Sports Sci 24: 763772
25. Nieman DC, Davis JM, Brown VA, Henson DA, Dumke CL, Utter AC, Vinci DM, Downs MF, Smith JC, Carson J, Brown A, McAnulty SR, and McAnulty LS (2004). Influence of carbohydrate ingestion on immune changes after 2 h of intensive resistance training. J Appl Physiol 96: 12921298
26. Nieman DC, Davis JM, Henson DA, Walberg-Rankin J, Shute M, Dumke CL, Utter AC, Vinci DM, Carson JA, Brown A, Lee WJ, McAnulty SR, and McAnulty LS (2003). Carbohydrate ingestion influences skeletal muscle cytokine mRNA and plasma cytokine levels after a 3-h run. J Appl Physiol 94: 19171925
27. Nieman DC, Fagoaga OR, Butterworth DE, Warren BJ, Utter A, Davis JM, Henson DA, and Nehlsen-Cannarella SL (1997). Carbohydrate supplementation affects blood granulocyte and monocyte trafficking but not function after 2.5 h or running. Am J Clin Nutr 66: 153159
28. Nieman DC, Henson DA, Fagoaga OR, Utter AC, Vinci DM, Davis JM, and Nehlsen-Cannarella SL (2002). Change in salivary IgA following a competitive marathon race. Int J Sports Med 23: 6975
29. Nieman DC, Henson DA, Gross SJ, Jenkins DP, Davis JM, Murphy EA, Carmichael MD, Dumke CL, Utter AC, Mcanulty SR, Mcnaulty LS, and Mayer EP (2007). Quercetin reduces illness but not immune perturbations after intensive exercise. Med Sci Sports Exerc 39: 15611569
30. Nieman DC, Henson DA, McAnulty SR, McAnulty L, Swick NS, Utter AC, Vinci DM, Opiela SJ, and Morrow JD (2002). Influence of vitamin C supplementation on oxidative and immune changes after an ultramarathon. J Appl Physiol 92: 19701977
31. Nieman DC, Nehlsen-Cannarella SL, Fagoaga OR, Henson DA, Utter A, Davis JM, Williams F, and Butterworth DE (1998). Effects of mode and carbohydrate on the granulocyte and monocyte response to intensive, prolonged exercise. J Appl Physiol 84: 12521259
32. Nybo L, Nielsen B, Pedersen BK, Moller K, and Secher NH (2002). Interleukin-6 release from the human brain during prolonged exercise. J Physiol 542: 991995
33. Ostrowski K, Rohde T, Asp S, Schjerling P, and Pedersen BK (1999). Pro- and anti-inflammatory cytokine balance in strenuous exercise in humans. J Physiol 515: 287291
34. Palmer FM, Nieman DC, Henson DA, McAnulty SR, McAnulty L, Swick NS, Utter AC, Vinci DM, and Morrow JD (2003). Influence of vitamin C supplementation on oxidative and salivary IgA changes following an ultramarathon. Eur J Appl Physiol 89: 100107
35. Pedersen BK and Febbraio M (2005). Muscle-derived interleukin-6a possible link between skeletal muscle, adipose tissue, liver, and brain. Brain Behav Immun 19: 371376
36. Pedersen BK, Ostrowski K, Rohde T, and Bruunsgaard H (1998). The cytokine response to strenuous exercise. Can J Physiol Pharm 76: 505511
37. Petersen AM and Pedersen BK (2005). The anti-inflammatory effect of exercise. J Appl Physiol 98: 11541162
38. Petersen EW, Ostrowski K, Ibfelt T, Richelle M, Offord E, Halkjaer-Kristensen J, and Pedersen BK (2001). Effect of vitamin supplementation on cytokine response and on muscle damage after strenuous exercise. Am J Physiol 280: C1570 C1575
39. Phillips AC, Burns VE, and Lord JM (2007). Stress and exercise: Getting the balance right for aging immunity . Exerc Sport Sci Rev 35: 3539
40. Phillips T, Childs AC, Dreon DM, Phinney S, and Leeuwenburgh C (2003). A dietary supplement attenuates IL-6 and CRP after eccentric exercise in untrained males. Med Sci Sports Exerc 35: 20322037
41. Radak Z, Chung HY, and Goto S (2005). Exercise and hormesis: Oxidative stress-related adaptation for successful aging. Biogerontology 6: 7175
42. Reimers K (2008). Nutritional factors in health and performance. In: Essentials of Strength Training and Conditioning. Baechle TR and Earle RW, eds. Champaign, IL: Human Kinetics, pp. 223
43. Scharhag J, Meyer T, Auracher M, Gabriel HH, and Kindermann W (2006). Effects of graded carbohydrate supplementation on the immune response in cycling. Med Sci Sports Exerc 38: 286292
44. Selye H (1978). The Stress of Life. New York, NY: McGraw Hill
45. Shephard RJ (2002). Cytokine responses to physical activity, with particular reference to IL-6: Sources, actions, and clinical implications. Crit Rev Immunol 22: 165 182
46. Shirreffs SM, Taylor AJ, Leiper JB, and Maughan RJ (1996). Post-exercise rehydration in man: Effects of volume consumed and drink sodium content. Med Sci Sports Exerc 28: 12601271
47. Smith LL (2004). Tissue trauma: The underlying cause of overtraining syndrome?. J Strength Cond Res 18: 185193
48. Starkie RL, Arkinstall MJ, Koukoulas I, Hawley JA, and Febbraio MA (2001). Carbohydrate ingestion attenuates the increase in plasma interleukin-6, but not skeletal muscle interleukin-6 mRNA, during exercise in humans. J Physiol 533: 585591
49. Vassilakopoulos T, Karatza MH, Katsaounou P, Kollintza A, Zakynthinos S, and Roussos C (2003). Antioxidants attenuate the plasma cytokine response to exercise in humans. J Appl Physiol 94: 10251032
50. Venkatraman JT and Pendergast DR (2002). Effects of dietary intake on immune function in athletes. Sports Med 32: 323337
51. Walker GJ, Caudwell P, Dixon N, and Bishop NC (2006). The effect of caffeine ingestion on neutrophil oxidative burst responses following prolonged cycling. Int J Sport Nutr Exerc Metab 16: 2435
52. Wang JS and Huang YH (2005). Effects of exercise intensity on lymphocyte apoptosis induced by oxidative stress in men. Eur J Appl Physiol 95: 290297
53. Wojcik JR, Walber-Rankin J, Smith LL, and Gwazdauskas FC (2001). Comparison of carbohydrate and milk-based beverages on muscle damage and glycogen following exercise. Int J Sport Nutr Exerc Metab 11: 406419
54. Woods JA, Vieira VJ, and Keylock KT (2006). Exercise, inflammation, and innate immunity. Neurol Clin 24: 585599
55. Ziegenfuss TN, Landis A, and Lemieux RA (2010). Protein for sportsNew data and new recommendations. Strength Cond J 32: 6570