Fundamentos del Entrenamiento de la Fuerza para el Entrenador de Campo - Parte 3: ¿De qué Depende la Fuerza?
Juan José González Badillo
Artículo publicado en el journal PubliCE del año 2016.
Publicado 12 de agosto de 2016
Resumen
La capacidad de producir tensión y aplicar fuerza depende de una serie de factores, de los cuales incluimos algunos a continuación
- El número de puentes cruzados de miosina que pueden interactuar con los filamentos de actina (Goldspink,1992).
- El número de sarcómeras en paralelo.
- La tensión específica o fuerza que una fibra muscular puede ejercer por unidad de sección transversal (N·cm-2) (Semmler y Enoka, 2000).
- La longitud de la fibra y del músculo. La relación entre la longitud de la fibra y la longitud del músculo determinará que los músculos sean denominados como “músculos de fuerza” (menor relación longitud fibra/longitud músculo) o “músculos de velocidad” (mayor relación longitud fibra/ longitud músculo).
- Los elementos elásticos en serie y en paralelo. Los elementos elásticos harán más eficaz la fase concéntrica de una acción con previo estiramiento muscular.
- El tipo de fibra. Las fibras rápidas pueden generar mayor tensión en términos absolutos que las lentas, pero ambas son igualmente eficaces cuando la tensión se mide en relación con la sección transversal. En cambio, las fibras rápidas son más eficaces cuando se trata de desplazar cargas a alta velocidad.
- Los factores facilitadores (reflejo de estiramiento) e inhibidores (reflejo de tensión) de la activación muscular agonista.
- Ángulo articular con el que se genera la tensión muscular. El ángulo articular en el que se pretende aplicar la fuerza determina la elongación del músculo. Esto, a su vez, determina la tensión en los elementos elásticos, el número de puentes cruzados que se pueden formar y por ello la tensión muscular.
- El tipo de activación muscular. La activación excéntrica permite alcanzar una mayor tensión que en la isométrica y en ésta más que en la dinámica.
- La velocidad de acortamiento. Cuanto mayor sea la velocidad de acortamiento, menor será la tensión muscular.
- Tasa de inervación: número de fibras musculares inervadas por unidad motora (UM)
- Tipo de UM: UMs rápidas y poco resistentes a la fatiga (FF), las rápidas y resistentes (FR) y las lentas y resistentes (S)
- Reclutamiento: activación de una UM
- Sincronización: activación o reclutamiento de manera simultánea de mayor o menor número de unidades motoras
- Frecuencia de estímulo: número de impulsos nerviosos que llegan a la célula muscular por segundo. Se considera determinante en la producción de fuerza en la unidad de tiempo (RFD)
- Especificidad: propiedad de determinados ejercicios realizados con determinados volúmenes e intensidades que producen un efecto especialmente positivo sobre un rendimiento concreto
- Coordinación intermuscular: participación simultánea o consecutiva de distintos grupos musculares de forma que permitan alcanzar la aplicación de la fuerza más adecuada en una acción deportiva (acción técnica) concreta
- Relación entre masa muscular y efecto del entrenamiento
Añadimos algunas aclaraciones sobre algunos de estos factores
Algunas notas en relación con las unidades motoras y las fibras musculares
Las unidades motoras (UMs) rápidas y poco resistentes a la fatiga (FF) y las rápidas y resistentes (FR) alcanzan mayor tensión isométrica que las lentas y resistentes (S) por tener mayor tasa de inervación, fibras inervadas de mayor área y mayor tensión específica (Linari y col., 2004). Las UMs más rápidas (FF y FR) proporcionan la activación a mayor velocidad que las S, debido a que su axón, de mayor diámetro, y la unión neuromuscular están diseñados para liberar más neurotransmisores en respuesta a cada impulso nervioso.
Las fibras rápidas (IIa y IIx) permiten una mayor velocidad máxima de acortamiento muscular (Vmáx). La Vmáx hace referencia a la máxima velocidad de acortamiento de la fibra muscular en ausencia de carga u oposición al acortamiento. La Vmáx viene determinada por la tasa de formación de puentes cruzados, la cual está en relación con la tasa de hidrólisis de ATP, el desplazamiento producido por cada puente cruzado en una acción de acortamiento sarcomérico, la duración de la unión del puente de miosina con la actina y de la rapidez en la liberación del ADP durante el ciclo de formación de puentes cruzados (Nyitrai y col., 2006). Una ventaja añadida para las fibras de tipo II es que en la fase concéntrica de la curva fuerza-velocidad, la curvatura es menor que en las fibras tipo I. Por ello, las fibras rápidas son más apropiadas para el rendimiento en acciones rápidas de corta duración (altos valores absolutos de fuerza, velocidad y potencia). Sin embargo, las fibras de tipo I presentan mejores condiciones y características para los esfuerzos en los que se generan menores valores absolutos de fuerza, velocidad y potencia pero de mayor duración, debido a su mayor capacidad para el metabolismo aeróbico y para resistir a la fatiga (Schiaffino y Reggiani, 2011)
Si comparamos el comportamiento de las UMs lentas y rápidas en una acción concéntrica progresiva pero de moderada pendiente, se produce el reclutamiento en primer lugar las UMs lentas y a medida que aumenta la fuerza de contracción se van incorporando las más fuertes, grandes y rápidas. La frecuencia de estímulo será la correspondiente a cada tipo de fibra, aumentando ésta hasta alcanzar los valores máximos propios de cada UM de manera progresiva, y dichos valores de frecuencia son mayores para las fibras rápidas que para las lentas. Sin embargo, si se trata de una acción en la que se pretende alcanzar la máxima producción de fuerza en la unidad de tiempo (máxima pendiente, máxima RFD), las fibras lentas y rápidas se reclutan al mismo tiempo con sus máximas frecuencias de estímulo, que en ambos casos son superiores a las alcanzadas en una pendiente moderada. Estas frecuencias de estímulo descienden de manera inmediata después del pico máximo (Desmet y Godaux 1977).
El grado de participación de las fibras lentas y rápidas en determinadas acciones está condicionado por la velocidad de acortamiento muscular. En un movimiento de pedaleo, las fibras lentas, especialmente del sóleo, participan en gran medida cuando la cadencia es baja, mientras que a medida que aumenta la cadencia se reduce la activación de estas fibras y se incrementa la participación de las más rápidas, especialmente de los gemelos. Este intercambio de participación puede ser importante para alcanzar mayor rendimiento, pues a la mayor capacidad de generar fuerza y potencia (considerando la potencia como medida del rendimiento en el pedaleo) de las fibras rápidas a medida que aumenta la velocidad, se une la ventaja que puede suponer la mayor inhibición de las fibras lentas, lo cual favorece alcanzar una alta cadencia debido al menor freno en la activación (acortamiento) muscular producido por la baja tasa de relajación de la fibras lentas (Duchateau y col, 1986, Sargeant, 2007).
Almacenamiento de energía. Elasticidad
Los ejemplos más evidentes de la contribución de la energía elástica a la contracción muscular concéntrica son los observados en los movimientos de estiramiento-acortamiento o excéntrico-concéntrico, a veces llamado “pliométrico”, en los que una elongación del músculo mientras se activan las sarcómeras en un intento de evitar la elongación (contracción o activación excéntrica), consigue una gran tensión sobre los elementos elásticos en serie (tendones y titina principalmente), seguida tras un muy corto intervalo de tiempo por un acortamiento muscular (contracción concéntrica).
Kawakami y col. (2002) comprobaron que la fuerza generada por una misma unidad músculo-tendinosa es muy distinta si la flexión plantar va precedida de un estiramiento previo o contramovimiento de dorsiflexión del pie o no (figura 1).
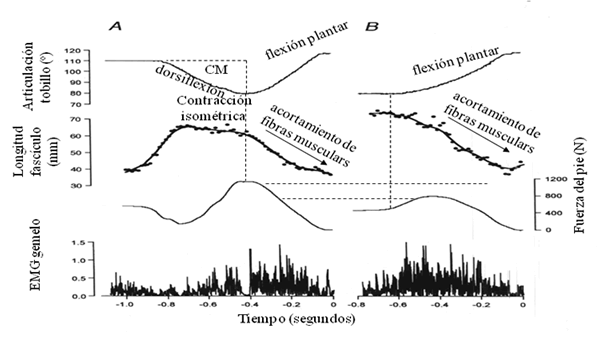
Figura 1. Aumento de la fuerza del pie en una flexión plantar con contramovimiento (A) con respecto a la acción sin contramovimiento (B). Ver texto para mayor aclaración (tomado de Kawakami y col., 2002)
En el proceso de acortamiento, el tendón devolverá una fuerza equivalente al producto de la elongación por la constante de elasticidad del tendón (F = -k·x, siendo x la distancia elongada y k la constante de elasticidad). Por tanto, cuando esta fuerza se devuelve rápidamente, la aplicación de fuerza es mayor durante la primera fase de contracción inmediata tras el contramovimiento previo, fase donde probablemente el aumento de la aceleración será mayor que en ninguna otra fase de la acción.
Longitud, grosor y ángulo de las fibras musculares
Las propiedades contráctiles básicas de un músculo están influidas, entre otros factores, por la manera en que están organizadas las fibras para formar el músculo. Si tuviéramos un músculo con tres fibras, éstas podrían disponerse en serie (una a continuación de otra) o en paralelo (una al lado de otra) o en un ángulo determinado en relación con la línea de tensión lineal del músculo. Si las fibras estuvieran en serie, serían mayores el rango de movimiento y la velocidad de acortamiento. Si se encontraran en paralelo, se alcanzaría la máxima fuerza que el músculo podría ejercer y sería menor la velocidad. Y si estuvieran organizadas formando un ángulo con la línea de tensión, la tensión neta que podría generar la fibra será menor (Enoka, 2002).
Cuando la proporción de fibras en serie es el doble que en paralelo, la velocidad máxima a la que se puede acortar el músculo es el doble y la tensión es la mitad que cuando la proporción es la contraria. Sin embargo, la potencia alcanzada por ambas configuraciones de músculos es la misma, pero el músculo con mayor proporción de fibras en serie la alcanza a mayor velocidad que el de mayor proporción de fibras en paralelo.
La orientación de las fibras respecto a los tendones y línea de tensión de fuerza creada en el músculo (línea entre ambos tendones unidos al músculo) es un aspecto a considerar a la hora de explicar la generación de tensión por el músculo. La distribución espacial de las fibras se organiza en el músculo formando ángulos de distinto tipo que tienen influencia en la tensión generada por el músculo. Las fibras se colocan formando ángulos menores de 90º, que, por lo general, van desde 0º a 45º respecto a la recta de tensión lineal del tendón.
Cuando las fibras musculares forman un ángulo con una supuesta línea recta que fuera de tendón a tendón, se les llama fibras penneadas y al ángulo que forman con la línea central, ángulo penneado o de penneación. Cuando el ángulo de penneación es cero, la fuerza neta ejercida por la fibra actúa en la dirección de la fuerza resultante del músculo. Si el ángulo de penneación no es cero, la fuerza neta que puede desarrollar la fibra en la dirección de la línea de tracción del músculo varía en función del coseno del ángulo de penneación, siendo siempre menor que si el ángulo fuera cero.
Para comprender la relación entre el ángulo, la tensión y la fuerza útil ejercida por una fibra, podemos imaginar una carretilla colocada en una vía de tren recta a través de la cual tenemos que desplazar la carretilla tirando de ella con una cuerda. Si tiramos de la carretilla en la misa dirección de la vía, es decir, con un ángulo cero con respecto a la dirección del desplazamiento, la fuerza o tensión que ejerzamos sobre la cuerda se transmitirá en la misma medida sobre la carretilla, por lo que toda la fuerza aplicada será fuerza útil. Si el ángulo con el que tiramos de la carretilla en relación con la dirección de la carretilla (línea de tensión) es muy pequeño, por ejemplo de 10º, cuyo coseno es 0,98, la fuerza útil será muy parecida a la fuerza o tensión ejercida sobre la cuerda, puesto que la fuerza que aplicamos a la cuerda habrá que multiplicarla por 0,98, y perderíamos sólo el 2% de la fuerza aplicada, pero si fuera de 30º, habría que multiplicar la fuerza aplicada a la cuerda por 0,87 (coseno de 30º), por lo que la fuerza útil ya se reduce en un 13%, y si fuera de 45º, la fuerza perdida sería el 30%, porque el coseno de 45º es 0,7. Por tanto, cuanto mayor es el ángulo de penneación, ante una misma tensión fibrilar, menor es la fuerza que contribuye al acortamiento muscular. El entrenamiento de fuerza que produce hipertrofia muscular tiende a aumentar el ángulo de penneación de los músculos entrenados. Un entrenamiento de 14 semanas con cargas pesadas de los miembros inferiores produjo un aumento del ángulo de penneación del vasto lateral de 8 a 10,7 grados (Aagaard y col, 2001).
El ángulo de penneación de la fibra hace que la relación entre la longitud de la fibra y la longitud del músculo sea diferente. Generalmente, cuanto mayor es el ángulo de penneación, menor es la longitud de la fibra comparada con la longitud del músculo. Cuando la relación o cociente entre la longitud de la fibra y el músculo es pequeña, al músculo se le denomina como “músculo de fuerza”, mientras que cuando es alta, se le denomina “músculo de velocidad”. Naturalmente, ambos tipos de músculos pueden generar fuerza y velocidad, pero la mayor eficacia de cada uno de ellos sobre fuerza o velocidad justifica su denominación. Este comportamiento en relación con la fuerza y la velocidad se explica porque los músculos con mayor ángulo de penneación son músculos de mayor número de fibras en paralelo y mayor sección transversal, y lo contrario ocurre cuando el ángulo de penneación es pequeño, en los que la proporción de fibras en serie es mayor y las fibras son más largas en relación con la longitud del músculo.
Aunque en párrafos anteriores hemos indicado que cuanto mayor es el ángulo de penneación menor es la eficacia de la fibra, dado que es necesario generar una mayor tensión fibrilar para conseguir el mismo efecto sobre la tensión que genera el músculo sobre el tendón, el mayor número de sarcómeras en paralelo o mayor sección transversal de este tipo de músculo compensa la menor eficacia por unidad de fibra y hace que el músculo pueda generar más fuerza en comparación con el que tiene una mayor proporción de fibras en serie.
Relación longitud-tensión
Cuando a un músculo esquelético se le distiende, sin que esté estimulado para provocar su acortamiento, se observa que la tensión crece de manera curvilínea, siguiendo una función exponencial creciente (figura 2). A esta curva se le llama la curva de tensión pasiva o inactiva. Si después de un incremento de longitud se provoca una activación máxima del sistema de filamentos contráctiles, se obtiene una tensión que es la máxima para esa longitud y equivale a la suma de las tensiones elásticas pasivas y contráctiles activas que se han generado en el músculo. De ahí que a la curva obtenida con estos valores se le denomine curva de tensión total (figura 2). Si para cada grado de longitud, a la tensión total le restamos la tensión pasiva, obtenemos una nueva curva que es la curva de tensión activa.
Siguiendo lo indicado en la figura 2, la tensión o fuerza estática (isométrica) activa generada por el músculo crece a medida que el músculo va aumentando su longitud hasta alcanzar un valor máximo, el cual se manifiesta en una zona intermedia de estiramiento. La mayor tensión generada se debe a que en este grado de estiramiento es en el que se puede formar un mayor número de puentes cruzados durante el proceso contráctil. Si el músculo sigue aumentando de longitud, la tensión disminuye, a pesar de que aumente la tensión pasiva hasta el máximo.
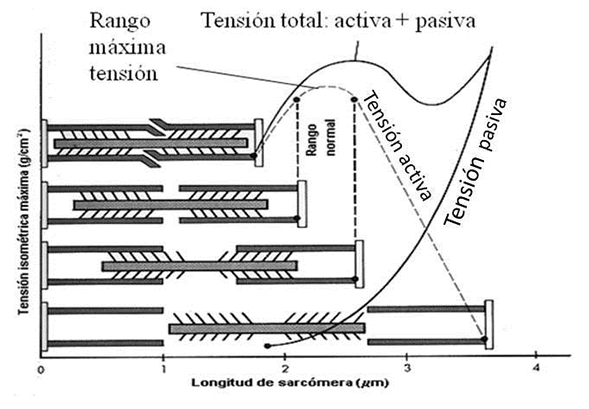
Figura 2. Relaciones entre distintas longitudes sarcoméricas y la fuerza o tensión isométrica ejercida por la fibra muscular. Obsérvese que el rango de máxima tensión en condiciones fisiológicas corresponde a un rango de elongación intermedio de la sarcómera, y aparece limitado entre las dos líneas discontinuas verticales.
Pero hay que distinguir entre tensión muscular y fuerza aplicada. Si consideramos lo que ocurre en el transcurso del desplazamiento de una carga, no suele coincidir el momento de mayor tensión con el momento de mayor fuerza aplicada. Así es que no se debe identificar ni confundir “máxima tensión” con “máxima fuerza aplicada”. La máxima tensión coincide con los momentos de menor velocidad (menor fuerza aplicada) dentro del recorrido, mientras que un aumento de la velocidad en una fase del recorrido es el indicador de que se está aplicando más fuerza, pero la tensión es menor.
Relación fuerza-velocidad-potencia
Como es conocido, esta relación es de tipo inverso en los músculos esqueléticos, es decir, cuanta más velocidad de acortamiento se le demande a un músculo, menos fuerza podrá ejercer (menor tensión y menor fuerza aplicada medias) y viceversa. La característica curva fuerza-velocidad, cuando se trata de un músculo completo, y con valores normalizados se presenta en la figura 3. Los valores están normalizados respecto a los máximos. La fuerza máxima isométrica y la velocidad absoluta se corresponden con los valores del 100%.
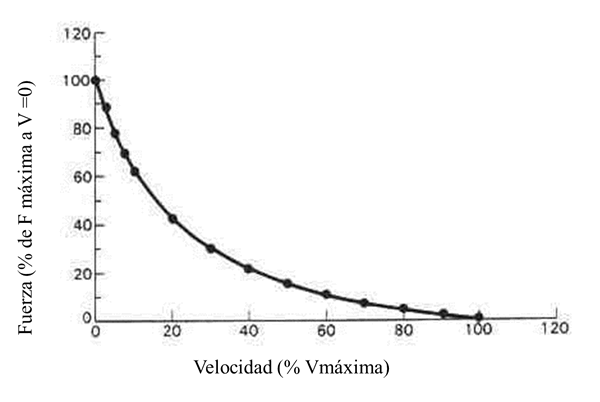
Figura 3. Curva fuerza-velocidad característica de un músculo completo. Los valores están normalizados respecto a los máximos. La fuerza máxima se refiere a la fuerza a velocidad cero, o sea, la fuerza isométrica máxima y la velocidad máxima a la velocidad absoluta (velocidad sin carga)
La menor capacidad de aplicación de fuerza cuando aumenta la velocidad parece ser debido a que con grandes velocidades de deslizamientos entre los miofilamentos disminuye el número de puentes cruzados disponibles (Edman, 1992). Por tanto, si disminuye la velocidad, aumentará la posibilidad de formar un mayor número de puentes cruzados activos en el sentido del acortamiento y, por ello, la posibilidad de generar mayor tensión y desplazar una carga mayor. Por el contrario, un aumento de la velocidad reducirá esta posibilidad.
Por tanto, a medida que se va reduciendo la necesidad de generar tensión o fuerza, el número de puentes cruzados que se forme deja de ser relevante para generar velocidad, de tal manera que cuando la carga es nula o se aproxima a cero, la velocidad de acortamiento no depende del número de puentes cruzados activos (figura 4).
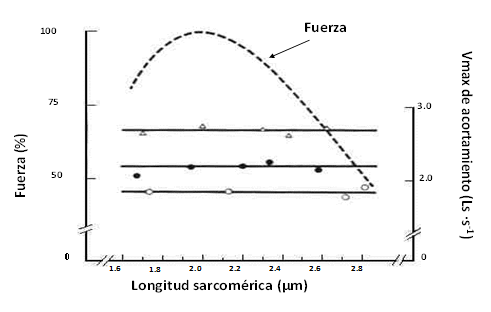
Figura 4. Relación entre la elongación sarcomérica (número de puentes cruzados activos) y la velocidad cuando la carga es nula (velocidad absoluta). La velocidad máxima (Vmax) de acortamiento no está relacionada con la elongación sarcomérica (tomado de Edman, 1992)
En la figura 4 se observa la conocida y ya comentada relación elongación muscular-tensión o fuerza (línea discontinua), pero lo relevante en esta figura es que cuando la carga a desplazar es nula, es decir, cuando se da la velocidad máxima absoluta, la velocidad de acortamiento de cada fibra es la misma (ordenada de la derecha) cualquiera que sea la elongación sarcomérica (abscisa). Por tanto, la velocidad máxima (velocidad máxima absoluta) de acortamiento no está relacionada con la elongación sarcomérica, es decir con el número de puentes cruzados que se pueden formar. Sin embargo, la velocidad de acortamiento sin carga está relacionada con la actividad de la ATPasa miofibrilar. Otros factores, como la sensibilidad al calcio de las troponinas, y el desplazamiento de las moléculas de tropomiosina, también pueden influir en la velocidad con que la actina reacciona con la miosina.
Aunque la fuerza por unidad de área de sección transversal de las fibras rápidas y lentas es aproximadamente la misma, la velocidad máxima de acortamiento es casi el doble en las fibras rápidas. Por tanto, para una velocidad de acortamiento dada ante una carga no máxima, la fuerza ejercida por las fibras rápidas será mayor, o dicho de otra forma equivalente: cuanto menor es la carga, más eficaz es la fibra rápida, ya que a medida que se reduce la carga, la fibra rápida permite alcanzar una mayor velocidad ante la misma carga (ver figura 5).
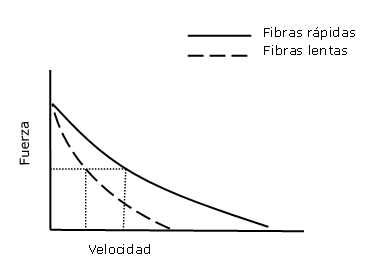
Figura 5. Relación esquemática de la curva fuerza-velocidad en contracciones concéntricas de fibras rápidas y lentas. La velocidad máxima de las fibras rápidas es aproximadamente el doble que la de las lentas (ver texto para mayor aclaración).
Al igual que ocurre con la velocidad, la potencia máxima que puede generar un deportista, al margen del tipo de entrenamiento que realice, está en relación directa con el porcentaje de fibras rápidas y lentas que posea. Si las fibras rápidas son capaces de proporcionar mayor velocidad ante la misma carga no máxima (ver figura 5), necesariamente van a generar mayor potencia con casi todas las cargas y especialmente generarán mayor potencia máxima. Por tanto, según todo lo indicado, las fibras rápidas y lentas son igualmente efectivas ante cargas muy elevadas y en acciones estáticas o isométricas máximas, pero las rápidas son mucho más efectivas para generar potencia. Pero no se debe perder de vista que alcanzar más potencia no es más que alcanzar más velocidad ante la misma carga, que es lo único que se debe pretender y se puede conseguir con el entrenamiento, con cualquier entrenamiento.
Hipertrofia
En relación con este factor determinante de la fuerza, debe tenerse en cuenta que en este momento lo tratamos como tal factor determinante, y no se entra en la discusión sobre cómo entrenar para alcanzar mayor hipertrofia ni cuáles son los procesos mecánicos, metabólicos o moleculares que están en la base del desarrollo muscular provocado por el entrenamiento físico.
Teóricamente, la fuerza máxima que puede producir una fibra de un músculo esquelético depende del número de sarcómeras dispuestas en paralelo. Por tanto, la máxima fuerza de un músculo dependerá del número de fibras dispuestas en paralelo entre sí. Esto se traduce en que la capacidad de un músculo para producir fuerza depende de su sección transversal (fisiológica), aunque no a mayor sección muscular corresponde necesariamente mayor fuerza, porque, aparte de los factores neurales implicados, otro factor que influye es la fuerza intrínseca del músculo, a la que se le denomina tensión específica. La tensión específica es expresada como la fuerza o tensión que una fibra muscular puede desarrollar por unidad de área de sección transversal (Semmler y Enoka, 2000). El valor de la tensión específica depende de la densidad de los filamentos de la fibra muscular y de la eficacia de la transmisión de la fuerza desde las sarcómeras al esqueleto (hueso). No obstante, la varianza de la fuerza muscular explicada por la masa muscular (sección transversal del músculo) difícilmente sobrepasa el 50%, a pesar de que a veces se incluyen, de manera errónea e inadecuada, a hombres y mujeres en el cálculo de estas correlaciones, alcanzando correlaciones de 0,75 que no son reales.
Por tanto, aunque el aumento de la masa muscular se puede considerar un elemento importante para el desarrollo de la fuerza, hay otros factores, fundamentalmente de tipo neural, que también contribuyen de manera notable a la mejora de la fuerza. Y también debería tenerse muy en cuenta que la hipertrofia es “un mal necesario” en el deporte de competición, ya que en la mayoría de los casos, el mejor rendimiento se obtiene si se mejora la fuerza sin aumentar el peso corporal, muy relacionado, en el mejor de los casos, con la hipertrofia muscular. Por tanto, la hipertrofia no debe ser un fin en sí mismo, sino una consecuencia del entrenamiento, pero que sólo estaría justificada y sería positiva si se traduce en mayor aplicación de fuerza ante cualquier carga y especialmente ante la carga de competición, y, además, sin provocar un aumento del déficit de fuerza.
Algunas evidencias sobre la probable participación de los factores neurales en la producción de fuerza
Los factores neurales que pueden influir en la mejora o la capacidad de aplicar fuerza son fundamentalmente los cambios en el reclutamiento de las unidades motoras (UM), en la frecuencia de estímulo y en la coordinación intermuscular, en la que podríamos incluir diversos procesos neurales, como la activación de los músculos agonistas, apropiada activación de los sinergistas e inhibición controlada de los antagonistas. Todos estos procesos tienen una consecuencia común que favorece la mejora de la utilización del potencial de fuerza del sujeto, lo que se podría traducir en la máxima u óptima activación muscular. Por eso se ha propuesto que quizás la adaptación neural más evidente que puede contribuir a la mejora de la fuerza sea el aumento de la activación muscular (Semmler y Enoka, 2000). La mayor activación de los agonistas se produce porque el entrenamiento permitirá el reclutamiento de las UM de mayor umbral (fibras rápidas), que tienen un mayor número de fibras por UM y permiten alcanzar mayor fuerza, y porque aumenta la frecuencia de estímulo de las UM (Sale, 1992). El aumento de la frecuencia de estímulo produce un aumento del pico de fuerza hasta llegar a la mínima frecuencia necesaria para alcanzar la fuerza máxima. A partir de este momento, si sigue aumentando la frecuencia de estímulo por encima de este umbral, no aumenta el pico de fuerza, pero sí mejora la RFD.
Cuando la mejora de la fuerza no puede ser explicada totalmente por el aumento de la masa muscular, se deduce que debe haber otro mecanismo responsable de la mejora de la fuerza, que sería de tipo neural. Unas mejoras en la fuerza del cuádriceps del 11 y del 15% después de entrenamiento excéntrico y concéntrico, respectivamente, se acompañaron de sólo un aumento aproximado del 5% de la sección transversal del músculo (Jones y Rutherford, 1987). La fuerza ganada en la fase inicial del ciclo de entrenamiento está asociada con un aumento de la amplitud de la señal en la electromiografía de superficie (SEMG), y se ha interpretado como dependiente del neural drive (impulso neural) (efecto eferente) (Gabriel y col., 2006). Aunque la síntesis de proteínas parece que se produce desde la primera sesión de entrenamiento (Phillips 2000), hasta las 6 semanas no se aprecian (por posibles problemas con la medida) aumentos de la masa muscular que justifiquen la mejora de la fuerza.
El efecto del entrenamiento se produce de manera prioritaria cuando se mide en las mismas condiciones en las que se ha entrenado. Esto quiere decir que utilizando la misma masa muscular, la mejora de la fuerza se manifiesta en mayor medida en el ejercicio y en el tipo de activación (concéntrica, excéntrica, isométrica o CEA) con los que se ha entrenado que en otros diferentes. En un estudio llevado a cabo por Wilson y col. (1996) en el que se entrenó la sentadilla durante 8 semanas, se observó una mejora (en kg) de la sentadilla del 20,9%, mientras que la fuerza en la extensión de rodillas medida isocinéticamente (N · m) a 60º · s-1 se redujo un 6%, y a 270º · s-1 mejoró sólo el 4%. La correlación entre los cambios en la sentadilla y en las dos medidas isocinéticas fue nula (-0,05), sin embargo la correlación con el salto vertical fue de 0,68 (p< 0,05). Por tanto, el tipo de activación muscular y el gesto en el cual se pretende obtener el resultado parecen determinantes en la elección de los ejercicios de entrenamiento. Se sugiere que estas discrepancias en los resultados se deben a los cambios producidos en el sistema nervioso central, lo cual refleja la importancia que tiene el sistema nervioso para expresar la fuerza muscular voluntaria.
Dentro del fenómeno de la especificidad y la coordinación intermuscular se incluye el factor de la coactivación de los músculos antagonistas. La coactivación tiene efectos positivos como el aumento de la estabilidad articular y la rigidez, y cambia en función de la intensidad y tipo de activación muscular, la velocidad de acortamiento muscular, la fatiga y el nivel de entrenamiento. Pero una coactivación excesiva o inadecuada de los músculos antagonistas podría producir una disminución de la fuerza aplicada a través de los músculos agonistas. Por ejemplo, Baratta y col. (1988) observaron que el entrenamiento específico de los flexores de rodillas produce un aumento de la activación de estos músculos cuando se trata de extender las rodillas. Por tanto, el entrenamiento de músculos aislados puede tener interferencia con el rendimiento, que siempre requiere la óptima activación de músculos antagonistas, agonistas y sinergistas.
Una de las adaptaciones que evidencian que el entrenamiento de fuerza se acompaña de efectos neurales es el hecho de que un entrenamiento unilateral de un miembro tenga efecto sobre el miembro no entrenado. Este fenómeno es denominado “efecto cruzado”, “efecto contralateral”, “transferencia contralateral” o “cross education”. Así, cuando se entrena un miembro, también mejora la fuerza en el miembro opuesto no entrenado. Si este miembro no se ha entrenado y, además, no se observa hipertrofia en el mismo ni cambios en la actividad enzimática, pero sí un aumento de la actividad muscular medida a través del SEMG, significa que ha habido un aumento del impulso nervioso (efecto neural). Por tanto, el cambio producido en la fuerza de dicho miembro debe ser por una adaptación neural (Shima y col., 2002).
La fuerza aplicada por los dos miembros de manera simultánea sobre una resistencia es inferior que la suma de la fuerza aplicada por ambos miembros por separado, especialmente en acciones de máxima velocidad. A la diferencia entre ambos valores se le denomina déficit bilateral. Este déficit podría considerarse un aspecto “negativo” de los factores neurales, porque se manifiesta como una reducción de la capacidad de la activación muscular. El déficit ha sido atribuido a una inhibición interhemisférica o contralateral, que contribuye a una reducción del impulso nervioso (Van Diee y col., 2003). En este estudio se comprobó, por ejemplo, que la magnitud de la fuerza desarrollada en la unidad de tiempo en la extensión bilateral de las rodillas fue un 13% inferior que en la extensión unilateral (p = 0,002). Estos resultados sugieren que el déficit de producción de fuerza bilateral es suficientemente grande como para constituir un importante factor limitante en el rendimiento. El hecho de que con la práctica específica de acciones bilaterales se reduzca el déficit, es un indicador del efecto neural del entrenamiento.
Se ha observado que si después de un entrenamiento mejora la fuerza, para desplazar la misma carga después del entrenamiento se utiliza una masa muscular menor (Ploutz, 1994). En este estudio se observó que no hubo hipertrofia de las diferentes fibras musculares en la pierna que no se entrenó (control), por lo que el efecto se puede considerar claramente neural en dos sentidos, por la reducción de la masa muscular necesaria y por el efecto colateral, lo cual se atribuye a una mejora de la activación muscular. Si cada UM dentro del músculo es capaz de producir más fuerza después del entrenamiento, se deduce que será necesario reclutar un menor número de UM y se producirá una reducción de la activación cortical para aplicar la misma fuerza y alcanzar la misma velocidad. Este efecto se manifiesta también por una menor activación neural (menor EMG) para la generación de la misma fuerza, lo que sugiere un aumento de la respuesta contráctil para la misma activación neural no máxima.
El reclutamiento de UM y la frecuencia de estímulo son dos procesos típicamente neurales. El aumento de la activación de los músculos agonistas por la aplicación de entrenamiento de fuerza de alta intensidad se puede deber a un aumento del reclutamiento de UM o al aumento de la frecuencia de estímulo o a ambas (Moritani, 2003). Cuanto mayor sea el número de UM reclutadas y su frecuencia de estímulo, mayor podrá ser la fuerza. Está bien documentado que el reclutamiento y la frecuencia de estímulo (firing rate / dischargue rate / rate coding) dependen principalmente del nivel de fuerza y de la velocidad de la acción. Cuando aumenta la velocidad del movimiento, la fuerza aplicada por las fibras lentas disminuye más rápidamente que la aplicada por las fibras rápidas debido a las diferencias en su relación fuerza-velocidad. Como consecuencia, se ha propuesto que los movimientos rápidos pueden ser realizados por un reclutamiento selectivo de UM rápidas desde el primer momento. En situaciones extraordinarias, como la competición, y como consecuencia de un entrenamiento prolongado de fuerza es probable que se activen en primer lugar la fibras rápidas, con umbral de excitación más alto, con muy alta frecuencia de estímulo, incluso mayor que la necesaria para alcanzar la tetanización. En situaciones de máxima velocidad de movimiento como, por ejemplo, los saltos continuos o acciones de máxima velocidad en carrera, es probable que sea incompatible el reclutamiento de UM lentas. En este sentido se ha observado que el entrenamiento de la velocidad (propio de corredores especialistas en pruebas de distancias cortas) no sólo favorece el reclutamiento de las UM más rápidas más fácilmente, sino que también aumenta la velocidad de conducción nerviosa de los axones motores, propiciando de esta manera la mayor frecuencia de estímulo y la mayor producción de fuerza en la unidad de tiempo de estas UM (Ross y col., 2001).
El término sincronización hace referencia a la activación simultánea de distintas unidades motoras. Aunque inicialmente se consideró que la sincronización de las unidades motoras es una adaptación paralela y determinante de la mejora de la fuerza, recientemente se ha observado que después de cuatro-ocho semanas de entrenamiento de músculos de la mano se mejoró la fuerza pero sin cambios en la sincronización de pares de unidades motoras activadas de manera simultánea (Kidgell y col., 2006). Sin embargo, aunque el aumento de la sincronización de las unidades motoras no influya en la magnitud de la fuerza generada, puede ser positiva cuando se necesita realizar acciones en las que es importante la producción de fuerza en la unidad de tiempo (Yao y col., 2000). El papel más probable que se le pueda atribuir a la sincronización en el rendimiento neuromuscular es la producción de fuerza en la unidad de tiempo (RFD) en acciones que se realizan con gran rapidez y como mecanismo para coordinar la actividad de numerosos músculos que tienen el objetivo de realizar tareas con alta y rápida generación de fuerza.
Factores hormonales
Se considera que los mecanismos hormonales forman una parte muy importante del complejo sistema que produce las adaptaciones al entrenamiento de fuerza. Una elevada concentración hormonal aumenta la probabilidad de las interacciones de los receptores específicos, iniciándose así una cascada de eventos que llevan a una respuesta adaptativa aguda (síntesis inmediata de proteínas) y crónica (hipertrofia muscular) (Kraemer y Ratamess, 2005). La función de las hormonas más relacionadas con la mejora de la fuerza es probablemente la síntesis y la degradación de las proteínas contráctiles del músculo. Las hormonas que contribuyen a la síntesis de proteínas se denominan anabólicas y las que intervienen en la degradación de proteínas se denominan catabólicas. Dentro de las primeras se encuentran la testosterona, la hormona de crecimiento (GH), la IGF (Insulin-Like Growth Factors) y la insulina, y dentro de las segundas principalmente el cortisol.
Temperatura
Es una experiencia común que cuando se intenta realizar una actividad física de alta o máxima intensidad no se alcanza el máximo rendimiento sin un “calentamiento” previo. Un aspecto importante de este “calentamiento” es el aumento de la temperatura muscular.
El aumento de la temperatura por encima de la de reposo produce una mejora de la RFD y una más rápida relajación, y un efecto contrario si se enfría el músculo por debajo de la temperatura natural (Asmussen y col., 1976, Bergh y Ekblom, 1979, de Ruiter y Haan, 2000). La RFD y la relajación en el músculo esquelético son dependientes de la temperatura, mientras que el pico máximo de fuerza parece tener una relación baja o negativa con la temperatura (Bennet, 1985). Sin embargo, Holewijn y Heus (1992) observaron que un enfriamiento con agua a 15 ºC resultó en una disminución significativa de la fuerza máxima (pico máximo de fuerza en la prensión de mano) del 20%, aunque la RFD (RFD hasta el 66% del pico de fuerza máxima) disminuyó hasta el 50%, lo que concuerda con los datos anteriores. En este mismo estudio se observó que un aumento excesivo de la temperatura, más de 32º no producía mayor mejora. Un efecto equivalente se observa en la curva fuerza-velocidad, con un aumento de la velocidad máxima y una reducción de su curvatura (de Ruiter y Haan, 2001). Estos cambios, naturalmente, se traducen en una mejora de la potencia, ya que significan que la misma carga se desplaza a mayor velocidad, o que a la misma velocidad se desplaza una carga mayor. Los efectos del aumento de la temperatura se manifiestan en mayor medida en acciones concéntricas que excéntricas (Ranatunga, 2010).
La relación entre los cambios de temperatura y el rendimiento en fuerza y velocidad justifican la conveniencia de realizar un calentamiento muscular antes de pretender el máximo rendimiento en acciones deportivas (Ranatunga, 2010).
Potenciación
Inmediatamente y durante algunos minutos después de realizar determinadas actividades / esfuerzos / ejercicios, el sistema neuromuscular puede mejorar su capacidad de rendimiento: mayor fuerza aplicada, mayor RFD, mayor velocidad. Este tipo de efecto se ha denominado “potenciación postactivación”. Esto significa que después de un determinado esfuerzo o activación muscular se “potencia” la ejecución del mismo ejercicio o en algún caso también de otro. El término “potenciar” hace referencia a “aumentar la potencia”, pero el efecto se mide por los cambios en la fuerza y la RFD especialmente. Si hay mejoras en la fuerza, necesariamente las habrá en la velocidad y en la potencia al realizar el mismo ejercicio. El efecto de la potenciación se puede producir desde el momento en el que se produce la activación, pero al mismo tiempo se ha podido producir fatiga, efecto opuesto a la potenciación. Por tanto, el resultado puede ser una mezcla de ambos efectos neuromusculares (MacIntosh y Rassier, 2002). Esta interacción entre potenciación y fatiga hace que sea difícil determinar si después de una activación se ha dado un efecto positivo, negativo o si no ha habido efecto en relación con la potenciación.
La mejora del rendimiento (potenciación) se produce porque la activación previa crea unas condiciones favorables para una más rápida, fuerte y frecuente formación de puentes cruzados. Estas condiciones se atribuyen en parte al efecto de la fosforilación de la miosina de cadena ligera reguladora (CLR). La forfoliración de la CLR (F-CLR) viene provocada por la liberación del calcio del retículo sarcoplásmico, que activa la enzima kinasa que propicia la fosforilación de la CLR (Stull y col., 2011). Debido a la F-CLR, se produce un cambio en la orientación de la cabeza de miosina acercándola a la actina, y aumentando la sensibilidad al calcio de los puentes cruzados por la proximidad, creando así una situación más favorable a la formación del puente cruzado. El efecto de potenciación es mayor en las fibras rápidas que en las lentas, precisamente por una mayor actividad en las fibras rápidas de la enzima kinasa responsable de la F-CLR (Grange y Houston, 1991; Stull y col., 2011). La potenciación también está en relación con el número y tamaño de las UMs reclutadas.
Teóricamente, cuanto mayor sea la intensidad de la actividad previa, mayor será el número de unidades motoras reclutadas y mayor la F-CLR, de la misma manera que el aumento del tiempo de activación permitirá un mayor tiempo para la F-CLR, pero al mismo tiempo la fatiga tenderá a ser mayor, por lo que llevar a los extremos la intensidad y el volumen puede no dar los mejores beneficios de potenciación. En estos casos, la F-CLR puede seguir creciendo al mismo tiempo que de reduce la potenciación (Stull y col., 2011).
En un músculo alongado la potenciación es menor que si está acortado (MacIntosh y col., 2008; Stull y col., 2011). El músculo elongado presenta mayor proximidad de las cabezas de miosina a la actina, dando lugar a una alta sensibilidad al calcio, por lo que las posibilidades de mejorar dicha sensibilidad por la F-CLR y la potenciación son bajas, mientras que ocurre lo contrario en un músculo acortado.
El mayor efecto de potenciación se produce sobre la RFD (Abbate y col., 2000; Baudry y Duchateau, 2007a; MacIntosh y col., 2008), lo que se relaciona con una mayor tasa de formación de puentes cruzados. Este mismo mecanismo reduce la curvatura de la curva fuerza-velocidad (Baudry y Duchateau, 2007b; Stull y col., 2011), lo que daría lugar a una mayor potencia especialmente con las cargas intermedias coincidentes con la zona de máxima curvatura.
El grado y el momento de la máxima potenciación ante un mismo tipo e intensidad de activación dependen del tiempo de activación. Un estímulo corto (10 s) produce una rápida potenciación para disminuir de manera inmediata. El mismo tipo de estímulo aplicado durante 60 s produce un descenso de la potenciación (reducción de la fuerza) de manera inmediata, para alcanzar el mayor efecto de potenciación (pero menor que cuando el estímulo se aplicó durante 10 s) a los cuatro minutos aproximadamente. Estos efectos se producen sin diferencias significativas en la F-CLR pre-post activación en ambos tiempos de activación (Houston y Grange, 1990). El cambio en el grado de potenciación y en el momento en producirse depende del efecto de la fatiga que acompaña a cualquier tipo de estimulación. Por tanto, dado un mismo grado de F-CLR, la fatiga parece determinar el grado y el momento de máxima potenciación posterior a la activación.
El análisis de una posible potenciación derivada de un esfuerzo o activación previa está justificado por lo que podría aportar en relación con la preparación inmediata para la obtención de una mayor actualización del potencial de fuerza en una acción determinada, que especialmente sería importante si se tratase de una acción específica de competición. Esta respuesta neuromuscular post-activación es la que se pretende optimizar en la fase de calentamiento de cualquier preparación inmediata para una competición o rendimiento físico máximo. Se espera que el efecto de potenciación contrarreste el efecto de la fatiga producida simultáneamente, especialmente en el momento en el que se vaya a producir el intento de alcanzar el máximo rendimiento. En este sentido, la tarea está en elegir la intensidad más apropiada, el tiempo y la frecuencia que se mantiene la intensidad o intensidades y el tiempo de recuperación post-activación hasta la ejecución de la tarea objeto de mejora.
Sin embargo, aprovechar la posible potenciación para realizar ejercicios muy distintos al que la provoca puede no tener efecto e incluso podría darse interferencia en la ejecución del segundo ejercicio. En este sentido, probablemente no sería procedente realizar una activación previa con un ejercicio “de fuerza” con altas cargas para realizar inmediatamente después, sin descanso intermedio, un ejercicio de características técnicas muy distintas y, además, realizado a velocidades mucho más altas.
La aplicación de dos ejercicios consecutivos con la intención de aprovechar la supuesta potenciación provocada por el primero también se ha utilizado con la intención de mejorar el rendimiento a medio y largo plazo, pero su efecto en relación con la mejora del rendimiento y la propuesta de cuáles son las combinaciones más efectivas de cargas, descansos, frecuencias y ejercicios, orden de ejercicios, temperatura… sólo se puede conocer por la aplicación de sucesivos estudios (Sale, 2002; Hodgson y col., 2005).
Referencias
1. Aagaard P, Andersen JL, Dyhre-Poulsen P, Leffers A, Wagner A, Magnusson SP, Halkjaer-Kristensen J y Simonsen EB, (2001). A mechanism for increased contractile strength of human pennate muscle in response to strength training: changes in muscle architecture. J. Physiol. 534(2).:613-623
2. Abbate, F., A. J. Sargeant, P. W. L. Verdijk, and A. de Haan (2000). Effects of high-frequency initial pulses and posttetanic potentiation on power output of skeletal muscle. J. Appl. Physiol. 88: 35–40
3. Asmussen, E., Flemmig, Bonde-Petersen and Kurt Jorgensen (1976). Mechano-Elastic Properties of Human Muscles at Different Temperatures. Acta physiol. scand.; 96. 83-93
4. Baratta R, Solomonow M, Zhou BH, Letson D, Chuinard R, D’Ambrosia R (1988). Muscular coactivation: the role of the antagonist musculature in maintaining knee stability. Am. J Sports Med.;16(2).:113-122.
5. Baudry S, Duchateau J. (2007a). Postactivation potentiation in a human muscle: effect on the rate of torque development of tetanic and voluntary isometric contractions. J Appl Physiol 102: 1394–1401
6. Baudry S, Duchateau J. (2007b). Postactivation potentiation in a human muscle: effect on the load-velocity relation of tetanic and voluntary shortening contractions. J Appl Physiol 103: 1318–1325
7. Bennett, A.F (1985). Temperature and muscle. J. Exp. Biol. 115,333-344
8. Bergh, U. and B. Ekblom (1979). Influence of muscle temperature on maximal muscle strength and power output in human skeletal muscles. Acta Physiol Scand; 107: 33-37
9. De Ruiter, C. J. and A. De Haan (2001). Similar effects of cooling and fatigue on eccentric and concentric force-velocity relationships in human muscle. J Appl Physiol 90: 2109–2116
10. De Ruiter, C.J., and A. De Haan (2000). Temperature effect on the force/velocity relationship of the fresh and fatigued human adductor pollicis muscle. Eur J Physiol.; 440:163–170
11. Desmedt, J. E., and Godaux, E. (1977). Ballistic contractions in man: characteristic recruitment pattern of single motor units of the tibialis anterior muscle. J. Physiol, 264(3)., 673-693.
12. Duchateau, J., S. L. Bozec, and K. Hainaut (1986). Contributions of slow and fast muscles of triceps surae to a cyclic movement. Eur J Appl Physiol (1986). 55:476—481.
13. Edman, K.A.P. (1992). Contractile performance of skeletal muscle fibers. In: Strength and power in sport. Editado por P. Komi. Blackwell Scientific Publication, London, 96-114
14. Enoka, R.M (2002). Neuromechanics of human movement (3ª edición). Champaign. Human Kinetics
15. Gabriel, David A. Gary Kamen, and Gail Frost (2006). Neural Adaptations to Resistive Exercise. Mechanisms and Recommendations for Training Practices. Sports Med; 36 (2).: 133-149
16. Goldspink, G. (1992). Cellular and Molecular Aspects of Adaptation in Skeletal Muscle. En: Strength and power in sport. Editado por P. Komi. Blackwell Scientific Publication, London, 211-229.
17. Grange RW, and Houston ME (1991). Simultaneous potentiation and fatigue in quadriceps after a 60-second maximal voluntary isometric contraction. J Appl Physiol. Feb;70(2).:726-31
18. Hodgson, M., D. Docherty, and D. Robbins (2005). Post-activation potentiation underlying physiology and implications for motor performance. Sports Med 2005; 35 (7).: 585-595
19. Holewijn, M., and Ronald Heus (1992). Effects of temperature on electromyogram and muscle function. Eur J Appl Physiol. 65:541-545
20. Houston, M.E., and R.W. Grange (1990). Myosin phosphorylation, twitch potentiation, and fatigue in human skeletal muscle. Can. J. Physiol. Phamacol. 68: 908-913.
21. Jones, D. A. and O. M. Rutherford (1987). Human muscle strength training: the effects of three different regimes and the nature of the resultant changes. J. Physiol. (1987)., 391, pp. 1-11
22. Kawakami Y., Murakoa T., Ito S., Kanehisa H. y Fukunaga, T. (2002). In vivo muscle fibre behaviour during counter-movement exercise in humans reveals a significant role for tendon elasticity. J. Physiol. 540:635-646
23. Kidgell DJ, Sale MV, Semmler JG. (2006). Motor unit synchronization measured by cross-correlation is not influenced by short-term strength training of a hand muscle. Exp Brain Res. Nov;175(4).:745-53
24. Kraemer, W. J., & Ratamess, N. A. (2005). Hormonal responses and adaptations to resistance exercise and training. Sports Med, 35(4)., 339-361
25. Linari, M., R. Bottinelli, M. A. Pellegrino, M. Reconditi, C. Reggiani, and V. Lombardi (2004). The mechanism of the force response to stretch in human skinned muscle fibres with different myosin isoforms. J Physiol. Jan 15; 554(Pt 2).: 335–352.
26. MacIntosh BR y Rassier DE (2002). What is fatigue?. Can J. Appl. Physiol. 27:42-55
27. MacIntosh, B. R., E. C. Taub, G. N. Dormer, and E. K. Tomaras (2008). Potentiation of isometric and isotonic contractions during high-frequency stimulation. Eur J Physiol.; 456:449–458
28. Moritani, T. (2003). Motor unit and motoneurone excitability during explosive movement. In: Strength and power in sport. Editado por P. Komi. Blackwell Scientific Publication, London en Strength and Power in Sport, 27-49
29. Nyitrai. M., R. Rossi, N. Adamek, M. A. Pellegrino, R. Bottinelli, and M. A. Geeves (2006). What Limits the Velocity of Fast-skeletal Muscle Contraction in Mammals? J. Mol. Biol.: 355, 432–442
30. Phillips SM. (2000). Short-term training: when do repeated bouts of resistance exercise become training? Can J Appl Physiol. 2000 Jun;25(3).:185-93.
31. Ploutz LL, Tesch PA, Biro RL, and Dudley GA (1994). Effect of resistance training on muscle use during exercise. J Appl Physiol 7: 1675–1681.
32. Ranatunga, K.W. (2010). Force and power generating mechanism(s). in active muscle as revealed from temperature perturbation studies. J Physiol 588.19 (2010). pp 3657–3670.
33. Ross A, Leveritt M, and Riek S. (2001). Neural influences on sprint running: training adaptations and acute responses. Sports Med. 2001;31(6).:409-25
34. Sale, D. G. (1992). Neural adaptation to strength training. In: Strength and power in sport. Edited by P. Komi. Blackwell Scientific Publication, London, 249-266.
35. Sale, D.G. (2002). Postactivation potentiation: Role in human performance. Exerc. Sport Sci. Rev., Vol. 30, No. 3, pp. 138–143.
36. Sargeant, A. J. (2007). Structural and functional determinants of human muscle power. Exp Physiol 92.2 pp 323–331
37. Schiaffino, S. and C. Reggiani (2011). Fiber types in mammalian skeletal muscles. Physiol Rev 91: 1447–1531, 2011
38. Semmler, J.G. y Enoka, R.M. (2000). Neural contributions to changes in muscle strength. En V. Zatsiorsk (Ed.). Biomechanics in sport. Blackwell. London: 3-20
39. Shima N, I., K. Katayama, Y. Morotome, Y. Sato, and M. Miyamura (2002). Cross-education of muscular strength during unilateral resistance training and detraining. Eur J Appl Physiol; 86: 287-94.
40. Stull, J. T. K. E. Kamm, and R. Vandenboom (2011). Myosin light chain kinase and the role of myosin light chain phosphorylation in skeletal muscle. Arch Biochem Biophys. June 15; 510(2).: 120–128
41. Van Dieen, J. H., F. Ogita, and A. DE HAAN (2003). Reduced Neural Drive in Bilateral Exertions: A Performance-Limiting Factor? Med. Sci. Sports Exerc., Vol. 35, No. 1, pp. 111–118.
42. Wilson, Greg J. Aron J. Murphy - Andrew Walshe (1996). The specificity of strength training: the effect of posture. Eur J Appl Physiol; 73: 346-352
43. Yao, W., A.J. Fuglevand, and R.M. Enoka (2000). Motor-unit synchronization increases EMG amplitude and decreases force steadiness of simulated contractions. J. Neurophysiol. 83:441–452.