Hormonas sexuales y distribución de tejido adiposo en mujeres fumadoras pre-menopáusicas
Alan D Martin1,2, Charles Fainman2,3 y Mark Daniel1
Instituto de Investigación de Deportes y Ciencias Aplicadas al Ejercicio, Universidad de Manitoba. Winnipeg Canadá
Artículo publicado en el journal PubliCE, Volumen 0 del año 1992.
Publicado 16 de enero de 2004
Resumen
Palabras clave: femenino, distribución adiposa, fumar, estradiol, testosterona, globulina ligada a hormonas sexuales
INTRODUCCION
Numerosas evidencias circunstanciales sugieren que las mujeres que fuman cigarrillos son deficientes en estrógenos. Fumar esta asociado con la menopausia temprana y síntomas menopáusicos, elevado riesgo de oligomenorrea y gran prevalencia de hirsutismo (1). Un estado hipoestrogénico es un factor de riesgo, ya largamente conocido para la osteoporosis, y las fumadoras post-menopáusicas de fracturas osteoporóticas que las no fumadoras (2). Las fumadoras pre y post menopáusicas tienen ambas, baja incidencia de los tipos de cáncer estrógeno-dependientes (3).
El fumar está asociado con la infertilidad, hay una relación directa entre el número de cigarrillos fumados por día y el tiempo requerido para quedar embarazada (4). Más aún, mujeres embarazadas fumadoras tienen menores niveles séricos de estrógenos que las no fumadoras (5,6), ya sea porque afecte, marcadamente, la producción de estradiol o de su metabolismo, hecho aún no aclarado.
La excreción urinaria reducida de estrona, estradiol y estriol en fumadoras pre-menopáusicas, sugiere un decremento en la producción de estrógenos. Fumar puede ser directamente tóxico para los ovarios (8). El fumar, y consecuentemente, los alcaloides nicotínicos, inhiben directamente la actividad de aromatización de las células granulosas humanas y, por ende, la conversión de andrógenos en estrógenos (9,10). Sin embargo, la aumentada 2-hidroxilación de estradiol en fumadoras pre-menopáusicas (11), sugiere un efecto antiestrogénico debido a la desactivación, y no a un decremento de producción; después de un año de terapia estrogénica de reemplazo, las fumadoras post-menopáusicas, tienen más bajos niveles de estrógenos que las no fumadoras (12).
Los esteroides sexuales están implicados en la distribución del tejido adiposo (13). Las hormonas reproductivas influyen directamente en el tamaño y número de los adipocitos humanos (14). La diferenciación sexual de la distribución del tejido adiposo en la pubertad (15) aparece mediada, al menos en parte, por los esteroides sexuales (16). Las niñas toman una distribución ginecoide (glúteo-femoral), los varones una distribución androide (abdominal). Esta variación puberal de distribución ginecoide-androide, se explica por la variación en las concentraciones séricas de estradiol y testosterona (17). El dimorfismo sexual de la distribución de grasa corporal en adultos, parece estar directamente mantenido por efectos regionales específicos de las hormonas reproductivas sobre los adipocitos (18, 19). Después de la menopausia, las mujeres cambian la distribución ginecoide a androide, concomitantemente con el incremento relativo de los niveles de andrógenos sobre los estrógenos. Tales observaciones sugieren la hipótesis de que la distribución del tejido adiposo es una función del balance androgénico/estrogénico (18). El cociente entre perímetro de cintura y cadera (WHR) y el cociente entre perímetro de cintura y muslo (WTR), considerados índices de adiposidad relativa, androide o ginecoide, tienen mayor riesgo están positivamente correlacionados, en mujeres, con la testosterona sérica total (20), la testosterona libre (18,21), el cociente testosterona libre/testosterona total (22), la tasa de producción de testosterona y dihidrotestosterona (20), la tasa de producción y el porcentaje del clearance metabólico de dehidroespiandrosterona (DHEA) (23). Repetidamente, se ha descrito una correlación inversa del WHR con la globulina ligada a las hormonas sexuales (SHBG), indicador del balance androgénico/ estrogénico (17,18,20).
Nuevo soporte para la hipótesis del balance androgénicoo/estrogénico es provisto por observaciones con medicación hormonal: el tratamiento de mujeres con andrógenos induce características androgénicas, y el tratamiento de varones con estrógenos induce características ginecoides (24). Estudios prospectivos (25) han establecido, independientemente del tipo de adiposidad, una clara relación entre el predominio de la grasa abdominal y las enfermedades cardiovasculares, hipertensión, infarto, patologías que están también fuertemente asociadas con el hábito de fumar. No hay relación entre este tipo de enfermedades y la adiposidad ginecoide (26). Puesto que el fumar cigarrillos parece ser anti-estrogénico, y la obesidad ginecoide es producida por la dominancia estrogénica, fumar podría promover la adiposidad androide y la génesis de estados patológicos relacionados con sus efectos sobre el balance androgénico/estrogénico.
Hipotetizando que la interacción del fumar influiría sobre los niveles de andrógenos/estrógenos, con efectos sobre la distribución del tejido adiposo, reportamos los resultados de un estudio cross-seccional de los niveles de esteroides sexuales endógenos, SHBG, y la distribución del tejido adiposo, en relación al hábito de fumar en mujeres pre-menopáusicas. Nuestros resultados sugieren que el fumar cigarrillos promueve la masculinización de la distribución grasa o del tejido adiposo, en mujeres jóvenes, a través de sus efectos interactivos con las hormonas masculinas, contrariamente a la imagen glamorosa y saludable de las mujeres fumadoras proyectadas por las empresas tabacaleras, en la publicidad en los medios de comunicación masivos.
METODOS
SUJETOS: La población estudiada o las participantes en este estudio, fueron reclutadas por medio de una campana de posters y anuncios publicados en las estaciones de TV y radio locales; otras fueron recomendadas por las mismas participantes. Los posters y los anuncios facilitaron la selección personal, pues especificaban el género elegido (femenino), edad (20-35 años) y la condición de fumadoras/no fumadoras. De las 187 que respondieron, 134 completaron un cuestionario después del cual 52 fueron excluidas debido a: a) uso de anticonceptivos orales u otro tipo de medicación hormonal (estrógenos, progestágenos, glucocorticoides u hormonas tiroideas), en los cuatro meses anteriores al estudio; b) uso de drogas prescriptas o no, dentro del 1 er. mes de participación en el estudio; c) ciclos menstruales menores de 21 días o mayores de 36 días; d) participación en competencias atléticas, o más de ocho horas de entrenamiento físico por semana; e) fluctuaciones en el peso corporal de 5 o más kg dentro de los 6 meses precedentes al inicio del estudio; f) antecedentes de algún tipo de anormalidad endocrina; g) embarazo y h) salud precaria. La mayor razón de exclusión fue el uso de anticonceptivos orales. Todas las mujeres proveyeron su informe por consentimiento escrito; el protocolo de investigación fue aprobado por el Comité de Etica Humana de la Facultad de Medicina de la Universidad de Manitoba. La muestra fue luego agrupada de acuerdo a su status de fumadora/no fumadora. De la muestra, 46 eran no fumadoras y 36 eran fumadoras regulares de cigarrillos. En razón de que otros estudios reportaron la falta de efectos del fumar sobre el peso corporal, cuando se fuman menos de ocho cigarrillos por día (27), aquellas fumadoras que reportaron fumar siete o menos cigarrillos por día (n = 9), durante un período de cinco años anteriores al estudio, fueron excluidas. Las no fumadoras fueron definidas como aquellas que nunca habían fumado ("nunca fumadoras"), y anteriormente fumadoras quienes: a) no habían fumado en el período de los últimos cinco años anterior a su participación en este estudio; o b) no habían fumado por un período igual o mayor, en duración, al tiempo en el cual habían fumado. Las anteriormente fumadoras que no satisfacían estos criterios (n = 17) fueron excluidas de la muestra, conformándose las "no fumadoras", por 16 mujeres "nunca fumadoras" y 13 anteriormente fumadoras. La decisión de permitir que mujeres antiguamente fumadoras integrarán el grupo de las no fumadoras, se basó en el hecho de que, investigaciones anteriores indican diferencias significativas en la distribución de la grasa corporal (perímetro de cintura, WHR) entre fumadoras corrientes y aquellas que nunca fumaron o lo hicieron antiguamente, mientras que no hay diferencias significativas al respecto, entre quienes nunca fumaron y quienes habían fumado antiguamente. Por consiguiente, la muestra estuvo finalmente compuesta por 56 sujetos (27 fumadoras y 29 no fumadoras). Cuatro participantes abandonaron el estudio después de completar la l era. serie (antropométrica) de mediciones; sus resultados están incluidos en el análisis de la distribución grasa, pero dado que sus niveles hormonales no pudieron ser medidos, sus resultados no se incluyeron en el análisis de los niveles hormonales sexuales.
MUESTRAS DE SANGRE Y METODOLOGIA ANALITICA PARA HORMONAS
Diez (10) ml de sangre venosa fueron extraídos con jeringas hipodérmicas de venas de la región antecubital entre las 8:00 y 12:00 hs siguientes a una noche de ayuno de al menos 10 horas, y de abstinencia de alcohol de al menos cinco días. La sangre fue extraída en la mitad de la fase folicular (en el 7 mo. u 8 vo. día del ciclo menstrual). La concentración sérica se obtuvo por centrifugación a 3.300 r.p.m. durante 15 minutos (a temperatura ambiente): alícuotas del suero fueron conservadas a 20° C hasta ser analizadas (1-4 meses). La concentración de testosterona sérica total (T) fue determinada por radioinmunoensayo -I, con muestras comerciales en fase sólida 125 (Coat-a-Count R, D.P.C. Diagnostic Products Corp, Los Angeles, CA, USA). Las concentraciones de SHBG y estradiol (E2) fueron determinadas por fluoroinmunoensayo con muestras comerciales en fase sólida (DELFIA R, Wallac Oy, Turcu, Finland).
Hubo una serie de tests para testosterona y dos series para SHBG y estradiol, respectivamente; igual número de muestras fueron tomadas a cada uno de los grupos de fumadoras y no fumadoras para ser incluidas en dos series de pruebas, posteriormente. Todos los tests fueron realizados por duplicado y cada test individual fue monitoreado con las muestras de control de calidad provistas por cada muestra comercial.
El coeficiente de variación intratest para la testosterona fue menor del 4%, el de SHBG fue menor del 6% y el del estradiol menor del 3%. Los. coeficientes de variación intertest para el SHBG y el estradiol fueron, ambos, de alrededor del 8%.
MEDICIONES ANTROPOMETRICAS
Todas las mediciones fueron realizadas por uno de los autores (MD), cuya confiabilidad en mediciones antropométrica había sido establecida, previamente.
Las evaluadas estaban en traje de baño, sin zapatos y en estado post absortivo. Todas las mediciones fueron hechas por triplicado, usándose la mediana como el valor experimental. Fueron registrados perímetros, peso, altura, diámetro de cadera y ocho pliegues cutáneos.
La circunferencia de la cintura (mínima) fue tomada donde la cintura estaba mejor definida, aproximadamente a la mitad de la distancia entre el reborde de la última costilla y la cresta ilíaca.
Dado que la definición precisa de la región de la cintura varía en la literatura, una medida de la circunferencia umbilical fue tomada además, a nivel del ombligo; sin embargo no se suponen diferencias en los resultados. Las mediciones de las circunferencias de la cintura y umbilical fueron hechas al final de la espiración normal (end-tidal).
La circunferencia de cadera máxima fue medida a nivel de la gran protuberanciacia posterior del glúteo. La medición de la circunferencia superior del muslo se hizo a 1-2 cm por debajo de la línea glútea.
El diámetro biilicrestídeo fue tomado como la distancia entre los puntos más laterales del borde superior de la cresta ilíaca, utilizando las ramas o brazos de un antropómetro de ramas largas deslizable. Se uso un calibre de pliegues Harpenden de precisión (British Indicators Ltd.), para medir los pliegues cutáneos bíceps, tríceps, subescapular, cresta ilíaca, supraespinal, abdominal, muslo frontal y pantorrilla medial, en el lado derecho del cuerpo (29).
ANALISIS ESTADISTICO
Para cada sujeto, el WHR, WTR, el cociente perímetro umbilical/perímetro de cadera (UHR), y perímetro de cintura/diámetro máximo de cadera (WHBR), fueron computados, además de la suma de ocho pliegues cutáneos (SF) y la suma de los pliegues cutáneos centrales (SFc) (abdominal, supraespinal y cresta ilíaca).
Para definir perfiles de hormonas sexuales, se computó la relación T/E2; y se estimaron niveles de testosterona y estradiol libres (E2/SHBG y T/SHBG). A fin de mejorar la asimilación de curvas a rectas, las siguientes variables fueron transformadas a valores logarítmicos (base 10) para su análisis: WHR, UHR, WTR, WHBR, perímetro superior del muslo, SF, SFc, T, E2, relación T/E2, SHBG, T/SHBG y E2/ SHBG. Tests paramétricos de significancia estadística se aplicaron a los valores transformados.
Son reportados los valores medios e intervalos de confianza (95%) de los datos, previamente transformados; el límite de confianza fue determinado a partir de los errores standards de los valores transformados, y son por lo tanto, ligeramente asimétricos. Comparaciones no paramétricas (no reportadas) de los valores originales, no transformados, usando el test U de Mann-Whitney, generaron conclusiones idénticas a aquellas de los tests paramétricos.
Los softwares Súper ANOVA (Abacus Concepts Inc., 1989) y Statview SE + Graphics (Abacus Concepts Inc., 1987), se usaron para el análisis estadístico de los datos en una computadora Macintosh SE/30 (Apple Computer, Inc.). La significancia estadística se estableció en el nivel 0.05 de probabilidad. Las características descriptivas fueron testeadas para establecer diferencias entre ambos grupos, por medio del Test t de Student y por el Test de chi cuadrado.
Las diferencias entre los grupos de fumadoras/no fumadoras en la adiposidad regional y en los niveles de esteroides sexuales (consideradas como variables dependientes), fueron testeadas, por análisis de covariancia a dos vías (ANCOVA), en relación a la suma de los pliegues cutáneos (SF) como covariante.
La linearidad de las relaciones dependientes fueron establecidas para evaluar los "plots" residuales. Los indicadores de adiposidad regional se ajustaron para el grado de adiposidad total, pues la adiposidad androide está positivamente correlacionada con la obesidad generalizada, variando este tipo de obesidad, típicamente, entre fumadoras y no fumadoras (4). Las variables endocrinas, también fueron ajustadas para obesidad generalizada, puesto que los niveles séricos de SHBG tienen correlación con el porcentaje del peso corporal ideal en mujeres pre-menopáusicas, y el nivel sérico de estradiol total tiene correlación con el porcentaje de grasa corporal en mujeres jóvenes, activas, magras, que menstrúan regularmente (30). Además, hay una asociación significativa entre el índice de masa corporal (BMI) y la conversión periférica de testosterona en estradiol (3 l); y la conversión periférica (en el tejido adiposo) de androstenediona a estrona, en mujeres pre-menopáusicas, favorece la interconversión de estrona a estradiol (33). Aunque el BMI está bien correlacionado con la adiposidad generalizada en las poblaciones obesas, nosotros consideramos a la suma de ocho pliegues cutáneos (SF), como una covariante más válida que el BMI, en esta muestra de mujeres jóvenes saludables, no obesas.
Adicionalmente, cuantificando directamente el grosor del tejido adiposo subcutáneo, la suma de pliegues cutáneos no puede ser confundida con otros tejidos que no sea el adiposo (34), y se relaciona mejor con la determinación densitométrica de la adiposidad que el BMI (35).
En términos de la interacción con SF, se incluyo el hábito de fumar en ler. orden para el análisis de covariancia a dos vías (ANCOVAs).
La relación del fumar con el balance de las hormonas sexuales y la adiposidad regional, entre los grupos de fumadoras y no fumadoras, fue testeada por interacción asesorando la homogeneidad de las pendientes, donde las hormonas sexuales fueron consideradas la variable independiente, y la distribución del tejido adiposo, la dependiente.
Se construyó un modelo de análisis factorial de variancia (ANOVA), el cual permitió testear el status de fumador y un parámetro hormonal, además de los términos de interacción, conteniendo estos principales efectos, en contra de un indicador de la distribución del tejido adiposo. Los principales efectos fueron ajustados para la obesidad general (SF) y las medias del grupo dependiente contrastó con la media de los valores de SF.
RESULTADOS
La edad media de las participantes fue 29.3 +/- 4.5 años (media +/- s.d.) (rango 20-35). El ciclo menstrual medio fue 28.2 +/- 2.6 días (rango 21-35).
Para las fumadoras, el promedio de cigarrillos fumados por día fue 16.9 +1-6.3 (rango 8-30); el tiempo que hacía que fumaban fue, en promedio, de 12.9 +/- 4.5 años (rango 5-21); la edad promedio de la iniciación del hábito fue de 16.9 +/- 2.9 años (rango 13-28).
No hubo diferencias significativas, entre grupos, en la edad, peso, altura, BMI, suma de pliegues cutáneos (SF), diámetro de cadera, edad de la menarca o parición (multípara/nulípara) (Tabla 1). Considerando el consumo de alcohol, estudiado por tabla de contingencia, no hubo diferencias significativas, entre las que nunca consumieron alcohol, las que consumieron menos de dos onzas, aquellas consumidoras de dos a seis onzas (o su equivalente) de bebidas alcohólicas por semana. Sin embargo, hubo diferencias significativas (p < 0.005) entre los grupos, con la categoría que consumía más de seis onzas por semana: ocho de veintisiete fumadoras (29,6%), reportaron el consumo de más de seis onzas de alcohol por semana, mientras que ninguna de las no fumadoras consumía tal cantidad.
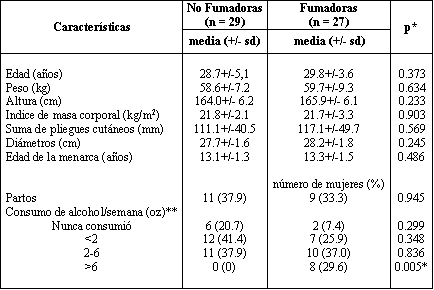
Tabla 1. Características de mujeres fumadoras y no fumadoras pre-menopáusicas.
* Test t de Student para datos continuos; test de chi cuadrado para parición y
consumo de alcohol (tabla de contingencia).
* 1 oz = 14 gr de alcohol (etanol).
DISTRIBUCION DEL TEJIDO ADIPOSO
La Tabla 2 resume la contribución del hábito de fumar en varios índices de adiposidad regional. Las fumadoras se caracterizaron por un mayor WHR (p <0.01), WTR (p <0.02) y WHBR (p <0.0001). La diferencia en UHR fue de una significancia límite (p= 0.052). Considerando mediciones de perímetros, las fumadoras tenían mayores valores en perímetros de cintura (p <0.0002) y umbilical (p <0.005), aunque el perímetro superior del muslo fue menor (p <0.05), en las mismas fumadoras.
No hubo diferencias entre los grupos, en el per metro de cadera (p= 0.12) o en la suma del espesor c los pliegues cutáneos centrales (SFc) (P= 0.38). Para todas las variables, una alta porción significativa <0.0001) de la variancia en la distribución del tejid adiposo, fueron explicados por SF (la covariante)
Con la excepción del perímetro de cintura, per metro de muslo y SFc, hubo también elevad significancia (p <0.005), en las fumadoras, por 1 interacción de SF, para todas las otras variable antropométricas (no mostradas en la Tabla 2).

Tabla 2. Índices antropométricos de la distribución de tejido adiposo en
56 mujeres pre-menopáusicas, de acuerdo a su status c fumadoras/no fumadoras.
* Análisis estadístico del log 10 de valores transformados. Los valores medios
y los límites de los intervalos de confianza están transformados, nuevamente,
a la escala natural.
** Datos ajustados para la suma de pliegues cutáneos, para el análisis de
covariancia a dos vías (ANCOVA).
PERFILES DE HORMONAS SEXUALES
La contribución del hábito de fumar en la variancia de las variables endocrinas, se resume en la Tabla 3.
No hubo diferencias significativas entre los grupos para testosterona, estradiol, la relación T/E2, T/ SHBG o E2/SHBG. Sin embargo, SHBG fue significativamente más grande en fumadoras (p < 0.01). La sumatoria de pliegues (SF), al ser usada como covariancia, no contribuyó significativamente sobre la variancia de ninguna de las variables endocrinas, aunque la significancia se acercó a < 0.05 cuando la testosterona fue la variable dependiente (p = 0.07). En fumadoras, se observaron interacciones significativas entre SF y SHBG (p < 001) (que no se muestran en la Tabla 3). Un simple análisis de regresión de las muestras de ambos grupos, indica una importante relación entre el estradiol (independiente) y SHBG (dependiente) (P < 0.002); el estradiol explica el 17,3% de la variancia en SHBG.
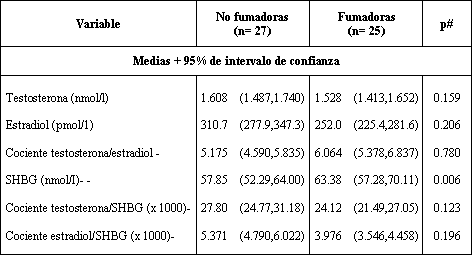
Tabla 3. Niveles séricos de hormonas sexuales y globulina ligada a
hormonas sexuales, en 52 mujeres pre-menopáusicas según su status de fumadoras
o no fumadoras (*).
* Valores transformados para el análisis estadístico en log 10. Las medias y
los límites de los intervalos de confianza, fueron reconvertidos, luego a
escala natural.
# Datos ajustados por /a suma de pliegues (SF), para el analisis de
covariancia a dos vías (ANCOVA). - Los resultados de los cocientes son
adimensionales (nmol/l % nmol/1)
-- SHBG expresa la globulina ligada a hormonas sexuales.
RELACION DEL HABITO DE FUMAR Y LAS VARIABLES ENDOCRINAS SOBRE LA DISTRIBUCION DEL TEJIDO ADIPOSO
Los principales resultados que se obtuvieron, fueron las siguientes: Primariamente, se encontró que el fumar, considerado como un efecto aislado importante, de por si no contribuye significativamente a la variación de la adiposidad regional, cuando las variables endocrinas fueron también consideradas como factores. Sin embargo, varias variables endocrinas contribuyen significativamente a la variancia de los índices de distribución del tejido adiposo:
a) Niveles de testosterona contribuyeron significativamente sobre WHR (p < 0.05), WHBR (p < 0.05) y el perímetro de cintura (p < 0.05).
b) La relación T/E2 contribuyó significativamente sobre WHR (p < 0.05), UHR (p < 0.01), perímetro de cintura (p < 0.05), perímetro umbilical (p < 0.05) y SFc (p < 0.05).
c) La relación E2/SHBG contribuyó significativamente sobre el perímetro de cintura (p < 0.05).
Para todas las correlaciones de efectos importantes entre todas las hormonas y la distribución del tejido adiposo, la observación de los puntos de las correlaciones (delineadas, al menos, con el mejor ajuste cuadrático, para marcar una tendencia de los puntos de dispersión), mostraron todas pendientes de orientación positiva (variable independiente: niveles o balances hormonales; variable dependiente: la distribución del tejido adiposo).
Se halló que los niveles de testosterona interactúan significativamente con el status de fumador. Este efecto se observó tanto sobre WHR (p= 0.032), como sobre WTR (p = 0.045). No hubo interacciones significativas del hábito de fumar con cualquier perímetro o cociente entre perímetros, con el estradiol, los cocientes TIE2, T/SHBG o E2/SHBG, o con SHBG.
Para ambos grupos, el examen de los puntos de dispersión indicaron una positiva relación entre los niveles de testosterona con WHR y WTR; sin embargo, el impacto relativo de la testosterona sobre la adiposidad androide, fue claramente mayor en las fumadoras.
INFLUENCIA DEL CONSUMO DE ALCOHOL
Considerando que ocho de las veintisiete fumadoras consumían mas de seis onzas de alcohol por semana, y de que tan alto grado de consumo podría estar asociado con la adiposidad androide alterando los niveles de esteroides sexuales, evaluamos estadísticamente los posibles efectos biológicos de este alto grado de consumo de alcohol sobre todos los resultados.
Primero, aquellas fumadoras que consumían más de 6 onzas de alcohol por semana, fueron comparadas con el resto de las fumadoras: No hubo diferencias en los indicadores de la distribución del tejido adiposo, ni en las variables endocrinas. Todos los análisis entre las fumadoras y no fumadoras, fueron luego repetidos controlando el consumo de mas de 6 onzas por semana. Encontramos que los valores significativamente diferentes entre ambos grupos, en la distribución de tejido adiposo, se incrementaban levemente, pero que estos niveles significativos no se modificaban, esencialmente, al comparar variables endocrinas.
Es de interés observar que el nivel o rango significativo para la diferencia en sangre de la SHBG quedó exactamente igual (p = 0.006). Finalmente, los tests de interacción para las diferencias entre los grupos, en relación con la distribución adiposa y variables endocrinas, fue repetido mientras se controlaba el consumo de alcohol. La interacción entre los niveles de testosterona sérica y WTR persistían (p = 0.033). Concluimos, que el alto grado de consumo de alcohol manifestado por ocho de las veintisiete fumadoras, no tuvo efectos sobre los resultados observados.
DISCUSION
Nuestra observación de que las fumadoras pre-menopáusicas muestran mayores WHR que las no fumadoras, es compatible con otro reporte de mujeres pre y post menopáusicas (36 ), estudiadas también como grupos no estratificados para el status menopáusico (37 ), pero no aclara las regiones exactas, afectadas por el hábito de fumar. Sin embargo, las fumadoras tenían perímetros de cintura y umbilicales mayores que las no fumadoras, pero los grupos no difirieron en el perímetro de cadera (Tabla 2). Adicionalmente, la falta de diferencia en la sumatoria de pliegues cutáneos centrales, indica que la adiposidad subcutánea en la región abdominal no es mayor en las fumadoras. Esto es coherente con un estudio que atribuye mayor WHR en fumadores, con más predominio del tejido adiposo intraabdominal que del tejido adiposo subcutáneo (38). Además, otros estudios en hombres, han demostrado que el fumar promueve la adiposidad androide producida, primariamente, por sus efectos sobre el perímetro de cintura (39), pero no sobre el de cadera (28, 39).
El perímetro de muslo menor y mayor WTR en las fumadoras (Tabla 2), indican un efecto adicional del fumar sobre los depósitos de grasa femoral en contraste con los depósitos de grasa en glúteos, donde no se observaron diferencias.
Observamos mayores concentraciones séricas de SHBG en mujeres fumadoras (p < 0.01). El otro único estudio que compara niveles de SHBG en fumadoras y no fumadoras pre-menopáusicas, halló además, que las fumadoras se caracterizaban por tener mayores niveles de SHBG que las no fumadoras (p < 0.051) (40). En mujeres post menopáusicas, dos estudios no hallaron diferencias en los niveles séricos de SHBG entre fumadoras y no fumadoras (41, 42), pero se observó, finalmente, una tendencia hacia mayores SHBG y menores niveles de estradiol libre (E2/ SHBG) en fumadoras (42). No se observaron diferencias significativas al estimar el estradiol libre entre fumadoras y no fumadoras. La dominancia estrogénica está, normalmente, asociada con altos niveles séricos de SHBG, y la dominancia androgénica lo está con bajos niveles de la misma. De este modo, observaciones de concentraciones elevadas de SHBG en mujeres fumadoras, implica altos niveles séricos de estrógenos y/o bajos niveles séricos de andrógenos, aunque no observamos diferencias significativas en los niveles séricos de testosterona total o niveles de estradiol. De hecho, aunque no significativo, el estradiol sérico era menor, casi en un 19%; y el cociente T/E2 era mayor en 17% en fumadoras (Tabla 3). Los datos sobre los esteroides sexuales no sustentan la dominancia estrogénica implicada por nuestras observaciones, sobre la significativamente mayor SHBG en fumadoras. Otras investigaciones han demostrado, consistentemente, concentraciones séricas elevadas de androstenediona en fumadoras (42, 45), encontrándose que la testosterona sérica era elevada en uno de estos estudios (43), y la concentración de DHEA-sulfato, en otro (42). Ninguno mostró diferencias séricas significativas de estradiol o estrona entre fumadoras y no fumadoras, pero la ausencia de diferencias puede explicarse por el hecho de que todos los grupos estaban compuestos por mujeres post menopáusicas. Las mujeres pre- menopáusicas no han sido suficientemente bien estudiadas: un estudio de mujeres mayores (edad media, alrededor de 50 años) no encontró efectos del fumar sobre la estrona o el estradiol sérico, pero si se observó una tendencia hacia mayores niveles séricos de testosterona (44). Dos investigaciones de mujeres embarazadas fumadoras y no fumadoras (5, 6), hallaron que las fumadoras tienen concentraciones significativamente bajas de estrona y estradiol séricos. Relacionado con los informes sobre niveles elevados de SHBG, estas observaciones sugieren que en mujeres fumadoras: a) El balance androgénico/ estrogénico se inclina en favor de los andrógenos; b) el hábito de fumar tiene efectos diferentes sobre los niveles de la SHBG y los esteroides sexuales; c) otros factores, además de las hormonas reproductivas, regulan la concentración de SHBG.
Por lo tanto, la SHBG no parece ser un marcador válido del balance relativo androgénico/estrogénico, cuando el fumar es el factor a analizar.
Es posible que este y otros estudios (40) de la elevación de los niveles séricos de SHBG en mujeres pre-menopáusicas puedan relacionarse con el incremento de la 2-hidroxilación del estradiol (11). Aunque requeriría replicación, ha sido demostrado, recientemente, que la SHBG podría inducir la inactivación periférica de la catecolamina estrógena 2-metoxiestradiol, con mayor afinidad que la testosterona, y que el complejo SHBG-2 metoxiestradiol es, además, biológicamente inactivo (46). De este modo, altas concentraciones de SHBG, en mujeres fumadoras, podrían reflejar un cambio funcional en el metabolismo estrogénico, representado no por un incremento de estrógenos, sino por un incremento en la conversión de los estrógenos en metabolitos inactivos, al unirse a la SHBG.
Junto con las observaciones de que altos niveles de SHBG incrementa la 2-hidroxilación del estradiol en fumadoras, es de interés observar que los bajos niveles de SHBG en mujeres obesas (47), van acompañados por un decrecimiento de la 2-hidroxilación (48). Estas observaciones sugieren que la concentración de SHBG podría estar relacionada con la 2-hidroxilación del estrógeno, pero esta hipótesis nunca ha sido probada. Puesto que raramente se han observado diferencias en los niveles séricos de los esteroides sexuales, el efecto antiestrogénico fundamental del hábito de fumar podría, ciertamente, involucrar un cambio en el comportamiento o en los mecanismos del metabolismo estrogénico, sin que hubiera un cambio concomitante en la producción de estrógenos.
El rol dimórfico sexual de los esteroides sexuales en la regulación de la distribución del tejido adiposo está apoyado por nuestros hallazgos, sobre el significado de los importantes efectos con que contribuyen la testosterona sérica total y la relación testosterona/estradiol (T/E2), sobre varios índices de la adiposidad regional para cada grupo-muestra, considerado como un todo.
La testosterona sérica contribuyó significativamente en la variación de WHR, WHBR y el perímetro de cintura. No estamos enterados de algún otro estudio que haya utilizado un diseño de análisis factorial de variación, para investigar la relación de los esteroides sexuales con la adiposidad regional, pero la contribución significativa de los niveles séricos de testosterona sobre el WRH está de acuerdo (o coincide) con las correlaciones positivas de la testosterona sérica total y el WHR en mujeres (20, 21). Correlaciones similares han sido halladas (en mujeres) con testosterona libre (18, 21), pero el presente estudio no halló una contribución significativa de la testosterona libre-estimada a través del índice de andrógeno libre - sobre la variación de ninguna variable antropométrica. No han sido reportadas, previamente, contribuciones significativas de la testosterona sérica sobre el WHbR y el perímetro de cintura.
La mayor parte de la variancia en el perímetro de cintura es explicada por la testosterona, lo que apoya la asociación de los andrógenos con la adiposidad abdominal "per se". La significativa contribución de la relación TIE2 sobre el WHR, UHR, el perímetro de cintura, el perímetro umbilical y SFc, apoya el concepto de que la distribución del tejido adiposo es una función del grado relativo de andrógenos sobre la actividad estrogénica.
Todavía no han sido reportados estudios, que hayan examinado la relación de T/E2 sobre los índices de adiposidad regional. Desde el momento que en el presente estudio, se hallaron significativas contribuciones del cociente T/E2 sobre la distribución adiposa corporal, ello marca evidencias para el concepto teórico de que el balance androgénico/ estrogénico tendría una utilidad empírica en relación a la distribución del tejido adiposo. Además, la utilización de la relación TIE2 al respecto, no necesita reunir "suposiciones" sobre la naturaleza del comportamiento de SHBG como un indicador del balance andrógeno/estrógeno, suposiciones que, no siempre, pueden ser sostenidas, como habíamos propuesto.
Sin embargo, la característica mas intrigante de este estudio fue el hallazgo de una significativa interacción entre el fumar y el nivel sérico de testosterona, en relación a la distribución del tejido adiposo.
Este hallazgo es de importancia biológica, indicando que la relación entre la testosterona sérica y el WHR es significativamente diferente entre fumadoras y no fumadoras. Para cualquier nivel dado de testosterona, el WHR fue mayor en fumadoras; la magnitud de esta diferencia se incrementa cuando aumenta la testosterona sérica. Pero, porqué causas el impacto relativo de la testosterona, sería mayor sobre la adiposidad androide, en las mujeres fumadoras?
Un efecto antiestrogénico del fumar puede ser, todavía, fundamental para este punto. Nosotros arguimos que fumar, al disminuir la biodisponibilidad de los estrógenos (posiblemente por elevar la concentración sérica de SHBG), incrementaría su degradación o conversión a formas inactivas o interferiría el reconocimiento estrogénico a nivel de los órganos. "blanco", incrementando la androgenicidad, independientemente de los niveles séricos de testosterona.
De este modo, la adiposidad androide sería mayor en fumadoras para cualquier valor de testosterona. Las hormonas sexuales femeninas promueven la lipólisis en la región abdominal y la lipogénesis en las regiones glútea y femoral (19, 49), resultando así la forma ginecoide en la mujer y en hombres, bajo tratamiento estrogénico, por alguna causa patológica.
La inhibición de estos efectos, por el fumar cigarrillos permitiría el desarrollo de la adiposidad androide; y pareciera ser por una mayor influencia de la testosterona, al respecto de este efecto.
Nuestros hallazgos, por consiguiente, proveen alguna explicación para la relación de la localización de la grasa abdominal con el fumar cigarrillos en humanos. Esta es una hipótesis razonable: que efectuando un cambio en el grado de la actividad androgénica relativa sobre la estrogénica, fumar induce una redistribución diferente de la grasa corporal en favor del depósito abdominal en mujeres en edad reproductiva, en quienes, primariamente, los depósitos grasos están normalmente almacenados en la región glúteo-femoral.
Posiblemente, confunde o limita la interpretación de los resultados el hecho de que las pruebas hormonales o ensayos estaban basados en una sola muestra de sangre tomada en la mitad de la fase folicular (en el 7mo. u 8vo. día del ciclo menstrual); la variabilidad intra e interindividual de la sincronización del ciclo menstrual, puede haber influido en los resultados observados.
En resumen, hemos provisto evidencias en apoyo a recientes reportes de la asociación del fumar con la adiposidad androide. Hemos implicado además, un efecto primario del fumar en la promoción de la adiposidad abdominal, en relación a las caderas, y observamos un efecto aparentemente inhibitorio sobre la adiposidad femoral. El no haber hallado diferencias entre fumadoras y no fumadoras pre-menopáusicas en la adiposidad subcutánea abdominal, a la par de un significativo mayor volumen abdominal, sugiere que el fumar promueve la adiposidad intraabdominal, apoyando la confirmación reciente de esta hipótesis "in vivo".
Diferencias no significativas fueron observadas entre los grupos, para los niveles séricos totales o libre de estradiol o testosterona, una observación aparentemente paradójica en vista de los altos niveles séricos de SHBG en fumadoras. El clásico concepto de que los niveles de SHBG, primariamente reflejarían el balance androgénico/estrogénico, necesita ser revisado. Encontramos que el impacto relativo de la testosterona sérica sobre la distribución del tejido adiposo, es significativamente mayor en fumadoras; para cualquier valor dado de testosterona, las fumadoras tenían mayor WHR y esta diferencia llegó a ser mayor, proporcionalmente cuando la concentración de testosterona aumentó.
Junto con las observaciones de la significativa contribución de los esteroides sexuales séricos sobre la variación de los índices de adiposidad regional, nuestros resultados indican que en mujeres jóvenes, las hormonas reproductivas están relacionadas con la distribución de la grasa corporal y sugiere que fumar, cambia la distribución del tejido adiposo desde la configuración ginecoide a la androide, a través de efectos interactivos con las hormonas sexuales.
Agradecimientos
Los autores expresan su gratitud a Thomas H. Hassard, Ph. D., Director de la Unidad de Consulta Bioestadística, Facultad de Medicina, Universidad de Manitoba, por su asistencia estadística. Estamos también en deuda con C. Stuart Houston, M.D., del Colegio de Medicina de la Universidad de Saskatchewan, por la revisión del manuscrito original y con el Sr. Derek Grant del Laboratorio de Endocrinología y Metabolismo del Centro de Ciencias de la Salud de Winnipeg, por su asistencia técnica.
Referencias
1. Hartz, A.J., Kelber, S., Borkowf, H., Wild, R., Gillis, B.L. & Rimm, A.A (1987). The association of smoking with clinical indicators of altered sex steroids - a study of 50, 145 women. Public Health Rep 102, 254-259
2. Williams, A.R., Weiss, N.S., Ure, C.L., Ballard, J. & Daing, J.R (1982). Effect of weight, smoking and estrogen use on the risk of hip and forearm fractures in post menopausal women. Obstet Gynecol 60, 695-699
3. Lesko, S.M., Rosenberg, L., Kaufman, D.W., et al (1985). Cigarette smoking and the risk of endometrial cancer. N Engl J Med 313, 593-596
4. Gam, S.M (1985). Smoking and human biology. Hum Biol 57,505-523
5. Mochizuki, M., Maruo, T., Masuko, K. & Ohtsu, T (1984). Effects of smoking on fetoplacental-maternal system during pregnancy. Am J Obstet Gynecol 149, 413-420
6. Bernstein, L., Pike, M.C., Lobo, R.A., Depue, R.H., Ross, R.K. & Henderson,B.E (1989). Cigarette smoking in pregnancy results in marked decrease in maternal hCG and oestradiol levels. Br J Obstet Gynecol 96, 92-96
7. MacMahon, B., Trichopoulos, D., Cole, P. & Brown, J (1982). Cigarette smoking and urinary estrogens. N Engl J Med 307, 1062-106.5
8. Mattison, D.R. & Thorgeirsson, S.S (1978). Smoking and industrial polution, and their effects on menopause and ovarian cancer. Lancet i, 187-188
9. Barbieri, R.L., Gochberg, J. & Ryan, K.J (1986). Nicotine, cotinine, and anabasine inhibit aromatase in human trophoblast in vitro. J Clin Invest 77 1727-1733
10. Barbieri, R.L., McShane, R.M. & Ryan, K.J (1986). Constituents of cigarette smoke inhibit human granulosa cell aromatase. Fertil Steril 46, 232-236
11. Michnovicz, J.J., Herschopf, R.J., Naganuma, H., Bradlow, H.L. & Fishman, J (1986). Increased 2-hydroxylation of estradiol as a possible mechanism for the antiestrogenic effect of cigarette smoking. N Engl J Med 315, 1305-1309
12. Tensen, J., Christiansen, C. & Rodbro, P (1985). Cigarette smoking, serum estrogens, and bone loss during hormone-replacement therapy early after menopause. N Engl J Med 313, 973-975
13. Vague, J (1956). The degree of masculine differentiation of obesities. Am J Clin Nutr 4, 20-34
14. Roncari, D.A.K. & Van, R.L.R (1978). Promotion of human adipocyte precursor replication by 17-beta-estradiol in culture. J Clin Invest 62, 503-508
15. Rolland-Cachera, M.-F., Bellisle, F., Deheeger, M., Peguignot, F & Sempe, M (1990). Influence of body fat distribution during childhood on body fat distribution in adulthood: a two-decade follow-up study. Int J Obes 14, 473-481
16. Krakower, G.R., James, R.G., Arnaud, C., Etienne, J., Keller, R.H. & Kissebach, A.H (1988). Regional adipocyte precursors in the female rat: influence of ovarian factors. Clin Invest 81, 641-648
17. Ridder, C.M., Bruning, P.F., Zonderland, M.L. et al (1990). Body fat mass, body fat distribution, and plasma hormones in early puberty in females. J Clin Endocrinol Metab 70, 888-893
18. Evans, D.J., Hoffman, R.G., Kalkhoff, R.K. & Kissebah, A.H (1983). Relationship of androgenic activity to body fat mass topography, fat cell morphology, and metabolic aberrations in premenopausal women. J Clin Endocrinol Metab 57, 304-310
19. Rebuffe-Scrive, M (1987). Sex steroid hormones and adipose tissue metabolism in ovariectomized and adrenalectomized rats. Acta Physiol Scand 129, 471-477
20. Kirschner, M.A., Samojlik, E., Drejka, M., Szmal, E., Schneider, G., & Ertel, N (1990). Androgen-estrogen metabolism in women with upper body versus lower body obesity. J Clin Endocrinol Metab 70, 473-479
21. Seidell, J.C., Cigolini, M., Charzewska, J. et al (1990). Androgenicity in relation to body fat distribution and metabolism in 38-year-old women. The European fat distribution study. J Clin Epidemiol 43, 21-34
22. Seidell, J.C., Cigolini, M., Deurenberg, P., Oosterlee, A. & Doornbos, G (1989). Fat distribution, androgens, and metabolism in non-obese women. Am J Clin Nutr 50, 269-273
23. Kurtz, B.R., Givens, J.R., Komindr, S. et al (1987). Maintenance of normal circulating levels of delta 4-androstenedione and dehydroepiandrosterone in simple obesity, despite increased metabolic clearance rates: evidence for a servo-control mechanism. J Clin Endocrino) Metab 64, 1261-1267
24. Vague, J., Meignem, J.M. & Negrin, J.F (1984). Effects of testosterone and estrogens on deltoid and trochanter adipocytes in two cases of transsexualism. Horm Metab Res 16, 380-381
25. Lapidus, L., Bergstsson, C., Larsson, B., Pennert, K., Rybo, E. & Sjostrom, L (1984). Distribution of adipose tissue and risk of cardiovascular disease and death: a l2 year follow up of participants in the population study of women in Gothenburg, Sweden. Br M J 289, 1257-1261
26. Hartz, A.J., Rupley, D.C. & Rimm, A.A (1984). The association of girth measurements with disease in 32,856 women. Am J Epidemiol 119,71-80
27. Albanes, D., Jones, Y., Micozzi, M.S. & Mattson, M.E (1987). Associations between smoking and body weight in the US population: analysis on NHANES II. Am J Public Health 77,439-444
28. Shimokata, H., Muller, D.C. & Andres, R (1989). Studies in the distribution of body fat.III. Effects of cigarette smoking. JAMA 261, 1169-1173
29. Ross, W.D. & Marfell-Jones, M.I (1982). Kinanthropometry. In Physiological Testing of the Elite Athlete, eds S.D. McDougall, H.A. Wenger, H.A. Green, pp 75-115. Ottawa: Mutual
30. Rice, P.L (1988). Relationship of estrogen to strength, percent body fat and oxygen uptake in women. J Sports Med Phys Fitness 28,145-150
31. Longcope, C., Baker, R. & Johnston, C.C (1986). Androgen and estrogen metabolism: relationship to obesity. Metabolism 35, 235-237
32. Longcope, C., Kato, T. & Horton, R (1969). Conversions of blood androgens to estrogens in normal adult men and women. J Clin Invest 48, 2191-2201
33. Longcope, C., Layne, D.S. & Tiat, J.F (1986). Metabolic clearance rates and interconversions of estrone and 17B(beta)-estradiol in normal males and females. J Clin Invest 47, 93-106
34. Garn, S.M., Leonard, W.R. & Hawthorne, V.M (1986). Three limitations of the body mass index (letter). Am J Clin Nutr 44, 996-997
35. Marshall, J.D., Hazlett, C.B., Spady, D.W., Conger, P.R. & Quinney, H.A (1991). Validity of convenient indicators of obesity. Hum Biol 63,137-153
36. Tonkelaar, I.D., Seidell, J.C., van Noord, P.A.H., Baanders-van Halewijn, E.A., Jacobus, J.H. & Bruning, P.F (1989). Factors influencing waist/hip ratio in randomly selected pre and post menopausal women in the Dom-Project (preliminary results). Int J Obes 13, 817-824
37. Haffner, S.M., Stern, M.P., Hazuda, H.P., Pugh, J., Patterson, J.K. & Malina, R (1986). Upper body and centralized adiposity in Mexican Americans and non-Hispanic whites: relationship to body mass index and other behavioral and demographic variables. Int J Obes 10, 493-502
38. Seidell, J.C., Bjorntorp, P. & Sjostrom, L (1991). Abdominal obesity and metabolism in men; possible role of behavioural characteristics. In Obesity in Europe (1988) eds P. Bjorntorp, S. Rossner, pp. 91-99. London: John Libbey
39. Selby, J.V., Newman, B., Quesenberry, C.P. et al (1990). Genetic and behavioral influences on body fat distribution. Int J Obes 14, 593-602
40. Moore, J.W., Key, T.J.A., Bulbrook, R.D. et al (1987). Sex hormone binding globulin and risk factors for breast cancer in a population of normal women who had never used exogenous sex hormones. Br J Cancer 56, 661-666
41. Lapidus, L., Lindstedt, G. & Lundberg, P.A (1986). Concentrations of sex hormones binding globulin and corticosteroid binding globulin in serum in relation to cardiovascular disease and overall mortality in post-menopausal women. Clin Chem 32, 146-152
42. Khaw, K.T., Tazuke, S. & Barret-Connor, E (1988). Cigarette smoking and levels of adrenal androgens in postmenopausal women. N Engl J Med 318, 1705-1709
43. Friedman, A.J., Ravnikar, V.A. & Barbieri, R.L (1987). Serum steroid hormone profiles in post menopausal smokers and non-smokers. Fertil Steril 47,398-401
44. Longcope, C. & Johnston, C.C (1988). Androgen and estrogen dynamics in pre and postmenopausal women: a comparison between smokers and non-smokers. J Clin Endocrinol Metab 67, 379-383
45. Cauley, J.A., Gutai, J.P., Kuller, L.H., LeDonne, D. & Powell, J.G (1989). The epidemiology of serum sex hormones in post menopausal women. Am J Epidemiol 129, 1120-1131
46. Cauley, J.A., Gutai, J.P., Kuller, L.H., LeDonne, D. & Powell, J.G (1989). The epidemiology of serum sex hormones in post menopausal women. Am J Epidemiol 129, 1120-1131
47. Rosner, W (1991). The direct participation of SHBG in the effects of steroid hormones. Proceedings of the Annual Meeting of the Canadian Fertility and Andrology Society. September 11- 14, Quebec City
48. Grenman, S., Ronnemaa, T., Irjala, K., Kaihola, H.L. & Gronroos, M (1986). Sex steroid, gonadotropin, cortisol, and prolactin levels in healthy, massively obese women: correlation with abdominal fat cell size and effect of weight reduction. J Clin Endocrinol Metab 63, 1257-1261
49. Schneider, J., Bradlow, H.L., Strain, G., Lebin, J., Anderson, K. & Fishman, J (1983). Effect of obesity on estradiol metabolism: decreased formation ofnonuterotropic metabolites. J Clin Endocrinol Metab 56, 973-979
50. Rebuffe-Scrive, M., Lonnroth, P., Marin, P., Wesslau, C., Bjorntorp, P. & Smith, U (1987). Regional adipose tissue metabolism in men and post menopausal women. Int J Obes 11, 347-355