Influencia de la Pérdida de Peso Corporal sobre el Umbral Anaeróbico en Mujeres Obesas
Mitsumasa Miyashita6, Józef Langfort3, Agnieszka Golab1, Barbara Zahorska-Markiewicz2, Michal Holecki4, Piotr Koceak5, Magdalena Olszanecka-Glinianowicz5 y Jerzy Chudek1
1Department and Unit of Pathophysiology, Medical University of Silesia, Katowice, Poland.
2Obesity Management Clinic “Waga”, Katowice, Poland.
3Department of Physiology, Academy of Physical Education, Katowice, Poland and Laboratory of Experimental Pharmacology, Polish Academy of Science, Warsaw, Poland.
4Department of Internal Medicine and Metabolic Diseases.
5Health Promotion and Obesity Management.
6Department of Cardiology, Medical University of Silesia, Katowice, Poland.
Artículo publicado en el journal PubliCE del año 2010.
Publicado 21 de febrero de 2011
Resumen
Palabras clave: obesidad, umbral anaeróbico, umbral de lactato, umbral ventilatorio
INTRODUCCION
La obesidad se produce por el desequilibrio entre el consumo y el gasto energético, lo que lleva a una acumulación de grasa corporal. El exceso de acumulación de grasa, combinado con una disminución de los niveles de actividad física en los individuos obesos está asociado con serias consecuencias médicas y con una mayor morbidez y mortalidad (Shepherd A, 2009). Además, la obesidad está relacionada con la aparición frecuente de resistencia a la insulina, lo que puede influenciar los procesos metabólicos durante el ejercicio (Salvadori et al., 2004).
El umbral anaeróbico es un parámetro importante que refleja la capacidad de resistencia, además del consumo de oxígeno. El umbral anaeróbico podría calcularse mediante métodos directos (midiendo la concentración de lactato) e indirectos (en base a los parámetros ventilatorios). Se define al umbral de lactato como el punto en el que la concentración de lactato en sangre comienza a aumentar por encima del valor de reposo, lo que indica el punto de desequilibrio inicial entre la producción y la eliminación de lactato muscular durante un ejercicio incremental (Meyer et al. 2005). A diferencia del umbral de lactato, el umbral ventilatorio puede no ser el resultado del aumento de la concentración de lactato sérico durante el ejercicio, como se suponía previamente (Wasserman et al., 1973; 1994).
El umbral de lactato depende de muchos factores, incluyendo los sustratos energéticos que se utilizan durante el ejercicio. La concentración de lactato depende de la dieta consumida (Langfort, 1996). Una dieta alta en carbohidratos disminuye el metabolismo de los lípidos, mientras que una baja en carbohidratos con reservas de grasa elevadas favorece el incremento de la utilización de grasa y disminuye el metabolismo de los carbohidratos (Jasson y Kaiser, 1982). Al parecer, esto explica los datos divergentes con respecto al umbral de lactato alcanzado en relación con las modificaciones de la dieta (Costil et al., 1977; Yoshida, 1986).
Las consecuencias metabólicas y físicas de un exceso de masa corporal en condiciones tales como la obesidad podrían influenciar los umbrales ventilatorio y de lactato. Una elevada concentración de ácidos grasos libres circulantes puede influenciar el umbral de lactato (Hulens et al., 2001; Rowland, 1991). Existen pocas publicaciones que abordan los umbrales anaeróbicos en los pacientes obesos (Colak y Ozcelik, 2004; Hulens et al., 2001; Ozcelik et al., 2006; Rowland, 1991; Salvadori et al., 1991; 1992).
El objetivo del presente estudio ha sido evaluar el umbral anaeróbico utilizando dos métodos diferentes en mujeres obesas y de peso normal, y analizar el efecto de la terapia de reducción de peso sobre los umbrales determinados.
METODOS
En este estudio se inscribieron cincuenta y nueve mujeres. A todas las participantes se las diagnosticó con obesidad (IMC ≥ 30 kg·m-2), sin enfermedades concomitantes. Los criterios de exclusión fueron la evidencia de cualquier enfermedad, terapia de drogas, contraindicación para realizar una prueba de ejercicios y consumo de tabaco. El protocolo de estudio fue aprobado por el Comité de Ética de la Universidad de Medicina de Silesia y todas las participantes dieron su consentimiento por escrito para participar en el estudio.
El análisis sólo se llevó a cabo en mujeres obesas con una duración de ejercicio que excedía los 9 minutos correspondientes a la carga de 75 W. Por último, el grupo examinado consistió de 42 mujeres (edad 30.5 ± 6.9 años; BMI 33.6 ± 3.7 kg·m-2, Tabla 1).
Todas las mujeres obesas participaron de una terapia de reducción de peso de 3 meses que consistió de una dieta balanceada de 1000-1200 kcal/día y ejercicios físicos regulares recomendados (no menos de tres veces por semana durante alrededor de 30 minutos que incluyeron: caminata, pedaleo y natación; 60-70% de la frecuencia cardiaca máxima – HRmáx.).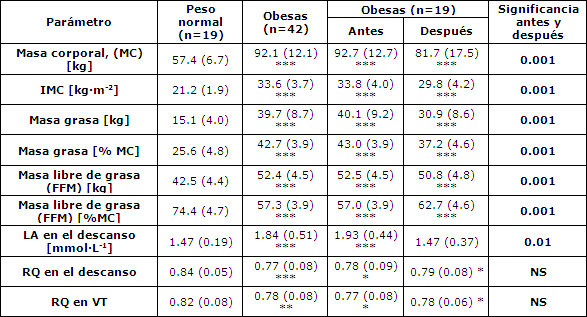
Tabla 1. Características de las mujeres de peso normal y las mujeres obesas y resultados de la terapia para la reducción de peso corporal. Los datos son medias (± DE). Significancia estadística vs grupo de peso normal *** p < 0.001; ** p < 0.01; * p < 0.05.
Durante una compleja terapia grupal de pérdida de peso de 3 meses, cada segunda semana todas las pacientes participaron de un asesoramiento con un médico, un nutricionista (una hora), y de una sesión de psicoterapia de una hora (se utilizaron métodos cognitivos y conductuales). A cada participante se le pidió que registrara en un diario la comida ingerida y el tipo y duración de la actividad física. Antes de la terapia compleja consumían 35 % de grasas, 19% de proteínas y 45% de carbohidratos. Durante la terapia, la dieta contuvo 19% de grasas, 25% de proteínas y 56% de carbohidratos.
Después del programa de reducción de peso corporal, se volvió a examinar a 26 mujeres del grupo de estudio (edad promedio 31.6 ± 7.4 años; peso corporal 83.8 ± 13.9 kg; IMC 29.4 ± 6.5 kg·m-2). Durante la re-examinación siete pacientes interrumpieron el test incremental de manera prematura y fueron excluidas. Por último, se incluyeron 19 mujeres en el análisis. Los parámetros antropométricos iniciales y la edad de este grupo no diferían de manera significativa de los de todos los participantes obesos (Tabla 1).
Además, se analizó a 26 mujeres con peso normal, 19 de las cuales estaban incluidas en el estudio como grupo de control (Tabla 1). La razón del elevado índice de abandono, tanto para las mujeres obesas como para las de peso normal, fue la temprana discontinuidad de la prueba debido a la fatiga y el dolor de las articulaciones de la rodilla.
La masa corporal se midió utilizando una balanza Tanita y la altura se midió utilizando un estadiómetro colocado en la pared. El IMC se calculó como el peso en kilogramos dividido por la altura en metros cuadrados (kg·m-2). La obesidad y el peso normal se diagnosticaron según el criterio de la WHO (IMC ≥30 kg·m-2 y < 25 kg·m-2, respectivamente).
La composición corporal se midió utilizando el método de impedancia bioeléctrica desde la mano hasta el pie utilizando el analizador de composición corporal Bodystat 1500. A los participantes se los examinó sin zapatos y en traje de baño durante la mañana, en comodidad térmica. Después de la terapia de reducción de peso se repitieron todas las mediciones.
Antes de las pruebas se analizó la composición de tres días de dieta. La dieta de los participantes con peso normal contenía aproximadamente 20% de grasas, 25% de proteínas y 55% de carbohidratos. La descripción de la dieta de las participantes obesas se mencionó anteriormente. Para cada participante del estudio se obtuvo un antecedente de actividad física de tres meses. El 19% de las mujeres obesas reportaron una actividad física muy baja; el 24%, baja; el 52%, media; y sólo el 5%, elevada; mientras que el 6% de las participantes de peso normal reportaron una actividad física muy baja; el 10%, baja; el 79%, media; y el 5%, elevada. En el análisis de actividad física se tuvo en cuenta el tipo de ocupación. Cabe destacar que la ingesta de comida auto-informada por los participantes obesos a menudo es más baja, pero la actividad física es más elevada.
Antes de la prueba de ejercicios, a cada participante se le realizó un ECG. La prueba de ejercicios incremental en el cicloergómetro (Monark) se llevó a cabo después de un ayuno nocturno. La prueba de ejercicios comenzó con una carga de 25W, y luego la carga de trabajo se incrementó en 25W cada 3 minutos hasta el momento del agotamiento. A la finalización de la prueba le siguió un período de 5 minutos durante el cual los sujetos se mantuvieron en posición de sentado en el cicloergómetro. El consumo de oxígeno (VO2máx) y las respuestas metabólicas se midieron utilizando el sistema metabólico START 2000 (MES), que analiza los gases respiratorios respiración por respiración. Los valores se promediaron por minuto y los valores finales derivaron del último minuto de cada carga (cuando se tomaron las muestras de sangre). Antes de cada prueba, se calibraron los analizadores utilizando gases de concentración conocida (5% de CO2, 12% de O2 y equilibrio del N2 y el volumen de calibración) por medio de una jeringa estandarizada.
Durante el reposo y al final de cada carga, se tomaron muestras de sangre en la yema del dedo para evaluar la concentración de lactato en sangre (LA). La concentración de lactato en sangre LA se midió de manera enzimática utilizando kits comerciales (Boehringer Gmbh, Mannheim, Alemania). La ∆LA se calculó como una diferencia entre la concentración de lactato en cada nivel durante la prueba y el valor de reposo. El umbral de lactato (umbral aeróbico, LT) se expresó como el consumo de oxígeno y se determinó mediante un análisis de regresión del modelo de dos curvas determinadas mediante la expresión de los datos en la forma log[LA] versus log[VO2], según lo describieron Beaver et al. (1985). Los datos del LA versus el VO2 fueron divididos en dos segmentos ajustados con regresiones lineales. Si se hallaba una desviación significativa de la linealidad, se designaba como umbral de lactato al punto de referencia que delimitaba los segmentos con la mayor diferencia de pendiente. La Figura 1 muestra las determinaciones del LT y VT para un paciente.
El umbral ventilatorio se determinó por medio del límite individual sobre el VE/VO2 a través de las curvas de consumo de oxígeno utilizando todos los datos de la respiración. El umbral estaba ubicado en el lugar en que la curva de VE/VO2 se inclinaba hacia arriba (Ekkekakis et al., 2008; Ohuchi et al., 1996, Figura 1). Asimismo, se determinaron todos los umbrales en relación con el peso corporal y la masa libre de grasa (FFM).
Figura 1. Método de determinación de los umbrales de lactato (A) y ventilatorio (B) para una participante. VO2 – consumo de oxígeno; VE/VO2 – equivalente ventilatorio para el oxígeno; LA: concentración de lactato en sangre.
Análisis Estadísticos
Todos los valores están expresados como medias ± desviación estándar. Todos los análisis se realizaron utilizando el software Statistica 6.0. La normalidad de la distribución se analizó utilizando el test de Kołmogorov-Smirnov. Se utilizó la comparación U para datos apareados de Manna-Whitney para muestras independientes y la comparación de datos apareados de Wilcoxon para muestras dependientes. Los coeficientes de correlación se calcularon según el test de Spearman. Los valores de P < 0.05 se consideraron estadísticamente significativos.
RESULTADOS
Comparación de las Mujeres Obesas y Delgadas
En reposo, la concentración de lactato en sangre fue significativamente más elevada, y el cociente respiratorio (RQ) fue significativamente más bajo en las mujeres obesas que en el grupo de control. Durante el ejercicio la concentración de lactato en sangre y el RQ se incrementó después de la carga de 50W, con valores significativamente más bajos en las participantes obesas (Figuras 2 y 3). El consumo de oxígeno en reposo y durante el ejercicio fue más elevado en las mujeres obesas que en las de peso normal (Tabla 2), pero a partir de las diferencias de 75W perdieron significancia. En la Tabla 3 se presentan los datos de la VE y el VE/VCO2.
El umbral de lactato (LT) expresado como la cantidad de consumo de oxígeno fue significativamente más elevado en las mujeres obesas que en el grupo de control. Sin embargo, los umbrales de lactato en relación con el peso corporal y la masa libre de grasa fueron más bajos en las personas obesas (Tabla 4). Un patrón similar se observó en los umbrales ventilatorios (Tabla 4).
Tanto en las mujeres obesas como en las de peso normal los umbrales de lactato fueron más elevados que los ventilatorios (Tabla 4). En todo el grupo y en las mujeres obesas, pero no en las de peso normal, se observó una correlación significativa entre el LT [L·min-1] y el VT [L·min-1] (R = 0.398, p ≤ 0.001; R = 0.366, p = 0.017 y R = 0.232, p = 0.34, respectivamente).
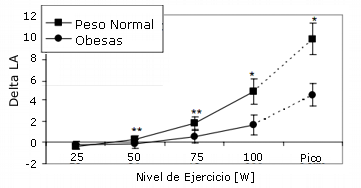
Figura 2. Diferencia entre la concentración de lactato para cada nivel de ejercicio durante el test y el valor en reposo en mujeres obesas y con peso normal. * p < 0.05; ** p < 0.01; *** p < 0.001.
Efectos de la Reducción de Peso sobre los diferentes Umbrales
La pérdida de peso promedio exhibida por los sujetos fue del 12.3 ± 4.2 % del peso inicial (Tabla 1). Después de la reducción de peso sólo una mujer logró el peso normal. Once tenían sobrepeso (rango de IMC 25.6-29.8 kg·m-2) y 7 aún continuaban siendo obesas (rango de 30.1-39.7 kg·m-2).
Después de la reducción de peso las concentraciones de lactato en sangre y el RQ no cambiaron de manera significativa. Asimismo, el incremento de la concentración de lactato y el RQ en el ejercicio fueron similares a antes de la reducción de peso. El VO2pico después de la terapia de reducción de peso no cambió de manera significativa (1.66 ± 0.28 L·min-1 vs 1.78 ± 0.28 L·min-1).
La reducción de peso obtenida no influenció el umbral de lactato (1.12 ± 0.21 vs 1.13 ± 0.15) ni el umbral ventilatorio (0.89 ± 0.17 L·min-1 vs 0.94 ± 0.25 L·min-1) (Tabla 4). Asimismo, hubo una aparición temprana del umbral ventilatorio después de la terapia de reducción de peso (Tabla 4). No se ha observado ningún cambio en los umbrales de consumo de oxígeno (% VO2pico) (Tabla 4).
DISCUSION
Este estudio ha demostrado que ambos umbrales, el ventilatorio y el de lactato, aparecen a un mayor consumo de oxígeno en las mujeres obesas en comparación con lo que se observa en las mujeres de peso normal. Además, la pérdida de peso del 12% obtenida no fue suficiente para provocar cambios significativos en los umbrales.
La cuestión del umbral ventilatorio en los obesos se ha investigado con anterioridad. Salvadori et al., examinaron la influencia de la obesidad sobre el umbral anaeróbico medido por el cambio de los parámetros ventilatorios durante el esfuerzo físico (Salvadori et al, 1991; 1992).
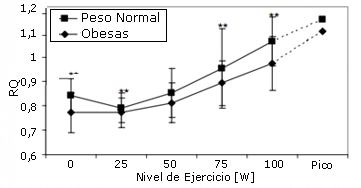
Figura 3. RQ en reposo y durante la prueba de ejercicio en mujeres obesas y los controles de peso normal. * p < 0.05; ** p < 0.01.
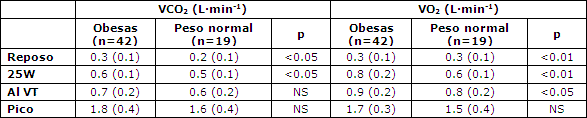
Tabla 2. VO2 y VCO2 en reposo y durante el ejercicio en los grupos examinados. Los datos son medias (± DE).
Las pacientes obesas tuvieron un nivel pico similar, pero el umbral ventilatorio fue significativamente más elevado en las participantes de peso normal que en las obesas. Los resultados de este estudio son opuestos a nuestros hallazgos. Las diferencias pueden ser resultado de un mayor grado de obesidad en las pacientes examinadas por Salvadori et al. (IMC promedio 40 kg·m-2 y 33 kg·m-2, respectivamente). Cabe destacar que el autor citado no determinó umbrales en relación con la masa absoluta y la masa libre de grasa. Aquí se halló que el umbral ventilatorio fue significativamente más bajo en las mujeres obesas que en las de peso normal cuando se lo presenta con relación al peso corporal, pero similar en relación con la masa libre de grasa. Según estos resultados, Rowland (1991) demostró que el umbral ventilatorio estimado en relación con el peso corporal fue significativamente más bajo en los pacientes obesos.
El consumo de oxígeno en reposo y durante el ejercicio fue más elevado en las mujeres obesas que en las de peso normal debido a un gasto de energía incrementado por la carga del propio cuerpo y el bajo nivel de aptitud física. La ausencia de una diferencia significativa del consumo de oxígeno con la cargas de trabajo de 75, 100 y 125W y en el pico de ejercicio puede explicarse mediante el número limitado del grupo de estudio y lo sugerido por Salvadori et al., en relación con una incrementada extracción del O2 periférico en los obesos (Salvadori et al., 2004; 2008).
Como se mencionó previamente, tanto el umbral ventilatorio como el VO2pico no cambiaron después de la compleja terapia de reducción de peso, a la que no le siguió una normalización del peso corporal. Por tanto, todas, excepto una participante, permanecieron con sobrepeso o continuaron siendo obesas. Otros investigadores observaron resultados similares (Hakala et al., 1996, Larssonn y Mattsson, 2003). Estos autores no observaron la mejora en la eficiencia física después del VLCD sin actividad física regular. A pesar del uso de la actividad física moderada (50-60% VO2máx, 3-4 veces por semana durante 45-60 min) Shinkai et al. (1994) tampoco observaron un incremento del consumo de oxígeno en el ejercicio pico. Resultados similares presentaron Utter et al. (1998), quienes examinaron la influencia de la dieta sola y junto con una actividad física incrementada (5 días por semana al 60-80% VO2máx). La terapia de reducción de peso duró 12 semanas. Se observó un incremento del 9.7% en el VO2máx sólo en el grupo con actividad física incrementada. Asimismo, Ashutosh (1997) observó un 11.6% de incremento del VO2 en el pico del ejercicio después de la terapia de reducción de peso con actividad física regular (3 veces por semana durante 45-60 min). Estos resultados podrían indicar que la actividad recomendada para estos individuos durante el programa de reducción de peso no fue suficiente para afectar su capacidad medida por el umbral ventilatorio y el consumo de oxígeno. A cada participante se le hizo una recomendación para que incremente la actividad diaria y que implemente un ejercicio auto-organizado tres veces por semana durante al menos 30 minutos. Sólo algunas declararon asistir a un establecimiento estructurado. En tales circunstancias, es difícil esperar una actividad física en el nivel del 50-70% VO2máx. El bajo nivel de actividad física durante la terapia de reducción de peso en el presente estudio sigue la línea de la significativa pérdida de masa magra corporal. Un rasgo característico de la terapia de reducción de peso exhaustiva es evitar la perdida de la masa magra corporal.
También se observó un umbral de lactato más elevado en las mujeres obesas que en las de peso normal. En las mujeres obesas y en las de peso normal el umbral de lactato apareció a un consumo de oxígeno más elevado que el umbral ventilatorio. Debe discutirse la cuestión del tiempo en el cual aparecen el umbral de lactato y ventilatorio, también teniendo en cuenta las limitaciones de la estimación del umbral de lactato (determinación de las concentraciones de lactato en sangre en intervalos de 3 minutos).
Se han descrito numerosos métodos de determinación de los umbrales (Bosquet et al., 2002; Ekkekakis et al., 2008; Meyer et al., 2005; Ohuchi et al., 1996). Los modelos de lactato disponibles encajan casi exclusivamente en una de dos categorías: 1) El primer incremento en las concentraciones de lactato en sangre por encima de los valores de reposo durante un test de ejercicio incremental (umbral de lactato aeróbico, LT1) y 2) El máximo estado estable de lactato que representa la intensidad del ejercicio por encima del cual es inevitable un incremento en el lactato en sangre (umbral anaeróbico, LT2) (Meyer et al., 2005). Según la teoría de Wasserman, el umbral ventilatorio es una respuesta a una ventilación incrementada conducida por un elevado VCO2 que resulta de la amortiguación de protones (Wasserman et al., 1973). Sin embargo, otros estudios probaron que la aparición del umbral ventilatorio es independiente de la concentración de lactato (Cecca et al., 1986; Gaesser y Poole, 1986; Hagberg et all., 1982; Hughes et al., 1982), pero está relacionada con otros factores tales como la concentración sérica de potasio (Lindinger y Sjogaard., 1991). Se ha sugerido que durante el ejercicio, los individuos con sobrepeso utilizan de manera predominante ácidos grasos libres (FFA) debido al reducido consumo de glucosa en los tejidos, como efecto de la resistencia a la insulina y a un mayor almacenamiento de grasa intramuscular (Perseghin et al., 1999, Salvadori et al., 2004; Weiss R et al., 2003).
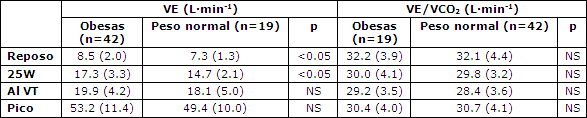
Tabla 3. VE y VE/VCO2 en reposo y durante el ejercicio en los grupos examinados. Los datos son medias (± DE).
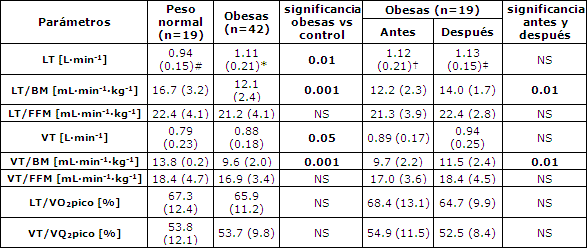
Tabla 4. Umbrales de los grupos examinados. Los datos son medias (± DE). * p < 0.001 LT vs VT en mujeres obesas, # p < 0.01 LT vs VT en mujeres de peso normal, † p < 0.001 LT vs VT en mujeres obesas antes de la terapia, ‡p < 0.01 LT vs VT en mujeres obesas después de la terapia. LT: umbral de lactato; VT: umbral ventilatorio; BM: masa corporal; FFM: masa libre de grasa.
Los niveles más bajos de lactato durante el ejercicio respaldan esta hipótesis. En consecuencia, en los obesos se observa un nivel de lactato más elevado y valores del RQ más bajos en reposo y durante el ejercicio. Estos resultados concuerdan con estudios previos (Kelman et al., 1975; Maughan et al., 1978; Salvadori et al, 2008; Yoshida, 1986).
La dieta es otro factor que puede influenciar el umbral de lactato. Este tema se ha investigado previamente en individuos con peso normal arrojando resultados contradictorios. Ivy et al. (1981) y Hughes et al. (1982) han demostrado que el umbral de lactato aumentó en las condiciones de FFA elevados o depleción glucógenica en los músculos. Por otro lado, Powers et al. (1983) han demostrado que la incrementada concentración sérica de FFA después de la ingesta de café no influenció la concentración de lactato en sangre. Asimismo, Yoshida (1986) no observó cambios en los umbrales de lactato y ventilatorio con dietas altas y bajas en carbohidratos. La ausencia de cambios esperados en el umbral ventilatorio se explicó mediante la inmediata amortiguación del lactato en la sangre por medio del sistema de bicarbonato.
Debe suponerse que una concentración sérica de FFA más elevada en los obesos facilita el metabolismo de las grasas durante el ejercicio. De hecho, Goodpaster et al. (2002) demostraron que durante el ejercicio moderado, los hombres obesos sedentarios habían incrementado los índices de oxidación de los ácidos grasos a partir de fuentes no plasmáticas y reducido el índice de oxidación de los carbohidratos, en particular el glucógeno muscular, en comparación con los hombres delgados sedentarios. Esta observación podría respaldar los hallazgos del presente estudio - el bajo incremento de la concentración de lactato en sangre durante el ejercicio y un umbral de lactato más elevado en las mujeres obesas que en las de peso normal. Ardevol et al. (1998) también demostraron con anterioridad umbrales de lactato más elevados en las mujeres obesas.
La limitación del presente estudio es la extraña (en intervalos de 3 minutos) determinación de la concentración de lactato en sangre, disminuyendo la precisión del cálculo del umbral. En consecuencia, se puede suponer que los valores de los umbrales de lactato están sobrevalorados de alguna manera. No obstante, este error es similar tanto para las mujeres obesas como para las de peso normal. Por tanto, es necesario realizar más estudios para calcular el umbral de lactato con una mayor precisión en los obesos.
Cabe destacar que la mayoría de los estudios realizados con respecto a la influencia de la reducción de peso sobre los parámetros ventilatorios, y sobre el umbral ventilatorio (Colak and Ozcelik, 2004; Ozcelik et al., 2006; Salvadori et al., 1992; 1993; 1999; Sartorio et al., 2003) no proporciona información sobre la concentración de lactato y el umbral de lactato durante el ejercicio físico antes y después de la terapia de reducción de peso. Los estudios publicados conciernen mayormente a individuos saludables, atletas o a personas que sufren de diabetes t.2 y enfermedad coronaria (Belli et al., 2007; Omija et al., 2004). Según lo que se conoce, la relación entre los valores del umbral medidos por medio de parámetros ventilatorios y la concentración del lactato no se ha estudiado en personas obesas.
CONCLUSION
Los resultados concluyeron que: (1) El umbral de lactato más elevado que se observó en las mujeres obesas puede estar relacionado con el incremento de la utilización del ácido graso en el metabolismo. (2) Tanto en las mujeres obesas como en las de peso normal el umbral de lactato aparece en el consumo de oxígeno más elevado en vez del umbral ventilatorio. (3) La reducción de peso obtenida (12%), sin la normalización del peso, no fue suficiente para producir cambios significativos en los umbrales de lactato y ventilatorio en las mujeres obesas.
Referencias
1. Ardevol, A., Adan, C., Franco, L., Garcia-Lorde, P., Rubio, F., Remesar, X., Fernandez-Lopez, J.A., Salas-Salvado, J. and Alemeny, M (1998). During intense exercise, obese women rely more than lean women on aerobic energy. Pflugers Archiv-European Journal of Physiology 43, 495-502
2. Ashutosh, K., Methrotra, K. and Fragale-Jackson, J (1997). Effects of sustained weight loss and exercise an aerobic fitness in obese women. Journal of Sports Medicine Physicals Fitness 37, 252-257
3. Beaver, W.L., Wassermann, B.J. and Whipp, B.J (1985). Improved detection of lactate threshold during exercise using log-log transformation. Journal of Applied Physiolology 59, 1936-1940
4. Beaver, W.L., Wasserman, K. and Whipp, B.J (1986). A new method for detecting anaerobic threshold by gas exchange. Journal of Ap-plied Physiolology 60, 2020-2027
5. Belli, T., Ackermann, M.A., Ribeiro, L.F., Langeani, R., Galdino da Silva, R. and Baldissera, V (2007). Lactate and ventilatory thresholds in type 2 diabetic women. Diabetes Research and Clinical Practice 76, 18-23
6. Bosquet, L., Lege, L. and Legros, P (2002). Methods to determine Aerobic Endurance. Sports Medicine 32, 675-700
7. Colak, R. and Ozcelik, O (2004). Effects of short period exercise train-ing and orlistat therapy on body composition and maximal power production capacity in obese patients. Physiological Reserch 53, 53-60
8. Costill, D.L., Coyle, E., Dalsky, G., Evans, W., Fink, W. and Hooper, D (1977). Effects of elevated plasma FFA and insulin on muscle glycogen usage during exercise. Journal of Applied Physiolology 43, 695-699
9. Ekkekakis, P., Lind, E., Hall, E.E. and Petruzzello, S.J (2008). Do regression-based computer algorithms for determining the ven-tilatory threshold agree?. Journal of Sports Sciences 26, 967-976
10. Gaesser, G.A. and Poole, D.C (1986). Lactate and ventilatory thresh-olds: disparity in time course of adaptations to training. Journal of Applied Physiolology 61, 999-1004
11. Goodpaster, B.H., Wolfe, R.R. and Kelley, D.E (2002). Effects of obesity on substrate utilisation during exercise. Obesity Reserch 10, 575-584
12. Hakala, K., Mustajoki, P., Aittomaki, J. and Sovijarvi, A (1996). Im-proved gas exchange during exercise after weight loss in mor-bid obesity. Clinical Physiology 16, 229-238
13. Hagberg, J., Cole, E.M., Carroll, J.E., Miller, J.M., Martin, W.H. and Brooke, M.H (1982). Exercise hyperventilation in patients with McArdles disease. Journal of Applied Physiolology 52, 991-994
14. Hughes, E.F., Tuner, S.C. and Brooks, G.A (1982). Effects of glycogen depletion and pedalling speed on anaerobic threshold. Journal of Applied Physiolology 52, 1598-1607
15. Hulens, M., Vansant, G., Lysens, R., Claessens, AL. and Muls, E (2001). Exercise capacity in lean versus obese women. Scandinavian Journal of Medicine Science Sports 11, 305-309
16. Ivy, J.L., Costill, D.L., Van Handel, P.J., Essing, D.A. and Lower, R.W (1981). Alteration the lactate threshold with changes in substrate availability. International of Sports Medicine 2, 139-142
17. Jasson, E. and Kaiser, L (1982). Effect of diet on the utilization of blood-borne and intramuscular substrate during exercise in man. Acta Physiologica Scandinavica 115, 19-30
18. Kelman, G.R., Maughan, R.J. and Williams, C (1975). The effect of dietary modifications on blood lactate during exercise. The Journal of Physiology 251, 34-35
19. Langfort, J., Zarzeczny, R., Nazar, K. and Kaciuba-Uściłko, H (1996). The effect of low-carbohydrate-ketogenic diet on metabolic and hormonal responses to graded exercise in young men. Journal of Physiology and Pharmacology 47, 361-371
20. Larsson, U.E. and Mattsson, E (2003). Influence of weight loss pro-grammes on walking speed and relative oxygen cost (%VO2max) in obese women during walking. Journal of Reha-bilitation Medicine 35, 91-97
21. Lindiger, M.I. and Sjogaard, G (1991). Potassium regulation during exercise and recovery. Sports Medicine 11, 382-401
22. Maughan, R.J., Williams, C., Cambell, D.M. and Hepburn, D (1978). Fat and carbohydrate metabolism during low intensity exercise: effects of the availability of muscle glycogen. European Jour-nal of Applied Physiology 39, 7-16
23. Meyer, T., Lucia, A., Earnest, C.P. and Kindermann, W (2005). A conceptual framework for performance diagnosis and training prescription from submaximal gas exchange parameters-theory and application. International Journal of Sports Medicine 26, 38-48
24. Ohuchi, H., Nakajima, T., Kawade, M., Matsuda, M. and Kamiya, T (1996). Measurement and validity of the ventilatory threshold in patients with congenital hart disease. Pediatric Cardiology 17, 7-14
25. Omija, K., Itoh, H. and Harada, N (2004). Relationship between double product break point, lactate threshold, and ventilatory threshold in cardiac patients. European Journal of Applied Physiology 91, 224-229
26. Orr, G., Greek, H.J., Hugson, R.L. and Bennett G.W (1982). A computer linear regression model to determinate ventilatory threshold. Journal of Applied Physiolology 56, 1349-1352
27. Ozcelik, O., Dogan, H. and Kelestimur, H (2006). Effects of eight weeks of exercise training and orlistat therapy on body composition and maximal exercise capacity in obese females. Public Health 120, 76-82
28. Perseghin, G., Scifo, P., De Cobelli, F., Pagliato, E., Battezzati, A., Arcelloni, G., Vanzulli, A., Testolin, G., Pozza, G., Del Maschio, A. and Luzi, L (1999). Intramyocellular triglyceride content is a determinant of in vivo insulin resistance in humans. Diabetes 48, 1600-1606
29. Powers, S.K., Byrd, R.J., Tulley, R. and Callender, T (1983). Effects of caffeine ingestion on metabolism and performance during graded exercise. European Journal Applied Physiology and Occupational Physiology 50, 301-207
30. Rowland, T.W (1991). Effects of obesity on aerobic fitness in adolescent females. American Journal of Diseases of Children 145, 764-768
31. Salvadori, A., Fanari, P., Cavestri, R., Mazza, P., Baudo, S. and Longhini, E (1991). Relationship between body mass and toler-ance to physical stress in obese patients. Respiration 58, 311-315
32. Salvadori, A., Fanari, P., Dworzak, F., Azan, G., Brunani, A., Tovaglieri, I., Luzi, L. and Longhini, E (2004). Respiratory and metabolic responses during exercise and skeletal muscle mor-phology in obesity. Sport Science and Health 1, 47-54.
33. Salvadori, A., Fanari, P., Fontana, M., Buontempi, L., Saeza, A., Bandos, S., Miserocchi, G., Longhini, E (1999). Oxygen uptake and cardiac performance in obese and normal subjects during exercise. Respiration 66, 25-33
34. Salvadori, A., Fanari, P., Mazza, P., Agosti, R. and Longhini, E (1992). Work capacity and cardiopulmonary adaptation of the obese subject during exercise testing. Chest 101, 674-679
35. Salvadori, A., Fanari, P., Mazza, P., Fontana, M., Clivati, A. and Longhini, E (1993). Breathing pattern during and after maximal exercise testing in young untrained subjects and in obese pa-tients. Respiration 60, 162-169
36. Salvadori, A., Fanari, P., Tovaglieri, I., Giacomotti, E., Nibbio, F., Belardi, F. and Longhini, E (2008). Ventilation and Its Control during incremental exercise in obesity. Respiration 75, 26-33
37. Sartorio, A., Ottolini, S., Agosti, F., Massarini, M. and Lafortuna, CL (2003). Three-week integrated body weight reduction pro-gramme markedly improves performance and work capacity in severely obese patients. Eating and Weight Disorders 8, 107-113
38. Shepherd, A (2009). Obesity: prevalence, causes and clinical conse-quences. Nursing Standard 23, 51-57
39. Shinkai, S., Watanabe, S., Kurokawa, Y., Torii, J., Asai, H. and Shephard, RJ (1994). Effects of 12 weeks of aerobic exercise plus dietary restriction on body composition, resting energy ex-penditure and aerobic fitness in mildly obese middle-aged women. European Journal of Applied Physiology 68, 258-265
40. Stegmann, H., Kindermann, A. and Schnabel, A (1981). Lactate kinetics and individual anaerobic threshold. International Journal of Sports Medicine 2, 160-165
41. Utter, A.C., Nieman, D.C., Shannonhouse, E.M., Butterworth, D.E. and Nieman, C.N (1998). Influence of diet and/or exercise on body composition and cardiorespiratory fitness in obese women. International Journal of Sport Nutrition 8, 213-222
42. Wasserman, K., Stringer, WW., Casaburi, R., Koike, A. and Cooper B (1994). Determination of the anaerobic threshold by gas ex-change: biochemical considerations, methodology and physio-logical effects. Zeitschrift fur Kardiologie Suppl 83, 1-12
43. Wasserman, K., Whipp, B.J., Koyal, S.N., Beaver, W.L (1973). Anaero-bic threshold and respiratory gas exchange during exercise. Journal of Applied Physiolology 35, 236-243
44. Weiss, R., Dufour, S.E., Tamborlane, W.V., Petersen, K.F., Bonadonna, R.C., Boselli, L., Barbetta, G., Allen, K., Rife, F., Savoye, M., Dziura, J., Sherwin, R., Shulman, G.I. and Caprio, S (2003). Prediabetes in obese youth: a syndrome of impaired glucose tolerance, severe insulin resistance, and altered myocellular and abdominal fat partitioning. Lancet 362, 951-957
45. Yoshida, T (1986). Effect of dietary modifications on anaerobic thresh-old. Sports Medicine 3, 4-9