La Actividad Física como un Estresante Metabólico
Human Performance Laboratory, Department of Kinesiology and Health Education, The University of Texas at Austin, TX 78712, Estados Unidos.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2000.
Publicado 8 de marzo de 2006
Resumen
Palabras clave: ejercicio, actividad fìsica, agotamiento, nutrición, carbohidratos, triacilglicéridos
INTRODUCCION
En forma progresiva está quedando claro que la salud y el bienestar de una persona mejoran mediante la actividad física así como con una dieta nutritiva (1). Tanto la actividad física como la dieta estimulan procesos que, a través del tiempo, alteran la composición morfológica y la función bioquímica del cuerpo. La actividad física y la dieta están interrelacionadas en que la adaptación óptima al estrés del entrenamiento requiere usualmente una dieta a la cual no le falten diferentes nutrientes. La cantidad óptima de nutrientes dietarios para la adaptación efectiva es un tema de este suplemento de esta revista. La actividad física debería de este modo ser vista como un estímulo que proporcione estrés a diferentes sistemas del cuerpo en diferentes grados y así promueva adaptaciones muy específicas y variadas de acuerdo al tipo, intensidad, y duración del ejercicio realizado.
ESTRES DE LA ACTIVIDAD FISICA
En la Figura 1 es presentado un esquema conceptual del estrés, el estímulo y la adaptación derivada a partir de la actividad física en el músculo esquelético. Los carbohidratos, grasas y proteínas obtenidos tanto directamente a partir de las comidas diarias como a partir de las reservas endógenas del cuerpo, proporcionan los sustratos que alimentan las reacciones químicas que son catalizadas por las enzimas y cofactores. En el proceso de estas reacciones, la energía química en los sustratos es convertida al tipo de energía química que las células pueden aprovechar, a saber el ATP. El ATP puede ser resintetizado anaeróbicamente rompiendo a la glucosa o al glucógeno (glucólisis) en el citoplasma de las células, o puede ser resintetizado aeróbicamente mediante las reacciones químicas que ocurren dentro de las mitocondrias que consumen oxígeno. Estas reacciones metabólicas proceden a las velocidades requeridas para mantener las concentraciones de ATP en las células. Así, el incremento de la intensidad de ejercicio incrementa la tasa metabólica como, es reflejado por el incremento de la tasa de las reacciones químicas, el consumo de oxígeno, y la depleción de sustratos. La resíntesis de ATP durante el ejercicio señala una alteración en la homeostasis metabólica y proporciona un estímulo poderoso a las células que eventualmente causa que la misma se adapte al entrenamiento aeróbico, generalmente alterando el equilibrio entre la síntesis y la degradación de proteínas determinadas (Figura 1). En general se piensa que los incrementos en las proteínas mitocondriales dentro del músculo esquelético como resultado del entrenamiento de resistencia aeróbico son estimulados en algún aspecto por la resíntesis del ATP (2).
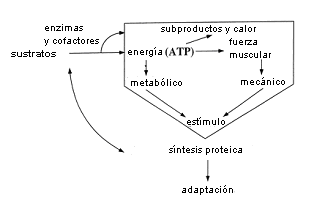
Figura 1. Esquema teórico del estrés metabólico y mecánico en el músculo
esquelético durante y después de la actividad física.
En el músculo, la energía química liberada por la hidrólisis del ATP durante la contracción es convertida en calor o en fuerza muscular. La fuerza muscular se desarrolla a partir de la tensión generada por la interacción de los filamentos de actina y miosina y produce una carga mecánica en las fibras musculares que también provee un estímulo para la adaptación muscular. En este caso, sin embargo, la fuerza mecánica en las fibras musculares estimula un incremento en la masa de actina y miosina dentro de las fibras musculares, nuevamente alterando el equilibrio entre la síntesis y degradación de estas proteínas específicas (3). Este proceso describe la hipertrofia que ocurre con el entrenamiento de la fuerza como se discutió anteriormente.
Intento de Maximizar el Estrés Positivo Mientras se Minimiza el Estrés Negativo
El estrés metabólico y mecánico de la actividad física estimula muchas adaptaciones saludables en numerosos tejidos y órganos en una forma dosis-respuesta (4). En este contexto, el estrés de la actividad física puede producir una respuesta positiva general, reflejada por una reducción del riesgo de enfermedad cardiovascular por un lado y un incremento del rendimiento físico por el otro (5). Sin embargo, la actividad física puede también poner a diferentes tejidos bajo un estrés agudo. Una cuestión subyacente a este suplemento de esta revista científica es el grado al cual la dieta o la suplementación pueden mejorar el estímulo positivo de la actividad física y reducir el estímulo negativo de modo de optimizar las adaptaciones saludables y las mejoras en el rendimiento físico.
Mediciones del Estrés Metabólico de la Actividad Física
En un sentido general, el estrés metabólico de la actividad física puede ser estimado por los flujos generados dentro del músculo en ejercicio en alguna o todas las reacciones ilustradas en la Figura 1. Es más común cuantificar la producción de ATP durante el ejercicio aeróbico continuo en estado estable midiendo el consumo de oxígeno de todo el cuerpo. Cuando una persona levanta un peso, de manera característica por una duración corta (e.g., 10-30 s), la resíntesis de ATP es derivada principalmente a partir de la glucólisis anaeróbica, y el estrés del ejercicio es comúnmente estimado a partir de la fuerza muscular desarrollada. La fuerza muscular es proporcional a la cantidad de peso levantado durante un recorrido de movimiento dado. Otra forma menos práctica y más específica de cuantificar diferentes aspectos del estrés metabólico durante la actividad física incluye la medición de la producción y consumo de sustratos o substrate turnover (i.e., flujo o cinética), depleción de sustratos (7, 8), actividad enzimática en el músculo (9), producción de calor (10), o acumulación de metabolitos (e.g., lactato, ion hidrógeno, amonio, y hexosas monofosfatos) (11). Es aún posible usar técnicas de biología molecular para probar el grado al cual la síntesis y degradación de proteínas específicas es alterada por la actividad física aguda o el entrenamiento crónico mediante ejercicio (2, 3).
El incremento del metabolismo en la musculatura activa debe ser asistido, y algunas veces iniciado, por otros sistemas del cuerpo, especialmente los sistemas nervioso, cardiovascular, endocrino, y respiratorio (12). El estrés metabólico de la actividad física puede también ser estimado generalmente por el grado al cual cada uno de estos sistemas es activado para responder. Sin embargo, cada uno de estos sistemas únicos difiere en cierta forma en su umbral y sensibilidad a diferentes componentes del estrés metabólico. Por ejemplo, la frecuencia cardiaca, gasto cardiaco, presión sanguínea sistólica, flujo sanguíneo muscular, y concentración de norepinefrina plasmática, aumentan linealmente con el incremento de la intensidad del ejercicio aeróbico (13). La ventilación, la glucogenólisis muscular y la concentración de epinefrina plasmática también se incrementan con la intensidad del ejercicio aeróbico, pero a una tasa no lineal a medida que el estrés metabólico se vuelve progresivamente más severo (13). Ejemplos de muchos otros tipos de respuesta podrían ser dados. El punto saliente es que cada marcador de los diferentes sistemas está respondiendo a un único estrés que su órgano final está experimentando durante la actividad física.
Determinantes del Estrés Metabólico de la Actividad Física
Dentro de un individuo determinado, el estrés metabólico durante la actividad física está generalmente determinado por el tipo e intensidad del ejercicio, nivel de aptitud física, nivel nutricional, y factores ambientales. En cierto grado, estos determinantes del estrés metabólico pueden ser controlados. Otros factores que influencian el estrés metabólico que experimenta un individuo durante la actividad física incluyen la disposición genética, la edad y el sexo.
Intensidad y Tipo de Ejercicio
Este artículo compara el estrés metabólico encontrado mientras se camina, corre y levanta altas cargas. La actividad física puede ser bastante variada, pero estas tres actividades comunes proporcionan buenos ejemplos de la influencia del incremento de la intensidad del ejercicio aeróbico prolongado desde la caminata hasta la carrera y de la generación repetida de altas fuerzas musculares de corta duración (i.e., levantamiento de pesos). Por ejemplo, en las Tabla 1 están presentadas las respuestas de un adulto típico que está implicado en ejercicio regular y está arriba de la media en aptitud física con un consumo máximo de oxígeno (VO2 máx.) relativo al peso corporal de 45 mL.kg-1.min-1 (i.e., 3 L/min en términos absolutos). Caminar a 4.8 km/h (3 millas/h) provocaría ≈33% del VO2 máx. en esta persona, lo cual corresponde a una tasa de gasto energético de ≈1.25 MJ/h (300 kcal/h). Las personas sanas pueden caminar por muchas horas a esta tasa. Esta persona típica podría correr confortablemente al 65% del VO2 máx. (i.e., 2.5 MJ/h, o 600 kcal/h) y cubrir 10 km en 1 h. Esto estaría clasificado como una intensidad moderada a alta.
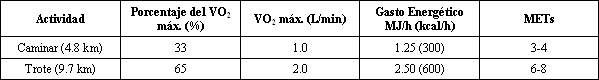
Tabla 1. Estrés metabólico aeróbico para un hombre típico activo de 30
años cuando camina y trota. Este ejemplo se aplica a una persona con un máximo
consumo de oxígeno (VO2 máx.) de 3 L/min (i.e., 45 mL.kg-1.min-1)
y un peso corporal de 66 kg. METs, equivalente metabólico relativo al reposo (el
número de veces que el consumo de oxígeno se eleva arriba de la tasa metabólica
de reposo).
Levantar grandes cargas mientras se realizan acciones como sentadilla, press de banca, o curl de brazos causa fatiga después de relativamente pocas repeticiones. La intensidad del levantamiento de pesas es cuantificada como un porcentaje de una repetición máxima de la persona (1RM; i.e., el mayor peso que un individuo puede levantar solo una vez) (14). Como es indicado en la Tabla 2, una persona puede usualmente levantar el 65% de su 1RM por 15 repeticiones y por ≈1 min antes de fatigarse. También está presentado en la Tabla 2 el grado al cual el número de repeticiones, hasta la fatiga, declina con los incrementos en el porcentaje de 1RM. Para la aptitud física general esquelética-muscular, el mínimo recomendado es 1 serie de 8-12 repeticiones de 8-10 ejercicios que implican a los principales grupos musculares ≥2 d/sem. Las personas pueden hacer progresos confortablemente para completar 3 series de cada ejercicio 3-4 veces/sem.

Tabla 2. Clasificación de la intensidad del levantamiento de pesas para
personas físicamente activas. 1 1RM, una repetición máxima (el máximo
peso que puede ser levantado a través del recorrido de movimiento completo).
2 El número estimado de repeticiones posibles va a depender del
índice fuerza/resistencia de la persona (14).
RECLUTAMIENTO NEUROMUSCULAR
El movimiento es iniciado por el sistema nervioso central. El mismo comienza con la activación de la corteza motora del cerebro y la despolarización de las neuronas corticoespinales que inervan las motoneuronas α en la médula. Estas neuronas dirigen a las fibras musculares que potencian la actividad. A medida que se incrementa la intensidad del ejercicio, las mayores fuerzas musculares y la producción de potencia son generadas tanto reclutando más unidades motoras (i.e., la motoneurona y sus fibras musculares) por contracción e incrementando la frecuencia de disparo con la cual una unidad motora dada es reclutada (15). En la Figura 2 es presentado un ejemplo teórico del patrón con el cual son reclutadas las fibras en el músculo vasto lateral durante el ciclismo y la carrera de intensidad incremental. Se cree que caminar o andar en bicicleta a baja intensidad recluta principalmente unidades motoras tipo I que inervan fibras musculares de contracción lenta, debido a que las mismas tienen un umbral de reclutamiento bajo (15). En promedio entre una población, aproximadamente la mitad de las fibras en el vasto lateral son fibras de contracción lenta, sin embargo los valores están entre 20 y 80% (16). Correr o andar en bicicleta al 65% del VO2 máx. recluta tanto unidades motoras de tipo I y algunas de tipo IIa (fibras de contracción rápida A). Las unidades motoras tipo IIb que inervan las fibras musculares de contracción rápida B no son reclutadas para contraerse hasta que la intensidad del ejercicio es alta.
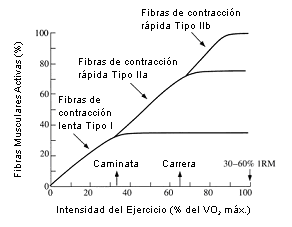
Figura 2. Relación teórica entre la intensidad de ejercicio y el
porcentaje de fibras musculares activas en el vasto lateral durante el ciclismo.
La intensidad de ejercicio es expresada como porcentaje del máximo consumo de
oxígeno (% del VO2 máx.), así como con un porcentaje de una
repetición máxima (1RM). Notar que el 100% del VO2 máx. corresponde a
≈30-60% de 1RM. Son indicadas la fibra muscular (de contracción lenta y rápida)
y los tipos de unidades motoras (tipo I, IIa o IIb) que son progresivamente
reclutadas (15).
Como es indicado en la Figura 2, una intensidad de ejercicio que provoca el 100% del VO2 máx., que puede ser mantenida durante 3-8 min antes de la fatiga, requiere una fuerza muscular que representa solo el 30-60% de 1RM o la potencia máxima. Parece que en el músculo vasto lateral, la producción de fuerza >30-60% de 1RM es generada no solo reclutando más fibras musculares, sino incrementando la frecuencia del reclutamiento de fibras por contracción, para lograr la mayor interacción instantánea de actina y miosina. Los diferentes músculos a través de todo el cuerpo difieren marcadamente en el patrón con el cual incrementan el número de fibras reclutadas en comparación con la frecuencia de reclutamiento para generar mayores fuerzas a medida que se incrementa la intensidad del ejercicio. Así, en la Figura 2 solo es mostrado un ejemplo. Esta interpretación también indica que la mejora en 1RM que las personas experimentan de manera característica después de un programa de entrenamiento crónico (e.g., varias semanas) de levantamiento de pesas es debido parcialmente a adaptaciones neurológicas que se piensa que incrementan el número y frecuencia de reclutamiento de unidades motoras (15).
Las fibras musculares que son muy raramente reclutadas para contraerse están obviamente bajo poco estrés metabólico y así reciben un estímulo mínimo. Un punto importante de la Figura 2 y de la discusión precedente es que muchas de las fibras musculares esqueléticas, especialmente las de alto umbral, de contracción rápida, se esperaría que no sean suficientemente activas cuando una persona no está implicada en ejercicio aeróbico periódico, de alta intensidad o entrenamiento de la fuerza. Da la impresión de que solo 10 contracciones por sesión de entrenamiento, que duren 40 s, parecen ser un estímulo poderoso para algunos aspectos de la adaptación muscular (17, 18).
Almacenamiento de Sustratos y Tasas Máximas de Utilización
Los principales sustratos para la resíntesis de ATP en el músculo activo son las grasas y los carbohidratos; las proteínas juegan un rol menor excepto en condiciones extremas análogas a la inanición (19). Las grasas son almacenadas como triacilglicéridos, principalmente en los adipositos del cuerpo. Por ejemplo, en una persona de 66 kg con 18% de grasa corporal, esta reserva energética alcanza para >480 MJ de energía (100000 kcal), lo cual es suficiente para abastecer ≈1600 km (1000 millas) de caminata (asumiendo ≈0.3 MJ/km o 100 kcal/milla). Los triacilglicéridos son también almacenados directamente dentro de las fibras musculares individuales [triacilglicéridos intramusculares (IMTG)]. La cantidad de estos IMTG almacenada está menos estudiada, pero es asumido que contiene ≈12-20 MJ de energía (19). Para que los triacilglicéridos sean oxidados en el músculo esquelético durante el ejercicio, deben ser primero hidrolizados por el proceso de lipólisis de los ácidos grasos libres y transportados a la mitocondria interna metabolicamente activa (20). Los ácidos grasos generados a partir de los triacilglicéridos de los adipositos son tanto reesterificados o liberados de la célula para una unión potencial con la albúmina plasmática, el mayor transportador proteico de la circulación sanguínea (20). Estos ácidos grasos plasmáticos circulantes están disponibles para la captación por parte de los tejidos. Los músculos esqueléticos activos oxidan 80-90% de los ácidos grasos que desaparecen de la circulación (21) y el resto son presumiblemente reesterificados. El transporte de los ácidos grasos desde los IMTG hasta la mebrana mitocondrial externa es menos complicado.
Todos los ácidos grasos deben ser transportados a través de la membrana mitocondrial para la oxidación, y este puede ser un paso limitante de la velocidad. Por ejemplo, el ácido graso común de cadena larga palmitato es transportado por la reacción de la carnitina O-palmitoiltransferasa, la cual es fuertemente inhibida por el manolil-CoA (22). Este metabolito ha sido propuesto como un sensor de combustible (23), debido a que el mismo aumenta cuando están disponibles ya sea carbohidratos como grasas y declina durante el ejercicio en el estado de ayuno (24). Efectivamente, nuestro laboratorio observó que la oxidación de palmitato plasmático durante el ejercicio está activamente reducida cuando son incrementados la captación de glucosa sanguínea y el flujo glucolítico (21). Además, este fenómeno parece implicar la reducción en el transporte mitocondrial, en la base de la observación de que la oxidación de un ácido graso de cadena media (i.e., octanoato) no está ni limitada ni reducida por el incremento del flujo glucolítico. Nuestra hipótesis es que la oxidación de ácidos grasos puede estar limitada en cierto grado por la disponibilidad de carbohidratos, la cual reduce el transporte de ácidos grasos dentro de la mitocondria (21). Esta hipótesis deja implícito que cuando los carbohidratos y los ácidos grasos están ambos disponibles para el músculo durante el ejercicio, parecen ser preferidos los carbohidratos. Sin embargo, la gente normalmente no tiene la capacidad para correr al 65% del VO2 máx. mientras oxida principalmente ácidos grasos (i.e., >70% de la energía). Por esta razón, cuando la disponibilidad de carbohidratos es muy baja, tal como durante la depleción de glucógeno muscular y la hipoglucemia que es típicamente experimentada después de 2-3 horas de ejercicio, las personas normalmente no son capaces de ejercitarse más intensamente que al 40-60% del VO2 máx. (25).
Otras posibles explicaciones para un límite en la tasa de oxidación que puede ser apoyada solo por los ácidos grasos durante el ejercicio puede implicar una pérdida anaplerótica de intermediarios del ciclo de los ácidos tricarboxílicos que requiere la repleción a partir de los carbohidratos (26-28). Aunque faltan respuestas definitivas, es claro que la disponibilidad de carnitina para el transporte mitocondrial de ácidos grasos durante el ejercicio no es limitante y que la suplementación con carnitina no es beneficiosa en los individuos normales y los atletas (29, 30). Los triacilglicéridos en la sangre, otro sustrato, parecen ser solo lentamente convertidos a ácidos grados y así no se piensa que sean un sustrato principal durante el ejercicio (31), aunque probablemente son importantes para repletar las reservas de IMTG después del ejercicio.
Los carbohidratos son almacenados en el cuerpo como glucógeno, un polímero que comprende moléculas de glucosa que puede ser fácilmente hidrolizado. El glucógeno es almacenado directamente en la fibra muscular y constituye la mayor fuente de carbohidratos durante el mayor tipo de ejercicios. La cantidad de glucógeno almacenado en el músculo esquelético puede variar con la dieta y el entrenamiento, pero está generalmente entre 6-10 MJ (1500-2500 kcal) (19). Un aspecto más importante de la hidrólisis del glucógeno muscular es que el mismo puede ser rápidamente activado para resintetizar ATP a altas tasas- hasta 1.5-2 veces que el VO2 máx. Estos “esprints” de alta intensidad no pueden ser mantenidos por >30-60 s, debido a que el ácido láctico se acumula en el músculo y eventualmente inhibe el acoplamiento excitación-contracción. El glucógeno almacenado en el hígado alcanza ≈1MJ (240 kcal) una vez que la persona se alimentó y sirve principalmente para mantener la concentración de glucosa sanguínea. A medida que se incrementa la intensidad del ejercicio, los músculos que se ejercitan incrementan la captación de glucosa desde la sangre y para mantener la concentración de glucosa sanguínea, debe incrementarse la producción de glucosa hepática (32). Además del glucógeno hepático, la glucosa sanguínea puede ser generada a partir de la glucogenólisis o a partir de la entrada de la glucosa ingerida dentro de la circulación esplánica (33). La captación de glucosa sanguínea durante el ejercicio puede ser incrementada hasta ≈1 g/min durante el ejercicio prolongado, lo cual normalmente provoca una disminución de la insulina plasmática (34-37). Sin embargo, durante el ejercicio prolongado con hiperinsulinemia e hiperglicemia, la captación de glucosa sanguínea puede alcanzar 2.5 g/min (38).
ESTRES METABOLICO DEL EJERCICIO AEROBICO DE BAJA INTENSIDAD
En el estado de ayuno
En la Figura 3 está presentada la oxidación de sustratos observada en ciclistas bien entrenados en reposo y después de 30 min de ejercicio luego de una noche de ayuno (6). En reposo, las necesidades oxidativas pueden ser alcanzadas mediante los ácidos grados plasmáticos y la glucosa plasmática. Durante el ejercicio al 25% del VO2 máx., la tasa metabólica se incrementa de 3 a 4 veces arriba de la condición de reposo, un requerimiento alcanzado principalmente mediante un incremento de la movilización, captación y oxidación de ácidos grasos plasmáticos (6). La captación de glucosa sanguínea se incrementa solo ligeramente. El ejercicio de baja intensidad incrementa marcadamente la movilización de ácidos grasos plasmáticos (i.e., tasa de aparición de ácidos grasos al plasma), parcialmente debido a que el ejercicio estimula el incremento de la lipólisis y en gran parte debido a que la tasa de reesterificación de los ácidos grasos dentro de los adipositos disminuye marcadamente, desde ≈80% en reposo hasta el 20% durante el ejercicio (39). La lipólisis en el tejido adiposo se incrementa durante el ejercicio principalmente debido a que la epinefrina estimula los receptores β-adrenérgicos (40) y debido a que la insulina plasmática, un potente inhibidor de la lipólisis, disminuye (32, 41). El estrés metabólico durante el ejercicio de baja intensidad no es grande y así las respuestas permanecen relativamente estables, no difiriendo substancialmente después de 30 min con respecto a aquellas observadas después de 2-4 h (6). La cinética de la glucosa sanguínea, y así su concentración, parece ser estable, como lo es la cinética de los ácidos grasos plasmáticos y la oxidación total de grasa (6). Por consiguiente, las respuestas hormonales que son indicativas de estrés metabólico no son tampoco substancialmente alteradas. Por ejemplo, la epinefrina y norepinefrina plasmáticas son solo ligeramente incrementadas arriba de sus valores de reposo (6). El cortisol plasmático disminuye verdaderamente a través de todo el ejercicio prologando de baja intensidad, probablemente como resultado del incremento del clearence (42). Estas respuestas son consistentes con la observación acerca de que la gente puede caminar por muchas horas sin que se produzca mucho estrés metabólico (43).
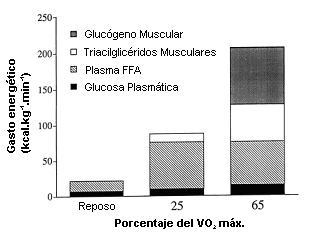
Figura 3. Contribución de los 4 sustratos principales al gasto energético
en reposo y después de 30 min de ejercicio al 25 y 65% del máximo consumo de
oxígeno (VO2 máx.) en hombres bien entrenados cuando hacen ayuno.
FFA, ácidos grasos libres. Para convertir kcal a kJ, multiplicar por 4.184.
Adaptado de Romjin et al. (6).
Después de Ingerir una Comida
La oxidación y movilización de ácidos grasos está marcadamente reducida cuando se ingiere una comida que contiene carbohidratos durante las horas antes al ejercicio, o aún cuando los carbohidratos son ingeridos durante un ejercicio de baja intensidad (33, 44, 45). Por supuesto, la ingestión de carbohidratos en reposo o durante el ejercicio de baja intensidad con incrementos mínimos en las catecolaminas va a estimular a la secreción de insulina. La insulina es un potente inhibidor de la lipólisis y de la movilización de ácidos grasos plasmáticos y es un potente estimulante de la captación de glucosa en el músculo (41, 46). Con estos dos efectos de la insulina, la oxidación de sustratos cambia de ácidos grasos plasmáticos a glucosa plasmática (21, 44, 46). La fuente del incremento de la oxidación de carbohidratos parece ser en gran parte la glucosa sanguínea a partir de los carbohidratos ingeridos (46). De este modo, comer antes o durante el ejercicio de baja intensidad no parece presentar mucho estrés metabólico debido a que no incrementa apreciablemente la utilización de glucosa endógena. De hecho, si la cantidad de carbohidratos en la comida es mayor que el incremento en la oxidación de carbohidratos que la ingesta estimula, el almacenamiento de glucógeno y glucosa en el cuerpo va a aumentar (47).
Nivel de Aptitud Física
El entrenamiento de resistencia es bien conocido por incrementar la oxidación de grasas durante el ejercicio, parcialmente debido a los incrementos en el número de mitocondrias, las cuales contienen las enzimas oxidativas necesarias (5). Por ejemplo, cuando se camina a la misma velocidad que provoca un consumo de oxígeno absoluto de 20 mL.kg-1.min-1, personas entrenadas en resistencia presentaron una tasa de oxidación de grasas que fue un 32% mayor que la de sujetos desentrenados (48). Esta velocidad generó el 28% del VO2 máx. de los sujetos entrenados y el 43% del VO2 max. de los sujetos desentrenados. De manera interesante, las tasas de lipólisis y de movilización de ácidos grasos plasmáticos no fueron significativamente diferentes, y aún las tasas de desaparición de ácidos grasos plasmáticos de la circulación fueron similares en los sujetos desentrenados y los entrenados en resistencia. En los sujetos desentrenados, las tasas de movilización de ácidos grasos plasmáticos excedían la oxidación total de grasas durante el ejercicio. Así, el factor limitante de la oxidación de grasas no parece ser la disponibilidad de ácidos grasos. Es asumido que la capacidad intrínseca muscular de oxidar grasa limita su oxidación, posiblemente debido a una densidad mitocondrial subóptima (5).
Durante el ejercicio de baja intensidad, los sujetos entrenados en resistencia, que probablemente tuvieron un incremento en la densidad mitocondrial de ≈2 veces (5), mostraron un equilibrio entre la desaparición de ácidos grasos plasmáticos y la oxidación total de grasas (6, 48). Así, el principal efecto del entrenamiento de resistencia para incrementar la oxidación de grasas durante el ejercicio de baja intensidad, no parece ser un incremento en la lipólisis o en la movilización de ácidos grasos plasmáticos; en vez de esto, el entrenamiento de resistencia incrementa el emparejamiento entre la desaparición de ácidos grasos plasmáticos y la oxidación total de ácidos grasos, probablemente debiendo incrementar la densidad mitocondrial.
Debido a que en los sujetos entrenados en resistencia es incrementada la oxidación de grasa, la oxidación de carbohidratos debe ser reducida. Es interesante que esta reducción en la oxidación de carbohidratos ocurra parcialmente debido a una reducción en la captación de glucosa en el músculo (49). Esto es a pesar del hecho de que el músculo esquelético en los sujetos entrenados en resistencia es más sensible a la insulina y también posee más de las proteínas (i.e., proteínas transportadoras de glucosa medidas en todo el músculo) responsables del transporte de glucosa dentro del músculo (50). Así, la disparidad entre las propiedades bioquímicas del músculo aislado, la cual parecería favorecer el incremento de la captación de glucosa durante el ejercicio, y la verdadera observación de la reducción de la captación de glucosa durante el ejercicio para todo el cuerpo indica que están implicados otros factores que no están claramente entendidos.
ESTRES METABOLICO DEL EJERCICIO AEROBICO DE INTENSIDAD MODERADA A ALTA
En el Estado de Ayuno
En la Figura 3se muestran las fuentes de oxidación de sustratos después de 30 min de ejercicio de intensidad moderada a alta al 65% del VO2 máx. en sujetos entrenados en resistencia que ayunaron durante una noche. El incremento en el consumo de oxígeno y así la respiración mitocondrial para el incremento de la resíntesis de ATP es generado por la mayor alteración de la homeostasis metabólica en la fibra muscular durante el ejercicio más intenso (5). Estas alteraciones metabólicas [i.e., incremento de las concentraciones de ADP, AMP, y fosfato inorgánico (51)] también sirven para acelerar la glucogenólisis muscular, contribuyendo así al gran aumento en la oxidación total en general y de la oxidación de carbohidratos en particular. La captación de glucosa sanguínea por parte del músculo también se incrementa con el incremento de la intensidad del ejercicio. Sin embargo, su contribución a la energía total no es todavía muy alta después de solo 30 min de ejercicio (Figura 3). La alta dependencia en el glucógeno muscular es necesaria debido a que la grasa, por las razones discutidas anteriormente, no puede ser oxidada a tasas suficientemente altas durante el ejercicio de moderada a alta intensidad. De manera interesante, la tasa de movilización y de captación de ácidos grasos plasmáticos durante el ejercicio no se incrementa a medida que la intensidad se incrementa desde el 25% hasta el 65% del VO2 máx., a pesar de los grandes incrementos en las catecolaminas plasmáticas. Parece que la movilización de ácidos grasos plasmáticos durante el ejercicio responde completamente a la baja cantidad de activación hormonal, típica del ejercicio de baja intensidad. Sin embargo, la oxidación total de grasas es marcadamente más alta durante el ejercicio al 65% del VO2 máx. que al 25% del VO2 máx., aparentemente debido a la marcada oxidación de ácidos grasos a partir de IMTG. Aunque se sabe poco acerca de los factores que estimulan la lipólisis de IMTG (52), se sospecha que la misma responde a algunos de los mismos factores que activan la glucogenólisis muscular, al menos durante el ejercicio de intensidad moderada a alta (20).
Hay interés práctico por identificar la intensidad de ejercicio en la cual se oxida (i.e., quema) la mayor cantidad de grasa corporal. Como es indicado en la Figura 3, durante el ejercicio al 25% del VO2 máx., un alto porcentaje (≈60-85%) de la energía es derivada de las grasas, mientras que durante el ejercicio al 65% del VO2 máx., ≈50% de la energía es derivada de las grasas. Sin embargo, debido a que el gasto energético total es de 2 a 3 veces más alto al 65% del VO2 máx. que al 25% del VO2 máx., la verdadera tasa absoluta de oxidación de grasa (MJ.kg-1.h-1 o kcal.kg-1.min-1) es mucho más alta a la mayor intensidad, en gran parte debido a la oxidación de IMTG. En términos de usar el ejercicio que puede ser realizado solo para una cantidad limitada de tiempo (e.g., 1h/d) para disminuir las reservas de grasa corporal, parece que el ejercicio al 65% del VO2 máx. sería más efectivo que el ejercicio al 25% del VO2 máx., debido a que las pérdidas absolutas de grasa del cuerpo sería más altas.
Ejercicio Prolongado
En la Figura 4 se muestran las alteraciones en las mezclas de sustratos que ocurren a través de varias horas de ejercicio al 65-75% del VO2 máx. en hombres entrenados en resistencia después de una noche de ayuno (6, 19, 53). La contribución relativa de las grasas y los carbohidratos cambia solo ligeramente: la oxidación de grasa se incrementa y la oxidación de carbohidratos declina ligeramente. El cambio más dramático en la oxidación de sustratos ocurre en la fuente de energía de los carbohidratos. Con el incremento de la duración del ejercicio, la contribución del glucógeno muscular declina a medida que sus reservas disminuyen, y la contribución de la glucosa sanguínea se incrementa a cantidades notablemente altas. Este cambio desde el glucógeno muscular hacia la glucosa sanguínea es necesario para mantener la oxidación total de carbohidratos que es requerida por el ejercicio a esta intensidad, debido a las limitaciones en la oxidación de grasas. Esta dependencia progresiva y alta en la oxidación de glucosa sanguínea forma la base de la ingestión de carbohidratos durante el ejercicio prolongado (53). Después de 1-2 h de ejercicio a estas intensidades, la concentración de glucosa sanguínea comienza a declinar debido al desequilibrio, por el cual la desaparición de glucosa desde la sangre se vuelve mayor que la aparición de glucosa a la sangre (36, 53). Las reducciones de las reservas de glucógeno hepático contribuyen a la incapacidad de mantener la concentración de glucosa sanguínea. Como resultado, la persona que se ejercita en un estado de ayuno usualmente se vuelve hipoglucémica (i.e., glucosa sanguínea <3mmol/L) durante la tercera hora y luego se fatiga (25, 53). La fatiga es precedida por una declinación en la oxidación de carbohidratos y está relacionada a la depleción del glucógeno muscular con la hipoglucemia concomitante. El estrés metabólico de la depleción de sustratos en los músculos que se ejercitan hasta el punto de la fatiga sugiere un desequilibrio en la producción de energía (e.g., flujo de ATP), como es reflejado por el incremento de la concentración de amonio (28). La ingestión de carbohidratos a través de todo el ejercicio mantiene a la concentración de glucosa sanguínea y a la oxidación de carbohidratos, lo cual retrasa la fatiga (54).
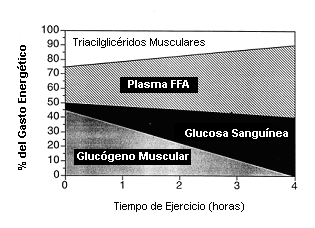
Figura 4. Porcentaje de la energía derivada a partir de los 4 sustratos
principales durante el ejercicio prolongado al 65-75% del máximo consumo de
oxígeno.
Inicialmente, aproximadamente la mitad de la energía es derivada de los carbohidratos y la otra mitad de las grasas. A medida que disminuye la concentración de glucógeno muscular, la glucosa sanguínea se vuelve una fuente incrementalmente más importante de energía de los carbohidratos para el músculo. * Después de 2 h de ejercicio, la ingestión de carbohidratos se necesita para mantener la concentración de glucosa sanguínea y la oxidación de carbohidratos. FFA, ácidos grasos libres. Reproducido a partir de la referencia 19 con permiso. Derechos de la American Society for Clinical Nutrition.
El estrés del ejercicio de intensidad moderada a alta es reflejado en las respuestas hormonales, las cuales, entre otras funciones, sirven para regular la utilización de sustratos y las respuestas cardiovasculares. Después de 30 min de ejercicio al 65% del VO2 máx., la epinefrina y norepinefrina plasmáticas se elevan ≈4-6 veces arriba de los valores de reposo (6, 55). La hipoglucemia estimula notablemente a la liberación de epinefrina, probablemente en un intento de atenuar las reducciones en la concentración de glucosa sanguínea incrementando la producción de glucosa hepática y/o reduciendo la captación de glucosa (56, 57). La fatiga experimentada a partir de la hipoglucemia y la depleción de glucógeno muscular está también asociada con elevaciones marcadas en el cortisol plasmático, indicando la activación del eje hipotalámico-pituitario-adrenal (58). Estos marcadores hormonales del estrés metabólico influencian numerosos sistemas fisiológicos, y algunas de las respuestas no parecen ser productivas. Por ejemplo, se cree que la elevación del cortisol reduce de manera aguda la función inmune (59). Se piensa que esta es una causa posible de la observación de que los individuos estresados crónicamente, especialmente aquellos que realizan ejercicio agotador en una base diaria, parecen ser más susceptibles para padecer infecciones respiratorios del tracto superior (59, 60).
Después de la Alimentación
La oxidación total de grasa durante los primeros 100 min de ejercicio está marcadamente inhibida y la oxidación de carbohidratos está obviamente incrementada cuando son ingeridos carbohidratos durante las 6 h anteriores al ejercicio de intensidad moderada a alta (44, 61). La observación acerca de que la oxidación de grasa se incrementa a medida que se incrementa la duración del ejercicio es en gran parte debido a la inversión de esta inhibición de la oxidación de grasas como resultado de la última comida. Este efecto está relacionado al efecto de la insulina luego de la comida, el cual parece persistir bastante después de que la insulina plasmática ha regresado a los valores de reposo (44, 61). Esta observación es apoyada por el hallazgo de que los incrementos en la concentración de glicerol plasmático durante el ejercicio, un índice de lipólisis, estuvo atenuada por ≤12 h después de la ingestión de carbohidratos (44). La ingestión de carbohidratos preejercicio redujo la oxidación de tanto ácidos grasos plasmáticos como de IMTG (21). Hay mucho interés práctico en si debería ser evitada la ingestión de carbohidratos que aumenta la insulina suficientemente, como lo hacen casi todas las comidas con carbohidratos. Estas comidas también producen un fenómeno en el cual la concentración de glucosa sanguínea disminuye durante los primeros 30 min de ejercicio (44, 62), más probablemente debido al incremento de la captación de glucosa sanguínea por el músculo (46). Parece que el determinante de si el estrés metabólico se incrementa depende de si la reducción en la oxidación de grasas es alcanzada por un incremento suficiente en la oxidación de glucosa sanguínea. Si no, la oxidación de glucógeno muscular podría ser incrementada (62), un efecto que podría ser interpretado como un incremento del estrés metabólico. Con la idea de que las comidas con carbohidratos preejercicio deberían ser suficientemente grandes para estimular una suficientemente alta captación de glucosa muscular para compensar la oxidación de grasas, las personas son aconsejadas en forma práctica para ingerir ≥1 g de carbohidratos, en vez de menores cantidades, por kilogramo de peso corporal antes del ejercicio (19).
Nivel de Aptitud Física
El incremento de la oxidación de grasas durante el ejercicio de intensidad moderada a alta que es característico del entrenamiento de resistencia parece ser debido solamente al incremento de la oxidación de IMTG. En una serie de 2 estudios, el metabolismo del ejercicio fue medido antes y después del entrenamiento a una misma intensidad absoluta que producía el 64% del VO2 máx. preentrenamiento (63, 64). Fue interesante la observación hallada acerca de que la oxidación total de grasas se incremento durante el ejercicio a pesar de haber una reducción significativa en la movilización y oxidación de ácidos grasos plasmáticos (64). Las mediciones directas de los IMTG usadas en el músculo confirmaron que su uso se incrementó dramáticamente con el entrenamiento de resistencia, y los cálculos sugirieron que la misma podría explicar el incremento entero en la oxidación de grasas (63). A la inversa, el uso de glucógeno muscular disminuyó (63), y se halló que la captación de glucosa sanguínea también disminuyó (49). Parece que el incremento en tanto la densidad mitocondrial y el uso de IMTG están funcionalmente relacionados, lo cual es interesante debido a que estas gotitas de IMTG están frecuentemente en contacto físico con las mitocondrias (65). La mitocondria proporciona las organelas celulares para la oxidación con menos alteración de la homeostasis, y así menos glucogenólisis, y los IMTG proporcionan el sustrato para el cambio de oxidación de carbohidratos a grasas.
ESTRES CARDIOVASCULAR Y ACTIVIDAD FISICA AEROBICA
El sistema cardiovascular asiste a la actividad física principalmente asegurando un adecuado transporte del oxígeno llevado en la sangre, sustratos y hormonas a los músculos en ejercicio. La remoción de productos metabólicos de desecho desde los músculos, así como la disipación de calor desde el cuerpo, son otras importantes funciones cardiovasculares durante la actividad física. Las respuestas cardiovasculares más funcionales implican la generación de la presión sanguínea arterial más apropiada y el flujo sanguíneo a diferentes órganos (14, 66, 67). El sistema nervioso central responde inmediatamente a la actividad física incrementado la actividad eferente del sistema nervioso simpático al corazón y los vasos sanguíneos, mientras que disminuye la actividad parasimpática (60, 67).
Los nervios motores (i.e., aferentes) monitorean el estado metabólico de los músculos que se ejercitan, así como la presión sanguínea y otros factores (e.g., contenido de oxígeno, pH, y temperatura) en diferentes áreas de la circulación, proveyendo así retroalimentación al sistema nervioso central con respecto a la adecuación de las respuestas cardiovasculares (66). El ejercicio aeróbico estimula una vasodilatación local inducida por metabolitos en las arteriolas de los músculos que se contraen, incrementando así dramáticamente el flujo sanguíneo, a condición de que la presión sanguínea sea mantenida o incrementada. El sistema nervioso responde a este desafío incrementando la actividad en los nervios simpáticos que liberan norepinefrina en el corazón, por ello incrementando la frecuencia cardiaca. La norepinefrina liberada en los riñones, hígado, y músculos en reposo incrementa la resistencia vascular a estos órganos (67). De este modo, el patrón básico de respuesta es un incremento en la frecuencia cardiaca y el gasto cardiaco con el incremento de la intensidad de ejercicio y un aún más dramático incremento en el flujo sanguíneo muscular a medida que un porcentaje incrementalmente mayor de gasto cardiaco es dirigido a los músculos en ejercicio (67).
EL flujo sanguíneo al músculo durante varios minutos de ejercicio dinámico con una pequeña masa muscular (e.g. usando solo los extensores de la rodilla) puede incrementar el flujo sanguíneo por kilogramo de músculo activo a valores tan altos como 3 L.min-1.kg-1 (68). Estas concentraciones deberían ser consideradas como hiperperfusión, debido al contenido de oxígeno relativamente alto en la sangre venosa (67). La capacidad muscular inicial para un alto flujo sanguíneo puede presentar un desafío severo para el sistema cardiovascular durante el ejercicio que recluta una gran masa muscular (e.g., carrera o ciclismo), debido a que la capacidad de esta gran masa muscular de aceptar flujo sanguíneo puede exceder fácilmente al gasto cardiaco máximo (12, 68). De este modo, durante el ejercicio aeróbico intenso con una gran masa muscular, el flujo sanguíneo por kilogramo de músculo está típicamente reducido a 1-2 L/min por la actividad nerviosa simpática que sobreimpone la vasoconstricción sobre la vasodilatación inducida por metabolitos. Esta respuesta equilibrada mantiene la presión arterial apropiada y minimiza la sobreperfusión de los músculos implicados en el ejercicio (68).
La frecuencia cardiaca proporciona una medición general razonable y práctica del grado de estrés cardiovascular durante la actividad física. Así, la intensidad es típicamente valorada como un porcentaje de la frecuencia cardiaca máxima (4). Sin embargo, la mayor frecuencia cardiaca que una persona puede alcanzar durante el ejercicio es proporcional a la cantidad de masa muscular activada (69). Por ejemplo, durante el ejercicio que implica solo los brazos, una persona puede no ser capaz de elevar la frecuencia cardiaca arriba de 130 latidos/min, aún si el ejercicio es realizado al punto de fatiga extrema. Sin embargo, durante la carrera intensa que implica grandes masas musculares de las piernas, una persona común de 30 años puede subir la frecuencia cardiaca a 180-190 latidos/min.
El estrés metabólico al que se enfrentan los músculos implicados en el ejercicio influencia las respuestas cardiovasculares de la frecuencia cardiaca y la presión sanguínea. La adaptación cardiovascular más importante al entrenamiento de resistencia es el incremento del volumen sistólico durante el ejercicio (67). Esto permite que el gasto cardiaco y el flujo sanguíneo muscular sean alcanzados con una reducción de la frecuencia cardiaca durante el ejercicio submáximo a una intensidad absoluta dada. Además, las adaptaciones bioquímicas en el músculo que reducen las alteraciones de la homeostasis metabólica también parecen ser importantes para reducir la respuesta de la frecuencia cardiaca al ejercicio causando menos estimulación de los nervios aferentes en los músculos (66).
Típicamente, la fatiga experimentada en los músculos implicados en el ejercicio limita la tolerancia de la persona para el ejercicio aeróbico y así el sistema cardiovascular generalmente no presenta signos de disfunción, al menos en una persona libre de enfermedad cardiaca isquémica u otras enfermedades. Sin embargo, el grado de estrés cardiovascular durante el ejercicio aeróbico puede ser enormemente incrementado por la hipertermia o la deshidratación. La deshidratación y la hipertermia pueden cada una individualmente reducir el volumen sistólico durante el ejercicio (70). Además, cuando estos dos fenómenos ocurren juntos, como es típico en una hipertermia inducida por deshidratación, las reducciones en el volumen sistólico son mucho más aditivas, y como resultado, el gasto cardiaco también declina significativamente (70-72). Otras indicaciones de función cardiovascular comprometida incluyen la reducción de la presión sanguínea y del flujo sanguíneo a la piel. Además, la respuesta de la norepinefrina plasmática a la hipertermia inducida por deshidratación es muy grande y es indicativa de estrés (73).
ESTRES METABOLICO, CARDIOVASCULAR Y NEUROLOGICO DEL LEVANTAMIENTO DE PESAS
Cuando las personas levantan pesos correspondientes al 65-75% de su 1RM, generalmente pueden realizar 10-15 repeticiones antes de fatigarse y no ser capaces de realizar otra repetición completa (Tabla 2). Las primeras pocas repeticiones de tal serie no son sentidas por el sujeto como difíciles, pero después de cada repetición del peso dado las repeticiones se vuelven más difíciles a medida que el sistema neuromuscular se fatiga. La activación de las unidades motoras parece seguir el esfuerzo percibido, y la última repetición parece provocar el máximo reclutamiento en número y frecuencia de las unidades motoras, al menos bajo estas condiciones específicas (15). Por esta razón, se cree que levantar pesos hasta el punto de la fatiga y el fallo hasta completar otra contracción es un potente estímulo para el reclutamiento neurológico, especialmente de las unidades motoras tipo II de alto umbral que no son frecuentemente estimuladas en personas inactivas.
La fatiga experimentada con el levantamiento de pesas repetitivo podría resultar del deterioro de un número de factores, incluyendo el reclutamiento, acoplamiento excitación-contracción, producción de ATP, y ciclo de los puentes cruzados (74). Las contracciones repetitivas que duran 30-90 s promueven una rápida glucogenólisis muscular y acumulación de hexosas monofosfato y lactato en el músculo, con una disminución concomitante de la fosfocreatina (11). El flujo sanguíneo muscular es impedido durante la contracción intensa, la cual en combinación con altas tasas de gasto energético, provoca que el músculo implicado en el ejercicio se vuelva hipóxico (74). Durante la recuperación de la contracción, el músculo experimenta una hiperemia postcontracción y los fluidos entran a los compartimientos intersticial e intracelular (12). El estrés metabólico en el músculo contribuye a la elevación de la frecuencia cardiaca y la presión arterial inducida por la contracción, y de manera interesante, la presión sanguínea se mantiene elevada si es ocluido el flujo sanguíneo al músculo fatigado, así previniendo la recuperación metabólica (66). El levantamiento de pesas provoca una respuesta simpatoadrenal medular, como es indicado por la elevación de las catacolaminas plasmáticas postcontracción (75, 76). Además, el levantamiento de pesas parece influenciar diferentes respuestas de hormonas anabólicas y factores de crecimiento (74, 77).
CONCLUSIÓN
La actividad física debería ser vista como un estímulo que promueve adaptaciones específicas y variadas dependiendo del tipo, intensidad y duración del ejercicio realizado. Está claro que las adaptaciones crónicas al estrés agudo de la actividad física promueven la salud (78). La caminata prolongada a baja intensidad presenta poco estrés metabólico, hormonal o cardiovascular, y la mayor perturbación con respecto al estado de reposo parece ser que la oxidación de grasas y la movilización de ácidos grasos libres plasmáticos se incrementan por una combinación de incremento de la lipólisis y disminución de la reesterificación, al menos cuando el sujeto está en estado de ayuno. El trote más intenso o la carrera estimulan considerablemente el incremento de la oxidación de glucógeno y triacilglicéridos, los cuales son almacenados directamente dentro de las fibras musculares. Además, estas reservas intramusculares de carbohidratos y grasas parecen ser los sustratos principales para la mejora de la capacidad oxidativa y de rendimiento derivada del entrenamiento de resistencia-inducida por el incremento de la densidad mitocondrial. El levantamiento de pesas que produce fatiga en períodos cortos (i.e., en 15-90 s y después de <15 contracciones repetitivas) provoca un alto grado de reclutamiento de unidades motoras y estimulación de las fibras musculares. Este es un estímulo notablemente potente para alterar la síntesis proteica en el músculo e incrementar la función neuromuscular.
Dirección para Envió de Correspondencia
E. F. Coyle, University of Texas at Austin, Room 222, Bellmont Hall, Austin, TX 78712.
Referencias
1. Centers for Disease Control and Prevention, National Center for Chronic Disease and Health Promotion (1996). Physical activity and health: a report of the Surgeon General. Washington, DC: US Government Printing Office
2. Essig DA (1996). Contractile activityinduced mitochondrial biogenesis in skeletal muscle. Exerc Sport Sci Rev; 24: 289319
3. Williams RS, Neufer PD (1996). Regulation of gene expression in skeletal muscle by contractile activity. In: Rowell LB, Shepherd JT, eds. Handbook of physiology. New York: Oxford University Press; 112450
4. American College of Sports Medicine (1990). The recommended quantity and quality of exercise for developing and maintaining cardiovascular and muscular fitness in healthy adults. Med Sci Sports Exerc;22:26574
5. Holloszy JO, Coyle EF (1984). Adaptations of skeletal muscle to endurance exercise and their metabolic consequences. J Appl Physiol; 56:8318
6. Romijn JA, Coyle EF, Sidossis L, et al (1993). Regulation of endogenous fat and carbohydrate metabolism in relation to exercise intensity and duration. Am J Physiol; 265: E38091
7. Costill DL, Coyle EF, Dalsky G, Evans W, Fink W, Hoopes D (1977). Effects of elevated plasma FA and insulin on muscle glycogen usage during exercise. J Appl Physiol; 43: 6959
8. Bergstrom J, Hultman E (1966). The effect of exercise on muscle glycogen and electrolytes in normals. Scand J Clin Invest 1966; 18: 1620
9. Putman CT, Spriet LL, Hultman E, et al (1993). Pyruvate dehydrogenase activity and acetyl group accumulation during exercise after different diets. Am J Physiol; 265: E75260
10. Webb P, Saris WHM, Schoffelen PFM, Van Ingen Schenau GJ, Ten Hoor F (1988). The work of walking: a calorimetric study. Med Sci Sports Exerc; 20: 3317
11. Hultman E, Greenhaff PL, Ren J-M, Soderlund K (1991). Energy metabolism and fatigue during intense muscle contraction. Biochem Soc Trans; 19: 34753
12. Rowell LB, Shepherd JT (1996). regulation and integration of multiple systems. eds. Handbook of physiology, section 12: exercise. New York: Oxford University Press
13. Wilmore JH, Costill DL (1994). Physiology of sport and exercise. Champaign, IL: Human Kinetics
14. Wathen D. (1994). Essentials of strength training and conditioning. Load assignment. In: Bacchle T, ed. Champaign, IL: Human Kinetics: 43547
15. Sale DG (1987). Influence of exercise and training on motor unit activation. Exerc Sport Sci Rev;15:95151
16. Johnson MA, Polgar J, Weightman JD, Appleton D (1973). Data on the distribution of fiber types in thirty-six human muscles. J Neurol Sci;18:11129
17. Caiozzo VJ, Haddad F, Baker MJ, Baldwin KM (1996). Influence of mechanical loading on myosin heavy-chain protein and Mrna isoform expression. J Appl Physiol;80:150312
18. Caiozzo VJ, Haddad F, Baker MJ, Herrick RE, Prietto N, Baldwin KM (1996). Microgravity-induced transformations of myosin isoforms and contractile properties of skeletal muscle. J Appl Physiol;81: 12332
19. Coyle EF (1995). Substrate utilization during exercise in active people. Am J Clin Nutr;61(suppl):S96879
20. van der Vusse GJ, Reneman RS (1996). Lipid metabolism in muscle. In: Rowell LB, Shepherd JT, eds. Handbook of physiology. New York: Oxford University Press, 95294
21. Coyle EF, Jeukendrup AE, Wagenmakers AJM, Saris WHM (1997). Fatty acid oxidation is directly regulated by carbohydrate metabolism during exercise. Am J Physiol; 273: E26875
22. Saddik M, Gamble J, Witters LA, Lopaschuk GD (1993). Acetyl-CoA carboxylase regulation of fatty acid oxidation in the heart. J Biol Chem; 268: 2583645
23. Saha AK, Kurowski TG, Ruderman NB (1995). A malonyl-CoA fuel-sensing mechanism in muscle: effects of insulin, glucose, and denervation. Am J Physiol;269:E2839
24. Winder WW, Arogyasami J, Barton RJ, Elayan IM, Vehrs PR (1989). Muscle malonyl-CoA decreases during exercise. J Appl Physiol; 67:22303
25. Coyle EF, Hagberg JM, Hurley BF, Martin WH, Ehsani AA, Holloszy JO (1983). Carbohydrate feedings during prolonged strenuous exercise can delay fatigue. J Appl Physiol; 55: 2305
26. Sahlin K, Katz A, Broberg S (1990). Tricarboxylic acid cycle intermediates in human muscle during prolonged exercise. Am J Physiol; 259:C83441
27. Wagenmaker AMJ, Beckers EJ, Brouns F, et al (1991). Carbohydrate supplementation, glycogen depletion, and amino acid metabolism during exercise. Am J Physiol;260:E88390.[Abstract/Free Full Text]
28. Spencer MK, Yan Z, Katz A (1992). Effect of low glycogen on carbohydrate and energy metabolism in human muscle during exercise. Am J Physiol; 262: C97599
29. Soop M, Bjorkman O, Cederblad G, Hagenfeldt, Wahren J (1988). Influence of carnitine supplementation on muscle substrate and carnitine metabolism during exercise. J Appl Physiol;64:23949
30. Trappe SW, Costill DL, Goodpaster B, Vukovich MD, Fink WJ (1994). The effects of L-carnitine supplementation on performance during interval swimming. Int J Sports Med;15: 1815
31. Terjung RL, Mackie BG, Dudley GA, Kaciuba-Uscilko H (1983). Influence of exercise on chylomicron triacylglycerol metabolism: plasma turnover and muscle uptake. Med Sci Sports Exerc;15: 3407
32. Wasserman DH, Cherrington AD (1996). Regulation of extramuscular fuel sources during exercise. In: Rowell LB, Shepherd JT, eds. Handbook of physiology. New York: Oxford University Press, 103674
33. Ahlborg G, Felig P (1976). Influence of glucose ingestion on the fuel-hormone responses during prolonged exercise. J Appl Physiol; 41: 6838
34. Coggan AR, Coyle EF (1987). Reversal of fatigue during prolonged exercise by carbohydrate infusion or ingestion. J Appl Physiol; 63: 238895
35. Coggan AR, Coyle EF (1988). Effect of carbohydrate feedings during high-intensity exercise. J Appl Physiol;65:17039
36. McConell G, Fabris S, Proietto J, Hargreaves M (1994). Effect of carbohydrate ingestion on glucose kinetics during exercise. J Appl Physiol; 77: 153741
37. Hawley JA, Bosch AN, Weltan SM, Dennis SC, Noakes TD (1994). Effects of glucose ingestion or glucose infusion on fuel substrate kinetics during prolonged exercise. Eur J Appl Physiol 1994;68:3819
38. Coyle EF, Hamilton MT, Alonso JG, Montain SJ, Ivy JL (1991). Carbohydrate metabolism during intense exercise when hyperglycemic. J Appl Physiol;70:83440
39. Wolfe RR, Klein S, Carraro F, Weber JM (1990). Role of triglyceride-fatty acid cycle in controlling fat metabolism in humans during and after exercise. Am J Physiol; 258: E3829
40. Arner P, Kriegholm E, Engfeldt P, Bolinder J (1990). Adrenergic regulation of lipolysis in situ at rest and during exercise. J Clin Invest; 85:8938
41. Campbell PJ, Carlson MG, Hill JO, Nurjhan N (1992). Regulation of free fatty acid metabolism by insulin in humans: role of lipolysis and reesterification. Am J Physiol; 26: E10639
42. Smoak B, Deuster P, Rabin D, Chrousos G (1991). Corticotropin-releasing hormone is not the sole factor mediating exercise-induced adrenocorticotropin release in humans. J Clin Endocrinol Metab; 73: 3026
43. Young DR, Shapira J, Forrest R, Adachi RR, Lim R, Pelligra R (1967). Model for evaluation of fatty acid metabolism in man during prolonged exercise. J Appl Physiol;23:71625
44. Montain SJ, Hopper MK, Coggan AR, Coyle EF (1991). Exercise metabolism at different time intervals after a meal. J Appl Physiol; 70: 8828
45. Benade AJS, Jansen CR, Rogers GG, Wyndham CH, Strydom NB (1973). The significance of an increased RQ after sucrose ingestion during prolonged aerobic exercise. Pflugers Arch;342:199206
46. Marmy-Conus N, Fabris S, Proietto J, Hargreaves M (1996). Preexercise glucose ingestion and glucose. J Appl Physiol; 81: 8537
47. Keizer HA, Kuipers H, Van Kranenburg G, Geurten P (1986). Influence of liquid and solid meals on muscle glycogen resynthesis, plasma fuel hormone response, and maximal physical working capacity. Int J Sports Med; 8: 99104
48. Klein S, Coyle EF, Wolfe RR (1994). Fat metabolism during low-intensity exercise in endurance-trained and untrained men. Am J Physiol; 267: E93440
49. Coggan AR, Kohrt WM, Spina RJ, Bier DM, Holloszy JO (1990). Endurance training decreases plasma glucose turnover and oxidation during moderate-intensity exercise in men. J Appl Physiol; 68: 9906
50. Richter EA (1996). Glucose utilization. In: Rowell LB, Shepherd JT, eds. Handbook of physiology. New York: Oxford University Press, 91251
51. Ren JM, Hultman E (1990). Regulation of phosphorylase a activity in human skeletal muscle. J Appl Physiol; 69: 91923
52. Oasci LB, Essig DA, Palmer WK (1990). Lipase regulation of muscle triglyceride hydrolysis. J Appl Physiol; 69: 15717
53. Coyle EF, Coggan AR, Hemmert MK, Ivy JL (1986). Muscle glycogen utilization during prolonged strenuous exercise when fed carbohydrate. J Appl Physiol;61:16572
54. Coggan AR, Coyle EF (1991). Carbohydrate ingestion during prolonged exercise: effects on metabolism and performance. Exerc Sport Sci Rev;19:140
55. Galbo H, Christensen HJ, Holst JJ (1977). Glucose induced decrease in glucagon and epinephrine response to exercise in man. J Appl Physiol; 42: 52530
56. Clutter WE, Bier DM, Shah SD, Cryer PE (1980). Epinephrine plasma metabolic clearance rates and physiologic thresholds for metabolic hemodynamic actions in man. J Clin Invest; 66: 94101
57. Galbo H, Holst JJ, Christensen NJ (1979). The effect of different diets and of insulin on the hormonal response to prolonged exercise. Acta Physiol Scand; 107: 1932
58. Fukatsu A, Sato N, Shimizu H (1996). 50-mile walking race suppresses neutrophil bactericidal function by inducing increases in cortisol and ketone bodies. Life Sci;58:233743.[Medline]
59. Kajiura JS, MacDougall JD, Ernst PB, Younglai EV (1995). Immune response to changes in training intensity and volume in runners. Med Sci Sports Exerc; 27: 11117
60. Coyle EF, Coggan AR, Hemmert MK, Lowe RC, Walters TJ (1985). Substrate usage during prolonged exercise following a preexercise meal. J Appl Physiol; 59: 42933.[Abstract/Free Full Text]
61. Costill DF, Coyle EF, Dalsky G, Evans W, Fink W, Hoopes D (1977). Effects of elevated plasma FA and insulin on muscle glycogen usage during exercise. J Appl Physiol;43:6959.[Abstract/Free Full Text]
62. Hurley BF, Nemeth PM, Martin WH III, Hagberg JM, Dalsky GP, Holloszy JO (1986). Muscle triglyceride utilization during exercise: effect of training. J Appl Physiol;60:5627
63. Martin WH III, Dalsky GP, Hurley BF, et al (1993). Effect of endurance training on plasma free fatty acid turnover and oxidation during exercise. Am J Physiol; 265: E70814.[Abstract/Free Full Text]
64. Vock R, Hoppeler H, Claassen H, et al (1996). Design of the oxygen and substrate pathways, VI: structural basis of intracellular substrate supply to mitochondria in muscle cells. J Exp Biol; 199: 168997
65. Waldrop TG, Eldridge FL, Iwamoto GA, Mitchell JH (1996). Central neural control of respiration and circulation during exercise. In: Rowell LB, Shepherd JT, eds. Handbook of physiology. New York: Oxford University Press, 33380
66. Rowell LB (1993). Human cardiovascular control. New York: Oxford University Press
67. Andersen P, Saltin B (1985). Maximal perfusion of skeletal muscle in man. J Physiol (Lond);366:23349
68. Lewis SF, Snell PG, Taylor WF, et al (1985). Role of muscle mass and mode of contraction in circulatory responses to exercise. J Appl Physiol;58:14651
69. Sawka MN, Knowlton RG, Critz JB (1979). Thermal and circulatory responses to repeated bouts of prolonged running. Med Sci Sports Exerc;11:17780
70. Montain SJ, Coyle EF (1992). Fluid ingestion during exercise increases skin blood flow independent of blood volume. J Appl Physiol;73:90310
71. Kraemer WJ, Gordon SE, Fleck SJ, et al (1991). Endogenous anabolic hormonal and growth factor responses to heavy resistance exercise in males and females. Int J Sports Med; 12: 22835
72. Fitts RH (1994). Cellular mechanisms of muscle fatigue. Physiol Rev;74:4994
73. Dziados JE, Fry AC, Frykman PN, Harman EA (1991). Effects of high-intensity cycle exercise on sympathoadrenal-medullary response patterns. J Appl Physiol; 70: 814
74. Fry AC, Kraemer WJ, Van Borselen F, et al (1994). Catecholamine responses to short-term high-intensity resistance exercise overtraining. J Appl Physiol; 77: 9416
75. Kraemer WJ, Marchitelli L, Gordon SE, et al (1990). Hormonal and growth factor responses to heavy resistance exercise protocols. J Appl Physiol; 69: 144250
76. Pate RR, Pratt M, Blair SN, et al (1995). Physical activity and public health: a recommendation from the Centers for Disease Control and Prevention and the American College. of Sports Medicine. JAMA; 273: 4027