La Hiperoxia Mejora la Capacidad de Sprint Repetido y la Carga de Entrenamiento Asociada en Atletas
Shannon Cyr-Kirk y François Billaut
Département de kinésiologie, Université Laval, Quebec City, QC, Canada
Artículo publicado en el journal PubliCE del año 2022.
Publicado 21 de septiembre de 2022
Resumen
INTRODUCCIÓN
La naturaleza y la magnitud del efecto de un entrenamiento están dictadas por la frecuencia, duración e intensidad del ejercicio; la llamada carga de entrenamiento (TL). Esos parámetros se modulan varias veces durante un ciclo de entrenamiento para controlar la acumulación de fatiga y garantizar adaptaciones fisiológicas específicas y progresivas. Es bien sabido que la mejora en el rendimiento atlético es atribuible a la fluctuación controlada de la TL a lo largo del año (Fitz-Clarke y cols., 1991). Por lo tanto, la comprensión y la cuantificación del impacto de diversos estímulos sobre la TL representan un elemento clave para la optimización del rendimiento deportivo (Foster y cols., 2001).
Entre los múltiples estímulos utilizados por los atletas y entrenadores para aumentar la TL y promover las adaptaciones fisiológicas, la suplementación con oxígeno (es decir, la hiperoxia) parece muy atractiva debido a las funciones cardiopulmonares, neuromusculares y metabólicas que dependen de este gas (Sperlich y cols., 2017). Con una popularidad creciente desde su aprobación por la Agencia Mundial Antidopaje (AMA) en 2001, la hiperoxia puede obtenerse aumentando la fracción de oxígeno inspirado (FIO2, hiperoxia normobárica) y/o la presión barométrica (hiperoxia hiperbárica). El rendimiento durante el ejercicio aeróbico, como las pruebas contrarreloj, el tiempo hasta el agotamiento, las pruebas de ejercicio gradual y las pruebas de función muscular dinámica, no sorprende que mejore de forma aguda en condiciones hiperóxicas (Peltonen y cols., 2001; Tucker y cols., 2007; Manselin y cols., 2017). Esas mejoras se derivan principalmente del aumento de la saturación de la hemoglobina arterial (SaO2), el contenido arterial de oxígeno (CaO2) y, por lo tanto, el suministro sistémico de O2 a los órganos y músculos esqueléticos (Powers y cols., 1993; Peltonen y cols., 1995). Estas mejoras atenúan la hipoxemia inducida por el ejercicio (Nummela y cols., 2002) y alteran el metabolismo energético (Linossier y cols., 2000). La hiperoxia también se ha utilizado durante el ejercicio repetido de alta intensidad y los resultados son prometedores. Como tal, se ha documentado una mayor producción de potencia máxima y promedio cuando se respira O2 al 100%, en comparación con el aire ambiente, durante dos sprints ciclistas de 30 seg separados por 4 min (Kay y cols., 2008), durante cinco series de 40 sprints de brazadas de pecho de alta intensidad (~50 seg) (Sperlich y cols., 2011), y durante diez sprints de ciclismo de 15 seg intercalados con 45 seg de recuperación (Porter y cols., 2020). En general, estos datos indican que la hiperoxia puede ser beneficiosa para el rendimiento del ejercicio en diversos entornos deportivos, aunque los patrones de actividad de los deportes intermitentes, como deportes con raquetas y los deportes de equipo, han recibido una atención limitada hasta el momento.
Durante la mayoría de los deportes de equipo y de raqueta, los atletas repiten esfuerzos breves máximos o casi máximos (es decir, sprints, cambios de dirección, saltos) con recuperaciones cortas de intensidad baja a moderada a lo largo de la competencia. Esta cualidad física, llamada capacidad de sprint repetido (RSA), es fundamental para el éxito, y los entrenadores y el personal de apoyo utilizan diferentes métodos de entrenamiento para mejorar la RSA durante el entrenamiento (Billaut y Bishop, 2009; Bishop y cols., 2011; Girard y cols., 2011). Muchos factores metabólicos (por ej., resíntesis de fosfocreatina, glucólisis aeróbica y anaeróbica, acumulación de metabolitos) y neuromusculares (por ej., estrategias de activación muscular) determinan la RSA, que se han revisado en detalle en otros lugares (Billaut y Bishop, 2009; Bishop y cols., 2011; Girard y cols., 2011). Los esfuerzos máximos cortos dependen en gran medida de los sistemas metabólicos anaeróbicos para producir ATP (Gaitanos y cols., 1993). Sin embargo, la investigación con biopsia muscular también ha demostrado que la contribución de la glucólisis anaeróbica a la resíntesis de ATP disminuye y el metabolismo aeróbico se vuelve más crítico cuando se repiten los sprints (Bogdanis y cols., 1996). Esto está confirmado por estudios que utilizan la hipoxia para reducir la disponibilidad de oxígeno en los tejidos. Se demostró con espectroscopía de infrarrojo cercano (NIRS) que la reducción de la saturación arterial de O2 condujo a una disminución en la oxigenación muscular que perjudicó la RSA en atletas entrenados (Billaut y Buchheit, 2013; Willis y cols., 2017). Además, la recuperación del rendimiento entre sprints se alimenta puramente a través de fuentes de energía aeróbica, y se ha demostrado que la reoxigenación del tejido muscular es otro factor determinante de la RSA (Buchheit y Ufland, 2011; Billaut y Buchheit, 2013). Con tales cambios metabólicos que ocurren durante una sesión de entrenamiento de sprint repetido, uno puede esperar que una mezcla hiperóxica mejore algunos de los componentes aeróbicos de la RSA y, por lo tanto, mantener mejor el rendimiento. Una mayor intensidad de ejercicio o la posibilidad de realizar más repeticiones de sprint durante una sesión de entrenamiento determinada conduciría a una mayor TL y, teóricamente, a mayores adaptaciones al entrenamiento a lo largo del tiempo. Sin embargo, hasta donde sabemos, ningún estudio ha evaluado la influencia de HYP en RSA y la TL asociada.
Antes de promover dicha práctica en el entrenamiento, primero se puede evaluar la eficacia de agregar hiperoxia a una sesión de entrenamiento de sprints repetidos con atletas. Por lo tanto, esta investigación examinó los efectos de la hiperoxia normobárica aguda sobre la RSA, parámetros psicofisiológicos claves y la TL en atletas entrenados. Se planteó la hipótesis de que la hiperoxia mejoraría la reoxigenación muscular y mantendría mejor la activación muscular, lo que conduciría a una mayor RSA y TL.
MATERIALES Y MÉTODOS
Aprobación de ética
El estudio fue aprobado por el Comité de Ética de la Universidad Laval y se apegó a los principios establecidos en la Declaración de Helsinki. Los participantes dieron su consentimiento informado por escrito después de haber sido informados de los procedimientos experimentales, los riesgos asociados y los beneficios potenciales.
Participantes
Trece atletas (incluidas 5 mujeres) se ofrecieron como voluntarios para este estudio (media ±SD; edad, 23.0±2.7 años; masa corporal, 70.7±14.9 kg; estatura, 175.5±7.3 cm; porcentaje de grasa corporal, 14.00±4.38%). Todos los participantes eran no fumadores, no tenían problemas de salud y no usaban ningún medicamento ni ningún otro producto de tabaco/nicotina. Los participantes entrenaban 8 (rango de 6 a 12) horas por semana (en un deporte que incluía intervalos cortos de alta intensidad (por ej., baloncesto, hockey y bádminton). Los atletas evitaron el ejercicio vigoroso, drogas y suplementos nutricionales 48 hs antes de la prueba, y se abstuvieron de consumir alcohol y cafeína durante 12 hs. También se pidió a los atletas que consumieran una comida normal al menos 2 hs antes de cada sesión y que mantuvieran una carga de entrenamiento constante durante el transcurso del estudio.
Diseño experimental
Los participantes fueron el laboratorio para una visita preliminar y dos ensayos experimentales durante los cuales todos los procedimientos de prueba fueron realizados por el mismo investigador. Las sesiones se separaron de un mínimo de 2 días para evitar la fatiga y un máximo de 7 días.
Durante la primera visita, se registraron la estatura, la masa corporal y el porcentaje de grasa corporal (Tanita TBF-310; Tanita Corp. of America Inc., Arlington Heights, IL). La frecuencia cardíaca en reposo y la presión arterial (criterios de inclusión, <140/100 mm Hg) se tomaron antes de la prueba en posición sentada. El manillar y el asiento se ajustaron vertical y horizontalmente según las preferencias de cada participante, y los pies se aseguraron a los pedales con clips para los pies. Estos ajustes también se replicaron para todos los ensayos posteriores. Los participantes completaron una entrada en calor específica para RSA y estandarizada de 10 min en una bicicleta ergométrica con freno eléctrico controlada por computadora (Velotron Elite; RacerMate, Seattle, WA). Después de 3 minutos de descanso pasivo, los participantes realizaron una prueba de fuerza-velocidad (FV) para determinar la resistencia de ciclismo óptima (consulte los procedimientos de prueba de fuerza-velocidad a continuación). Los atletas tuvieron 5 min de recuperación pasiva y luego se familiarizaron con los procedimientos de la prueba de RSA. Los atletas ejecutaron una versión abreviada de la prueba de RSA (consulte los procedimientos de la Prueba de habilidad de sprint repetido a continuación) que incluía seis sprints de 6 seg mientras usaban la máscara de respiración solamente.
Después de la visita preliminar, los atletas fueron aleatorizados en un diseño cruzado simple ciego y se les pidió que realizaran una prueba de RSA en normoxia (NOR, FIO2 0.21) y en hiperoxia normobárica (HYP, FIO2 0.40). Las mezclas de gases normóxicos e hiperóxicos se suministraron mediante un concentrador de O2 de flujo continuo (New Life Intensity 10, AirSep Corporation, Buffalo, NY) y se administraron a través de una plataforma de 3 bolsas Douglas de 170 litros conectadas a una máscara facial (AltitudeTech Inc., Kingston, ON, Canadá). Después del calentamiento estandarizado, se equipó a los participantes con el dispositivo NIRS, electrodos de electromiografía y oxímetro de pulso. Para ambas pruebas experimentales, el aparato de respiración se instaló 1 min antes del comienzo de la prueba de RSA y se retiró después del último sprint. Se proporcionó una vuelta a la calma de 5 minutos después de cada prueba.
PROCEDIMIENTOS DE PRUEBA
Calentamiento estandarizado
Los atletas realizaron un calentamiento estandarizado antes de las pruebas de fuerza-velocidad y de RSA. Incluyó un total de 3 min de ciclismo de intensidad moderada, dos aceleraciones de 15 seg con 15 seg de recuperación activa, 1 min 30 seg de intensidad moderada y luego tres sprints de 6 seg al 80, 90 y 100% de su esfuerzo máximo con 24 seg de recuperación entre cada uno de ellos. Los últimos 3 min del calentamiento fueron de descanso pasivo donde los participantes podían permanecer sobre la bicicleta sin pedalear ni ponerse de pie.
Prueba de fuerza-velocidad
Los atletas realizaron cinco sprints máximos de ciclismo de 6 seg contra resistencias crecientes e intercalados con 4 min de recuperación pasiva. Los sprints se iniciaban con 5 seg de ciclismo a una cadencia estandarizada (entre 80 y 90 rpm) con la misma resistencia del siguiente sprint. A los atletas se les permitió ponerse de pie para las dos primeras pedaladas y luego permanecer sentados durante el sprint y se les recomendó encarecidamente que alcanzaran la máxima potencia lo más rápido posible (se dieron las mismas instrucciones para la prueba de RSA). Se obtuvieron las relaciones potencia-velocidad individuales, y la resistencia de ciclismo óptima se definió como la marcha para la que se alcanzó la potencia máxima de pedaleo.
Prueba de capacidad de sprint repetido
Después de una entrada en calor estandarizada, los participantes realizaron sprints consecutivos máximos de 6 seg en bicicleta, separados por 24 seg de descanso (19 seg de descanso pasivo y 5 seg de reaceleración progresiva del pedaleo) hasta el agotamiento en una bicicleta ergométrica con freno electrónico (Velotron Elite, RacerMate, Seattle, WA). Se colocó una tablet electrónica con una señal visual y audible directamente frente a los participantes para una cuenta regresiva precisa. Se pidió a los participantes que dejaran de pedalear inmediatamente al final del sprint, y el experimentador detenía la estrella de la cadena con el freno del ergómetro. La resistencia determinada durante la prueba de fuerza-velocidad se estableció al comienzo de la prueba RSA y no cambiaba después. Después de la prueba, se retiró toda la instrumentación y los participantes realizaron un enfriamiento a su propio ritmo de al menos 3 min.
Para reducir la variabilidad entre sujetos en la disminución del rendimiento y permitir un nivel de fatiga más estandarizado entre los participantes, ambas pruebas de RSA se detuvieron cuando los participantes completaron dos sprints consecutivos con una puntuación de disminución porcentual (SDEC) superior al 15% o si alcanzaban 20 sprints (Morin y cols., 2011). La SDEC a lo largo de los sprints se determinó como la diferencia porcentual entre el rendimiento total y el ideal (Glaister y cols., 2008), de la siguiente manera: SDEC = [100 × (rendimiento total/rendimiento ideal)]−100, donde el rendimiento total es la suma de la potencia máxima (PPO) de todos los sprints realizados, y el rendimiento ideal es la PPO más alta registrada multiplicada por el número de sprints realizados.
El ergómetro Velotron proporciona valores instantáneos, medios y máximos para la potencia de salida, la frecuencia de pedaleo y la velocidad a 23 Hz. El trabajo mecánico (kJ) realizado durante cada sprint se calculó integrando la curva de potencia instantánea durante los 6 seg del sprint. Se midió y calculó el número de sprints, la PPO y el trabajo mecánico total (Wtot, la suma del trabajo de todos los sprints). También se calculó la suma de los valores de trabajo mecánico para los sprints comunes (es decir, los sprints realizados por cada participante en las dos condiciones, Wcom). Por ejemplo, si un participante realizó 12 sprints en NOR y 14 sprints en HYP, sóolo se tomaban los primeros 12 sprints de cada condición para el cálculo de Wcom.
RESPUESTAS FISIOLÓGICAS AL EJERCICIO
Tasa de Agotamiento Percibido (RPE) y TL
El agotamiento percibido (RPEtot), la incomodidad percibida en las extremidades (RPElim) y la dificultad respiratoria percibida (RPEbre) se registraron a partir de una escala de Borg CR10 modificada después de cada sprint. Se pidió a los participantes que señalaran el número asociado con su esfuerzo percibido en una escala impresa.
La TL se calculó como el producto del trabajo mecánico total y el promedio de las puntuaciones de RPEtot durante la prueba de RSA. Este cálculo considera tanto la carga externa como la carga interna, lo cual es una herramienta válida y práctica para monitorear la carga de entrenamiento de los atletas (Gabbett y cols., 2017). Además, es utilizado por muchos profesionales del rendimiento deportivo en los campos de la fuerza y del acondicionamiento físico y la fisiología del deporte. Cálculo: TL = (Wtot × tasas medias de esfuerzo percibido).
Saturación arterial de O2 (SpO2) y frecuencia cardíaca (FC)
La SpO2 se estimó mediante oximetría de pulso (Nellcor Bedside; Nellcor Inc., Hayward, CA) con óptodes adhesivos colocados en la frente. Se ha demostrado que la reproducibilidad y la validez (coeficiente de correlación intraclase = 0.99) de este método de medición para saturaciones superiores al 80% concuerdan bien con el O2 de la hemoglobina en comparación con las mediciones de gases en sangre arterial (Romer y cols., 2007). La SpO2 y la FC se registraron en reposo, e inmediatamente después de cada sprint y cada período de recuperación. El valor más bajo de SpO2 registrado durante la prueba RSA se consideró como SpO2min.
Espectroscopia de infrarrojo cercano (NIRS)
Se instaló un aparato portátil de NIRS de longitud de onda dual con resolución espacial (PortaMon, Artinis Medical Systems BV, Países Bajos) en la parte distal del vientre del músculo vasto lateral del miembro inferior dominante (~15 cm por encima del borde proximal de la rótula), paralelo a las fibras musculares, para cuantificar los cambios en la absorción de la luz infrarroja cercana por parte de la oxihemoglobina/mioglobina (O2Hb/Mb) y la desoxihemoglobina/mioglobina (HHb/Mb). El grosor de los pliegues cutáneos se midió en el sitio de aplicación de la NIRS (9.0±4.6 mm) utilizando un calibrador de pliegues cutáneos Harpenden (British Indicators Ltd, West Sussex, Gran Bretaña) durante la sesión de familiarización y fue menos de la mitad de la distancia entre el emisor y el detector (es decir, 20 mm). Este grosor es adecuado para permitir que la luz del infrarrojo cercano atraviese el tejido muscular (McCully y Hamaoka, 2000). El dispositivo se empaquetó en una envoltura de plástico transparente para protegerlo del sudor y se fijó con cinta adhesiva.
Se usaron vendajes negros para cubrir el dispositivo de la luz de fondo que interfiere. Se marcó la posición del aparato con un bolígrafo indeleble para su reposicionamiento en la visita posterior.
Se utilizó una forma modificada de la ley de Beer-Lambert, utilizando dos longitudes de onda continuas (760 y 850 nm) y un factor de longitud de camino óptico diferencial de 4.95, para calcular las concentraciones micromolares en tejido de O2Hb/Mb, HHb/Mb y hemoglobina/mioglobina total. ([THb/Mb] = [O2Hb/Mb] + [HHb/Mb]). También se calculó el índice de saturación del tejido (TSI = [O2Hb/Mb]/[THb/Mb]). Los datos del ejercicio se normalizaron a una línea de base de 1 minuto registrada mientras se descansaba en la bicicleta antes del calentamiento de las visitas 2 y 3 (definido como 0 μM). Los datos NIRS se adquirieron continuamente a 10 Hz y luego se ajustaron utilizando un filtro de paso bajo Butterworth de décimo orden con una frecuencia de corte de 4 Hz. El análisis de la oxigenación muscular se limitó a [HHb/Mb] porque esta variable es menos sensible que [O2Hb/Mb] a las variaciones de perfusión durante la contracción y recuperación y está estrechamente relacionada con el contenido venoso de O2 (De Blasi y cols., 1993; Ferrari y cols., 2004) y al TSI porque este parámetro es independiente de la longitud de la trayectoria del fotón infrarrojo cercano en el tejido y refleja el equilibrio dinámico entre el suministro y el consumo de O2 en la microcirculación (Van Beekvelt y cols., 2001). A partir de la señal filtrada, se identificaron [HHb/Mb], [THb/Mb] y TSI máximos y mínimos para cada ciclo de sprint/recuperación a partir de una media móvil de 5 seg para identificar los límites superior e inferior máximos de las señales (Rodríguez y cols., 2018). Además, la amplitud de desoxigenación durante los sprints (Δ[HHb/Mb]ejercicio y ΔTSIejercicio) también se calculó como la diferencia promedio entre los valores máximos y mínimos de [HHb/Mb] y TSI para cada sprint. De manera similar, la amplitud de reoxigenación durante los períodos de recuperación posteriores al sprint (recuperación de Δ[HHb/Mb] y recuperación de ΔTSI) se calculó como la diferencia entre los valores máximos y mínimos de [HHb/Mb] y TSI para cada período de recuperación.
Los valores NIRS normalizados también se representaron como porcentaje de finalización de la prueba de RSA. Como el menor número de sprints realizados por un participante era cinco, los datos se dividieron en cinco segmentos para obtener el inicio (0%), 25, 50, 75 y 100% de finalización de la prueba, y se calcularon los promedios de todos los parámetros para cada segmento, tanto para el sprint como para los períodos de recuperación.
Electromiografía (EMG)
Las señales EMG del vasto lateral, recto femoral y gastrocnemio lateral se registraron desde la extremidad inferior dominante a través de electrodos de superficie (Delsys, Trigno Wireless, Boston, MA) durante cada sprint. Se realizó una preparación cuidadosa de la piel (afeitado, abrasión ligera y limpieza con un algodón con alcohol) en los sitios de los electrodos antes de cada prueba. Los electrodos se fijaron longitudinalmente (alineados en paralelo a la dirección de la fibra muscular subyacente) sobre el vientre muscular. La señal EMG se pre-amplificó y filtró (ancho de banda de 12 a 500 Hz, ganancia = 1000, frecuencia de muestreo de 2 kHz) y se registró con hardware Delsys (Bagnoli EMG System; Delsys, Inc., EE. UU.). Durante el post-procesamiento, el inicio y el final de la activación de todas las ráfagas de EMG en todos los músculos y cada sprint se detectaron manualmente. La actividad de cada músculo se determinó calculando la integral de la EMG (iEMG) y la frecuencia de potencia media (MPF) entre el inicio y el final de las últimas 6 ráfagas subsiguientes del sprint. Se totalizaron los valores de iEMG de cada músculo y se utilizó un nuevo parámetro sum-iEMG para representar la actividad muscular global durante los sprints (Billaut y Smith, 2009; Smith y Billaut, 2010; Billaut y cols., 2013). También se calculó la sum-iEMG para todos los sprints (sum-iEMGtot) y para los sprints comunes (sum-iEMGcom).
La eficiencia neuromuscular (NME) se calculó para cada sprint como la relación entre el trabajo y la suma-iEMG (NME = trabajo/sum-iEMG) y se expresó para todos los sprints (NMEtot) y para los sprints comunes (NMEcom). Una disminución en NME indicaría perturbaciones en la contractilidad muscular (Bigland-Ritchie, 1981). Los parámetros mecánicos y la EMG se informan como datos sin procesar y como porcentaje del valor del primer sprint. La normalización se ha utilizado ampliamente cuando se estudian los efectos de la fatiga sobre la producción de fuerza y la actividad EMG (Bigland-Ritchie, 1981; Hunter y cols., 2004).
Análisis estadístico
Todos los datos se informan como medias ±SD, porcentaje de valores normalizados o porcentaje de cambio de NOR. Las diferencias de NOR y HYP se analizaron utilizando el tamaño del efecto de Cohen (ES) ±90% de los límites de confianza y se compararon con el cambio más pequeño que valía la pena (0.2 multiplicado por la SD entre participantes), así como con los valores de trabajo y la PPO del primer sprint (Batterham y Hopkins, 2005; Hopkins y cols., 2009). Los tamaños del efecto se clasificaron como pequeños (>0.2), moderados (>0.5) y grandes (>0.8), y sólo se informan los efectos probables (>75%) (Batterham y Hopkins, 2005; Hopkins y cols., 2009).
RESULTADOS
Mediciones mecánicas y perceptivas
Las variables de rendimiento se presentan en la Tabla 1 y la Figura 1. La PPO alcanzada fue similar en ambas condiciones, pero HYP amplió el número de sprints realizados antes del agotamiento en comparación con NOR (diferencia entre grupos 14.5±8.6%, ES 0.28). El trabajo total realizado durante toda la serie también aumentó en HYP (13.6±6.8 %, ES 0.30), pero cuando se consideró el mismo número de sprints tanto en NOR como en HYP, el trabajo en estos sprints comunes no cambió significativamente (2.0±1.7%, ES 0.05). Se observaron efectos similares cuando se analizó la relación entre el trabajo y la masa corporal (J/kg) en Wtot (13.6±6.8%, ES 0.27) y Wcom (2.0±1.7%, ES 0.04).
Tabla 1. Cambios medios en el rendimiento y las respuestas perceptivas al ejercicio en la prueba de capacidad de sprint repetido en normoxia (NOR, FIO2: 0.21) o hiperoxia (HYP, FIO2: 0.40).
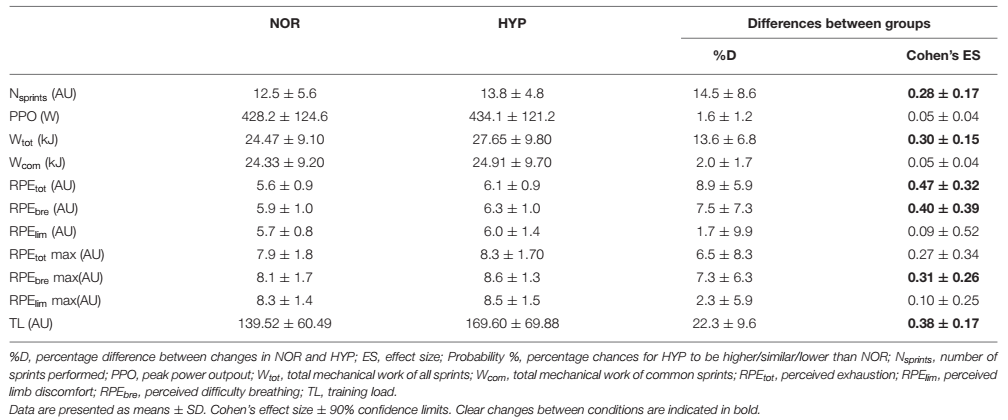
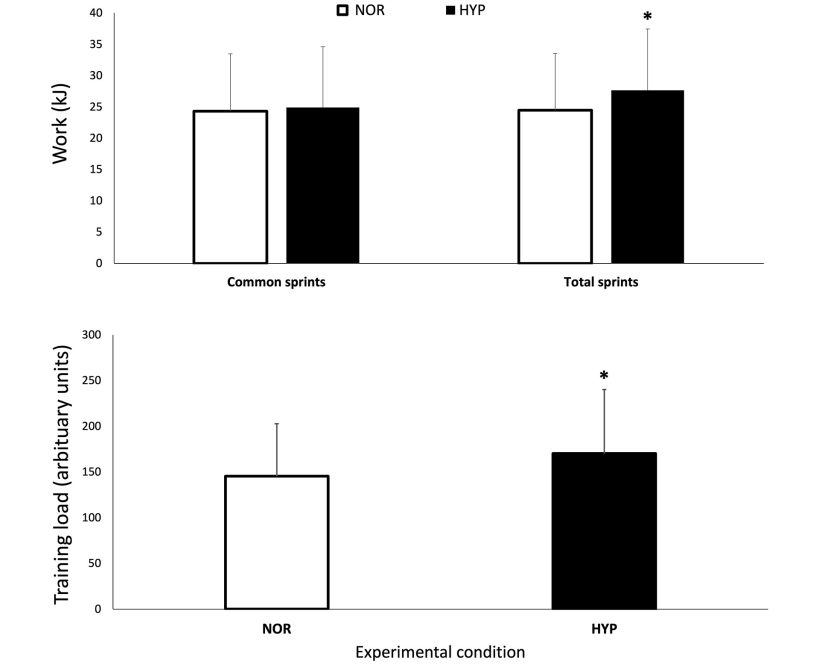
Figura 1. Trabajo mecánico realizado durante toda la serie de sprints (Wtot) y para el mismo número de sprints realizados en ambas condiciones (Wcom) carga de entrenamiento de la sesión sobre el test de capacidad de sprint repetido en normoxia e hiperoxia (FIO2 0.40). Los datos se presentan como medias ±SD. *Pequeño efecto entre condiciones. Los valores wtot fueron 24.47±9.1 kJ en NOR y 27.65±9.8 kJ en NYP. Los valores de Wcom fueron 24.33±9.2 kJ en NOR y 24.91±9.7 kJ en HYP. La TL se incrementó de 139.52±60.49 AU en NOR a 169.60±69.88 en HYP.
Es importante destacar que HYP también aumentó el TL de la sesión en un 19.4±7.0% (ES 0.33). HYP también aumentó RPEtot (8.9±5.9%, ES 0.47) y RPEbre (7.5±7.3%, ES 0.40). No hubo una diferencia clara entre las condiciones para RPElim.
Oxigenación arterial y frecuencia cardíaca
Respirar la mezcla hiperóxica aumentó la SpO2 promedio registrada durante toda la serie de sprints (2.7±0.8, ES 0.55), así como la SpO2 más baja (HYP 99.2+0.8 vs. NOR 95.1±2.1, diferencia 4.4±1.0, ES 1.85). Además, la FC fue menor en HYP (HYP 163.1±14.2 lat·min vs NOR 164.8±12.6 lat·min, diferencia −1.1±1.9, ES −0.24).
Oxigenación Muscular
La Figura 2 muestra los cambios en las variables NIRS sobre la prueba de RSA tanto en NOR como en HYP. Durante los sprints, las alteraciones metabólicas máximas ([HHb/Mb]max y TSImin) no fueron diferentes entre las condiciones, sin embargo, se observó que se produjo una mayor amplitud de desoxigenación muscular promedio cuando los sprints se realizaron en HYP en comparación con NOR (Δ[HHb/Mb]ejercicio: 25.2±11.7%, ES 0.36 y ΔTSIejercicio: 14.0±13.3%, ES 0.62).
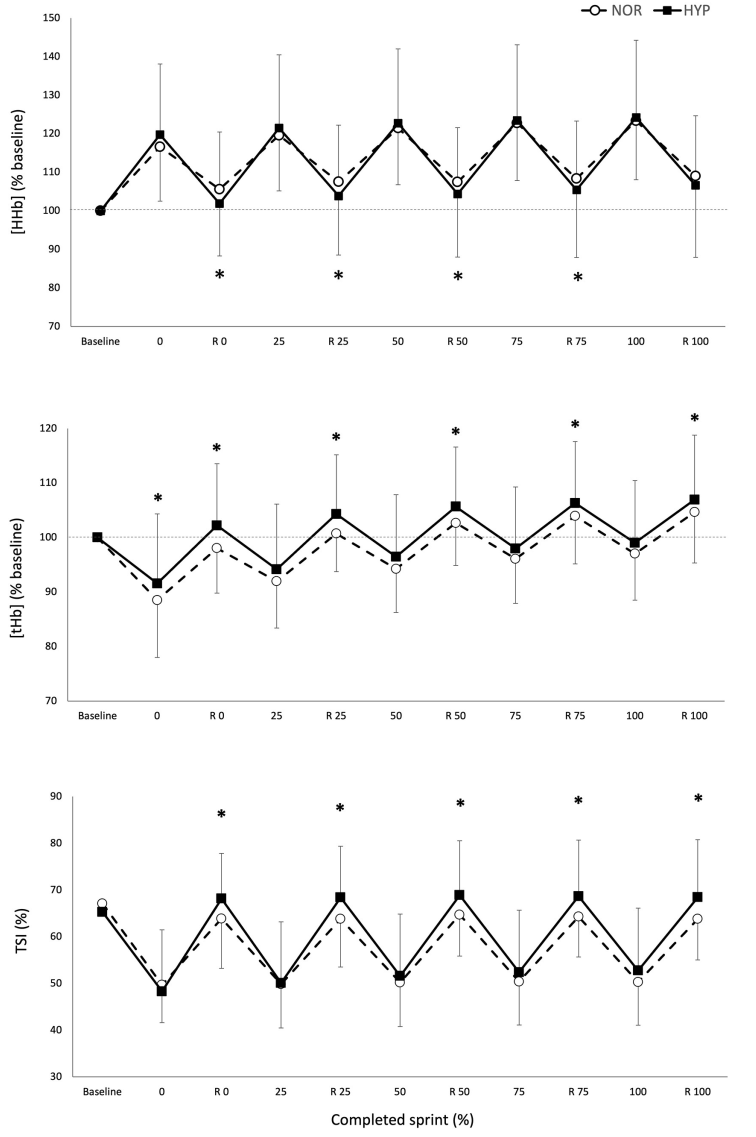
Figura 2. Valores máximos y mínimos de concentración normalizada de desoxihemoglobina/mioglobina [HHb/Mb], concentración total de hemoglobina/mioglobina [tHb/Mb] e índice de saturación tisular [TSI], sobre el número de sprints y períodos de recuperación (R) para los cinco porcentajes relativos de finalización de la prueba en normoxia e hiperoxia (Fi IO2 0.40). Los datos se presentan como medias ±SD, expresados como porcentaje de la línea de base. *Pequeño efecto entre condiciones.
El estado metabólico de los períodos de recuperación entre los sprints también se vio alterado por la condición. La reoxigenación muscular fue mayor en HYP (recuperación Δ[HHb/Mb]: 26.1±11.4%, ES .37 y recuperación ΔTSI: 27.8±15.7%, ES 0.53). Esto llevó a valores más bajos de [HHb/Mb]min en HYP al inicio (−3.5±4.1%, ES −0.25), 25% (−3.5±5.2%, ES −0.24), 50% (−3.2±5.1%, ES −0.22) y 75% (−3.0±5.5%, ES −0,21) de finalización de la prueba. Además, TSImax fue mayor en HYP al inicio (7.0±6.7%, ES 0.36), 25% (7,0 ± 6,9%, ES 0.36), 50% (5.8±7.8%, ES 0.30), 75% (5.9±7.8%, ES 0.31), y 100% (6.3±7.9%, ES 0.33) de finalización de la prueba. También se observó un aumento de [THb/Mb]max al inicio (4.3±4.7%, ES 0.45), 25% (3.3±3.9%, ES 0.35), 50% (2.7±3.5%, ES 0.29), 75% (2.1±3.4%, ES 0.22) y 100 % (1.9±3.5%, ES 0.21).
Actividad electromiográfica
La condición HYP aumentó la sum-iEMGtot en un 9.9 ± 12.1 % (ES 0.74) y sum-iEMGcom en un 10.2±12.0% (ES 0.77). Al observar los músculos individualmente, HYP aumentó el valor promedio del vasto lateral sum-iEMGtot en 10.3±11.8% (ES 0.71) y el de recto femoral la sum-iEMGtot en 14.8±16.7% (ES 0.93), mientras que no se observaron cambios en el gastrocnemio lateral.
Los valores de NME se presentan en la Figura 3. El valor medio de NMEtot aumentó en HYP (6.9±9.0%, ES 0.24), así como el valor medio de NMEcom (7.8±8.7 %, ES 0.27). Finalmente, MPF disminuyó de 82.3±13.9 Hz a 77.85±10.81 Hz en NOR y de 81.75±13.22 a 78.14±10.61 Hz en HYP, sin mostrar una diferencia clara entre las condiciones.
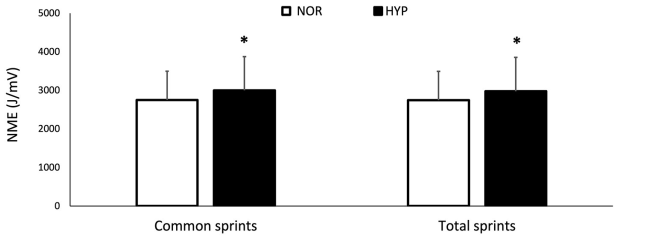
Figura 3. Cambios para la eficiencia neuromuscular (NME) sobre la serie completa de sprints (NMEtot) y para el mismo número de sprints realizados en ambas condiciones (NMEcom) sobre la prueba de capacidad de sprint repetido en normoxia e hiperoxia (FIO2 0.40). Los datos se presentan como medias ±SD. *Pequeño efecto entre condiciones. Los valores de NMEtot fueron 2747.12±746.54 AU en NOR y 2975.51±879.80 AU en HYP. Los valores de NMEcom fueron 2749.86±746.07 AU en NOR y 3000.14±872.70 AU en HYP.
Discusión
El presente estudio se realizó para evaluar los efectos agudos de respirar una mezcla hiperóxica sobre las respuestas psicofisiológicas y el rendimiento durante una prueba de capacidad de sprint repetido en atletas. Los principales resultados fueron que la hiperoxia mejoró la resistencia al sprint durante los sprints de ciclismo cortos y la carga de entrenamiento de la sesión. Esta mejora en el rendimiento mecánico puede deberse al aumento concomitante en los flujos de oxigenación muscular durante los sprints y los períodos de recuperación posteriores a la mejora en la saturación arterial de O2 y en la actividad neuromuscular.
Hiperoxia y carga de entrenamiento de la sesión de sprint repetido
El presente estudio demostró que los índices mecánicos del sprint inicial (trabajo y PPO) no fueron alterados por la condición HYP. Esto no sorprende, ya que la capacidad de producir una potencia máxima durante esfuerzos cortos se deriva principalmente de fuentes de energía anaeróbicas (Calbet y cols., 2003). Esto está en línea con el sólido hallazgo de que la reducción de FIO2 (es decir, la hipoxia) tampoco afecta la producción de potencia máxima (Balsom y cols., 1994; Smith y Billaut, 2010; Billaut y Buchheit, 2013). En conjunto, estos datos sugieren que el rendimiento máximo de corta duración está bien conservado frente a una amplia gama de FIO2. El rendimiento del sprint inicial está relacionado con la disminución mecánica que ocurre en los sprints posteriores (Bishop y cols., 2003), por lo que la influencia de este factor metodológico en la RSA puede excluirse en el presente estudio. Cuando se repiten los sprints, la acumulación de productos metabólicos finales vinculados a altas tasas de glucólisis anaeróbica induce la fatiga muscular. En este sentido, respirar más O2 puede atenuar la pérdida de potencia y prolongar el ejercicio. De hecho, los participantes produjeron un ~14% más de trabajo durante toda la serie en HYP en comparación con el aire ambiente, y este rendimiento mejorado probablemente provino de una mayor producción de ATP aeróbico (Calbet y cols., 2020). Este efecto ergogénico también se ha informado durante sprints de 15 a 30 seg de duración con 100% de O2 (Kay y cols., 2008; Porter y cols., 2020). Por lo tanto, los presentes datos se suman a la literatura de que una hiperoxia leve (40% O2) también puede mejorar la RSA durante esfuerzos muy cortos.
Además del mayor rendimiento, la condición HYP exacerbó la percepción de la respiración y del esfuerzo total. Esto puede ser sorprendente ya que se ha demostrado que la dificultad física que experimenta un atleta permanece igual o se reduce ligeramente con la respiración hiperóxica durante el ejercicio máximo, especialmente con FIO2 inferior a 1.00 (Sperlich y cols., 2017). Sin embargo, es importante señalar que tal hallazgo proviene principalmente del ejercicio de duración determinada en el que la mayor saturación de O2 mejora las funciones cardiopulmonares y metabólicas y la sensación de esfuerzo. En el estudio actual, los participantes se ejercitaron durante más tiempo, lo que podría explicar por qué percibieron la prueba de RSA como más agotadora. Se necesitará más investigación para desentrañar qué mecanismos (por ejemplo, la facilidad para respirar, la liberación de neurotransmisores) juegan un rol fundamental en la modificación de la sensación del esfuerzo.
En general, HYP aumentó la TL de la sesión en ~19%, y esto ocurrió en 12 de los 13 participantes. Otro resultado interesante, con aplicaciones prácticas para el entrenamiento, fue que HYP mejoró el rendimiento al aumentar el número de repeticiones sin alterar el trabajo realizado durante los sprints de sesión que eran comunes a ambas condiciones. Esto representa un impacto ergogénico diferente de la hiperoxia durante los sprints cortos frente a los largos, en los que la producción de potencia parece aumentar durante el sprint (Kay y cols., 2008; Porter y cols., 2020). Esto probablemente se deba a las diferentes energías de los músculos durante los esfuerzos de duración variable (Calbet y cols., 2020). Dado que los procesos aeróbicos se vuelven más predominantes a medida que se repiten los sprints de 6 seg (Gaitanos y cols., 1993), no sorprende observar el impacto ergogénico de la hiperoxia en las últimas etapas de un protocolo de RSA. Esta diferencia también puede deberse a la hiperoxia leve utilizada en el presente estudio en comparación con una FIO2 de 1.0 en estudios anteriores. No obstante, para el entrenador o científico del deporte que busca aumentar la TL durante las sesiones de RSA con atletas de deportes de equipo y de raqueta, puede ser más relevante usar ejercicios de circuito abierto en los que los atletas puedan realizar más repeticiones antes de finalizar una sesión. De acuerdo con el principio de sobrecarga, realizar más repeticiones de un ejercicio desencadenará cambios mecánicos y/o fisiológicos que, con el tiempo, deberían mejorar la función neuromuscular y la capacidad de ejercicio. Por lo tanto, se puede argumentar que realizar algunos esfuerzos más durante cada sesión de sprint durante un mesociclo podría conducir a adaptaciones superiores. Dicho enfoque de entrenamiento debería probarse en estudios longitudinales periodizados a largo plazo.
Debido a la incomodidad de los generadores, la conFiguración más fácil para usar HYP durante las sesiones de RSA sería en interiores, cuando los atletas entrenan en ergómetros con una máscara facial conectada a un generador. De hecho, en muchos deportes, los atletas entrenan en gimnasios, espacios o laboratorios de fuerza y de acondicionamiento físico para complementar las actividades específicas al aire libre y aumentar su TL por encima de lo que se puede lograr al aire libre. En tales entornos, otra oportunidad sería usar generadores de HYP para llenar un espacio con mezclas hiperóxicas y hacer que los atletas se ejerciten más libremente en su interior. Hasta la fecha, el principal desafío para el uso de HYP en el campo es realmente la falta de generadores portátiles ligeros y prácticos para usar durante intensos periodos de ejercicio. Si bien algunos atletas pueden intentar respirar HYP a través de una máscara facial durante la recuperación entre series de ejercicio de alta intensidad, esto no es práctico y el desarrollo de avances tecnológicos ciertamente mejorará esta limitación para usar la exposición ambiental para adaptaciones fisiológicas específicas.
Hiperoxia y Oxigenación Arterial y Muscular
Aunque la hipoxemia rara vez se observa durante los protocolos de RSA al nivel del mar, aún puede desarrollarse durante protocolos de ejercicio más largos y dificultar el rendimiento (Billaut y Smith, 2010). Teniendo en cuenta los criterios definidos por Dempsey y Wagner (Dempsey y Wagner, 1999), los presentes resultados muestran que siete participantes experimentaron hipoxemia leve (>3% de caída de SpO2 desde los niveles de reposo) y un participante experimentó hipoxemia moderada (SpO2 <93%) durante la prueba. La disponibilidad de oxígeno juega un papel importante durante las pruebas de RSA. De hecho, la hipoxemia arterial impuesta por la hipoxia induce mayores perturbaciones metabólicas y reduce el rendimiento durante los sprints repetidos con recuperación breve (Billaut y Smith, 2010; Smith y Billaut, 2012; Willis y cols., 2017). Aquí, la condición HYP tuvo un claro impacto positivo para prevenir la caída de SpO2 y la mantuvo en 99-100% durante toda la prueba. Curiosamente, los cinco atletas que no mostraron una caída significativa en SpO2 en NOR fueron los que exhibieron la diferencia más pequeña en el trabajo mecánico entre NOR y HYP.
Hasta donde sabemos, el presente estudio es el primero en informar cambios en la oxigenación muscular durante sprints repetidos bajo hiperoxia. Las ganancias de rendimiento en HYP fueron concomitantes con mayores flujos de oxigenación muscular. Por lo general, la desoxigenación muscular aumenta rápidamente en el primer sprint y luego se estabiliza en los sprints posteriores, lo que indica una extracción máxima de O2 del músculo esquelético al comienzo del ejercicio (Buchheit y cols., 2009; Smith y Billaut, 2010; Buchheit y Ufland, 2011; Billaut y Buchheit, 2013). La condición HYP no pudo mejorar más este mecanismo ya que tanto [HHb/Mb]max como TSImin permanecieron similares a los observados en NOR. Sin embargo, Δ[HHb/Mb]ejercicio y ΔTSIejercicio aumentaron en HYP, lo que indica una mayor extracción de O2 del músculo periférico cuando hay más O2 disponible antes de alcanzar el límite máximo. Por lo tanto, se puede argumentar que la contribución relativa del metabolismo oxidativo frente a la glucólisis anaeróbica fue mayor durante los sprints en HYP, lo que contribuyó a prolongar el ejercicio.
Esta mayor contribución aeróbica durante el ejercicio probablemente fue posible a través de cambios durante la recuperación. La menor [HHb/Mb]min y mayor TSImax, Δ[HHb/Mb]recuperación y ΔTSIrecuperación sugieren que HYP también mejoró el estado de oxigenación del músculo durante los períodos de recuperación. La actividad muscular depende del equilibrio entre el suministro de O2 y el consumo de O2 por parte de las fibras del músculo esquelético, y el suministro convectivo de O2 está regulado por el flujo sanguíneo que alimenta los músculos activos y el contenido de O2 de la sangre. La condición HYP mejoró la SpO2 y también [THb/Mb]max, lo que sugiere un mayor volumen regional de sangre rica en O2. Aunque este estudio no midió el flujo sanguíneo per se, todavía es probable que el suministro y la utilización de O2 mejoraran durante la recuperación entre los sprints. La reoxigenación muscular juega un papel fundamental en la RSA (Buchheit y cols., 2009; Billaut y Buchheit, 2013). Los presentes resultados confirman estos hallazgos y juntos destacan la capacidad de reoxigenación muscular como un factor importante de la capacidad de reproducir el rendimiento mecánico en repeticiones de sprint posteriores. La recuperación de la fosfocreatina y la reoxigenación muscular después del ejercicio presenta cinéticas similares (Chance y cols., 1992; McCully y cols., 1994; Kime y cols., 2003), y se ha reportado que la hiperoxia acelera la resíntesis de fosfocreatina (Haseler y cols., 1998; Hogan y cols., 1999). Por lo tanto, es probable que una mejor reoxigenación muscular en HYP se haya traducido en una mejor resíntesis de PCr durante los períodos de recuperación y una mayor disponibilidad de PCr para los sprints posteriores. Otros factores alterados por la disponibilidad sistémica de O2 y el flujo sanguíneo muscular, como la acumulación de glucosa-6-fosfato, iones de hidrógeno (y la subsiguiente caída en el pH) y fosfatos inorgánicos, y la dependencia del metabolismo de las grasas para la energía no medidos en este estudio, pero detallados sólidamente en otro lugar (Sperlich y cols., 2017), también puede haber contribuido a extender la RSA.
Aunque el consumo periférico máximo de O2 durante los sprints no pareció diferir entre los ambientes, probablemente debido a la muy alta intensidad de los esfuerzos y al estrés ejercido sobre la vía oxidativa, el HYP aún generó marcadas amplitudes de oxigenación tisular tanto durante el sprint como durante la recuperación. Las fluctuaciones repetidas de la presión parcial tisular de O2 son necesarias para las adaptaciones de la capacidad oxidativa muscular (Daussin y cols., 2008; Casey y Joyner, 2012). Por lo tanto, además de aumentar la TL de una sesión per se, la hiperoxia también puede ser un estrés ambiental eficaz para inducir adaptaciones periféricas mediante la imposición de flujos de oxigenación muscular repetidos. Por ejemplo, Kon y cols. (2019) informaron una mejora en la curva de lactato en el ejercicio submáximo después de 3 semanas de entrenamiento de intervalos de sprint (sprint de 30 s) con 60 % de O2 en atletas universitarios, lo que podría estar relacionado con una mejora en la capacidad oxidativa mitocondrial. Por otro lado, el entrenamiento interválico de 6 semanas entre el 80 y el 100 % de la potencia aeróbica máxima con 30 % de O2 en ciclistas entrenados no resultó en ninguna mejora en la capacidad de fosforilación mitocondrial ni en los marcadores del contenido mitocondrial (Cardinale y cols., 2019). Los hallazgos actuales y previos son difíciles de reconciliar debido a la disparidad en las fracciones de O2 inspiradas utilizadas, el tipo de entrenamiento y probablemente también el estado físico y el perfil histoquímico y metabólico de los atletas. El entrenamiento de sprint repetido en hiperoxia debe investigarse ya que el entrenamiento RSA proporciona un estímulo muy diferente al entrenamiento de intervalos de alta intensidad (Billaut y Bishop, 2009; Bishop y cols., 2011; Girard y cols., 2011).
Hiperoxia y Activación Muscular
Bajo fatiga sustancial (evaluada en >10% del índice de fatiga o disminución del sprint), se suele observar una atenuación concomitante de la actividad EMG y el rendimiento mecánico en las repeticiones de sprint (Racinais y cols., 2007; Méndez-Villanueva y cols., 2008; Billaut y Buchheit, 2013). Esto sugiere que la capacidad de activar completamente los músculos que trabajan puede verse afectada por la pérdida de rendimiento mecánico. La actividad de las neuronas motoras está muy influenciada por la disponibilidad de O2 (Bigland-Ritchie y cols., 1986; Szubski y cols., 2006; Amann y cols., 2007). En la literatura de RSA, la reducción de SpO2 se ha correlacionado con la atenuación de la actividad EMG de superficie (Billaut y Smith, 2010), y también se ha demostrado que acentúa la disminución del control motor central evaluado a partir de la estimulación de los músculos periféricos (Billaut y cols., 2013). Por lo tanto, los presentes resultados sugieren que la suplementación con O2 durante los sprints ayuda a mantener una mayor activación muscular (como lo demuestra un ~10% más de índices de s-iEMG en HYP). La explicación más probable sería que la mayor perfusión y oxigenación tisular mejoró el entorno metabólico de los músculos que se contraen y atenuó la inhibición refleja que se origina en los aferentes del grupo III y IV, manteniendo así el impulso neural hacia los músculos esqueléticos (Amann y Dempsey, 2008).
También existe la posibilidad de que los cambios en los índices EMG estén relacionados, al menos en parte, con la excitabilidad del sarcolema y los cambios en la velocidad de conducción de los potenciales de acción. La excitabilidad de la membrana se ve afectada durante el ejercicio intenso y agotador como resultado de una menor actividad de la trifosfatasa de adenosina de sodio (Na+)/potasio (K+) para mantener el gradiente iónico transmembrana causado por la disminución del pH y la acumulación de fosfatos inorgánicos. Una mayor perfusión muscular y oxigenación durante los sprints podría haber alterado el metabolismo energético y la subsiguiente acumulación de subproductos y acidosis que resultaron en una menor disfunción del sarcolema (Linossier y cols., 2000). Los estudios futuros deberían investigar más sólidamente la atenuación potencial de la disminución mediada centralmente en el impulso neural y las alteraciones en la amplitud de la onda M.
Conclusión
Este estudio demostró que respirar una mezcla hiperóxica con 40% de O2 mejoró el trabajo total realizado y la carga de entrenamiento asociada durante una prueba de circuito abierto de RSA en atletas entrenados en equipos y deportes de raqueta. Este efecto ergogénico ocurrió simultáneamente con un aumento en los flujos de oxigenación muscular durante los sprints y los períodos de recuperación y en la actividad neuromuscular. Aunque este estudio mostró resultados prometedores sobre la efectividad de la hiperoxia leve para mejorar la TL durante las sesiones de RSA, aún quedan por explorar factores importantes como la manipulación de FIO2 y las proporciones óptimas de ejercicio/descanso para aplicaciones eficientes.
Declaración de Ética
Los estudios con participantes humanos fueron revisados y aprobados por el Comité de Ética de la Universidad Laval. Los pacientes/participantes dieron su consentimiento informado por escrito para participar en este estudio.
Conflicto de intereses
Los autores declaran que la investigación se realizó en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de interés.
Expresiones de gratitud
Los autores agradecen a los atletas por su participación en este estudio. También agradecemos sinceramente a todos los estudiantes de posgrado y pregrado de nuestro grupo de investigación por su valiosa ayuda, así como a la TMC Distribution por el generoso préstamo del concentrador de oxígeno.
Referencias
1. Amann, M., and Dempsey, J. A. (2008). Locomotor muscle fatigue modifies central motor drive in healthy humans and imposes a limitation to exercise performance. J. Physiol. 586, 161–173.
2. Amann, M., Romer, L. M., Subudhi, A. W., Pegelow, D. F., and Dempsey, J. A. (2007). Severity of arterial hypoxaemia affects the relative contributions of peripheral muscle fatigue to exercise performance in healthy humans. J. Physiol. 581, 389–403.
3. Balsom, P. D., Ekblom, B., and Sjödin, B. (1994). Enhanced oxygen availability during high intensity intermittent exercise decreases anaerobic metabolite concentrations in blood. Acta Physiol. Scand. 150, 455–456.
4. Batterham, A. M., and Hopkins, W. G. (2005). Making meaningful inferences about magnitudes. Sportscience 9, 6–14.
5. Bigland-Ritchie, B (1981). Emg/Force relations and fatigue of human voluntary contractions. Exerc. Sport Sci. Rev. 9, 75–117.
6. Bigland-Ritchie, B. R., Dawson, N. J., Johansson, R. S., and Lippold, O. C. (1986). Reflex origin for the slowing of motoneurone firing rates in fatigue of human voluntary contractions. J. Physiol. 379, 451–459.
7. Billaut, F., and Bishop, D. (2009). Muscle fatigue in males and females during multiple-sprint exercise. Sports Med. 39, 257–278.
8. Billaut, F., and Buchheit, M. (2013). Repeated-sprint performance and vastus lateralis oxygenation: effect of limited O2 availability. Scand. J. Med. Sci. Sports 23:e185–e193.
9. Billaut, F., Kerris, J. P., Rodriguez, R. F., Martin, D. T., Gore, C. J., and Bishop, D. J. (2013). Interaction of central and peripheral factors during repeated sprints at different levels of arterial O2 saturation. PLoS ONE 8:e77297.
10. Billaut, F., and Smith, K. (2009). Sex alters impact of repeated bouts of sprint exercise on neuromuscular activity in trained athletes. Appl. Physiol. Nutr. Metab. 34:689–99.
11. Billaut, F., and Smith, K. (2010). Prolonged repeated-sprint ability is related to arterial O2 desaturation in men. Int. J. Sports Physiol. Perform. 5, 197–209.
12. Bishop, D., Girard, O., and Mendez-Villanueva, A. (2011). Repeated-sprint ability — Part II. Sports Med. 41, 741–756.
13. Bishop, D., Lawrence, S., and Spencer, M. (2003). Predictors of repeated-sprint ability in elite female hockey players. J. Sci. Med. Sport 6, 199–209.
14. Bogdanis, G. C., Nevill, M. E., Boobis, L. H., and Lakomy, H. K. (1996). Contribution of phosphocreatine and aerobic metabolism to energy supply during repeated sprint exercise. J. Appl. Physiol. 80, 876–884.
15. Buchheit, M., Cormie, P., Abbiss, C. R., Ahmaidi, S., Nosaka, K. K., and Laursen, P. B. (2009). Muscle deoxygenation during repeated sprint running: effect of active vs. passive recovery. Int. J. Sports Med. 30, 418–425.
16. Buchheit, M., and Ufland, P. (2011). Effect of endurance training on performance and muscle reoxygenation rate during repeated-sprint running. Eur. J. Appl. Physiol. 111, 293–301.
17. Calbet, J. A. L., De Paz, J. A., Garatachea, N., de Vaca, S. C., and Chavarren, J. (2003). Anaerobic energy provision does not limit Wingate exercise performance in endurance-trained cyclists. J. Appl. Physiol. 94:668–76.
18. Calbet, J. A. L., Martín-Rodríguez, S., Martin-Rincon, M., and Morales-Alamo, D. (2020). An integrative approach to the regulation of mitochondrial respiration during exercise: focus on high-intensity exercise. Redox Biol. 35:101478.
19. Cardinale, D. A., Larsen, F. J., Lännerström, J., Manselin, T., Södergård, O., Mijwel, S., et al. (2019). Influence of hyperoxic-supplemented high-intensity interval training on hemotological and muscle mitochondrial adaptations in trained cyclists. Front. Physiol. 10:730.
20. Casey, D. P., and Joyner, M. J. (2012). Compensatory vasodilatation during hypoxic exercise: mechanisms responsible for matching oxygen supply to demand. J. Physiol. 590, 6321–6326.
21. Chance, B., Dait, M. T., Zhang, C., Hamaoka, T., and Hagerman, F. (1992). Recovery from exercise-induced desaturation in the quadriceps muscles of elite competitive rowers. Am. J. Physiol. 262, C766–C775.
22. Daussin, F. N., Zoll, J., Ponsot, E., Dufour, S. P., Doutreleau, S., Lonsdorfer, E., et al. (2008). Training at high exercise intensity promotes qualitative adaptations of mitochondrial function in human skeletal muscle. J. Appl. Physiol. 104, 1436–1441.
23. De Blasi, R. A., Cope, M., Elwell, C., Safoue, F., and Ferrari, M. (1993). Noninvasive measurement of human forearm oxygen consumption by near infrared spectroscopy. Eur. J. Appl. Physiol. 67, 20–25.
24. Dempsey, J. A., and Wagner, P. D. (1999). Exercise-induced arterial hypoxemia. J. Appl. Physiol. 87, 1997–2006.
25. Ferrari, M., Mottola, L., and Quaresima, V. (2004). Principles, techniques, and limitations of near infrared spectroscopy. Can. J. Appl. Physiol. 29, 463–487.
26. Fitz-Clarke, J. R., Morton, R. H., and Banister, E. W. (1991). Optimizing athletic performance by influence curves. J. Appl. Physiol. 71, 1151–1158.
27. Foster, C. G., Florhaug, J. A., Franklin, J. E., Gottschall, L., Hrovatin, L. A., Parker, S., et al. (2001). A new approach to monitoring exercise training. J. Strength Cond. Res. 15, 109–15.
28. Gabbett, T. J., Nassis, G. P., Oetter, E., Pretorius, J., Johnston, N., Medina, D., et al. (2017). The athlete monitoring cycle: a practical guide to interpreting and applying training monitoring data. Br. J. Sports Med. 51, 1451–1452.
29. Gaitanos, G. C., Williams, C., Boobis, L. H., and Brooks, S. (1993). Human muscle metabolism during intermittent maximal exercise. J. Appl. Physiol. 75, 712–719.
30. Girard, O., Mendez-Villanueva, A., and Bishop, D. (2011). Repeated-Sprint ability — Part I. Sports Med. 41, 673–694.
31. Glaister, M., Howatson, G., Pattison, J. R., and McInnes, G. (2008). The reliability and validity of fatigue measures during multiple-sprint work: an issue revisited. J. Strength Cond. Res. 22, 1597–1601.
32. Haseler, L. J., Richardson, R. S., Videen, J. S., and Hogan, M. C. (1998). Phosphocreatine hydrolysis during submaximal exercise: the effect of F I O 2. J. Appl. Physiol. 85:1457–63.
33. Hogan, M. C., Richardson, R. S., and Haseler, L. J. (1999). Human muscle performance and PCr hydrolysis with varied inspired oxygen fractions: a 31P-MRS study. J. Appl. Physiol. 86, 1367–1373.
34. Hopkins, W. G., Marshall, S. W., Batterham, A. M., and Hanin, J. (2009). Progressive statistics for studies in sports medicine and exercise science. Med. Sci. Sports Exerc. 41, 3–13.
35. Hunter, S. K., Critchlow, A., Shin, I.-S., and Enoka, R. M. (2004). Men are more fatigable than strength-matched women when performing intermittent submaximal contractions. J. Appl. Physiol. 96, 2125–2132.
36. Kay, B., Stannard, S. R., and Morton, R. H. (2008). Hyperoxia during recovery improves peak power during repeated wingate cycle performance. Braz. J. Biomotrocity. 2, 92–100.
37. Kime, R., Karlsen, T., Nioka, S., Lech, G., Madsen, Ø., Sæterdal, R., et al. (2003). Discrepancy between cardiorespiratory system and skeletal muscle in elite cyclists after hypoxic training. Dyn. Med. 2:4.
38. Kon, M., Nakagaki, K., and Ebi, Y. (2019). Effects of all-out sprint interval training under hyperoxia on exercise performance. Physiol. Rep. 7:14194.
39. Linossier, M. T., Dormois, D., Arsac, L., Denis, C., and Lacour, J. R. (2000). Effect of hyperoxia on aerobic and anaerobic performances and muscle metabolism during maximal cycling exercise. Acta Physiol. Scand. 168, 403–411.
40. Manselin, T. A., Södergård, O., Larsen, F. J., and Lindholm, P. (2017). Aerobic efficiency is associated with the improvement in maximal power output during acute hyperoxia. Physiol. Rep. 5:e13119.
41. McCully, K. K., and Hamaoka, T. (2000). Near-infrared spectroscopy: what can it tell us about oxygen saturation in skeletal muscle? Exerc. Sport Sci. Rev. 28, 123–127.
42. McCully, K. K., Iotti, S., Kendrick, K., Wang, Z., Posner, J. D., Leigh, J., et al. (1994). Simultaneous in vivo measurements of HbO2 saturation and PCr kinetics after exercise in normal humans. J. Appl. Physiol. 77, 5–10.
43. Mendez-Villanueva, A., Hamer, P., and Bishop, D. (2008). Fatigue in repeated-sprint exercise is related to muscle power factors and reduced neuromuscular activity. Eur. J. Appl. Physiol. 103, 411–419.
44. Morin, J.-B., Dupuy, J., and Samozino, P. (2011). Performance and fatigue during repeated sprints: what is the appropriate sprint dose? J. Strength Cond. Res. 25, 1918–1924.
45. Nummela, A., Hämäläinen, I., and Rusko, H. (2002). Effect of hyperoxia on metabolic responses and recovery in intermittent exercise. Scand. J. Med. Sci. Sports 12, 309–315.
46. Peltonen, J. E., Rantamäki, J., Niittymäki, S. P., Sweins, K., Viitasalo, J. T., and Rusko, H. K. (1995). Effects of oxygen fraction in inspired air on rowing performance. Med. Sci. Sports Exerc. 27, 573–579.
47. Peltonen, J. E., Tikkanen, H. O., and Rusko, H. K. (2001). Cardiorespiratory responses to exercise in acute hypoxia, hyperoxia and normoxia. Eur. J. Appl. Physiol. 85, 82–88.
48. Porter, M. S., Reed, K., and Jones, B. (2020). The use of acute oxygen supplementation upon muscle tissue saturation during repeat sprint cycling. J. Human Sport Exerc. 17.
49. Powers, S. K., Martin, D., and Dodd, S. (1993). Exercise-induced hypoxaemia in elite endurance athletes. Incidence, causes and impact on VO2max. Sports Med. 16, 14–22.
50. Racinais, S., Bishop, D., Denis, R., Lattier, G., Mendez-Villaneuva, A., and Perrey, S. (2007). Muscle deoxygenation and neural drive to the muscle during repeated sprint cycling. Med. Sci. Sports Exerc. 39, 268–274.
51. Rodriguez, R. F., Townsend, N. E., Aughey, R. J., and Billaut, F. (2018). Influence of averaging method on muscle deoxygenation interpretation during repeated-sprint exercise. Scand. J. Med. Sci. Sports 28, 2263–2271.
52. Romer, L. M., Haverkamp, H. C., Amann, M., Lovering, A. T., Pegelow, D. F., and Dempsey, J. A. (2007). Effect of acute severe hypoxia on peripheral fatigue and endurance capacity in healthy humans. Am. J. Physiol. Regul. Integr. Comp. Physiol. 292, R598–R606.
53. Smith, K. J., and Billaut, F. (2010). Influence of cerebral and muscle oxygenation on repeated-sprint ability. Eur. J. Appl. Physiol. 109, 989–999.
54. Smith, K. J., and Billaut, F. (2012). Tissue oxygenation in men and women during repeated-sprint exercise. Int. J. Sports Physiol. Perform. 7, 59–67.
55. Sperlich, B., Zinner, C., Hauser, A., Holmberg, H.-C., and Wegrzyk, J. (2017). The impact of hyperoxia on human performance and recovery. Sports Med. 47, 429–438.
56. Sperlich, B., Zinner, C., Krueger, M., Wegrzyk, J., Mester, J., and Holmberg, H. C. (2011). Ergogenic effect of hyperoxic recovery in elite swimmers performing high-intensity intervals. Scand. J. Med. Sci. Sports 21, e421–e429.
57. Szubski, C., Burtscher, M., and Löscher, W. N. (2006). The effects of short-term hypoxia on motor cortex excitability and neuromuscular activation. J. Appl. Physiol. 101, 1673–1677.
58. Tucker, R., Kayser, B., Rae, E., Rauch, L., Bosch, A., and Noakes, T. (2007). Hyperoxia improves 20 km cycling time trial performance by increasing muscle activation levels while perceived exertion stays the same. Eur. J. Appl. Physiol. 101, 771–781.
59. Van Beekvelt, M. C. P., Colier, W. N. J. M., Wevers, R. A., and Van Engelen, B. G. M. (2001). Performance of near-infrared spectroscopy in measuring local O2 consumption and blood flow in skeletal muscle. J. Appl. Physiol. 90, 511–519.
60. Willis, S. J., Alvarez, L., Millet, G. P., and Borrani, F. (2017). Changes in muscle and cerebral deoxygenation and perfusion during repeated sprints in hypoxia to exhaustion. Front. Physiol. 8:846.