Los Hombres Altamente Entrenados Fallan en Supercompensar en Forma Repetida sus Reservas Musculares de Glucógeno
Louise M Burke2, John A Hawley1, Patrick Mcinerney1, Sarah Lessard1, Vernon . G Coffey1, Robert J Southgate1 y Sonia Lo Giudice1
1Exercise Metabolism Group, School of Medical Sciences, Faculty of Health Sciences, RMIT University, Bundoora, 3083, Australia.
2School of Health Sciences, Deakin University, 221 Burwood Highway, Burwood, Australia, 3125.
Artículo publicado en el journal PubliCE, Volumen 0 del año 2005.
Publicado 17 de enero de 2007
Resumen
Palabras clave: síntesis de glucógeno, triacilglicerol muscular, glucógeno sintetasa
INTRODUCCION
Hace casi 40 años atrás, los investigadores suecos describieron un régimen extremo que implicaba la realización de ejercicio submáximo hasta el agotamiento, un período de ingesta restringida de carbohidratos (CHO) y el subsiguiente consumo de grandes cantidades de CHO dietarios, lo cual tenía como objetivo incrementar las reservas musculares y hepáticas de glucógeno (2). Este régimen de dieta y ejercicio elevó dramáticamente, o supercompensó, los niveles musculares de glucógeno y ayudó a prolongar el tiempo hasta el agotamiento durante la realización de ejercicios submáximos, en comparación con la ingesta de una dieta baja en CHO (1). La relación positiva entre los niveles pre-ejercicio de glucógeno muscular (y hepático) y la mejora en la capacidad de ejercicio llevó a que se diseñaran experimentos adicionales para determinar cual era el/los método/s óptimo/s para incrementar de manera máxima las reservas de glucógeno antes de la realización de ejercicios que provocaran la depleción del glucógeno (14, 18, 29).
Dependiendo del grado de depleción glucogénica, y suponiendo que se consume una adecuada cantidad de CHO y que el individuo reduce la cantidad de ejercicio que realiza, la completa restauración de las reservas musculares de glucógeno ocurre dentro de las 24 horas posteriores a la realización de ejercicios continuos prolongados de intensidad submáxima (1). Si bien se han descrito intervenciones con dieta y ejercicio para provocar la supercompensación de las reservas musculares de glucógeno y sus efectos sobre diversas formas simples de ejercicio (14), estos procedimientos no han abordado el problema de la competición deportiva que requiere de la realización de esfuerzos máximos repetidos: los deportistas de diversos eventos con frecuencia realizan series de ejercicio submáximo prolongado y/o de ejercicio intermitente de alta intensidad en día sucesivos y durante varias semanas (19). En este caso, la restauración de las reservas de glucógeno luego de la realización de ejercicios hasta el agotamiento es probablemente el factor más importante que determinará el tiempo necesario de recuperación antes de poder continuar o reanudar con actividades intensas (5). Hasta el momento no se sabe si los individuos entrenados pueden supercompensar sus reservas musculares de glucógeno luego de la realización de ejercicios que provocan la depleción de las mismas cuando el ejercicio se lleva a cabo en una rápida sucesión (~ 48 h).
Si bien se le ha prestado mucha atención a los determinantes de la acumulación de glucógeno post ejercicio (18), menos se sabe acerca del metabolismo del triacilglicerol (IMTG) muscular durante la recuperación. Kiens y Richter (20) reportaron que durante el período de recuperación post-ejercicio, la síntesis de glucógeno muscular tiene una prioridad metabólica tan alta que el IMTG es degradado a una mayor tasa para suministrar el combustible de lípidos necesario para el metabolismo oxidativo. Sin embargo, otros han reportado que el IMTG tiene un papel insignificante en el metabolismo durante el período de recuperación posterior a la realización de ejercicios hasta el agotamiento (21). Recientemente, van Loon et al. (31) mostraron que la reposición de IMTG luego de la realización de ejercicios prolongados de intensidad submáxima estaba reducida si los sujetos consumían una dieta característica rica en CHO en el período post-ejercicio. Además, estos investigadores especularon que dicho fenómeno podría resultar en una capacidad subóptima de rendimiento durante los períodos en que se repiten las pruebas de ejercicio de resistencia prolongado. De acuerdo con esto, en el presente estudio, hemos determinado los efectos de la realización de series repetidas de ejercicio hasta el agotamiento seguidas de una dieta alta en CHO sobre el metabolismo muscular del glucógeno y de los IMTG en sujetos bien entrenados. Nuestra hipótesis fue que si los atletas competitivos eran capaces de supercompensar de manera repetida sus reservas musculares de glucógeno e IMTG luego de la realización de ejercicios hasta el agotamiento y con el consumo de una dieta alta en CHO, estos podrían mantener su capacidad de ejercicio en las sesiones subsiguientes. Debido a que la carrera ha sido asociada con una inhibición de la acumulación de glucógeno debido a los miotraumas causados por la misma (16), hemos elegido estudiar el equilibrio del glucógeno muscular en ciclistas bien entrenados en lugar de utilizar corredores, ya que Costill et al. (6) han reportado previamente una desmejora en la resíntesis del glucógeno luego de la realización de ejercicios excéntricos.
METODOS
Sujetos
Nueve ciclistas/triatletas bien entrenados que realizaban ciclismo >15 horas/semana fueron voluntarios para participar en el presente estudio. De los nueve sujetos originales que comenzaron el estudio, dos sufrieron lesiones/enfermedades después de llevar a cabo alguna de las pruebas experimentales, mientras que otro de los sujetos abandonó el estudio después de la primera prueba. De esta manera, un total de seis sujetos completaron todo el protocolo de evaluación. La edad, masa corporal (BM), consumo de oxígeno pico (VO2 pico) y producción pico de potencia (PPO) de los sujetos fue de 28.3±1.8 años, 72.5±3.1 kg, 63.4±1.6 mL.kg-1.min-1, y 361±11 W (los datos son presentados como valores medios±EE). A cada sujeto se le explicaron los procedimientos y los posibles riesgos de la participación en el estudio y cada uno dio su consentimiento por escrito antes de comenzar su participación. El estudio fue aprobado por el Comité de Ética para la Investigación con Humanos de la Universidad RMIT.
Perspectiva del Estudio
Los sujetos completaron cuatro pruebas prolongadas de ciclismo hasta el agotamiento (EX) luego de consumir una dieta apropiada y de realizar ejercicio de control. La primera prueba EX fue utilizada para familiarizar a los sujetos con los protocolos de evaluación de laboratorio, y para realizar los procedimientos no invasivos. Una semana después de la prueba de familiarización, los sujetos comenzaron el período de intervención de 5 días que implicó la realización de tres pruebas EX, estando separada cada prueba por un período de 48 horas. Antes e inmediatamente después de completar cada una de estas tres pruebas de ejercicio, se recolectaron muestras musculares utilizando la técnica de biopsia. Los sujetos fueron alimentados con comidas que contenían un alto porcentaje de CHO y fueron monitoreados en las siguientes 3 horas del período de recuperación. Durante este período, se recolectaron muestras sanguíneas a intervalos regulares y al final del período de recuperación de 3 h se recolectaron biopsias musculares (pero no en el día 5, debido a consideraciones de los sujetos). En los días en que los sujetos no realizaron las pruebas de EX, estos realizaron un entrenamiento liviano (descrito a continuación).
Evaluaciones Principales
Los sujetos realizaron un test progresivo máximo de ciclismo en un ergómetro Lode (Groningen, Holanda) para la determinación de la PPO y del VO2 pico. El protocolo del test progresivo máximo comenzó con una carga equivalente a 3.3 W/kg de BM, y la carga se incrementó en 50 W cada 150 s, y luego en 25 W cada 150 s hasta que los sujetos alcanzaran el agotamiento (13). Durante la realización del test máximo los sujetos respiraron a través de una boquilla conectada a un sistema metabólico (MedGraphics CardiO2, St Paul, MN). Los gases espirados pasaron por un flujómetro, un analizador de O2 y uno de CO2 que fueron calibrados antes de cada test utilizando una jeringa de gases de concentración conocida (4.00% CO2y 16.00% O2) de 3L Hans-Rudolph. El flujómetro y los analizadores de gases fueron conectados a una computadora que calculaba la ventilación minuto, el consumo de oxígeno (VO2), la producción de CO2 (VCO2) y el índice de intercambio respiratorio (RER) a partir de ecuaciones convencionales. El test finalizaba en el punto en que se alcanzaba el agotamiento volitivo, definido como la incapacidad para mantener una cadencia > 700 rpm. El VO2 pico se definió como el valor más alto de VO2 obtenido en cualquier período de 60 s. La PPO fue calculada adicionando el trabajo realizado con la carga final al trabajo completado con la última carga que se completara exitosamente (13). Los valores individuales de PPO fueron utilizados para determinar las intensidades apropiadas de ejercicio a utilizar en las pruebas experimentales que se describen a continuación.
Control Dietario y del Ejercicio
En el día previo a la realización de la prueba de familiarización (FAM) y de la primera prueba experimental (día 1), se le suministró a cada sujeto una dieta con una proporción moderada de CHO la cual tenía un contenido energético total de 0.25 MJ/kg de BM que proveía de 6 g de CHO/kg de BM/día. Luego de la primera prueba experimental, y a lo largo de los restantes 5 días del período de intervención, los sujetos consumieron una dieta alta en CHO que cubría sus necesidades energéticas y que proveía de 12 g de CHO/kg de BM/día. Inmediatamente después de las pruebas de EX, en los días 1 y 3 (que se describen a continuación), los sujetos fueron alimentados con 4 g de CHO/kg de BM mediante alimentos ricos en CHO y fluidos de índice glucémico moderado a alto consumidos dentro de los 30 minutos. El resto de la ingesta dietaria (i.e., 8 g de CHO/kg de BM) necesaria para alcanzar el equilibrio energético fue consumido a lo largo del día. Todas las dietas fueron diseñadas por un nutricionista, y el control dietario incluyó la individualización de los planes alimentarios para cada sujeto en relación a la BM y a las preferencias alimentarias de los sujetos. Todos los alimentos y las bebidas fueron suministradas a los sujetos y fueron pre empaquetados para minimizar la cantidad de preparación requerida. A cada sujeto se les proporcionó una lista de alimentos para que registraran la ingesta diaria de los alimentos suministrados, cualquier proporción de alimentos que no consumieran, y cualquier ingesta adicional de fluidos. El día previo a las pruebas experimentales, los sujetos realizaron 60-120 min de ciclismo continuo de intensidad baja a moderada (~ 70 % del VO2 pico). La duración de esta sesión de entrenamiento dependió del volumen actual de entrenamiento de cada sujeto y varío entre los individuos. Sin embargo, la duración de estas sesiones de entrenamiento fue controlada rigurosamente y se mantuvo constante para cada sujeto a lo largo del período experimental.
Pruebas Experimentales
Los sujetos completaron tres series de EX en el laboratorio a la misma hora del día, y luego de 10 a 12 horas de ayuno nocturno. Al arribar al laboratorio, los sujetos se mantuvieron en reposo durante 5 min luego de lo cual se les insertó un Catéter de Teflón calibre 20 (Terumo, Tokyo, Japón) en la vena del antebrazo y se extrajeron muestras sanguíneas de reposo (~ 5 mL). El catéter fue enjuagado con ~1 mL solución salina estéril (Astra Zeneca, North Ryde, Australia) para mantener el catéter abierto y esterilizado, un procedimiento que fue completado luego de cada subsiguiente extracción de sangre. Se administró anestesia local (2-3 mL de Xylocaina al 1% (lignocaína)) al tejido cutáneo, subcutáneo y a la fascia del vasto lateral, luego de lo cual se realizó una incisión con un escalpelo, y se extrajeron las biopsias de reposo utilizando una modificación de la aguja Bergstrom de succión de 6 mm. Se extrajeron aproximadamente 100-125 mg de tejido muscular, los cuales fueron inmediatamente congelados en N2 líquido y conservados a -80 ºC hasta el momento de los análisis. En ese mismo momento, se prepararon dos sitios separados de la misma extremidad (~ 5 cm distal) para que las subsiguientes biopsias fueran realizadas inmediatamente después de la finalización del ejercicio y luego de las 3 h de recuperación.
Los sujetos se subieron al cicloergómetro y comenzaron con una entrada en calor de 5 min al 50% de la PPO antes de comenzar con al prueba de EX descrita previamente (23). En forma resumida, los sujetos completaron 2 min de ciclismo de alta intensidad al 90% de la PPO (~ 95% del VO2 pico) seguidos de 2 min al 50% de la PPO (~ 50% del VO2 pico). Este protocolo de trabajo-recuperación fue mantenido hasta que los sujetos no fueran capaces de completar los 2 min de ciclismo al 90% de la PPO, determinado como la incapacidad de mantener una cadencia de 60 rpm durante 15 s. En ese momento la carga fue disminuida hasta el 80% de la PPO (~ 85% del VO2 pico) empleando la misma recuperación. Cuando los sujetos no fueron capaces de completar 2 min de ciclismo de alta intensidad, la carga de trabajo fue reducida hasta el 70% de la PPO (~ 75% del VO2 pico) y por último hasta el 60% de la PPO (~ 65% del VO2 pico) manteniendo la misma proporción de trabajo: recuperación. El ejercicio finalizaba cuando el sujeto no podía completar 2 min de ciclismo al 60% de la PPO. Dicho protocolo de ejercicio fue seleccionado debido a que provoca la depleción completa de las reservas de glucógeno tanto de las fibras Tipo I como de las Tipo II. Durante las pruebas de EX, los sujetos no recibieron retroalimentación respecto del número de repeticiones que habían realizado con cada potencia ni acerca del tiempo de ejercicio. Durante estas pruebas, se permitió el consumo de agua ad limitum y se colocó un ventilador eléctrico (velocidad del viento, 7 m/s) para incrementar la circulación de aire y permitir el enfriamiento por evaporación. En el punto en que los sujetos alcanzaban el agotamiento y con los mismos permaneciendo en el cicloergómetro, se realizó la segunda biopsia muscular (< 15 segundos) las cuales fueron rápidamente congeladas. En este mismo momento también se extrajo una nueva muestra de sangre de 5 mL. Luego de esto los sujetos dejaron el cicloergómetro y descansaron en posición supina mientras consumían una comida estandarizada que contenía 4 g de CHO/kg de BM. Esta comida fue consumida dentro de los ~ 30 min posteriores a la finalización del ejercicio. Durante todo el período de recuperación de 3 h se extrajeron muestras sanguíneas (~ 5 mL) a intervalos regulares. Luego del período de recuperación de 3 h, se procedió a realizar la tercera biopsia y la extracción de las muestras finales de sangre El mismo protocolo experimental fue repetido en los días 3 y 5, con la excepción de que en el día 5 no se practicaron las biopsias que se habían realizado los días previos al finalizar el período de recuperación de 3 h. Las condiciones de laboratorio se mantuvieron constantes durante todas las evaluaciones (21-22 ºC, 40-50% de humedad relativa).
Procedimientos Analíticos
Se removió una pequeña porción de la muestra de músculo congelado (40-50 mg) y se intentó limpiar esta porción de cualquier resto visible de sangre, tejido conectivo y grasa. Esta muestra fue congelada en seco y pulverizada. Luego de esto se extrajo una alícuota (~ 3 mg) de músculo congelado en seco y con 250 μL de ácido clorhídrico 2M, que se incubó a 100ºC durante 2 h luego de lo cual se procedió a la neutralización con 750 μL de hidróxido de sodio 0.667 M para la subsiguiente determinación de las concentración de glucógeno por medio de análisis enzimáticos con detección fluorométrica (24). La concentración de glucógeno fue expresada en milimoles de glucógeno por kilogramo de peso seco. El coeficiente de variación intraensayo (CV) para este análisis en nuestro laboratorio es del 6%.
Una segunda alícuota (5-7 mg) de músculo congelado en seco fue extraída para la determinación de la concentración intramuscular de triacilglicerol (IMTG). En forma resumida, el IMTG fue extraído en cloroformo y la fase de cloroformo fue evaporada (10). Luego de la reconstitución, se removieron los restos de fosfolípidos con la adición de ácido silícico. Los IMTG fueron saponificados y el glicerol libre fue determinado fluorométricamente (26). La concentración de IMTG fue expresada en milimoles por kilogramo de peso seco. El CV intraensayo para este análisis en nuestro laboratorio es del 9%.
Una segunda porción de músculo congelado (10 mg) fue extraído y homogeneizado (dilución 1:50) en una solución de glicerol al 50%, con amortiguador de fosfato 20 mM (pH 7.4), 5 mM de 2-mercaptoetanol, 0.5 mM de EDTA y albúmina bovina sérica al 0.02% para la determinación de la actividad de la glucógeno sintetasa, tal como se describiera previamente (15). La actividad de la glucógeno sintetasa fue medida en ausencia (forma activa) y en presencia de 10 mM (actividad total) de glucosa 6 fosfato. Se ha reportado la actividad de la glucógeno sintetasa como una fracción de la actividad de la enzima (activa/total).
Un mililitro de sangre total fue inmediatamente analizado para determinar la concentración de glucosa y lactato utilizando un analizador de glucosa/lactato automatizado (YSI 2300 STAT PLUS, Yellow Springs, OH). Cinco mililitros de sangre total fueron colocados en un tubo que contenía fluoruro de EDTA, los cuales fueron mezclados y centrifugados en una centrífuga a 4000 rpm durante 8 min a 0ºC. El plasma fue conservado a -80ºC para los posteriores análisis de la concentración plasmática de insulina mediante la utilización de radioinmunoensayo (Coat-A-Count, Insulin RIA, Diagnostics Products Corporation, Los Angeles, CA) y de FFA mediante le método enzimático calorimétrico (Wako, NEFA C code 279-75409, Tokyo, Japan). La concentración plasmática de glicerol fue determinada colocando 250 μL de plasma en un tubo que contenía 250 μL de ácido perclórico 3M helado, lo cual fue mezclado vigorosamente en un mezclador de vortex y centrifugado; 400 μL del sobrenadante fueron agregados a un tubo que contenía 100 μL de hidróxido de potasio (KOH) 6M, mezclados y centrifugados. El sobrenadante resultante fue analizado para determinar la concentración plasmática de glicerol utilizando el análisis enzimático espctrofotométrico (26).
Rendimiento en la Prueba de Ciclismo
El rendimiento en la prueba de ciclismo fue determinado a partir del trabajo total realizado durante cada prueba y expresado en relación a la BM de cada sujeto (i.e., kJ/kg).
Análisis Estadísticos
Los metabolitos sanguíneos y las hormonas, y las concentraciones de glucógeno e IMTG fueron analizadas utilizando el análisis de varianza ANOVA de una vía para mediciones repetidas. Cuando se detectaba una diferencia significativa, se realizaban análisis post hoc utilizando el test de Student-Newman-Keuls. Los análisis de las concentraciones de glucosa, insulina y FFA entre las pruebas fueron llevados a cabo utilizando la prueba t de Student para datos apareados y también comparando las áreas bajo las curvas de concentración versus tiempo. Los datos de las tasas de resíntesis de glucógeno e IMTG y de las concentraciones de metabolismo sanguíneo entre las pruebas en puntos individuales del tiempo fueron analizados utilizando la prueba t de Student para datos apareados.
RESULTADOS
Todos los sujetos cumplieron con los requerimientos dietarios y de ejercicio en todo el período del estudio.
Concentración de Glucógeno y Triacilglicerol Muscular
La Figura 1 muestra las concentraciones de glucógeno en reposo y post-ejercicio mientras que la Figura 2 muestra las concentraciones de triacilglicerol, antes y después del EX. En el día 1 después de 1 día de dieta moderada en CHO (6 g/kg), la concentración muscular de glucógeno fue de 435±57 mmol/kg de peso seco (dw). La prueba de EX resultó en una marcada depleción del glucógeno muscular hasta 96±50 mmol/kg dw (p<0.001). Luego del día 2 con una dieta alta en CHO (12 g/kg), la concentración muscular de glucógeno en reposo en el día 3 se supercompensó hasta alcanzar valores de 713±60 mmol/kg dw (p<0.01). La prueba de EX resultó en una reducción del glucógeno muscular hasta 111±84 mmol/kg dw (p<0.001) de manera tal que la utilización neta de glucógeno fue mayor en el día 3 en comparación con el día 1 (601±83 vs. 339±83 mmol/kg dw, p<0.05). A pesar de los dos días adicionales con una dieta alta en CHO (12 g/kg), la concentración muscular de glucógeno en reposo en el día 5 fue similar a la registrada en el día 1 (luego de una dieta moderada en CHO), y menor que la registrada en el día 3 (409±40 vs. 713±60 mmol/kg dw, p<0.001). De acuerdo con esto, la tasa de resíntesis de glucógeno fue mayor durante el tiempo correspondiente al período entre las pruebas 1 y 3 en comparación con el correspondiente período entre las pruebas 3 y 5 (14.56±1.11 vs. 9.61±0.6 mmol/kg dw/h, p<0.05). Consecuentemente, la utilización de glucógeno durante el ejercicio también fue menor en el día 5 que en el día 3 (350±115 vs. 601±83 mmol/kg dw, p<0.001). La tasa de depleción de glucógeno inducida por el ejercicio en el día 5 fue menor que la del día 3 (138.8±20.2 vs. 213.6±20.2, mmol/kg dw/h, p<0.05). Como se podría haber esperado a partir del grado de depleción similar de glucógeno y de una idéntica ingesta de CHO, no hubo diferencias significativas en las tasas de resíntesis de glucógeno muscular durante el período de recuperación de 3 horas en los días 1 o 3 (36.2± 6.9 y 41.3±5.4 mmol/kg dw/h, respectivamente).
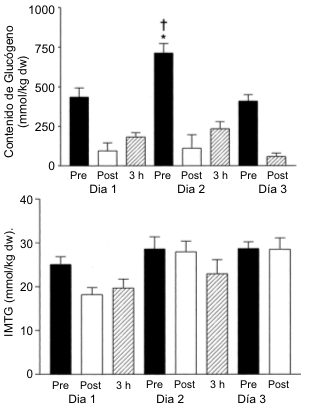
Figura 1. Concentraciones musculares de glucógeno (A) e IMTG (B) antes (pre),
inmediatamente después de la realización de ejercicio intenso prolongado hasta
el agotamiento (post) y después del período de recuperación de 3 horas (3 h).
*La concentración de glucógeno pre-ejercicio fue significativamente diferente
con respecto al día 1, p<0.001; † la utilización de glucógeno fue
significativamente diferente de la registrada en el día 1, p<0.001.
En el día 1, la concentración de IMTG en reposo fue de 25±2 mmol/kg dw, y se redujo en un 28% (p<0.05) luego de la prueba de EX (Figura 1B). Luego de dos días de dieta alta en CHO, la concentración de IMTG fue de 29±3 mmol/kg dw, en el día 3 y de 28±2 mmol/kg dw en el día 5. Estos valores de reposo no fueron diferentes a los registrados en el día 1. El contenido de IMTG en los días 3 y 5 no fue diferente de los valores de reposo. No se observaron cambios en la concentración de IMTG durante el período de recuperación de 3 h en los días 1 o 3 (datos no mostrados).
Actividad de la Glucógeno Sintetasa
La actividad fraccional de la glucógeno sintetasa fue similar en reposo (0.57±0.06, 0.53±0.08, y 0.54±0.06) e inmediatamente post-ejercicio (0.76±0.06, 0.69±0.06, y 0.76±0.01) en los días 1, 3 y 5 respectivamente. Luego del período de recuperación de 3 h, la actividad de la glucógeno sintetasa fue significativamente mayor en comparación con la del reposo tanto en el día 1 como en el día 3 (0.57±0.06 vs. 0.83±0.08, p<0.05; y 0.53±0.08 vs. 0.90±0.04, p<0.001, respectivamente)
Concentración de Hormonas y Metabolitos Sanguíneos
La Figura 2 muestra las concentraciones de glucosa sanguínea (A), insulina plasmática (B) y FFA plasmáticos (C) en reposo, inmediatamente post ejercicio y a intervalos regulares durante el período de recuperación de 3 horas en las tres pruebas experimentales. La concentración de glucosa sanguínea en reposo en el día 1 fue de ~ 5 mmol/L, y los sujetos mantuvieron el estado euglucémico durante todo el ejercicio. Con la ingesta de CHO luego del ejercicio (4 g de CHO/kg de BM), la concentración sanguínea de glucosa se incremento de manera tal que entre los 30 y 120 min su concentración fue mayor que la registrada en reposo o inmediatamente después del ejercicio (p<0.05). Como se había esperado con idénticos protocolos de ingesta de CHO post ejercicio, no se observaron diferencias en las concentraciones sanguíneas de glucosa (área bajo la curva) entre los días 1 y 3 (no se extrajeron muestras sanguíneas durante la recuperación en el día 5).
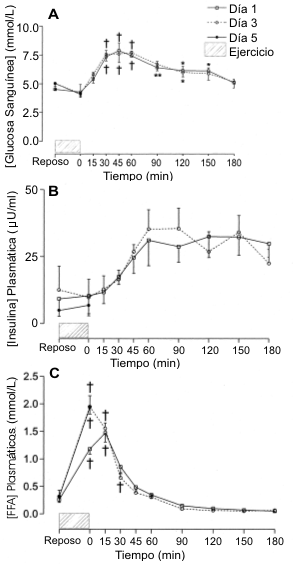
Figura 2. Concentraciones de glucosa sanguínea (A), insulina plasmática
(B) y FFA plasmáticos (C) durante el período de recuperación de 3 h. Los valores
post-ejercicio fueron significativamente diferente con respecto a los del
reposo, * p<0.05, ** p<0.01, † p<0.001.
Las concentraciones plasmáticas de insulina en las tres pruebas experimentales no fueron diferentes (Figura 2B). Además, la concentración plasmática de insulina no fue diferente de los valores medidos inmediatamente post-ejercicio. Sin embargo, la ingesta de CHO post-ejercicio resultó en un aumento estable en la concentración plasmática de insulina durante los primeros 60 min de la recuperación, y a partir de allí se mantuvo elevada (a ~ 0.30 μU/mL) en las siguientes 2 h de la recuperación. No se hallaron diferencias en las concentraciones plasmáticas de insulina (área bajo la curva) entre los días 1 y 3.
Las concentraciones de FFA plasmáticos en reposo fueron de ~ 0.30 mmol/L y no fueron diferentes entre las pruebas experimentales (Figura 2C). El ejercicio prolongado en el día 1 resultó en un incremento en el nivel de FFA plasmáticos cuatro veces mayor al de reposo (p<0.001). Las concentraciones plasmáticas de FFA luego del ejercicio en el día 3 (1.9±0.2 mmol/L) y en el día 5 (1.9±0.1 mmol/L) fueron mayores que las registradas en el día 1 (p<0.05). Las concentraciones plasmáticas de FFA se mantuvieron elevadas durante 30 min luego del ejercicio en el día 1 (p<0.001) y 15 min en el día 3 (p<0.001) y en los siguientes 150 min retornaron a los valores de reposo (Figura 2C).
La concentración plasmática de glicerol en el día 1 fue de 0.27±0.08 mmol/L y se incrementó a 0.58±0.06 mmol/L hacia el final del ejercicio (p<0.001). Hacia el final del período de recuperación de 3 h, la concentración plasmática de glicerol retornó a los valores de reposo. No se hallaron diferencias en las concentraciones de glicerol de reposo o las registradas inmediatamente post-ejercicio entre los días 1, 3 y 5 o al final del período de recuperación de 3 h entre los días 1 y 3 (datos no mostrados).
Rendimiento durante el Ejercicio
La Figura 3 muestra el rendimiento durante las pruebas de ejercicio en cada una de las cuatro pruebas. No se hallaron diferencias en el rendimiento durante el ejercicio entre las prueba de familiarización y la prueba del día 1 (23.6±2.4 vs. 24.1±1.4 kJ/kg, respectivamente). Luego de 2 días de dieta alta en CHO, el rendimiento durante el ejercicio en las prueba llevadas a cabo en los días 3 y 5 fue mayor que durante la prueba del día 1 (22.4±4.3), el número de repeticiones de trabajo de alta intensidad al 90% de la PPO (~ 95% del VO2 pico) fue mayor tanto en el día 3 (29.3±1.5, p<0.01) como en el día 5 (26.3±3.3, p<0.05). No se hallaron diferencias en el tiempo hasta el agotamiento entre la prueba de familiarización y la realizada en el día 1 (88.9±16.6 vs. 111.0±6.4 min). Sin embargo, el tiempo hasta el agotamiento en la prueba realizada en el día 1 fue menor que el registrado tanto durante la prueba del día 3 como durante la prueba del día 5 (111.0±6.4 vs. 163.5±10.3 y 174.7±16.8 min, p<0.05)
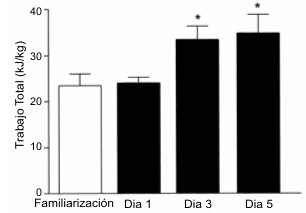
Figura 3. Rendimiento en el ejercicio durante las pruebas experimentales
expresado como trabajo total (kJ/kg). * Significativamente diferente del día 1 y
de la prueba de familiarización, p<0.05.
DISCUSION
La importancia de las reservas endógenas de CHO para el rendimiento en ejercicios submáximos prolongados (>90 min) ha sido reconocida desde los estudios clásicos llevados a cabo por los investigadores escandinavos hace casi un cuarto de siglo (1). En ese momento, también se demostró que la alimentación con CHO luego de una única serie de ejercicio que provocaba la depleción del glucógeno muscular resultaba en un incremento substancial en la concentración muscular de glucógeno, un fenómeno conocido como supercompensación de glucógeno. Debido a estas investigaciones pioneras, se han evaluado diversos regímenes de dieta y ejercicio en un intento por provocar la supercompensación de los niveles musculares (y hepáticos) de glucógeno y de mejorar el rendimiento durante el ejercicio subsiguiente (14, 18). Una característica común de todos los estudios con carga de glucógeno llevados a cabo hasta la fecha es que la capacidad de ejercicio fue evaluada en una única tarea de ejercicio. Por lo tanto, en el presente se desconoce si los individuos entrenados pueden supercompensar sus reservas musculares de glucógeno luego de la realización de series de ejercicio que provocan la depleción del glucógeno cuando estas se llevan a cabo en rápida sucesión (48 h). Debido a que el entrenamiento de resistencia en humanos incrementa marcadamente la capacidad de acumular glucógeno muscular (11), particularmente en las primeras 6 horas posteriores a la realización de ejercicios que provocan la depleción del glucógeno, nosotros hipotetizamos que los sujetos altamente entrenados serían capaces de supercompensar sus reservas de glucógeno luego de la realización repetida de ejercicios y mediante la intervención dietaria. De esta manera, el primer hallazgo novedoso de la presente investigación fue que bajo las condiciones del actual experimento, los atletas competitivos que realizan varias sesiones de ciclismo prolongado hasta el agotamiento para depletar las reservas musculares de glucógeno y que luego consumen una dieta alta en carbohidratos, no pueden supercompensar sus reservas musculares de glucógeno por segunda vez (2 días después de la supercompensación inicial).
Los estudios previos en los cuales se ha utilizado ejercicio prolongado e intenso (pero no hasta el agotamiento) en días sucesivos han mostrado una marcada reducción tanto en el contenido de glucógeno en reposo como en su utilización subsiguiente (5, 22). En efecto, Kirwan et al. (22) reportaron que el contenido muscular de glucógeno se redujo en un ~ 35% luego de 9 días de carreras diarias de alta intensidad. Hay que señalar que esta progresiva depleción de glucógeno ocurrió a pesar de los intentos llevados a cabo para igualar la ingesta de CHO con el gasto energético diario de los sujetos. Esta observación sugiere que los sujetos realizaron una inadecuada ingesta dietaria de CHO o que los mecanismos responsables de la resíntesis de glucógeno muscular estuvieron atenuados como consecuencia de las carreras depletantes de glucógeno llevadas a cabo en días sucesivos.
Aunque no puede ser completamente descartado, nosotros creemos que nuestra dieta alta en CHO pudo haber proporcionado la suficiente cantidad de sustrato para la resíntesis de glucógeno: los sujetos consumieron 12 g de CHO/kg de BM en cuatro días sucesivos: dicha cantidad es un 20-35% mayor a la utilizada en los protocolos de carga de glucógeno más característicos (14). De acuerdo con esto, el fallo de las reservas musculares de glucógeno para alcanzar los valores de supercompensación en el día 5 en comparación con el día 3 del protocolo experimental sugiere una desmejora en uno o más de los mecanismos responsables de la acumulación de glucógeno, posiblemente como consecuencia directa del efecto acumulativo del ejercicio submáximo hasta el agotamiento. Además, debido a que las tasas de resíntesis de glucógeno muscular en las primeras 3 h posteriores al ejercicio fueron similares a las reportadas por otros investigadores (11, 17, 30), este efecto pudo estar confinado a la fase lenta o dependiente de la insulina, de la resíntesis de glucógeno (27). Una limitación potencial del presente estudio es la falta de información respecto de la acumulación de glucógeno en el hígado. Sin embargo, aunque no se realizaron mediciones directas del glucógeno hepático, parece seguro asumir que las reservas de glucógeno eran adecuadas: las concentraciones de glucosa sanguínea en reposo en las mañanas de las pruebas de rendimiento fueron de ~ 5 mmol/L y los sujetos mantuvieron el estado euglucémico durante todo el período de ejercicio.
Se ha propuesto que la activación de la glucógeno sintetasa es responsable de la supercompensación de glucógeno que ocurre luego de la realización de ejercicios que provocan la depleción del mismo (4). Sin embargo, los resultados del presente estudio, al igual que los de otras investigaciones (9, 28) no respaldan el concepto de que la actividad de la glucógeno sintetasa es el paso tasa limitante de la resíntesis de glucógeno, a menos que la actividad de la glucógeno sintetasa este por debajo del rango observado en ayunas (8). En el presente estudio, la actividad de la glucógeno sintetasa fue similar en reposo e inmediatamente post-ejercicio. Los valores observados en el presente estudio concuerdan con los valores reportados previamente por otros investigadores (3). Aunque es probable que la glucógeno sintetasa desempeñe un importante papel en el rápido incremento inicial del glucógeno muscular, solo desempeña un papel permisivo en el fenómeno de supercompensación. Esto queda demostrado por el hallazgo de que la concentración de glucógeno continúa incrementándose y alcanza el nivel de supercompensación a pesar de la reducción en la actividad de la glucógeno sintetasa (25).
Es difícil especular acerca de un mecanismo preciso que pueda explicar el fallo de las reservas musculares de glucógeno en alcanzar el valor de supercompensación al 5to día en comparación con el 3er día del protocolo experimental. Nosotros elegimos deliberadamente que nuestros sujetos bien entrenados realizaran entrenamientos en los días intermedios a las pruebas de ejercicio hasta el agotamiento (60-120 min de ciclismo continuo de intensidad baja a moderada), ya que es una práctica común entre los atletas competitivos (19). Como se señaló, la duración de estas sesiones de entrenamiento varió entre los sujetos y dependió del volumen actual de sus entrenamientos. Sin embargo, la duración de estas sesiones de entrenamiento fue rigurosamente controlada y fue constante para cada sujeto durante todo el período experimental. Mientras que el entrenamiento a una intensidad que requiere de una substancial oxidación de CHO podría obviamente ser contraproducente para la resíntesis de glucógeno, este no pareció ser el caso, ya que las reservas de glucógeno alcanzaron el nivel de supercompensación en el día 3. De acuerdo con esto, estas sesiones de entrenamiento para la recuperación no pudieron haber sido la razón de la falta de supercompensación de glucógeno en el día 5.
Como se podría haber esperado, la capacidad de ejercicio se incrementó en el día 3 en comparación con el día 1 dada la supercompensación de las reservas del glucógeno muscular (Figura 1A). Sin embargo, en el día 5, luego de dos días de dieta alta en CHO; las reservas musculares de glucógeno fueron similares a las del día 1 luego de una ingesta de una dieta moderada en CHO. Dada la falta de supercompensación en el día 5 en comparación con el día 3, y la concomitante reducción en la utilización de glucógeno, es difícil explicar la capacidad de ejercicio similar durante estas dos pruebas. Nosotros no determinamos los valores del RER durante las pruebas intermitentes hasta el agotamiento, debido a que los sujetos nunca alcanzarían las condiciones de estado estable necesarias para hacer mediciones válidas. Sin embargo, las concentraciones sanguíneas de glucosa fueron similares en cada día, sugiriendo que los cambios en el consumo de glucosa fueron mínimos. De acuerdo con esto, una explicación probable para el mantenimiento de la capacidad de ejercicio (en el día 5) podría ser el substancial incremento en la contribución de la oxidación de los lípidos a los requerimientos energéticos totales. Otra posible razón para la preservación de la capacidad de ejercicio en el día 5 es que haya habido un efecto de entrenamiento durante el período de intervención. Sin embargo, esto parece improbable ya que nuestros sujetos eran todos atletas competitivos que tenían una larga historia de entrenamiento de resistencia. Además, no se observaron diferencias en el rendimiento entre la prueba de familiarización y la prueba de ejercicio del día 1. Si se hubiera producido cualquier adaptación, dichos cambios habrían sido pequeños y no tendrían un efecto directo sobre las mediciones del metabolismo del glucógeno realizadas en este estudio. Por último, es posible que la supercompensación del glucógeno no sea necesaria en deportistas entrenados durante días sucesivos de competencia: dicha premisa surge de los rendimientos similares observados en los días 3 y 5 a pesar de la falta de acumulación de glucógeno en el día 5.
En contraste con numerosos estudios acerca de la acumulación de glucógeno post-ejercicio (18), hay muchos menos datos disponibles sobre la reposición de IMTG post-ejercicio (7, 20, 31). En una reciente investigación, van Loon et al. (31) reportaron que en sujetos bien entrenados, el contenido de IMTG declinaba significativamente durante la realización de 3 h de ejercicio submáximo y que su acumulación se vio desmejorada cuando los sujetos consumieron una dieta baja en grasas y alta en CHO en comparación con el consumo de una dieta normal en grasas. En contraste, Kiens y Richter (20) reportaron que los niveles de IMTG se mantuvieron inalterados luego de completar una serie de ejercicio prolongado hasta el agotamiento que provocó la depleción de glucógeno, en individuos bien entrenados. Sin embargo, en aquel estudio se observó una rápida y marcada reducción post-ejercicio (~ 20%) en el contenido de IMTG: tal observación fue particularmente sorprendente dada la gran ingesta de CHO y la concomitante elevación de la concentración plasmática de insulina, condiciones que se esperarían inhiban la hidrólisis de los IMTG. En el presente estudio, observamos una reducción significativa (~ 30%) en la concentración de IMTG durante el ejercicio hasta el agotamiento realizado el día 1, pero fuimos incapaces de detectar cualquier reducción significativa en los niveles de IMTG luego del ejercicio hasta el agotamiento realizado en los días 3 y 5. Se debería señalar que la serie de ejercicio hasta el agotamiento realizada en el día 1 fue llevada a cabo luego de que los sujetos consumieran una dieta con una cantidad moderada de CHO (6 g/kg de BM), mientras que los sujetos comenzaron el ejercicio en los días 3 y 5 luego de consumir una dieta alta en CHO (12 g/kg de BM) y baja en grasas. A diferencia de la resíntesis de glucógeno muscular, no se observaron cambios en la concentración de IMTG durante el período de recuperación de 3 h en los días 1 y 3 (no se obtuvieron biopsias en el período de recuperación del día 5). Estos hallazgos concuerdan con los de Kimber et al. (21), quienes reportaron que el contenido de IMTG nos se reducía durante la recuperación posterior a la realización de ejercicios hasta el agotamiento en sujetos bien entrenados en presencia de concentraciones elevadas de glucosa e insulina. Nuestros datos respecto del uso, o la falta de uso, de los IMTG durante y después del ejercicio, aumentan la controversia respecto de la utilización de este sustrato.
Aunque sería tentador especular que la falta de un incremento mesurable en la utilización de los IMTG durante el ejercicio se debió a los menores valores pre-ejercicio (i.e., desmejora en la reposición) luego de 2 días de dieta alta en CHO (31), este no fue el caso. Los niveles de IMTG de reposo fueron similares en los 3 días (~ 30 mmol/kg dw), mientras que los niveles post-ejercicio en los días 3 y 5 no fueron diferentes de los valores pre-ejercicio. La falta de cambios detectables en los niveles de IMTG durante o después del ejercicio con frecuencia se ha atribuido a las limitaciones metodológicas asociadas con la técnica de biopsia, la cual no discrimina entre IMTG y la grasa contenida entre fibras musculares adyacentes. Sin embargo, utilizando sujetos bien entrenados, con características fisiológicas y de entrenamiento similares a aquellos que participaron en la presente investigación, Watt et al. (32) reportaron un CV del 12% para los IMTG medidos en biopsias apareadas del mismo sujeto. De acuerdo con esto, nosotros reconocemos que se requiere una reducción del 12% o mayor en los IMTG para que los cambios sean considerados significativos. Otra potencial explicación para la falta de cambios en los niveles de IMTG es que las reservas de IMTG pueden esterificarse durante la realización de ejercicios de baja intensidad (~ 45% del VO2 pico) cuando los niveles de FFA se encuentran elevados (12). Debido a que en el presente estudio los niveles de FFA al final de la prueba de EX en los días 3 y 5 se incrementaron hasta ~ 2.0 mmol/L, no podemos excluir la posibilidad de que se haya producido un ciclo de IMTG/FFA durante nuestro protocolo de ejercicio intermitente de intensidad alta y baja. Dicho escenario podría potencialmente enmascarar la hidrólisis de los IMTG.
En conclusión, los resultados del presente estudio demuestran que los sujetos bien entrenados fallan en supercompensar de forma repetida sus reservas musculares de glucógeno luego de la realización de series repetidas de ejercicio hasta el agotamiento y de 2 días de dieta alta en CHO durante los cuales se realizó un entrenamiento normal. Este efecto estuvo confinado en gran parte a la fase lente de la resíntesis de glucógeno, ya que las tasas de resíntesis del glucógeno durante las etapas iniciales (3 h) de la recuperación post-ejercicio fueron similares a las reportadas previamente. De acuerdo con esto, nuestros datos no respaldan el concepto de que la actividad de la glucógeno sintetasa es el paso tasa limitante de la resíntesis del glucógeno. En cambio, los mecanismos responsables de la resíntesis del glucógeno parecen estar atenuados como consecuencia de la realización de ejercicios que provocan la depleción de glucógeno en días sucesivos. No hallamos evidencia de una desmejora en la reposición de IMTG luego de la realización de ciclismo prolongado e intenso seguido por una dieta alta en CHO. Por último, el rendimiento similar durante las pruebas llevadas a cabo en los días 3 y 5, a pesar de la falta de acumulación de glucógeno en el día 5, sugiere que la supercompensación de glucógeno puede no ser necesaria en deportistas entrenados durante días sucesivos de competencia.
Agradecimientos
Agradecemos a los sujetos por su excelente cooperación y esfuerzo físico en un estudio de alta dificultad. Este estudio fue respaldado por una subvención otorgada por GlaxoSmithKline Nutrition (U.K) a John A. Hawley.
Dirección para el Envío de Correspondencia
John A. Hawley, PhD., Exercise Metabolism Group, School of Medical Sciences, RMIT University, PO Box 71, Bundoora, Victoria 3083, Australia; correo electrónico: john.hawley@rmit.edu.au.
Referencias
1. Bergstrom, J., L. Hermansen, E. Hultman, and B. Saltin (1967). Diet, muscle glycogen and physical performance. Acta Physiol. Scand. 71:140-150
2. Bergstrom, J., and E. Hultman (1966). Muscle glycogen synthesis after exercise: an enhancing factor localised to the muscle cells in man. Nature 210:309-310
3. Bergstrom, J., E. Hultman, and A. E. Roch-Norlund (1972). Muscle glycogen synthetase in normal subjects. Scand. J. Clin. Lab. Invest. 29:231-236
4. Bogdarus, C., S. Lillioja, K. Stone, and D. Mott (1984). Correlation between muscle glycogen synthase activity and in vivo insulin action in man. J. Clin. Invest. 73:1185-1190
5. Costill, D. L., R. Bowers, G. Branam, and K. Sparks (1971). Muscle glycogen utilization during prolonged exercise on successive days. J. Appl. Physiol. 31:834-838
6. Costill, D. L., D. D. Pascoe, W. J. Fink, R. A. Robergs, S. I. Barr, and D. Pearson (1990). Impaired muscle glycogen resynthesis after eccentric exercise. J. Appl. Physiol. 69:46-50
7. Decombaz, J., M. Fleith, H. Hoppeler, R. Kreis, and C. Boesch (2000). Effect of diet on the replenishment of intramyocellular lipids after exercise. Eur. J. Nutr. 39:244-247
8. Fisher, J. S., L. A. Nolte, K. Kawanaka, D.-H. Han, T. E. Jones, and J. O. Holloszy (2002). Glucose transport rate and glycogen synthase activity both limit skeletal muscle glycogen accumulation. Am. J. Physiol. Endocrinol. Metab. 282:E1214-E1221
9. Fogt, D. L., S. Pan, S. Lee, et al (2004). Effect of glycogen synthase overexpression on insulin-stimulated muscle glucose uptake and storage. Am. J. Physiol. Endocrinol. Metab. 286:E363-369
10. Frayn, K. N., and P. F. Maycock (1980). Skeletal muscle triacylglycerol in the rat: methods for sampling and measurement, and studies of biological variability. J. Lipid Res. 21:139-144
11. Greiwe, J. S., R. C. Hickner, P. A. Hansen, S. B. Racette, M. M. Chen, and J. O. Holloszy (1999). Effects of endurance exercise training on muscle glycogen accumulation in humans. J. Appl. Physiol. 87:222-226
12. Guo, Z., B. Burguera, and M. D. Jensen (2000). Kinetics of intramuscular triglyceride fatty acids in exercising humans. J. Appl. Physiol. 89:2057-2064
13. Hawley, J. A., and T. D. Noakes (1992). Peak power output predicts maximal oxygen uptake and performance time in trained cyclists. Eur. J. Appl. Physiol. 65:79-83
14. Hawley, J. A., E. J. Schabort, T. D. Noakes, and S. C. Dennis (1997). Carbohydrate-Loading and exercise performance. Sports Med. 24:73-81
15. Henriksson, J., M. M.-Y. Chi, C. S. Hintz, et al (1986). Chronic stimulation of mammalian muscle: changes in enzymes of six metabolic pathways. Am. J. Physiol. 251:C614-C632
16. Hikida, R. S., R. S. Staron, F. C. Hagerman, W. M. Sherman, and D. L. Costill (1983). Muscle fiber necrosis associated with human marathon runners. J. Neurol. Sci. 59:185-203
17. vy, J. L., A. L. Katz, C. L. Cutler, W. M. Sherman, and E. F. Coyle (1988). Muscle glycogen synthesis after exercise: effect of time of carbohydrate ingestion. J. Appl. Physiol. 64:1480-1485
18. Jentjens, R., and A. E. Jeukendrup (2003). Determinants of post-exercise glycogen synthesis during short term recovery. Sports Med. 33:117-144
19. Jeukendrup, A., E., N. P. Craig, and J. A. Hawley (2000). The bioenergetics of world class cycling. J. Sci. Med. Sport 3:414-433
20. Kiens, B., and E. A. Richter (1998). Utilization of skeletal muscle triacylglycerol during postexercise recovery in humans. Am. J. Physiol. 275:E332-E337
21. Kimber, N. E., G. J. F. Heigenhauser, L. L. Spriet, and D. J. Dyck (2003). Skelatal muscle fat and carbohydrate metabolism during recovery from glycogen-depleting exercise in humans. J. Physiol. 548:919-927
22. Kirwan, J. P., D. L. Costill, J. B. Mitchell, et al (1988). Carbohydrate balance in competitive runners during successive days of intense training. J. Appl. Physiol. 65:2601-2606
23. Kuipers, H., H. A. Keizer, F. Brouns, and W. H. M. Saris (1987). Carbohydrate feeding and glycogen synthesis during exercise in man. Pflugers Arch. 410:652-656
24. Lowry, O. H. and J. V. Passonneau (1972). A Flexible System of Enzymatic Analysis. New York: Academic, pp. 64-66
25. Nakatani, A., D.-H. Han, P. A. Hansen, et al (1997). Effect of endurance exercise training on muscle glycogen supercompensation in rats. J. Appl. Physiol. 82:711-715
26. Pinter, J. K., J. A. Hayashi, and J. A. Watson (1967). Enzymatic assay of glycerol, dihydroxyacetone and glyceraldehydes. Arch. Biochem. Biophysics. 121:404-414
27. Price, T. B., D. L. Rothman, R. Taylor, M. J. Avison, G. I. Shulman, and R. G. Shulman (1994). Human muscle glycogen resynthesis after exercise: insulin-dependent and -independent phases. J. Appl Physiol. 76:104-111
28. Ren, J.-M., C. F. Semenkovich, E. A. Gulve, et al (1993). Evidence from transgenic mice that glucose transport is rate-limiting for glycogen deposition and glycolysis in skeletal muscle. J. Biol. Chem. 268:16113-16115
29. Sherman, W. M., D. L. Costill, W. J. Fink, and J. M. Miller (1981). Effect of exercise-diet manipulation on muscle glycogen and its subsequent utilization during performance. Int. J. Sports Med. 2:114-118
30. Van Loon, L. J. C., W. H. M. Saris, M. Kruijshoop, and A. J. M. Wagenmakes (2000). Maximizing post exercise muscle glycogen synthesis: carbohydrate supplementation and the application of amino acid or protein hydrolysate mixtures1-3. Am. J. Clin. Nutr. 72:106-111
31. Van Loon, L. J. C., V. B. Schrauwen-Hinderling, R. Koopman, et al (2003). Influence of prolonged endurance cycling and recovery diet on intramuscular triglyceride content in trained males. Am. J. Physiol. Endocrinol. Metab. 285:E804-E811
32. Watt, M. J., G. J. F. Heigenhauser, D. J. Dyck, and L. L. Spriet (2002). Intramuscular triacylglycerol, glycogen and acetyl group metabolism during 4 h of moderate exercise in man. J. Physiol. 541:969-978