Más Ejercicio, Más Vida… Qué nos Dicen los Telómeros
Publicado 20 de julio de 2017, 18:21
Los telómeros, son bases pares de nucleótidos que se encuentran estratégicamente ubicados en los extremos de los cromosomas y su función es proteger la indemnidad de nuestro propio código genético.
Durante el transcurso de la vida, las células de los diferentes órganos se van replicando, dicha replicación forma parte del complejo proceso de envejecimiento que sufre todo ser vivo.
Las células durante su replicación evolutiva viven lo que se ha dado en llamar “Dinámica de los Telómeros” (1) que consiste en una atricción y acortamiento de estos. Dicha atricción y acortamiento a cierto nivel, hacenque las células tengan un funcionamiento anormal de tal manera que se comienzan a padecer enfermedades que son propias de la vejez, como por ejemplo la hipertensión arterial, la diabetes, la demencia, el cáncer, la fibrosis pulmonar, la osteoporosis, ciertas miocardiopatías y la aterosclerosis con la tan temida y frecuente enfermedad coronaria entre muchas otras enfermedades propias de ese tiempo vital… (Figura 1)
Estas enfermedades aumentan significativamente la mortalidad en este período de la vida.
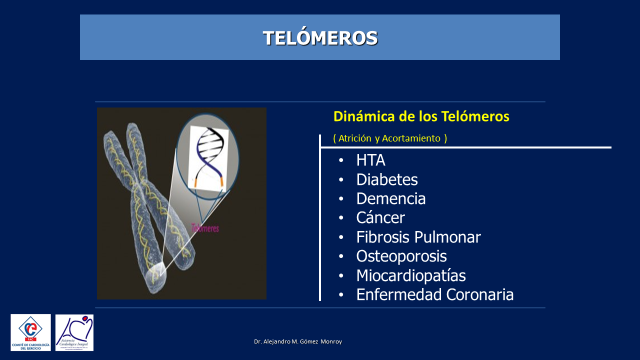
Figura 1
Por otra parte, desde hace ya bastante tiempo sabemos que el ejercicio físico tiene como uno de sus efectos más importantes a la disminución de la mortalidad tanto de causa cardiovascular y de otras enfermedades.
Solo hay que recordar el ya mítico trabajo de Ralph Paffenbarger publicado en el American Journal of Epidemiology en el año 1978 y realizado sobre más de 16.000 ex alumnos de la Universidad de Harvard, seguidos por 12 a 16 años y cuyo resultado nos mostró claramente que, a medida que los ex alumnos estudiados aumentaban el consumo (gasto) calórico semanal, el riesgo de muerte les disminuía progresivamente llegando hasta un 54 % menos de mortalidad en aquellos individuos que presentaban un gasto calórico de entre 3.000 y 3.499 Kilocalorías por semana. (2) (Figura 2)
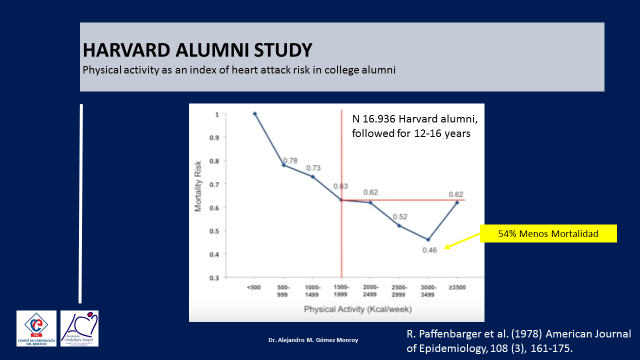
Figura 2
Estudios similares, fueron replicados en los años siguientes demostrando los efectos beneficiosos del ejercicio y la mortalidad no solo de causa cardiovascular si no de todas las causas y tal vez uno de los más grandes y más recientemente publicado a la fecha sea el de Hannah Arem y Colaboradores (3). (Figura 3)
En él, se siguieron nada menos que 661.137 individuos de Europa y Estado Unidos con una edad media de 62 años durante una media de 14,2 años, de alguna manera la intención fue realizar una auditoría de las Guías Americanas para un ejercicio saludable, que recomiendan 75 minutos de ejercicio de intensidad vigorosa o 150 minutos de ejercicio de intensidad moderada por semana para producir un impacto sobre la mortalidad de la población general. En el seguimiento a largo plazo el estudio demostró que quienes cumplían con el requerimiento mínimo lograban un 20% de disminución de la mortalidad, quienes aumentaban su gasto calórico entre 3 a 5 veces el básico lograban una disminución de un 39%, esto se mantenía en quienes aumentaban hasta 10 veces el requerimiento básico y cuando se aumentaba la intensidad mas allá de 10 veces, la disminución de la mortalidad seguía siendo importante 31%, pero la curva ya comenzaba a mostrar la típica forma en U que ocurre cuando se comienzan a perder algunos de los efectos beneficiosos alcanzados con una menor intensidad.
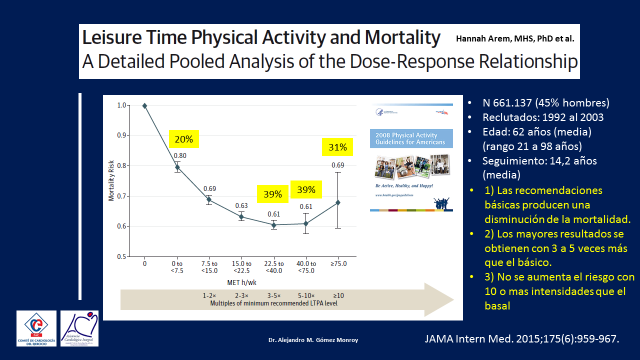
Figura 3
Cabría entonces preguntarnos en esta instancia, desde el punto de vista biomolecular ¿por que el ejercicio físico disminuye la mortalidad o lo que es lo mismo, por que prolonga la vida?
Lo hace actuando individualmente actuando sobre cada enfermedad, o bien lo hace actuando globalmente sobre todos los complejos procesos del envejecimiento celular que nos llevan a padecer las enfermedades propias de la vejez… (Figura 4).

Figura 4
Pues bien, la ciencia aun no nos brinda una respuesta única a esta pregunta, lo que si nos confirma es que a pesar de los enormes avances en materia diagnóstica y terapéutica que se han alcanzado en relación a la enfermedad coronaria en los últimos años, esta continúa siendo la 1er. causa de muerte en la gran mayoría de los países del mundo (4) y paralelamente a estos fantásticos avances estamos viviendo un gran retroceso en lo que hace a la utilización del ejercicio físico tanto en la prevención primaria de las enfermedades, como así también en su utilización como un medicamento en la prevención secundaria, es decir la misma rehabilitación cardiovascular. (Figura 5)
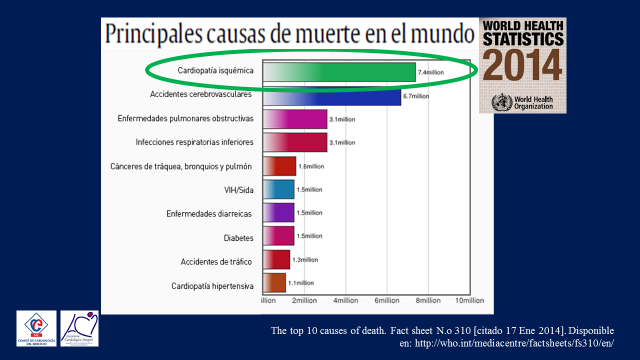
Figura 5
Por lo tanto, quienes nos dedicamos a la prevención y rehabilitación cardiovascular, no podemos hacernos cargo, por ser prácticas totalmente subutilizadas, de este persistente fracaso, más aun cuando existe suficiente evidencia del impresionante impacto que tendría el solo hecho de poder controlar solo nueve factores de riesgo coronario, muchos de los cuales podrían ser controlados o incluso erradicados totalmente por medio del ejercicio físico. (5)
Veamos entonces, como se genera la senescencia celular endotelial para poder entender luego como el ejercicio podría intervenir a este mismo nivel.
Existen dos formas de senescencia celular endotelial, una la senescencia replicativa que ocurre con el paso del tiempo y otra la senescencia prematura inducida por stress, pero claro, no solo por el stress psíquico que sin duda genera un envejecimiento endotelial precoz como bien lo han documentado varios estudios , si no que me refiero al stress oxidativo que generan sobre las células endoteliales los factores de riesgo coronario (tabaquismo, hipertensión arterial, dislipemias, sedentarismo, etc.) (6,7,8,9,10) (Figura 6)
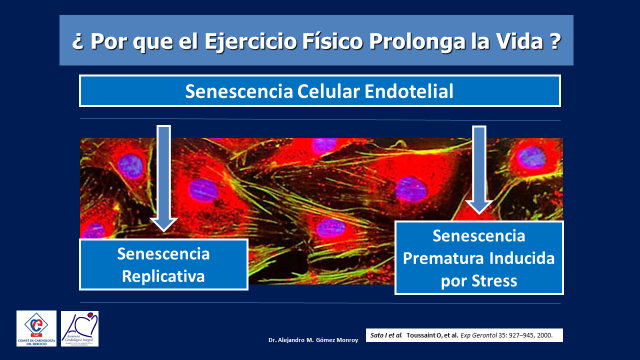
Figura 6
Todo este proceso puede resumirse con esta revisión en donde se muestra que factores genéticos y daños del ADN, la propia senescencia replicativa natural y el stress oxidativo y la inflamación propia de un estilo de vida lleno de factores de riesgo, generan un acortamiento telomérico y una disfunción celular, todo en conjunto producen lo que se conoce con el nombre de fenotipo secretor celular senescente que no solo afecta a la misma célula, si no que tambien afecta a todas las células endoteliales circundantes llevandolas a un estado de hiperinflamación y depresión de la reparación celular tisular y del remodelado. (11) (Figura 7)
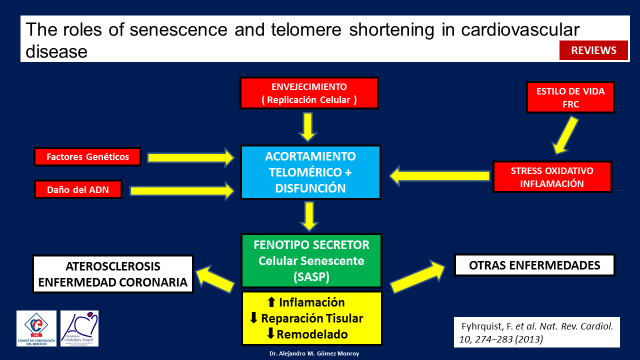
Figura 7
En definitiva podemos afirmar que todo el complejo proceso de envejecimiento celular depende de una enorme interacción de diferentes sustancias, pero hay tres que se destacan y tienen que ver con la aparición de la enfermedad coronaria y el ejercicio físico, dos son proteínas y una es un gas liposoluble.
Simplificando al máximo todo el proceso vemos que las bases pares de nucleótidos se van aplicando por medio de una plantilla, como si fuera un sello formando las cadenas helicodales de ADN sobre la misma porción de los telómeros, esta acción puede estar catalizada por unas proteínas conservadoras de la integridad de los telómeros que cometen el menor número posible de pérdidas de bases pares, estas son las llamadas telomerasas o por otras proteínas que hacen el mismo trabajo pero con una mayor cantidad de errores por lo que pierden muchos más pares de nucléotidos por lo que los telómeros se acortan en mayor proporción, estas son las proteínas proapoptóticas (12) (Figura 8)
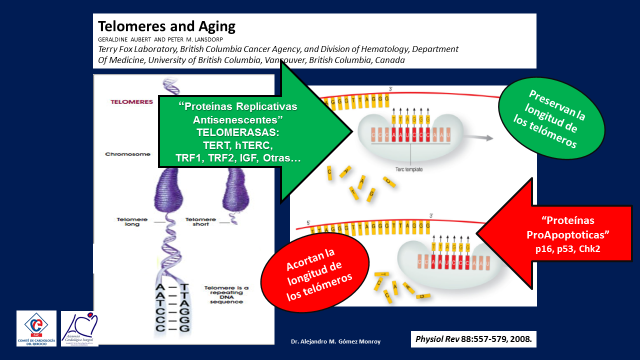
Figura 8
Se sabe que las telomerasa aumentan y que las proteinas proapoptóticas disminuyen con el ejercicio físico.
La tercer sustancia interviniente en el proceso es un gas liposoluble llamado Óxido Nítrico, este gas actúa sobre todas las estructuras arteriales generando múltiples acciones locales y a distancia, produciendo vasodilatación, entiagregación plaquetaria, antiinflamación, reducción del stress oxidativo, e incremento de las telomerasas y disminución de las proteinas proapoptóticas entre otras cientos de importantes funciones.
El Óxido Nítrico se genera en la misma célula endotelial y se encuentra disminuido en las personas de mayor edad, aun aunque no presentaran otros factores de riesgo más que la vejez (13,14).
Durante el ejercicio físico, las demandas metabólicas de los músculos en actividad requieren mayor oxigenación, una forma de suplirla es por medio de un incremento en la velocidad circulatoria, este aumento genera una fricción de rozamiento, conocida también como Shear Stress, esto moviliza una pequeñas silias de apenas unos micrones que se encuentran en el borde libre de las células endoteliales, ese movimiento transforma una energía mecánica en una energía bioquímica, liberando unos MicroRNA que actúan como si fueran unos swich que enciende o pagan genes, las silias al ser estimuladas liberan los MicroRNA que encienden la transcripción génica de la enzima Óxido Nítrico Sintetaza Endotelial (eNOS) justamente la encargada de generar el óxido nítrico, paralelamente a esto, el ejercicio físico también disminuye la acción de la Dimetil Arginina asimétrica (ADMA) que es la competidora natural del la eNOS en la utilización del sustrato necesario para generar óxido nítrico, la L Arginina, de tal forma que comienza a producirse una mayor cantidad de Óxido Nítrico, la vida media del Óxido Nitrico es muy corta, solo 7 a 11 segundos y su vida media se ve acortada aun mas por la presencia de las Especies Oxidativas Reactivas, también conocidas como Radicales Libres, pero estos se encuentran atenuados gracias a la transcripción génica que genera el mismo Óxido Nítrico actuando sobre las células musculares lisas de la capa media arterial ya que además de generar vasodilatación, las transforma en células secretoras de la Superóxido Dismutasa Endotelial que actuando en un equilibrio muy delicado neutraliza los efectos deletereos de los Radicales Libres sobre el Óxido Nítrico, de tal manera que al permanecer más tiempo en la célula endotelial, no ocurre la oxidación del LDL y entonces no aparecen las Moleculas de Adhesión Celular (VCAM1 e ICAM) cortando de raiz el inicio de la respuesta endotelial inflamatoria (15). (Figura 9)
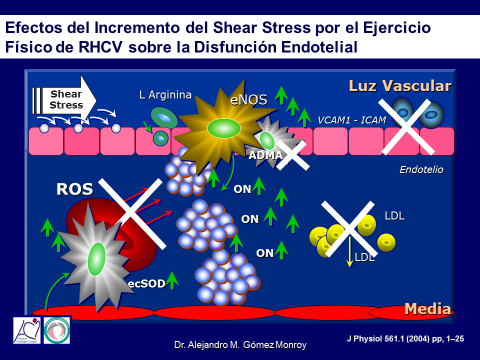
Figura 9
Y todo esto ya ha sido demostrado en Hamburgo, Alemania por Christian Werner quien utilizando tres tipos de ratones de laboratorio, unos de tipo Wild-Tipe y otros modificados genéticamente para estar inhibidos en la producción de las Telomerasas y la enzima Oxido Nítrico Endotelial, luego los dividieron en dos grupos, sedentarios y running este grupo corrió una media de cinco km por día, luego les midio las Proteinas Antisenescentes (las telomerasas) y las Proteinas Proapoptoticas a las tres semanas, tres y seis meses. (16)(Figura 10)
A los tres meses los análisis mostraron en los ratones wild-tipe que, las telomerasas aumentaban rapidamente y las proteinas proapoptoticas disminuian, ambas significativamente en el grupo running en relación a los ratones sedentarios, luego evaluaron lo mismo sobre los grupos de ratones geneticamente modificados y encontraron que no se producia ningúna diferencia entre el grupo running y el sedentario.
Estos hallazgos se replicaron de la misma forma a los tres y seis meses, este estudio nos permite concluir que las proteinas antisenescentes aumentan rapidamente con el ejercicio y las proteinas proapoptóticas disminuyen con el mismo, que el efecto se mantiene a traves del tiempo y que ambas acciones dependen de la indemnidad de las telomeras y de la enzima óxido nítrico. (Figuras 11, 12 y 13)

Figura 10
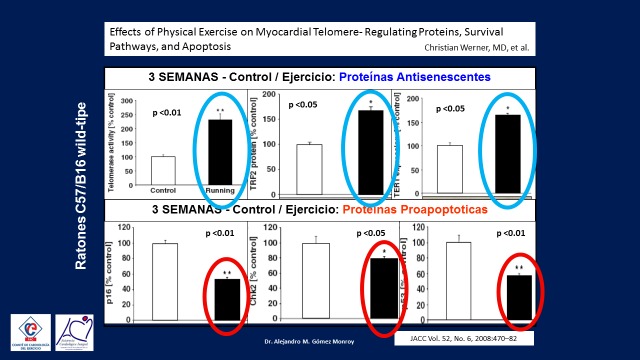
Figura 11
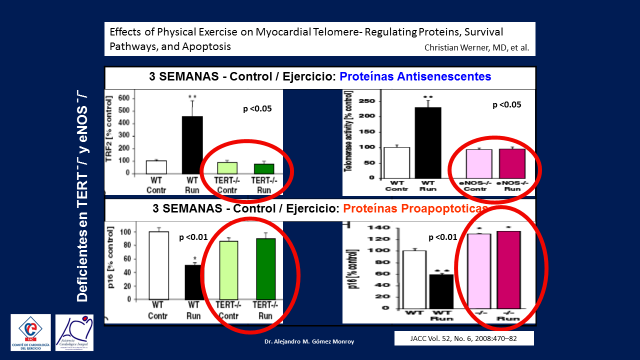
Figura 12

Figura 13
Un años después, el mismo grupo de investigadores publico un articulo similar, pero hecho sobre seres humanos, luegos los dividieron en dos grupos, uno menor de 20 años y otro mayor de 50, a la vez cada grupo fue dividido en sedentarios y atletas. (17)(Figura 14)
A todos los grupos se les midieron las telomerasas en sangre y luego se evaluo la longitud de los telómetros de los Leucocitos.
Las telomerasas se encontraban elevadas y sin diferencias significativas tanto en los jóvenes como en los adultos activos y mostraban una gran diferencia significativa con ambos grupos sedentarios.
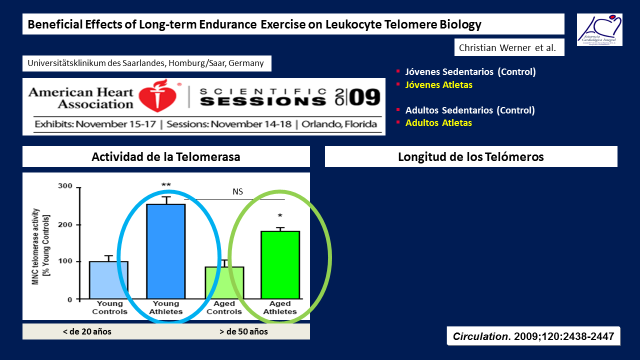
Figura 14
En relación a la lungitud de los telómeros, los adultos mayores activos tuvieron los telómeros tan largos y sin diferencias significativas con los más jovenes y mucho más largos que los grupos de adultos sedentarios. (Figura 15)
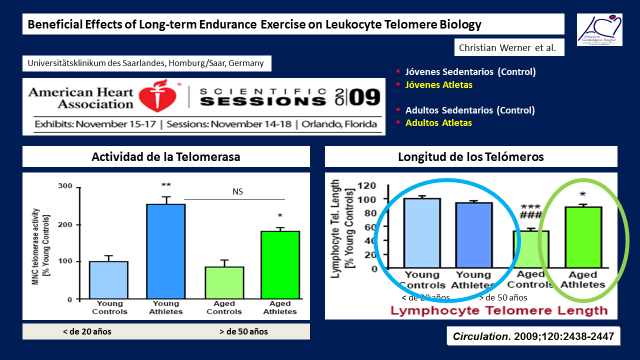
Figura 15
Los telómeros de los jovenes tanto sedentarios como activos mostraron los telómeros largos ya que si bien estos comienzan a afectarse desde el mismo momento del nacimiento, el acortamiento solo se hace evidente luego de los 50 años de edad.
Pero no solo el conocer la longitud de los telómeros como si fuera una fotografía estática es suficiente, también es importantesaber cual es el comportamiento de los mismos a traves del tiempo, tal como si fuera parte de una película, es decir saber como es el comportamiento de la “dinámica de los telómeros” tendría implicancias sobre la mortalidad.
Esto fue demostrado en un estudio realizado sobre 608 pacientes coronarios del Heart and Soul Study publicado en el 2015 por el grupo de Goglin y sus colaboradores, dentro de los cuales se encontraba la Dra. Elizabeth Blackburn quien fuera distinguida con el premio Nobel de Medicina en el año 2009 por sus descubrimientos de cómo los telómeros eran protegidos por las telomerasas. (18)(Figura 16) El estudio evaluo la mortalidad a 10 años de pacientes coronarios.
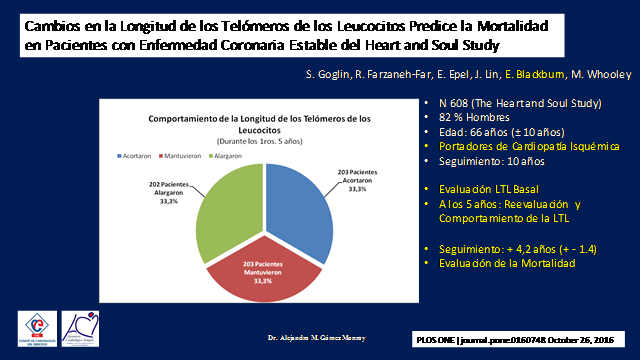
Figura 16
En primera instancia se midieron la longitud de los telómeros de sus leucositos y se los volvió a medir a los cinco años, en este punto el 33,3% habían acortaron sus telómeros, el 33,3 los habían mantenido igual y el 33,2 los habían alargado, luego se evaluo la mortalidad a los 4,2 años (+ -1,4 años) en cada grupo.
El resultado fue sorprendente dentro de los que habían acortado sus telómeros la mortalidad fue de 39% (79/203), entre los que los habían mantenido fue de 22% (45/203) y de los que los habían alargado solo de 12% (25/202). (Figura 17)
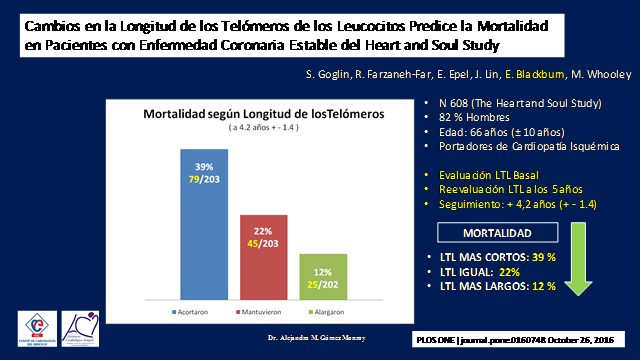
Figura 17
Un año antes, en el 2015, otro grupo de investigadores dentro de los que se encontraba también la Dra. Elizabeth Blackburn había publicado otro estudio similar, pero con un número muy grande de individuos tomados del estudio NHANES de 1999 al 2002. (19)(Figura 18)
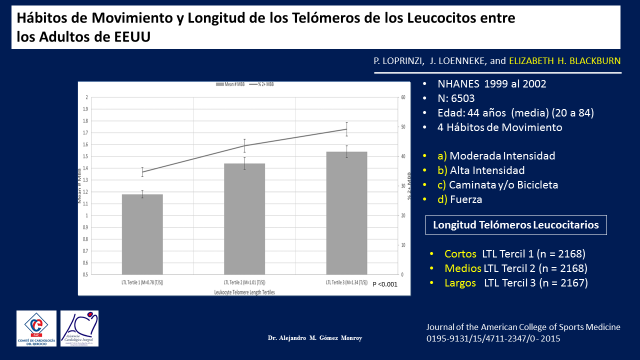
Figura 18
Fueron 6503 personas de 44 años de edad media (20 a 84) y se estudio la presencia de cuatro hábitos de ejercicio físico y su relación con la longitud de los telómeros de sus Leucocitos.
Los cuatro habitos de ejercicio fueron, hacer a) Ejercicios físicos de moderada intensidad, b) Ejercicios de alta intensidad, c) Usar para sus tareas de la vida diaria la caminata o la bicicleta permanentemente y d) Ejercicio de fuerza.
Inicialmente se determino el nivel de los telómeros de toda la muestra y se observo que la población se dividia en tercilos, unos con los telómeros cortos, otros medianos y otros largos con diferencias significativas constituyendo practicamente una división del 33,3% cada uno.
Posteriormente se evaluo la posibilidad de No pertenecer al grupo de los telomeros más cortos según la cantidad de habitos de ejercicio aplicados y se observo que quienes hacian un solo habito la posibilidad de no estar en el tercil mas corto era del 3%, si hacian dos de 24%, si hacian tres de 29% y si hacian los cuatro de 52%. Es decir que quienes tenian mas cantidad de habitos de vida saludables, tenian mas probabilidades de encontrarse entre los tercilos con los telómeros medianos y largos. (Figura 19).
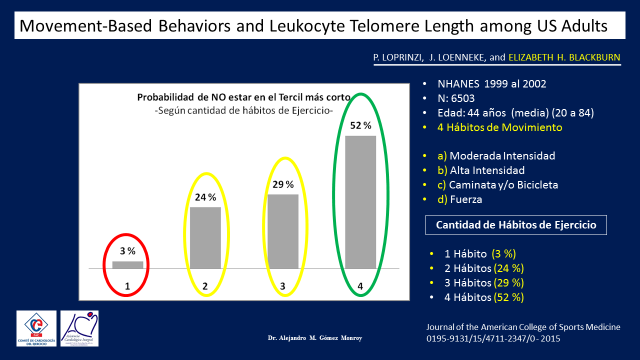
Figura 19
Existe ya suficiente evidencia que relaciona al ejercicio físico con la longitud de los telómeros, esto ha sido replicado en diversas poblaciones, incluso en poblaciones especiales como por ejemplo en las mujeres pos-menopausicas. (20)(Figura 20)
En este pequeño estudio Koreano se midieron la longitud de los telómeros de los Leucositos de un grupo de mujeres de 58 años unas que se mantenían sedentarias y otras que tenian una vida activa con un historial de al menos una hora de ejercicio físico tres o mas días a la semana y una vez mas aquellas mujeres activas mostraron un nivel mas largo de sus telómeros con una diferencia significativa con el grupo sedentario.
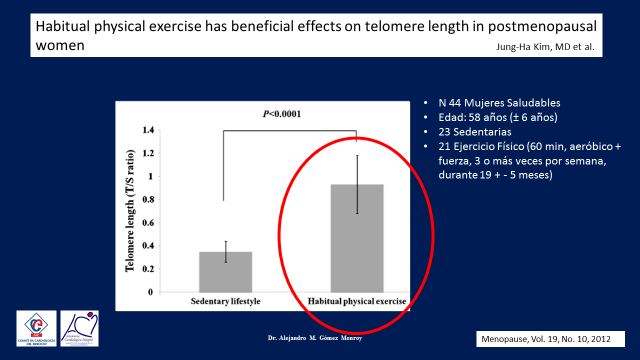
Figura 20
Hemos repasado algunas de las mas nuevas y significativas evidencias de la relación entre el ejercicio y la prolongación de la vida o la disminución de la mortalidad, además de describir los efectos biomoleculares del ejercicio físico sobre la salud de los telómeros que bien podrían ser la relación final de estos efectos, sin embargo esto que parecen ser investigaciones novedosas, en realidad no lo son…
Solo tenemos que remontarnos al pasado a esta reflexión hecha aproximadamente hace unos 2400 años por quien fuera considerado el padre de la medicina, Hipócrates. (Figura 21)

Figura 21
Esta gran observación del ser humano presentada por Hipocrates quien vivió unos 400 años antes de Cristo hace que cualquier cosa que podamos decir de los efectos del ejercicio físico sobre la salud, la vida y el envejecimiento no tendrán nada de moderno ni novedoso…
Dr. Alejandro M. Gómez Monroy MP. 17.532 Especialista Consultor en Cardiología
Bibliografia:
1.- Fuster J. et al. Circulation Reserch. 2006;99:1167-1180.
2.- R. Paffenbarger et al. (1978) American Journal of Epidemiology, 108 (3), 161-175.
3.- Arem H. et al. JAMA Intern Med. 2015;175(6):959-967.
4.- http://who.int/mediacentre/factsheets/fs310/en/
5.- Yusuf S. Et al. http://dx.doi.org/10.1016/S0140-6736(04)17018-9
6.- Sato I et al. Biochem Biophys Res Commun 195: 1070–1076, 1993
7.- Toussaint O, et al. Exp Gerontol 35: 927–945, 2000
8.- Puterman E. et al. PLoS ONE 5(5): e10837. doi:10.1371/journal.pone.0010837
9.- Epel E. et al. www.pnas.org_cgi_doi_10.1073_pnas.0407162101
10.- Yusuf S. The Lancet 2004 Sep 11-17;364(9438):937-52.
11.- Fyhrquist, F. et al. Nat. Rev. Cardiol. 10, 274–283 (2013)
12.- Aubert G. et al. Physiol Rev 88:557-579, 2008.
13.- Celermajer DS, et a.. Aging is associated with endothelial dysfunction in healthy men years before the age-related decline in women. J Am Coll Cardiol 24: 471–476, 1994.
14.- Kimura Y. et al Impaired endothelial function in hypertensive elderly patients evaluated by high resolution ultrasonography. Can J Cardiol 15: 563–568, 1999.
15.- Green D. et al. J Physiol 561.1 (2004) pp, 1–25. 16,- Werner C. et al. JACC Vol. 52, No. 6, 2008:470–82 17,- Werner C. et al. Circulation. 2009;120:2438-2447 18.- Goglin S. et al. PLOS ONE |journal.pone.0160748 October 26, 2016 19,- Loprizi P. et al. Journal of the American College of Sports Medicine 0195-9131/15/4711-2347/0 – 2015. 20,- Jung-Ha Kim et al. Menopause, Vol. 19, No. 10, 2012
