Metabolismo de las Grasas Durante el Ejercicio: Una Revisión Parte I: Movilización de Ácidos Grasos y Metabolismo Muscular
Asker Jeukendrup1, William H Saris1 y Anton J Wagenmakers1
Nutrition Research Center, Department of Human Biology, Maastricht University, Maastricht, The Neterlands.
Artículo publicado en el journal PubliCE, Volumen 0 del año 1999.
Publicado 25 de junio de 2007
Resumen
Palabras clave: metabolismo de las grasas, ácidos grasos, triacilglicéridos intramusculares, PTAG, ejercicio, lipóli
INTRODUCCION
Las dos fuentes principales de energía para la contracción muscular son los carbohidratos y las grasas. Si bien los aminoácidos de cadena ramificada, así como otros aminoácidos, pueden ser oxidados en el músculo, se piensa que su contribución al gasto total de energía es insignificante durante el ejercicio aeróbico. En la década pasada se llevo a cabo una investigación extensiva acerca del rol de los carbohidratos durante el ejercicio, lo que condujo a un entendimiento casi completo del metabolismo de los carbohidratos bajo condiciones de ejercicio. Hay mucho menos información disponible acerca del rol de las grasas durante el ejercicio. Por eso, nuestra comprensión del metabolismo de las grasas durante el ejercicio esta lejos de ser completa. El propósito de esta revisión es dar un panorama del conocimiento actual del metabolismo de las grasas durante el ejercicio. Se le da una especial atención a los factores que limitan la oxidación de grasas y los efectos del entrenamiento. La revisión del metabolismo de las grasas durante el ejercicio esta dividida en tres artículos separados.
- Parte I: Movilización de los ácidos grasos y metabolismo muscular.
- Parte II: Regulación del metabolismo y los efectos del entrenamiento.
- Parte III: Los efectos de las intervenciones nutricionales sobre el metabolismo de las grasas.
En esta parte se discuten los procesos de lipólisis y movilización de ácidos grasos, el transporte de ácidos grasos, y el consumo y oxidación por parte del músculo. Las revisiones que trataron estos temas en el pasado incluyen las Refs. (55) y (108), y una publicación muy reciente de Van der Vusse y Reneman (126).
NOMENCLATURA
En la literatura se manejan diversas nomenclaturas respecto de los ácidos grasos. Para evitar malos entendidos o malas interpretaciones se explicara la nomenclatura en este artículo. Se debe distinguir entre los ácidos grasos que son incorporados a triacilglicéridos (o su sinónimo intercambiable, triglicéridos) u otras partículas, y ácidos grasos que no son incorporados a triacilglicéridos. Los ácidos grasos que no son esterificados para formar un mono, di o triacilglicéridos son llamados ácidos grasos no esterificados (AGNE), o ácidos grasos libres (AGL). El término ácido graso libre, puede de alguna manera ser ambiguo debido a que, por ejemplo en el plasma, estos ácidos grasos están unidos a la albúmina y no se encuentran “libres”. También existe una pequeña fracción de ácidos grasos (menos del 0.01% del “pool” de ácidos grasos en plasma) que está realmente libre, y no unido a ningún otro compuesto (ácidos grasos no unidos a proteínas) (44, 101, 102). Por lo tanto utilizaremos el termino ácidos grasos (y no ácidos grasos libres) en esta revisión para designar a los ácidos grasos que no están esterificados a mono, di, o triacilglicéridos, pero podrían estar unidos a la albúmina o a proteínas (PUAG). La estructura química básica de los ácidos grasos se muestra en la Figura 1.
En humanos, la longitud de cadena de los ácidos grasos generalmente varía de C14 a C24, aunque pueden haber ácidos grasos con longitud de cadena más larga o más corta (Tabla 1). Los ácidos grasos con una longitud de cadena de C8 o C10 son llamados ácidos grasos de cadena media (AGCM) mientras que aquellos con una longitud de cadena de C6 o menos son llamados ácidos grasos de cadena corta (AGCC)(67).
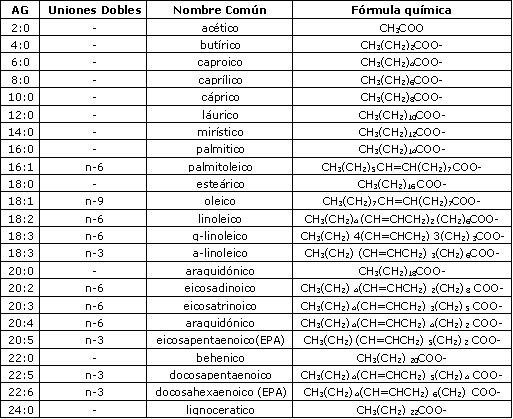
Tabla 1. Nomenclatura y fórmulas de los ácidos grasos (AG).
Los ácidos grasos más abundantes son los de cadena larga (AGCL) con una longitud de cadena de C12 o más. De los ácidos grasos de cadena larga, los ácidos palmítico (C16) y oleico (C18, con una unión doble) son los mas abundantes. Los ácidos grasos sin unión doble en su cadena de hidrocarbono son llamados ácidos grasos saturados, y aquellos con una o más uniones dobles, ácidos grasos no saturados. Los ácidos grasos con una unión doble se conocen como ácidos grasos monoinsaturados mientras que los ácidos grasos con dos o más uniones dobles son llamados poliinsaturados. También la posición de la unión doble es usualmente indicada. Por ejemplo C20:4 (n-3) significa que este acido graso de 20 carbonos con cuatro uniones dobles tiene la primera unión doble comenzando desde el tercer carbono, contando desde el grupo metilo Terminal (Figura 1). Otra forma de indicar el ácido graso y la posición de la unión doble es C20: 4 w3.
Los combustibles lípidos oxidables incluyen ácidos grasos, triacilglicéridos intramusculares (TGIM) y triacilglicéridos circulantes en plasma (TG; quilomicrones y lipoproteínas de muy baja densidad (VLDL)). Estos TG en plasma son comúnmente incorporados en las lipoproteínas como quilomicrones, lipoproteínas de baja densidad (LDL), lipoproteínas de densidad intermedia (IDL), o lipoproteínas de alta densidad (HDL). Estas lipoproteínas difieren en sus densidades, contenido de TG y contenido de colesterol pero ellos también cumplen diferentes funciones. El VLDL, por ejemplo, es la especie principal de lipoproteínas para el transporte de triacilglicéridos desde el hígado hacia el tejido adiposo y el músculo mientras que la función del HDL, es el transporte de colesterol desde los tejidos periféricos hacia el hígado. Por lo tanto, se cree que los quilomicrones y el VLDL pueden desempeñar un rol en el metabolismo energético durante el ejercicio, mientras que la LDL, IDL y HDL probablemente no desempeñen un rol significativo en la provisión de energía para el músculo. Los compuestos derivados de grasas como los cuerpos cetónicos (acetoacetato y beta-hidroxibutirato) pueden servir como combustibles mientras que el glicerol puede ser convertido en glucosa en el proceso de glucogénesis en el hígado, y subsecuentemente utilizado como glucosa.
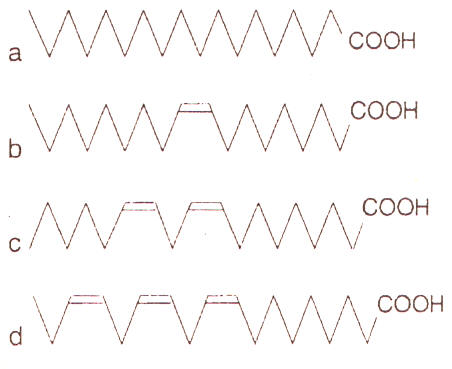
Figura. 1. Estructura química de algunos ácidos grasos comunes. a) Ácido
esteárico, 18:0; b) Ácido oleico 18:1 (n-9); c) Ácido linoleico 18:2 (n-6); d) α
ácido linoleico 18:3 (n-3)
ACIDOS GRASOS VERSUS CARBOHIDRATOS
Los ácidos grasos tienen diversas propiedades bioquímicas y físicas lo cual los distingue de los carbohidratos y, en muchos casos, los hace el sustrato de elección. Una de estas propiedades es que las grasas contienen más del doble de energía por gramo que los carbohidratos, 38 kj/gr (9 kcal/gr) para las grasas versus 18 kj/gr (4 kcal/gr) para los carbohidratos. Además, los carbohidratos son almacenados en presencia de agua, mientras que las grasas son almacenadas casi en forma anhidra (1 gr de glucógeno contiene aproximadamente 2 gr de agua [67]). Esto hace de las grasas un combustible mucho más eficiente por unidad de peso. Si todas las grasas en nuestro cuerpo serian sustituidas por una cantidad equienergética de carbohidratos nuestro peso seria el doble. Las grasas parecen ser el combustible ideal para el ejercicio prolongado en situación de los cuales la provisión de alimentos es limitada. Un buen ejemplo para ilustrar este hecho son ciertas especies animales, como las aves migratorias, que vuelan por días sin comer. Estas aves que dependen fuertemente de sus depósitos de energía endógenos, ya que almacenan casi exclusivamente grasas como combustibles (43).
En humanos tanto grasas como carbohidratos son almacenados. Los carbohidratos son almacenados como glucógeno en los músculos y en el hígado. El glucógeno muscular puede ser utilizado directamente como combustible de los procesos contráctiles, mientras que la glucosa del glucógeno hepático primero tiene que ser transportada por la sangre, y tomada por el músculo antes que esta pueda ser oxidada. Los sustratos gluconeogénicos como lactato, glicerol y aminoácidos pueden ser convertidos en glucosa en el hígado, y pueden servir indirectamente como sustrato energético. Además, las fuentes exógenas de carbohidratos también pueden proveer glucosa para los procesos oxidativos en el músculo, luego de haber sido absorbidas en el intestino y de haber entrado en la circulación. Los depósitos de carbohidratos son pequeños. La cantidad total de glucógeno hepático muscular de un hombre de 80 kg es de aproximadamente 400 gr (Tabla 2) aunque los individuos entrenados pueden tener depósitos de glucógeno más grandes. El glucógeno hepático representa aproximadamente 80-100 gramos. La cantidad total de sustratos en plasma (glucosa y lactato) es de aproximadamente 20 gramos. Expresado en términos de energía, los depósitos de carbohidratos del cuerpo representan aproximadamente 8.00 kj (2.000 kcal). En comparación con esto, los depósitos de grasas son muy grandes y, teóricamente, los depósitos de grasas podrían proveer energía por días mientras que los depósitos de glucógeno se pueden depletar dentro de los 60-90 min. Se ha estimado que al correr una maratón se requieren aproximadamente 83 kj/min (21 kcal/min) para corredores de maratón de elite mientras que los corredores que no son de elite gastan una cantidad similar de energía durante toda la distancia (42:2 km: aprox. 12.000 kj)(92). Por lo tanto, se puede calcular que 500 gr de glucógeno pueden servir de combustible para correr aproximadamente 95 min a ritmo de maratón para corredores de elite. Calculando la cantidad de energía almacenada como grasas para un hombre de 80 kg y una mujer de 60 kg (composición corporal promedio) se podrían obtener respectivamente 450.000 kj (110.000 kcal) y 550.000 kj (135.000 kcal) la energía almacenada en forma de carbohidratos puede variar en un rango desde 6.00 kj (1.500 kcal) hasta 12.000 kj (3.00 kcal) en otras palabras, si pudieran ser utilizadas solo las grasas o solo carbohidratos como combustible, los depósitos de carbohidratos de los músculos en ejercicio podrían contribuir con energía por no mas de 95 min de carrera en la maratón, mientras que la energía derivada de los depósitos de grasas seria satisfactoria para 119 horas de carrera de maratón continua (92).

Tabla 2. Los depósitos de energía de un hombre de 80 kg
Los valores dados son estimados para un hombre de 80 kg la cantidad de proteínas en el cuerpo no esta mencionada pero podría ser aproximadamente 10 kg (160.000 kj), principalmente ubicadas en el músculo.
Por supuesto que el tejido adiposo contiene la mayor cantidad de grasas, y la mayoría de las grasas en el hombre son almacenadas en el tejido adiposo subcutáneo y visceral profundo. El almacenamiento de grasas es dinámico, lo cual significa que en el caso de un balance negativo de energía, el tamaño de las células grasas del individuo decrecerá, mientras que con un balance positivo, el exceso de ácidos grasos ser convertido en triacilglicéridos, lo que resulta en hipertrofia de células grasas. Si bien el tejido adiposo es lejos el sitio más importante de almacenamiento, las grasas también son almacenadas dentro del músculo. El tamaño de este “pool” de grasas es difícil de determinar, pero se estima que es de entre 7 y 40 mmol/kg ps (14, 35, 40, 70, 109). Se estimo que la cantidad total de grasas almacenadas en todas las células musculares es de aproximadamente 300 gramos (10), pero asumiendo una masa muscular de 18 kg en un hombre de 80 kg, y la concentración de TG en el músculo en el rango de 7 y 40 mmol/kg ps, esto puede variar desde 100-600 gramos. La cantidad de ácidos grasos almacenados varía sustancialmente entre tejidos pero también dentro de los mismos. En el tejido muscular por ejemplo, se demostró que las fibras tipo I tienen un contenido de TG mas alto que las de tipo II (35, 39). Al margen de estos depósitos de TG en el tejido adiposo y el músculo existe una pequeña fracción de ácidos grasos en la sangre, transportada por lipoproteínas o como un acido graso, unido a la albúmina.
Los ácidos grasos proveen más ATP por molécula que la glucosa. Una molécula de glucosa puede producir 38 ATP mientras que una molécula de acido esteárico puede producir 147 ATP. Sin embargo, para producir la misma cantidad de ATP, la oxidación de ácidos grasos requiere más oxígeno que la oxidación de carbohidratos (88). La oxidación de una molécula de glucosa requiere 6 moléculas de oxígeno mientras que, por ejemplo, la oxidación completa del acido esteárico requiere 26 moléculas de oxígeno.
Además, por unidad de tiempo puede ser derivado más ATP desde los carbohidratos (glucosa) que desde la oxidación de ácidos grasos (88). Cuando los ácidos grasos provenientes de la sangre son oxidados la tasa máxima de formación de fosfato de alta energía (FAE) es 0.40 mmol FAE/min, mientras que la ruptura aeróbica o anaeróbica de glucógeno endógeno puede generar 1.0-2.4 mmol FAE/ min (126). Debido a que las vías metabólicas mas allá de la formación de acetil CoA son idénticas para la oxidación de carbohidratos y ácidos grasos, el paso tasa-limitante en la utilización total de grasas debe ser próximo al Ciclo de los ácidos Tricarboxílicos (CAT) (posiblemente por beta oxidación, activación del acido graso, transporte a través de la mitocondria mediado por la carnitina, o transporte de ácidos grasos desde la sangre hacia el sitio intracelular de activación). En el presente, la pregunta acerca de que parte de la utilización total de ácidos grasos es tasa-limitante no esta resuelta aun. Los posibles pasos limitantes serán discutidos a continuación.
LAS GRASAS COMO COMBUSTIBLES DURANTE EL EJERCICIO
En los primeros años, Zuntz (145,146), Krogh y Lindhart (80) y mas tarde Christensen y Hansen (24) demostraron que en reposo, y durante el ejercicio, se utiliza una mezcla de carbohidratos y grasas. Basados en el hecho de que los carbohidratos producen diferentes cantidades de CO2 y requieren diferentes cantidades de O2 cuando son oxidados, estos investigadores utilizaron mediciones de VO2 y VCO2 en gases espirados para obtener información acerca de la utilización de sustratos. El cociente VCO2 / VO2 en el aire espirado, el índice de intercambio respiratorio (R) puede ser de 0.69-0.73 cuando se oxidan solo grasas (dependiendo del largo de la cadena de carbono del ácido graso oxidado), y puede ser 1.0 cuando se oxida solo glucosa. Estos primeros estudios no solo demostraron que tanto carbohidratos como grasas fueron utilizados durante el ejercicio sino también que sus contribuciones relativas cambiaron dependiendo de la intensidad, la duración del ejercicio y la dieta previa al mismo (24, 32, 80). En general más del 50% de los requerimientos energéticos en reposo es derivado de la oxidación de ácidos grasos (50). Los ácidos grasos siguen siendo un sustrato muy importante durante el ejercicio, mientras la intensidad de ejercicio esta por debajo de 80-90 % VO2 máx (47, 50, 105). Por encima de esta intensidad de ejercicio, los carbohidratos son el sustrato predominante (1, 47, 50, 105).
En tanto los primeros estudios estuvieron principalmente basados en mediciones de intercambio de gases respiratorios, luego de la Segunda Guerra Mundial se dispuso de marcadores de isótopos radioactivos y estables, y con técnicas de dilución de trazadores fue posible investigar la cinética de la movilización y utilización de sustratos (97). También fue muy importante la reintroducción de la técnica de biopsia muscular por parte de Bergstrom y Hultman (8, 9, 69) al final de los años sesenta. Estas técnicas hicieron posible cuantificar los flujos de sustratos y medir la concentración de sustrato en los tejidos.
PROCESOS QUE POTENCIALMENTE LIMITAN LA OXIDACION DE GRASAS
Dado que los depósitos corporales de glucógeno son relativamente pequeños y a que se demostró que la deplección de estos depósitos resulta en fatiga, seria beneficiosos para el rendimiento, si a la misma intensidad de ejercicio pudieran ser oxidados más ácidos grasos y menos carbohidratos. Sin embargo, aunque los depósitos de grasas son relativamente grandes, la capacidad de oxidar ácidos grasos es limitada, y en muchos casos los carbohidratos son el sustrato dominante. La razón para esta limitación en el uso de los depósitos de grasas sigue sin ser completamente dilucidada. Las limitaciones en oxidación de grasas podrían estar ubicadas a diferentes niveles.
- Movilización de ácidos grasos desde el tejido adiposo.
- El transporte de ácidos grasos hacia el músculo.
- El consumo de ácidos grasos por parte de la célula muscular.
a- El consumo de ácidos grasos plasmáticos.
b- El consumo de ácidos grasos desde la unión lipoproteína- TG circulante en plasma.
- Movilización de ácidos grasos de los “pools” de TGIM.
- El transporte de ácidos grasos dentro de la mitocondria.
- La oxidación de ácidos grasos en la mitocondria.
Movilización de ácidos grasos
La mayoría de los tejidos (e.g., el músculo, hígado, intestino, cerebro) contienen solo pequeñas cantidades de grasas y la disponibilidad de estos tejidos para la síntesis “de novo” de grasas es pequeña, en compararon con la resíntesis (“turnover”) de ácidos grasos durante el ejercicio. Por lo tanto la mayoría de los tejidos depende de un continuo abastecimiento de ácidos grasos de la dieta y del tejido adiposo. Esto también es valido para el músculo. La tasa de movilización de ácidos grasos del tejido adiposo depende de:
1) la tasa de lipólisis; 2) la tasa de reesterificación de los ácidos grasos dentro del adiposito; y 3) la tasa de transporte de ácidos grasos desde el tejido adiposo hacia la sangre.
Lipólisis en el tejido adiposo
En el tejido adiposo, los ácidos grasos son continuamente movilizados por lipólisis (hidrólisis de tri-acilgliceroles), un proceso que puede ser iniciado por el sistema nervioso simpático (SNS). Un primer paso en el proceso de movilización de lípidos desde los adipositos es la transferencia de triacilgliceroles desde la gotita principal de lípidos hasta el sitio de descomposición enzimática en el citoplasma del adiposito (Figura 2). Si bien solo hay una pequeña información acerca de este proceso, se cree que no es un factor tasa-limitante (11). Un segundo paso en la movilización de ácidos grasos es la descomposición enzimática del triacilglicérido en el citoplasma. Los ácidos grasos en el exterior o la posición beta de los triacilglicéridos son hidrolizadas por la acción de la lipasa hormona-sensible (LHS). Esta enzima esta sujeta a la regulación hormonal. El monoacilglicerol remanente (glicerol con un acido graso en la posición-alfa (interior) es entonces hidrolizado por la enzima mas activa monoaciglicerol lipasa.
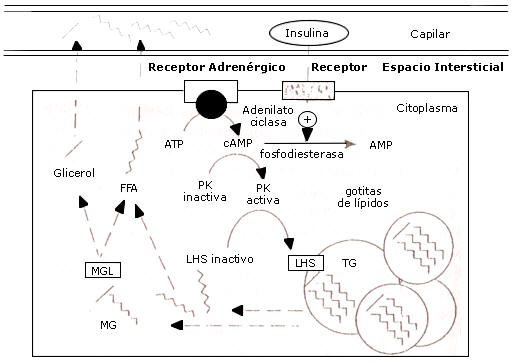
Figura 2. Movilización de ácidos grasos desde el tejido adiposo. Los
triacilgliceroles son transportados desde la gotita de lípidos hacia el
citoplasma del adiposito. Este triacilglicerol esta sujeto a descomposición por
la enzima lipasa hormona-sensible (LHS); se forman un monoacilglicerol y dos
ácidos grasos, los cuales se pueden difundir dentro de la circulación. El
monoacilglicerol remanente es descompuesto por la enzima monoacilglicerol lipasa
(MGL) en glicerol y otro ácido graso, el cual también puede difundirse dentro de
la circulación. El monoacilglicerol remanente es descompuesto por la enzima
monoacilglicerol lipasa (MGL) en glicerol y otro ácido graso, el cual también
puede difundirse dentro de la circulación. El paso tasa- limitante en la
movilización de los ácidos grasos desde la gotita de lípidos es la LHS. Esta
enzima esta presente en una forma activa e inactiva, y puede ser activada por
estimulación adrenérgica, lo cual disparar una cascada de eventos conduciendo a
la fosforilación de la hormona sensitiva lipasa inactiva. La insulina estimula
la fosfodiesterasa conduciendo a niveles reducidos de cAMP y activación
disminuida de LHS (PK = Protein-Kinasa; LHS = Lipasa hormona-sensible; TG =
Triglicérido, ácidos grasos = ácidos grasos libres).
El glicerol no puede ser reutilizado por el adiposito para formar nuevos triacilglicéridos debido a que la enzima glicerol quinasa, solo esta presente en muy bajas concentración o aun ausente en el tejido adiposo (y músculo) (104). El glicerol es una pequeña molécula soluble en agua que puede difundirse fácilmente a través de la membrana celular dentro de la sangre. Por lo tanto todo el glicerol producido por lipólisis en el adiposito es liberado en la circulación. Por esta razón la aparición de glicerol en la sangre generalmente es utilizada como medición (de todo el cuerpo) de lipólisis. Sin embargo, debe señalarse que en ciertas condiciones como isquemia, también puede haber otras fuentes de producción de glicerol (e.g., Hidrólisis de glicerol-3-fosfato en glicerol) como lo muestran de Groot et al (29) para músculo cardiaco. Además, Elia et al (31) han mencionado la posibilidad de que el glicerol liberado del TGIM podría ser directamente oxidado, lo cual puede resultar en una subestimación de la lipólisis corporal total determinada por el marcador. A diferencia del glicerol, los ácidos grasos pueden ser reesterificados para formar nuevos triacilglicéridos, un proceso llamado ciclo triacilglicérido – graso. Los estudios con marcadores generalmente asumen que alguno de los ácidos grasos y todo el glicerol formado por lipólisis en el citoplasma se difundirá fuera del adiposito en la circulación.
La tasa de lipólisis es ampliamente dependiente de la activación de la Lipasa Hormona-Sensible. La regulación de la actividad de esta enzima es de importancia primaria para la movilización de ácidos grasos desde el tejido adiposo. La actividad de la enzima depende de diversos factores inhibitorios y estimulantes. El SNS y la concentración de epinefrina circulante parecen ser los mayores factores inhibitorios y estimulantes (41), y la insulina probablemente es la mayor hormona tiroidea contrarregulatoria (58). Estudios en adipositos humanos aislados revelaron que a concentraciones fisiológicas, las catecolaminas, los glucocorticoides, la hormona tiroidea estimulante y la hormona del crecimiento son buenos estimulantes de la lipólisis (26, 58). La importancia relativa de estos factores estimulantes sobre la lipólisis no esta completamente dilucidada. Por el contrario, el lactato (53), los cuerpos cetónicos (26) y especialmente la insulina (58) tienen un efecto inhibitorio sobre la enzima.
La transferencia de la actividad del SNS al nivel celular ocurre a través de receptores adrenérgicos. En el tejido adiposo humano, las catecolaminas tienen ambos efectos sobre la tasa de lipólisis, el efecto alfa-adrenérgico inhibitorio, y el efecto beta-adrenérgico estimulante (26, 37). A través de los receptores adrenérgicos se disparan una cascada de eventos: el sistema adenilato ciclasa es activado, lo cual estimula el sistema Protein-quinasa. La Protein-quinasa, en cambio, activara la lipasa por fosforilación. La insulina actúa principalmente estimulando las fosfodiesterasas lo cual rompe al cAMP a AMP, previniendo, por lo tanto, la estimulación de LHS. Por otro lado, la cafeína por ejemplo, es un estimulante conocido del sistema adenilato ciclasa, y por lo tanto también un potente estimulante de la lipólisis (ver sección acerca de cafeína, parte III: Efectos de las intervenciones nutricionales).
Estudios que utilizaron micro-diálisis demostraron que en el hombre, los mecanismos inhibitorios alfa-adrenérgicos modulan la lipólisis en reposo, mientras que los efectos estimulantes beta-adrenérgicos son predominantes durante el ejercicio.
Durante el ejercicio la concentración de insulina en plasma decrece, principalmente debido al efecto inhibitorio de la epinefrina, y en un menor grado de la norepinefrina, sobre la liberación de insulina pancreática. Debido a que la insulina es un fuerte inhibidor de la lipólisis, el efecto neto será una lipólisis incrementada. Al mismo tiempo se incrementara la sensibilidad de los receptores beta-adrenérgicos a las catecolaminas en el tejido adiposo (133). La combinación de estos efectos resulta en una lipólisis incrementada en el tejido adiposo durante una intensidad de ejercicio de baja a moderada. A altas intensidades de ejercicio >80% VO2 máx, los altos niveles de epinefrina circulante, en combinación con flujo glucolítico incrementado, y las concentraciones aumentadas de lactato en plasma pueden reducir la lipólisis e incrementar la reesterificación en el tejido adiposo, resultando en una reducción de la Tasa de aparición (Ra) de ácidos grasos.
Tasa de Remoción de Ácidos Grasos
Si bien los mayores factores regulatorios que controlan la movilización de ácidos grasos del tejido adiposo son a través de la estimulación adrenérgica y de la insulina, la tasa a la cual los ácidos grasos son removidos del tejido adiposo parece ser otro factor. La tasa de remoción de los ácidos grasos desde el tejido adiposo depende de la concentración de albúmina en el plasma, el cociente acido graso arterial/albúmina y el flujo sanguíneo a través del tejido adiposo (17). La concentración de albúmina en plasma es bastante constante (aproximadamente 6 mmol/l), mientras que en la mayoría de las condiciones (excepto en el ayuno prolongado y en el ejercicio de resistencia de larga duración), la concentración de ácidos grasos varia entre 0.2-1.0 mmol/L. Durante una intensidad de ejercicio moderada la concentración de ácidos grasos en el plasma arterial se puede incrementar más de veinte veces. Esto conduce a cambios en el cociente ácidos grasos/albúmina desde un valor de reposo de 0.2 a valores de 3-4 durante el ejercicio. Dado que la albúmina se une a los ácidos grasos con afinidad decreciente, al ser ocupados más lados de las uniones (113), los incrementos en el cociente ácidos grasos/albúmina están acompañados de las concentraciones incrementadas de la fracción de ácidos grasos no unida a proteínas en el plasma. Esto en cambio favorece la reesterificación dentro del adiposito dado que el cociente ácidos grasos/albúmina en el plasma se incrementa aun más (15,20). También se demostró que el flujo sanguíneo del tejido adiposo incrementa marcadamente la tasa de remoción desde tejido adiposo, y por lo tanto, la movilización de ácidos grasos (17,20).
Madsen et al (83) demostraron que en el tejido adiposo perfundido los incrementos en el cociente ácidos grasos/albúmina como también los detrimentos en el flujo sanguíneo adiposo reducen la movilización de ácidos grasos. Ellos sugirieron que la producción neta de ácidos grasos reducida fue debido al incremento de las tasas de reesterificación o una capacidad reducida de transporte de la sangre. Durante el ejercicio, el flujo sanguíneo a través del tejido adiposo se puede incrementar mas de tres veces lo cual puede compensar parcialmente la capacidad reducida de transporte causada por el incremento del cociente ácidos grasos/albúmina (16, 18, 19).
Ciclo Triacilglicérido-Ácidos Grasos
Como se mencionó antes, el glicerol que es liberado luego de la lipólisis, no puede ser incorporado en los triacilglicéridos, dado que la enzima glicerol-quinasa esta virtualmente ausente en el tejido adiposo y en el músculo (104). En el tejido adiposo esta enzima, además, de necesita para convertir glicerol en glicerol-3-fosfato (G-3-F) que es la columna vertebral de una molécula de triacilglicérido. Por lo tanto, la tasa de aparición (Ta) de glicerol generalmente es utilizada como indicador directo de lipólisis (141). El G-3-F requerido para la reesterificación deriva indirectamente de la glucosa en el tejido adiposo. La formación de G-3-F involucra la reducción del fosfatodihidroxiacetona, un intermediario glucolítico. Los G-3-F nuevamente formados pueden entonces ser ligados a acil CoA para sintetizar triacilglicéridos. Con bajos niveles de glucosa en sangre, menos G-3-F se formará, y consecuentemente la tasa de reesterificación de ácidos grasos decrecerá (142,143). El exceso de ácidos grasos será liberado en la circulación. Esta hidrólisis de TG y subsecuente reesterificación fue el primer ciclo de sustratos documentado, y es llamado el ciclo triacilglicéridos-ácidos grasos (Figura 3). El funcionamiento de este ciclo permite al adiposito ajusta la liberación de ácidos grasos rápidamente en respuesta a las alteraciones en las demandas metabólicas. Pero ejemplo, cuando no hay suficiente glucosa disponible, la reesterificación se reducirá y más ácidos grasos son movilizados desde el tejido adiposo (142). La reesterificación puede ocurrir dentro del adiposito (reesterificación intracelular) o los ácidos grasos pueden ser liberados y reesterificados en algún otro tejido (reesterificación extracelular).
Asumiendo la hidrólisis completa de cada molécula de TG, la liberación de 1 molécula de glicerol debería estar acompañada por la liberación de 3 moléculas de ácidos grasos, si no ocurre reesterificación luego de la histolisis de los triacilglicéridos. Sin embargo, se descubrió que el cociente de liberación entre glicerol (Ta glicerol) y ácidos grasos (Ta AG) usualmente es 1-2 (142). Esto significa que parte de los ácidos grasos derivados de la lipólisis no entrarán en el torrente sanguíneo pero serán utilizados para reesterificación. La estimulación de la lipólisis tiene lugar muy rápidamente luego del comienzo del ejercicio (5). Sin embargo, la tasa de lipólisis excede por lejos la necesidad de ácidos grasos en los procesos oxidativos. Por lo tanto, se concluyó que la movilización de ácidos grasos fue regulada por la reesterificación. Durante los primeros 30 min de ejercicio al 40% VO2 máx, la reesterificación de los ácidos grasos estuvo marcadamente reducida. Mientras que en reposo aproximadamente un 70% de todos los ácidos grasos liberados fue reesterificado, durante el ejercicio solo el 25% fue reesterificado (142). Descubrimientos similares fueron obtenidos por Hodgetts et al (62) durante el ejercicio al 50-70% del VO2 máx. Durante los primeros30 min de ejercicio, la reesterificación se suprime, y al mismo tiempo, la lipólisis y el flujo sanguíneo al tejido adiposo son incrementados (16). Esto resulta en un incremento masivo en la tasa de aparición y disponibilidad de ácidos grasos en el plasma. La tasa de reesterificación también depende de la disponibilidad de plasma para transportar hacia fuera los ácidos grasos liberados (i.e., el número de sitios libres de unión a la albúmina para los ácidos grasos y el flujo sanguíneo del tejido adiposo), y la disponibilidad de glucosa para producir G-3-F. Además, se demostró que el lactato incrementa la tasa de reesterificación de ácidos grasos (73, 98, 111). Shaw et al (111) expresaron que una concentración de lactato de 2 mmol/l reduce la producción de ácidos grasos un 35-40 % en todo el animal.
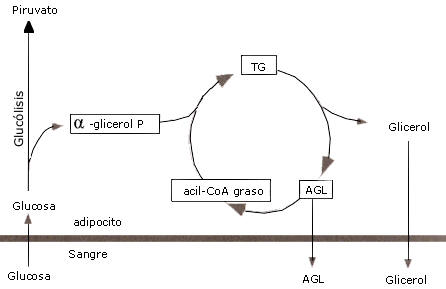
Figura 3. El ciclo triacilglicérido-acido graso. Los ácidos grasos (AG)
movilizados luego de la hidrólisis de los triacilglicéridos (TG) pueden ser
liberados en la circulación o reesterificdo con una molécula de
glicerol-3-fosfato (G-3-F). Esta hidrólisis de TG y la subsecuente
reesterificación es llamada ciclo triacilglicérido-ácido graso.
Transporte de lípidos por la sangre
Cuando los ácidos grasos pasaron la membrana celular del adiposito pasivamente, o mediados por proteínas asociadas a la membrana como la ácido graso-translocasa (AGT) o como la proteína transportadora de ácidos grasos (PTAG) (60, 110, 126), estos se moverán a través del intersticio unidos a la albúmina, pasarán la pared vascular de los capilares, y nuevamente se unirán a la albúmina circulante. Dado que la albúmina tiene al menos tres sitios de unión con ácidos grasos de alta afinidad (113), bajo circunstancias fisiológicas una minoría de todos los sitios de unión esta ocupada. La fracción mas grande de los ácidos grasos en el plasma (más del 99.9 %) es transportada unida a la albúmina (101, 102). Previo a la extracción por parte del músculo esquelético, los ácidos grasos tienen que ser liberados desde la albúmina debido a que la permeabilidad de las células endoteliales, que revisten la pared de los capilares musculares, es muy baja para el complejo albúmina- ácido graso (7). Como se discutió previamente, el flujo sanguíneo y la saturación de complejo albúmina- ácido graso parecen ser factores importantes en la movilización de ácidos grasos desde el tejido adiposo (21). En el hígado los ácidos grasos pueden ser incorporados en las lipoproteínas (lipoproteínas de muy baja densidad, VLDL). Otras lipoproteínas también funcionan como trasportadores de ácidos grasos a través de la sangre (quilomicrones, lipoproteínas de baja densidad [LDL], lipoproteínas de alta densidad [HDL].
Mecanismo de consumo de ácidos grasos
Havel et al (61) en 1967, demostraron que durante el ejercicio las concentraciones de ácidos grasos en el plasma se incrementaron junto con el consumo de los mismos aunque la tasa de extracción fraccional se redujo. Estudios en hombres y perros sugirieron que existe una relación lineal entre concentraciones de ácidos grasos en la sangre y la utilización de los mismos, sugiriendo que el consumo de ácidos grasos por el músculo es un proceso pasivo que curre por difusión pasiva (4, 71). Sin embargo, esta visión tradicional fue puesta en tela de juicio recientemente (7, 125). Se está acumulando evidencia que indica la existencia de un “sistema transportador” de ácidos grasos a través de la membrana celular. Si bien los detalles del transporte de ácidos grasos dentro de la célula muscular son desconocidos en gran medida, generalmente se acepta que una o más proteínas asociadas a la membrana están involucradas (22, 99, 129). En los adipositos se identificaron proteínas transportadoras como TAG y PTAG con propiedades estimulantes del transporte de ácidos grasos (60). Recientemente, también se identificaron en el músculo esquelético proteínas de unión con AG (PUAG) (22), TAG (2, 45) y PTAG.
Junto con el transporte mediado por proteínas, parte de los ácidos grasos pasaran pasivamente las membranas celulares debido a la naturaleza lipofílica de los mismos (45, 126).
El paso inicial en el consumo de ácidos grasos del plasma podría ser un desplazamiento a través de la membrana luminar de la célula endotelial, el compartimiento citoplasmático de la célula endotelial, y subsecuentemente a través de la membrana albuminal de la célula endotelial (Figura 4). Luego, los ácidos grasos tienen que ser transportados a través del espacio intersticial, mas probablemente unidos a la albúmina (125). Allí los ácidos grasos serán trasportados a través del sarcolema, tanto por difusión pasiva como facilitado por la membrana plasmática ligada a PUAG (125), o como se sugirió recientemente, por proteínas en la membrana: TAG y PTAG (45, 129). En el citoplasma, los ácidos grasos están ligados a la PUAG citoplasmática (PUAGc), y el transporte de los mismos dentro del citoplasma ocurre ligado a esta proteína (45, 46, 129). Vork et al (130) reportaron una correlación positiva significativa entre el porcentaje de contenido de PUAG del músculo y el porcentaje de fibras oxidativas en el músculo esquelético, sugiriendo que las PUAG desempeñan un rol importante en la tasa de oxidación de ácidos grasos.
Si bien el mecanismo de transporte de ácidos grasos dentro de la célula se desconoce en gran medida, la existencia del transporte mediado por un transportador podría explicar los descubrimientos de Turcotte et al (124) y Kiens et al (77). En el músculo esquelético aislado de ratas perfundido (124), y también en el hombre (77), se observó que el consumo de ácidos grasos no unidos a proteínas por el músculo siguió una cinética de saturación y no se incrementó linealmente con las concentraciones incrementadas de ácidos grasos en la sangre como generalmente se creyó. Por encima de cierta concentración de ácidos grasos, se produce la saturación del proceso de transporte, lo cual podría indicar una limitación en el transporte a través de la membrana celular aunque no se pueden excluir las limitaciones distantes del consumo de ácidos grasos (e.g., oxidación). Los datos que implican la cinética de saturación del consumo de ácidos grasos son derivados de gráficos de consumo de ácidos grasos versus la fracción distribuida de ácidos grasos no unidos a proteínas (51, 77, 112, 118, 124). Recientemente se sugirió que si bien la fracción mas grande de ácidos grasos en plasma (99.9 %) es trasportada unida a la albúmina, el consumo de ácidos grasos puede depender de la pequeña fracción de ácido graso no ligado a las proteínas en el plasma (0.1 % del “pool” total de ácidos grasos en plasma) (77, 124).
Disponibilidad de ácidos grasos en plasma
Debido a que las grasas son almacenadas principalmente fuera del músculo en el tejido adiposo, la disponibilidad de ácidos grasos del sustrato depende de la lipólisis en el tejido adiposo, el transporte a través de la sangre, y el consumo de ácidos grasos por el músculo. Sin embargo, la lipólisis en el músculo puede ser otro factor muy importante que determina la disponibilidad de ácidos grasos especialmente en humanos entrenados en resistencia. Durante los primero minutos de ejercicio la concentración de ácidos grasos en plasma decrece como resultado de una demora entre el consumo incrementado de ácidos grasos directamente luego del comienzo del ejercicio, y la estimulación de la lipólisis (23). Una vez que la lipólisis es completamente activada y la reesterificación es suprimida, la concentración de ácidos grasos en plasma se elevará (142). La concentración de ácidos grasos en plasma se incrementa progresivamente con la intensidad en incremento del ejercicio submáximo (48, 49, 92). A altas intensidades de ejercicio (> 80% VO2 máx), sin embargo, la disponibilidad de ácidos grasos puede ser limitada como resultado de una liberación disminuida de ácidos grasos (Tasa de aparición [TA] de ácidos grasos) desde el tejido adiposo (195).
Al cese del ejercicio la utilización de ácidos grasos es drásticamente reducida mientras que la actividad lipolítica será mantenida debido a la activación metabólica.
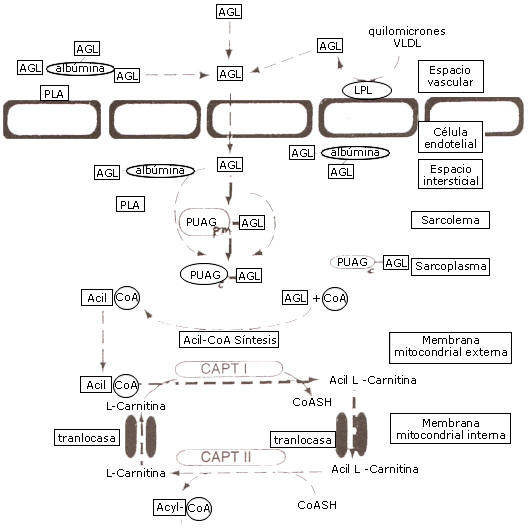
Figura 4. Transporte de ácidos grasos desde el espacio vascular en la
mitocondria de la célula muscular. Los ácidos grasos en plasma están unidos a la
albúmina, y luego del transporte en el espacio intersticial otra vez se unen a
la albúmina. Los ácidos grasos cruzan el sarcolema por una membrana plasmática,
ligados a la proteína de unión de ácidos grasos (PUAGpm), y en el sarcolema
serán ligadas a una proteína unión de ácidos grasos citoplasmática (PUAGc).
Subsecuentemente, los ácidos grasos serán activados por la acil-CoA-sintetasa
para formar un acil-CoA que puede ser transportado vía carnitin-palmitoil
transferasa I (CPT I), una translocasa y carnitin-palmitoil transferasa II (CPt
II) en la matriz mitocondrial. Ese transporte dentro de la mitocondria es
carnitina-dependiente. Las unidades de Acil-CoA dentro de la matriz mitocondrial
pueden estar sujetas a una descomposición enzimática en la beta-oxidación.
Como resultado se incrementaran los niveles de ácidos grasos en la sangre en el periodo post-ejercicio (92). Luego de 10-15 min se alcanza un pico de concentración de ácidos grasos, y las concentraciones declinaran otra vez a los niveles de reposo (0.2-0.5 mmol/L). Luego del ejercicio, y a veces aun durante el ejercicio, las concentraciones de ácidos grasos se pueden incrementar más de 2 mmol/L. Generalmente se presume que concentraciones de ácidos grasos por sobre los 2 mmol/L son tóxicas para los humanos (74, 92). Altas concentraciones de ácidos grasos post ejercicio también pueden ser consideradas en forma positiva, dado que estos rellenan los depósitos de TG en músculo (134). Hagenfeldt et al (57) demostraron que la oxidación de ácidos grasos depende en gran parte de la concentración de ácidos grasos en plasma. Sin embargo, la tasa de oxidación de ácidos grasos en el músculo en esfuerzo, no solo es determinada por la concentración de ácidos grasos en el plasma, sino también por factores tales como el numero y el tamaño de la mitocondria (ver parte II, los efectos del entrenamiento sobre la utilización de ácidos grasos en plasma), y probablemente también la presencia de otros sustratos como la glucosa, determinan la tasa a la cual los ácidos grasos pueden ser oxidados. Coyle et al (27) demostraron que la oxidación reducida a ácidos grasos de cadena larga durante el ejercicio en presencia de hiperglucemia e hiperinsulinemia fue, en parte, debido a la reducción en la disponibilidad de ácidos grasos en plasma, y en parte debido a otros factores situados dentro de la célula muscular. Horowitz et al (68) demostraron que la ingesta de glucosa pre-ejercicio resulto en una reducción de la oxidación de ácidos grasos. Este efecto fue causado en parte por una reducción en la lipólisis inducida por la insulina, y una reducción en la concentración de ácidos grasos plasmáticos. Sin embargo, cuando los niveles de ácidos grasos en plasma fueron restaurados al mismo nivel que durante la prueba de control (sin alimentación de glucosa pre-ejercicio), perfundiendo una emulsión de triacilglicéridos mas heparina, la oxidación de grasas fue solo parcialmente restaurada. Estos hallazgos indican que la concentración de ácidos grasos puede ser un factor importante pero no es el único factor de la oxidación de ácidos grasos plasmáticos.
En otro estudios se demostró que tasas mas altas de glucogenólisis y la subsecuente glucólisis lo cual conduce a mayores concentraciones de piruvato en músculo a altas intensidades de ejercicio (107, 114) están acompañadas por tasas mas bajas de oxidación. Aparte de una reducción de la tasa de oxidación de ácidos grasos por altas concentraciones de piruvato en músculo (a través de la PDH (ciclo glucosa-acido graso) o a través de la malonil CoA; ver discusión en parte II, también existen sugerencias de que altas tasas de oxidación de ácidos grasos solo pueden ser mantenidas en presencia de una mínima cantidad de intermediarios de ciclo TCA (TCAI) (107, 127, 128). En ausencia de carbohidratos, la oxidación de ácidos grasos es inhibida en el miembro inferior de la rata aislado y perfundido (103, 123). Se demostró claramente que la concentración de TCAi en el músculo esquelético se incrementa varias veces, rápidamente, luego del comienzo del ejercicio (107). La reacción alanina- aminotransferasa en el músculo (piruvato + glutamato <-> alanina + alfa - cetoglutarato) parece funcionar para lograr este incremento y mantener altas concentraciones de TCAi durante el ejercicio prolongado (107, 127, 128). El incremento en la concentración de piruvato en el músculo por lo tanto es la fuerza conductora para mover la reacción alanina-aminotransferasa (reacción de equilibrio) a la derecha hacia la síntesis de alfa-cetoglutarato y de otro TCAi. Sin embargo, no se puede mantener una tasa anaplerótica adecuada cuando el glucógeno muscular se depleta durante el ejercicio prolongado y las concentraciones de piruvato en músculo comienzan a caer. Esto implica que el máximo flujo del ciclo TCA ser reducido una vez que el glucógeno muscular se deplete y los ácidos grasos se hayan tornado en el sustrato principal. La oxidación de ácidos grasos se ve disminuida en ausencia de carbohidratos (103, 127). Esto puede explicar porque los atletas de resistencia durante la competencia tienen que reducir la intensidad de ejercicio hasta aproximadamente 59 % VO2máx cuando los depósitos de glucógeno llegan a depletarse, y los ácidos grasos pasaron a ser el combustible principal.
Captación de Ácidos Grasos por Parte de las Lipoproteínas Circulantes
Otra fuente potencial de ácidos grasos son los triacilglicéridos (triglicéridos) ligados a las lipoproteínas (VLDL y quilomicrones) (61). El endotelio muscular es virtualmente impermeable para las lipoproteínas circulantes. Antes que los ácidos grasos puedan ser captados por el músculo, estos tienen que ser liberados desde los triacilglicéridos formando el núcleo de las lipoproteínas (VLDL y quilomicrones). Solo luego de la hidrólisis de los compuestos TG-lipoproteínas por la acción de las lipoprotein-lipasa (LPL), los ácidos grasos pueden ser transportados dentro de la célula muscular. La LPL esta ubicada sobre la superficie luminar de la pared vascular (13) e hidrolizar alguno de los TG en las lipoproteínas que pasan a través del lecho capilar. La actividad de la LPL se encuentra en la mayoría, sino en todos, los tejidos. Las actividades mas altas se reportaron en el músculo cardiaco y en los esqueléticos (rojos), y en el tejido adiposo. La respuesta de la actividad de la LPL a ciertos estímulos (como ayuno o ejercicio) parece ser específica de cada tejido (81). Por ejemplo, durante el ayuno o el ejercicio la actividad de la LPL se incrementa en el corazón y músculo esqueléticos, mientras que al mismo tiempo la actividad de la LPL en el tejido adiposo se reduce (81).
Si hicieron intentos, utilizando balances arteriovenosos y TG marcados radioisotópicamente, para cuantificar la oxidación de TG en plasma. De la mayoría de los estudios, la contribución de los ácidos grasos derivados de los TG plasmáticos al metabolismo total de las grasas durante el ejercicio, parece ser muy pequeña (56, 61, 95, 96). Intentos por cuantificar la utilización de las VLDL-TG durante el ejercicio revelaron que el consumo de ácidos grasos de las lipoproteínas-triacilglicéridos plasmáticos ocurre lentamente (44), y da cuenta de menos del 5 % del CO2 derivado de los ácidos grasos durante el ejercicio prolongado (61, 72). Por lo tanto, generalmente se cree que los TG en el plasma contribuyen solo minimamente a la producción de energía durante el ejercicio (61, 72, 144). Sin embargo, existen algunas observaciones interesantes que necesitan investigación adicional. Por ejemplo, la actividad de la LPL se incrementa significativamente luego del entrenamiento (79), y luego de una dieta alta en grasas se incrementa marcadamente. Adicionalmente, el ejercicio agudo también estimula la actividad de la LPL en el músculo (121). Además, estudios en perros en ejercicio demostraron que la contribución de las VLDL-TG no es insignificante (122). Estos hallazgos combinados sugieren que los TG de las lipoproteínas plasmáticas pueden ser un combustible importante durante el ejercicio, aunque algunos intentos de medir la contribución de los TG en plasma, directamente, mostraron que éstos no son un combustible principal durante el ejercicio. Por lo tanto, la contribución de las VLDL-TG (y de los compuestos quilomicrones-TG) al gasto de energía sigue siendo incierta.
Triacilgliceroles en Músculo
Los triacilglicéridos en el músculo son almacenados en depósitos, generalmente adyacentes a la mitocondria (66) (Figura 5). El músculo esquelético contiene en promedio aproximadamente 12 mmol/kg ps de TG (14, 35, 52, 70, 109) pero esto puede variar marcadamente debido a factores tales como el tipo de fibra, la nutrición y el ejercicio físico. Estudios histológicos revelaron que las fibras de tipo I contienen más TG que las de tipo II en humanos. Las fibras de tipo IIb presentaron la menor concentración de TG intramuscular (35). Las fibras glucolíticas recurren menos a los TG como fuente de energía, y como consecuencia de ello, los “pools” de TG pueden ser menores en estas fibras. Como se discutirá mas adelante, a veces es difícil distinguir entre triacilglicérido intramuscular e intermuscular (e.g., Triacilglicérido de los adipositos que están intercalados entre las fibras musculares). Poco se sabe acerca del rol de los depósitos de triacilglicéridos intermusculares vs intramusculares. Sin embargo, el hecho de que los sujetos entrenados tienen más triacilglicéridos intramusculares y menos intermusculares (66), y en tanto oxidan más triacilglicéridos en el músculo (84), sugiere que los depósitos intramusculares de triacilglicéridos son los más importantes en términos de provisión de energía.
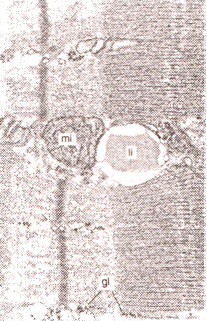
Figura 5. Imagen de Microcospía electrónica de una gotita de lípidos (li)
en proximidad cercana a la mitocondria (mi), en el músculo esquelético. También
son visibles los gránulos de glucógeno intramuscular (gl). Cortesía
micrográficas de: H Claasen, Intitute of Anatomy, Univerisity of Bem,
Switzerland.
Si bien el metabolismo de los triacilglicéridos en el tejido adiposo fue descrito a fondo con el correr de los años, nuestro conocimiento acerca de la regulación del metabolismo de los TG en el músculo es muy limitado. De manera sorprendente, ni siquiera la enzima responsable de la hidrólisis de TG ha sido identificada. En el músculo esquelético de ratas se descubrieron tres triglicérido-lipasas (TGLi) diferentes, cada una con distintas actividades a un pH de 5.0, 7.0 u 8.5. Estas lipasas son conocidas como ácidas, neutras o alcalinas, respectivamente. La lipasa alcalina se identificó como lipoproteín-lipasa (119). Se sugirió que esta TGLi alcalina (LPL) en el músculo sirve principalmente para catalizar la descomposición de ácidos grasos de los TG circulantes. La TGLi neutral, que probablemente este bajo control hormonal, e influenciada por el sistema adrenérgico, puede ser la enzima responsable la lipólisis intramuscular (52). Sin embargo, la información acerca de esta enzima en el músculo esquelético es escasa. La regulación de las lipasas intramusculares se estudio indirectamente. Cuando se perfundió norepinefrina, se observó una reducción significativa en el contenido de TGIM en humanos (40). Además, la estimulación de los receptores beta-adrenérgicos en el diafragma de ratas, con isoproterenol, incremento la lipólisis in vitro, y a su vez, este incremento fue parcialmente bloqueado por la adición de insulina al medio de incubación (3). Además, se descubrió que la administración de propanolol a ratas durante el nado evita la declinación de los triacilglicéridos en músculo, indicando que el bloqueo del beta-adrenoreceptor inhibe efectivamente la degradación intramuscular neutral de lípidos durante el ejercicio (116). En el corazón aislado y perfundido con epinefrina se demostró que se incrementó la liberación de glicerol (137). Además con la perfusión con dibutiril adenosina-monofosfato 3’5’ –cíclico (cAMP), los TG decrecieron en un 50 % en corazones de ratas perfundidas (42). Esto puede indicar que, como en el tejido adiposo la lipólisis cardiaca es mediada, al menos en parte, a través de la clásica cascada cAMP. Cleroux y cols. (25) demostraron que la lipólisis de triacilglicérido en el músculo esta medida por beta2-adrenoreceptores. En sujetos que realizan ejercicio prolongado hasta el agotamiento, la utilización de triacilglicéridos en el músculo estuvo completamente bloqueada por el nadolol, un bloqueador no selectivo, mientras que no cambió con atenolol, un bloqueador selectivo beta1-adrenoreceptor. Un respaldo indirecto para estas observaciones en el músculo esquelético proviene de estudios que demuestran que la lipólisis de triacilglicéridos en el músculo ocurre principalmente en las fibras lentas (115, 117), las que también tienen una densidad más alta de beta2-adrenoreceptores (136). Debido a que los resultados indican que la lipólisis extra-muscular decreció en un mismo grado con el bloqueo de beta1-adrenoreceptores o de beta beta2-adrenoreceptores se concluyó que la lipólisis en el tejido adiposo es solo parcialmente controlada por el sistema adrenérgico y principalmente a través de los beta1-adrenoreceptores, mientras que la ruptura del triacilglicérido en el músculo esquelético parece ser controlada por el sistema adrenérgico a través de los beta-2adrenoreceptores (25). Sin embargo hasta el presente sigue sin estar completamente claro hasta que grado los beta1, beta2 y beta3-adrenoreceptores están involucrados en la lipólisis del músculo esquelético. También existe evidencia de que la lipólisis en el músculo y la degradación de TGIM puede estar influenciada por la estimulación directa del nervio ciático (115), o luego de la estimulación directa del músculo con electrodos (65), indicando que otros factores ajenos a la estimulación adrenérgica (e.g., mecanismos locales) pueden desempeñar un rol en la regulación de la lipólisis intramuscular. Gorski et al (52) hipotetizaron que el Ca2+ puede ser un posible candidato a ejercer un efecto de estimulación local sobre las TG-lipasas endógenas.
Los primeros estudios que utilizaban ácidos grasos marcados con 14C para cuantificar el reciclado (turnover) de ácidos grasos indicaron que durante el ejercicio se utilizaron los TG musculares (56, 61). Estos estudios revelaron que durante el ejercicio submáximo (60-120 min), los ácidos grasos en el plasma contribuyeron solo en un 50 % de la oxidación total de grasas, implicando que el residuo puede haber venido de otras fuentes, probablemente triacilglicéridos intramusculares. Con el microscopio electrónico, fueron estudiadas las vacuolas de grasa en el músculo, antes y después del ejercicio (94). El tamaño de las vacuolas fue mas pequeño luego del ejercicio sugiriendo realmente que los ácidos grasos fueron movilizados desde las vacuolas, y subsiguientemente oxidados (94). Estudios que utilizaron biopsias musculares indicaron que el contenido de TG en músculo decrece durante el ejercicio (14, 36, 39, 100). Sin embargo, otros estudios no fueron capaces de encontrar diferencias entre el contenido de TG pre y post-ejercicio, en biopsias musculares (48, 75). Parte de los resultados inconsistentes pueden ser explicados por la técnica de biopsia muscular aplicada. La biopsia muscular (usualmente 50-150 mg de peso seco [ps]), representa solo una pequeña parte del músculo entero, o no podría ser representativa de los depósitos de TG de todo el músculo. Los TG no son almacenados en forma homogénea a lo largo de los compartimentos del músculo, y como se ha mencionado antes, los diferentes tipos de fibras levemente diferente contenido de TG (109). Especialmente en biopsias de músculo humano, esto puede ser un problema del momento ya que las biopsias pre y post-ejercicio usualmente tienen una composición de fibras levemente diferente. Wending et al (135) demostraron recientemente que los TG medidos en repetidas biopsias musculares presentaron una gran variación resultante en coeficientes de variación de entre 20-26 %. Ellos sugirieron que solo pueden ser detectables los cambios en TGIM mayores al 24%. En adición a la utilización de triacilglicéridos musculares exactamente cuantificada, es de suma importancia que toda grasa circundante sea cuidadosamente disecada de las fibras musculares, antes de que el contenido de triacilglicéridos sea analizado. Si no se realiza esta disección, el contenido de triacilglicéridos medido podría ser la suma de los triglicéridos musculares y el de los adipositos ubicados entre las fibras musculares. Recientemente, fueron utilizadas técnicas de espectroscopia por resonancia magnética, para cuantificar las concentraciones intramusculares de triacilglicéridos “in vivo” (12). Estas técnicas pueden permitir mediciones mas precisas de concentraciones de triacilglicéridos intramusculares en el futuro. Boesch et al (12) reportaron un error del 6 % en sus métodos. Sin embargo, ellos también reportaron diferencias considerables entre sus individuos cuando se investigó el mismo músculo.
Se estimó que la contribución de los TG musculares al gasto total de energía durante el ejercicio (65 % VO2 máx) fue de 15-35 % (70, 75). Debería mencionarse, sin embargo, que esta contribución se calculó sustrayendo el consumo de ácidos grasos plasmáticos de la oxidación total de grasas, y la diferencia teóricamente refleja los TG musculares, los TG entre las fibras musculares y los TG en VLDL. En este estudio se asumió que la contribución de las VLDL-TG fue insignificante. Romijn et al (105) investigaron la contribución energética de distintos sustratos durante el ejercicio a tres intensidades diferentes de ejercicio. La contribución de los TG intramuscular fue del 7 %, 26 % y 8 % durante el ejercicio al 25 %, 65 % y 85 % VO2 máx, respectivamente (Figura 6). Esto sugiere que hay una óptima utilización de TG musculares en algún nivel entre el 25 % y el 85 % VO2 máx. Los atletas entrenados en resistencia recurren más a sus TGIM. Martin et al (84) demostraron que el entrenamiento incrementó la contribución de la utilización de TGIM al gasto total de energía. Esto será discutido en mas detalle en la parte II de esta revisión (sección: “el efecto del entrenamiento sobre la utilización de TGIM”).
En general se puede concluir que los TG musculares son utilizados durante el ejercicio submáximo, y estos son un sustrato importante para el músculo en contracción. Desafortunadamente, los problemas metodológicos hacen muy difícil la cuantificación de la utilización de triacilglicéridos musculares.
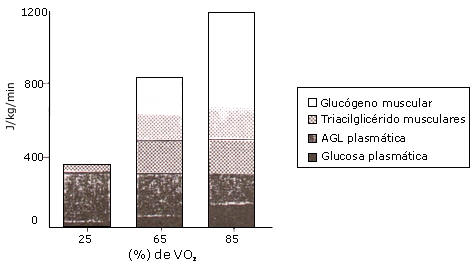
Figura 6. Utilización de sustratos a diferentes intensidades de ejercicio
(25 % VO2 máx, 65 % VO2 máx y 85 % VO2
máx). Datos adaptados de Romijn et al (105)
Transporte de ácidos grasos a través de la membrana mitocondrial
Una vez que los ácidos grasos entran al citoplasma de la célula muscular pueden ser tanto esterificados como almacenados en los TG intracelulares (28); o el ácido graso puede ser ligado a la PUAG para el trasporte al sitio de oxidación, y activado para convertirse en acil CoA graso por la enzima acil CoA sintetasa. La activación del ácido graso es un proceso extramitocondrial. La membrana mitocondrial interna es impermeable para el acil CoA (o ácido graso) de manera tal que se necesita un transportador para el desplazamiento del ácido graso activado a través de la membrana mitocondrial interna. Primero el éster acil CoA es convertido en acil-carnitina por la carnitin-acil-transferasa (CAT I) ubicada en la cara externa de la membrana mitocondrial interna y reconvertido en acil CoA graso en el lado de la matriz de la membrana mitocondrial interna por la enzima CAT II (Figura 4). La acil carnitina atraviesa la membrana interna en un intercambio 1:1 con una molécula libre de carnitina, un paso del transporte que es controlado por la proteína acil carnitin-translocasa (93, 126). Generalmente, se cree que los ácidos grasos de cadena media y corta pueden ser difundidos más libremente en la matriz mitocondrial, donde son convertidos en sus respectivos ésteres CoA. Sin embargo, al menos parte de estos ácidos grasos son transportados por proteínas transportadoras especificas acil CoA-transferasas de cadena corta o media (54, 106). Debido a que la malonil Coa, un intermediario de la biosíntesis de ácidos grasos, inhibe la CATI, se cree que este compuesto esta involucrado en la regulación de la utilización total de grasas (27, 85 - 87, 106, 138-140). El posible rol de la malonil CoA en la regulación de la oxidación de ácidos grasos será discutido en la parte II de esta revisión (sección: “regulación a través del malonil CoA”).
La importancia del sistema de transporte acil-carnitina a través de la membrana mitocondrial interna se torna obvia cuando se consideran las serias complicaciones observadas en los pacientes deficientes en carnitina (120). Estos pacientes esta imposibilitados reutilizar las grasas como combustible. En consecuencia, ellos recurren fuertemente a sus depósitos de glucógeno, los cuales se depletarán mas precozmente durante el ejercicio. Esto resulta en fatiga temprana y una reducción de la performance.
Existe evidencia indirecta preliminar que sugiere que el trasporte de ácidos grasos de cadena larga dependiente de la carnitina dentro de la mitocondria puede ser el paso tasa-limitante en el proceso de oxidación de ácidos grasos. Cuando se dan infusiones intravenosas de ácidos grasos de cadena larga (que depende del sistema de transporte de carnitina para atravesar la membrana mitocondrial interna), se encuentran menores tasas de oxidación, comparado con los ácidos grasos de cadena media los cuales son menos dependientes del sistema de transporte de carnitina (27, 89). Sin embargo, en el presente es incierto el grado en el cual el transporte de ácidos grasos dependiente de la carnitina dentro de la mitocondria es un factor tasa-limitante.
Oxidación de ácidos grasos
En la beta-oxidación, el acil-CoA graso es degradado en gran medida a acetil-CoA y un residuo de acil-CoA acortado en dos carbonos. Las unidades de acetil-CoA pueden entrar al Ciclo de los ácidos Tricarboxílicos (ciclo ATC) y seguir exactamente el mismo camino que las unidades de acetil-CoA desde el piruvato. El acil-CoA graso acortado actúa otra vez como un sustrato para el camino beta-oxidativo hasta que es completamente oxidado. La tasa a la cual los ácidos grasos son oxidados depende del tipo de ácidos grasos. Los acil grasos que son pobremente oxidados por la mitocondria (i.e., ácidos grasos de cadena muy larga) también pueden ser oxidados (126). Se demostró que tanto el número de átomos de carbono como el grado de saturación influyen en la tasa de oxidación. Se sabe que los ácidos grasos de cadena media (AGCM) son oxidados mas rápida y completamente que los ácidos grasos de cadena larga (AGCL) (6). Jones et al (78) estudiaron las tasas de oxidación corporal total de ácidos grasos con longitud de cadena similar (C18), pero con diferentes grados de saturación. Se observaron diferencias remarcables en las tasas de oxidación; el ácido oleico (C18:1 n-9) se oxidó mas rápido que el ácido linoleico (C18:2 n-6), el que en cambio se oxidó mas rápido que el ácido esteárico (C18:0). Estudios in vivo llevados a cabo con ratas (82) demostraron que las tasas de oxidación de los ácidos grasos decrecieron con el incremento de la longitud de cadena (C12:0 > C14:0 > C16:0 > C18:0). Hubo diferencias considerables en las tasas de oxidación de diferentes ácidos grasos insaturados (C18:3 n-3 > C18:1 n-3 > C18:3 n-6 > C22:6 n-3 > C20:4 n-6). El ácido oleico (C18:1) se oxidó a una tasa considerablemente alta, casi tan rápido como el ácido lúrico (C12:0). De los ácidos grasos n-6 el ácido linoleico (C18:2 n-6) se oxidó a una tasa mas rápida que cualquiera de estos metabolitos, siendo el ácido araquidónico (C20:4 n-6) el que oxidó a la tasa mas baja. La tasa de oxidación del ácido alfa-linoleico (C18:3 n-3) fue casi tan rápida como la de los ácidos lúrico (C12:0) y oleico (C18:1 n-9). En cultivos de hepatocitos incubados, las tasas de captación de ácidos grasos y formación de cuerpos cetónicos fueron del orden de C16:1 > C16:0 > C18:2 > C18:1 > C18:0 (34). Hagenfeldt y Wahren (56) también observaron una leve extracción preferencial de los ácidos linoleico (C18:2 n-6) y oleico (C18:1), comparados con el ácido palmítico (C16:0) a través del antebrazo. De estos estudios se desprende el hecho de que parece que los ácidos grasos saturados e insaturados se oxidan a tasas diferentes.
Otros Metabolismos de las Grasas
Otros componentes relacionados con las grasas como el glicerol y los cuerpos cetónicos también pueden servir como combustibles durante el ejercicio. El glicerol es liberado luego de la hidrólisis de TG y es transportado al espacio vascular. Vía sangre, el glicerol es transportado hacia el hígado donde puede servir como precursor glucogénico de la glucosa. Sin embargo, estudios con administración de glicerol demostraron que la tasa de conversión de glicerol a glucosa fue inadecuada para contribuir significativamente al gasto de energía durante el ejercicio (90, 91).
Los cuerpos cetónicos (acetoacetato y beta-hidroxibutarato) son productos de la oxidación incompleta de ácidos grasos. Bajo circunstancias normales, el hígado es el único órgano con aptitud para producir cuerpos cetónicos. Por otro lado, los cuerpos cetónicos pueden ser oxidados por la mayoría de los tejidos incluyendo el músculo esquelético. La concentración de cuerpos cetónicos en el plasma es usualmente muy baja (50-150 mmol/L), pero se puede incrementar marcadamente luego del ayuno o durante el ejercicio prolongado (14, 30, 31). Durante el ayuno la producción de cuerpos cetónicos es extremadamente importante dado que estos sirven como combustible alternativo a la glucosa en el cerebro. Normalmente hay bastante glucosa para proveer al cerebro de sustratos energéticos. Sin embargo, durante el ayuno la disponibilidad de glucosa esta marcadamente reducida y los cuerpos cetónicos pueden servir como un combustible alternativo en las células musculares. Con respecto a la provisión de energía durante el ejercicio, generalmente se cree que la contribución de los cuerpos cetónicos no es significativa (38, 92).
RESUMEN Y CONCLUSIONES
Los ácidos grasos son un combustible importante para el músculo en contracción. Luego de la lipólisis, los ácidos grasos del tejido adiposo tienen que ser transportados a través de la sangre hacia el músculo. Los ácidos grasos derivados de los TG circulantes también pueden ser utilizados como combustible pero se cree que son menos importantes durante el ejercicio. En el músculo los depósitos de TGIM también peden proveer ácidos grasos para oxidación, luego de la estimulación de la Lipasa Hormonosensible. En la célula muscular, los ácidos grasos serán transportados por proteínas trasportadoras (PTAG), y luego de la activación del acil-CoA graso tienen que atravesar la membrana mitocondrial a través del sistema carnitin-palmitoil-transferasa, luego de lo cual el acil-CoA será degradado a acetil-CoA para su oxidación.
En la parte II de esta revisión focalizaremos en la interacción entre los carbohidratos y metabolismo de las grasas, y en la regulación del metabolismo de ácidos grasos. También serán enfocados los efectos del entrenamiento.
En la parte III de esta revisión discutiremos los efectos de varias manipulaciones nutricionales.
RECONOCIMIENTO
Agradecemos la ayuda del Dr. Hans Hoppeler (Universidad de Berna, Suiza), quien proveyó la excelente microfotografía de la Figura 5.
Referencias
1. Abernethy Pj. Thayer R Tayler AW (1990). Acute and chronic responses of skeletal muscle to endurance and sprint exercise. Sports Med 10: 365-89
2. Abumrad NA. El-Maghrabi MR. Amri E-Z Lopez E. Grimaldi PA (1993). Cloning of a fat adipocyte membrane protein implicated in binding or transport of long-chain fatt acids that is induced during preadipocyte differentiation. I Biot Chem 268: 17665-8
3. Abrumad NA, Stearns SB, Tepperman I. (1978). Studies of serum lipids, insulin and glucogen and on muscle triglyceride in rat adapted to high-fat and high-carbohydrate diet. J Lipid Res 19 : 423-32
4. Armstong DT, Steele R. Altszulcer N Dunn A. Boshop JS. De Bodo RC (1961). Regulation of plasma free fatty acid turnover. Am J. Physiol, 201: 9-15
5. Arner P. Kriegholm E. Engfeidt P. Bolinder J (1990). Adrenergic regulation of lipolysis in situ at rest and during exercise. J. Clin Invest, 85: 893-8
6. Bach c, Babayan VK (1982). Meduim, Cham triglycerides: at update. Am J Clin Nutr 36: 950-62
7. Bassingthwaighte JB, Noodleman I. Van der Vusse G. Glatz JFC. (1989). Modeling of palmitate transport in the heart. Mol Cell Biochem 88: 51-8
8. Bergstrom J. Hermansen I. Hultman E. Saltin B (1967). Diet, muscle glycogen and physical perfonmance. Acta Phisiol Scand 71: 140-50
9. Bergstrom J. Hultman E (1966). Muscle glycogen synthesis after exercise: an enhancing factor localized in muscle cells in man. Nature 210: 309-10
10. Bjorkman O (1986). Fuel utilization during exercise. Biochemical aspects of physical execise. Amsterdam: Elseiver, 345-60
11. Bjorntorp P (1990). Adipose tisuue adaptation to exercise. Exercise, fitness and health. Champaing, Illinois: Human Kinetics books. 315-23
12. Boesch C. Slotboom J. Hopprlrt H. Kreis R (1997). in vivo determination of intra-myocellular lipids in human skeletal muscle by means if localized H-MR-spectroscopy. Magn Res Med 37: 84-93
13. Braun JFA. Severson DL (1992). Regulation of the synthesis, processing and translocation of lipoprotein lipase. Bioch J. 287: 337-47
14. Brouns F. Saris WHM, Beckers E. Adlercteutz H. Van der Vusse GJ Keizer HA, Kuipers H, Menheere P. Wagenmajers AJM, ten Hoor F (1989). Metabolic changes induced by sustained exhaustive cycling and diet manipulation. Int. J. Sports Med 10: 549-562
15. Bulow J (1982). Subcutaneous adipose tissue boold flow and triacylglycerol mobilization durin prolonged exercise in dogs. Pfluglers Atch 392: 230-4
16. Bulow J (1983). Adipose tissue blood flow during exercise. Dan Med Bull 30: 85-100
17. Bulow J (1987). Regulation of lipid mobilization in exercise. Can J Sport Sci 117S- 119S
18. Bulow J. Madsen J (1976). Adipose tissue blood flow during heavy exercise. Pfluglers Arch 363: 231-4
19. Bulow J. Madsen J (1978). Adipose tissue blood flow during heavy exercise II. Pfluglers Arch 378: 41-5
20. Bulow J. Madsen J. Astrup A. Christensen NJ (1985). Vasoconstrictor effect oh high FFA/albumin ratios in adipose tissue in vivo. Acta Physiol Scand 125: 661-7
21. Bulow J. Simonsen I. Madsen J (1992). Effect of exercise and glucose ingestoin on adipose tissue metabolism. Integration of Medical and Sport Sciences. Basel: Karger, 329-5
22. Calles-Escandon I. Sweet I. Ljungqvist O. Hirshman MF (1996). The membrane associated 40 kD fatty acid binding, protein (Berk`s protein), a putative fatty acid transporter, is present in skeletal muscle. Life Sci 58: 19-28
23. Carlson LA, Pernow B (1961). Studies on blod lipids during exercise. II. The arterial plasma-free fatty acid concentration during and after exercise and its regulation. J. Lab Clin Med 58: 673-81
24. Christensen EH, Hansen O (1939). Arbeitsfahigkeit and Ernahrung. Scand Arch Physiol 81: 160-71
25. Cleroux J. Van Nguyen P. Taylor AW. Leenen FHH (1986). Effects of Beta1 vs. Beta1+Beta2-blockade on exercise endurance and muscle metabolism in humans. J Appl Physiol 66: 548-54
26. Coppack SW. Jensen MD. Miles JN (1994). in vivo regulation of lipolysis in humans. J. Lipid Res 35: 177-93
27. Coye EF. Jeukendrup AE. Wagenmakers AJM. Saris WHM (1997). Fatty acid oxidation of directly regulated by carbohydrate metabolism during exercise. Am J. Physiol 273: in press
28. Dagenais GR. Francredt RG, Zierler KL (1976). Free fatty acid oxidation by forearm musle in rest an evidence for an intramuscular lipid pool in the human forearm. J. Glin Invest 58 421-31
29. De Groot MJM. De jong Y. Coumans WA. Vn der Vusse GJ (1994). The hydrolysis of glycerol-3 phosphate into glycerol in cardiac tissue : possible consequences for the validity of glycerol release as a measure of lipolysis. Pflugers Arch 427: 96-101
30. Dohm GI., Beeker RT. Israel RG. Tapscott EB (1986). Metabolic responses after fasting. I Appl Physiol 61: 1363-68
31. Dohm GI. Tpscott EB. Barakat HA. Kasperek GJ (1983). Influence of fasting on glycogen depletion in rats during exercise. J Appl Physiel 55: 830-3
32. Edwards HT. Margaria R. Dill DB (1934). Metabolic rate, blood sugar and the utilization of carbohydrate. Am J. Physiol 108: 203-9
33. Elia M. Khan K. Calder G. Kmpad A (1993). Glycerol exchange across the human forearm assessed by a combination of tracer and arteriovenous exchange techniques. Clin Sci 84: 99-104
34. Emminson N. Aius L (1988). Fatty acid uptake and metabolism to ketone bpdies and tricyllycerol in rat and human hepatocyte cultures is dependent on chain length and degree of saturation. FEBS 236: 83-8
35. Essen B (1977). Intramuscular substrate utilization during prolonged exercise. Ann N Y Acad Sci. New York Academy of sciences. 30-44
36. Essen-Gustavsson B. Tesch PA (1990). Glycogen and triglyceride utilization in relation to muscle metabolic charasteristics in men performing heavy-resitance exercise. Eur J. Appl Phyiol 61: 5-10
37. Felig P. Wahten J (1975). Fuel homeostasis in exercise. New Eng J Med 20: 1078-1975
38. Froberg SO (1971). Effect of acute exercise on tissue lipids in rats. Metabolism 20: 714-20
39. Froberg SO. Hultman F. Nilsson LH (1975). Effect of noradrenaline on triglyceride and glycogen concentrations in liver and muscle trom man. Metabolism 24: 119-26
40. Galster AD. Clutler WE. Cryen PE. Collins JA (1981). Epinephrine plasma thresholds for lipolystic effects in man. J. Clin Invest 67: 1729-38
41. Gartner St. Valiouny GV (1972). Effects of epinephrine and 3´,5´-AMP on perfused fat hearts. Am J. Physiol 222: 1121-4
42. George JC. Jyoti D (1955). Histological features of the breast and leg muscles of bird and bat and their physiological and evolutionary significanse. 31-6
43. Glatz JFC. Van der Vusse GJ (1988). Lipid terminology: free fatty acid is ambiguous . TIBS 13: 167-77
44. Glatz JFC. Van der Vusse GJ (1996). Cellular fatty acid binding proteins: their fuction and physiological significance. Progress in Lipid Research. in press
45. Glatz JFC. Van der Vusse GJ. Veerkamp JH (1988). Fatty acid bonding proteins and their physiological significance. NIPS 3: 41-3
46. Gollnick PD (1985). Metabolism of substrates: energy substrate metabolism durin exercise and as modified bye training. Fed Proc 44: 353-7
47. Gollnick PD. Ianuzzo CD. Williams C. Hill TR (1969). Effect of prolonged severe exercise on the ultrastructure of human skeletal muscle. Int Z Angew Physiol 1969: 27: 257-65
48. Gollnick PD. Pernow B. Essen N. Jansson E. Saltin B (1981). Availability of glycogen and plasma FFA for substrate utilization in leg muscle of man during exercise. Clin Physiol 1: 27-42
49. Gollnick PD. Saltin B (1988). Fuel for muscular exercise. Exercise, nutrition and energy metabolism. New York: Macmillan Publishing Company. 71-88
50. Goresky CA. Daly DS. Mishkin S. Arias IM (1978). Uptake of labelled palmitate bye the intact liver: role of intracellular binding sites. Am J. Physiol 3: E542-E553
51. Gorsky J (1990). Muscle triglyceride metabolism during exercise. Can J. Physiol Pharmacol 70: 123-31
52. Green HJ. Houston ME. Thompson JA. Sutton JR. Gollnick PD (1979). Metabolic consequences of supramaximal leg work. J Appl Physiol 46: 249-55
53. Groot PHE, Hulsman WC (1973). The activation and oxidation of octanoate and palmitate by rat skeletal muscle mitochondria. Biochim Biophys Acta 316: 124-35
54. Guezeunec CY (1992). Role of lipids on endurance capacity in man. Int. J Sports Med 13: S114-S118
55. Hagenfeldt L. Wahren J (1963). Human forearm muscle metabolism during exercise II. Scand J. Clip Lab Invest 21: 263-76
56. Hagenfeldt L. Wahren J (1971). Metabolism of free fatty acids and ketone bodies in skeletal muscle. Muscle metabolism during exercise. II. New York: Plenum. 153-63
57. Hales CN. Luzio JP. Siddle K (1978). Hormonal control of adipose-tissue lipolysis. Binch Soc Symp. 97-135
58. Hargraves M. Kiens B. Richter EA (1991). Effect of increased plasma free fatty acid concentrations on muscle metabolism in exercising men. J. Appl Physiol 70: 194-201
59. Harmon CM. Abumrad NA (1993). Binding of sulfosuccinimidyl fatty acids to adipocyte membrane proteins: isolation and aminoterminal sequence of an 88-kD protein implicated in transport of long-chain fatty acids. J. Membr Biol 133: 43-7
60. Havel RJ. Pernow B. Jones NI (1967). Uptake and release of free fatty acids and other metabolites in the legs of exercising men. J. Appl Physiol 23: 90-9
61. Hodgetts V. CoppackSW, Frayn KN, Hockaday TDR (1991). Factors controlling fat mobilization from human subcuaneous adipose tissue during exercise. J. Appl Physiol 71: 445-51
62. Holloszy IO (1988). Utilization of fatty acids during exercise. Exercise Sport Sci Rev. Illinois: Hum Kin Publ. 319-27
63. Holloszy IO. Coyle EF (1984). Adaptations of skeletal muscle to endurance exercise and their metabolic consequences. J. Appl Physiol 56: 831-8
64. Hopp JE. Palmer WK (1990). Effect of electrical stimulation on intracellular triacylglycerol in isolated skeletal muscle. J. Appl Physiol 56: 831-8
65. Hoppeler H (1986). Exercise induced ultraestructural changes in skeletal muscle. Int Sports Med 7: 187-204
66. Hornstra G (1982). Dietary fats, prostanoids and arterial thrombosis. The Hague: Martinus Nijhoff publishers
67. Hultman E (1967). Physiological role of muscle glycogen in man with special reference to exercise. Circ Res 10:1-99 - 1 114
68. Hurley BF. Nemeth PM. Martin WH HI. Hagherg JM. Dalsky G.P. halloszy IO (1986). Muscle triglyceride utilization during exercise effect of training I. Appl Physiol 60: 562-7
69. Issekutz B. Bortz WM. Miller Ht. Paul P (1967). Turnover rate of plasma FTA in humans and in dogs. metabolism 1967: 16: 1004-9
70. Issekutz B. Miller HI. Paul P. Rodahl K (1964). Source of fat in exercising dogs. Am J. Physiol 207: 583-9
71. Issekut B. Shaw WA. Issekutz TB (1975). Effect of lactate on FFA and glycerol turnover in resting and execising dogs. Am J. Physiol 39: 349-53
72. Jansson L (1980). Diet and muscke netabolism in man. Acta Physiol Scand 487: 1-24
73. Jansson F. Kaiser I (1987). Substrate utilization and enzymes in skeletal muscle of extremely enduance trained men I. Appl Physiol 62: 999-1005
74. Jones PJH. Penchanz PB. Clandinin MT (1985). Whole body oxidation of dietary fatty acids : implications for energy utilization. Am J. Clin Nutt 42: 769-77
75. Kiens B. Essen-Gustavsson B. Christensen NJ. Saltin B (1993). Skeletal muscle substrate utilization during submaximal exercise in man effect of endurance training. J. Physiol 469: 459-78
76. Kiens B. Essen-Gustavsson B. Gad. P Lithel H (1987). Lipoprotein lipase activity and intramuscular triglyceride stores after longterm high-fat and high-carbohydrate diets in physically trained men . Clin Physiol 7: 1-9
77. Kiens B. Lithell H (1989). Lipoprotein metabolism influenced by training induced changes in human skeletal muscle. J. Clin Invest 83: 558-64
78. Krogh A Lindhard I (1920). The relative value of fat and carbohydrate as sources of muscular energy. Bioch J. 14: 290-363
79. Ladu MJ (1991). Regulation of lipoprotein lipase in muscle and adipose tissue durin exercise. J. Appl Physiol 71: 404-9
80. Leyton J. Drury PJ. Crawford MA (1987). Differential oxidation of saturated and unsaturated fatty acids in vivo in the rat. Br. J. Nuts 57: 383-93
81. Madsen J. Bulow J. Nielsen NE (1986). Inhibition of FFA mobilization by arterial free fatty acid concentration. Acta physiol Scand 127: 161-6
82. Martin Ill WH. Dalsky GP. Hurley BF. Matthews DE. Bier DM. Hagberg JM. Rogers MA. King DS Holloszy JO (1993). Effect of endurance training on plasma free fatty acid turnover and oxidation during exercise. Am J. Physiol 265: E708-E714
83. McGarry JD. Foster DW (1980). Regulation of hepatic fatty acid oxidation and ketone body production. Ann Rev Biochem 49: 395-430
84. McGarry JD. Mills SE. Longs CS. Foster DW (1983). Observations on the affinity for carnitine, and malonyl-CoA sensitivity of carnitine palmitoyl transferase I in animal and human tissues. Bioch J. 214: 21-8
85. McGarry JD. Stark MJ. Foster DW (1978). Hepatic Malonyl-CoA levels of led., fasted and diabetic rats as measuren using simple radioisotopic assy. J. Biol Chem 253: 8291-3
86. McGilvery (1975). The use of fuels for muscular work. Metabolic adaptation to prolonged physical exercise. Basel: Birkhauser Verlag 12-30
87. Metges CC. Wolfgram G (1991). Medium-and long- chain triglycerides labelled with FC. A compatison of oxidation after oral or pareteral administration in humans. J. Nutr 121: 31-6
88. Miller WC. Bryce R. Conlee RK (1984). Adaptation to highfat diet that increase exercise endurance in male rats. J. Appl Physiol 56: 78-83
89. Murray R. Eddy DF., Paul GL Seifert JG. Halaby GA (1991). Physiological responses to glycerol ingestion during exercise. J. Appl Physiol 71: 144-9
90. Newshotme EA. Leech AR (1990). Biochemistry for the medical sciences Chichester. John Wiley & Sons
91. Numa S (1984). Fatty acid metabolism and its regulation. Amsterdam Elseiver
92. Oberholzer F. Claasen B. Moesch H. Howald H (1976). Ultrastructurelle. Biochemische and energetische Analyse einer extremen Dauerleistung (100 km Lauf) Schweiz Z. Sportmed 24: 71-98
93. Olsson AG. Eklund P. Kaiser I. Carlson I.A (1975). Extraction of endogenous plasma triglycerides by the working human forearm muscle in the fasting state. Scand J. Clin Lab Invest 35: 231-6
94. Oscai LB. Essing DA. Palmer WK (1990). Lipase regulation of muscle triglyceride hydrolysis. J. Appl Physiol 69: 1571-9
95. Paul P (1975). Effects of long fasting physical exercise and training on lipid metabolism. Metabolic adaptation to prolonged physical exercise. Basel: Birkhauser Ver Lag. 156-93
96. Pearce IJ. Conneh RJ (1980). Effect of lactate and palmitate on substrate utilization of isolated fat soleous. Am J. Physiol 238: C149-59
97. Potter BJ. Sorrentino D. Berk PD (1989). Mechanisms of cellular uptake of free fatty acids. Ann Rev Nutr. 9: 253-70
98. Reitman J. Baldwin KM. Holloszy JO (1973). Intramuscular trygliceryd utilisation by red, withe and intermediate skeletal muscle and hearth during exhaustive exercise. Proc. Soc. Exp. Biol. Med. 142: 628-34
99. Richieri GV,Anel A, Kleinfeld A. M (1993). Interctions of long-chain fatty acids and albumin: determination of free fatty acid levels using the fluorescent probe (ADIFAB). Biochemistry 32: 7574-81
100. Richieri GV, kleinfeld A. M (1995). Unbound acid levelsin human serum. J. I. Lipid Res 36: 229-4
101. Richter E. A (1992). Interaction of fuels in muscle metabolism during exercise. In: Y. Sato et al. (eds). Integration of medical and Sport Sciences. Baset, Karger 349-55
102. Robinson J. Newsbolme F. A (1967). Glyserol kinase activity in rat heart and adipose tissue. Bioch 104: 2C-4C.
103. Romijn J. A. Coyle EF., Sidossis T. S. Gastaldelli A. Horowitz JE, Endert E., Wolfe RR (1993). Regulation of endogenous fat and carbohydrate metabolism in relation to exercise intensity. Am J Physiol 265: E380-E391
104. Saggerson ED, Carpenter CA (1981). Carnitine palmitoyltranferase and carnitine octanoytransferase activities in liver, Kidney cortex, adipocyte, lactating mammary gladn, skeletal muscle and heart. FFBS letter 129-32
105. Sablin K, Brobrg S (1990). Tricarboxylic acid cycle intermendiates in human muscle during prolonged exercise. Am J Physiol 259: C834- C841
106. Saltin B. Astrand P. Q (1993). Free fatty acids and exercise. Am J Clin Nutr 57: 752S 758S
107. Saltin B, Gollnick PD (1983). Skeletal muscle adaptability: significance for metabolism and performance. In: Handbook of physiology, Baltimore, Williams and Wilkins, 555-661
108. Schaffer JE. Lodish HF (1994). Expression cloning and characterization of a novel adipocyte long chain fatty acid transport protein. Cell 79:427 - 436
109. Shaw Was. Isseckutz TB., Isseckutz B (1975). Interrelationship of FFA and glycerol turnovers in resting and exercise dogs. J appl Physiol 39: 30-60
110. Sorrentino D. Stump D. Potter BJ., Robinson RB., White R, Kiang C. I., Berk PD (1988). Oleato uptake by cardiac myocytes is carrier mediated and involves a 40-kD plasma membrane fatty acid binding protein similar to that in liver, adipose tissue and gut. L Clin Invest 928-935
111. Spector AA (1975). Fatty acid binding to plasma albumin. J Lipid Res 16: 165-179
112. Spencer MK., Yan Z. Katz A (1991). Carbohydrate supplementation attenuatesIMP accumulation in human muscle during titanic stimulation. J Appl Physiol 261-C71 C76
113. Spriet Ll., Heigenhauser JF., Jones NL (1986). Endogenous triacylglycero utilization by rat skeletal muscle during titanic stimulation. J. Appl Physiol 60: 410-415
114. Stankiewicz Choroszucha B. Gorski J (1978). Effect of decreased availability of substrate on intramuscular triglyceride utilitation during exercise. Experientia 34: 357-358
115. Stankiewicz Choroszucha B. Gorski J (1978). Effect of decreased availability of substrate on intramuscular triglyceride utilization during exercise. Eur J. Appl Physiol 40: 27-35
116. Stremmel W, Strohmeyer G., Berk PD (1986). Hepatocellular uptake of oleate is energy dependent. Sodium Inked, and inhibited by an antibody to a hepatocyte plasma membrane fattyacid binding protein. Natl Acad Sci USA 83: 3584-8
117. Strohfeldt P., Heugel C (1984). Characterisation of triglyceridelipase activies in rat skeletal muscle. Biochem Biophys Res Commun 121: 87-94
118. Stumpf DA,Parker WD, Angelini C (1985). Carnitine deficiency organic acidemias, and reves syndrome. Neurology 35: 1041-1045
119. Terjung RL., Budohoski I. Nazar K. Kobryn A (1982). Kaciuba-Uscilko chylomicron triglyceride metabolism in resting and exercise dogs. J. Appl Physiol 52: 815-820.
120. Turcotte LP, Hespel Pj, Graham TE., Richter FA (1994). Impaires plasma FFA oxidation imposed by extreme CHO deficiency in contracting rat skeletal muscle. J Appl Physiol 77: 517-525
121. Turcotte LP, Kiens B, Richter EA (1991). Saturation kinetics of palmitate uptake in perfused skeletal muscle. FEBS 279:327-329
122. Van der Vusse GJ. Glatz JFC. Stam HCG. Reneman RS (1992). Fatty acid homeostasis in the noroxic and ischemic heart. Physiol Rev. 72: 881-940
123. Van der Vusse GJ., Reneman RS (1996). Lipid metabolism in muscle Handlbook of physiology section 12: Exercise: Regulation and integration of multiple systems. New York: Oxford Press. 952-994
124. Van Hall G (1996). Ammino acids. Ammonia and exercise in man. Maastricht: Maastricht University
125. Van Hall, Van der Vusse GJ. Soderlund K., Wagenmakers AJ (1995). Deamination of amino acids as a source for ammonia production in human skeletal muscle during prolonged exercise. J. Physiol 489: 251-261
126. Van Nieuwenhoven FA., Van der Vusse GJ. Glatz JFC (1996). Membrana associated and cytoplasmic fatty acid-inding proteins. Lipids 31: S223-S227
127. Vork MM. Glatz JFC. Surtel DAM, Knubben H, Van der Vusse JM, and G (1991). A sandwich enzyme linked inmunosorbent assay for th determination of rat heart fatty acid binding protein using the straptavidin-biotin system. application to tissue and effluesnt sample from normox rat heart perfusion. Biochim Biophys Acta 1075: 199-205
128. Wagenmakers AJM, Becker EJ. Brouns F, Kuipers H, Soeters PB, Van der Vusse GJ Saris WHM (1990). Carbohydrate supplementation glycogen depletion and amino acid metabolism during exercise. Am J. Physiol 260
129. Wagenmakers AJM, Coakley JH, Edwards HT (1990). Metabolism of branched chain amino acids metabolism during exercise. Clues from McArdles desease. Int J Sports Med 11: S101-S113
130. Wahrenberg H., EngfeldtP. Bolinder J. Arner P (1987). Acute adaptation in adrenergic ontrol of lipolysis during physical exercise in humans. Am J Physiol 253: E383-E390
131. Wending PS., Peters SJ, Heigenhayser GJF., Spriet LL (1996). Variability of triacyglycerol content in human skeletal muscle biopsy sample. J Appl Physiol 115-1155
132. William RS., Caron MG., Daniel K (1984). Skeletal muscle beta-adrenergic receptors: variations due to fiber type and training. Am J Physiol 246: E160-E167
133. Williamson JR (1964). Metabolic effects of epinephrine in the isolated, perfuses rat heart. L Biol Chem 239: 2721-2729
134. Winder WW. Arogyasami J. Barton RJ. Elayan Im. Vehrs PR (1989). Muscle malonyl-CoA decrease during exercise. J Appl Physiol 67: 2230-2233
135. Winder WW Aroguasami J. Elayan IM, Cartmill D (1990). Time course of exercise induces decline in manonyl-CoA in different muscle types. Am Physiol 259: E266-271
136. Winder WW., Cartmill D C., Hutber CA., Jones JP (1993). Effect of edrenomedullation on decline in muscle malonyl-Coa during exercise. J Appl Physiol 74: 2548-2551
137. Wolfe RR (1992). Radioactive and stable isotope tracers in biomedicine. New York: Wiley-Liss
138. Wolfe RR., Klein S., Carraro F. Weber J. M (1990). Role of triglyceride fatty acid cycle in controlling fat cycle in controlling fat metabolism in humans during and after exercise. Am Physiol 258: E382-E389
139. Wolfe RR, Peters Ej. , Klein S., Holland OB, Rosenblatt J., Gary H (1987). Effect of shortterm fasting on lipolytic responsiveness in normal and obese human subjets. Am J. Physiol 252: E189-E196
140. Young DR Shapira J., Forrest R., Adachi RR., Lim R., Pelligra R (1967). Model for evaluation of fatty acid metabolism during prolonged exercise. J Appl Physiol 23: 716-725
141. Zuntz. N (1996). Über die Rolle des Zuckers im thierischen Stoffwechsel. Arch Physiol 538-577
142. Zuntz. N (1901). Über die Bedeutung der verschiedenen Nährstoffe als Erzeuger der Muskelkraft. Pfluglers Arch 83: 557-571