Metabolismo del Combustible Hepático durante el Ejercicio
Universidad de Copenhague, Dinamarca.
Artículo publicado en el journal PubliCE, Volumen 0 del año 1995.
Publicado 14 de junio de 2004
Durante el ejercicio físico, el incremento de la liberación de glucosa desde el hígado es muy importante para la mantención de la homeostasis de la glucemia sanguínea, y por lo tanto evitar la hipoglicemia. En 1961, los científicos que utilizaron una técnica de dilución de isótopos con infusión de [U-14C] glucosa, demostraron en un sujeto humano, que el intercambio de glucosa que se produce en todo el cuerpo esta aumentado durante la actividad física (61).
El descenso específico de la glucemia durante la actividad física brinda una evidencia indirecta de que la producción hepática de glucosa fue acelerada de 3 a 6 veces, comparada con los valores de reposo, durante el trabajo muscular (61). Más tarde, mediciones de la excreción esplácnica de glucosa durante el ejercicio en humanos, tomadas con cateterización hepática arteriovenosa mostraron un aumento en la producción de glucosa durante el ejercicio de hasta de 20 umol/kg/min a tasas de consumo de O2 corporal total de 2.2-2.3 L O,/min (67). Aunque la técnica de cateterización, cuando se usa en humanos, no distingue entre la contribución de sustancias provenientes del hígado o del intestino, las mediciones de excreción de glucosa esplácnica brindan un buen indicador de la producción de glucosa desde el hígado, siempre y cuando los sujetos estén en un período post-prandial. El experimento de Rowell y cols. demostró que la producción hepática de glucosa durante el ejercicio en humanos aumentó 3 veces en relación a los valores de reposo. En varios estudios posteriores, la excreción hepática de glucosa se encontró aumentada de 2 a 3 veces, durante ejercicios de moderada intensidad, y de 7 a 10 veces durante ejercicios de miembros inferiores más intensos, tanto en humanos (1, 4, 8, 9, 12, 13, 17-19, 29, 31, 41, 43-45, 47-49, 53, 57, 72, 87, 88) como en otras especies (7376, 79, 80, 82, 90, 93, 94). Durante ejercicios en «steady state» en ratas, la tasa de glucosa reconvertida, y por lo tanto la excreción de glucosa hepática, está directamente relacionada a la intensidad de trabajo, tanto en animales entrenados (11) como en los no entrenados (73, 75). En concordancia con ello, en humanos en período post-absortivo, la elevación de la producción de glucosa esplácnica inducida por el ejercicio, está correlacionada con un incremento del trabajo (87) (Figura 3.1).
Resumiendo, los datos obtenidos de experimentos en humanos indican que la producción de glucosa esplácnica se eleva linealmente con la intensidad del ejercicio hasta 50-60 % VO2 máx., mientras que a altas cargas de trabajo la producción de glucosa se incrementa exponencialmente con intensidades relativas de ejercicio (% de VO2máx.), a pesar de un descenso gradual del flujo sanguíneo hépato -esplácnico (68).
Durante el ejercicio moderado (< 60 % VO2máx), el nivel de glicemia permanece relativamente constante, a pesar de una marcada elevación inducida por el ejercicio en el consumo periférico de glucosa por parte de los músculos que trabajan (47), y no se observa una importante caída de la glicemia, a menos que el ejercicio se prolongue por varias horas (1, 20). Esto indica que la elevación de la excreción de glucosa hepática inducida por el ejercicio equipara el incremento del consumo de glucosa por el músculo esquelético que trabaja, siempre y cuando suficientes reservas de glucógeno estén presentes en el hígado.
En contraste, si el ejercicio resulta más intenso (> 60 % VO2máx la glicemia se encuentra usualmente aumentada en humanos, indicando que la excreción de glucosa hepática, excede el consumo periférico de glucosa (13, 29, 43, 44, 47). Esto confirma la hipótesis de que existen otros mecanismos involucrados en la movilización de la glucosa desde el hígado durante el ejercicio, además de la regulación «feedback», que mantienen la euglicemia.
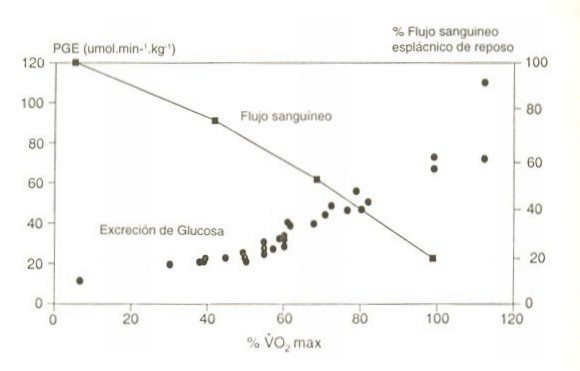
Figura 1. Producción hepática de glucosa (Excreción de glucosa esplácnica =
PGE) en reposo y durante el ejercicio, en relación a la intensidad relativa de
trabajo (% de VO2máx ). El valor basal es la media de los valores
obtenidos en 84 sujetos, y durante el ejercicio (en carrera y en ciclismo) cada
valor representa la media de 5-10 sujetos. Los datos son tomados de las
referencias 1, 4, 8, 9, 12, 13, 17-19, 29, 31, 41, 43-45, 47-49, 53, 57, 72, 87
y 88. La determinación de la excreción de glucosa esplácnica fue hecha usando ya
sea técnica de dilución isotópica con infusión de glucosa radio marcada, o
cateterización hepática artero-venosa con medición de la concentración de
glucosa arterial y venosa hepática y simultáneamente determinación del flujo
sanguíneo hépato-esplácnico.
Adicionalmente al rol de movilización de glucosa del hígado, compuestos de unión carbonados y nitrogenados son extraídos desde el torrente sanguíneo. Alguno de estos compuestos sirven como sustratos para la formación de glucosa vía gluconeogénesis, mientras que otros son metabolizados en urea, forman proteínas o causan aceleración de la cetogénesis. Aunque no todos los procesos fueron completamente estudiados, todos ellos probablemente se aceleren marcadamente durante la actividad física (15, 21, 71, 88, 89, 93).
EXCRECION HEPATICA DE GLUCOSA DURANTE EL EJERCICIO: GLUCOGENOLISIS Y GLUCONEOGENESIS
Con la transición desde reposo a ejercicio, aumenta la producción de glucosa hepática debido al incremento tanto de la glucogenólisis como de la gluconeogénesis. Durante ejercicios moderados e intensos de corta duración (menos de 30 minutos), el aumento en la excreción esplácnica de glucosa es causado casi enteramente por una glucogenólisis hepática acelerada (87, 88, 92). La contribución de la glucogenólisis está demostrada por una reducción del contenido hepático de glucógeno inducida por el ejercicio, tanto en ratas (76) como en humanos (33) (Figura 2). La contribución de la gluconeogénesis a la excreción hepática de glucosa durante los primeros 60 minutos de ejercicio liviano es solamente 5-15 %, tal como fue estimado del total de sustancias gluconeogénicas captadas en hígado en perros (92, 98). Sin embargo, cuando el ejercicio continúa por más de 60 minutos, la contribución relativa de la gluconeogénesis se incrementa al 20-25 % (92, 98). En humanos, la captación de precursores gluconeogénicos aumenta con la duración del ejercicio, totalizando hasta casi la mitad del total de la producción esplácnica de glucosa después de 4 horas de ejercicio (1). Otras evidencias del incremento de la gluconeogénesis durante el ejercicio son obtenidas por experimentos que encontraron que la actividad de las enzimas gluconeogénicos se eleva por el ejercicio (22). En conjunto, estos hallazgos indican que la contribución relativa de la glucogenólisis y de la gluconeogénesis en el hígado, es determinada tanto por la duración como por la intensidad del ejercicio, y que el rol de la gluconeogénesis crece con la duración y decrece con la intensidad de la actividad física.
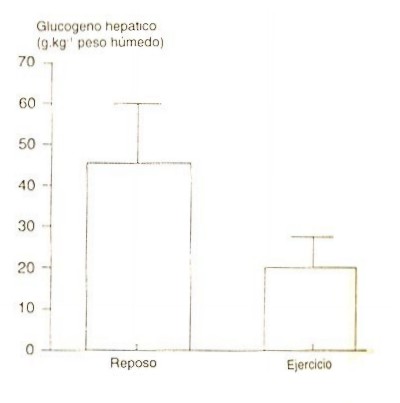
Figura 2. Catorce sujetos en ayuno desde la noche anterior cuya
concentración hepática de glucosa fue determinada por biopsia hepática, luego de
haber completado una hora de ejercicio intenso en bicicloergómetro. Las
concentraciones fueron significativamente bajas (p <0.001) comparadas con la
concentración de gluc6geno hepático determinada en 33 sujetos en reposo, en
periodo normal post-absortivo (post-ingesta) quienes fueron sometidos a biopsia
hepática a la misma hora del día que los sujetos en ejercicio. Datos tomados de
Hultman y Nilsson (33). Los valores son medias +/- ES.
El estado absortivo del organismo influye en la importancia relativa de la gluconeogénesis. En sujetos con un ayuno de 60 horas, casi todo el incremento en la excreción esplácnica de glucosa durante el ejercicio suave es debido al consumo de precursores gluconeogénicos (9). Debe notarse, sin embargo, que en sujetos que están en ayuno el consumo total de glucosa periférica está marcadamente disminuido en comparación con los sujetos control en período post-absortivo, indicando una disminución en el requerimiento total para la excreción de glucosa (9, 53). Además, se encontró en ese estudio, que el envío de precursores gluconeogénicos fue marcadamente incrementado por el ayuno comparado con el estado postabsortivo (9). En contraste, si los sujetos reciben glucosa o fructosa, antes o durante el ejercicio, se observa una disminución en el consumo esplácnico de precursores gluconeogénicos, lo que probablemente resulte en una reducida contribución de la gluconeogénesis (2, 3, 6). Sin embargo, en estos experimentos la ingesta de glucosa indujo cambios hormonales que favorecieron una reducción en la excreción hepática total de glucosa, lo que hace difícil sacar conclusiones con respecto al rol de la glucosa «per se» sobre la gluconeogénesis durante el ejercicio. Así, la relativa contribución de la gluconeogénesis al total de la excreción de glucosa desde el hígado durante el ejercicio, se incrementa en relación al tiempo transcurrido desde la última ingestión de carbohidratos, y esto es, al menos parcialmente, debido a una gradual reducción en el contenido de glucógeno hepático, al continuar el ejercicio (33).
El incremento de la gluconeogénesis hepática durante ejercicios prolongados es importante por la conversión del glicerol, del lactato y de aminoácidos en glucosa para demorar la deplección de glucógeno hepático y muscular; además la capacidad gluconeogénica se incrementa con el entrenamiento físico (34). En ratas, cuando la gluconeogénesis es bloqueada por la administración de ácido mercaptopicolínico, el tiempo de resistencia al ejercicio disminuye en aproximadamente un 30 %, tanto en animales entrenados como desentrenados (40). Esta inhibición de la gluconeogénesis resultó en un descenso del 20 % en la excreción hepática de glucosa y una marcada degradación de glucógeno hepático durante el ejercicio en ratas experimentales corriendo, comparados con controles falsos y tratados (77). En humanos, la captación de sustratos gluconeogénicos se redujo por una infusión de etanol, y ello resultó en una marcada reducción en la excreción hepática de glucosa después de 180 minutos de ejercicio suave (41). En contraste, si uno incrementa la excreción de precursores gluconeogénicos por entrenamiento con brazos en lugar de las piernas, a una carga absoluta de trabajo dada, la gluconeogénesis se incrementa más durante ejercicios de brazos comparados con ejercicios de piernas (5).
El contenido hepático de glucógeno, influye en la magnitud de la excreción de glucosa hepática durante el ejercicio. Esto se basa en hallazgos en ratas, en las cuales el nivel de glucógeno hepático aumentó o disminuyó por ingestión de fructosa o restricción de alimentos respectivamente (75, 76). Durante carrera en cinta se encontró una correlación entre el aumento en la excreción hepática de glucosa y los niveles de glucógeno hepático, indicando que la concentración hepática de glucógeno es un determinante importante de la glucogenólisis hepática y, por lo tanto, de la producción de glucosa (75, 76). Además, en ratas sometidas a carrera, las cuales fueron controles o ratas en ayunas y luego alimentadas, por lo cual se obtuvieron niveles supranormales de glucógeno hepático, la glucogenólisis hepática durante el ejercicio fue directamente proporcional al contenido hepático de glucógeno (82). En ratas entrenadas, probablemente también en hombres entrenados, el contenido hepático de glucógeno es mayor comparado con las contrapartes no entrenadas físicamente (27). De acuerdo con los hallazgos antes mencionados, la excreción hepática de glucosa durante el ejercicio fue mayor en ratas entrenadas que en las no entrenadas (11), y mayor en atletas entrenados en resistencia que en sujetos control sanos no entrenados, cuando ambos grupos fueron comparados a idénticas cargas de trabajo relativas (45). Por lo tanto, la actividad glucogenolítica, y por ende la movilización de glucosa desde el hígado durante el ejercicio, es dependiente del contenido de glucógeno hepático.
REGULACION «FEEDBACK» (RETROALIMENTACION NEGATIVA) DE LA EXCRECION HEPATICA DE GLUCOSA DURANTE EL EJERCICIO
Se ha argumentado que los mecanismos de «feedback» o retroalimentación negativa son muy importantes para una equiparación precisa de la excreción hepática de glucosa con el aumento de los requerimientos de glucosa por parte de los músculos en contracción. Se ha sugerido que el principal mecanismo regulador es un cambio del nivel de glicemia «per se», reflejando cambios en la necesidad de movilización de sustratos. Como soporte de lo anterior, una infusión de glucosa durante el ejercicio, para imitar el incremento de glucosa inducido por el ejercicio en la producción hepática de glucosa en experimentos con grupo control, resultó en un bloqueo de la producción endógena de glucosa durante ejercicios moderados (60 % VO2máx.) tanto en humanos (38, 39) como en ratas (79). El hecho de que la infusión de glucosa en estos experimentos produjo solo un cambio muy moderado en la glucemia (4-5 mg %) indica que la producción hepática de glucosa es muy sensible a las señales de retroalimentación o «feedback», y además, que las señales que contribuyen a un aumento en la producción hepática de glucosa inducida por el ejercicio puede ser inhibida por la infusión de glucosa. También en perros que corren, la infusión de glucosa reduce la producción endógena de glucosa, pero la producción hepática de glucosa puede no estar totalmente bloqueada, especialmente al comienzo del ejercicio (37). Esto indica que las señales de «feedback» están activas durante la contracción muscular, pero no son únicamente responsables del aumento de la movilización de glucosa inducida por el ejercicio. Otra evidencia que sugiere que las señales de «feedback» podrían no ser el único mecanismo responsable para un aumento en la producción hepática de glucosa durante el ejercicio, se encontró llevando a cabo experimentos en humanos con el mantenimiento constante de los niveles basales de insulina y glucagón en plasma. Se demostró que la producción esplácnica de glucosa aumentaba y luego alcanzaba una meseta («plateau») luego de aproximadamente 10 minutos de ejercicio suave, a pesar del hecho de que la glucemia experimentó un descenso continuo de 5 a 4 mmol/1-1 durante los 20 minutos del período ejercitado (48).
En ratas, se usó una infusión de «phlorizin» durante el ejercicio para provocar un incremento en la pérdida renal de glucosa, y por lo tanto incrementar el «clearance» de glucosa (80). En experimentos donde la infusión de «phlorozin» aumentó la pérdida de glucosa, pero no hubo descenso del nivel de glucemia respecto del valor de reposo, se observó un incremento compensatorio de la excreción esplácnica de glucosa en ratas durante ejercicio suave, en comparación con ratas control que corrieron con una infusión salina (80). Estos hallazgos indican que hay mecanismos de «feedback» metabólicos, no relacionados a la glucemia «per se» , que podrían también estar involucrados en la regulación de la producción hepática de glucosa durante ejercicios suaves.
La actividad de nervios aferentes provenientes de los músculos en contracción podría ser potencialmente importante para la producción hepática de glucosa. En gatos, la estimulación eléctrica de la terminal central de nervios musculares seccionados (n. femoral) produjo tanto un incremento de la glucemia como un aumento en la excreción hepática de glucosa (84 a). En humanos, sin embargo, reduciendo el «feedback» neural aferente por bloqueo sensorial lumbar epidural en forma parcial, no influye en la producción de glucosa en las piernas durante ejercicios de ciclismo (46). Aunque mecanismos reflejos neurales aferentes pueden producir aumentos en la movilización de glucosa durante el ejercicio, son probablemente secundarios a mecanismos regulatorios más importantes en humanos sanos. En pacientes, sin embargo, los mecanismos neurales de «feedback» podrían ser de gran importancia, si otras vías mecánicas están restringidas. En la deficiencia humana de Miofosforilasa (enfermedad de McArdle) con glucogenólisis muscular ausente, la movilización de combustible extramuscular durante el ejercicio (por ejemplo, excreción esplácnica de glucosa) está aumentada, comparado con los resultados obtenidos en sujetos de control sanos. Esta diferencia no puede ser explicada por señales de error sanguíneas, y por lo tanto, indica la importancia del «feedback» neural para el metabolismo que trabaja en el músculo esquelético en estos pacientes (84). Cuando a estos pacientes le fue infundida glucosa para imitar el aumento normal en la excreción esplácnica de glucosa observada en los sujetos control durante el ejercicio, la producción esplácnica endógena de glucosa fue abolida (84).
REGULACION «FEED-FORDWARD» (RETROALIMENTACION POSITIVA) DE LA EXCRECION HEPATICA DE GLUCOSA DURANTE EL EJERCICIO
Contradiciendo la hipótesis de «feedback» sobre la regulación de la producción hepática de glucosa durante el ejercicio, un estudio precoz encontró que la concentración plasmática de glucosa no solo no decreció, sino que aumentó durante el ejercicio intenso (60). Este hallazgo fue causado por un aumento en la producción hepática de glucosa inducido por el ejercicio, que excedió el incremento en el consumo periférico de glucosa, tanto en ratas corriendo (73), como en humanos con ejercicios de ciclismo o pedestrismo (13, 43-45, 47, 57). Esta disparidad entre la producción y el consumo periférico de glucosa es más pronunciada con el incremento de la intensidad de trabajo (19, 44, 47, 87), y más bien en etapas tempranas que tardías del ejercicio (45, 73). Esto indica que la movilización hepática de glucosa es un evento determinado, al menos en parte por actividad en centros motores del S.N.C (comando central), y que la producción de glucosa esta sujeta a regulación «feed-forward» más que a «feedback» (Figura 3).
En humanos, se llevaron a cabo experimentos en los cuales el comando central fue magnificado por bloqueo neuromuscular parcial (portubocurarina), lo cual demostró que el incremento inicial en la producción de glucosa fue mayor en los sujetos tratados con curare que en los sujetos control, aunque las cargas absolutas de trabajo (y el consumo periférico de glucosa) fueron idénticos en ambas situaciones (45) (Figura 4). Otro indicador de que la producción hepática de glucosa puede aumentar independientemente de las señales de «feedback», resultó de la infusión de glucosa a una tasa alta (dos veces la tasa de glucogenólisis hepática en un estudio control) que produjo un gran incremento de la glucemia, con un descenso de la degradación del glucógeno hepático de solo un 30-40 % en ratas en ejercicio (101). Más evidencia directa del rol de los mecanismos de «feed-forward» en la producción hepática de glucosa derivó de experimentos en ratas cuyos centros hipotalámicos fueron bloqueados o estimulados. Cuando el área ventromedial del hipotálamo (VMH) fue bloqueada con la infusión de un antagonista alfa adrenérgico, el incremento normal de la glucemia inducido por el ejercicio, en ratas durante la natación, fue bloqueado (69). Y cuando se realizó ablación anestésica bilateral de VMH en ratas, el incremento en la producción hepática de glucosa y de la glucemia durante la carrera fue atenuado, en comparación con los resultados en ratas control (83). Adicionalmente, cuando se realizó estimulación eléctrica de la región locomotora del hipotálamo posterior, en gatos decorticados y anestesiados, donde el «feedback» desde los músculos en contracción fue impedido por bloqueo neuromuscular y anestesia respectivamente, se encontró un incremento en la producción hepática de glucosa similar al visto durante ejercicios voluntarios (81). Estos resultados sustentan los hallazgos en estudios humanos de que la activación de centros motores en el cerebro, en paralelo con la activación de la locomoción, induce un incremento en la movilización de glucosa desde el hígado, ya sea directamente vía nervios o indirectamente vía cambios en las hormonas glucoreguladoras.
En individuos cuadriplégicos, cuyas piernas fueron eléctricamente estimuladas por computadora en ejercicios de ciclismo, el consumo periférico de glucosa aumento aproximadamente un 50 % y la glucemia descendió 0.7 mM. Durante el ejercicio, estos sujetos no tuvieron incremento en la producción hepática de glucosa por sobre los valores de reposo (52). Esto indica que cuando tanto el comando central como el «feedback» neural desde los músculos faltan durante el ejercicio, no se produce ningún cambio en la concentración de la glucosa plasmática, ni ninguna otra sepal producida en sangre desde los músculos en contracción son suficientes para causar un aumento en la producción hepática de glucosa (52). Un experimento similar con estimulación eléctrica fue llevado a cabo en sujetos sanos cuyos miembros inferiores fueron paralizados temporariamente con anestesia epidural. En esos sujetos fue posible producir ciclismo eléctricamente inducido a una tasa de consumo de oxígeno de 1.9 L/min (51). En acuerdo con los hallazgos en sujetos cuadriplégicos, la glucemia fue estable durante el ejercicio con las piernas en voluntarios control (no bloqueados) a un VO2 equiparado, mientras que la glucemia caía gradualmente cuando el ejercicio fue inducido eléctricamente en ausencia de comando central y el «feedback» neural periférico reducido (51). Esto indica que el comando central y/o el «feedback» neural son necesarios para un incremento suficiente inducido por el ejercicio en la producción hepática de glucosa en humanos.
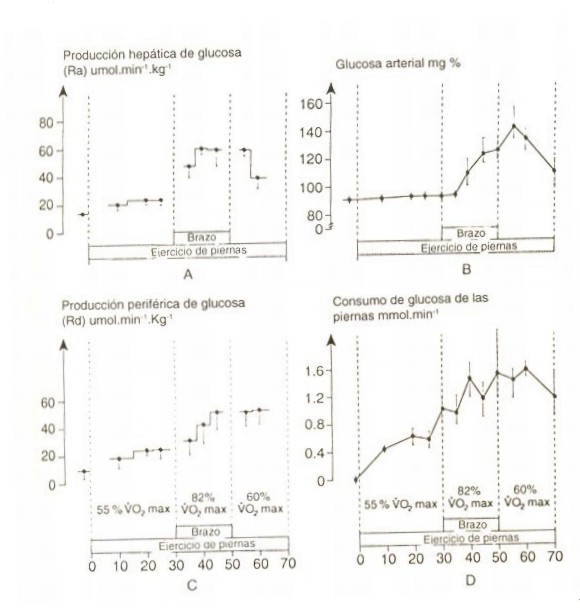
Figura 3. Concentraciones de glucosa en sangre, reconversión de glucosa de
todo el cuerpo determinada por una técnica de infusión con trazadores (3-3
H-glucosa) administrada a una tasa constante, y el consumo de glucosa en un
ejercicio de piernas determinado directamente por la glucemia, en arteria y vena
femoral, y determinación del flujo sanguíneo por técnica de termo-dilución. Esto
fue determinado en reposo y durante 70 minutos de ciclismo con piernas
solamente, o con piernas y brazos combinados, en 7 sujetos jóvenes sanos. Las
piernas fueron llevadas a idéntica carga de trabajo absoluta (155+/- 10 Watts,
media +/- ES) durante todo el estudio. El consumo de glucosa calculado para las
2 piernas en ejercicio mostró que las mismas daban cuenta del 82% del total del
consumo de glucosa para todo el cuerpo, durante un ejercicio de piernas
solamente. Durante ejercicios con piernas y brazos, el consumo de glucosa de las
piernas promedio el 68 % del total del consumo de glucosa de todo el cuerpo.
Durante ejercicios intensos la producción hepática de glucosa fue siempre
significativamente mas alta (p <0.05), comparada con el consumo periférico de
glucosa. Los valores son medias +/- ES. Las cargas relativas de trabajo son
tomadas como porcentaje del VO2max. durante ciclismo con piernas.
Reimpreso con permiso de Kjaer y cols. (1991).
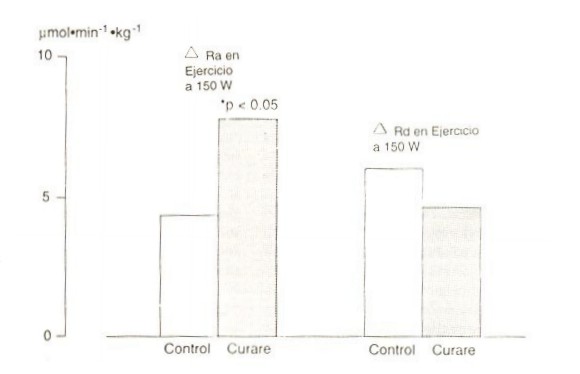
Figura 4. Reconversión de glucosa durante ciclismo al 56 % del VO2,
Ocho sujetos fueron estudiados con y sin bloqueo parcial neuromuscular (con
curare) pare variar la actividad motora central necesaria para una carga de
trabajo dada. Los valores son medias para los cambios en la producción hepática
de glucosa (Ra) y el consumo periférico de glucosa (Rd) durante los 5 minutos
iniciales del periodo de trabajo dado. *(p <0.05) denota diferencias entre
tratados con curare y sujetos control no tratados, así como los cambios
inducidos entre Re y Rd en los tratados con curare. Reimpreso con permiso de
Kjaer (1989).
Mientras que la producción hepática de glucosa parece ser sensible a inhibición por el incremento en la glucemia por encima de los niveles de reposo post-absortivos normales, la producción de glucosa aparentemente es relativamente insensible a descensos menores de la glucemia (48, 52). Además, existen hallazgos que indican la presencia de factores ligados al nivel de intensidad del ejercicio, y por lo tanto al nivel de actividad motora, establecen la magnitud de la producción de glucosa durante la actividad física (45, 81, 83). Sumado a ello, es posible que un factor no identificado producido por la contracción muscular pueda incrementar directamente la producción hepática de glucosa durante el ejercicio. En acuerdo con este hecho, durante el sueño, el cual esta asociado con inactividad muscular, una tasa metabólica y un consumo de glucosa reducidos, se encontró una caída en la producción hepática de glucosa que no pudo ser explicada por mecanismos glucoregulatorios conocidos (por ejemplo, hormonales) (16). En un intento por investigar esta cuestión, Hua y Mikines perfundieron recientemente músculos e hígado de ratas combinados en series. En esa preparación, sin la presencia de glándulas endócrinas, no pudieron identificarse sustancias liberadas desde el músculo en contracción que fueran responsables del incremento en la producción hepática de glucosa inducida por el ejercicio (Hue y Mikines, observación no publicada)
REGULACION HORMONAL Y NEURAL DE LA EXCRECION HEPATICA DE GLUCOSA DURANTE EL EJERCICIO
La regulación de la excreción hepática de glucosa durante el ejercicio, probablemente involucre una compleja interacción entre los mecanismos de control neurales y hormonales.
Hormonas Pancreáticas
Un factor hormonal esencial para el aumento de la producción hepática de glucosa durante el ejercicio es el descenso de la insulina plasmática (65). En perros en ejercicio, una caída rápida en el nivel de la insulina plasmática por infusión de manoheptulosa resultó en un repentino incremento en la producción hepática de glucosa (35). El rol aislado del descenso de la insulina durante el ejercicio fue estudiado evitando la caída normal de la insulina inducida por el ejercicio, ya sea por infusión intraportal de insulina, por infusión de glucosa para mantener la euglicemia, y por infusión de glucagón para obtener el normal incremento durante el ejercicio. En este experimento, la caída de insulina fue responsable del 50-60 % del aumento estimado en la producción hepática de glucosa inducida por el ejercicio (94). En el mismo experimento el efecto estimulatorio fue más pronunciado sobre 1 a glucogenólisis, mientras que la gluconeogénesis fue estimulada principalmente cuando se permitió caer a la glucosa y se hicieron presentes las respuestas hormonales contrarregulatorias (94). Esto parece 1ógico, ya que se sabe que las hormonas contrarregulatorias estimulan el envío de precursores gluconeogénicos.
Tanto en perros como en ovejas en ejercicio, la supresión de glucagón inducida por la somatostatina resultó en una reducción de la producción hepática de glucosa y en la consecuente caída de la glucemia (10, 36). Además, en ratas, el tratamiento con anticuerpos al glucagón resultó en una degradación hepática disminuida de glucógeno en respuesta al ejercicio (65). En perros en ejercicio, se demostró que cuando la secreción de insulina endógena y de glucagón se encuentran bloqueadas por la somatostatina, y se infunde glucagón e insulina en la vena porta, el incremento en la concentración de glucagón es el factor responsable principal del aumento en la glucogenólisis y la gluconeogénesis hepática durante la actividad muscular (90, 93). En aquel estudio, también fue demostrado que el efecto potenciador del aumento en el glucagón sobre la excreción hepática de glucosa durante el ejercicio fue aun más pronunciado cuando se acompañó de una caída de la insulina (93). Un factor que dificulta es que la falta de glucagón resulta en una caída de la glucosa y, por lo tanto, la activación de respuestas hormonales contrarregulatorias. Para superar este problema, la contra regulación fue prevenida infundiendo glucosa para mantener la euglicemia; se mostró entonces que el incremento durante el ejercicio inducido por el glucagón fue responsable de un 60 % de la excreción de glucosa (93). Aunque el glucagón podría ser un importante regulador de la excreción hepática de glucosa durante el ejercicio en los perros, en los humanos la concentración de glucagón no aumenta a menos que el ejercicio se prolongue más allá de una hora. Esto indica que un aumento en el glucagón no es de principal importancia en el aumento de la producción hepática de glucosa en el humano en las etapas tempranas del ejercicio, pero si podría ser de importancia secundaria en el ejercicio tardío, cuando la glucemia cae (26, 78).
En experimentos en humanos, donde la insulina y el glucagón plasmáticos
fueron mantenidos constantes, se obtuvieron resultados contradictorios del rol
de la insulina y el glucagón. En algunos estudios la producción de glucosa fue
abolida (30, 56), mientras que la mayoría de los estudios encontraron un
incremento (9, 31, 32, 48, 103). En un estudio en humanos se demostró que el
mayor efecto sobre la producción hepática de glucosa se obtuvo cuando, en forma
simultánea, hubo aumento del glucagón y descenso en la insulina plasmáticos,
indicando interacción entre ambas hormonas (56). Además, si una caída en la
insulina plasmática se previene durante el ejercicio en perros, el aumento en la
excreción hepática de glucosa, aunque disminuido, es más sensible a otros
estímulos (por ejemplo una caída de la glucemia). Este mecanismo compensatorio
involucra primariamente una aceleración de la gluconeogénesis, pero también de
la glucogenólisis (99). En perros, la proporción cociente entre glucagón e
insulina, probablemente muestre una fuerte correlación con el
aumento de la producción hepática de glucosa durante el ejercicio (86). A pesar
de la demostración de un rol tanto para la caída de la insulina, como para el
aumento en el glucagón en el plasma inducidos por el ejercicio, estos mecanismos
no pueden explicar totalmente la excreción hepática de glucosa aumentada durante
el ejercicio en humanos.
Actividad Simpatoadrenérgica
En experimentos en humanos, el incremento en la producción hepática de glucosa inducida por el ejercicio fue paralelo a un crecimiento de la epinefrina y la norepinefrina plasmáticas. Cuando el ejercicio era llevado a cabo en hipoxia, el incremento en la producción hepática de glucosa durante el ejercicio era más pronunciado si se lo compara con ese mismo ejercicio, a similar carga de trabajo, pero llevado a cabo en normoxia (18).
Este hecho fue acompañado por una mas pronunciada respuesta catecolamínica en la hipoxia, mientras que la respuesta de las hormonas pancreáticas fue idéntica en las dos condiciones experimentales (18). Además, en experimentos con el uso de ejercicios de piernas así como combinación de ejercicios de piernas y brazos, una correlación positiva fue hallada entre la concentración de catecolaminas plasmáticas y la producción hepática de glucosa (47). Estos hallazgos se compatibilizan, aunque no de manera concluyente, con la idea de que la actividad simpatoadrenérgica regula la excreción de glucosa desde el hígado, durante el ejercicio. Son conocidos los efectos tanto de la infusión de dosis fisiológicas de epinefrina como de la estimulación de nervios hepáticos que resultan en una excreción hepática de glucosa incrementada, en humanos y perros en reposo (28, 59). En las ratas, la remoción de la médula adrenal produce una glucogenólisis hepática reducida en respuesta a la natación (64), y en ratas adrenodemeduladas, el incremento en la producción hepática de glucosa inducida por el ejercicio en respuesta a la carrera en treadmill, fue menor en comparación con ratas con secreción intacta de epinefrina (74). Estos experimentos en ratas indican que la epinefrina es importante para el incremento en la excreción hepática de glucosa inducida por el ejercicio. Sin embargo algunos experimentos en ratas fueron incapaces de mostrar efectos de la epinefrina sobre la degradación hepática de glucógeno durante el ejercicio (7, 14, 55, 100). Las diferencias en las conclusiones de los estudios pueden ser debidas, ya sea al uso de diferentes protocolos incluyendo una larga variedad de intensidades, o al hecho de que la adrenodemedulación causó un incremento de la insulina plasmática desfavoreciendo la glucogenólisis hepática. Finalmente, es posible que el rol de la epinefrina sobre la degradación glucolítica sea principalmente sobre la glucogenólisis muscular, proveyendo así más precursores gluconeogénicos al hígado. Esto último está de acuerdo con los hallazgos de altos niveles de lactacidemia y una incrementada degradación glucolítica muscular en ratas con producción intacta de epinefrina, comparada con animales adrenodemedulados, durante el ejercicio (64). Además, en ratas ejercitando en ayuno que dependen muchísimo de la gluconeogénesis, el rol de la epinefrina parece ser más pronunciado, comparado con ratas que ejercitan en período post-absortivo (101). Experimentos en perros indican que aunque un incremento normal en la excreción hepática de glucosa se mantiene en perros adrenalectomizados, sustituidos con cortisol, la epinefrina puede jugar un rol menor en la excreción hepática de glucosa, en los ú1timos estadios durante ejercicios prolongados (58). Esto es compatible con la idea de que un rol de la epinefrina consiste en incrementar los niveles sanguíneos de precursores gluconeogénicos.
El rol de los nervios hepáticos fue estudiado en modelos animales. La denervación química y quirúrgica del hígado no disminuyó el incremento en la producción hepática de glucosa durante el ejercicio en ratas (63, 74). Además, en perros, el incremento inducido por el ejercicio en la glucogenólisis y en la gluconeogénesis no fue influenciado por la denervación quirúrgica del hígado (97). Estos hallazgos indican que los nervios hepáticos no son esenciales para el incremento en la excreción hepática de glucosa durante el ejercicio. Ya que en humanos la innervación simpática hepática es más abundante que en otros animales, por lo cual al comienzo del ejercicio la actividad nerviosa simpática hepática y la excreción hepática de glucosa aumentan más rápidamente que la producción del resto de las hormonas, es que los nervios hepáticos podrían ser importantes para la regulación de la producción hepática de glucosa durante el ejercicio en humanos. En un estudio en humanos, en el cual los cambios plasmáticos de insulina y glucagón fueron prevenidos, el aumento inducido por el ejercicio en la producción de glucosa fue disminuido si se agregaba bloqueo alfa y beta adrenérgico (32). Además, un incremento comparable en la producción de glucosa fue encontrado entre sujetos humanos adrenal entomizados quirúrgicamente y sujetos control (31). Esto proveyó evidencia indirecta para la conclusión de que los nervios simpáticos hepáticos más que la actividad adrenomedular secretoria, son importantes para el aumento en la producción hepática de glucosa inducida por el ejercicio. La importancia de los nervios hepáticos simpáticos fue, sin embargo, cuestionado por hallazgos en otros experimentos en los cuales bloqueadores alfa y beta adrenérgicos fueron incapaces de bloquear el aumento normal en la producción hepática de glucosa durante el ejercicio en humanos (56, 72). En estudios recientes, el rol de la actividad simpatoadrenérgica fue enfocado hacia sujetos sanos, quienes fueron sometidos a anestesia local del ganglio simpático celíaco que inerva al hígado, el páncreas y la médula adrenal. Los niveles de hormonas pancreáticas y de glucemia fueron mantenidos constantes durante el reposo, y durante el ejercicio a 40 y a 75 % de VO2máx., y los cambios normales inducidos por el ejercicio en los niveles periféricos de glucagón e insulina se aseguraron por infusión venosa de somatostatina y hormonas pancreáticas. Durante el bloqueo ganglionar celíaco, el incremento de epinefrina inducido por el ejercicio fue reducido entre 40-90 %, la glucemia descendió y la producción de glucosa aumentó al igual que en los experimentos control sin bloqueo (48). Este fue también el caso cuando la epinefrina fue infundida en dosis sustitutivas, mientras que la epinefrina provocó aumentos en la producción de glucosa durante el ejercicio, cuando fue infundida en dosis suprafisiológicas. Esto indica que aunque altas dosis de epinefrina pueden aumentar la excreción de glucosa en humanos en ejercicio, normalmente ni la epinefrina ni la actividad nerviosa simpática hepática son estímulos importantes (48). Otro soporte para la falta de importancia de los nervios hepáticos es obtenido por experimentos en pacientes trasplantados hepáticos. De acuerdo con hallazgos de estudios animales, el aumento en la producción de glucosa inducido por el ejercicio en pacientes trasplantados hepáticos, fue idéntico al de los sujetos sanos control, y a los pacientes trasplantados renales, quienes recibieron un tratamiento hormonal y de drogas inmunosupresoras similar a los pacientes trasplantados hepáticos (49) (Figura 5). Los pacientes trasplantados hepáticos fueron investigados aproximadamente ocho meses después de la cirugía, y no se encontraron signos de reinervación simpática en ninguno de los pacientes, a juzgar por el contenido de norepinefrina en las biopsias hepáticas (50). Estos hallazgos indican que los nervios simpáticos hepáticos no juegan un rol importante en el aumento de la producción de glucosa inducido por el ejercicio en el hombre.
Otros Factores
Se propuso que los nervios parasimpáticos del hígado influencian el metabolismo hepático durante el ejercicio, debido a que la denervación quirúrgica en ratas disminuía el aumento en el glucagón y la caída de la insulina inducidos por el ejercicio (54). Si la actividad vagal del hígado tiene alguna importancia funcional, ésta es probablemente indirecta, vía hormonas pancreáticas, No fue posible demostrar ningún efecto limitante de la vagotomía sobre ejercicios de resistencia (23), ni tampoco se encontró influencia sistemática de la vagotomía sobre el aumento de la degradación del glucógeno hepático inducido por el ejercicio (23, 54).
El cortisol y la hormona del crecimiento juegan un rol menor en la estimulación de la producción hepática de glucosa durante el ejercicio. En ratas durante carrera, se prolongo el tiempo de resistencia después de la injección de corticosterona, probablemente debido a la estimulación de enzimas gluconeogénicas y al aumento del suministro gluconeogénico al hígado, más que a la aceleración de la glucogenólisis hepática (70).
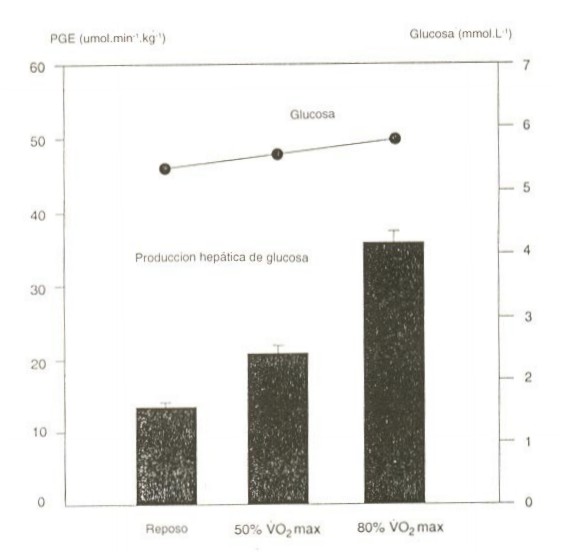
Figura 5. Producción hepática de glucosa (Producción esplácnica de glucosa =
PEG) en cuatro sujetos hepatotransplantados en período post-absortivo, durante
20 minutos de ejercicio en bicicleta al 50 % del consumo máximo de oxigeno (% VO2máx
y en 20 minutos al 80 % VO2 determinado con infusión de "3-3
H-glucosa". Las concentraciones de la glucemia fueron medidas en sangre
arterializada en una vena de la mano; se presentan los valores medios.
CONSUMO HEPATICO DE PRECURSORES GLUCONEOGENICOS DURANTE EL EJERCICIO
Metabolismo Aminoácido Hepático
Un incremento en la liberación de aminoácidos desde los músculos como resultado del aumento de la proteólisis durante el trabajo muscular, ha sido demostrado tanto con cateterización arterio-venosa (1, 21, 25) como con métodos de dilución isotópica (103). Estos aminoácidos proveen una fuente importante para la gluconeogénesis, y en humanos el consumo esplácnico de aminoácidos se incrementa durante el ejercicio (Figura 6), siendo más importante cuantitativamente el consumo de alanina que se incrementa en un 15-20 % durante ejercicios moderados (25). Este consumo aumentado es una consecuencia del incremento en la extracción fraccional esplácnica durante el ejercicio (1). Durante el ejercicio en humanos, solo el balance esplácnico pudo ser medido, pero el verdadero balance hepático fue determinado por punción de la vena porta en sujetos en reposo, sometidos a cirugía abdominal (25). Mediciones del gradiente arterio-portal de aminoácidos sustentan la idea de que la medición del balance esplácnico puede subestimar el verdadero consumo hepático de aminoácidos, ya que algunos aminoácidos son liberados desde el intestino durante el reposo (92). En acuerdo con esto, Wasserman y cols. (98), usando cateterización arterial, venosa hepática y portal demostraron que la aminoácido glutamina en perros durante la carrera fue captado por el hígado 5 o 6 veces más durante el ejercicio que en reposo, mientras que se observaba una transitoria liberación de glutamina desde el intestino durante el ejercicio. Esto apoya la hipótesis de que no solo la proteólisis muscular, sino también la proteólisis intestinal, contribuyen al suministro aumentado de aminoácidos para la gluconeogénesis hepática. Sumado a ello, una proteólisis aumentada dentro del mismo hígado puede también contribuir a la formación de aminoácidos (42).
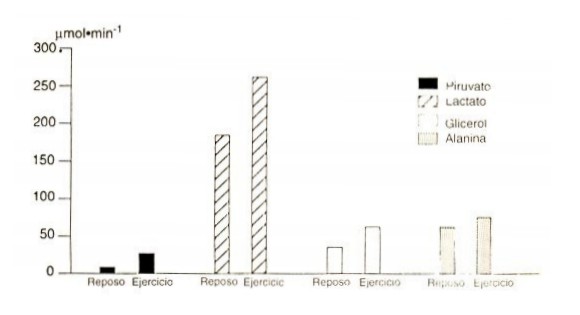
Figura 6. Intercambio esplácnico de sustratos gluconeogénicos en 8 sujetos
control sanos, en reposo y después de 40 minutos de ciclismo al 55-60 % VO2máx.
Los cálculos fueron realizados usando mediciones de la concentración de
sustratos en la arteria y vena hepática, y la estimación del flujo sanguíneo
hepático fue obtenida usando infusión continua de «indocyanine-green dye». Los
datos proceden de Wahren, Hagenfeldt, and Felig (88).
No está claro que factor regula la magnitud de los aminoácidos involucrados en la gluconeogénesis en humanos, pero un importante rol para el incremento en el glucagón inducido por el ejercicio fue recientemente demostrado en perros en ejercicio (93); y en humanos la cantidad de alanina captada por el hígado se correlacionó con la concentración venosa hepática de glucagón (71).
A pesar de la gran canalización de aminoácidos dentro de la gluconeogénesis, ya que los compuestos con carbonos son construidos en glucosa, es claro que los caminos del metabolismo nitrogenado (por ejemplo, formación de urea), también necesitan ser acelerados para prestar cuidado al exceso de nitrógeno formado por la degradación de aminoácidos, y absorber el amonio liberado por los músculos en esfuerzo (24). En perros, la formación de urea hepática esta aumentada 1,5-2 veces durante ejercicios moderados (98), y durante ejercicios extremos se hallaron niveles plasmáticos de urea marcadamente aumentados, lo que indica en forma indirecta un aumento en la producción (62). Sin embargo, durante ejercicios muy suaves (30 % VO2máx.) no fue posible detectar ningún aumento en el intercambio de urea de todo el cuerpo por el método de dilución isotópica (102). Esto indica que tanto la intensidad de ejercicio pudo ser demasiado baja, como que puede haber limitaciones en el método para detectar efectos inducidos por el ejercicio.
A pesar del hecho de que la mayoría de los estudios acuerdan con una aceleración de la formación de urea durante el ejercicio, el consumo de compuestos nitrogenados en el hígado durante el ejercicio es mayor al que puede ser explicado por el aumento en la formación de urea, por lo que deben existir caminos alternativos. Es de interés que fuera recientemente demostrado en un estudio que el ejercicio agudo resulta en incorporación de aminoácidos radio marcados infundidos por parte del hígado dentro de la formación de proteínas en fase aguda (fibrinógeno y fibronectina) (15).
LIPOLISIS ESPLACNICA Y CETOGENESIS
La lipólisis en el tejido adiposo esta marcadamente acelerada durante el trabajo muscular e importantes cantidades de glicerol y ácidos grasos libres (AGL) son liberados a la circulación. Tanto el consumo de glicerol, sirviendo como un precursor para la gluconeogésis, como de AGL, están incrementados durante el ejercicio (1, 88). El consumo de glicerol esta incrementado en dos veces durante ejercicios prolongados (Figura 6), y en sujetos sanos esto se explica más por su concentración plasmática arterial aumentada que por un aumento en su extracción fraccional (1, 89).
Durante el ejercicio la liberación de cuerpos cetónicos (acetoacetato y b-hidroxibutirato) desde el hígado está también acelerada y en correlación con el aumento de AGL suministrados al hígado (71, 87, 89). De hecho, cuando el aumento de AGL plasmáticos se previene por bloqueo del descenso en la insulina, no se encuentran aumentos en la excreción de sustancias cetogénicas desde el hígado durante el ejercicio (95). Ya fue demostrado en otros experimentos que la caída en la insulina inducida por el ejercicio; aumenta la cetogénesis por incremento de la extracción de AGL durante el ejercicio (96). Sumado a la caída de insulina, el aumento en el glucagón plasmático también influye en el aumento en la cetogénesis durante el ejercicio (96).
Adicional al aumento en el consumo hepático de AGL durante el ejercicio, los depósitos grasos intrahepáticos también podrían ser activados. Wahren y colaboradores encontraron que el ácido oleico radio marcado fue captado dentro del hígado, y liberado desde el hígado a una tasa aumentada durante el ejercicio, lo cual es compatible con la idea de que los depósitos grasos intrahepáticos fueron movilizados. Sin embargo, la cateterización de la vena hepática en ese experimento no excluyó la posibilidad de que la movilización actual de las grasas fuera derivada desde el intestino más que desde el hígado. En concordancia con esta idea, un aumento en la liberación intestinal y en el consumo hepático, respectivamente, de AGL fue encontrado durante el ejercicio en perros corriendo (95). La movilización de depósitos grasos esplácnicos (por ejemplo, intestinales) durante el ejercicio, se encuentra probablemente regulada por la actividad nerviosa simpática local. Esta teoría es sostenida por experimentos en humanos en los cuales los nervios simpáticos del área esplácnica fueron bloqueados por anestesia local del ganglio celíaco. En estos sujetos, la concentración de AGL y glicerol durante el ejercicio fue menor que en los experimentos control, sin bloqueo (48). Aún altas tasas de infusión de epinefrina durante el ejercicio no pudieron equiparar completamente esta diferencia. Además, la estimulación eléctrica de los nervios simpáticos del epiplón canino mostró provocar movilización de grasas (66), sosteniendo la hipótesis de que la actividad nerviosa simpática es responsable de la movilización de las grasas desde el área esplácnica, durante el ejercicio.
BALANCE HEPATICO DEL LACTATO
El lactato como producto final glucolítico en el músculo es uno de los principales precursores de la gluconeogénesis hepática durante el ejercicio; y en humanos, un pronunciado consumo de lactato esplácnico fue demostrado durante ejercicios prolongados (1, 88) (Figura 6). En perros durante carrera se determino un verdadero balance hepático de lactato, y Wasserman y cols. encontraron que, mientras al comienzo del ejercicio el lactato fue 1iberado desde el hígado como resultado de la glucogenólisis aumentada, cuando progresaba la duración del ejercicio, el hígado cambiaba a una posición de consumo de lactato (91). Esto ú1timo es debido al incremento en el envío de lactato, lo cual resulta en un aumento en el consumo de mismo, probablemente debido a un efecto de acción de masa, resultante en un incremento de la gluconeogénesis.
El aumento de la epinefrina en el plasma durante el ejercicio puede, como mencionamos antes, estimular indirectamente la gluconeogénesis hepática por incremento de la glucogenólisis muscular (73, 76). Cuando la epinefrina fue infundida a dosis fisiológicamente altas durante el ejercicio, las concentraciones de lactato en sangre aumentaron más que durante los experimentos control ante el mismo ejercicio, a pesar de un índice similar de consumo de glucosa periférico en ambas situaciones. Hay una pronunciada respuesta contrarregulatoria al final de ejercicios prolongados, por lo cual puede acelerarse la liberación de lactato desde el músculo y proveer sustratos para la gluconeogénesis aumentada, la cual es necesaria para la producción hepática de glucosa y así equiparar el consumo periférico de glucosa.
CONCLUSION
El rol del hígado como órgano metabólico durante el ejercicio primariamente involucra un aumento en la producción y movilización de glucosa dentro del flujo sanguíneo, pero también incluye aceleración de caminos químicos para el metabolismo de aminoácidos y grasas durante el trabajo muscular. La producción de glucosa hepática se incrementa en relación lineal con la intensidad del ejercicio. Durante ejercicios leves a moderados la excreción de glucosa se incrementa de dos a tres veces, y durante ejercicios intensos aumenta de siete a diez veces con respecto a los valores de reposo. La magnitud de la excreción hepática de glucosa durante el ejercicio es dependiente del contenido hepático de glucógeno, el cual varía con el grado de ayuno, la ingesta de comida previa al ejercicio, y el grado de entrenamiento del individuo. Durante el ejercicio, la producción de glucosa es derivada principalmente de la degradación de glucógeno hepático (glucogenólisis), y solamente una pequeña parte (10-20 %) es aportada por la gluconeogénesis. Con el incremento de la duración del ejercicio (varias horas) la contribución de la gluconeogénesis aumenta hasta el 50 % del total de la producción hepática de glucosa. Este aumento ocurre con una declinación paralela en el depósito hepático de glucosa y un incremento en el suministro de precursores gluconeogénicos al hígado.
Durante ejercicios suaves y prolongados, señales de «feedback» desde los músculos en contracción, mediadas tanto neuralmente como vía flujo sanguíneo, ajustan el estímulo para la producción de glucosa y mantener la euglicemia. Un incremento en la glucemia inhibe directamente la producción de glucosa durante el ejercicio, mientras que una caída de la glucemia, vía activación de las hormonas contrarregulatorias (por ejemplo glucagón) aumenta indirectamente la producción hepática de glucosa durante la actividad física. En contraste, durante el ejercicio intenso y al comienzo el ejercicio, mecanismos centrales acoplados al centro de actividad motora, inician una muy pronunciada respuesta hormonal (por ejemplo incremento de la epinefrina plasmática), las cuales son responsables de un incremento en la producción de glucosa que excede el consumo periférico de la misma, provocando un aumento del nivel de la glucemia durante ejercicios intensos.
Un descenso en el nivel plasmático de insulina es importante para el incremento en la producción hepática de glucosa durante el ejercicio, tanto en humanos como en otras especies. Sin embargo esto no puede explicar totalmente el incremento en la excreción hepática de glucosa, especialmente durante ejercicios suaves. Un aumento en el glucagón plasmático mostró ser importante en algunas especies; pero en humanos el glucagón aumenta solo durante ejercicios prolongados y, por lo tanto, no puede explicar incrementos precoces en la producción hepática de glucosa. La epinefrina puede explicar una pequeña parte del incremento en la producción de glucosa durante el ejercicio intenso, y puede convertirse en más importante después, en ejercicios prolongados por incrementar la liberación muscular, y por lo tanto la provisión hepática, de precursores gluconeogénicos. La inervación simpática hepática demostró carecer de rol alguno en la producción hepática de glucosa durante el ejercicio, tanto en humanos como en otras especies; la hormona del crecimiento y el cortisol solo contribuyen mínimamente al incremento de la excreción hepática de glucosa inducida por el ejercicio.
Los mecanismos hormonales pueden de hecho, explicar solo parcialmente la estimulación en la producción de glucosa en humanos durante el ejercicio. Otros factores, más que aquellos corrientemente identificados deben contribuir al incremento en la producción hepática de glucosa inducida por el ejercicio, en humanos.
El consumo hepático de aminoácidos está acelerado durante el ejercicio a partir de un suministro aumentado desde la proteólisis muscular e intestinal. Además, la actividad gluconeogénica aumentada, la formación de urea, y probablemente la formación de proteínas en fase aguda, son también intensificadas durante el ejercicio. Los depósitos esplácnicos de grasa pueden ser movilizados por la actividad nerviosa simpática durante el ejercicio, y ello probablemente refleje liberación de AGL y glicerol desde el intestino, los que son captados por el hígado acelerando no solo la gluconeogénesis, sino también incrementando la cetogénesis durante la actividad física.
Reconocimientos
Este trabajo fue sustentado por subsidies del CONCEJO DANES de INVESTIGACIONES MEDICAS (J.nr. SSF 12-9360), la FUNDACION NACIONAL de INVESTIGACION DANESA (J.nr 504-14), la FUNDACION NOVO, el CONCEJO DANES de IN VESTIGACIONES DEPORTIVAS y la FUNDACION P. CARL PETERSENS.
Referencias
1. Ahlborg, G.; Felig, P.; Hagenfeldt, L.; Hendler, R.; Wahren, J (1974). Substrate turnover during prolonged exercise in man. J. Clin. Invest. 53:1080-1090
2. Ahlborg, G.; Felig, P (1976). Influence of glucose ingestion on fuel hormone response during prolonged exercise. J. Appl. Physiol. 41:683-688
3. Ahlborg, G.; Felig, P (1977). Sustrate utilization during prolonged exercise preceded by ingestion of glucose. Am. J. Physiol. 233:13188-13194
4. Ahlborg, G.; Felig, P (1982). Lactate and glucose exchange across the forearm, legs, and splanchnic bed during and after prolonged exercise. J. Clin. Invest. 69:45-54
5. Ahlborg, G.; Wahren, J.; Felig, P (1986). Splanchnic and peripheral glucose and lactate metabolism during and after prolonged arm exercise. J. Clin. Invest. 77:690-699
6. Ahlborg, G.; Bjerkman, O (1990). Splanchnic and muscle fructose metabolism during and afterexercise. J. Appl. Physiol. 69:1244 1251
7. Arnall, D.A.; Marker, J.C.; Coulee, R.K.; Winder, W.W (1986). Effect of infusing epinephrine on liver and muscle glycogenolysis during exercise in rats. Am. Pyshiol. 250:13641-13649
8. Tockrnan, R.P (1979). Effect of somatostatin on plasma glucagon and insulin, and glucose turnover in exercising sheep. J. Appl. Physiol.47:273-278
9. Brooks, G.A.; Donovan, C.M (1983). Effect of endurance training on glucose kinetics during exercise. Am. J. Physiol. 244:E505 E512
10. Brooks, G.A.; Butterfield, G.E.; Wolfe R.R.; Groves, B.M.; Mazzeo, R.S.;Sutton, JR.; Wolfel, E.E.; Reeves, J.T (1991). Increased dependence on blood glucose after acclimatization to 4.300 m. J. Appl. Physiol. 70:919-927
11. Calles, J.; Cunningham, J.J.; Nelson, L.; Brown, N.; Nadel, E.; Sherwin,R.S; Felig, P (1983). Glucose turnover during recovery from intense exercise. Diabetes 32:734-738
12. Carlson, K.L.; Marker, J.C.; Arnall, D.A.; Terry, M.L.; Yang, H.T.; Lindsay, L.G.; Bracken, M.E.; Winder, W. W (1985). Epinephrine is unessential for stimulation of liver glycogenolysis during exercise. J. Appl. Physiol. 58:544-548
13. Carraro, F.; Hart], W.H.; Stuart, C.A.; Layman, D.K.; Jahoor, F.; Wolfe,R.R (1990). Whole body and plasma protein synthesis in exercise and recovery in human subjects. Am. J. Physiol. 258:13821-13831
14. Clore, J.N.; Nestler, J.E.; Blackard, W.G (1989). Sleep-associated fall inglucosedisposalandhepatic glucose Output innormalhumans: putative signaling mechanism linking peripheral and hepatic events. Diabetes 38:285-290
15. Coggan, A.R.; Kohrt, W.M.; Spina, R.J., Bier, D.M.; Hollowzy, J.0 (1990). Endurance training decreases plasrnaglucose turnoverand oxidate during moderate-intensity exercise in men. J. Appl. Physiol. 68:990-996
16. Cooper, D.M.; Wasserman, D.W.; Vranic, M.; Wasserman, K (1986). Glucose turnover in response to exercise during high-and low F102 breathing in man. Am. J. Physiol. 251:13209-132 t4
17. Cooper, D.M.; Barstow, T.J.; Bergner, A.; Lee, W.-N.P (1989). Blood glucose turnover during high- and low- intensity exercise. Am. J. Physiol. 257:13405-13412
18. Coyle, A.R.; Coggan, A.; Hemmert, M.; Ivy, J (1986). Muscle glycogen utilization during prolonged strenuous exercise when fed carbohydrate. J. Appl. Physiol. 61:165-172
19. Dohm, G.L.; Kasperek, G.J.; Topscott, E.B.; Beecher, G.R (1980). Effect of exercise on sinthesys and degradation of muscle protein. Bioehem. J. 188:255-262
20. Dohm, G.L.; Kasperek, G.J.; Barakat, H.A (1985). Time course of changes in gluconeogenic enzime activities during exercise and recovery. Am. J. Physiol. 249:136-EI l
21. Doiron, B.; Cardin, S.; Brisson, G.R.; Lavoie, J.M (1990). Effects of selective hepatic vagotomy on running endurance in rats. J. Appl. Physiol. 69:2197-2201
22. Eriksson,L.S.; Broberg,S.; Bj6rkman,0.; Wahren,J (1985). Ammonia metabolism during exercise in man. Clin. Physiol. 5:325-336
23. Felig,P.; Wahren,J (1971). Amino acid metabolism inexercising man. J. Clin. Invest. 50:2703-2714
24. Galbo, H.; Christensen, N.J.; Holst, J.J (1977). Glucose-induced decrease in glucagon and epinephrine responses to exercise in man. J. Appl. Physiol. 42: 525-530
25. Galbo, H.; Richter, E.A.; Holst, J.J.; Christensen, N.J (1977). Disminished hormonal responses to exercise in trained rats. J. Appl. Physiol. 43:953-958
26. Garceau, D.; Yamaguchi, N.; Guyer, R.; Guitard, F (1984). Correlation between endogenous noradrenaline and glucose released from the liver upon hepatic sympathetic nerve stimulation in anesthetized dogs. Can. J. Physiol. Pharmacol . 62:1086-1091
27. Hargreaves, M.; Proietto, J (1994). Glucose kinetics during exercise in trained men. Acta Physiol. Scand. 150:221-225
28. Hirsch, I.B.; Marker, J.C.; Smith, L.J.; Spina , R.J.; Holoszy, J.O.; Cryer, P.E (1991). Insulin and glucagon in prevention of hypoglycemia during exercise in humans. Am. J. Physiol. 260:E695-E704
29. Hoelzer,D.R.;Dalsky,G.P.;Clutter, W.E.;Shah , S.D.;Holloszy, J.O.; Cryer, P.E (1986). Glucoregulation duringexercise: Hypoglycemia is prevented by redundant glucoregulatory systems, sympathochromaffin activation, and changes in islet hormone secretion. J. Clin. Invest. 77:212-221
30. Hoelzer, D.R.; Dalsky, G.P.; Schwartz, N.S. ; Clutter, W.E.; Shah, S.D.; Holloszy, J.O.; Cryer, P.E (1986). Epinephrine is not critical to prevention of hypoglycemiaduring exercise in humans. Am. J. Physiol. 25I:E104-Et 10
31. Hultman, E.; Nilsson, L.H (1971). Liver glycogen in man . Effect of different diets and muscular exercise. Advan. Exp . Med. Biol. 11:143-151
32. Huston, R.L.; Weiser, P.C.; Dohm, G.L.; Askew, E.W.; Boyd, J.B (1975). Effects of training, exercise and diet on muscle glucolysis and liver gluconeogenesis. Life Sci. 17:369-376
33. Issekutz, B (1980). The role of hypoinsulinemia in exercise metabolism. Diabetes 29:629-635
34. Issekutz, B.; Vranic, M (1980). Role of glucagon in regulation of glucose production in exercising dogs. Am. J . Physiol. 238:E 13 E20
35. Issekutz, B (1981). Effects of glucose infusion on hepatic and muscle glycogenolysis in exercising dogs. Am. J. Physiol . 240:E451 E457
36. Jenkins, A.B.; Chisholm, D.J.; James, D.E.; Ho, KY.; Kraegen, E.W (1985). Exercise-induced hepatic glucose output is precisely sensitive to the rate of systemic glucose supply. Metabolism 34:431-441
37. enkins, A.B.; Furler, S.M.; Chisholm, D.J.; Kraegen, E.W (1986). Regulation of hepatic glucose output during exercise by circulating glucose and insulin in humans. Am. J . Physiol. 250:R41I-R417
38. John-Adler, H.B.; McAllister, R.M.; Terjung, R.L (1986). Reduced running endurance in gluconeogenesis-inhibited rats. Am. J. Physiol. 251: R 137-R 142
39. Juhlin-Dannfelt, A.; Ahlborg, G.; Hagenfeldt, L.; Jorfeldt, L.; Felig, P (1977). Influence of ethanol on splanchnic and skeletal muscle substrate turnover during prolonged exercise in man. Am. J. Physiol.233:E195-E202
40. Kasperek, G.J.; Dohm, G.L.; Barakat, H.A.; Straus- Bauch, P.H.; Burnes, D. W.; Snider, R.D (1982). The role of Iysosomes in exercise-induced protein loss. Biochem. J. 202:281- 288
41. Katz, A.; Broberg, S.; Sahlin, K.; W ahren, J (1986). Leg glucose uptake during maximal dynamic exercise in humans. Am. J. Physiol. 251:E65-E70
42. Kjaer, M.; Farrell, P.A.; Christensen, N.J.; Galbo, H (1986). Increased epinephrine response and inaccurate glucoregulation in exercising athletes. J. Appl. Physiol. 61:1693 -1700
43. Kjaer, M.; Secher, N.H.; Bach, F.W.; Galbo, H (1987). Role of motor center activity for hormonal changes and substrate mobilization in humans. Am. J. Physiol. 253:R687-R695
44. Kjaer, M.; Secher, N.H.; Bach, F.W.; Sheikh, S.; Galbo, H (1989). Hormonal and metabolic responses to exercise in humans: effect of sensory nervous blockade. Am. J. Physiol . 257:E95 E10
45. Kjaer, M.; Kiens, B.; Hargreaves, M.; Richter, E.A (1991). Influence of active muscle mass on glucose homeostasis during exercise in humans. J. Appl. Physiol. 71:552-557
46. Kjaer, M.; Engfred, K.; Fernandes, A.; Secher, N.H.; Galbo, H (1993). Regulation of hepatic glucose production during exercise in humans: role of sympatho-adrenergic activity. Am. J . Physiol. 265:E275-E283
47. Kjaer, M.; Engfred, K.; Galbo, H.; Sonne B.; Rasmussen, K.; Keiding, S (1994). Glucose homeostasis during exercise in humans press. No Disponible
48. Kjaer, M.; Jurlander, J.; Galbo, H.; Kirkegaard, P.; Keiding, S.; Hage, E (1994). No reinnervation of hepatic sympathetic nerves after liver transplantation in human subjects. J. Hepatol. 20:97-100
49. Kjaer, M.; Perko, G.; Secher, N.H.; Boushel, R.; Beyer, N.; Pollack, S.;Horn, A.; Fernandes, A.; Mohr, T. ; Lewis, S.F.; Galbo, H (1994). Cardiovascular and ventilatory responses to electrically induced cycling with complete epidural anaesthesia in humans. Acta Physiol. Scand. 151:199-207
50. Kjaer, M.; Pollack , S.F.; Mohr, T.; Weiss, H. ; Gleim, G.W.; Bach, F.W.; Nicolaisen, T.; Galbo, H.; Ragnarsson, K.T (1994). Regulation of glucose turnover and hormonal responses during exercise. Electrically induced cycling in tetraplegic humans. Am. J. Physiol. In press
51. Knapek, J.J.; Meredith, C.N.; Jones, B.H.; Suck, L.; Young, V.R.; Evans,W.J (1988). Influence of fasting on carbohydrate and fat metabolism during rest and exercise in men. J. Appl. Physiol. 64:1923-1929
52. Lavone, J.N.; Cardin, S.; Doiron, B (1989). Influence of hepatus vagus nerve on pancreatic hormone secretion during exercise. Am. J. Physiol.257:E855-E859
53. Marker, J.C.;Arnall,D.A.;Conlee,R.K.;Winder,W.W (1986). Effect of adrenodemedullation on metabolic responses to high-intensity exercise. Am. J. Physiol. 25I:R552-R559
54. Marker, J.C.; Hirsch, I.B; Smith, L.J.; Parvin, C.A.; Holloszy, J.O.; Cryer, P.E (1991). Catecholamines in prevention of hypoglycemia during exercise in humans. Am. J. Physiol. 260:E705-E712
55. Markss, E.B.; Simantirakis, E.; Miles, P.D.G.; Purdon, C.; Go ugeon, R.;Field, C.J.; Hotter J. B.; Vranic, M (1991). Glucoregulatory and hormonal responses to repeated bouts o f intense exercise in normal male subjects. J. Appl. Physiol. 71:924-933
56. Mosez, J.M.; Lacy, D.B.; Cherrington, A.D. ; Goldstein, R.E.; Wasserman, D.H (1988). The metabolic role of the exercise-induced increment in epinephrine. Am. J. Physiol. 255:E428-E436
57. Nobiz, A.; Falek, B.; Ingemansson, S.; Jarhult, J.; Rosengren, E (1977). Organization and function of the sympathetic innervation of human liver. Acta Physiol. Scand. 432(suppl):103-106
58. Rakestraw, N.W (1919). Chemical factors in fatigue. J. Biol. Chem. 46:565-590
59. Reichard, G.A.; Issekutz, B., Jr.; Kimbel P.; Putnam, R.C.; Hochella, N.J.;Wenhouse, S (1961). Blood glucose metabolism in man during muscular work. J. Appl. Physiol. 16:1001-1005
60. Refsum H.E., Gjessing, R.; Str6mine, S.B (1979). Changes in plasma amino acid distribution and urine amino acids excretion during prolonged heavy exercise. Scand. J. Clin. Lab. Invest. 39:407 413
61. Richter, E.A., Galbo, H.; Sonne, B.; Hoist, J.J.; Christensen, N.J (1980). Adrenal medullary control of muscular and hepatic glycogenolysis and ofpancreatic hormonal secretion in exercising rats. Acta Physiol. Scand. 108: 235-242
62. Richter, E.A.; Galbo, H.; Christensen N.J (1981). Control of exercise induced muscular gluycogenolysis by adrenal medullary hormones in rats. J. Appl. Physiol. 50:21-26
63. Richter, E.A.; Galbo, H.; Hoslt, J.J.; Sonne, B (1981). Significance of glucagon forinsulin secretion and hepatic glycogenolysisduring exercise in rats. Hormone Metab. Res. 13:323- 326
64. Rosell, S.; Ballard, K (1971). Adrenergic neuro- humoral control of lipolysis in adipose tissue. In: Pernow, B.; Safin, B., eds. Muscle metabolism during exercise. New York- London: Plenum Press; 111-11
65. Rowell, L.B.; Masoro, E.J.; Spencer, M.J (1965). Splanehnic metabolism in exercising man. J. Appl. Physiol. 20: t032-1037
66. Rowell, L.B (1986). Human circulation-regulation during physical stress. New York: Oxford University Press, 416
67. Scheurink, A.J.W.; Steffens,A.B.; Benthem, L (1988). Central and peripheral adrenoreceptors affect glucose, FFA and insulin in exercising rats. Am. J. Physiol. 255:R547-R556
68. Sellers, T.L.;Jaussi,A.W.;Yang,H.T.;Heninger,R.W.;Winder, W.W (1988). Effect ofthe exercise-induced increase in glucocortieoids on endurance in the rat. J. Appl. Physiol . 656:173-178
69. Sestoft, L.; Trap-Jansen, J.; Lyngsoe,J.; Clausen, J.P.; Hoist, J.J.; Nielsen, S.L.; Rehfeld, F.J (1977). Shaffalitsky de Muckadell, O Regulation of gluconeogenesis and ketogenesis during rest and exercise in diabetic subjects and normal men. Clin. Sci. Mol. Med. 53:411-418
70. Simonson, D.C.; Koivisto, V.; Sherwin, R.S.; Ferrannini, E.; Hendler, R.; De-Fonzo, R.A (1984). Adrenergic blockade alters glucose kinetics during exercise in insulin-dependent diabetics. J. Clin. Invest. 73:1648-1658
71. Sonne, B.; Galbo, H (1985). Carbohydrate metabolism during and after exercise in rats: studies whith radioglucose. J. Appl. Physiol. 59:1627-1639
72. Sonne, B.; Mikines, K.J.; Richter, E.A.; Christensen , N.J.; Galbo, H (1985). Role of liver nerves and adrenal medulla in glucose turnover of running rats. J. Appl. Physiol. 59:1640-1646
73. Sonne, B.; Galbo, H (1986). Carbohydrate metabolism in fructose-fed and food-restricted running rats. J. Appl. Physiol. 61:1457-1466
74. Sonne, B.; Galbo, H (1986). Carbohydrate metabolism in fructose-fed and food-restricted running rats. J. Appl. Physiol. 61:1457-1466
75. Sonne, B.; Mikines, K.J.; Galbo, H (1987). Glucose turnover in 48 hour-fasted running rats. Am. J. Physiol. 252:R587- R593
76. Turcotte,L.P.;Rovner,A.S.;Roark,R.R.;Brooks, G.A (1990). Glucose kinetics in gluconeogenesis-inhibited rats during rest and exercise. Am. J. Physiol. 258:13203-13211
77. Tuttle, K.R.; Marker, J.C.; Dalsky, G.P.; Schwartz , N.S.; Shah, S.D.; Cluter, W.E.; Holloszy, J.O.; Cryer, P.E (1988). Glucagon, not insulin, may play a secondary role in defense against hypoglycemia during exercise. Am. J. Physiol . 254:13713-13719
78. Vissing, J.; Sonne, B.; Galbo, H (1988). Role of metabolic feedback regulation in glucose production of running rats. Am . J. Physiol. 255:R400-R406
79. Vissing, J.; Sonne, B.; Galbo, H (1988). Regulation of hepatic glucose production in running rats studies by glucose infusion. Appl. Physiol. 65: 2552-2557
80. Vissing, J.; Iwamoto, G.A.; Rybicki, K.J.; Galbo, H.; Mitchell, J.H (1989). Mobilization of glucoregulatory hormones and glucose by hypothalamic locomotor centers. Am. J. Physic. 257:E722 E728
81. Vissing, J.; Wallace, J.L.; Galbo, H (1989). Effect of liver glycogen content on glucose production in running rats. J. Appl. Physiol. 66:318-322
82. Vissing,J.; Wallace, J.L.; Scheurink, A.J.W.; Galbo, H.; Steffens, A.B (1989). Ventro-medial hypothalamic regulation of hormonal and metabolic responses to exercise. Am. J. Physiol. 256:R1019 R1026
83. Vissing, J.; Lewis, S.F.; Galbo, H; Haller, R.G (1992). Effect of defficient muscular glycogenolyisis on extramuscular fuel production in exercise. J. Appl. Physiol. 72:1773-1779
84. Vissing, J.; Iwamoto, G.A.; Fuchs, I.E.,;Galbo, H.; Mitchell, J.H (1994). Reflex control of glucoregulatory exercise responses by group III and IV muscle affe-rents. Am. J. Physiol. 266:R824 R830
85. Vranic, M.; Kawamori, R.; Pek, S.; Kovacevic, N.; Wrenshall, G (1976). The esentiality of insulin and the role of glucagon in regulating glucose utilization and production during strenuous exercise in dogs. J. Clin. Invest. 57:245-256
86. Vranic, M.: Gauthier, C.; Bilinski, D.; Wasserman, D.; El Tayeb, K; Hetenyi, G.;Lickley, H.L.A (1984). Catecholamine responses and their interactions with otherglucoregulatory hormones. Am. J. Physiol. 247:13145-13156
87. Wahren, J.; Felig, P.; Ahlborg, G.; Jorfeldt, L (1971). Glucose metabolism during leg exercise in man. J. Clin.Invest. 50:2715-2725
88. Warren,J.;Hagenfeldt,L.;Felig,P (1975). Splanchingandlegexchange of glucose, amino acid, and free fatty acids during exercise in diabetes mellitus. J. Clin. Invest. 55:1303-1314
89. Wahren, J.; Sato, Y.; Ostman, J.; Hagenfeldt, L.; Felig P (1984). Turnover and splanchnic metabolism of free fatty acids and ketones in insulin-dependent diabetics at rest and in response to exercis. J. Clin. Invest. 73:1367-1376
90. Wasserman, D.H.; Lickley, H.L.A.; Vranic, M (1984). Interactions between glucagon and other counterregulatory hormone during normoglycemic and hypoglycemic exercise in dogs. J. Clin. Invest. 73:1367-1376
91. Wasserman, D.H.; Lacy, D. B.; Green, D. R .; Williams, P.E.; Cherrington, A.D (1987). Dynamics of hepatic lactate and glucose balances during prolonged exercise and recovery in the dog. J. Appl. Physiol. 63:2411-2417
92. Wasserman, D.H.; Williams, PE.; Lacy, D.B.; Green, D.R.; Cherrington, A.D (1988). Importance of intrahepatic mechanisms to gluconeogenesis from alanine during exercise and recovery. Am. J. Physiol. 254:13518-13525
93. Wasserman, D.H.; Spalding, J.A.; Lacy, D.B.; Colbum, C.A.; Goldstein, RE.; Cherrington, A.D (1989). Glucagon is a primary controller of hepatic glycogenolysis and gluconeogenesis during muscular work. Am. J. Physiol. 257: 13108-13117
94. Wasserman, D.H.; Williams, P.E.; Lacy, D.B.; Goldstein, R.E.; Cherrington, A.D (1989). Exercise-induced fall in insuli n and hepatic carbohydrate metabolism during muscularwork. Am. J. Physiol. 256:13500-13509
95. Wasserman, D.H.; Lacy, D.B.; Goldstein, RE.; Williams, P.E.; Cherrington, A.D (1989). Exercise-induced fall in insulin and the increase in fat metabolism during prolonged muscular work. Diabetes 38:484-490. Cherrington, A.D
96. Wasserman, D.H.; Spalding, J.A.; Bracy, D.; Wasserman, D.H.; Spalding, J.A.; Bracy, D.; Lacy, D.B (1989). Cherrington, A.D. Exercise-induced rise in glucagon and ketogenesis during prolonged muscular work. Diabetes 38:799 807
97. Wasserman, D.H.; Williams, P.E.; Lacy, D.B.; Bracy, D.; Cherrington, A.D (1990). Hepatic nerves are no t essential to the increase in hepatic glucose production during muscular work. Am. J. Physiol.259:E195-13203
98. Wasserman, D.H.; Geer, R.J; Williams, PE. ; Becker, T.; Lacy, D.B.; Abunrad, N.N (1991). Interaction of gut and liver in nitrogen metabolism during exercise. Metabolism 40:307-314
99. Wasserman, D.H.;Lacy, D.B.; Colburn, C.A.; Goldstein, RE.; Bracy, D.;Cherfngton, A.D (1991). Efficiency of compensation for absence of fall in insulin during exercise. m. J. Physiol. 261:13587-13597
100. Winder, W.W.; Terry, M.L.; Mitchell, V.M (1985). Role of plasma epinephrine in fasted exercising rats. Am. J. Physiol. 248:R302 R307
101. Winder, W.W.; Yang, H.T.; Jaussi, AW. ; Hopkins, C.R (1987). Epinephrine, glucose and lactate infusion in exercising adredemedullated rats. J. Appl. Physiol. 62:1442-1447
102. Wolfe, R.R; Goodenough, R.D.; Wolfe, M.H.; Royle, G.T.; Nadel, E.R (1982). Isotopic analysis of leucine and urea metabolism in exercising humans. J. Appl. Physiol. 52:458-466
103. Wolfe, R.R; Nadel, E.R.; Shaw, J.H.F.; Stephenson, L.A.; Wolfe, M.H (1986). Role of changes in insulin and glucagon in glucose homeostasis in exercise. J. Clin. Invest. 77:900-907