Oxidación de grasas y señalamiento celular del tejido adiposo después de un HIIE
Publicado 10 de julio de 2020, 15:32
Efecto agudo del ejercicio por intervalos de alta intensidad sobre la oxidación de grasas de todo el cuerpo y el señalamiento celular del tejido adiposo subcutáneo en mujeres con sobrepeso
El señalamiento β-adrenérgico (β-AR) y de insulina regulan el equilibrio entre la liberación de ácidos grasos no esterificados (NEFA) y la síntesis de triglicéridos (TG) en el tejido adiposo (Slatiel 2001). La estimulación de los receptores β-AR en el tejido adiposo inicia la lipólisis al aumentar la producción de monofosfato de adenosina cíclico (cAMP), que activa la proteína quinasa A (PKA) (Honnor 1984), lo que resulta en la activación posterior de las lipasas y la liberación de los NEFA de los adipocitos (Miyoshi 2007, Sztalryd 2003). Por el contrario, la insulina se fosforila y activa la proteína quinasa B (PKB/Akt), que reduce el AMPc intracelular, lo que disminuye la actividad de la PKA y, en última instancia, reduce la estimulación de la lipólisis mediada por la PKA (Kitamura 1999). Además, se han observado aumentos en la oxidación de grasas en todo el cuerpo y una liberación elevada de NEFA del tejido adiposo durante el período posterior al ejercicio en humanos. Sin embargo, aunque el impacto de la señalización β-AR sobre el tejido adiposo durante el ejercicio es bien conocido, parece poco probable que esta cascada de señalización sea completamente responsable de los aumentos prolongados en la lipólisis dada la rápida disminución de las catecolaminas circulantes que ocurre después de la interrupción del ejercicio (Galbo 1975, Willians 2013). La señalización alterada de insulina, por lo tanto, representa una posible explicación alternativa para las elevadas tasas de lipólisis de los adipocitos observadas durante el período posterior al ejercicio. Actualmente, no está claro cómo se altera la señalización de la insulina sobre el tejido adiposo abdominal subcutáneo en el período posterior al ejercicio en humanos.
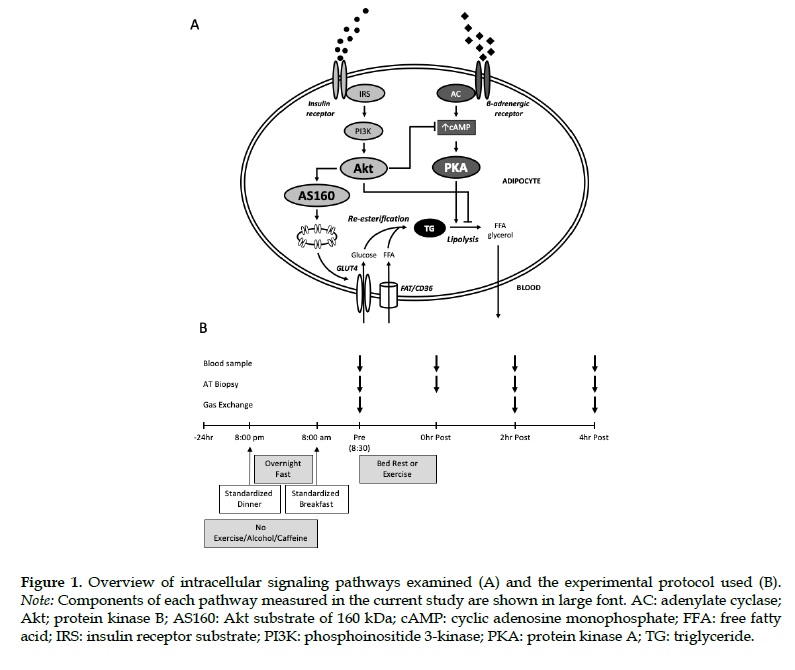
Recientemente, Brendon J, de la Queen’s University (Canadá), llevó a cabo un estudio al respecto, cuyo objetivo principal de ese estudio fue examinar el efecto agudo del ejercicio de intervalos de alta intensidad (HIIE) sobre las proteínas de señalización de la insulina (Akt y AS160) en el tejido adiposo subcutáneo humano (Figura 1A), para examinar la asociación entre los cambios en el señalamiento de la insulina del tejido adiposo y la oxidación de grasas en todo el cuerpo. Los autores suponen que los aumentos inducidos por el HIIE sobre la oxidación de la grasa corporal estarían asociados con una disminución de la señalización de la insulina (es decir, una disminución de la fosforilación de la Akt y/o AS160). Además, también se examinaron los cambios en la fosforilación del sustrato PKA para aproximar los cambios en las vías de señalización β-AR en el tejido adiposo. Los resultados del estudio actual pueden proporcionar una importante perspectiva del mecanismo sobre la regulación de las vías de señalización del tejido adiposo subcutáneo en relación con los cambios en la oxidación del sustrato durante el período posterior al ejercicio.
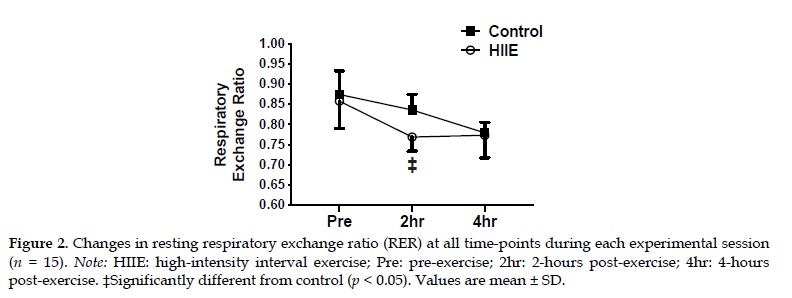
Mujeres con sobrepeso completaron dos sesiones experimentales en un orden aleatorio: 1) control (reposo en cama) y 2) HIIE (intervalos de carrera de 10 x 4 min al 90% de FCmáx, recuperación de 2 min). Se obtuvieron biopsias del tejido adiposo abdominal subcutáneo de 10 participantes antes (pre), inmediatamente (0 h), después (post), 2 h después y 4 h después del ejercicio. Los niveles de glucosa e insulina en plasma se evaluaron en muestras de sangre venosa obtenidas en cada punto de tiempo de las biopsias de un grupo diferente de 5 participantes (emparejados por BMI con el grupo de biopsia). Las tasas de oxidación de grasas se estimaron utilizando la relación de intercambio respiratorio (RER) en todos los participantes que utilizaron calorimetría indirecta antes, 2 horas después y 4 horas después del ejercicio.
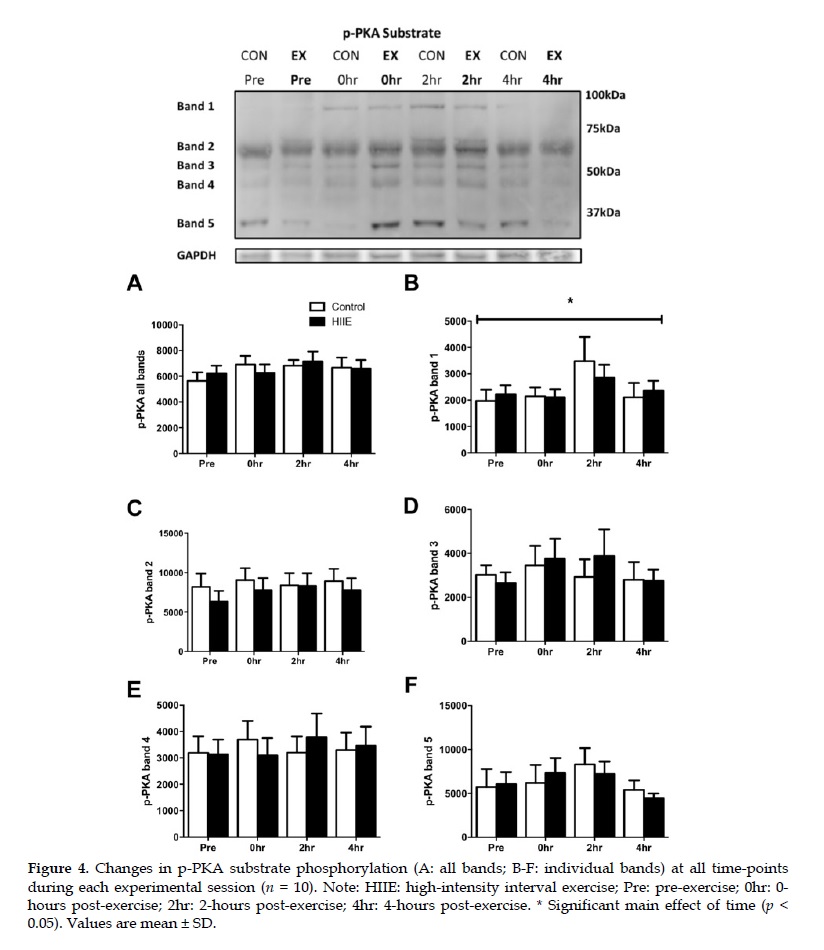
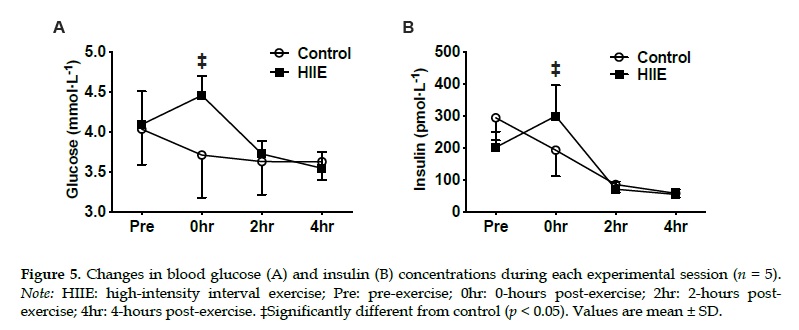
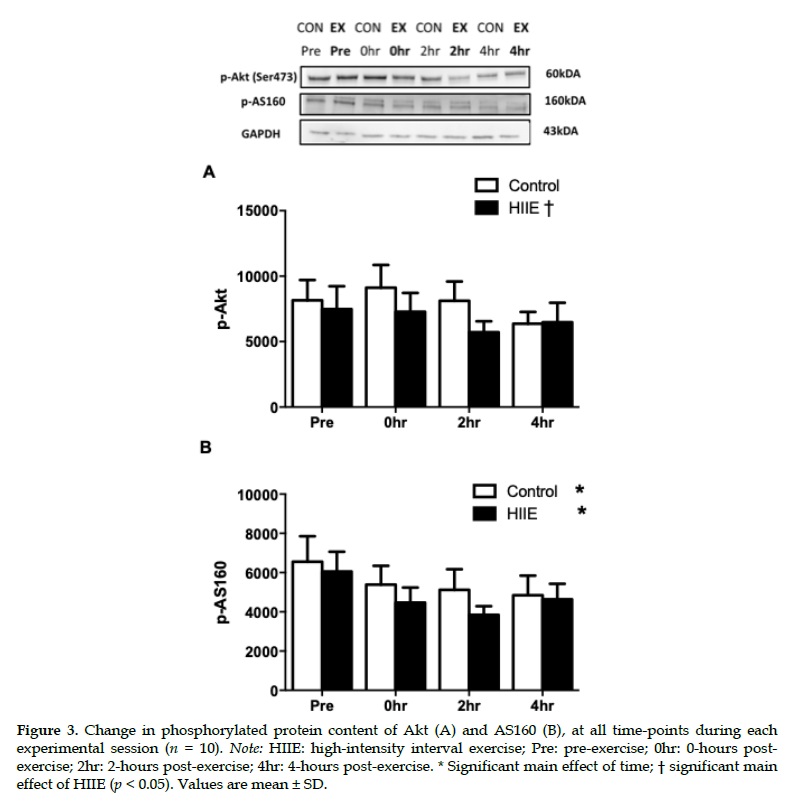
El RER disminuyó (p <0.05) a las 2 horas después del ejercicio después del HIIE (0.77±0.04) en comparación con el control (0.84±0.04). A pesar de los niveles más altos de glucosa en plasma (p <0.01) e insulina (p <0.05) a las 0 horas después del ejercicio versus el control, no se observaron efectos de interacción significativos para la fosforilación de Akt o AS160 (p> 0.05). La fosforilación de sustratos de la PKA no se modificó en ambas condiciones (p> 0.05). Colectivamente, la señalización alterada β-adrenérgica y de insulina en el tejido adiposo abdominal subcutáneo no parece explicar el aumento de la oxidación de grasas en todo el cuerpo después de un HIIE agudo.
En conjunto, estos hallazgos sugieren que el HIIE agudo no altera significativamente las vías de señalización intracelular que controlan la movilización de grasa (es decir, PKA) y/o el almacenamiento (es decir, Akt, AS160) en el tejido adiposo abdominal subcutáneo. Sin embargo, la preservación de la fosforilación de la proteína señalizadora de la insulina a pesar del aumento de los niveles circulantes de insulina en el período posterior al ejercicio podría indicar una potencial respuesta alterada del tejido adiposo a esta hormona. Este fenómeno debe explorarse más en la investigación futura, ya que puede explicar en parte el aumento de las tasas de oxidación de grasas en todo el cuerpo observadas en el período posterior al ejercicio. Por otro lado, los aumentos en la oxidación de grasas en todo el cuerpo no fueron acompañados por una alteración de la fosforilación de la PKA del sustrato, inducida por la señalización de la epinefrina, razones por las cuales no están claras.
